
Закинули археи эволюционный невод и вытянули...
22 января 2015
Закинули археи эволюционный невод и вытянули...
- 1847
- 0
- 5
Прокариотическая эволюционная сеть. Древовидную основу перекрывают тонкие нити, отражающие вклад горизонтального генетического переноса, отчего схема выглядит «разбеленной».
трехмерная схема эволюции прокариот взята из [1]
-
Автор
-
Редакторы
...2264 бактериальных генных семейства, кодирующих чрезвычайно полезные в клеточном хозяйстве белки. Золотая рыбка проявила щедрость в отношении 134 архей, участвовавших в исследовании распространения и «биографии» огромного пула архейных генов с целью объяснения формирования высших таксонов Archaea. Именно междоменные переносы генов, судя по всему, ответственны за возникновение 13 крупных групп архей (в основном, порядков). Интернациональный коллектив ученых вволю поупражнялся в построении всевозможных дендрограмм и опубликовал результаты прямо в новогоднем номере Nature. Помимо судьбоносного заимствования бактериальных генов археями авторы работы обнаружили и другие интересные закономерности.
Экскурс в плетение эволюционных сетей
Научное сообщество уже пришло к пониманию того, что эволюцию прокариот (бактерий и архей) невозможно отобразить с помощью классического дерева. По сути, деревья, построенные по разным генам, могут даже не походить друг на друга. Древовидный каркас, связанный с «вертикальной» передачей наследственной информации, конечно же, есть, но из-за обильных горизонтальных генетических потоков формируется структура, похожая на сеть (см. заглавный рисунок) [1].
Считается, что на заре эволюции, в «золотом веке додарвиновской жизни» по К. Везе [2], существовал общий, «коммунальный», генетический пул — древние организмы могли беспрепятственно обмениваться генами, методом проб и ошибок формируя различные комбинации признаков. По мере усложнения организмов и развития механизмов защиты собственной «идентичности» горизонтальные потоки превращались в ручейки, однако в мире прокариот и сейчас они играют ведущую роль в приобретении новых признаков и адаптации организмов к среде обитания. Помимо обмена, осуществляемого пестрой компанией мобильных генетических элементов , в плетении филогенетических сетей задействованы и иные процессы. Некоторые, например, считают, что местами эволюционная схема напоминает кольчугу из-за сростания ветвей в кольца в результате эндосимбиотических событий (рис. 1). По аналогии с формированием эукариотической клетки М. Ривера и Дж. Лейк предложили еретическую (пока) гипотезу эндосимбиотического происхождения грамотрицательных бактерий. Улики, указывающие на потенциальных виновников этого бактериального ароморфоза — клостридий и актинобактерий, — рассмотрены в статье «Древо жизни завивается в кольца» [3].
О разнообразии МГЭ прокариот: «Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов» [4]. — Ред.
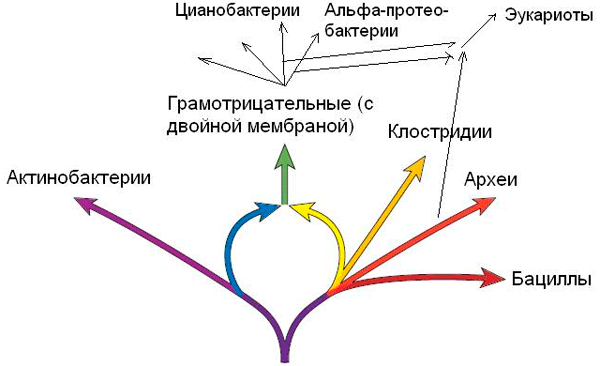
Рисунок 1. «Кольца жизни» по Лейку, указывающие на формирование крупных таксонов организмов в результате эндосимбиоза.
схема заимствована из [3]
Интенсивность горизонтального переноса зависит как от генетических особенностей таксона, так и от образа жизни его представителей: у эндосимбионтов он выражен слабо, в отличие от свободноживущих форм, контактирующих с сотнями видов микроорганизмов в ризосфере растений или сточных водах. Бактериям для этого совсем не обязательно быть близкими родственниками, необходимо лишь проживать в тесноте с соседями. Такая закономерность описана, например, в работе [5]: представители Proteobacteria активно обмениваются генами на уровне класса и даже отдела при условии обитания в одной эконише, причем ведущим механизмом обмена выступает конъюгация, для которой обязателен физический контакт донора плазмиды с реципиентом. В целом, масштабы генетического обмена с соседями впечатляют — до 98% генов некоторых прокариот могли быть получены именно таким путем. Конечно, речь идет о приобретениях, сделанных конкретными эволюционными линиями за все время их существования [1].
Биоинформатический инструментарий, позволяющий выявлять события горизонтального генетического переноса на разной таксономической «глубине» и строить эволюционные сети, разработали недавно. Вкупе с нарастанием числа полностью прочитанных геномов этот инструментарий оказал неоценимую услугу биологам, пытающимся пролить свет на обстоятельства формирования крупных прокариотических таксонов. Последние традиционно распознаются на основе сравнения генов 16S рРНК, в лучшем случае подкрепленного филогенией 30–40 универсальных информационных генов (кодируют белки, участвующие в биогенезе рибосом и реализации наследственной информации). Предоставляя неплохую основу для классификации, эти гены составляют лишь 1% прокариотического генома, а потому не отражают особенности целого генофонда конкретной группы и не могут подсказать, какие именно изменения привели к ее формированию.
Прокариотическая экономика: Archaea-центричная модель
В статье Шиджулала Нельсона-Сати и соавторов [6], опубликованной в новогоднем номере Nature, раскрываются некоторые секреты генетического обмена между археями и бактериями, но главное — устанавливается связь между этим обменом и образованием высших таксонов архей. Карл Везе на основе анализа последовательностей 16S рРНК отделил их от бактерий в 1977 году , а трехдоменную систему живых организмов (Archaea, Bacteria, Eucarya) предложил в 1990-м [7]. Помимо особенностей, связанных с реализацией наследственной информации, археи отличаются как от бактерий, так и от эукариот структурой мембраны [8], клеточной стенки, жгутиков, способностью производить метан и др. Однако не успели многие расстаться с термином «архебактерия», как начали всплывать факты, указывающие на действительно тесные связи между прокариотическими доменами. Оказалось, что междоменная граница легко преодолевается пресловутым горизонтальным генетическим переносом, и в архейные дендрограммы вторгаются «инородцы».
История этого открытия — в статье «Карл Вёзе (1928–2012)» [2]. — Ред.
Для лучшего понимания работы Нельсона-Сати стоит упомянуть, что на заимствование какого-либо гена указывает высокая степень его сходства с гомологом из отдаленного таксона при отсутствии подобного гена у близких родственников. Учитывая этот принцип, интернациональный коллектив ученых решил проинспектировать гены 267 568 белков, локализованные в 134 полностью секвенированных архейных хромосомах. Для этого потребовалась следующая подготовка:
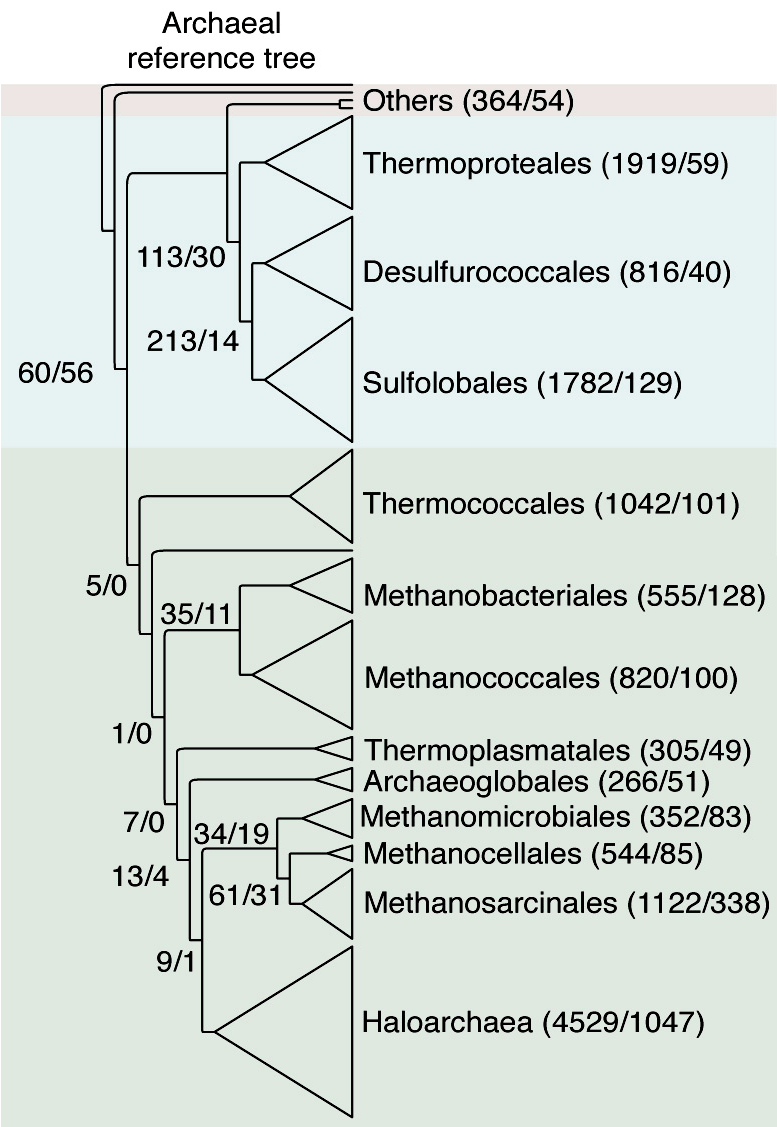
Рисунок 2. Референсное филогенетическое дерево архей. В скобках напротив каждого таксона: количество архей-специфичных семейств генов / количество семейств, заимствованных у бактерий. Группа Others включает представителей отделов Thaumarchaeota, Nanoarchaeota и Korarchaeota.
- на основе сравнения выведенных аминокислотных последовательностей отобранные белки по определенному алгоритму разделили на 25 762 кластера (белковых семейства), исключили синглтоны;
- для изучения распространения генов этих белков (соответствующих генных семейств) составили выборку из 13 крупных таксонов архей и 23 групп бактерий (всего 1981 геном — 134 археи и 1847 бактерий);
- на основе сцепленных последовательностей 70 универсальных для архей генов построили неукорененное референсное филогенетическое древо (рис. 2) — образец, относительно которого затем распределяли информацию об «аборигенных» и заимствованных последовательностях.
Поиск похожих генных семейств у бактерий выявил, что 2/3 (16 983) кластеров не имеют гомологов у представителей домена Bacteria, то есть архей-специфичны. Более того, эти гены распределяются в строгом соответствии с 13 ветвями референсного дерева, а значит, и поддерживают разделение 13 высших архейных таксонов, присутствующих в данной выборке. 85% генных семейств зафиксированы у одного таксона, 9% — одновременно у двух и лишь 0,3% — у всей выборки.
У трети кластеров (8 779 семейств) были обнаружены бактериальные гомологи. Далее по построенным с их учетом деревьям исследователи судили о монофилетичности архей по тем или иным генам, об уникальности/обилии гомологов в геномах бактерий и архей — все это указывало направление генетических потоков. В итоге были сформулированы основные результаты:
- 2264 семейства присутствуют всего в одном крупном таксоне архей, но широко распространены среди бактерий, значит, эти семейства были импортированы археями.
- Как и в случае архей-специфичных генов, импорт связан с образованием 13 ветвей референсного дерева. Особенно четко это удалось показать для шести групп архей (Thermoproteales, Desulfurococcales, Methanobacteriales, Methanococcales, Methanosarcinales, Haloarchaea).
- 83% случаев импорта приходится на метаногенов (или их предковые линии), наиболее мощный поток генов наблюдается между Actinobacteria и Haloarchaea (рис. 3). Импорт бактериальных генов, судя по всему, привел к выделению из предковых клад метаногенов трех ветвей — Haloarchaea, Archaeoglobales и Thermoplasmatales.
- Археи предпочитают импортировать метаболические гены (39% от 2264 заимствованных семейств). В частности, в обсуждаемой выборке «шли нарасхват» бактериальные кластеры, связанные с транспортом и метаболизмом аминокислот (208), продукцией и превращением энергии (175), транспортом и метаболизмом углеводов (139) или неорганических ионов (123).
- Бактерии заимствуют у архей гены в 5 раз реже (а в пересчете на равное количество геномов архей и бактерий — почти в 11 раз). Отслежен всего 361 эпизод экспорта генов археями. И даже в случаях неясного направления перемещения генов (немонофилетичные деревья), их распределение указывает на отсутствие связи импорта архейных генов с происхождением каких-либо бактериальных таксонов. Наиболее благодарными реципиентами (по числу импортированных генов на каждого члена группы) оказались бактерии классов Thermotogae, Aquificae, Chloroflexi.
- Анализ распространения архей-специфичных и заимствованных генов не выявил иерархичных взаимоотношений между 13 кладами архей, кроме их разделения на Crenarchaeota и Euryarchaeota. На рис.3 в древе, построенном с учетом индивидуальных филогений 70 информационных архейных генов, эта бифуркация не прочерчивается из-за спорного положения таумархей и наноархей.
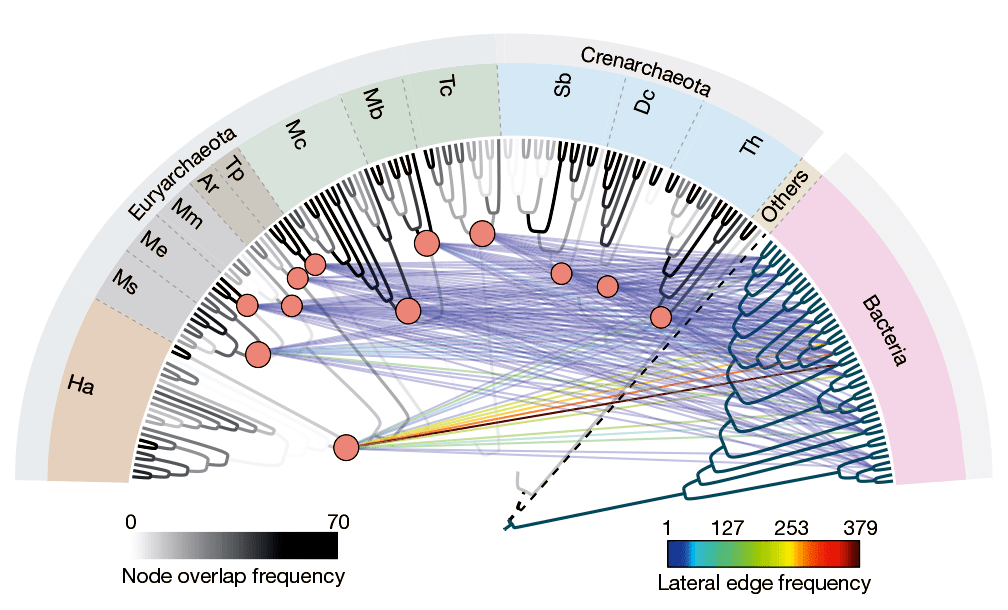
Рисунок 3. Эволюционная сеть архей. Сверху представлена референсная филогения, основанная на сцепленных последовательностях 70 универсальных генов. Порядок клад такой же, как на рис.2. Археи укоренены на Korarchaeota.
Шкала с градацией серого (0–70) показывает, сколько раз каждая ветвь референсного древа «перекрывалась» дендрограммами каждого из 70 генов.
Цветная шкала (1–379) отражает интенсивность горизонтального обмена генами, т.е. сколько раз тот или иной бактериальный таксон выступал донором генов. Бактериальные таксоны слева направо: Chlorobi, Bacteroidetes, Acidobacteria, Chlamydiae, Planctomycetes, Spirochaetes, ε-Proteobacteria, δ-Proteobacteria, β-Proteobacteria, γ-Proteobacteria, α-Proteobacteria, Actinobacteria, Bacilli, Tenericutes, Negativicutes, Clostridia, Cyanobacteria, Chloroflexi, Deinococcus-Thermococcus, Fusobacteria, Aquificae, Thermotogae. Наиболее мощный трафик (красная линия) наблюдается между Haloarchaea и Actinobacteria. Количество заимствований каждой группой архей приведено на рисунке.
Таким образом, горизонтальный генетический перенос между доменами Archaea и Bacteria, зафиксированный в данной работе, сильно поляризован — направлен преимущественно в сторону архей, причем чаще в нем участвуют метаболические гены. Импорт бактериальных генных кластеров четко коррелирует с образованием высших таксонов архей.
Байки о междоменной борьбе за существование, алчности и неблагодарности
С чем же может быть связана обнаруженная грубая асимметрия генных потоков? Авторы статьи полагают, что частично в этом виноват стиль жизни метаногенов, на которых приходится львиная доля генимпорта. Домен Archaea вообще богат на «спартанцев» — хемолитоавтотрофов, не нуждающихся в готовой органике, получающих углерод в основном из СО2, а энергию посредством окислительно-восстановительных реакций с использованием неорганических веществ. Возможно, «не корысти ради, а токмо волею» сильных конкурентов приходится им ютиться в экстремальных и голодных нишах. Метаногены — узкие специалисты, получающие энергию за счет восстановления углекислоты молекулярным водородом. Как в сказке сказывается, и хочется царицею морскою стать, да ДНК «холопская». И возроптала, наконец, часть метаногенов в своем анаэробном доисторическом «корыте» — побарствовать захотелось, вздохнуть полной грудью. Но перекрыты оказались пути-дорожки генерализации до притока нового генетического материала. Вот и закинули метаногены эволюционный невод... И превратила золотая рыбка самых отчаянных из них в основателей новых крупных таксонов — Haloarchaea, Archaeoglobales и Thermoplasmatales, получивших возможность осваивать иные ниши благодаря органотрофии.
Но далеко не все метаногены распрощались со спартанским образом жизни, несмотря на обильный приток бактериальных генов [9]. Особо идейные, как метаносарцины, например, даже в богатейшем органикой кишечнике животных до сих пор «гонят» метан.
Делиться с бактериями своим генетическим хозяйством археи, видно, не очень любят по политическим соображениям: снабдишь конкурентов полезными нише-специфическими признаками, а они весь твой род потом вытеснят. Даже из «убитого корыта». Подозрительна, например, биография раздувшегося до целой экосистемы сульфатредуктора Desulforudis audaxviator — резидента скважины золотого прииска в ЮАР [10]. Клостридия-экстремалка влачит свое существование в трехкилометровом подземелье, ни солнца, ни кислорода, ни общения не зная, позабыв, когда в последний раз размножалась... Зато добывать себе скудное пропитание она научилась всеми возможными для членов традиционной экосистемы способами. Как? Конечно, экспроприировав у архей гены, связанные со спартанским образом жизни — фиксацией азота, утилизацией неорганического углерода и водорода, сульфатредукцией и т. п. На всякий случай разжилась бактерия и CRISPR-ассоциированными генами («Вдруг стала так похожа на архею, что и вирус не различит?»).
О CRISPR-ассоциированных генах можно прочитать статью «CRISPR-системы: иммунизация прокариот» [11]. — Ред.
В то же время, хитрая клостридия предусмотрительно оставила себе гены гетеротрофного метаболизма, которых нет у архей-метаногенов, обитающих в подобных условиях («Вдруг совсем голодно станет, родственники лизироваться начнут, что ж добру-то пропадать?»). Да еще и спорообразование припасла на совсем уж крайний случай. А где же та щедрая архея, что наделила Desulforudis audaxviator способностями к жизни в экстремальных условиях? Ведь раз горизонтальный перенос случился, контакт был точно! Но... В 2600 литрах скважинной воды ученые обнаружили только ДНК узурпатора. Позже «надежные источники» сообщили об обнаружении близких родственников Desulforudis audaxviator, обитающих в шахтах гидротермальной электростанции в Германии совместно с археями. А вдруг южноафриканская клостридия не воспитала в себе «политкорректность», да и съела своих благодетелей в особо голодные годы? Кто знает...
Эволюция архей глазами других биологов. Генуборка — двигатель прогресса
Стоит отметить, что работа Ш. Нельсона-Сати и его коллег строилась на определенном фундаменте — факты судьбоносного импорта ДНК археями фиксировались и ранее. Например, о более сложных эволюционных тропах, по которым в геном Thaumarchaeota попали бактериальные гены стрессовых белков, рассказано в статье [12]. Излагая упрощенно, ген нетипичного ко-шаперона DnaJ-Fer путем горизонтального переноса переместился из цианобактерий в Viridiplantae (зеленые растения), а оттуда — в Thaumarchaeota, где «встретился» с генами шаперонной системы DnaK/DnaJ/GrpE, проследовавшими из бактерий в мезофильные археи, а затем — в термофильные. Предполагается, что эта череда междоменных переносов сыграла важную роль в адаптации некоторых архейных групп с гипертермофильными «корнями» к мезо- и термофильным условиям.

Рисунок 4. Генуборка — двигатель прогресса
коллаж автора статьи
Нельсон-Сати и соавторы [6] напоминают, что заимствование бактериальных генов привело не только к возникновению высших таксонов архей, но и к более весомому ароморфозу — образованию эукариотической клетки. Ведь считается, что последняя унаследовала от архей ядро и цитоплазму вместе с механизмами реализации наследственной информации, а вся «периферия» — метаболические пути, сигнальные системы, структура мембран, не говоря уже о пластидах и митохондриях, — досталась эукариотам от бактерий.
Авторы полагают, что без симбиотических событий не обошлось и в моменты закладки крупных таксонов Archaea, а также отмечают, что их данные поддерживают теорию «быстрого расширения и медленного сокращения», сформулированную по отношению к эволюции геномов Юрием Вольфом и Евгением Куниным в статье [13]. Разработчики теории утверждают, что именно редукция геномов, а не постоянное их увеличение за счет притока новых генов, — преобладающий эволюционный механизм. Этот вывод был сделан на основе сравнительного анализа 120 архейных геномов. Реконструированный в исследовании общий предок архей обладал более крупным геномом, чем все современные представители домена. Формирование крупных кладов архей так же, как и в работе Нельсона-Сати, коррелировало с заимствованием генов, а далее в подавляющем большинстве линий шла оптимизация геномов с постепенной редукцией. Но исключения всё же существуют. Вольф и Кунин отмечают, что Halobacteria и Methanosarcinales «компенсируют» потери интенсивным импортом бактериальных генов и потому увеличивают геномы.
В более ранней статье Юрий Вольф и соавторы на примере архейной и референсной бактериальной выборок подсчитали, что в эволюции прокариотических линий минимальное соотношение потерь и приобретений генов — 4:1 [14]. В работе также отмечено, что горизонтальный генетический перенос между группами архей в целом однороден и не формирует каких-то выделяющихся магистралей, за исключением крупных потоков в направлении Halobacteria.
Заключение
По мере углубления знаний о родстве и распространении не только «коровых», но и «периферических» генов, растет и крепнет уважение биологов к паукообразному божеству, плетущему вычурные эволюционные сети — Горизонтальному Генетическому Переносу. А ведь процесс конъюгации, обнаруженный в 1946 году Джошуа Ледербергом и Эдвардом Л. Татумом, несколько десятилетий оставался в тени научного догматизма — пока на смену эйфории от начала эры антибиотиков не пришло тревожное ощущение неконтролируемости многих смертельных инфекций. И лишь в последние годы горизонтальный перенос окончательно признали одним из механизмов эволюции.
О перипетиях эволюционной биологии на микроуровне читайте в статье «Эволюция между молотом и наковальней, или как микробиология спасла эволюцию от поглощения молекулярной биологией» [15]. — Ред.
Литература
- Марков А.В. (2008). Горизонтальный перенос генов и эволюция. Доклад в Институте общей генетики;
- Карл Вёзе (1928–2012);
- Элементы: «Древо жизни завивается в кольца»;
- Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов;
- Kloesges Th., Popa O., Martin W., Dagan T. (2011). Networks of gene sharing among 329 proteobacterial genomes reveal differences in lateral gene transfer frequency at different phylogenetic depths. Mol. Biol. Evol. 28, 1057–1074;
- Nelson-Sathi Sh., Sousa F.L., Roettger M., Lozada-Chavez N., Thiergart Th., Janssen A. et al. (2015). Origins of major archaeal clades correspond to gene acquisitions from bacteria. Nature. 517, 77–80;
- Woese C.R., Kandler O., Wheelis M.L. (1990). Towards a natural system of organisms: proposal for the domains Archaea, Bacteria, and Eucarya. PNAS. 87, 4576–4579;
- Chugunov A.O., Volynsky P.E., Krylov N.A., Boldyrev I.A., Efremov R.G. (2014). Liquid but Durable: Molecular Dynamics Simulations Explain the Unique Properties of Archaeal-Like Membranes. Sci. Rep. 4, article number: 7462;
- Deppenmeier U., Johann A., Hartsch T., Merkl R., Schmitz R.A., Martinez-Arias R. et al. (2002). The genome of Methanosarcina mazei: evidence for lateral gene transfer between bacteria and archaea. J. Mol. Microbiol. Biotechnol. 4, 453–461;
- Элементы: «В недрах земли найден микроб, живущий сам по себе»;
- CRISPR-системы: иммунизация прокариот;
- Petitjean C., Moreira D., López-García P., Brochier-Armanet C. (2012). Horizontal gene transfer of a chloroplast DnaJ-Fer protein to Thaumarchaeota and the evolutionary history of the DnaK chaperone system in Archaea. BMC Evol. Biol. 12: 226;
- Wolf Yu. I. and Koonin E.V. (2013). Genome reduction as the dominant mode of evolution. BioEssays. 35, 829–837;
- Wolf Yu. I., Makarova K.S., Yutin N., Koonin E.V. (2012). Updated clusters of orthologous genes for Archaea: A complex ancestor of the Archaea and the byways of horizontal gene transfer. Biol. Direct. 7:46;
- Эволюция между молотом и наковальней, или Как микробиология спасла эволюцию от поглощения молекулярной биологией.





