Животные как объект для проведения испытаний вакцин против COVID-19: необходимость или излишество
12 марта 2021
Животные как объект для проведения испытаний вакцин против COVID-19: необходимость или излишество
- 1436
- 2
- 1
Все ли считают необходимым использование животных для борьбы с COVID-19 во время глобальной пандемии?
рисунок автора статьи
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Глобальная пандемия COVID-19 вновь активизировала дискуссию об использовании животных в экспериментально-исследовательской деятельности, поскольку ученые стремились как можно быстрее разработать вакцину против нового коронавируса. Традиционно препараты проходят доклинические испытания, которые предполагают тестирование на животных для установления их безопасности и эффективности. Необходимо ли соблюдать определенную последовательность при тестировании препарата, в то время как некоторые компании обратились к новым подходам разработки вакцины, что позволило пропустить стадию экспериментирования на четвероногих и сразу перейти к испытаниям на людях? В данной статье будут рассмотрены вопросы использования животных при разработке вакцины для борьбы с новой коронавирусной инфекцией.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Вирусы и микроорганизмы» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Вакцины: от изобретения до применения
Разработка вакцины для борьбы с новым заболеванием является многоступенчатым процессом и занимает в среднем от 10 до 15 лет. Период, который предшествует утверждению препарата и его массовому производству, включает несколько этапов (рис. 1).
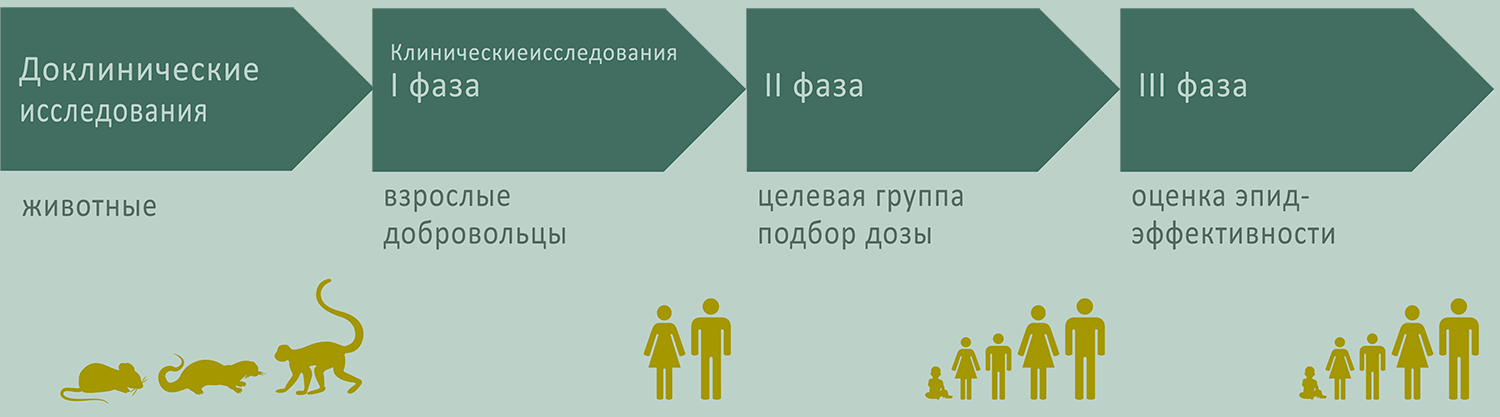
Рисунок 1. Принципы организации и проведения доклинических и клинических исследований новых препаратов. Существует несколько шагов в процессе изготовления вакцины: исследовательская стадия, доклиническая; клиническая, состоящая из трех фаз; затем следует лицензирование, выпуск для массового применения, профессиональная оценка вакцины врачами и одобрение со стороны населения.
Первый — исследовательский этап (длится, на минуточку, 2–4 года!) — проведение испытаний в лабораториях с использованием животных или in vitro, то есть вне живого организма. Ученые осуществляют идентификацию возбудителя, изучают его генетику, антигены [2] и основные свойства. На этом же этапе формируются предположения о том, каким может быть будущий препарат — живой, инактивированный, синтетический и т.д. [3], а также создается прототип вакцины.
Затем следует доклинический этап, который длится 1–2 года. Это тестирование вакцины на клеточных культурах и лабораторных животных . Его цель — удостовериться в переносимости препарата живым организмом без фатальных последствий, а также проверить наличие иммунного ответа: организм животного должен вырабатывать антитела к вакцине. Помимо этого, исследователи определяют оптимальную дозу препарата, его аллергенность и токсичность, влияние на плод (возможность развития дефектов или аномалий) и возможность образования опухолей (рис. 2). Исследования на животных обычно включают обезьян из-за их биологического сходства с людьми, но часто начинают с мышей или крыс, так как в дело вступают вопросы как морально-этического, так и финансового характера (обезьян не так много, и содержать их более чем затратно).
Для проведения доклинических исследований, как правило, берут два вида животных. Чаще всего, это — мыши и приматы. Идеальный вариант — когда в тестировании принимают участие три и более видов. Это дает возможность подобрать максимально подходящую дозировку и обеспечить полную безопасность препарата [4].
Многие вакцины не продвигаются дальше этой стадии, потому что их разработчики либо не могут достичь желаемого иммунного ответа, либо наблюдают серьезные последствия вакцинации.
Если доклинические исследования признаны успешными, то начинается этап клинических испытаний на людях . Он представляет собой тестирование на добровольцах и состоит из трех фаз.
Подробнее о клинических испытаниях вы можете прочитать в статьях спецпроекта «Биомолекулы» «Клинические исследования».
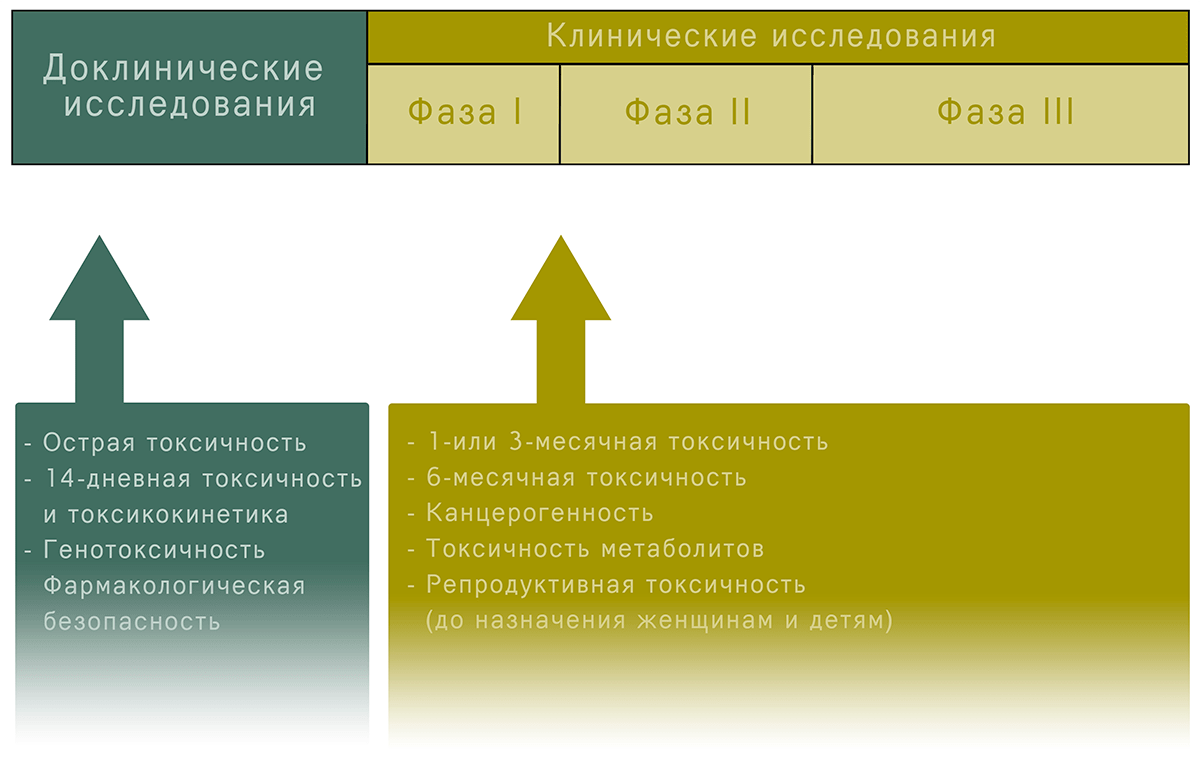
Рисунок 2. Оценка безопасности препарата при проведении клинических и доклинических исследований. Основная задача доклинических и первой стадии клинических испытаний — оценить токсичность препарата. Ученые досконально наблюдают за вакцинированными, уделяя внимание как местным реакциям, так и общему состоянию. Регистрируют возможное повышение температуры, воспаление в месте инъекции; изучают общий и биохимический анализы крови и идентифицируют побочные эффекты. Это необходимо для установления оптимальной дозы патогенных элементов, оценки переносимости и безопасности препарата.
Фаза I длится от нескольких недель до одного года. Вакцина вводится небольшому числу здоровых взрослых добровольцев (обычно от 20 до 100 человек). Целью проведения первой фазы является оценка безопасности вакцины для человека, установление типа и степени иммунного ответа, утверждение оптимальной дозировки. Также на данном этапе фиксируются возможные побочные эффекты (рис. 2).
Фаза II длится до двух лет. Во второй фазе испытаний принимают участие несколько сотен добровольцев. Предмет оценки этой стадии — иммуногенность вакцины, то есть способность антигена вызывать иммунный ответ. На данном этапе происходит детальный анализ всех реакций организма, определяется периодичность и сроки вакцинации, особенности транспортировки препарата.
Фаза III. Длительность — до семи лет. «Выпускники» второй фазы переходят к более крупным экспериментам, в которых участвуют тысячи или даже десятки тысяч человек. Однако не все из них становятся испытуемыми нового препарата: часть добровольцев получают экспериментальную вакцину, другим вводят плацебо (это может быть физиологический раствор, например). Главная цель третьего этапа — оценка безопасности и эффективности вакцины при массовом применении. Анализируются побочные эффекты (в том числе редкие и отсроченные), которые могут не проявляться в небольших группах испытуемых на более ранних стадиях тестирования.
После успешного прохождения всех фаз клинического этапа выдается лицензия на вакцину и ее производство.
Выдача лицензии и массовый выпуск вакцины не означает, что все проверки закончились. Существует IV фаза — постклинический мониторинг, который позволяет получить еще более детальные данные о действенности вакцины, ее безвредности и возможных побочных явлениях , [4].
После утверждения вакцины и ее массового применения крайне важно продолжать мониторинг как безопасности, так и эффективности препарата. Отсроченные и очень редкие побочные явления могут быть обнаружены, только когда вакцинировано большое количество людей. Негативные последствия вакцинации, выявленные уже после лицензирования, могут привести к тому, что препарат будет снят с производства и запрещен для использования, хотя это случается довольно редко.
В декабре 2019 года в Ухане началась эпидемия нового коронавирусного заболевания COVID-19 (англ. coronavirus disease — 2019). Количество заболевших росло (и продолжает расти до сих пор) в геометрической прогрессии. В марте 2020 года ВОЗ объявила всемирную пандемию: зараженные коронавирусом выявлены повсюду [6]. Началась гонка за изготовление безопасных и эффективных вакцин против новой коронавирусной инфекции в рекордно короткие сроки.
Кто занимается разработкой вакцины и почему их так много?
Вакцины против COVID-19 разрабатывались в режиме «турбо»: менее чем за год объявили об успешной создании нескольких препаратов, которые уже одобрены для использования в ряде стран.
На момент начала января 2021 года на стадии клинических испытаний находилось 89 вакцин, 20 из которых достигли финального этапа тестирования (рис. 3). По меньшей мере 80 вакцин активно исследуются на животных. Почему их так много и чем они различаются? Существует несколько типов вакцин против SARS-CoV-2. Некоторые из них основаны на традиционных способах разработки, другие — на новых, более современных методах.

Рисунок 3. Трекер вакцин от COVID-19 по всему миру. Из рисунка видно, сколько вакцин на данный момент находится на той или иной стадии испытаний. Фаза 1: тестирование безопасности и дозировки — 37 вакцин. Фаза 2: расширенные испытания для определения безопасности — 24 вакцины. Фаза 3: установление эффективности при массовом введении — 20 вакцин. Раннее и ограниченное одобрение на основе предварительных данных об эффективности и безопасности (отсутствие окончательных результатов III фазы клинических испытаний) — 8 вакцин. Одобрены (рассмотрение результатов клинических исследований и планов по производству вакцины; принятие решения по выдаче полного одобрения вакцины) — 2 вакцины. Заброшены (исследователи наблюдают серьезные побочные эффекты у добровольцев) — 4 вакцины.
[9], рисунок адаптирован
Одним из классических путей изготовления вакцин является инактивация (уничтожение) вируса с помощью химического или физического воздействия, чтобы вирус больше не мог размножаться. Над данным типом вакцин работают такие компании как Sinopharm (вакцина BBIBP-CorV), Sinovac (вакцина CoronaVac), Bharat Biotech (вакцина Covaxin) и другие.
К более современным относят векторные вакцины. При их разработке ген SARS-CoV-2 вводится в другой безвредный вирус (чаще всего отдают предпочтение аденовирусам, но могут использоваться и вирусы кори или гриппа, например), чтобы доставить ген возбудителя в клетки человека для стимуляции иммунного ответа. Компаниями-разработчиками таких вакцин выступают: Национальный исследовательский центр эпидемиологии и микробиологии имени Н.Ф. Гамалеи (вакцина «Спутник V»), Оксфордский университет и AstraZeneca (вакцина AZD1222), CanSino (вакцина Convidecia), Johnson&Johnson (вакцина Ad26.COV2.S) и другие.
Следующий тип — пептидные вакцины. Они представляют собой смесь разных химически синтезированных пептидных антигенов белка коронавируса. К таким относится вакцина «ЭпиВакКорона» российского Государственного научного центра вирусологии и биотехнологии «Вектор» , NVX-CoV2373 американской компании Novavax и другие.
И, наконец, самыми новыми являются вакцины на основе мРНК. Матричная РНК, заключенная в липидную частицу попадает в клетку и превращается в «шаблон» для синтеза вирусных антигенов. В итоге собственные клетки организма начинают синтезировать вирусные белки. Такие вакцины разрабатывают ведущие компании Moderna (вакцина mRNA-1273), Pfizer—BioNTech (вакцина Comirnaty) и другие. Список наиболее известных вакцин приведен в таблице 1.
| Вакцина | Фаза испытания | Доклинические исследования | Статус |
|---|---|---|---|
  Comirnaty Comirnaty |
II, III | Проводились | Одобрена в Саудовской Аравии, Бахрейне, Швейцарии. Ограниченное использование в США и ЕС. |
 mRNA-1273 mRNA-1273 |
III | Не проводились | Одобрена в Канаде. Ограниченное использование в США, Великобритании, Израиле. |
 «Спутник V» «Спутник V» |
III | Проводились | Ограниченное использование в России, Белоруссии и некоторых других странах. |
  AZD1222 AZD1222 |
II, III | Проводились | Ограниченное использование в Великобритании, Индии и некоторых других странах. |
 Convidecia Convidecia |
III | Не проводились | Ограниченное использование в Китае. |
  Ad26.COV2.S Ad26.COV2.S |
III | Проводились | |
 «ЭпиВакКорона» «ЭпиВакКорона» |
III | Проводились | Ограниченное использование в России. |
 NVX-CoV2373 NVX-CoV2373 |
III | Проводились | |
 BBIBP-CorV BBIBP-CorV |
III | Проводились | Одобрена в Китае, США, Бахрейне. Ограниченное использование в Египте. |
 CoronaVac CoronaVac |
III | Нет данных | Ограниченное использование в Китае. |
 Covaxin Covaxin |
III | Проводились | Ограниченное использование в Индии. |
Более подробно с вакцинами из таблицы 1 можно ознакомиться в статье «Вакцины против коронавируса: последние новости» [10].
Из таблицы мы видим, что большинство компаний-разработчиков вакцин от коронавирусной инфекции не стали рисковать и полностью отказываться от доклинических испытаний. Остановимся более подробно на вакцинах, которые в «эпоху суперкомпьютеров» все же были протестированы на животных.
Кто и зачем выступает в качестве подопытных «кроликов» для испытания вакцин от COVID-19?
Исполнительный директор Европейской ассоциации исследований животных Кирк Лич считает, что животныео обеспечивают наиболее близкую модель заражения человека COVID-19 и как нельзя лучше подходят для испытаний [11].
В Государственном научном центре вирусологии и биотехнологии «Вектор», а также в московском Федеральном научном центре исследований и разработки иммунобиологических препаратов им. М.П. Чумакова РАН проводят испытания вакцин от коронавирусной инфекции. Эксперименты осуществляют на лабораторных моделях животных. Исследования направлены на определение наиболее безопасных прототипов вакцины, состава, дозы и способа введения [12].
Для получения достоверных данных в исследованиях задействована группа различных животных, которые имеют различные признаки, определяющие проявление идентичных человеческим симптомов болезни.
В основном для экспериментов используются обезьяны — из-за тесного генетического сходства с людьми. Именно с участием этих приматов ученые выяснили, что риск заражения коронавирусной инфекцией минимален у тех, кто уже переболел COVID-19.
Испытания на макаках проводили китайские исследователи из Академии военно-медицинских наук, Suzhou Abogen Biosciences и Walvax Biotechnology. Они объявили о начале тестирования вакцины на основе мРНК под названием ARCoV.
Было установлено: ARCoV не только индуцирует выработку антител, но и стимулирует защитные Т-клеточные иммунные реакции. Эксперименты на макаках показали, что иммунизированные вакциной животные могут эффективно противостоять атаке нового коронавируса, предотвращать его репликацию (воспроизведение) и прогрессирование легочных заболеваний.
Незаменимыми участниками тестирования вакцины остаются мыши. Однако обычные мыши не восприимчивы к новой инфекции, поэтому ученые решили поработать над созданием «модели заболевания COVID-19» — мышей, которые будут чувствительны к SARS-CoV-2 и смогут воспроизводить симптомы заболевания.
Калифорнийская компания Arcturus Therapeutics и сингапурская Медицинская школа Duke-NUS разработали мРНК-вакцину LUNAR-COV19, для апробации которой использовались мыши.
Тесты на животных показали, что активация клеточно-опосредованного иммунитета вызывает сильный ответ Т-лимфоцитов CD8+ (Т-киллеров). Кроме того, эксперименты на мышах доказали, что LUNAR-COV19 стимулирует не только клеточный, но и гуморальный иммунный ответ, в частности, наблюдается более высокий уровень IgG и IgM по сравнению с обычными мРНК-вакцинами.
Также, проводя доклинические исследования, специалисты Arcturus Therapeutics и Duke-NUS выяснили, что однократная первичная вакцинация привела к стойкой выработке антител, то есть разовая доза LUNAR-COV19 защищает от смертельного исхода.
Новое модельное животное для тестирования COVID-19 — сирийский хомяк. На его клетках находятся рецепторы, обладающие высоким сродством к SARS-CoV-2, благодаря которым коронавирус нового типа проникает в организм животного.
Хомяки использовались в доклинических испытаниях вакцины индийской компании Bharat Biotech, которая в сотрудничестве с индийским Советом медицинских исследований и Национальным институтом вирусологии разработала препарат Covaxin на основе инактивированной формы коронавируса.
В ходе экспериментов индийским ученым удалось доказать, что Covaxin действительно вызывает стойкий гуморальный иммунный ответ, снижает риск патогенного воздействия вируса на верхние и нижние дыхательные пути, что дает гарантию отсутствия возникновения серьезных патологий легких. Эти данные подтверждают эффективность вакцины для защиты хомяков, которым был введен SARS-CoV-2.
Кроме того, ученые из Файнбергской школы медицины Северо-Западного университета США с помощью опытов на сирийских хомяках установили, что введение вакцины от коронавируса интраназально оказывает более мощную защиту от COVID-19, чем внутримышечное введение [13].
Другая подходящая модель — хорьки, поскольку анатомия и физиология их легких похожи на человеческие. Кроме того, распространение вируса у этих животных (а также у кошек, норок, хомяков и обезьян) осуществляется воздушно-капельным путем, в то время как, например, мыши первоначально подлежат генетическим изменениям, чтобы стать восприимчивыми к инфекции (не самый легкий путь, согласитесь).
Благодаря экспериментам на хорьках и других животных установлена безопасность вакцины «ЭпиВакКорона» новосибирского центра «Вектор» . Препарат прошел доклинические испытания продолжительностью 4,5 месяца. На четырех видах животных (хомяках, хорьках, африканских зеленых мартышках, макаках резус) показана специфическая активность: иммуногенность и защитные свойства в отношении SARS-CoV-2 [14]. Безвредность вакцины подтверждена исследованиями на шести видах животных (морских свинках, кроликах, мышах, крысах, африканских зеленых мартышках, макаках резус) по следующим характеристикам: аллергические свойства, иммуногенность, общая токсичность, мутагенная активность [15].
Здесь хотелось бы отметить: возможно «ЭпиВакКорона» действительно безопасна* и не дает побочных эффектов на животных, но все-таки основополагающее свойство вакцины — способность защищать от заболевания человека, о чем пока почти ничего неизвестно.
Пептидная вакцина — одна из самых непростых для создания. Сложность ее разработки состоит в том, что иммунизация осуществляется не всем белком, а лишь его важным «кусочком» — коротким пептидом, подобрать который крайне проблематично. В случае все-таки успешного подбора рабочих пептидов возникают затруднения с обеспечением доставки этих элементов до иммунных клеток, для чего фрагменты белка заключают в липидные оболочки или в специальные клетки человека — это, несомненно, крайне трудоемкий процесс.
Также известно, что «ЭпиВакКорона» преимущественно активирует Т-клеточный иммунитет, однако пока неизвестно достаточно ли его одного для защиты от COVID-19.
* — Пептидные вакцины состоят из искусственно созданных коротких фрагментов белков вируса, на которые формируется иммунный ответ, то есть в таких препаратах нет ни патогенных микроорганизмов, ни их токсинов, поэтому они зачастую отличаются высокой безопасностью.
«Идеальными» животными для тестирования вакцин от коронавирусной инфекции считаются кошки. Заведующий лабораторией биотехнологии и вирусологии Новосибирского государственного университета, член-корреспондент РАН Сергей Нетесов сообщил, что высокая чувствительность кошек к коронавирусу делает их хорошим модельным объектом для доклинических испытаний [16]. У кошек на поверхности клеток есть белки-рецепторы, отвечающие за проникновение вируса. Эти белки, по всей видимости, наиболее близки по строению к человеческим, поэтому тестирование препаратов таким образом наиболее приоритетно. Также была выдвинута гипотеза о том, что кошки больше всех подходят на роль промежуточного хозяина вируса между летучими мышами и человеком.
Однако кошки в доклинических испытаниях пока не участвуют из морально-этических соображений.
Используются при тестировании вакцины от инфекции SARS-CoV-2 и свиньи. Многие из органов и систем этих животных на 90% аналогичны соответствующим системам в организме человека как по анатомическим характеристикам, так и по выполняемым функциям. Полученные результаты помогли лучше понять, насколько безопасна и эффективна новая вакцина и подходит ли она для испытаний на людях. Также свиньи используются для проверки эффективности новых типов аппаратов ИВЛ [11].
Однако все ли считают необходимым использование животных для борьбы с COVID-19 во время глобальной пандемии?
Доклинические исследования вакцины «Спутник V» длились чуть больше месяца. О чем говорят такие сжатые сроки? О том, что отсроченные последствия введения вакцин, вероятно, на животных глубоко изучаться не будут.
Многие ученые и исследователи уверены: вакцины могут быть разработаны и испытаны без проведения длительных доклинических испытаний . По их мнению, в новом подходе к изобретению вакцин должны быть пропущены некоторые стадии экспериментирования на животных. К примеру, вирусологи из Национального института аллергии и инфекционных заболеваний действительно вводили новую вакцину лабораторным мышам в тот же день, когда началось исследование на людях.
Главный риск ускоренных испытаний — побочные эффекты, которые не успели обнаружить во время массовой вакцинации во второй и третьей фазах. Например, в 1955 году американская компания Cutter Laboratory выпустила на рынок 120 тысяч доз вакцины от полиомиелита с патогенным штаммом. В течение недели зарегистрировали десятки тысяч случаев заболевания полиомиелитом, в некоторых случаях инфекция вызывала у детей паралич вплоть до остановки дыхания [17].
Марк Файнберг, президент и генеральный директор Международной инициативы по вакцинации против СПИДа, чья работа в качестве главного сотрудника по общественному здравоохранению и науке в компании Merck Vaccines сыграла важную роль в разработке вакцинации против вируса Эбола, убежден: учитывая нынешнюю чрезвычайную ситуацию, имеет смысл начать тестирование вакцины, сократив доклинические испытания на животных. «Я лично считаю, что это не только уместно; я думаю, что это единственный вариант, который у нас есть», — сказал директор [18].
Единомышленники Марка Файнберга уверены: если добровольцы получат доступ к вакцине как можно быстрее, то ученые узнают гораздо раньше, действует препарат или нет.
Команда экспериментаторов американской биотехнологической компании Moderna Therapeutics разрабатывала вакцину от COVID-19 и не пошла по традиционному пути выделения живых образцов вируса, благодаря чему смогла ускорить процесс разработки [19]. Исследователи воспользовались новой технологией: вместо того, чтобы брать за основу мертвую или ослабленную форму вируса, создали методику использования синтетической копии генетического кода COVID-19. Не дождавшись завершения проверки своего изобретения на доклиническом этапе, компания сразу перешла к опытам на людях, при этом экспериментирование на животных провели уже после завершения II фазы клинических испытаний.
Несмотря на то, что в данном исследовании тестирование на животных было непродолжительным, оно показало, что вакцинация mRNA-1273 приводит к сильному иммунному ответу и защищает от инфекции верхние и нижние дыхательные пути нечеловеческих приматов (шимпанзе, горилл, бонобо и орангутанов). У макак резус установлен высокий титр антител, а также повышенное функционирование Т-клеточного иммунитета. Это стало одним из ключевых этапов, доказывающим, что mRNA-1273 защищает от развития заболевания у нечеловеческих приматов и предотвращает легочные заболевания у всех животных, что является основанием для клинического продвижения вакцины Moderna.
Проведем более подробный анализ эффективности вакцины «Спутник V», которая испытывалась на животных, и вакцины mRNA-1273, которая не участвовала в соответствующих исследованиях, а также установим, повлияло ли на действенность препаратов проведение или отсутствие экспериментирования на животных.
С тестированием на животных или без него: данные клинической эффективности вакцин
Уже 11 августа 2020 года российская вакцина «Спутник V» на основе аденовирусного вектора была зарегистрирована Минздравом России и стала первой, официально представленной вакциной от COVID-19 на рынке.
До начала клинических испытаний вакцина прошла все стадии доклинических экспериментов на различных типах животных, включая 2 типа приматов. I/II фаза клинических испытаний вакцины была завершена 1 августа 2020 года.
2 февраля 2021 года РФПИ (Российский фонд прямых инвестиций) опубликовал информацию о результатах третьей фазы клинических испытаний. К этому времени было вакцинировано 19 866 добровольцев, из них 14 964 получили вакцину, а 4902 — плацебо. Согласно промежуточным результатам исследований было инфицировано 78 человек, из них только 16 получили настоящую вакцину. Эти данные позволили сделать вывод о ее эффективности в 91,6% (табл. 2).
Также стало известно об участии в исследовании 2144 человек старше 60 лет. В этой группе вакцина показала эффективность 91,8% [20].
| 3:1 | Количество заболевших | Частота | Эффективность | |
|---|---|---|---|---|
| Вакцина | 14 964 | 16 | 0,04% | 91,6% |
| Плацебо | 4699 | 62 | 1,3% |
Что касается вакцины mRNA-1273, анализ результатов III фазы исследования с участием 30 000 добровольцев включал 196 случаев заболеваний COVID-19, из которых 30 были тяжелыми — все в группе плацебо и ни одного среди вакцинированных. Вакцина показала высокую эффективность: 94,1% против инфекции и 100% против тяжелого течения COVID-19. При этом среди заболевших только 11 человек оказались в группе вакцинированных, остальные получили плацебо [21].
Сравнивая эффективность вакцины «Спутник V», которая испытывалась на животных, и вакцины mRNA-1273, которая не проходила соответствующих исследований, пока отмечаем, что доклинические испытания не гарантируют значительных преимуществ по таким параметрам как безопасность и действенность. Но основные выводы можно будет сделать, только когда начнется массовая вакцинация населения.
Ускоряемся или минимизируем риски?
Специалисты Moderna подготовили план разработки вакцины через 48 часов после того, как китайские ученые расшифровали генетическую последовательность SARS-CoV-2. А уже через 2 месяца начались клинические испытания на людях.
Практически полный отказ от неклинических исследований позволил специалистам меньше чем через год добиться завершения III фазы клинических испытаний и ограниченного одобрения для применения.
Достичь подобных результатов в такие сжатые сроки удалось именно за счет сокращения всех этапов клинических испытаний и почти полного отказа от доклинических. Для сравнения: после вспышки атипичной пневмонии в 2002–2003 гг. потребовалось 20 месяцев, чтобы начать тестирование вакцины.
Мы видим, что использование новых более коротких путей способно ускорить ход изготовления вакцины, но долгосрочные перспективы данного процесса пока неизвестны. Даже если исследователи решат, что стоит «перепрыгивать через ступеньки» и оценивать безопасность новой вакцины на людях, все еще выясняя, работает ли препарат у восприимчивых животных, они должны быть готовы остановить клинические испытания, если результаты доклинических покажут отрицательный результат или его отсутствие.
Получается, что ответить однозначно на вопрос о необходимости полноценного проведения доклинических испытаний в настоящий момент невозможно. С одной стороны, пропуская некоторые стадии тестирования на животных, ученые действительно смогли сократить длительность изобретения вакцины в несколько раз, но, с другой стороны, исключить возможность проявления отсроченных последствий и побочных эффектов пока не может никто.
Литература
- Контроль над производством вакцин. (2020). «Специалисты о прививках»;
- Антиген — невидимка;
- Разработка вакцин: чем и как имитировать болезнь?;
- Вакцины: путь от изобретения до применения. «Аско-Мед-Плюс»;
- Клинические испытания вакцин от вирусных инфекций. Как их проводят? (2020). «Вдумчива_я — Яндекс.Дзен»;
- Хроника распространения SARS-CoV-2;
- Откуда появились человеческие коронавирусы?;
- Беляков Н.А., Рассохин В.В., Боева Е.В., Трофимова Т.Н., Ястребова Е.Б., Багненко С.Ф. (2020). Коронавирусная инфекция COVID-19. Часть 4. Осознание эпидемического процесса и организация помощи больным. ПСПбГМУ им. И.П. Павлова;
- Zimmer C., Corum J., Wee S.-L. (2021). Coronavirus vaccine tracker. The New York Times;
- Вакцины против коронавируса: последние новости;
- Веласкес М. (2020). Какие животные и почему используются для тестирования вакцины от коронавируса. Metro;
- Ловчикова С.А. (2020). Биоэтические проблемы экспериментирования на животных в исследовательской деятельности. «Научный журнал молодых ученых». 19, 14–16;
- Испытали на хомяках. Определен эффективный способ вакцинации от COVID. (2020). «Радио Sputnik»;
- ТОП-20 вопросов о вакцине ФБУН ГНЦ ВБ «Вектор». (2021). Роспотребнадзор;
- Should animals be used for scientific or commercial testing? (2020). ProCon.org;
- Недюк М. и Коленцова О. (2020). Котомодель: найдены идеальные животные для тестирования вакцин от COVID-19. «Известия»;
- Никитин Н. (2020). Как разрабатывают вакцины. «Постнаука»;
- Boodman E. (2020). Researchers rush to test coronavirus vaccine in people without knowing how well it works in animals. Stat;
- Second interim analysis of clinical trial data showed a 91.4% efficacy for the Sputnik V vaccine on day 28 after the first dose; vaccine efficacy is over 95% 42 days after the first dose. (2020). Russian Direct Investment Fund;
- Lancet опубликовал результаты третьей фазы испытаний «Спутника V». Главные выводы. (2021). BBC;
- Абсолютно исчерпывающий (и постоянно обновляемый) путеводитель «Медузы» по вакцинам от коронавируса. (2021). Meduza;
- Коробатов Я. (2021). «Вирус учится распространяться все быстрее»: биолог рассказал главное, что известно о мутациях COVID-2019. «Комсомольская правда».