
Разработка вакцин: чем и как имитировать болезнь?
21 декабря 2018
Разработка вакцин: чем и как имитировать болезнь?
- 8783
- 4
- 15
Разработка вакцины — сложный, многостадийный процесс, в котором безопасность и эффективность получившегося продукта стоят на первом месте. Рисунок в полном размере можно посмотреть по ссылке.
иллюстрация Ирины Ефремовой
-
Автор
-
Редакторы
-
Иллюстратор
В предыдущих статьях спецпроекта по вакцинации мы рассказали, как развивалась идея борьбы с болезнями при помощи вакцин и как они изменили жизнь человечества почти до неузнаваемости. Но как же работают вакцины? Из каких компонентов они состоят и чем различаются между собой? Разберемся с этим в нашей третьей статье.
Вакцинация

Изобретение вакцин кардинально изменило жизнь человечества. Многие болезни, уносившие тысячи, а то и миллионы жизней ежегодно, теперь практически не встречаются. В этом спецпроекте мы не только рассказываем об истории возникновения вакцин, общих принципах их разработки и роли вакцинопрофилактики в современном здравоохранении (этому посвящены первые три статьи), но и подробно говорим о каждой вакцине, включенной в Национальный календарь прививок, а также вакцинах против гриппа и вируса папилломы человека. Вы узнаете о том, что собой представляет каждый из возбудителей болезней, какие существуют варианты вакцин и чем они различаются между собой, затронем тему поствакцинальных осложнений и эффективности вакцин.
Для соблюдения объективности мы пригласили стать кураторами спецпроекта Александра Соломоновича Апта — доктора биологических наук, профессора МГУ, заведующего лабораторией иммуногенетики Института туберкулеза (Москва), — а также Сусанну Михайловну Харит — доктора медицинских наук, профессора, руководителя отдела профилактики НИИ детских инфекций (Санкт-Петербург).
Генеральный партнер спецпроекта — Zimin Foundation.
Партнер публикации этой статьи — компания «ИНВИТРО». «ИНВИТРО» — это крупнейшая частная медицинская лаборатория, специализирующаяся на проведении лабораторных анализов и функциональной диагностики, включающая магнитно-резонансную томографию, маммо- и рентгенографию, УЗИ и другие.
Мир сильно изменился с изобретением вакцин: продолжительность жизни выросла, единичные случаи заболеваний перестали превращаться в эпидемии, а эпидемии — в пандемии; некоторые болезни (например, натуральную оспу) вообще удалось победить.
Тем не менее мир по-прежнему нуждается в вакцинах — как в проверенных временем, так и в новых. Некоторые возбудители, такие как вирус гриппа [1], научились выживать в новых условиях тотально вакцинированного мира и меняют свою белковую оболочку по несколько раз в год, пытаясь ускользнуть от надзора иммунной системы [2]. Другие заболевания, вроде ВИЧ-инфекции, десятилетиями не покоряются разработчикам вакцин [3]. Да и природа не устает подкидывать нам новые инфекционные заболевания, как это произошло, например, с не так давно нашумевшей лихорадкой Зика [4].
Таким образом, разработчики вакцин еще долго не останутся без работы. Но чтобы что-то создать, нужно сначала понять, как работает система, на которую мы пытаемся повлиять. В этой статье мы подробно расскажем, как вакцины запускают иммунный ответ, что происходит с возбудителем внутри вакцинированного организма и как разрабатывают новые вакцины.
Иммунитет: борьба с захватчиками
Иммунная система — это самая настоящая армия, направленная на борьбу с бактериями, вирусами, грибами и другими незваными гостями. Описывать всю сложность этой многогранной системы мы сейчас не можем, да в этом и нет необходимости. Заинтересованному читателю можно порекомендовать подробную статью, вышедшую на «Биомолекуле» ранее: «Иммунитет: борьба с чужими и… своими» [5]. А здесь мы остановимся на тех звеньях иммунной защиты, которые важны для работы вакцин.
Практически любое инфекционное заболевание начинается с того, что некий возбудитель пробивает защитные барьеры нашего организма и оказывается в его внутренней среде. Задача этих захватчиков — как можно скорее исполнить свою биологическую функцию, то есть размножиться. Естественно, за наш с вами счет — заражая или разрушая человеческие клетки.
Ответ организма на такое неподобающее поведение «гостей» обычно быстрый и агрессивный. В борьбу с противником вовлекаются практически все иммунные клетки пораженного участка. Тканевые макрофаги разворачивают битву с врагом, эндотелий сосудов ощетинивается белками-селектинами и становится «посадочной площадкой» для прибывающих из крови лейкоцитов — макрофагов, нейтрофилов, а затем и лимфоцитов. Ткани заполняются токсичными белками и активными формами кислорода и азота, которые не щадят ни чужих, ни своих. Все эти события приводят к быстрому развитию воспаления.
Воспаление активируется, когда в тканях и клетках появляются сигналы опасности [6], [7]. Это несколько типов молекул, общих для поврежденной или инфицированной ткани. Например, если в клетке хозяина обнаруживается чужеродная ДНК вируса или бактерии, значит, тут явно что-то не так. Или в тканевых жидкостях появляются компоненты стенок бактерий, которые в нашем организме не производятся. Распознавая такие сигналы, иммунитет способен понять, что организм подвергся нападению.
Ученые разделяют иммунный ответ на два основных типа — врожденный и адаптивный . Макрофаги и нейтрофилы относятся к врожденному иммунитету, чей основной инструмент борьбы с врагами — острое воспаление. Со многими микроорганизмами такая защита справляется легко, и мы чаще всего не замечаем, что именно произошло внутри нашего тела.
За основополагающие работы в области изучения взаимосвязи между функционированием врожденного и адаптивного иммунитета в 2011 году была вручена Нобелевская премия по физиологии или медицине. Ей на нашем сайте посвящена статья «Иммунологическая Нобелевская премия (2011)» [6].
Практически все специализированные патогены человека могут выживать под ударами острого воспаления и справляться с ним, ослабляя или как-то иначе изменяя его течение. Некоторые даже освоили методы контроля воспаления и использования его в своих целях. Для борьбы с такими патогенами нужно не просто зафиксировать угрозу, а точно нацелиться на противника. За это отвечает адаптивный иммунитет. Он медленнее разворачивается (от одной до двух недель), тонко настраивается (адаптируется) на конкретный вирус или бактерию и только после этого обретает способность быстро и эффективно уничтожать практически любой патоген.
Адаптивный иммунитет устроен очень сложно. В зависимости от типа возбудителя в активацию вовлекаются разные наборы клеток и белков. Однако, как правило, для эффективного ответа необходимы специальные молекулы — антитела.
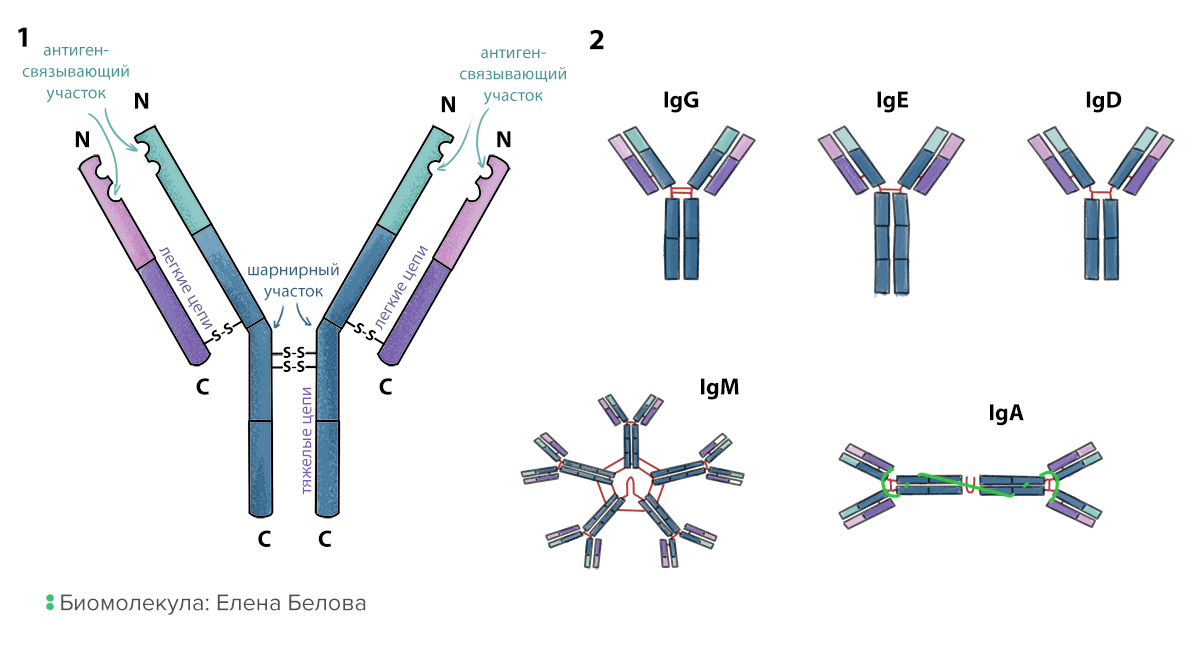
Рисунок 1. Строение и классы антител. Вне зависимости от класса, антитела имеют два основных участка. Антигенсвязывающий участок «подбирается» лимфоцитами под каждый конкретный антиген и прилипает к нему при контакте. Константный же обеспечивает связывание с рецепторами и белками самогό организма.
иллюстрация Елены Беловой из [8]
Антитело — это огромная по меркам микромира молекула (рис. 1) . На одном ее конце находятся как минимум два идентичных «липких» участка, отвечающих за распознавание чужеродных молекул (антигенов).
Строению и свойствам этой молекулы посвящена статья «Антитело: лучший способ распознать чужого» [8]. — Ред.
Антигены — любые вещества, которые организм воспринимает как чужеродные и, соответственно, отвечает на их появление активацией иммунитета. Самые важные для иммунной системы антигены — это участки молекул, расположенные на внешней поверхности патогена.
Взаимодействие антитела с антигеном — очень сложный процесс, основанный на межмолекулярном распознавании. Для простоты можно представить, что антитело — это ключ, который подбирают к замку (рис. 2).
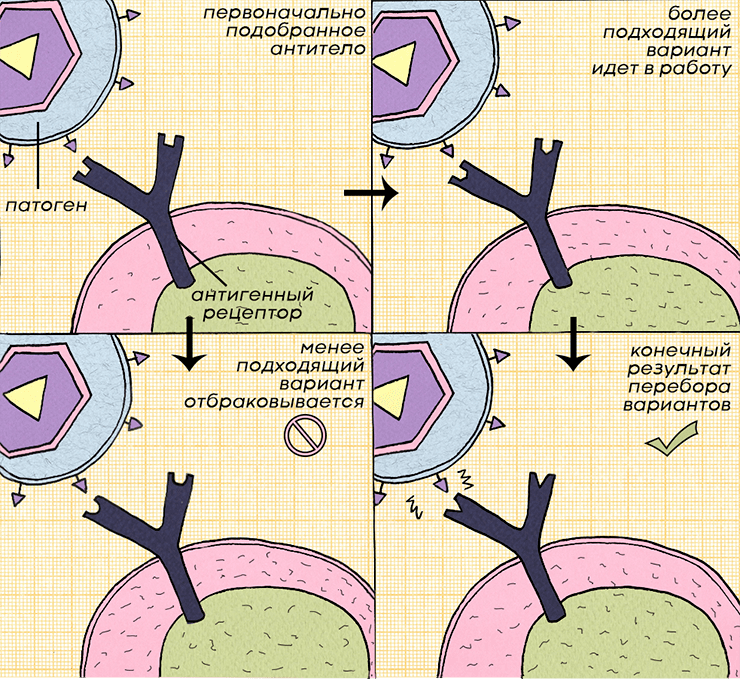
Рисунок 2. Схема процесса селекции и созревания антител. Крайне редко организм сразу находит антитело, идеально подходящее к патогену. Как правило, лимфоцитам нужно некоторое время, чтобы доработать имеющуюся более-менее подходящую «заготовку» до нужной силы связывания. Для этого они случайным образом меняют структуру антигенсвязывающего участка и постоянно тестируют его эффективность, конкурируя за антиген. Этот процесс происходит в лимфоузлах и белой пульпе селезенки и называется соматическим гипермутагенезом [8].
иллюстрация Ирины Ефремовой
За продукцию антител отвечает специальный тип иммунных клеток — В-лимфоциты. В-клеточный рецептор, локализованный на их поверхности, — тоже не что иное, как антитело. Благодаря сложнейшему молекулярному механизму создается громадный репертуар В-клеточных рецепторов, имеющих различное строение участка, который отвечает за связывание антигена. Каждый В-лимфоцит несет на своей поверхности рецепторы только одного варианта.
Когда в организм проникает патоген, его антигены связываются с В-клеточными рецепторами на поверхности В-лимфоцитов. Далее лимфоциты начинают изменять строение рецепторного участка, связывающего антиген, чтобы это связывание было максимально эффективным, а после того, как такой вариант найден — активно делиться, формируя целую армию В-лимфоцитов. И вот тогда клетки запускают программу массированной продукции антител.
Таким образом, образование антитела — это настоящая эволюция на уровне одной молекулы и один из самых удивительных процессов внутри нашего организма. В 2018 году ученым, которые сумели применить этот эволюционный процесс к молекулам вне иммунных клеток, была вручена Нобелевская премия по химии (об этом можно прочесть в статье «Черный ящик изобилия» [9]).
Вторая часть антитела не так изменчива, как «липкий» конец. С ней взаимодействуют многие клетки и белки иммунной системы. Клетки-фагоциты при связывании с ней активируются и съедают то, к чему антитело прикрепилось. Белки системы комплемента собираются вокруг антитела в комплекс, который дырявит оболочку бактерии и тем самым уничтожает ее. Кроме того, само связывание «липкого» конца антитела может приводить к обезвреживанию патогена. Например, это происходит тогда, когда антитела специфичны к токсинам какого-то патогена. В этом случае блокировка сводит на нет их повреждающую способность.
Следует, правда, отметить, что существует целый ряд заболеваний, вызываемых вирусами, бактериями и простейшими, при которых выработка антител не защищает организм хозяина. Это касается в первую очередь инфекций с хроническим течением, в числе которых туберкулез, малярия и ВИЧ-инфекция.
Появление антител к патогену, как правило, служит признаком скорого выздоровления — настолько эффективно начинает в их присутствии работать иммунитет. После болезни они могут обнаруживаться в крови годами. На этом основаны методы диагностики, призванные определить, сталкивался ли человек с тем или иным патогеном когда-либо [10]. Так, заражение некоторыми вирусами (например, вирусом краснухи) может навредить плоду во время беременности будущей матери [11]. Однако если у женщины есть антитела против вируса, это означает, что она ранее уже болела краснухой и не заразится вновь в самый неподходящий момент.
В природе единственная причина развития адаптивного иммунитета против какого-то возбудителя — это перенесенное заболевание. Человечество же изобрело способ заставить организм «поверить», будто он болел, хотя на самом деле оставался здоровым. Этот способ и называется вакцинацией, которой мы посвятили данный спецпроект.
Вакцины: имитация заболевания
Когда мы хотим искусственно заставить организм выработать адаптивный иммунитет, нам нужно повторить заболевание «в миниатюре» и активировать иммунную систему подобно тому, как это делает патоген. Для активации В-лимфоцитов, продуцирующих антитела, необходимы два молекулярных сигнала.
Первым сигналом служат фрагменты поверхности вируса или бактерии — антигены. Они поступают в лимфоузлы с клетками иммунной системы, лимфой и кровью, попадающими туда из воспаленной ткани.
Второй сигнал — это само воспаление в той области, откуда поступают антигены. Многочисленные факторы (молекулы) воспаления показывают, что источник антигенов опасен для организма. Если антигены есть, а воспаления нет, то возникает риск, что иммунитет отнесется к этим белкам, как обычно относится, например, к компонентам пищи. Тогда вместо иммунизации возникнет толерантность. Иммунная система признает эти белки за безопасные и не будет их атаковать.
Первый вопрос, который встает перед разработчиками вакцин, — откуда взять антиген. С точки зрения силы и продолжительности иммунного ответа нет ничего лучше, чем просто заразить человека тем возбудителем, от которого мы хотим его защитить. Именно так действовали врачи в отношении оспы, еще до открытий Дженнера [12] и появления животных моделей человеческих болезней. На протяжении столетий люди по всему миру пытались защищаться от оспы, прививая здоровому человеку содержимое оспенных пузырьков больного. Проблемы с этой процедурой очевидны: несмотря на то, что так вызывали более мягкую форму заболевания, около 2% привитых погибало от инфекции [13]. Очевидно, что сейчас этот метод неприемлем, и уже есть альтернативные решения.
По источнику антигенов вакцины подразделяют на несколько типов. Бывают живые вакцины, в состав которых входит настоящий живой патоген. Его ослабляют определенными способами (о них речь пойдет позже), чтобы он не смог вызвать заболевание, но спровоцировал активацию иммунитета. Помимо живых можно использовать убитые патогены. Иммунный ответ получается слабее, но зато такие вакцины безопаснее. И наконец, можно иммунизировать даже отдельными фрагментами вирусов, бактерий или их токсинов. В зависимости от использованной молекулы эти вакцины называются рекомбинантными (если содержат белки вируса или бактерии, наработанные в других организмах с помощью генной инженерии [14]) или анатоксинами (если содержат токсины бактерий с подавленной токсичностью).
В последнее время появился особый класс вакцин — ДНК-вакцины. Они вообще не подразумевают введения в организм готового антигена [15], [16]. Вместо него вводят фрагменты ДНК, содержащие гены, которые кодируют белки патогена. Такой белок становится мишенью для иммунной системы. Подобные вакцины пока применяют только экспериментально.
Живые вакцины
«Живыми» в вакцинах могут быть как бактерии, так и вирусы. Главная проблема при разработке таких препаратов заключается в обезвреживании того патогена, которым собираются вакцинировать, иначе мы будем просто заражать человека той же самой болезнью. В статье об истории вакцинации [12] мы рассказывали о случае с живой вакциной от полиомиелита, которую представил в 1935 году профессор Кольмер: вирус в ней сохранил слишком высокую способность вызывать заболевание, и это привело к проявлению у некоторых вакцинированных неоправданно сильных побочных эффектов. Случившееся отсрочило появление полноценной общедоступной вакцины на 20 лет.
При этом самая первая вакцина против оспы, придуманная еще Эдвардом Дженнером, была именно «живым» вирусом оспы коров [12]. Великому первопроходцу вакцинации мы должны быть благодарны не только за идею самой процедуры, но и за принципы ослабления патогенов, которые используются до сих пор.
Как правило, ослабленные вакцины создают против вирусов, так как они позволяют развить более широкий иммунный ответ [17]. Но есть и примеры аттенуации (ослабления) бактерий — например, вакцина БЦЖ против туберкулеза. Этой вакцине будет посвящена отдельная статья, так что пока мы опустим подробности ее разработки. Подобным образом получают вакцины для защиты от полиомиелита, сезонного гриппа [18], желтой лихорадки [19], кори, эпидемического паротита [20], краснухи, ветряной оспы и нескольких других заболеваний. Бόльшая часть этих вакцин входит в Национальный календарь прививок, поэтому подробности их создания будут разобраны в будущих статьях спецпроекта.
Основная методика, которую используют для ослабления вируса, — заражение клеточных культур или куриных и перепелиных эмбрионов. В норме вирус адаптируется к своему хозяину довольно точно, заражение клеток другого вида будет затруднено или даже невозможно. Но если такое заражение всё же возможно хотя бы в небольшом числе случаев, то вирус в течение нескольких поколений подстраивается под нового хозяина и перестает быть опасным для человека. Частота мутаций в вирусном геноме обычно достаточно велика, чтобы обеспечить быструю подстройку. При этом там остается достаточное количество неизмененных участков, чтобы вызвать полноценный иммунный ответ и на исходный вирус.
И вот тут-то кроется проблема [21]. Некоторые живые аттенуированные вирусные вакцины могут при длительной циркуляции в организме привитого частично вернуть свои свойства и заражать других людей. Пока это известно только для полиомиелитных вакцинных вирусов. Чтобы предупредить такую возможность, детям рекомендуется сначала ввести убитую вакцину (в России это делается двукратно) и лишь затем живую. Во многих странах применяется только убитая полиовакцина. Для других же живых вирусных вакцин феномен возврата вирулентности не описан, а альтернативы в виде убитых препаратов, как правило, нет.
В чём же преимущество живых вакцин? Почему нельзя ограничиться убитыми? Основная причина — это более сильный иммунный ответ. Дело в том, что при введении живой вакцины организм сталкивается не просто с набором антигенов, а с самым настоящим заболеванием, пусть и сильно ослабленным, и может подобрать больше специфических механизмов защиты. Такой иммунный ответ не только мощнее, но зачастую и продолжительнее [22].
Также к плюсам живых вакцин стόит отнести более удобное применение. Особенно хорошо это видно на примере вакцины от полиомиелита. Убитую вакцину чаще всего необходимо вводить с помощью болезненных инъекций, в то время как живые полиовакцины просто капают в рот.
К минусам же, несомненно, относятся все проблемы, свойственные живым болезнетворным агентам, которых мы вынуждены сохранять и использовать. Это серьезные требования к хранению и транспортировке [23], а также максимальная осторожность применения у пациентов с иммунодефицитами [24].
Инактивированные вакцины
Хотя использование живых инфекционных агентов предоставляет врачам уникальные возможности в деле формирования защиты от патогена, всё же куда чаще иммунизировать приходится убитыми патогенами или их частями.
В настоящее время инактивировать патогена можно одним из трех способов. Его можно убить химически (например, обработать формальдегидом), нагреванием или ионизирующим излучением [25]. После обработки патоген перестает быть опасным, но до некоторой степени сохраняет свою внешнюю и внутреннюю структуру. Сейчас таким образом получают вакцины от полиомиелита, гепатита А, гриппа, тифа, холеры, чумы, коклюша и др. Такие вакцины безопаснее живых, но обеспечивают менее выраженный и долгий ответ.
Субъединичные вакцины и анатоксины
Помимо цельных живых и убитых патогенов для вакцинации используют отдельные белки или их фрагменты, а также другие компоненты патогенов. Их можно получить из самих патогенов или биотехнологически — например, синтезировать нужные антигены в дрожжах. В настоящее время тестируют различные новые способы комбинирования и доставки этих антигенов, нацеленные на усиление иммунного ответа [26], [27].
К этому типу препаратов относятся вакцины против гепатита В [28], гриппа [29], вируса папилломы человека [30]. Если говорить о бактериальных заболеваниях, то ведутся разработки субъединичных вакцин от чумы [31–33] и туберкулеза [27], [34].
С помощью вакцин можно выработать иммунный ответ не на самогό патогена, а на его токсины — те молекулы, которые вызывают у нас наиболее сильные симптомы при заражении. В этом случае при заражении пациента токсины бактерии не смогут причинить ему вред, так как будут связаны и блокированы антителами. Чтобы сделать вакцину для защиты от токсина, первым делом его необходимо обезвредить, то есть превратить в анатоксин. Для этого токсин можно, например, обработать формальдегидом. Далее нужно убедиться в нетоксичности вакцины и только после этого вводить ее пациенту. Основные мишени таких вакцин — токсины возбудителей дифтерии и столбняка.
Другие типы вакцин
Так как основным механизмом работы вакцин является стимуляция выработки специфических антител к патогену или его компонентам, исследователи разумно задались вопросом, являются ли белки достаточно эффективной мишенью. Ведь бактерии покрыты не столько белками, сколько сахарами и жирами, а большинство белков находится внутри клетки и недоступно для антител.
Поэтому начал активно разрабатываться новый класс вакцин — полисахаридные и полисахарид-конъюгатные, — которые способствуют выработке эффективного антительного ответа именно к оболочкам патогенов. Однако в ходе разработок таких вакцин появились определенные проблемы, препятствующие их повсеместному употреблению. Во-первых, не все полисахаридные антигены в составе вакцин могут быть эффективно распознаны детским иммунитетом, поэтому их применение для вакцинации младенцев ограничено. Во-вторых, иммунный ответ на такие вакцины длится крайне недолго — не более 2–3 лет. Сегодня полисахаридные вакцины разработаны лишь против некоторых штаммов менингококка, однако дальнейшие исследования в этой области активно ведутся.
У каждого типа вакцин есть свои преимущества и недостатки, которые врачи и исследователи должны принимать во внимание. Мы постарались резюмировать их в таблице.
| Тип вакцины | Источник антигена | Плюсы | Минусы |
|---|---|---|---|
| Живая вакцина | Живые ослабленные патогены |
|
|
| Инактивированная вакцина | Убитые целые патогены |
|
|
| Субъединичная вакцина; анатоксин | Фрагменты и отдельные белки патогенов, инактивированные токсины |
|
|
| Генная вакцина | Клетки пациента, в которые ввели отдельные гены патогена |
|
|
Усилители вакцин — адъюванты
Важной проблемой при использовании любых неживых вакцин становится недостаточно сильный иммунный ответ. Потому проводят повторные (бустерные) инъекции, а также дополняют вакцины веществами, повышающими интенсивность иммунного ответа, — адъювантами.
Разработка новых адъювантов — очень перспективная область прикладной иммунологии. Показано, что от адъюванта может зависеть не только продолжительность, но и относительная и абсолютная активация различных ветвей иммунного ответа. Для многих современных адъювантов механизм действия недостаточно изучен, что также стимулирует исследования [35].
Будущее вакцинации
Вакцинация — наш главный способ борьбы с патогенами. Это единственный известный нам способ создать защиту у еще неболевшего человека. Массовая вакцинация открывает возможности не только для предотвращения эпидемий, но и для полного уничтожения болезни. Среди новых мишеней вакцинопрофилактики — ВИЧ [36] и вирус Зика [37].
Сейчас разрабатываются и новые способы доставки антигенов в организм. К примеру, развивается концепция ДНК-вакцин, предполагающая введение в тело пациента не самих белков, а генов, кодирующих их [15], [38]. Часть клеток иммунной системы начинает самостоятельно производить нужные антигены и активирует иммунный ответ на них.
Не менее активно развивается направление, посвященное разработке терапевтических онковакцин: они позволяют бороться со злокачественными новообразованиями так же, как с инфекциями. Тут исследователи разработали методы нагрузки иммунных клеток опухолевыми белками вне организма с последующим возвратом их в циркуляцию [39]. Так что в будущем мы можем увидеть еще не одну победу вакцинации над самыми агрессивными и неожиданными противниками.
Некоторые мифы о вакцинации
Вакцинация относится к самым мифологизированным процедурам в медицинской практике [40]. Практически каждый в своей жизни сталкивался хотя бы с одним из таких мифов. Эта статья не претендует на их всеобъемлющий анализ, однако мы попробуем разобрать основные легенды, распространенные в обществе.
Миф №1. Вакцины сами вызывают заболевания
Аутизм, гепатит, рак, иммунодефициты, отравление алюминием — в каких только грехах не обвиняли вакцины. Судя по всему, первыми на этом поприще потрудились еще современники Дженнера, утверждавшие, что прививка коровьей оспой спровоцирует у человека рост вымени и рогов. Противники вакцинации часто указывают на то, что проблем от нее куда больше, чем пользы.
В реальности большинство подобных сообщений относится к разряду мифов. Серьезных осложнений вакцины практически никогда не вызывают. Побочные эффекты возникают редко и включают в себя признаки начавшейся иммунной реакции, такие как повышение температуры или слабость. Применение живых вакцин при иммунодефиците может спровоцировать серьезные заболевания, поэтому вакцинация больных людей должна строго контролироваться. Современные исследования показывают, что вакцины — одни из самых безопасных средств защиты от инфекций.
Миф №2. Одновременная прививка против нескольких заболеваний может привести к негативным последствиям, особенно для ребенка
Вакцинация детей начинается практически сразу после рождения. Первые прививки ребенок получает еще в роддоме. В первый год жизни их довольно много, причем часто в одной инъекции объединяют несколько антигенов разных возбудителей — например, в комбинированной вакцине против кори, краснухи и паротита. Некоторые родители опасаются, что такое обильное вакцинирование может «перегрузить» иммунную систему и отключить ее.
На самом деле природа в этот же год жизни предоставляет иммунитету младенца куда больше задач, нежели любая вакцина. Одна только колонизация его тела микроорганизмами сводит нагрузку от всех «календарных» вакцин к уровню статистической погрешности: в кишечник младенца постоянно проникают тысячи новых видов микробов, которые иммунитету нужно рассортировать, изгнать патогенных и взять под контроль полезных. Кроме того, надо понимать, что иммунный ответ на каждый антиген возникает независимо. В-лимфоцит, подбирающий антитело к оболочке возбудителя кори, не станет делать свою работу хуже, если рядом с ним другой лимфоцит будет упражняться с антигенами вируса краснухи. Использование комбинированных вакцин позволяет сократить количество посещений врача, болезненных уколов и финансовых затрат.
Миф №3. Без вакцин можно было бы и обойтись, болезни и так победили бы гигиеной
Появление вакцин по времени совпало с введением в повседневную жизнь и медицинскую практику многих других процедур. За короткий период времени люди переселились из деревень в города, перешли на более качественную пищу. Технологическая революция и «второй гигиенический переход», произошедшие в конце прошлого тысячелетия, сильно изменили расстановку сил в борьбе с болезнями. Появился доступ к качественной госпитальной медицине. Централизованный водопровод снизил заболеваемость кишечными инфекциями. Но лишь снизил, а не свел на нет.
Если посмотреть исторические данные по заболеваемости, легко заметить, что ее интенсивность падает с улучшением качества жизни. Но если отметить на этих графиках точку начала полномасштабных программ вакцинации, станет ясно, насколько велик этот качественный скачок. Гигиена помогла придавить инфекции, но лишь вакцины по-настоящему загнали их в подполье.
Так почему же мифы о вакцинах так живучи?
Скептически настроенный читатель может задаться резонным вопросом. Если вакцины так безопасны, эффективны и необходимы, почему же у них столько противников? Никто же не протестует против туалетной бумаги, электрической лампочки или аспирина. А против вакцин такое мощное информационное давление. Что-то тут нечисто. Не бывает же дыма без огня.
Довольно сложно сказать, почему именно этот класс лекарств вызывает столь бурную реакцию. Некоторые причины разобраны в предыдущей статье нашего спецпроекта по вакцинации [41]. Некоторые специалисты считают, что вакцины страдают от собственной эффективности. Мы с вами привыкли использовать в быту то, что приносит нам непосредственную пользу. Заболели — выпили антибиотик — выздоровели. Проголодались — заказали пиццу — наелись. Вакцины же осязаемой, сиюминутной пользы не несут. Их действие направлено на предотвращение заболевания. И когда человек получает укол, он не видит непосредственного улучшения своей жизни.
Чем эффективнее вакцина и чем больше людей ее применяют, тем ниже риск заболеть. И тем дальше от нашей повседневной жизни ужасы кори и оспы. Уже взрослым стало поколение, не видевшее на своем веку ни одного больного оспой. Да и корь с коклюшем уже практически не уносят маленькие жизни. На почве такого благополучия велик соблазн придумать причину не идти на неприятную процедуру и не нести туда своего драгоценного малыша. Но надо помнить, что не стόит отказываться от ремня безопасности просто потому, что он вам ни разу не пригодился во время вождения. Когда пригодится — вы вряд ли успеете его пристегнуть.
Литература
- Гонки с вирусом: эпидемиология и экология вируса гриппа;
- C. A. Russell, T. C. Jones, I. G. Barr, N. J. Cox, R. J. Garten, et. al.. (2008). The Global Circulation of Seasonal Influenza A (H3N2) Viruses. Science. 320, 340-346;
- Barton F. Haynes, Dennis R. Burton. (2017). Developing an HIV vaccine. Science. 355, 1129-1130;
- Chao Shan, Xuping Xie, Pei-Yong Shi. (2018). Zika Virus Vaccine: Progress and Challenges. Cell Host & Microbe. 24, 12-17;
- Иммунитет: борьба с чужими и… своими;
- Иммунологическая Нобелевская премия (2011);
- Толл-подобные рецепторы: от революционной идеи Чарльза Джейнуэя до Нобелевской премии 2011 года;
- Антитело: лучший способ распознать чужого;
- Черный ящик изобилия. Нобелевская премия по химии 2018 года;
- Следствие ведет ВироСкан. Новый подход выявляет большинство вирусов, с которыми сталкивался человек;
- Dontigny L., Arsenault M.-Y., Martel M.-J. (2008). Rubella in pregnancy. J. Obstet. Gynaecol. Can. 30, 152–158;
- История вакцинации;
- Inaya Hajj Hussein, Nour Chams, Sana Chams, Skye El Sayegh, Reina Badran, et. al.. (2015). Vaccines Through Centuries: Major Cornerstones of Global Health. Front. Public Health. 3;
- 12 методов в картинках: генная инженерия. Часть II: инструменты и техники;
- Что такое ДНК-вакцины и с чем их едят?;
- Иммуностимулирующие вакцины;
- Marcela F. Pasetti, Jakub K. Simon, Marcelo B. Sztein, Myron M. Levine. (2011). Immunology of gut mucosal vaccines. Immunological Reviews. 239, 125-148;
- Anthony E. Fiore, Carolyn B. Bridges, Nancy J. Cox. (2009). Seasonal Influenza Vaccines. Current Topics in Microbiology and Immunology. 43-82;
- Thomas P Monath. (2005). Yellow fever vaccine. Expert Review of Vaccines. 4, 553-574;
- Philip A. Brunell. (1969). Evaluation of a Live Attenuated Mumps Vaccine (Jeryl Lynn). Am J Dis Child. 118, 435;
- T. Kuiken, E. C. Holmes, J. McCauley, G. F. Rimmelzwaan, C. S. Williams, B. T. Grenfell. (2006). Host Species Barriers to Influenza Virus Infections. Science. 312, 394-397;
- K. G.- I. Mohn, G. Bredholt, K. A. Brokstad, R. D. Pathirana, H. J. Aarstad, et. al.. (2015). Longevity of B-Cell and T-Cell Responses After Live Attenuated Influenza Vaccination in Children. Journal of Infectious Diseases. 211, 1541-1549;
- Recommendations for the use of live attenuated varicella vaccine. (1995). Pediatrics. 5, 791–796;
- Baker C., Pickering L., Chilton L., Cieslak P., Ehresmann K., Englund J. et al. (2011). General recommendations on immunization: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm. Rep. 60, 1–64;
- Shaw-Wei D Tsen, Tzyy Wu, Juliann G Kiang, Kong-Thon Tsen. (2012). Prospects for a novel ultrashort pulsed laser technology for pathogen inactivation. J Biomed Sci. 19, 62;
- Вакцинация в контексте «нано»;
- Самособирающиеся пептидные нановолокна в борьбе с туберкулезом;
- William J. McAleer, Eugene B. Buynak, Robert Z. Maigetter, D. Eugene Wampler, William J. Miller, Maurice R. Hilleman. (1984). Human hepatitis B vaccine from recombinant yeast. Nature. 307, 178-180;
- TN Athmaram, Shweta Saraswat, SR Santhosh, Anil Singh, VVS Suryanarayana, et. al.. (2011). Yeast expressed recombinant Hemagglutinin protein of Novel H1N1 elicits neutralising antibodies in rabbits and mice. Virology Journal. 8, 524;
- Suzanne M. Garland, Jennifer S. Smith. (2010). Human Papillomavirus Vaccines. Drugs. 70, 1079-1098;
- M. Lucrecia Alvarez, Heidi L. Pinyerd, Jason D. Crisantes, M. Manuela Rigano, Julia Pinkhasov, et. al.. (2006). Plant-made subunit vaccine against pneumonic and bubonic plague is orally immunogenic in mice. Vaccine. 24, 2477-2490;
- Это чума;
- Смертельный поцелуй чумы;
- Болезнь, не думавшая сдаваться;
- Béatris Mastelic, Sohail Ahmed, William M. Egan, Giuseppe Del Giudice, Hana Golding, et. al.. (2010). Mode of action of adjuvants: Implications for vaccine safety and design. Biologicals. 38, 594-601;
- Raiees Andrabi, Jinal N Bhiman, Dennis R Burton. (2018). Strategies for a multi-stage neutralizing antibody-based HIV vaccine. Current Opinion in Immunology. 53, 143-151;
- Annelies Wilder-Smith, Kirsten Vannice, Anna Durbin, Joachim Hombach, Stephen J. Thomas, et. al.. (2018). Zika vaccines and therapeutics: landscape analysis and challenges ahead. BMC Med. 16;
- Gregory Gregoriadis. (1998). . Pharmaceutical Research. 15, 661-670;
- Mansi Saxena, Sreekumar Balan, Vladimir Roudko, Nina Bhardwaj. (2018). Towards superior dendritic-cell vaccines for cancer therapy. Nat Biomed Eng. 2, 341-346;
- Six common misconceptions about immunization. (2018). WHO;
- Мир до и после изобретения вакцин.







