Жизнь после Nature: эксперимент длиной в шесть лет
20 февраля 2020
Жизнь после Nature: эксперимент длиной в шесть лет
- 1381
- 2
- 6
NK-клетка (белая), атакующая врага организма (лазурный)
-
Автор
-
Редакторы
Четыре года назад в научном журнале Nature Immunology вышла наша статья с описанием молекулярного механизма не исследованного ранее синдрома XLPDR (X-linked pigmentary reticulate disorder), и я подробно описал профессиональную кухню этого открытия на «Биомолекуле»: «ДНК-полимераза как регулятор иммунитета. История одного открытия из первых рук». Статья была хорошо воспринята, и сейчас я хочу написать, как развивалась эта тема дальше, — благо, ею занимаюсь в основном я сам, а потому все повороты сюжета происходили на моих глазах. В итоге, по прошествии шести лет мы обнаружили новый симптом синдрома XLPDR, хотя сами исследования по бестолковости напоминали охоту на единорога. Однако в результате единорог был пойман и опубликован.
Предыстория
Для тех, кому лень читать предыдущую статью на «Биомолекуле» [1], коротко напомню: мы — типичная лаборатория в американском университете, которая занимается молекулярной биологией человека. Шесть лет назад, совместно с генетиками, медиками и кучей другого народа, мы впервые расшифровали биологию Х-сцепленного ретикулярного пигментного синдрома (или XLPDR) — исключительно редкой генетической болезни, от которой страдают только мальчики [2]. На сегодняшний день мы зарегистрировали всего 30 пациентов по всему миру.
Наша предыдущая работа описала болезнь довольно поверхностно: анализ медицинских и биологических образцов показал, что большинство параметров у больных нормальны, за исключением хронического воспаления, постоянных воспалений легких и довольно специфической сухой кожи в веснушках [3]. Мы показали, что из-за мутации в гене каталитической субъединицы ДНК-полимеразы альфа POLA1 срабатывает «антивирусная сигнализация» — интерферон первого типа, — и эта хроническая «ложная тревога» приводит к нескоординированности иммунной системы в целом и постепенно истощает организм хроническими инфекциями. Наша статья была первой публикацией симптомов и молекулярной кухни XLPDR.
Что не вошло в статью
На самом деле, в предыдущей публикации [1] в разделе «Сказка о потерянном времени» я не упомянул об одном интересном спин-оффе, который собственно и лежит в основе данного рассказа. Перед тем как открыть и описать цитоплазматический гетеродуплекс РНК:ДНК, мы уже пытались (под напором коллег) опубликовать ту первую работу в несколько другом ключе... Еще тогда, шесть лет назад, мы увидели в медицинских анализах двух XLPDR-пациентов аномально низкую активность естественных киллеров (их еще называют NK-клетками, от Natural killer) — известных антивирусных и антираковых «деятелей» (см. врезку).
Повторный тест подтвердил: у обоих пациентов низкая концентрация NK-клеток в крови, а сами эти клетки — почти неактивны. При этом все остальные игроки иммунитета — и В-, и Т-клетки, и моноциты с макрофагами, и лейкоциты — работали и множились как положено. На фоне бушующего хронического интерферона такой избирательный дефект объяснить было сложно (ожидалось, что либо все клетки работают плохо, либо все они как-то адаптировались к постоянному воспалению).
Итак, мы попробовали тогда, шесть лет назад, опубликовать нашу статью в следующем виде: вот синдром; вот ген, который его вызывает и его генетика; вот иммунологический анализ крови, где зашкаливает интерферон первого типа и виден дефицит NK-клеток; и как результат, у больных появляются аутоиммунные реакции и иммунодефицит. Идея имела право на успех, однако нас подвело то, что для работы с NK-клетками мы привлекли лабораторию из другого университета, а они сделали ее из рук вон плохо! Тут следует признаться, что NK-клетки и другая мудреная клеточная иммунология — это очень далекая от нас область, со своим сленгом и неписаными стандартами. Не мудрено, что мы не разобрались в данных, предоставленных коллегой — мы как раз от него и ожидали подобной экспертизы. Нам тогда здорово попало от рецензентов — все трое обсуждали только детские промахи по части NK-биологии и всячески стыдили нас. Это был очень болезненный удар по нашему эго: мы исключили ту группу из авторов и выпилили все NK-данные из публикации. Чтобы заполнить образовавшуюся брешь, мы всё внимание обратили на гетеродуплексы РНК:ДНК, и с их помощью объяснили молекулярный механизм болезни, — в таком виде наша предыдущая статья и вышла [3]. Подробности — в материале «ДНК-полимераза как регулятор иммунитета. История одного открытия из первых рук» [1]. Но шаг в сторону NK-биологии был уже сделан, и данные по NK-дефекту отложены до лучших времен.
Лучшие времена
За последующие четыре года работы нам посчастливилось довести до конца несколько проектов. Помимо работы с врачами по выявлению и систематизации новых случаев XLPDR [5], мы пошли вглубь молекулярной и клеточной биологии синдрома, поскольку представилась уникальная возможность — синдром есть, а симптомы толком не описаны и не изучены! Конкуренции никакой, а потому всё, что мы ни найдем, — пойдет в медицинские скрижали! И вот, запустив все эти проекты, наша группа поскребла по сусекам — нет ли еще каких-нибудь запылившихся наработок, которые можно было бы пустить в ход? И наткнулась на старые записи по NK-клеткам четырехлетней (на тот момент) давности. К тому времени у нас уже был некоторый опыт, а сами данные всё так же выглядели неплохо, даже с учетом полученной ранее разгромной критики. Перспектива маленькой победоносной публикации при минимуме вливаний проглядывалась очень четко! И мой шеф и я пошли искать, кто бы нам помог довести до ума NK-эксперименты.
NK-клетки, попытка 2.0
Наши новые коллабораторы, а особенно их список публикаций, вызывали доверие. Мы предложили им выигрышный вариант — у нас уже есть история, но мы хотим повторить все эксперименты с корректными сопутствующими контролями. Дело в том, что первичный анализ литературы по NK-клеткам человека показал, что основные сведения об этом типе клеток получены на мышах, но мышиные NK-клетки далеко не всегда можно сравнивать с человеческими: например, их поверхностные маркеры и специализация часто сильно различаются. С человеческими же NK-клетками работать крайне сложно по причине их очень низкого содержания в крови и сложностей культивирования. Поэтому изучение литературы почти не принесло информации — NK-биология человека на уровне клеток и молекул до сих пор в зачаточном состоянии, а нам нужна была идея, как связать низкую цитолитическую активность и дефицит ДНК-полимеразы воедино.
Углубившись в вопрос, мы наткнулись на ряд публикаций, из которых следовало, что пациенты с дефицитом других белков — МСМ4 или GINS1 — имеют похожий дефицит NK-клеток и страдают от постоянных воспалений легких. Описываемый синдром (его называют immunodeficiency 54, поскольку уже нет смысла давать им иные имена, кроме порядковых) клинически был и вправду похож на наш XLPDR, но главное — белки МСМ4 и GINS1 являются известными партнерами POLA1 при репликации ДНК (рис. 2). Более того, цитолитические везикулы с перфорином доставляются к клетке-мишени с помощью центра организации микротрубочек (англ. microtubule-organising centre, MTOC), который тоже связан с репликацией ДНК — именно он образует веретёна деления и центриоль для разделения сестринских хроматид во время митоза. Однако как ядерные белки, связанные с репликацией, могут влиять на активность NK-клеток?
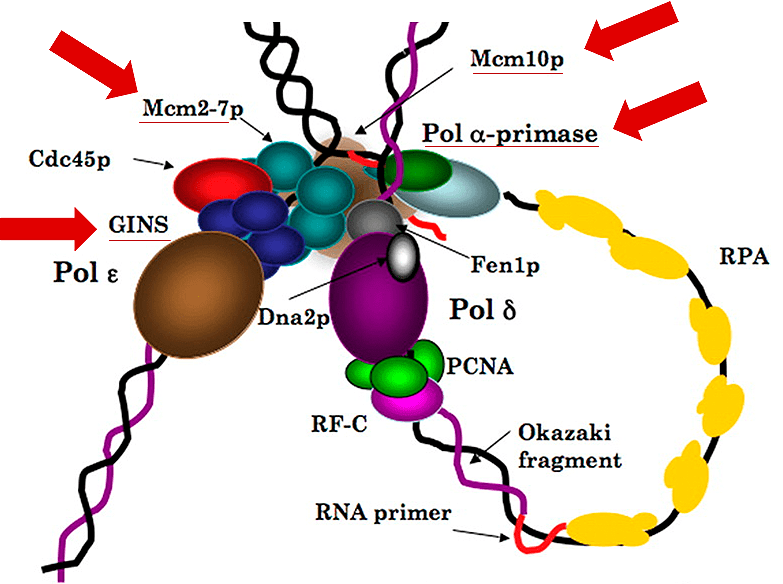
Рисунок 2. Репликация ДНК и белки репликасомы. Ферменты GINS, MCMs и Pol-alpha отмечены красными стрелками.
В наших тестах цитотоксическая активность NK-клеток всегда нарушалась при дефиците ДНК-полимеразы, причем клетки продолжали нормально размножаться, т.е. дело было не в нарушении клеточного цикла или повреждении генома! И тогда мы решили посмотреть под микроскопом, как ведут себя NK-клетки больных XLPDR в момент атаки (звучит как фантастика, но на самом деле это возможно при использовании конфокальной микроскопии [6]).
Итак, наш план был очень прост — мы:
- Получаем по 50 мл крови от каждого больного.
- Пересылаем партнерам через всю страну.
- Повторяем старые эксперименты, подкрепляя их новыми данными (микроскопией).
- Публикуем полученные данные в среднем клиническом журнале.
- Профит!
Как это всегда бывает, реальность внесла суровые коррективы. Пациенты были не в восторге от того, что с них сдоят 50 мл крови (с меньшим количеством мы б не справились, учитывая сутки на пересылку живых клеток Fedex’ом и крайне маленькое количество NK-клеток в крови). Мы заручились поддержкой пятерых из них, и то только потому, что трое посещают наш госпиталь. Довольно быстро мы собрали всех вместе, прочитали лекцию о том, чего именно хотим достичь и чем это поможет им.
Свежие результаты подтвердили наши давние находки — у всех пациентов NK-клетки были на нижней границе нормы и почти неактивны по сравнению с контролями: киллеры отказывались убивать! Кстати, каждый образец крови больного нужно было сопровождать несколькими образцами крови здоровых людей того же возраста и пола. А теперь представь, читатель, что тебе за один час надо собрать 20 людей и попросить каждого сдать 50 мл крови... В общем, к концу эксперимента люди сторонились нашей лаборатории как замка с вампирами, предлагая встретиться снова уже после публикации.
Тем не менее мы получили фантастические данные — ниже приведена одна картинка in vitro анализа активности NK-клеток пациентов (их инкубировали вместе с классической мишенью — раковыми клетками линии 721.221) (рис. 3).
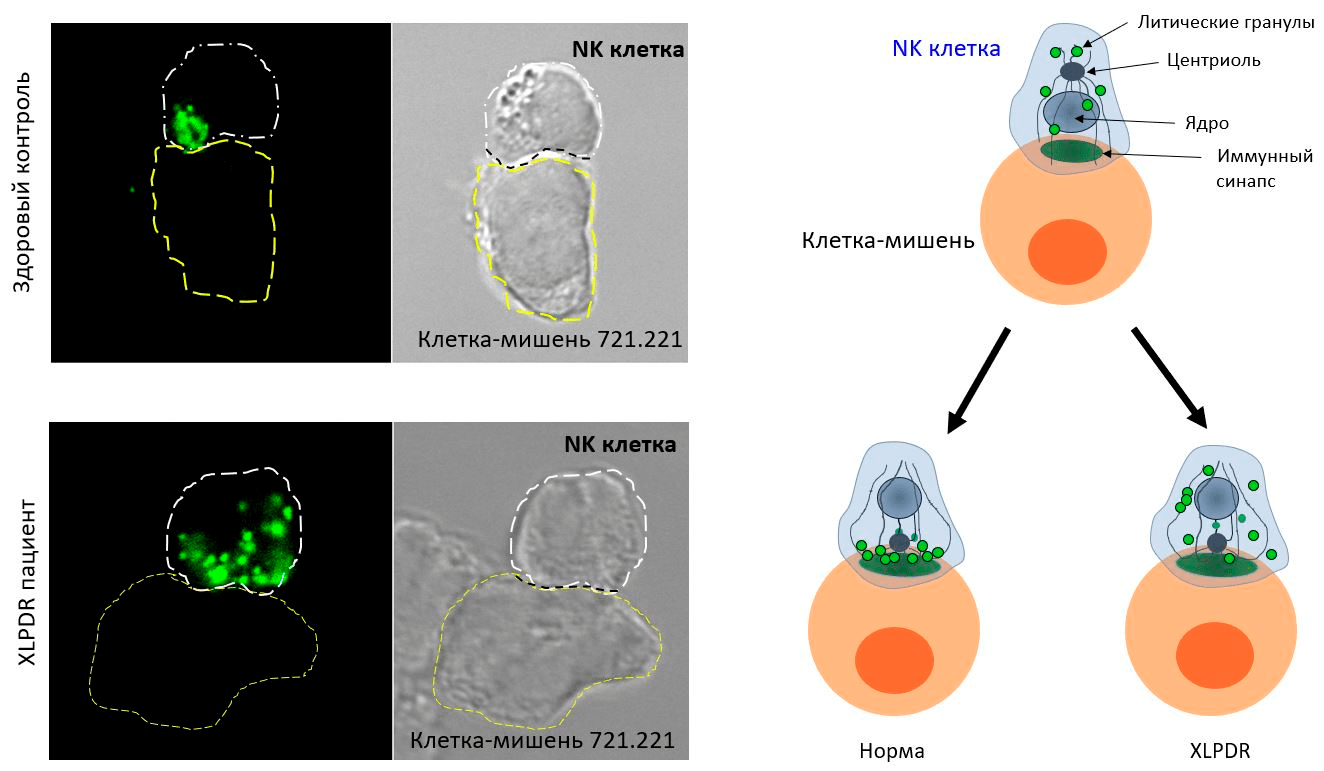
Рисунок 3. Почему NK-клетки у XLPDR-пациентов перестают убивать. Слева: по данным микроскопии, доставка литических гранул с перфорином (зеленый) у пациентов с синдромом XLPDR заметно нарушена по сравнению с контрольными образцами: в «здоровом» контроле (сверху) эти гранулы «бросаются» в атаку на раковую клетку, а в NK-клетках больных (снизу) эти гранулы лениво распределены практически по всей клетке! Стоит отметить также, что здоровые NK-клетки здесь принадлежат автору текста. Справа всё то же самое показано схематически.
Интересно, что активация вирусных инфекций — не самое страшное при XLPDR: наши прежние результаты показали, что при этом синдроме вирусы угнетаются сверхэкспрессией интерферона — основой «антивирусной системой» [1]. Главная проблема тут — бактериальное поражение легких, причем оно является типичным симптомом нарушения нормальной работы NK-клеток [7]. Полной уверенности нет, но считается, что это связано с другой функцией NK-клеток — секрецией интерферона-γ и интерлейкинов, координирующих работу иммунных клеток. А потому проблемы с секрецией гранул у NK-клеток приводят не только к тому, что киллеры отказываются убивать, но и к нарушению контроля над стерильностью тканей легких, и бактерии начинают понемногу уничтожать их.
Трезвый взгляд на вещи
Предыдущие работы на пациентах с immunodeficiency 54 объясняли иммунодефицит с точки зрения проблем деления — дескать, из-за мутаций в аппарате репликации NK-клетки не успевают размножиться, чтобы контролировать инфекцию. Однако мы-то точно знали, что дефицит POLA1 не вызывает нарушений клеточного цикла, и иммунодефицит при XLPDR вызван не столько низким числом NK-клеток, сколько их низкой цитолитической активностью! Наша лаборатория первой обратила внимание именно на секрецию гранул — и точно: дефицит ДНК-полимеразы почему-то мешает содержимому везикул секретироваться наружу (рис. 3)! Поскольку биохимия работы иммунного синапса сложна так же, как и у нейронов [8], мы заключили: мутации в ферментах репликации активируют внутриклеточную антивирусную систему, а везикулярный трафик нарушается... просто потому, что при воспалении приостанавливаются многие процессы, трансляция выключается, а всё подозрительное на всякий случай просто уничтожается. И вот в таких-то условиях филигранно настроенные клеточные системы трафика начинают сбоить, что мы и видим на рис. 3! Не претендуя на полное раскрытие механизма, мы просто систематизировали все данные и послали статью в журнал.
Однако рецензенты не оценили красоту этой идеи и попросили проверить традиционную версию: мутации репликативных белков должны в первую очередь нарушать клеточный цикл, а мы утверждаем, что при XLPDR NK-клетки делятся нормально, а значит, причина не в этом! Первая серьезная критика была — мы хотим, чтоб вы доказали несколькими методами, что NK-клетки из ваших пациентов не имеют проблем с делением! Ссылки на предыдущие анализы не принимались. Более того, рецензентов огорчило малое количество образцов (15 от 5 пациентов, плюс 30 «контролей»). Раз вы нашли пациентов, написали они нам, то сможете это сделать и еще раз на большем количестве испытуемых!
Спор с рецензентом лишен смысла — идея peer-reviewed-публикации состоит именно в том, что тебе нужно убедить в своей правоте посторонних специалистов. В виде высокого слога этот принцип, конечно, звучит красиво. Но в жизни это опять обернулось обзвоном потенциальных кандидатов, гонками с врачами за кровью, а после этого ласковое приглашение в лабораторию на чай уже расслабившихся было коллег мужского пола, среднего возраста... Для дополнительных экспериментов мы набрали образцы всё тех же пяти пациентов и удвоили нашу контрольную когорту. Новые данные ложились хорошо, и статья наливалась фактажом. Мы добавили дополнительный рисунок, суммирующий результаты трех независимых методов — все данные подтверждали, что при дефиците ДНК-полимеразы NK-клетки продолжают делиться наравне с нормальными, признаков нарушений хромосомной ДНК или клеточного цикла у них нет. Доработанная статья снова отправилась в редакцию. Пациенты между тем перестали отвечать на звонки.
А у меня еще столько идей!
Два рецензента приняли все наши дополнения и самоликвидировались. Но вот третий никак не отставал — он всё хотел разобраться в новом механизме более глубоко. Его понять можно — ведь наша модель XLPDR впервые продемонстрировала, что ДНК-реплицирующие ферменты контролируют выброс везикул. Но как!? Мы понимали его научный интерес, однако твердо знали: в третий раз за полгода пациентов нам не собрать. Мы намекали, что виной всему интерферон, который путает клетку, — однако эта часть работы сейчас только готовится к публикации, поэтому выходило неубедительно. Рецензент не сдавался — его третий отзыв принес очередные эксперименты. В целом это было оправдано, но рецензент упорно не понимал нашей проблемы с числом больных. Плюс — теперь замечания пошли вглубь темы, предлагая нам полностью раскопать механизм, используя всё новые и новые методики... Я недоверчиво поднял телефонную трубку — двое из пациентов не ответили, третий сослался на отпуск.
Мы сделали то, что оставалось — написали нежное письмо редактору, где поблагодарили за профессиональную работу рецензентов и отметили, насколько работа стала лучше! Настолько лучше, что любой профессиональный журнал, наверное, возьмет ее к публикации, поскольку требования уважаемого рецензента в вашем уважаемом издании мы исполнить уже не в силах.
Надо сказать, что изначально, осознавая малое число пациентов, мы и не целились в слишком заоблачные журналы, остановившись на недавно созданном JCI Insight, ожидая менее требовательных рецензентов. Однако теперь, после двух раундов доработок, статья легко подошла бы и другим, более престижным журналам!.. Редактор оказался очень милым человеком, быстро понял, что из пяти человек особо много крови не слить, а критика третьего рецензента уже явно вышла за рамки необходимого. И он согласился прекратить наши страдания. По-моему, рецензент, фонтанирующий идеями, редактору был уже знаком, а наша работа в принципе созрела, и новые рекомендации не особенно ее бы уже улучшили.
Послесловие
Ура, работа закончена! Принимай, мир, новую модель: NK cell defects in XLPDR!
После публикации [9] с нами связались врачи из Швейцарии: они написали про своего XLPDR-больного и что проверили у него параметры NK-клеток, прочитав нашу статью. Их данные полностью сошлись с нашими — в крови больного было совсем мало NK-клеток, а те, что были — оказались практически неактивными! Наши данные независимо подтвердились буквально месяц спустя после публикации.
Суммируя четыре года, прошедшие с нашей первой статьи, хочется отметить:
- Приятно полностью охарактеризовать механизм болезни. По нашей версии, аутовоспалительные процессы при XLPDR происходят из-за разбалансировки интерферона типа 1, что роднит XLPDR с ревматоидным семейством заболеваний [10]. Проблемы с легкими поялвяются из-за низкой активности NK-клеток, дефицита POLA1 и нарушения выброса цитолитиков и гормонов, что приводит к хроническому воспалению.
- Механизм секреции завязан на ферменты, участвующие в репликации ДНК и разводе сестринских копий хромосом к полюсам клетки. Оказывается, «грузовая система» (митотическое веретено с кинетохорами) активно эксплуатируется не только при делении клетки, но и в G0-фазе! Эту систему используют NK-клетки для быстрого и точного перемещения гранул с цитолитиками. Каким же образом в этом участвуют ДНК-полимераза POLA1, хеликазные белки MCM и GINS и прочие чисто ядерные белки — загадка, еще ждущая своего естествоиспытателя.
Постскриптум
В прошлом рассказе я упоминал некую цитоплазматическую РНК:ДНК как молекулярную основу аутовоспаления. Работа над расшифровкой этой новой молекулы заняла фактически весь период времени, однако эти результаты настолько интересные, что заслуживают отдельного описания. Я напишу о ней отдельно, после официальной публикации. Stay tuned!
Литература
- ДНК-полимераза как регулятор иммунитета. История одного открытия из первых рук;
- Strickland A. (2016). Living in shadows: A child's rare disorder. CNN health;
- Petro Starokadomskyy, Terry Gemelli, Jonathan J Rios, Chao Xing, Richard C Wang, et. al.. (2016). DNA polymerase-α regulates the activation of type I interferons through cytosolic RNA:DNA synthesis. Nat Immunol. 17, 495-504;
- Иммунитет: борьба с чужими и… своими;
- Hilde Van Esch, Rita Colnaghi, Kathleen Freson, Petro Starokadomskyy, Andreas Zankl, et. al.. (2019). Defective DNA Polymerase α-Primase Leads to X-Linked Intellectual Disability Associated with Severe Growth Retardation, Microcephaly, and Hypogonadism. The American Journal of Human Genetics. 104, 957-967;
- 12 методов в картинках: микроскопия;
- Mikael Ebbo, Laurence Gérard, Sabrina Carpentier, Frédéric Vély, Sophie Cypowyj, et. al.. (2016). Low Circulating Natural Killer Cell Counts are Associated With Severe Disease in Patients With Common Variable Immunodeficiency. EBioMedicine. 6, 222-230;
- Как происходит выделение нейромедиатора;
- Petro Starokadomskyy, Katelynn M. Wilton, Konrad Krzewski, Adam Lopez, Luis Sifuentes-Dominguez, et. al.. (2019). NK cell defects in X-linked pigmentary reticulate disorder. JCI Insight. 4;
- Ревматоидный артрит: изменить состав суставов.