
ДНК-полимераза как регулятор иммунитета. История одного открытия из первых рук
28 марта 2016
ДНК-полимераза как регулятор иммунитета. История одного открытия из первых рук
- 3525
- 5
- 7
Зеленый шарик — это хорошо!
-
Автор
-
Редакторы
Недавно мне повезло участвовать в международном исследовании, результаты которого попали на страницы Nature Immunology. Мы смогли открыть новую мутацию, приводящую к очень редкому иммунологическому синдрому; мы умудрились разобраться в молекулярной основе этого синдрома, а также открыли новый тип биологических молекул, регулирующих внутриклеточный иммунитет. Это был незабываемый опыт, которым я хочу поделиться по свежей памяти с широкой аудиторией.
Предыстория
В далеком 2006 году, в Киеве, я торжественно вставил в рамку диплом кандидата биологических наук и стал думать, как жить дальше. Вариантов на тот момент было немного — мне очень хотелось заняться иммунологией, а эта область науки требует дорогостоящего оборудования и квалифицированных коллег. Поэтому на тот момент найти хорошую лабораторию я смог только за рубежом. Кстати, в то же время я присоединился к недавно созданному молодому сайту — Биомолекула.ру (если не ошибаюсь, моя учетная запись идет под номером 35).
Итак, я получил приглашение поработать пост-доком в Вайцманновском институте (Израиль), и всё завертелось. Мне повезло: в Израиле я попал в именитую лабораторию и смог освоить самые современные методы, постепенно получив неплохую специализацию в области молекулярной иммунологии клетки. И после трех лет в земле обетованной я попал в США, где получил второй пост-док в одно из отделений Техасского университета (UT Southwestern Medical Center). Мне опять повезло: университет занимается медицинскими исследованиями, в то же время являясь действующей больницей. Это позволило постепенно объединить мои иммунологические исследования с проблемами конкретных пациентов. И хотя я сам не медик и не имею допуска к пациентам, я работаю в составе большой команды специалистов, включающей медиков, генетиков, биоинформатиков и др. Мои обязанности — исследовать молекулярными методами материалы, полученные от пациентов: как правило, это клетки крови или культуры фибробластов кожи. Ниже описан один из таких проектов, который неожиданно для всех нас перерос в нечто гораздо большее.
XLPDR — синдром, про который ничего неизвестно
Как-то раз к нам за консультацией обратились генетики. Они уже давно бились над идентификацией гена, вызывающего очень редкий синдром, названия которому даже нет по-русски, — X-linked reticulate pigmentary disorder (XLPDR). На сегодня известно только около десятка семей во всем мире, в которых отмечены случаи этого заболевания. Болеют только мальчики (болезнь классически сцеплена с Х-хромосомой), ну а девочки являются носителями без каких-либо особо заметных проявлений болезни. Синдром характеризируется пятнистой (похоже на яркие веснушки) и сухой кожей по всему телу (у большинства пациентов хронический ангидроз — с рождения нет потовых желез) и очень специфическим лицом с направленными назад волосами (рис. 1). Однако самое неприятное — помимо фенотипических признаков, у этих пациентов постоянные воспалительные процессы в легких, почках и желудочно-кишечном тракте. Ничего о природе и механизмах этой редкой болезни на момент начала работы не было известно.
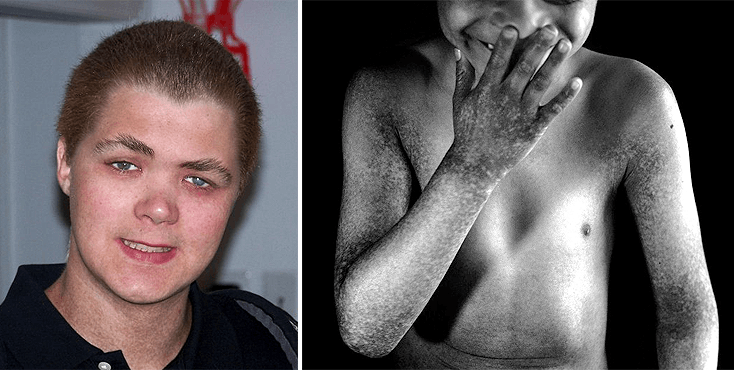
Рисунок 1. Пациенты с синдромом XLPDR.
сайты edition.cnn.com и www.xlpdr.com
...Итак, генетики обратились к нам с просьбой изучить молекулярный механизм синдрома XLPDR. Традиционный быстрый сиквенс генома (сиквенс последовательностей только экзонов, exome sequencing) результатов не приносил, и найти мутацию относительно дешевыми методами генетикам не удавалось. Поэтому нас попросили взглянуть на проблему c точки зрения молекулярной иммунологии — мы как раз тогда только-только опубликовали похожего типа статью, где описали молекулярные изменения во внутриклеточных сигнальных путях у больных с другим редким синдромом — XLID (наследственное слабоумие, тоже сцепленное с Х-хромосомой и тоже проявляющееся только у мальчиков) [1]. То есть мы к тому времени уже имели опыт иммунологических исследований реальных больных «с нуля». Кроме того, как раз двое больных с XLPDR наблюдались в нашей больнице. В общем, мы охотно ввязались в новый проект.
Надежда на быстрый успех
Поначалу дело спорилось: все клеточные линии, полученные от пациентов (фибробласты кожи и клетки крови), показывали на порядки более высокую экспрессию всей палитры иммунологических маркеров-генов. И NF-kB, и интерферон-зависимые гены экспрессировались через край без видимой на то причины. Было похоже, что у больных утратил свои функции некий важный ген-регулятор, и клеткам постоянно чудилось вторжение коварных вирусов, даже когда они росли в стерильных условиях инкубатора. Задокументировав все артефакты, мы стали дожидаться, когда генетики выяснят имя гена, который бы содержал мутацию у всех больных.
Ждать пришлось недолго — поскольку синдром редкий, и геномная ДНК всех известных пациентов была у нас на руках, генетики провели полное секвенирование геномов (whole genome sequencing) всех больных ребят (как уже было сказано, синдром поражает только мальчиков). И внезапно оказалось, что все больные имеют одинаковую точечную замену (SNP) в тринадцатом интроне гена POLA1 — каталитической субъединицы ДНК-полимеразы альфа . Эта полимераза известна всем биологам с университета как фермент, синтезирующий фрагменты Оказаки во время репликации генома. Найденная мутация в интроне гена POLA1 приводит к миссплайсингу пре-мРНК и провоцирует сдвиг рамки считывания (рис. 2). В результате во время трансляции рибосомы налетают на внезапный стоп-кодон, трансляция останавливается, и весь комплекс деградирует. В итоге клетки пациентов содержат очень мало правильной мРНК (только 10–20% от нормы) и, соответственно, очень мало самой полимеразы. Это странно, потому что нехватка полимеразы должна бы быть смертельной (как позже выяснилось, люди выживают только с этой мутацией, а другие мутации в этом же гене, скорее всего, летальны). Однако, на удивление, больные не имели особых дефектов роста или развития, и потому мы просто приняли этот факт во внимание и приступили к дальнейшим поискам — впереди нас ждало еще много неожиданностей.
О нормальной — то есть довольно халатной — работе этого фермента и механизмах закрепления его ошибок в геноме очень доходчиво рассказывает статья «Следы полимеразы α» [2]. — Ред.
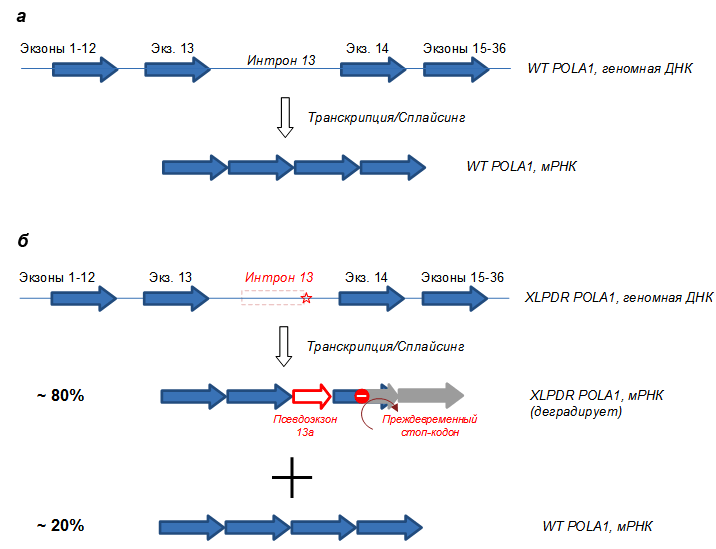
Рисунок 2. Схема гена POLA1 и мРНК у здоровых людей (а) и у больных XLPDR (б). В результате точечной замены в интроне 13 (звездочка) образуется ложный альтернативный сайт сплайсинга, и бόльшая часть пре-мРНК образует нежизнеспособную мРНК, которая быстро деградирует. Меньшая часть мРНК всё же собирается правильно, что обеспечивает выживание клеток (репликацию), однако этого количества POLA1 не хватает для выполнения альтернативных функций (см. дальше).
Первая загадка
Первая гипотеза — что больные болеют из-за неспособности лимфоцитов при инфекции быстро размножаться и подавлять инфекцию — была опровергнута простым анализом крови. Мы обнаружили, что мутация не влияет на количество иммунных клеток в крови больных, и значит, делятся они нормально. Стало быть, нарушение метаболизма происходит внутри самих клеток, и это каким-то неведомым образом провоцирует иммунный ответ.
И правда — исследовав клетки пациентов, мы нашли, что дефицит полимеразы почему-то приводит к хронической активации многих сигнальных путей. Кроме того, если с помощью специфической киРНК (siRNA) [3] снизить количество POLA1 в нормальных клетках, у них тоже начинается воспаление. Все данные указывали на то, что полимераза POLA1 каким-то образом удерживает клетки от постоянного воспалительного ответа, то есть служит негативным регулятором иммунитета. Оставалось только понять, как такое может быть.
Молекулярная рутина
Дальше пошли бесконечные эксперименты с использованием всего оборудования, до которого мы могли дотянуться. С помощью микроскопии мы обнаружили, что значительная часть белка POLA1 находится в цитоплазме, что для ДНК-зависимой ДНК-полимеразы, опять же, довольно необычно. Тогда мы (вполне оправданно) стали искать точки соприкосновения POLA1 с другими известными цитоплазматическими регуляторами иммунного ответа. В клетках существует целый ряд иммунных сенсоров и сигнальных путей, и большинство этих белков при активации взаимодействует друг с другом напрямую. Мы даже разработали специальный метод, упрощающий поиск таких взаимодействий [4]. Однако в случае с POLA1 ничего не сработало — полимераза напрямую не входила в состав ни одного известного сигнального пути.
Следующим маневром была попытка определить, какой именно сигнальный путь регулируется полимеразой POLA1. С помощью киРНК мы снижали концентрацию POLA1 в культурах различных нормальных клеток до уровня больных (это называется нокдаун гена) и после этого проверяли, насколько клетки становились чувствительными к тому или иному иммунному стимулу. Надо сказать, клетки человека виртуозно могут распознавать всякую заразу с помощью не одного десятка различных рецепторов, и это существенно осложняет работу. Потому мы последовательно обрабатывали клетки всеми мыслимыми лигандами для толл-подобных рецепторов (TLR; рецепторы заражения, которых у человека с десяток, и каждый «чувствует» присутствие определенного типа бактерий или грибов).
Подборка статей об этих молекулах: «Толл-подобные рецепторы: от революционной идеи Чарльза Джейнуэя до Нобелевской премии 2011 года» [5], «Иммунологическая Нобелевская премия (2011)» [6], «Найти CpG-мотив, или Тонкая работа толл-подобного рецептора 9» [7]. — Ред.
Также мы стимулировали клетки интерлейкином-1 и TNF (универсальными воспалительными факторами, из-за которых у человека повышается температура и наступает болезненная усталость), а также имитировали вирусное заражение (что активирует внутриклеточные ДНК- и РНК-сенсоры, например, RIG-I, MAVS, STING). Логично было предположить, что если определенный сигнальный путь связан с POLA1, клетка с искусственным нокдауном POLA1 должна становиться гиперчувствительной только к определенному лиганду, а действие остальных стимулов не должно особо отличаться от контроля. Однако нас снова ожидал сюрприз: при нокдауне POLA1 большинство клеток приобретало гиперчувствительность ко всем стимулам сразу. Получалось чёрт-те что: никто из нас не слышал о существовании таких глобальных регуляторов всего иммунитета, а главное — мы до сих пор так и не поняли механизм.
Тут у нас закрались серьезные подозрения — вдруг мы прозевали какой-то очевидный фактор, который вызывает такой артефакт? Чтоб исключить возможные влияния на эксперимент наших биополей, барабашек и прочих потусторонних сил, мы обратились в несколько лабораторий с просьбой повторить ключевые опыты. Но все результаты подтвердились независимо от фазы Луны и месторасположения лабораторий. Стало ясно, что мы поймали нечто большее, чем просто мутацию.
Путь во тьме
Приблизиться к раскрытию механизма нам помогла случайность. В описанных выше экспериментах с киРНК мы заметили, что нокдаун POLA1 в одной из самых популярных лабораторных линий клеток — карциномы почки, НЕК293 — не вызывал ожидаемого воспаления. На тот момент мы просто отметили это и переключились на другие линии. Однако теперь мы вспомнили, почему клетки НЕК293 — одна из самых популярных лабораторных клеточных линий: они очень легко трансфецируются любой ДНК. А это происходит в частности из-за того, что в НЕК293 из-за ряда мутаций почти полностью отсутствуют внутренние антивирусные сенсоры, которые узнают проникшие в клетку вирусные молекулы РНК и ДНК. То, что именно эта клеточная линия оказалась единственной невосприимчивой системой к перепадам количества POLA1, дало нам решающую подсказку: наблюдаемый эффект каким-то образом должен быть связан с концентрацией нуклеиновых кислот в цитоплазме и способностью клетки различать нуклеиновые кислоты в цитоплазме по принципу «свой–чужой».
Известно, что клетки очень тщательно контролируют количество нуклеиновых кислот в цитоплазме. При инфекции вирусы впрыскивают свою ДНК (или РНК) внутрь клеток, и клеточные сенсоры распознают чужеродные нуклеиновые кислоты по целому ряду особенностей. При обнаружении чужеродной ДНК/РНК активируется интерфероновая защита — основа антивирусного ответа. Этот процесс включает арест метаболизма (чтобы вирусные частицы не успели собраться), секрецию интерферонов (оповещение соседних клеток и иммунной системы о заражении) и деградацию внутри клеток всего, что выглядит подозрительным (генеральная уборка, назовем это так). И то, что мы видели у клеточных линий больных с нашим синдромом, очень напоминало именно антивирусный ответ — с одной только разницей: клетки находились в стерильных условиях и вирусами не инфицировались.
Теперь, если соединить воедино всё, что мы знали о синдроме, картина наполнялась новым смыслом:
- POLA1 синтезирует ДНК (в форме фрагментов Оказаки), при этом для синтеза использует нестандартный РНК-праймер.
- POLA1 в больших количествах находится в цитоплазме клетки.
- При дефиците POLA1 клетки ведут себя, как будто они заражены вирусами.
- Клетки, не чувствительные к дефициту POLA1 (это линия НЕК293), не имеют активных систем регистрации вирусных РНК и ДНК, а также РНК:ДНК-химер (которые образуются при обратной транскрипции многих вирусов).
В целом всё указывало на то, что POLA1 каким-то образом уменьшает количество вирусной или собственной (например, ретротранспозонной) РНК или ДНК в цитоплазме. А если POLA1 отсутствует, то «мусорные» нуклеиновые кислоты накапливаются в цитоплазме и хронически активируют антивирусные сигнальные пути, что ведет к постоянному воспалению, которое мы видим у больных.
Это всё логично, но хотелось всё-таки понять механизм работы POLA1. Она не может напрямую уничтожать мусорную ДНК (как это делает ряд ферментов — например, TREX1 [8]), потому что POLA1 — одна из немногих полимераз с неактивным экзонуклеазным доменом. Кроме того, мы должны были научиться определять количество нуклеиновых кислот в цитоплазме, поскольку существующие методы — микроскопия или проточная цитометрия с использованием специфических антител к ДНК — работали на наших моделях из рук вон плохо, ведь нас интересовала только цитоплазма, а ядро, полное нуклеиновых кислот, неизменно давало очень высокий фоновый сигнал.
Сказка о потерянном времени
Параллельно возникла еще одна проблема: ввиду «горячей» информации (ведь на тот момент самым главным, что мы открыли, была мутация в гене POLA1) и большого количества соавторов, нас постоянно торопили с публикацией того, что есть — иначе любой другой генетик мог случайно наткнуться на интересную мутацию и опубликовать статью, тем самым нивелировав ценность наших изысканий.
Мы начали ощущать неслабое давление — мол, давайте не гнаться за топовыми журналами, опубликуем что есть в средненьком генетическом издании, а позже спокойно найдем механизм и опубликуем еще раз, тоже в хорошем молекулярном журнале. Нам (мне и моему руководителю) пришлось проявить недюжинные политические качества, убеждая коллабораторов в том, что мы почти закончили и что волноваться не стоит, и еще у нас есть парабеллум... Однако настроения это не поднимало — мы действительно не знали, с какой стороны подойти к механизму, а время всё утекало. Каждый новый вариант проверки требовал двух-трех месяцев напряженной работы, и у нас оставалось максимум две-три попытки до того момента, как коллабораторы потеряют последнее терпение.
Зеленый свет
Пасьянс сложился как-то вдруг. У нас уже был под рукой полный набор антител к нуклеиновым кислотам: к двух- и одноцепочечной ДНК, а также к РНК:ДНК-гибридным молекулам. Антитела работали неплохо, но мы не могли придумать нормального метода регистрации. И вдруг нас осенило: если цитоплазматическую фракцию клеток отделить от ядер (это легко), то тогда с помощью антител можно очистить именно цитоплазматические ДНК или ДНК:РНК. А если антитела прикрепить к сефарозным шарикам (Protein-G agarose beads — реактив, который традиционно используют в лабораториях для аффинной хроматографии), то эти шарики можно просто окрасить специфическим красителем для нуклеиновых кислот (с изобретением qPCR таких красителей продается много, и мы выбрали PicoGreen, потому что он зеленый и красивый), а потом сравнить уровни свечения под обычным микроскопом с ультрафиолетовой лампой.
Значит, если в цитоплазме много молекул ДНК или РНК:ДНК, шарики будут светиться ярко-зеленым, а если мало — то бледно-зеленым. Быстро обкатав методику, мы начали сравнивать цитоплазму в различных здоровых клетках и в клетках наших пациентов с синдромом XLRPD.
Первый же эксперимент поразил нас: у здоровых клеток в цитоплазме оказалось очень-очень много цитоплазматической РНК:ДНК. В цитоплазме же клеток наших больных РНК:ДНК-молекул не было практически совсем (рис. 3)! Ровно противоположный результат тому, что мы ожидали. Однако нас уже было не остановить.
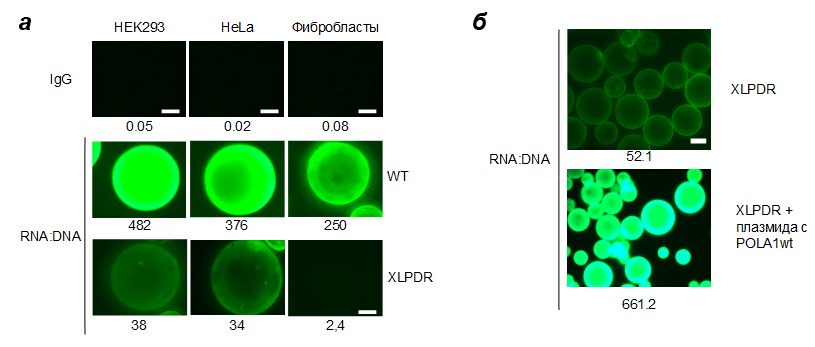
Рисунок 3. Типичный результат анализа цитоплазматической РНК:ДНК в различных моделях клеток. а — Индивидуальные зерна сорбента с иммобилизированными РНК:ДНК-антителами (RNA:DNA) или неспецифическими контрольными антителами (IgG). Сравниваются три типа клеток — HEK293 и HeLa с POLA1-нокдауном, а также фибробласты здоровых людей и пациентов с XLPDR. Числа под картинками — относительная флуоресценция. б — Зерна сорбента при меньшем увеличении показывают сравнительное количество РНК:ДНК в цитоплазме пациентов с XLPDR и в тех же клетках после добавления в геном здоровой копии гена POLA1. Числа — относительная флуоресценция: как видно, разница более чем десятикратная.
Убедившись, что главное различие между здоровой клеткой и клеткой с дефицитом POLA1 — это загадочная РНК:ДНК в цитоплазме, мы в который раз с запозданием хлопнули себя по лбу. Ведь что гласит университетский курс по молекулярной биологии: фрагмент Оказаки — основной продукт POLA1 — представляет собой небольшую РНК-затравку, к которой полимераза добавляет ДНК-нуклеотиды. Получается, что POLA1 в свободное от репликации время синтезирует подобные РНК:ДНК-комплексы в цитоплазме.
Мы попробовали очистить эти цитоплазматические химеры и трансфецировать их в клетки больных синдромом XLPDR. Действительно, после этого воспаление на время пропадало. А значит, POLA1 постоянно синтезирует некие иммунологически инертные РНК:ДНК-комплексы (размером около 100 пар нуклеотидов), которые служат неким «белым шумом», не давая цитоплазматическим сенсорам перевозбуждаться из-за незначительных утечек нуклеиновых кислот, например, из ядра или при повреждении митохондрий. И только когда концентрация подозрительной ДНК превышает уровень шума, вся антивирусная система и запускается. По всему выходило, что задача POLA1 — постоянно производить «нуклеиновый шум», чтобы не допускать ложного срабатывания интерферонового ответа.
Публикация, в натуре
Мы сделали это! Обычно в сказках и в подростковых фильмах на этом месте начинаются титры, и герои уходят в даль, на закат. Увы, в реальности так элегантно не получается.

Во-первых, большинство было настроено скептически относительно публикации в топовом журнале — конкуренция там огромная, и любая даже очень хорошая статья может застрять на этапе рецензии на многие месяцы. Во-вторых, написать и оформить статью под подачу в каждый журнал занимает около месяца. А писать, естественно, приходилось нам самим — несмотря на обилие соавторов, реальную помощь оказывали единицы.
Мы начали по старшинству: август 2015 года — Science. Ответ через две недели — нет. Сентябрь 2015 — переписанная статья пошла в Nature. Ответ через полторы недели — нет. Октябрь 2015 — Nature Immunology, статья снова переписана и рисунки переделаны. И вдруг нам улыбнулась удача — ответ редактора пришел почти сразу: «Мне нравится, но давайте посмотрим, что скажут рецензенты». Через неделю все три рецензента ответили одинаково — будем брать. А дальше события развивались фантастически быстро: ответить на основные замечания у нас заняло всего месяц — почти все комментарии были по делу, и бόльшая часть материала у нас уже была на руках (мы его не включали в статью по причине экономии места, ведь объем текста и рисунков жестко регламентирован). Переделанная версия была отправлена на суд рецензентов, и позитивный ответ мы получили уже на следующий день. После трех лет работы над проектом это была поистине королевская награда [9]!
По-вашему, это финал?
Конечно, наша идея про РНК:ДНК-дуплексы в роли «нуклеинового шума» пока что только рабочая гипотеза. Мы до сих пор не смогли определить последовательность нуклеотидов в этих дуплексах, поэтому не представляем их источника и мишеней внутри клеток. Идея про «нуклеиновый шум» хоть и элегантна, но тоже еще не доказана. И в целом, вопросов на данный момент больше, чем ответов. Но одним из результатов этой работы всё-таки уже можно гордиться: мы теперь можем генотипировать сестер больных ребят — чтобы определить, являются ли они носителями мутации или могут не опасаться иметь детей в будущем. И мы наконец смогли рассказать десяти больным, почему они больны и что с ними не так, и теперь можем подсказать их лечащим врачам, в какую сторону следует корректировать их метаболизм. Потому что это ужасно — знать, что у тебя редкая болезнь, о которой известно одно лишь название. Да и то — до сих пор не переведенное на русский.
Литература
- Petro Starokadomskyy, Nathan Gluck, Haiying Li, Baozhi Chen, Mathew Wallis, et. al.. (2013). CCDC22 deficiency in humans blunts activation of proinflammatory NF-κB signaling. J. Clin. Invest.. 123, 2244-2256;
- Следы полимеразы alpha;
- Обо всех РНК на свете, больших и малых;
- Starokadomskyy P. and Burstein E. (2014). Bimolecular affinity purification — a variation of TAP with multiple applications. Methods Mol. Biol. 1177, 193–209;
- Толл-подобные рецепторы: от революционной идеи Чарльза Джейнуэя до Нобелевской премии 2011 года;
- Иммунологическая Нобелевская премия (2011);
- Найти CpG-мотив, или Тонкая работа толл-подобного рецептора 9;
- Daniel B. Stetson, Joan S. Ko, Thierry Heidmann, Ruslan Medzhitov. (2008). Trex1 Prevents Cell-Intrinsic Initiation of Autoimmunity. Cell. 134, 587-598;
- Petro Starokadomskyy, Terry Gemelli, Jonathan J Rios, Chao Xing, Richard C Wang, et. al.. (2016). DNA polymerase-α regulates the activation of type I interferons through cytosolic RNA:DNA synthesis. Nat Immunol. 17, 495-504.





