Малая РНК большого значения
24 февраля 2016
Малая РНК большого значения
- 1573
- 0
- 4
Малая некодирующая РНК сальмонелл влияет не только на экспрессию бактериальных генов, но и на экспрессию генов клетки хозяйского организма.
[1], рисунок адаптирован
-
Автор
-
Редакторы
Параллельный анализ молекул РНК, которые синтезируются сальмонеллами и клетками человека во время инфекции, показал, как бактериальная малая РНК изменяет транскрипционные профили не только клеток сальмонеллы, но и клеток человека.
Что происходит, когда бактерия сталкивается с клетками хозяйского организма? А когда проникает внутрь? За счет чего бактерия выживает в новой для нее среде? Как клетки хозяина защищаются от патогенов? Чтобы ответить на все эти вопросы, необходимо понять, как изменяется транскрипция генов во взаимодействующих клетках. За последние годы было разработано множество подходов: от анализа экспрессии генов in vivo до секвенирования полного транскриптома бактерий и хозяйских клеток. Однако все они фокусировались на матричных РНК одного из объектов (бактерии или клетки-хозяина), но не обоих сразу [1].
Полногеномное секвенирование РНК (RNA-seq) — это очень чувствительный метод глобального анализа экспрессии генов, использующийся в инфекционной биологии. Однако в изучении внутриклеточных бактериальных инфекций есть свои трудности: в процессе участвуют два разных организма с совершенно разными наборами РНК. Обычно эти организмы физически разделяют, а затем секвенируют транскриптомы каждого из них. Причем ограничиваются лишь матричными РНК, поскольку именно они дают информацию о производимых в клетке белках, и пренебрегают РНК, считывающимися с некодирующих регионов [2].
Бактерии синтезируют множество некодирующих малых РНК (small RNA, sRNA) [7], роль которых в патогенезе всё еще остается малопонятной — ведь такие РНК не находят своего отражения в фенотипе вирулентности. Эти малые РНК оказывают посттранскрипционное влияние на экспрессию генов у многих организмов. Исключением не является и Salmonella enterica серовар Typhimurium, у которой транскрибируются сотни малых регуляторных РНК. Многие из них активны лишь в условиях стресса или при инфицировании. Однако делеция генов таких РНК приводит к незначительному изменению фенотипа — возможно, потому, что малые РНК отвечают за точную настройку процессов экспрессии, а не за сами процессы. Чтобы узнать функции малых РНК во время инфекции, необходимы высокочувствительные методы исследования.
Группа ученых из нескольких институтов Германии предложила новый метод изучения РНК клеток человека и их внутренних паразитов — бактерий [2]. Исследователи решили провести одновременный анализ РНК патогена и хозяйской клетки — двойное секвенирование РНК (dual RNA-seq). Причем не стали ограничиваться лишь матричными РНК, а изучили и малые регуляторные РНК бактерий.
Эксперимент с человеческими клетками, инфицированными сальмонеллой
А. Вестерманн и коллеги использовали Salmonella Typhimurium и клетки линии HeLa, в которых бактерия может длительно размножаться [2]. Идентификацию клеток HeLa с сальмонеллами внутри проводили по зеленому флуоресцентному белку (GFP), синтезируемому бактериями. Методом флуоресцентно-активированного отбора (Fluorescence Activated Cell Sorting, FACS) изучали клетки на 4-м часу после инфицирования (в среднем там находили 10 бактерий) и по прошествии 24 часов (75 бактерий). В качестве контроля использовали неинфицированные клетки (рис. 1). Из образцов выделяли тотальную РНК и на аппаратуре Illumina проводили двойное секвенирование кодирующих и некодирующих молекул.
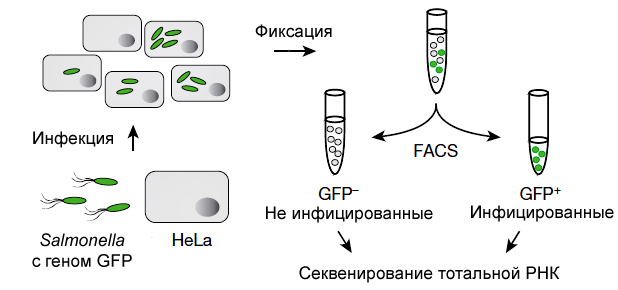
Рисунок 1. Схема двойного секвенирования РНК (dual RNA-seq).
[2], рисунок адаптирован
Малые РНК внутриклеточных сальмонелл
Чтобы повысить информативность двойного секвенирования, исследователи проанализировали малые РНК бактерий в образцах, взятых не только через 4 и 24 часа, но и через 2, 8 и 16 часов после инфицирования. Таким образом были идентифицированы 145 известных и 189 новых малых РНК сальмонеллы. Синтез некоторых из них возрастал более чем в 10 раз уже на второй час после инвазии.
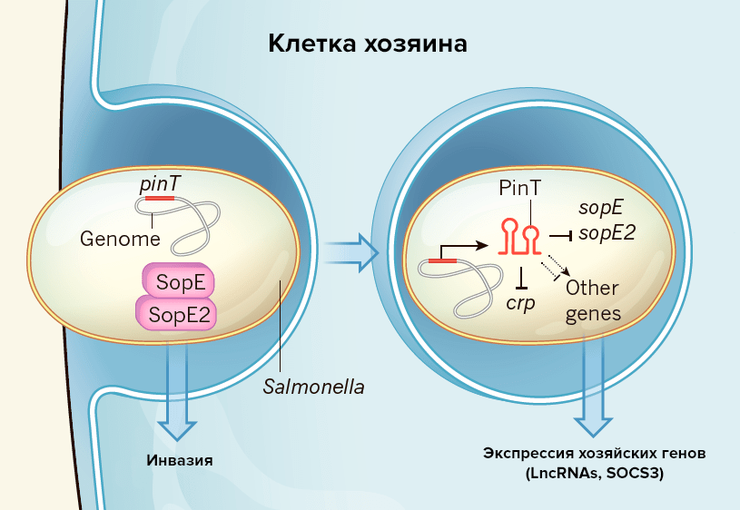
Функция малых РНК состоит в том, что, соединяясь с целевыми матричными РНК, они модулируют их стабильность и экспрессию. Исследователи обнаружили наиболее активную 80-нуклеотидную малую РНК, чья транскрипция возрастала более чем в 100 раз во время инфекции, и назвали ее PinT. Ген этой РНК приобретен сальмонеллами горизонтально и активируется бактериальной сигнальной системой PhoP/PhoQ.
Анализ показал, что PinT снижает уровень транскрипции генов sopE и sopE2 из региона SPI-1 — генов эффекторных белков, которые участвуют в процессе инвазии (рис. 2). Также эта малая РНК регулирует экспрессию РНК белка CRP (рецептора цАМФ), который участвует в активации генов внутриклеточной выживаемости бактерий. Блокируя РНК CRP, PinT модулирует активность второго острова патогенности — SPI-2.
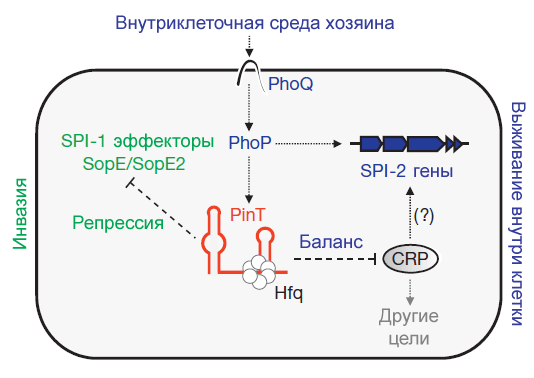
Рисунок 2. Схема регуляции экспрессии генов вирулентности малой РНК PinT. Стрелками с острыми концами показано положительное влияние, стрелками с тупыми концами — негативное влияние.
[2], рисунок адаптирован
Полученная информация позволяет утверждать, что PinT регулирует переход сальмонеллы из фазы вирулентности в фазу внутриклеточного выживания, оказывая влияние на гены островов SPI-1 и SPI-2.
Влияние PinT на реакцию хозяйской клетки
С помощью одновременного секвенирования РНК бактерии и клетки-хозяина удалось выяснить, как малые РНК сальмонеллы влияют на процессы внутри клеток HeLa. В эксперименте использовали Salmonella Typhimurium дикого типа и с делецией pinT.
Оказалось, что в отсутствие PinT наблюдается повышенная активность регуляторного белка SOCS3, который ингибирует фосфорилирование транскрипционного фактора STAT3, запрещая его активацию и транспортировку в ядро клетки (рис. 3). SOCS3 — белок воспалительного сигнального пути, играющий важную роль в течении инфекции: небольшое воспаление понижает способность сальмонеллы конкурировать с кишечной микробиотой, а слишком сильное — приводит к уничтожению бактериальных клеток хозяином [1]. Роль PinT в данном случае — поддерживать оптимальное для развития бактерий количество SOCS3 в человеческой клетке.
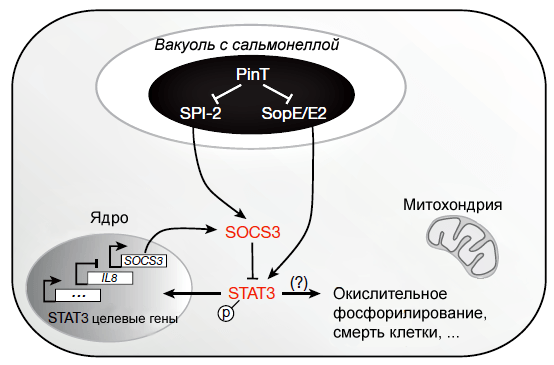
Рисунок 3. Схема влияния PinT-зависимых бактериальных эффекторов на биохимические процессы в хозяйской клетке. Стрелками с острыми концами показано положительное влияние, стрелками с тупыми концами — негативное влияние.
[2], рисунок адаптирован
Кроме того, делеция PinT повышала выработку интерлейкина 8 (IL-8) — провоспалительного хемокина.
То есть посредством влияния на эффекторные белки SopE и SopE2 PinT регулирует синтез интерлейкина 8, а контролируя некоторые гены острова SPI-2, оказывает влияние на активность SOCS3 [12], [13].
Вместе с тем метод dual RNA-seq показал связанный с инфекцией синтез длинной некодирующей РНК (long noncoding RNAs, lncRNAs). Определенные днРНК очень быстро отвечают на PinT-зависимые изменения в клетке, а потому могут использоваться при диагностике сальмонеллёза как чувствительные маркеры ранних стадий инфекции.
Сальмонелла также устойчиво влияет на митохондрии клетки-хозяина: бактериальный штамм без PinT вызывал гиперактивацию синтеза РНК митохондрий, включая гены пути окислительного фосфорилирования, а также изменял внутриклеточную локализацию самих митохондрий.
В дальнейшем метод высокопроизводительного двойного секвенирования РНК поможет понять многие скрытые взаимосвязанные процессы в болезнетворных бактериях и хозяйских клетках при инфицировании не только сальмонеллой, но и другими микроорганизмами.
Литература
- Machner M.P. and Storz G. (2016). Small RNA with a large impact. Nature. 529, 472–473;
- Westermann A.J., Förstner K.U., Amman F., Barquist L., Chao Y., Schulte L.N. et al. (2016). Dual RNA-seq unveils noncoding RNA functions in host-pathogen interactions. Nature. 529, 496–501;
- Wang Z., Gerstein M., Snyder M. (2009). RNA-Seq: a revolutionary tool for transcriptomics. Nat. Rev. Genet. 10, 57–63;
- Секвенирование единичных клеток (версия — Metazoa);
- Новый метод CETCh-seq может за одну метку поймать много результатов;
- 454-секвенирование (высокопроизводительное пиросеквенирование ДНК);
- Обо всех РНК на свете, больших и малых;
- Сальмонелла энтерика (Salmonella enterica). Сайт «Гастроскан»;
- Сальмонеллёз: патогенез. База знаний по биологии человека;
- Экзосома — механизм координации и взаимопомощи клеток организма;
- Choi J., Shin D., Ryu S. (2007). Implication of quorum sensing in Salmonella enterica serovar Typhimurium virulence: the luxS gene is necessary for expression of genes in pathogenicity island 1. Infect. Immun. 75, 4885–4890;
- Bruno V.M., Hannemann S., Lara-Tejero M., Flavell R.A., Kleinstein S.H., Galán J.E. (2009). Salmonella Typhimurium type III secretion effectors stimulate innate immune responses in cultured epithelial cells. PLoS Pathog. 5, e1000538;
- Uchiya K. and Nikai T. (2005). Salmonella pathogenicity island 2-dependent expression of suppressor of cytokine signaling 3 in macrophages. Infect. Immun. 73, 5587–5594.