Универсальная вакцина от гриппа — мечты и реальность
16 декабря 2011
Универсальная вакцина от гриппа — мечты и реальность
- 3037
- 0
- 3
Делать прививку каждый год — это так неудобно
-
Автор
-
Редакторы
Грипп ложится на человечество ежегодным тяжким бременем, и его сезонные эпидемии заставляют нас с неприятной регулярностью брать больничные. Такая систематичность вызвана высокой изменчивостью вирусных серотипов, которые очень быстро мутируют и вследствие этого год за годом проскакивают мимо кордонов иммунитета неузнанными. Почему это так, и будет ли возможно в обозримом будущем остановить сезонные вспышки гриппа с помощью универсальной вакцины — об этом и пойдет речь в статье, оригинал которой был опубликован в недавнем выпуске Nature Outlook.
Грипп
Специальная серия статей «Биомолекулы», посвященных различным аспектам проблемы гриппа. Источник — сборник Influenza Outlook, опубликованный в декабре 2011 г. журналом Nature.
Вирус гриппа является одной из основных причин заболеваний в зимний период в нашей стране и во многих других государствах. И поскольку простого и дешевого метода лечения гриппа на сегодняшний день нет (даже мощный «Тамифлю» начинает сдавать свои позиции [2]), единственный способ уберечься — это ежегодная вакцинация (почему это стоит делать, мы детально рассмотрели в статье, посвященной вакцинам и вакцинации [3] ). Однако этот способ тоже далек от оптимального, — хотя бы из-за сложностей, связанных с разработкой и производством вакцин в срок и организацией самого процесса вакцинации. Но другого выхода пока нет. Пока — это потому, что работы над созданием универсальной вакцины, способной обезвреживать любые серотипы вирусов гриппа, ведутся сразу по нескольким направлениям.
Смотрите также наш спецпроект «Вакцинация». — Ред.
Вакцина на все случаи жизни
Пока в 2006–2010 годах внимание исследователей было приковано к азиатскому «птичьему» гриппу (H5N1), в 2009 г. на другом конца земного шара (в Мексике и Калифорнии) зародилась новая пандемия . Весь мир с замиранием сердца следил за появлением на мексиканских равнинах и в южных США нового штамма «свиного» вируса гриппа А, к которому у людей не существовало устойчивости. В течение всего нескольких недель вирус серотипа H1N1, аналогичный «испанке» 1918 года [4], [5] и более столетия циркулировавший у свиней, неожиданно снова обрел вирулентность для человека. Это стало неприятным сюрпризом, и, причем, весьма крупным.
«Стрела времени» основных эпидемий гриппа приведена в статье «Гонки с вирусом: эпидемиология и экология вируса гриппа» [1].
Потребовались месяцы на то, чтобы разработать вакцину от H1N1 — слишком долго, чтобы предупредить пандемию, пик которой пришелся на март 2009 г. с последующим рецидивом в ноябре. «Нам повезло, что вирус был не таким уж агрессивным и не привел к смерти большого числа больных, — говорит вирусолог Роберт Вебстер (Robert Webster), чья лаборатория в Мемфисе (Теннесси, США) отслеживает вспышки гриппа и разрабатывает соответствующие вакцины. — Вот если бы более „смертоносный“ вирус H5N1 передавался от человека к человеку так же легко, как и свиной грипп, дела бы обстояли намного хуже!» [6].
В поиске неподвижной мишени
Вирус гриппа постоянно играет с иммунной системой человека в игру, напоминающую шахматы. Поверхность вирусной частицы несет два основных белка — нейраминидазу и гемагглютинин (см. врезку). Функции гемагглютинина — проникновение внутрь клетки-хозяина и формирование ложных «приманок» для хозяйского иммунитета. Для антител вирус выглядит как густой тропический лес, «кроны» которого, скрывающие сам вирус, — это поверхностные петли гемагглютинина, высокая изменчивость которых позволяет антигенам быстро менять пространственную структуру, вновь становясь невидимыми для иммунных барьеров в следующем сезоне.
Существующие вакцины от гриппа действуют на том же принципе, что и наша иммунная система. Вследствие этого вакцины неизбежно попадают в ту же ловушку — разработчикам приходится каждый год отслеживать антигенные детерминанты «актуальных» вирусов и в авральном порядке создавать новую вакцину. А вакцина эта, кстати, защитит людей только в данный момент — на следующий год от нее проку уже не будет, и вся ситуация повторится.
Выйти из этого порочного круга можно только, если удастся найти новые фрагменты поверхности вирусной частицы (эпитопы), в неизменном виде присутствующие во всех популяциях вируса гриппа. Такие участки есть: тот же гемагглютинин имеет довольно консервативный «ствол» (если продолжить аналогию с тропическим лесом; см. рисунок), до которого, впрочем, антителам без посторонней помощи не дотянуться.
Вспышка гриппа 2009 года придала поиску универсальной вакцины новый импульс. Дело в том, что даже у одного человека при заражении вирусом вырабатывается целый «букет» антител, каждое из которых распознает лишь отдельные части вируса. Как правило, бóльшая часть будет специфична к антигенам, которые мутируют уже на следующий год (а, значит, такие антитела не могут обеспечить устойчивый иммунитет). Однако проанализировав все варианты антител, синтезирующихся в ответ на инфекцию, можно найти те немногочисленные разновидности, которые будут распознавать не только данныйсеротип, но и другие варианты вируса гриппа. Раньше сделать такое было просто невозможно, однако самые современные высокопроизводительные технологии уже позволяют ученым буквально поштучно анализировать В-лимфоциты людей в поисках редких «пород» антител, обладающих широкой специфичностью.
Похоже, в конце туннеля забрезжил-таки свет: например, с помощью таких технологий у одного больного были выявлены антитела, способные блокировать все 16 подтипов вируса гриппа типа А (так называемые F16-антитела). Чтобы найти их, команде швейцарских иммунологов под руководством Антонио Ланцавеккья (Antonio Lanzavecchia) пришлось просканировать 104 тысячи В-лимфоцитов, полученных от восьми доноров, пока они не обнаружили нужные клоны.
F16-антитела уникальны тем, что они связываются со всеми известными разновидностями гемагглютинина, в том числе в «свином» (H1N1), «птичьем» (H1N5) и более традиционном сезонном (H3N2) вирусах гриппа. Теоретически, F16-антитела оптимальны для получения универсальной вакцины от гриппа, — это своеобразный Святой Грааль иммунологов. Однако применить их на практике не так-то просто.
«Мы впервые обнаружили антитела, способные нейтрализовать все без исключения подвиды гриппа А, — говорит Рино Раппуоли (Rino Rappuoli), глава вакцинологических исследований швейцарской фармацевтической фирмы Novartis. — Но мы пока не знаем в точности, как это можно использовать на практике» [6].
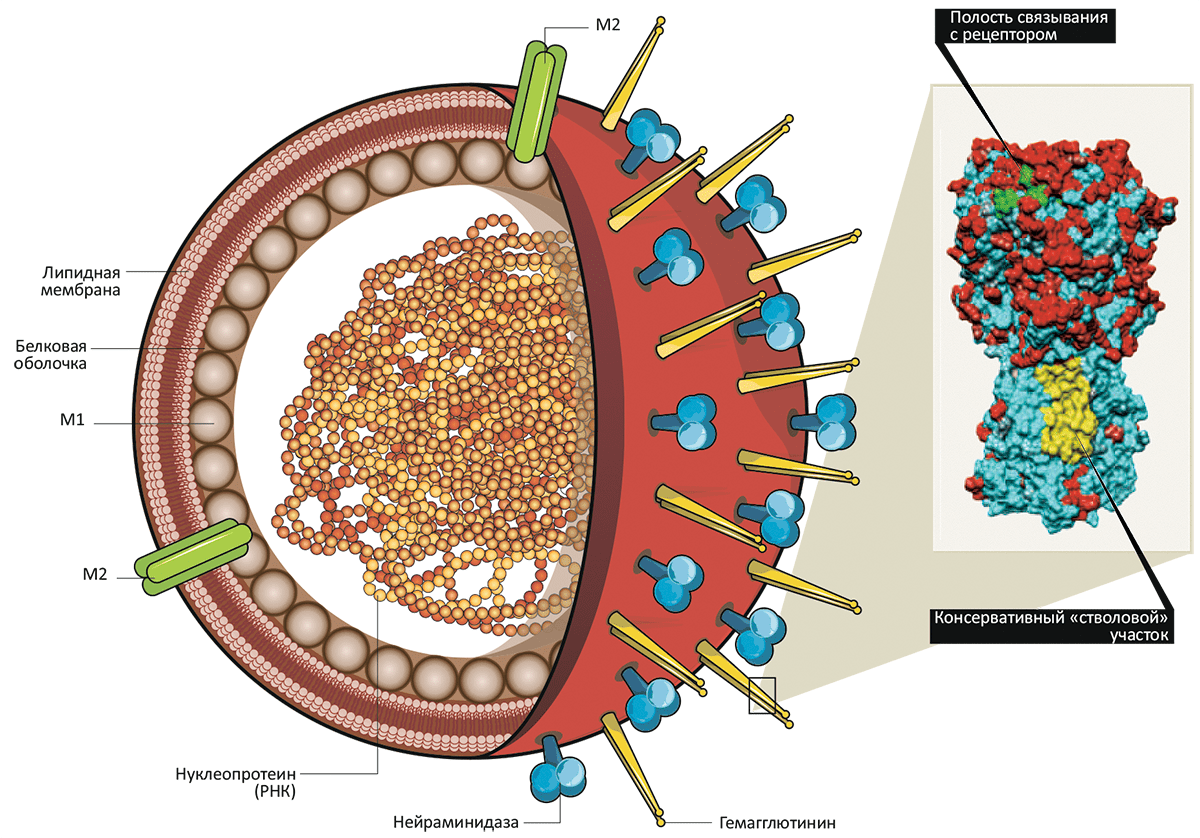
Рисунок 1. Схема строения вируса гриппа и его основные иммунные детерминанты. В структуре гемагглютинина, являющегося одним из основных антигенов вируса гриппа, есть два сравнительно консервативных (а, следовательно, перспективных в смысле создания вакцин) участка. Это «ствол», в норме укрытый «кроной» и недоступный для антител, и недавно открытый «карман» (полость связывания с сиалогликорецепторами), который, как считали ранее, чересчур маленький, чтобы его могли распознавать антитела. Диаметр вириона гриппа — 80–120 нм.
Зри в корень
Существует два способа использования таких «универсальных» антител:
- Пассивная иммунизация для лечения серьезно больных пациентов, которые не отвечают на лечение антивирусными препаратами. В этом случае «готовые» антитела вводят в кровь в качестве иммунологической сыворотки.
- Создание превентивных вакцин «для всех».
Второй вариант намного сложнее — ведь тут нужно не просто выявить антитело, по воле случая образовавшееся у какого-то пациента и способное распознавать вирус, но заставить организм любого провакцинированного синтезировать это антитело. Поэтому исследователи предпочитают сначала закончить с первым вариантом — то есть, научиться спасать тяжелобольных с помощью «готовых» F16-антител.
«Эти антитела эффективны, обладают широким действием и они человеческие — а значит, проблем при инъекциях человеку возникнуть не должно. Поэтому наша самая реальная и близкая цель — использовать их в терапии», — говорит Ланцавеккья [6].
Гэри Нейбл (Gary Nabel), директор центра исследования вакцин в Бетесде (Мэриленд, США), согласен с преждевременностью утверждения, что универсальные антитела наподобие F16 реально использовать как «шаблон» для универсальной вакцины. «„Создание универсальной вакцины“ — это только звучит просто, однако на деле это займет очень много времени», — говорит он [6]. Главная сложность заключается в том, чтобы вызвать специфический, но довольно редкий физиологический ответ организма. Даже если в качестве антигена вводить в организм специально изолированный консервативный «ствол» гемагглютинина (см. рисунок), организм ответит выработкой широкого спектра антител, подавляющая часть которых будет не способна распознать живой вирус, у которого этот участок глубоко спрятан.
Пока что стимулировать выработку универсальных антител к «стволу» гемагглютинина очень сложно, однако вовсе не невозможно. Нейбл со своей командой впервые использовали технику «паровоза» (в оригинале: prime—boost) для достижения этой цели. Смысл ее заключается в последовательном вводе двух вакцин, что позволяет выработать иммунитет к гораздо более широкому спектру штаммов вируса гриппа — включая H5N1, H5N2 и H9N2. Первой (в качестве «локомотива») идет ДНК-вакцина, кодирующая гемагглютинин птичьего гриппа. Потом (через 24 недели) вводится вторая вакцина («прицеп»), состоящая из целого, но инактивированного вируса H5N1. Такой способ позволил значительно усилить иммунный ответ против птичьего вируса гриппа, а, кроме того, у троих испытуемых были обнаружены высокие титры антител широкого спектра действия против «ствола» гемагглютинина! Этот успех является одной из первых удачных попыток научить организм вырабатывать антитела широкого профиля, — и, возможно, такой принцип ляжет в основу создания вакцин от гриппа следующего поколения.
А вот мыши из лаборатории Питера Палеза (Peter Palese) в Нью-Йорке уже защищены от различных вирусов гриппа с помощью другой экспериментальной вакцины. Он показал, что два варианта укороченного гемагглютинина (у одного из которых отсутствуют «петли» верхушки, а у другого их укладка специфическим образом нарушена) работают в качестве вакцины лучше, чем «оригинальный» гемагглютинин. Однако и этот вариант не совершенен: это вакцина только от вирусов H3, малоэффективная против штаммов H1. Кроме того, мыши — это все-таки не люди.
Исследователи по всему миру работают, не покладая рук. В 2008 году группа ученых из датской компании Crucell нашла свой вариант универсальных человеческих антител против вируса гриппа, используя новейшие высокопроизводительные технологии скрининга лимфоцитов.
Обычно иммунная система не реагирует на «стволовую» часть гемагглютинина, до которой сложно добраться, а вместо этого бурно вырабатывает антитела к поверхностным детерминантам, которые «поймать» намного проще. Однако, как уже было сказано, их высокая изменчивость позволяет вирусу раз за разом возвращаться незамеченным. Антитела широкого спектра действия вырабатываются значительно реже, но зато они могут распознавать консервативные участки гемагглютинина — в частности, тот самый «ствол». Ученые из Crucell пробуют воссоздать эти консервативные участки в различных комбинациях и презентировать их иммунной системе с целью «набрести» на редкие, но универсальные антитела. Здесь особенно важно подобрать правильный участок, иначе выработается всего лишь еще одна группа штамм-специфических антител.
Дыра в кармане
Выясняется, что кроме консервативной «стволовой» области гемагглютинина существуют и другие антигены, на которые стоит обратить внимание. Недавно была найдена еще одна область гемагглютинина, перспективная в плане создания универсальной вакцины, — тоже консервативная, но отнюдь не настолько замаскированная, как «ствол» (рис. 1). На верхушке «кроны» белка находится «карман», при помощи которого гемагглютинин «узнает» сиалогликорецепторы на поверхности клеток «хозяина», — собственно, с этого распознавания и начинается инфекционный процесс. С незначительными вариациями эта полость одинакова у всех 16 разновидностей белка. Однако глубина кармана очень невелика (значительно меньше, чем размер молекулы антитела) — поэтому никто и не ожидал, что он может послужить мишенью для создания вакцин.
Антитела CH65, обнаруженные исследователями из университета Дьюка (Северная Каролина, США) в процессе изучения того, как иммунная система реагирует на вакцинацию, оказались немного более эффективными против разных вирусов, чем большинство других. Структурный биолог Стефан Харрисон (Stephan Harrison) с медицинского факультета Гарварда, проанализировав структуру CH65, к своему удивлению обнаружил, что антитело связывается с рецепторным «карманом» гемагглютинина. По его словам, почти половина аминокислотных остатков гемагглютинина, контактирующих с антителом, располагается внутри кармана. Особенно важно то, что аминокислотные мутации вокруг кармана не сильно меняли эффективность связывания антител. Исследования показали, что антитела CH65 блокируют 30 из 36 исследованных штаммов вирусов H1.
В другой плоскости
Пока одни исследователи заняты картированием консервативных областей гемагглютинина, прочие исследуют другие мишени для вакцин, актуальные уже в течение многих лет. В частности, это ионный канал M2, матричный белок 1 (M1) и рибонуклеопротеин, который стабилизирует РНК-геном вируса. «Эти белки остаются стабильными в течение всех 20 лет исследований, — говорит Раппуоли. — И хотя они могли бы стать удачной мишенью для универсальной вакцины, большого прогресса в этом направлении до сих пор нет» [6].
Многие компании ищут идеальную мишень на поверхности частицы вируса гриппа. VaxInnate — биотехнологическая фирма из Кренбери (Нью-Джерси, США) — создала гибридный белок, состоящий из четырех копий M2e (поверхностного фрагмента ионного канала M2) и бактериального белка флаггелина. По их данным, созданная вакцина Vax102 безопасна и вызывает развитие иммунитета против всех разновидностей вируса гриппа А.
Другая компания того же профиля — Dyna Vax, расположенная в Беркли (Калифорния, США), — создала аналогичную рекомбинантную вакцину (получившую название N895), состоящую из M2e и рибонуклеопротеина. Теоретически предсказанное действие вакцины — запустить атаку антител на вирусный белок M2, а Т-клеток — на нуклеокапсид.
Биотехнологическая фирма Acambis (Кембридж, Великобритания) проводит испытания собственной вакцины на основе белка M2, показав ее хорошую переносимость и эффективность против вирусов гриппа типа А. Исследование на хорьках (их гортань чрезвычайно напоминает человеческую) показало выработку иммунитета против птичьего гриппа у 70% животных. Купившая Acambis французская компания Sanofi Pasteur собирается продолжать испытания, однако, по словам ее представителей, белок M2 сам по себе вряд ли будет лучшей вакциной, чем уже существующие, и поэтому требуются дополнительные активные факторы, поиск которых сейчас и ведется.
Зайти с двух сторон
Другое направление в создании универсальной вакцины — это не поиск универсальных антител, а попытки «натравить» на вирус Т-лимфоциты. Антитела предотвращают заражение клетки вирусом, блокируя вирусные детерминанты, а Т-клетки противостоят вирусной инфекции, убивая уже зараженные клетки и не давая вирусу размножаться.
Это направление было предложено вакцинологом Сарой Гилберт (Sarah Gilbert) из Института Дженнера (Оксфорд, Великобритания). Гилберт использует ослабленный поксвирус MVA, который презентирует нуклеопротеин и белок M1 иммунной системе. В эксперименте наблюдался мощный Т-клеточный ответ, что привело к полному выздоровлению всех подопытных животных. Такой «индуцированный» Т-клеточный иммунитет мог бы послужить дополнительной линией защиты от гриппа в комбинации с вакциной, основанной на консервативных участках гемагглютинина.
Комбинируя такую вакцину с вакцинами традиционными, направленными на выработку антител В-клетками, можно значительно повысить сопротивляемость организма, особенно у пожилых людей, которым часто недостаточно обычной сезонной вакцины. Эта деталь подчеркивает, что даже изобретение «универсальной» вакцины от гриппа не станет панацеей для пожилых людей, чей иммунитет ослаблен. Таким образом, единственная универсальная вакцина от гриппа вряд ли будет действенной абсолютно для всех пациентов. «Весь вопрос в том, что понимать под универсальностью вакцины. Должна ли она защищать от всех пандемичных и сезонных штаммов вируса? Но это почти не возможно. Однако это все равно стоящая цель для того, чтобы стремиться к ней», — говорит Раппуоли [6].
Написано по материалам Nature Outlook Influenza [6].