
50 оттенков ДНК: генная инженерия пениса
02 декабря 2015
50 оттенков ДНК: генная инженерия пениса
- 5206
- 0
- 2
Правильная шкала мужских размеров по версии Рэнди из «Южного парка» (South Park).
Рисунок в полном размере.
рисунок с сайта i0.wp.com
-
Автор
-
Редактор
Статья на конкурс «био/мол/текст»: Вы никогда не задумывались о том (и вообще, были ли в курсе?), почему у курообразных птиц маленький член, а у гусеобразных — большой? Признавайтесь! Нет? А вот некоторые ученые задумывались и даже нашли ответ на этот вопрос. А еще они задумывались о куда более прагматичных вещах: можно ли улучшить регенерацию пениса млекопитающего, замедлить его старение и сохранить эрекцию или изменить размеры с помощью молекул ДНК и кодируемых ими белков. Сегодня мы поговорим о том, что на этот счет может сказать современная молекулярная генетика.
Конкурс «Био/Мол/Текст»-2015
Эта работа опубликована в номинации «Лучшая обзорная статья» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
В фильме «Идиократия» ученые вместо того, чтобы попробовать сделать человека умнее, направили свои усилия на увеличение объема женской груди и размера мужского полового члена, а также разработку средств восстановления утраченных функций этого важнейшего органа. Ученых можно понять: на подобные разработки всегда был и будет коммерческий спрос, но именно поэтому они не смогли спасти падающее в бездну глупости и невежества человечество, не думающее ни о чем, кроме размножения. Увы, судя по некоторым новостям реального мира, наше падение ко дну не остановить даже режиссеру Джеймсу Камерону. Поэтому, как говорит поговорка: если не можешь победить — присоединяйся!
Начнем с общего вопроса: можно ли изменить генетический материал взрослого человека с какой-либо целью? Изменить ДНК каждой его клетки не получится (нужно было редактировать ДНК сперматозоида, яйцеклетки или эмбриона, из которых получился человек), однако это и не нужно. Если кто-то страдает гемофилией — наследственным заболеванием, при котором плохо сворачивается кровь, — вам незачем исправлять ДНК в клетках его глаз, кожных покровов или нервной системы. Нужно исправлять исключительно клетки печени — именно там производится большинство факторов свертывания крови, а значит, именно там работают кодирующие их гены [1]. В рамках современной генной терапии мы можем направить обезвреженный вирус, несущий исправленные или дополнительные копии какого-нибудь гена, именно в клетки печени или какой-нибудь другой ткани. Остается только разобраться в том, какой ген и где нужно включить или выключить, чтобы избавить человека от того или иного заболевания, ну а если вернуться к теме статьи — что-нибудь ему увеличить.
Вообще-то, технологии редактирования генома в живой клетке взрослого организма уже есть: об этом все говорят уже несколько лет: «CRISPR-системы: иммунизация прокариот» [2]. Однако штука в том, что в организме, должно быть, около триллиона клеток, и исправить все их — вряд ли возможная задача. Хотя и тут не без луча света: распространение изменений в геноме же можно сделать самоподдерживающимся: «Мутагенная цепная реакция: редактирование геномов на грани фантастики» [3]... Хотя тут уже и до расы мутантных черепашек-ниндзя недалеко. — Ред.
Использованию генной инженерии для изменения гениталий животных уже десяток лет. В 2004 году вышла статья в American Journal of Pathology, авторы которой хотели всего лишь увеличить плотность волосяного покрова мышей. Сделать это им удалось, усилив активность гена, регулирующего работу BMP-белков — факторов роста, играющих важную роль в формировании костей, хрящей и некоторых других тканей [4].
Полученные генетически модифицированные мыши имели множество аномалий: уменьшенную прорезь глаз, утолщения кожи, превращение сальных желез, открывающихся на краях век, в волосяные фолликулы, и некоторые изменения конечностей. Но один результат был прямо удивительным: у мышей увеличились размеры гениталий. Судя по приведенным в статье фотографиям, длина полового члена мышей-мутантов (рис. 1) увеличилась примерно вдвое. Стоит отметить, что мыши были фертильны!

Рисунок 1. Увеличение размера пениса трансгенных мышей. На рисунке б показан генетически модифицированный орган (ГМО).
Думаю, что основная часть мужского населения планеты пока еще не готова ради большого размера пениса покрыться волосами в неожиданных местах, но ценность данного исследования не в самом открытии сомнительного метода увеличения размеров полового члена (тем более, что этот метод не поможет взрослым мужчинам). Данное исследование — еще один кирпичик «пазла», проливающего свет на механизмы формирования тканей и органов, в том числе и пениса.
Авторы работы предполагают, что данная генетическая модификация могла повлиять на концентрацию одного из факторов роста — BMP4, активного на кончике растущего пениса. Если это так, то направленно изменив работу гена, кодирующего этот фактор роста исключительно в нужной нам ткани, а не во всем организме, нам удастся «и вишенку съесть, и косточкой не подавиться». То есть, избежать упомянутых побочных эффектов и получить только рост полового члена.
Впрочем, пока не известно, удастся ли это сделать на взрослых организмах. Пока что эффективное применение на грызунах нашел другой фактора роста, который, как оказалось, улучшает регенерацию нервов пениса при их повреждении [5]. Да-да, именно такие медицинские технологии обрекают нашу цивилизацию на путь Идиократии: повредил пенис, случайно поместив его в кофемолку или блендер, а тебе все вылечили! Можешь продолжать плодить и воспитывать идиотов. (На самом деле, это важная технология, способная помочь людям, пережившим хирургическую операцию по удалению части простаты, например, в случае рака.)
Что касается гена BMP4, то именно он оказался разгадкой столь животрепещущего вопроса о значительных отличиях между размерами пенисов у разных групп птиц. В 2013 году в журнале Current Biology появилась статья, раскрывающая эту тайну природы [6]. Оказалось, что у курообразных есть все гены, необходимые для развития нормального, полноценного и длинного пениса. У них даже появляется вполне развитый зачаток данного органа, однако из-за чрезмерной работы гена BMP4 во время развития, клетки этого неготового пениса решают покончить жизнь самоубийством (это называется апоптоз), что приводит к уменьшению размеров органа. Если подавить работу BMP4, можно защитить клетки пениса от такой печальности участи и сохранить его размеры. Аналогично у гусеобразных можно добиться уменьшения размера пениса, активировав BMP4. Без ответа остается вопрос о том, хотят ли петухи, чтобы им увеличивали пенисы? Может, у них совсем другие ценности?
Ну а теперь мы подходим к самому интересному. В 2015 году Швейцарские ученые сконструировали и перенесли в эректильную ткань крыс ген, кодирующий белок, активность которого зависит от уровня освещенности. У таких крыс возникает эрекция, если на их половые органы направить синий свет [7] . Только представьте потенциал такого подхода к лечению импотенции!
«Не встает? Просто посвети фонариком! Подари подруге лампочку в знак серьезности ваших отношений!»
Специально разработанный швейцарскими учеными вариант светочувствительного белка, названный «эректильный оптогенетический стимулятор» или EROS, запускал в клетках эректильной ткани крыс определенные каскады химических превращений, что в конечном итоге приводило к эрекции. Прелесть подхода в том, что эту технологию в будущем можно перенести на взрослых людей, если они не побоятся такой своеобразной просветленной «Виагры». Стоит отметить, что в отличие от классических белков, используемых в оптогенетике , EROS — это не канал, а фермент, обнаруженный в бактериях. Его светочувствительность была улучшена в лаборатории с помощью мутагенеза.
Оптогенетика начиналась с каналродопсина — белка, пропускавшего в клетку катионы под влиянием света: «Светлая голова» [8], «Оптогенетика + голография = прозрение?» [9]. Однако недавно найден и анионный канал — так что арсенал постепенно растет: «Обнаружены управляемые светом анионные каналы» [10]. — Ред.
Классические светочувствительные каналы исходно были обнаружены у водорослей. В ответ на попадание света каналы открываются, пропуская в клетку положительно-заряженные ионы натрия. Если перенести ген такого канала в нервную клетку, то в ответ на воздействие света она активируется, порождая нервный импульс. Подобный оптогенетический подход позволил японскому ученому Сусуме Тонегаве и его коллегам редактировать память грызунов [11], вселяя в них страх перед комнатой, в которой с ними ничего плохого не происходило, но это отдельная история.
Недостатком оптогенетического подхода при работе с крупным половым членом (а ведь даже маленький человеческий член крупнее, чем член грызуна) будет то, что сложно просветить его целиком, насквозь! Поэтому, возможно, EROS для людей придется доработать, перейдя от оптогенетики к термогенетике [12]. Аналогично существованию белков, активируемых светом, есть белки, которые активируются при нагревании. Если гены таких белков встроить в нервные клетки организма, то нервной функцией можно управлять, изменяя температуру. Так с помощью термогенетики удалось повлиять на поведение (в том числе и половое) мушек дрозофил [13]. Теоретически, можно настроить термогенетическое управление эрекцией. Принять горячий душ перед сексом и без того неплохая идея, но так пользы будет вдвое больше!
К слову, есть еще один перспективный подход уже не к лечению, а профилактике возрастной эректильной дисфункции, основанный на генной терапии. В ряде случаев это заболевание связано с увеличением количества активных форм кислорода, повреждающих клетки и нарушающих работу кровеносных сосудов и гладкой мускулатуры в эректильной ткани пениса. В 2003 году ученые добились замедления старения полового члена у крыс, которым с помощью специально сконструированного вируса ввели ген фермента, нейтрализующего активные формы кислорода [14].
В том же году удалось улучшить эректильную функцию крыс, активируя физиологический механизм, благодаря которому и действует та самая «Виагра». Только на этот раз с помощью генной терапии [15]. Перенесенный в ткани пениса ген кодировал NO-синтазу — фермент, отвечающий за производство оксида азота. Оксид азота активирует фермент гуанилат-циклазу, который производит циклический ГМФ. Повышение концентрации циклического ГМФ в клетках гладкой мускулатуры приводит к их расслаблению, расширению сосудов, эрекции. Есть несколько способов увеличить количество циклического ГМФ в клетках. «Виагра» защищает циклический ГМФ от разрушения, а NO-синтаза увеличивает синтез ГМФ. NO-синтаза и так работает в тканях нормального пениса, но дополнительные копии соответствующего гена увеличивают концентрацию фермента. Преимущество генной терапии перед лекарством заключается в том, что у последнего есть масса побочных эффектов, связанных с его воздействием на другие ткани и органы человека. Генная терапия может действовать локально, ровно в тех тканях, куда мы сделали инъекцию. К тому же терапевтический эффект будет долгосрочным.
Результаты первого испытания генной терапии от эректильной дисфункции, проведенного на людях, были опубликованы в 2006 году [16]. С помощью инъекции пациентам вводили в ткани пещеристого тела пениса плазмиду (кольцевую молекулу ДНК), несущую ген калиевого канала. Активация подобных каналов тоже способствует расслаблению гладкой мускулатуры, что увеличивает приток крови к пенису, вызывая эрекцию. В исследовании было показано, что никаких негативных эффектов от такой генной модификации клеток пениса не наблюдается, а сама плазмида не попадает в семенную жидкость, т.е. безопасна для потомства. У пациентов, получивших наибольшую дозу плазмиды, наблюдалось улучшение их состояния, однако надо понимать, что это хоть и обнадеживающие, но предварительные результаты.
Конечно, есть еще масса нерешенных загадок устройства пениса, но, как видите, наука не стоит на месте [17], отвечая в том числе и на социальные запросы. В будущем мы научимся печатать половые органы на биологических 3D принтерах [18], создавать пенисы идеального размера, формы и чувствительности. Быть может даже двойные, для особо пикантных ситуаций. Я думаю, что это еще один повод поддержать развитие генной инженерии как для мужчин, так и для женщин. Никто, конечно, не признает этот повод важным или актуальным, но статистика запросов в Google говорит сама за себя (рис. 2). Ее не обманешь!
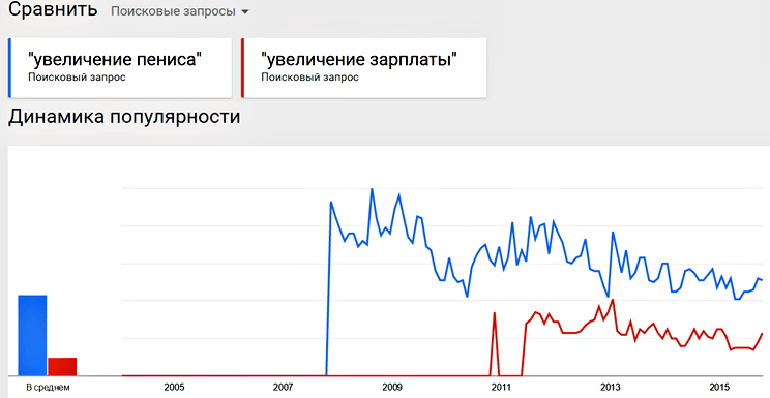
Рисунок 2. Динамика популярности запросов «увеличение пениса» и «увеличение зарплаты» по данным Google Trends.
Есть и серьезный научный подход к определению оптимального размера пениса. Так, в 2015 году в журнале PLoS ONE вышла статья, авторы которой предлагали 75 женщинам выбирать между пластиковыми фаллосами разного размера, напечатанными на 3D принтере. Оказалось, что женщины предпочитали фаллосы со средней длиной около 16 см и периметром около 12 см [19]. В еще одном исследовании было показано, что женщины, предпочитающие более крупные пенисы, чаще испытывают вагинальный оргазм [20].
Ну а для мужчин, недовольных своими размерами, ученые из South Park предложили альтернативное решение проблемы маленьких пенисов (рис. 3).
Рисунок 3. Оригинальное решение проблем мужской агрессии, предложенное в одной из серий «Южного парка».
Литература
- Mark S. Sands. (2012). AAV-Mediated Liver-Directed Gene Therapy. Methods in Molecular Biology. 141-157;
- CRISPR-системы: иммунизация прокариот;
- Мутагенная цепная реакция: редактирование геномов на грани фантастики;
- Maksim Plikus, Wen Pin Wang, Jian Liu, Xia Wang, Ting-Xin Jiang, Cheng-Ming Chuong. (2004). Morpho-Regulation of Ectodermal Organs. The American Journal of Pathology. 164, 1099-1114;
- Thomas M. Fandel, Anthony J. Bella, Guiting Lin, Kavirach Tantiwongse, Ching-Shwun Lin, et. al.. (2008). Intracavernous Growth Differentiation Factor-5 Therapy Enhances the Recovery of Erectile Function in a Rat Model of Cavernous Nerve Injury. The Journal of Sexual Medicine. 5, 1866-1875;
- Ana M. Herrera, Simone G. Shuster, Claire L. Perriton, Martin J. Cohn. (2013). Developmental Basis of Phallus Reduction during Bird Evolution. Current Biology. 23, 1065-1074;
- Taeuk Kim, Marc Folcher, Marie Doaud‐El Baba, Martin Fussenegger. (2015). A Synthetic Erectile Optogenetic Stimulator Enabling Blue‐Light‐Inducible Penile Erection. Angew Chem Int Ed. 54, 5933-5938;
- Светлая голова;
- Оптогенетика + голография = прозрение?;
- Обнаружены управляемые светом анионные каналы;
- Steve Ramirez, Xu Liu, Pei-Ann Lin, Junghyup Suh, Michele Pignatelli, et. al.. (2013). Creating a False Memory in the Hippocampus. Science. 341, 387-391;
- Jacob G Bernstein, Paul A Garrity, Edward S Boyden. (2012). Optogenetics and thermogenetics: technologies for controlling the activity of targeted cells within intact neural circuits. Current Opinion in Neurobiology. 22, 61-71;
- Atefeh Pooryasin, André Fiala. (2015). Identified Serotonin-Releasing Neurons Induce Behavioral Quiescence and Suppress Mating inDrosophila. J. Neurosci.. 35, 12792-12812;
- Trinity J. Bivalacqua, Jeffrey S. Armstrong, John Biggerstaff, Asim B. Abdel-Mageed, Philip J. Kadowitz, et. al.. (2003). Gene transfer of extracellular SOD to the penis reduces O 2 − · and improves erectile function in aged rats. American Journal of Physiology-Heart and Circulatory Physiology. 284, H1408-H1421;
- TRINITY J. BIVALACQUA, MUSTAFA F. USTA, HUNTER C. CHAMPION, DAVE ADAMS, DENNIS B. McNAMARA, et. al.. (2003). Gene Transfer of Endothelial Nitric Oxide Synthase Partially Restores Nitric Oxide Synthesis and Erectile Function in Streptozotocin Diabetic Rats. Journal of Urology. 169, 1911-1917;
- Arnold Melman, Natan Bar-Chama, Andrew McCullough, Kelvin Davies, George Christ. (2006). hMaxi-K Gene Transfer in Males with Erectile Dysfunction: Results of the First Human Trial. Human Gene Therapy. 17, 1165-1176;
- Ahmed Harraz, Alan W. Shindel, Tom F. Lue. (2010). Emerging gene and stem cell therapies for the treatment of erectile dysfunction. Nat Rev Urol. 7, 143-152;
- Органы из лаборатории;
- Nicole Prause, Jaymie Park, Shannon Leung, Geoffrey Miller. (2015). Women's Preferences for Penis Size: A New Research Method Using Selection among 3D Models. PLoS ONE. 10, e0133079;
- Rui Miguel Costa, Geoffrey F. Miller, Stuart Brody. (2012). Women Who Prefer Longer Penises Are More Likely to Have Vaginal Orgasms (but Not Clitoral Orgasms): Implications for an Evolutionary Theory of Vaginal Orgasm. The Journal of Sexual Medicine. 9, 3079-3088.






