
Агрегация белков – смерть или выживание?
25 сентября 2017
Агрегация белков – смерть или выживание?
- 5106
- 0
- 8
рисунок автора статьи
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: «Неправильная» укладка белковых молекул считается главной причиной нейродегенеративных заболеваний. Но как она может быть необходима организму для выживания? Вот плетет паук свою паутину и недоумевает, как это связано с Альцгеймером, сперматозоидами, загаром, гормонами и долговременной памятью... Разобраться в этом поможет данная статья.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Для того чтобы сложилось представление, о чем идет речь далее, необходимо понимать, что такое структура белка и чем она важна для клеток нашего организма.
Множество химических превращений протекает в цитоплазме, ядре, митохондриях наших клеток и даже в пространстве между клетками. Но эти реакции не происходят спонтанно и хаотично, они требуют четкой и отлаженной работы ферментов — специальных белковых молекул.
Белок — это молекула, представляющая собой цепочку из определенной последовательности аминокислот. Но в клетках белки не работают в виде цепочки, они должны иметь определенную форму в пространстве. Ученые выделяют несколько уровней упаковки белковых цепей (рис. 1):
- Первичная структура — это последовательность аминокислот. Та самая цепочка, с которой всё начинается. В ней не выделяют пространственные формы.
- Вторичная структура — уже форма изгиба аминокислотной цепи определенным образом. Выделяют две основные формы такой укладки: α-спираль, подобная шнуру от стационарного телефона, и β-складчатость, похожая на изгибы тела ползущей змеи.
- Третичная структура — это пространственное расположение всех атомов белковой молекулы друг относительно друга. Зачастую третичная структура соответствует доменам белка — стабильным четковыраженным областям, которые могут выполнять одну и ту же или разные функции.
- Четвертичная структура — это, как вы могли догадаться, способ укладки доменов белка (совокупность белковых цепей с третичной укладкой).
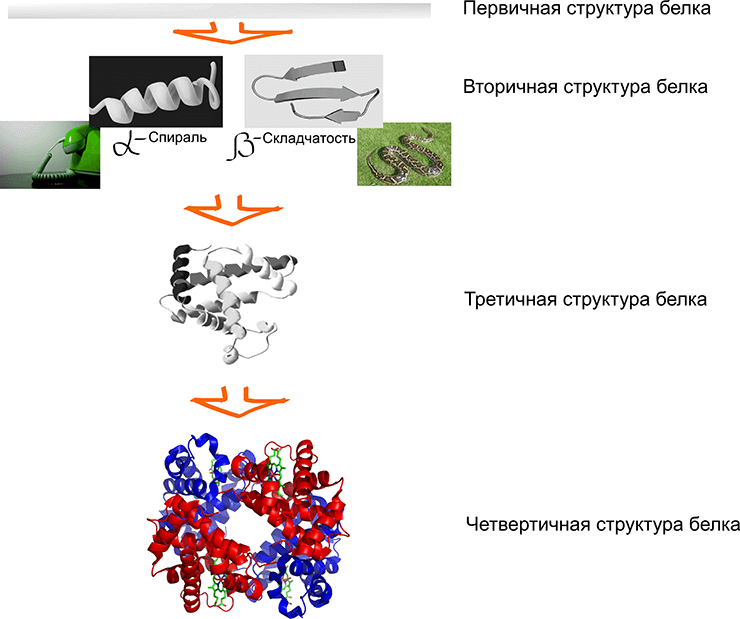
Рисунок 1. Уровни укладки белков. Внизу представлена четвертичная структура гемоглобина.
рисунок автора статьи с использованием изображения с сайта www.thinglink.com
Благодаря пространственной форме белки и несут свою специфическую функцию. К примеру, их форма может иметь выпуклую часть, в которую легко проходит нужное вещество и задерживается там для протекания химической реакции, а ненужные не подходят по размеру и форме. Это лишь малая часть того, как белок может использовать свою укладку. Белками регулируется в нашем организме многое: от сокращения мышц, до выполнения мыслительных процессов. Поэтому становится понятно, что какое-либо нарушение в укладке белков будет негативно сказываться на их работе и, как следствие этого, угнетать жизнь клеток и самого организма.
Когда же нарушается пространственная укладка белков, могут образоваться жесткие агрегаты — амилоиды. Образование амилоидов (амилоидогенез) представляет собой стадийный процесс, в основе которого лежит изменение пространственной формы белка. Для этого белковая молекула частично разворачивается (денатурирует) и вне зависимости от того, какая у нее была вторичная структура (α-спирали или β-складки, или они обе), она формирует β-складчатый жесткий каркас на всем своем протяжении (рис. 2).
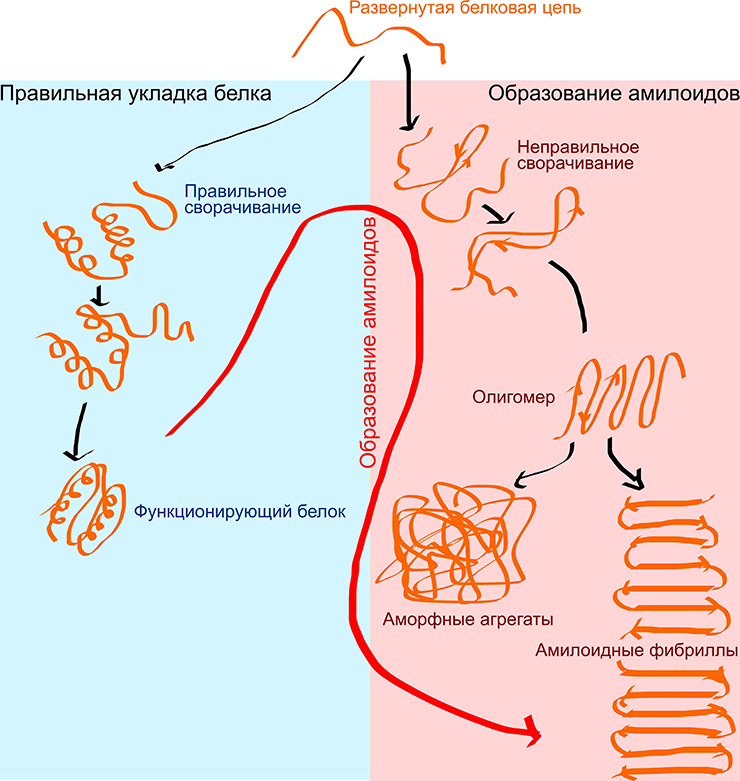
Рисунок 2. Процесс укладки белка и образования амилоидов. При обычной укладке белка цепочка аминокислот образует α-спирали или β-складки, которые формируют в дальнейшем функционирующий белок. Для образования амилоидов уложенный белок должен развернуться и начать компактно укладываться в β-складки, образуя олигомеры (олигомеры представляют собой переходную форму от нормальной укладки белка к амилоидной), которые агрегируют между собой либо в аморфные агрегаты, либо в амилоидные фибриллы.
рисунок автора статьи
Этот процесс не зависит от того, в каком порядке расположены аминокислоты, как при обычной укладке белка, то есть белок с любой последовательностью может подвергаться этому процессу. Но на этом все не кончается, новые формируемые β-складчатые молекулы агрегируют между собой и образуют фибриллу. Фибрилла представляет собой длинный тяж из агрегатов белков с новой формой. Такие фибриллы не увидеть при световой микроскопии, они находятся в нанометровом мире и потому, чтобы их увидеть, необходим электронный (рис. 3) [1] или атомно-силовой микроскоп.

Рисунок 3. Электронные микрофотографии амилоидных фибрилл. а — Амилоидные фибриллы, образованные островковым амилоидным полипептидом, ассоциированным с диабетом второго типа (светлые ниточки на темном фоне). б — Могут формироваться различные типы форм, такие как скрученные ленты, трубки и канаты.
Такая новая пространственная форма белков устойчива к протеазам (ферментам, расщепляющим белки) и растворителям, и потому они могут накапливаться в клетках и тканях организма. Собственно эта их способность лежит в основе их открытия.
Открытие амилоидов начинается с обнаружения в посмертных срезах тканей больных людей загадочных включений, как в мозге при болезни Альцгеймера (рис. 4). Благодаря таким обстоятельствам открытия вплоть до 2000-х годов за амилоидами закрепилась дурная слава патогенных «неправильно свернутых» белков. К настоящему же времени ученые постепенно пересматривают такой взгляд, обращая внимание на то, как амилоиды некоторых белков помогают своим хозяевам выживать.
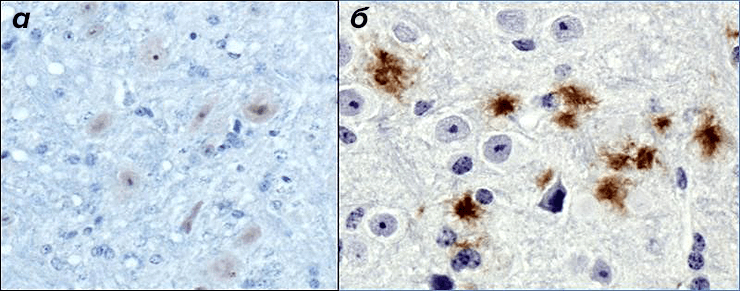
Рисунок 4. Срез мозга мыши в норме (а) и с нейродегенеративными бляшками, имеющими вид коричневых включений (б).
Амилоиды считают главной причиной развития таких патологий, как болезни Альцгеймера и Паркинсона, диабет второго типа и др., благодаря «каскадной амилоидной гипотезе», сформулированной в 1992 году Джоном Харди [2]. После закрепления этой гипотезы в литературе началось активное финансирование поиска лекарств, разрушающих амилоиды и предотвращающих их образование. Но не создано еще ни одного действующего лекарства для человека от амилоидозов, основанного на этом принципе.
Более подробно про болезнь Альцгеймера можно узнать у «биомолекулы» в статьях «Альцгеймеровский нейротоксин: ядовиты не только фибриллы» [3], «На руинах памяти: настоящее и будущее болезни Альцгеймера» [4] и «Смерть после жизни, болезнь Альцгеймера и почему мы хотим перемен» [5].
Краткая история вопроса
Стоит отметить, что история изучения амилоидов начинается не с изучения заболеваний мозга, а с исследования неизвестных тогда болезней, затрагивающих печень, почки и ряд других органов [6], [7]. К примеру, еще в 17 веке у женщины обнаружили сильно увеличенную селезенку, которая с трудом разрезалась ножом, и при резке слышался звук, как при распиливании древесины [8]. В более поздних работах 19 века можно увидеть такое понятие как «восковая печень», присвоенное органу, в котором обнаружено большое количество неизвестного вещества [6]. После этого вышел целый ряд работ, посвященных описанию «амилоидозов» — заболеваний, связанных с амилоидными отложениями в тканях и органах. Таким образом, с одной стороны началось бурное изучение амилоидов, их природы и происхождения, но с другой стороны за ними крепко закрепилась дурная слава «амилоидозов».
Благодаря исследованиям Прузинера и его группы в 80-х годах стала известна природа таких инфекционных заболеваний, как овечий скрепи, губчатая энцефалопатия крупного рогатого скота и болезнь Крейтцфельдта-Якоба у человека. Причиной этих недугов, как оказалось, являются белки. Белки эти закодированы в нашем геноме и не представляют опасности, но если они приобретут амилоидную укладку богатую бета-складчатостью, то становятся способными переводить нормальную форму этого белка также в амилоидную. Что удивительно, если в организм здорового животного или человека попадет такая форма белка, то его собственные белки также изменятся. Такие самовоспроизводящиеся инфекционные белки назвали прионами [9], [10].
Про прионы «биомолекула» рассказывала в статьях «Разоблачитель белков-убийц» [11], «Прионы: исследования таинственных молекул продолжаются» [12] и «Мутация, защищающая от всех известных прионных болезней» [13].
Таким образом, все прионы являются амилоидами, но не все амилоиды являются прионами (инфекционными).
Но, кроме того, что выделился еще один класс амилоидных заболеваний (прионные болезни), в биологии амилоидов выделился еще один раздел — функциональных амилоидов. С начала 21 века раздел пополняется данными о белковых агрегатах с амилоидной структурой, которые не вызывают заболевания, а исполняют специфическую роль в организме и потому называются функциональными амилоидами. Функциональные амилоиды были обнаружены как у одноклеточных микроорганизмов (как бактерии), так и у многоклеточных грибов, животных, в том числе и у людей.
Функциональные амилоиды бактерий
Первый открытый функциональный амилоид назван курлином (от англ. curled structures — скрученные структуры) (рис. 5) и обнаружен у бактерии — кишечной палочки Escherichia coli. Он является основным белковым компонентом биопленок E. coli и важен для колонизации поверхности и взаимодействия с иммунной системой хозяина [14], [15]. Благодаря общим свойствам амилоидов — устойчивости к протеазам и растворителям — они являются хорошим строительным материалом и придают колонии стабильность и защиту. Исследования показали, что эти амилоиды также участвуют в процессах адгезии клеток (способности клеток к прикреплению к поверхности), в формировании биопленок (особая форма сосуществующих клеток, сцепленных друг с другом в единую колонию). Таким образом, за отработку механизма правильного использования амилоидов, заключающуюся в правильном выборе времени и места их сборки, бактерии получают большую выгоду [14].
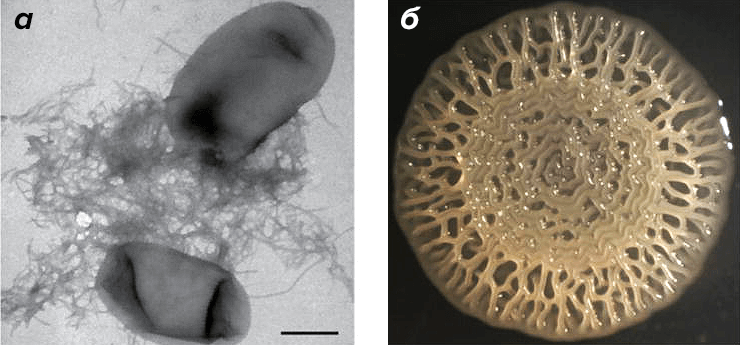
Рисунок 5. Кишечная палочка Escherichia coli. а — Электронная микрофотография клеток E. coli, продуцирующих амилоидные фибриллы. б — «Морщинистая» колония уропатогенной E. coli, имеющая такой вид благодаря амилоидам курлина. Шкала 500 нм.
Функциональные амилоиды животных
Функциональные амилоиды обнаружены и у животных: у бабочки Antheraea polyphemus в оболочке яиц [16], у пауков в составе паутинных нитей [17]. Эти амилоиды выполняют строительные и защитные функции, а в случае паутины и такие, как захват пищи.
Паутина пауков имеет слоистое строение, но в своей основе она содержит белок спидроин, укладка которого состоит не только из жесткой амилоидной формы, но и имеет неструктурированные «хаотичные» участки. Такое строение обеспечивает паутине эластичность с прочностью (рис. 6).
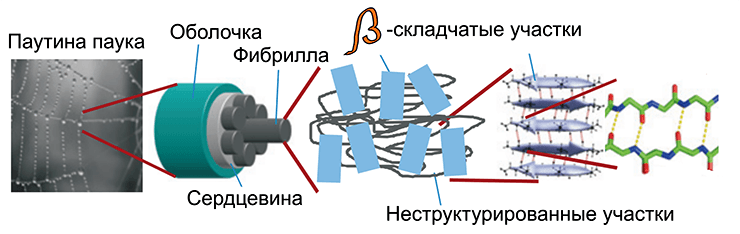
Рисунок 6. Строение паутины.
Интересно то, как пауки приспособились образовывать амилоиды из белков. В специальной паутинной железе синтезируются компоненты будущей паутины, включая белки спидроины. В полости железы паутина находится в жидком состоянии. Прежде чем быть выделенной наружу из специальных отверстий на брюшке паука, жидкость проходит через специальные «коридоры». При движении изнутри к отверстию в этих коридорах меняются условия, в частности, pH (кислотность раствора, зависящая от содержания ионов водорода). Перепады кислотности вызывают изменение структуры белка, заставляя его приобретать амилоидоподобную форму к выходу из брюшка паука. Такая хитрость защищает пауков от агрегации белков внутри самой железы и обеспечивает их прочным элементом паутины.
Одним из новейших открытий стало обнаружение амилоидоподобного вещества в таких важных для воспроизведения клетках, как сперматозоиды (показано для мышей). У сперматозоидов, чтобы проникнуть через плотные оболочки яйцеклетки, есть специальный мешочек с ферментами для ее растворения, называемый акросомой. Именно в ее составе обнаружили амилоиды (рис. 7) [19].

Рисунок 7. Строение сперматозоида (головка, как у сперматозоида мыши).
рисунок автора статьи
Акросомальная матрица является нерастворимой структурой, которая служит в качестве каркаса, контролирующего высвобождение ферментов во время проникновения сперматозоида в яйцеклетку. Для того чтобы пройти все оболочки, окружающие яйцеклетку, состоящие, в том числе, из окружающих ее клеток, сперматозоиды выбрасывают содержимое акросомы. Что удивительно, сами находясь в окружении своих протеолитических и гидролитических ферментов, они не разрушаются. А механизм, ответственный за стабильность матрикса акросомы, не был известен, пока группа ученых в 2014 году не показала, что в акросоме присутствуют амилоиды [19].
Для протекания акросомальной реакции, а именно выброса содержимого акросомы, важен показатель рН, который в ходе реакции изменяется. Ничего не напоминает? Пауки тоже используют этот показатель среды для использования амилоидной укладки. Считается, что внутри акросомы ферменты удерживаются в неактивном состоянии благодаря кислотной среде (рН от 3 до 4). Когда среда начинает подщелачиваться, то есть рН растет, ферменты активируются и начинают высвобождаться. Чего и стоит ожидать, выделенный амилоид акросомы был стабилен при рН 3, но быстро дестабилизировался при рН 7. Потому исследователи смело заявляют о новом функциональном амилоиде. И хотя еще точно не известно, какой именно белок укладывается в амилоиды (там содержится несколько возможных кандидатов), ясно, что клетки используют их для своей выгоды. Предположительно, амилоидная укладка белка является стабильным каркасом, который играет роль в процессах последовательного высвобождения ферментов для растворения оболочек женской половой клетки [19].
Наконец, возможно, что сама структура амилоида сперматозоидов функционирует как неферментативный механизм, помогающий проникать через все препятствующие оплодотворению оболочки [19].
Функциональные амилоиды человека
В 2006 году исследователи опубликовали работу, в которой было описано действие функционального амилоида человека [20]. Смелая работа была посвящена процессу образования меланина, степень выработки которого и отвечает за наш оттенок кожи (рис. 8). При чем же тут амилоиды? Оказалось, что в специальных органоидах клеток кожи — меланосомах, формируются амилоидные фибриллы из фрагментов белка Pmel17, на которых плотно упаковывается предшественник меланина. Такая локализация предшественника на амилоидах, как на подложке, ускоряет процесс его превращения в меланин [20].

Рисунок 8. Чем больше в меланоцитах пигмента меланина, тем темнее наша кожа, как на правой половине фото. Если же пигмента мало, кожа остается светлой, как на левой половине.
сайт modelity.it
Меланин служит защитником химической природы против патогенов, токсичных малых молекул и УФ-излучения и присутствует у большинства эукариот — от грибов и насекомых до человека. Именно меланин причастен к потемнению кожи, когда человек загорает или находится длительное время на солнце.
Описанный механизм формирования меланина является «срывающим шаблоны». До этого считалось, что амилоиды у человека — это лишь причина развития заболеваний. Полученные данные оказались настолько интересными, что процесс образования меланина, запечатлели на обложке журнала Journal of biological chemistry в декабре 2009 года (рис. 9).

Рисунок 9. Обложка декабрьского выпуска журнала Journal of biological chemistry 2009 года. Снизу показана электронно-микроскопическая фотография меланоцита и выделена округлая структура меланосомы (нарисованна в 3D красным цветом). Сверху две фотографии показывают фибриллярное содержимое меланосом — амилоидные фибриллы.
сайт www.jbc.org
Роль белка Pmel17 в формировании меланина не оставляет сомнений. Мутации в гене этого белка приводят к гипопигментации, то есть неспособности выработки пигмента меланина и снижению жизнеспособности клеток. Как уже упоминалось, процесс образования меланина связан с образованием амилоидов. Учитывая токсический эффект, обнаруживаемый у амилоидов и их предшественников (олигомеров) как во внутриклеточном, так и внеклеточном пространстве, можно ожидать, что процесс образования амилоидов будет строго регулироваться, чтобы избежать повреждения клеток. Действительно, полноразмерный Pmel17 синтезируется и доставляется в молодые меланосомы в виде белка, связанного со структурой мембраны (трансмембранного белка), неспособного формировать амилоиды. Только тогда, когда специальный фермент отщепит от белка фрагмент, называемый Mα, запускается процесс. Быстрое образование амилоидов Mα в сочетании с их вычленением из мембраны, по-видимому, минимизирует токсичность, возникающую при образовании амилоидов [20].
Амилоидные фибриллы Mα служат для связывания и ориентации предшественников меланина, ускоряя их превращение в меланин. Другая, по-видимому, важная функция Mα-амилоида заключается в предотвращении токсичного действия на клетки, связанного с процессом полимеризации меланина. Было показано, что большие избытки предшественников меланина приводят к сильным токсическим эффектам в клетках [21], что также может объяснить, почему мутации в гене, кодирующем Pmel17, приводит к снижению их жизнеспособности [22], [23]. Такой эффект можно объяснить утечкой токсичных меланогенных предшественников из меланосом в результате недостаточного удерживания со стороны Mα-амилоида. Предполагается, что связывание соединений-предшественников меланина будет предотвращать прохождение их через мембрану, перекрывая им выход в цитоплазму. Следовательно, способность Mα-амилоида связывать и концентрировать эти соединения внутри меланосом, по-видимому, защищает клетку от токсичности [20].
Таким образом, механизм образования функциональных амилоидов оказался очень похож у эволюционно далеких организмов от бактерий до человека.
Как мы храним гормоны
Многие процессы в организме регулируются особыми сигнальными молекулами — гормонами. Они синтезируются в специальных клетках, после чего поступают в кровь и разносят сигнал на большие расстояния (эндокринное действие), к рядом расположенным клеткам (паракринное действие) или даже действуют на клетки, их синтезирующие (аутокринное действие). Природа таких соединений хорошо изучена и, в основном, их делят на три большие группы: 1) белковые и пептидные гормоны, 2) стероидные гормоны и 3) гормоны, являющиеся производными аминокислот. Первая группа гормонов оказалась под пристальным вниманием исследователей статьи 2009 года, опубликованной в Science [24]. Их интересовал вопрос хранения синтезированных гормонов.
Клетки заключают вновь синтезированные белковые и пептидные гормоны в везикулы (специальные мешочки) для того, чтобы позже «выбросить» их во внеклеточное пространство. Некоторые из этих клеток хранят такие гормоны длительные периоды времени в высококонцентрированной форме в так называемых «секреторных гранулах» [25]. Такие гранулы содержат крупные нерастворимые агрегаты белков и пептидов [26], [27] и обладают определенной молекулярной организацией. Так как амилоиды представляют собой высокоорганизованные агрегаты белков (в том числе и пептидов), группа исследователей решила проверить, могут ли гормоны запасаться плотной амилоидной упаковкой. Результаты оказались весьма интересными и были представлены в вышеупомянутой статье [24].
Чтобы решить вопрос о том, хранятся ли пептидные и белковые гормоны в секреторных гранулах в амилоидоподобном состоянии, авторы сначала проверили способность таких гормонов образовывать амилоиды in vitro, то есть «в пробирке». Из 42-х случайно выбранных для исследования гормонов 10 проявили склонность к амилоидной агрегации. Таким образом, лишь ¼ исследуемых пептидов показала положительный результат, но это не остановило исследователей. Они решили учесть еще один фактор, а именно — гликозаминогликаны (ГАГ) [24]. Известно, что ГАГ принимают участие в формировании как секреторных гранул, так и амилоидных фибрилл [28], [29]. Потому в систему был добавлен гепарин в качестве представителя ГАГ, что оказалось ключевым моментом, так как после этого 31 из 42 изученных гормонов образовали амилоиды. Авторы также объясняют возможные причины отсутствия амилоидной агрегации оставшихся гормонов. Возможно, это связано с тем, что они не образуют амилоиды при хранении в секреторных гранулах, но также, возможно, что для того чтобы они образовывали амилоиды, требуется другое вещество, нежели гепарин. Как они показали, гормон человека пролактин не образовывал амилоиды в присутствии гепарина, но в присутствии хондроитинсульфата А (ГАГ, содержащийся в пролактин-специфических гранулах) образовывал [24].
Несмотря на полученные данные, ученым оставалось решить еще один вопрос: могут ли из такой амилоидной формы освобождаться отдельные молекулы гормона, когда они нужны организму? И ответ был найден. Было обнаружено, что амилоидные фибриллы гормонов высвобождали мономерный (одиночный) гормон при изменении кислотности среды от рН 6 (соответствует секреторным гранулам) к рН 7,4, при которой происходит высвобождение и секреция гормонов [24]. Нужно учитывать, что результаты экспериментов получены в условиях in vitro. Не всегда они соответствуют тому, что происходит в целом организме, потому на исследованиях in vitro авторы не остановились. Они проверили свою гипотезу на культурах клеток гипофиза мыши и на самих мышах. При помощи антител и специальных красителей на амилоиды было доказано, что внутри клетки гормоны гипофиза хранятся в виде амилоидной структуры [24].
Таким образом, процесс внутриклеточного использования амилоидной структуры не заканчивается на образовании меланина. Ученые продолжают расширять наш круг знаний об этой особой укладке белков.
Амилоиды памяти
За наше дыхание, сокращение сердца, чихание, способность видеть и слышать и многое другое отвечают нейроны — клетки нашего мозга. Но как в отдельных клетках мозга откладывается информация на долгое время, благодаря чему мы не забываем, к примеру, лица наших знакомых и родных?
Группы ученых исследуют нашу способность запоминать что-то на длительное время. А за открытие механизмов, лежащих в основе нашей долговременной памяти, точно вручили бы Нобелевскую премию... Так и произошло в 2000 году. Нобелевскую премию по физиологии и медицине получил Эрик Кандель «За открытие молекулярных механизмов работы синапсов», подразумевающее открытие молекулярных механизмов кратковременной и долговременной памяти [30].
Ученый использовал различных животных для исследований, но признание ему пришло благодаря такому незамысловатому моллюску как аплизия (Aplysia californica) (рис. 10). Порой для того чтобы открыть молекулярные механизмы, необходимо обращаться к животным попроще. Ведь очень сложно вычленить информацию из богатой запутанной нейронной сети, заключенной в нашем головном мозге. Тем более, когда нам интересны механизмы, происходящие в отдельных клетках. Уж чем хороша аплизия, так это своей упрощенной нервной системой и яркими ответными реакциями (рефлексами), по которым легко можно исследовать, как она «помнит».

Рисунок 10. Аплизия (Aplysia californica).
сайт www.sci-news.com
Благодаря такой замечательной модели для исследования ученым открылся молекулярный механизм долговременной памяти. Оказалось, что белок-регулятор трансляции CPEB играет ключевую роль в долгосрочных изменениях, связанных с хранением памяти. [31]. Белок CPEB был так назван сокращенно от cytoplasmic polyadenylation element binding protein. Это значит, что он представляет собой РНК-связывающий белок, который способствует удлинению полиаденинового хвоста РНК-носителя.
Белок ApCPEB, обнаруженный в нейронах слизняка, а также его аналоги у мушек дрозофил, мышей и людей, содержит на одном из концов домен, который демонстрирует высокое сходство с последовательностью прионных белков, что позволяет ему агрегировать и формировать амилоиды. При помощи другой модели исследования, еще более простой (дрожжи), показали, что CPEB аплизии обладает ключевым свойством, присущим прионам: он может вызывать перестройку структуры других белков, которые наследуются в последующих поколениях дрожжевых клеток [31]. Это свойство прионов имеет большое преимущество перед простыми белками, так как те подвержены процессу постоянного расщепления и нового синтеза (обновление). Если простой белок после некоторого времени функционирования расщепляется и синтезируется снова и так все время, как можно так надолго выполнять свою роль? Белок CPEB приобретает амилоидную структуру, не подверженную деградации, да и еще переводит другие белки в амилоиды, поддерживая изменения в синапсах длительное время. Именно этот процесс может лежать в основе долговременного «запоминания» отдельных клеток нашего мозга.
Итак, схема формирования долговременной памяти в синапсе нейрона при помощи CPEB на сегодняшний момент выглядит так (рис. 11). В синапсе присутствует CPEB, который представляет собой РНК-связывающий белок. Молекулы РНК необходимы для процессов синтеза (трансляции) новых белков. И потому, когда к нейрону проходит сигнал (стимуляция серотонином) происходит локальный «всплеск» трансляции ApCPEB (то есть синтез новых молекул). Это событие в свою очередь стимулирует образование этим белком прионной формы. Следовательно, прионы ApCPEB могут частично составлять следовую память нейронов. В стимулированных серотонином нейронах ApCPEB, возможно, распределен в виде агрегатов (как представлено на рисунке 11). Затем прионная форма ApCPEB запускает процесс активации трансляции факторов, которые необходимы для долгосрочного обеспечения синаптических изменений исключительно в определенных стимулированных синапсах. Это активное состояние ApCPEB является самовоспроизводящимся, благодаря свойству прионой формы, и сохраняется без каких-либо дополнительных посторонних сигналов [32].
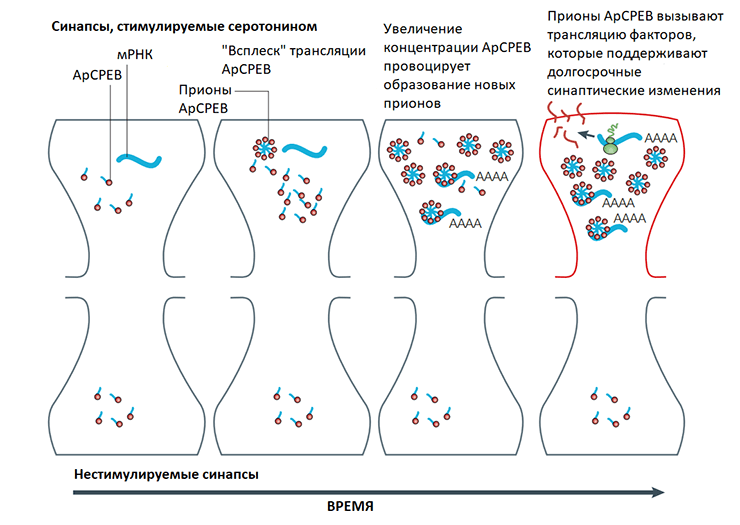
Рисунок 11. Обеспечение долгосрочной синаптической памяти при помощи прионов ApCPEB.
К тому же такой прионный механизм способствует тому, что формируемая «память» не распространяется на синапсы, где не было стимуляции, благодаря агрегированной форме амилоидов, которая не дает им покинуть стимулированный синапс. А большое конформационное разнообразие, присущее прионным формам («штаммы» или «варианты»), может обеспечить соответствующее разнообразие в силе долгосрочных изменений в разных синапсах [32].
Таким образом, даже прионы могут быть необходимы организму для выживания, участвуя в процессах долговременной памяти у аплизии. Но ученым еще предстоит выяснить, насколько этот или похожий механизм работает у людей.
Заключение
Исследования последних лет показали, что многие белки при определенных условиях способны формировать амилоидные агрегаты in vitro. Пополнение данных и расширение наших знаний в вопросах амилоидной агрегации белков способствовало принятию нового термина «амилом» (amylome) наряду с такими известными, как «геном» и «протеом». Он обозначает совокупность белков, потенциально способных формировать амилоидоподобные фибриллы [33]. При этом не все из белков, которые к такому способны, обнаруживают при заболеваниях. И если раньше амилоиды ассоциировали лишь с патологией, и десятилетиями ученые и медики искали способы их разрушения и выведения из организма, сейчас становится понятно, что амилоиды эволюционно отбирались для выполнения важных функций. Амилоиды — это и паутина паука, и процессы оплодотворения и образования меланина нашей кожи, запасание пептидных гормонов и даже формирование долгосрочной синаптической памяти. Даже была открыта функциональная роль амилоидных агрегатов белка APP, обнаруживаемых при болезни Альцгеймера, связанная с иммунной системой [34].
Изучение функциональных амилоидов является новым направлением в биологии амилоидов. И нет сомнений в том, что их число будет только пополняться.
Так кто же такие амилоиды? Друзья или враги? Очевидно, что, как и в случае бактерий, нет одного ответа. Есть патогенные, а есть нормальные, необходимые нам для выживания.
Литература
- Louise Serpell. (2014). Amyloid structure. Essays Biochem.. 56, 1-10;
- J. Hardy, G. Higgins. (1992). Alzheimer's disease: the amyloid cascade hypothesis. Science. 256, 184-185;
- Альцгеймеровский нейротоксин: ядовиты не только фибриллы;
- На руинах памяти: настоящее и будущее болезни Альцгеймера;
- Смерть после жизни, болезнь Альцгеймера и почему мы хотим перемен;
- Robert A. Kyle. (2001). Amyloidosis: a convoluted story. Br J Haematol. 114, 529-538;
- Jean D. Sipe, Alan S. Cohen. (2000). Review: History of the Amyloid Fibril. Journal of Structural Biology. 130, 88-98;
- A. A. Nizhnikov, K. S. Antonets, S. G. Inge-Vechtomov. (2015). Amyloids: from pathogenesis to function. Biochemistry Moscow. 80, 1127-1144;
- Arthur L Horwich, Jonathan S Weissman. (1997). Deadly Conformations—Protein Misfolding in Prion Disease. Cell. 89, 499-510;
- Stanley B Prusiner, Michael R Scott, Stephen J DeArmond, Fred E Cohen. (1998). Prion Protein Biology. Cell. 93, 337-348;
- Разоблачитель белков-убийц;
- Прионы: исследования таинственных молекул продолжаются;
- Мутация, защищающая от всех известных прионных болезней;
- D. Otzen, P. H. Nielsen. (2008). We find them here, we find them there: Functional bacterial amyloid. Cell. Mol. Life Sci.. 65, 910-927;
- Margery L. Evans, Matthew R. Chapman. (2014). Curli biogenesis: Order out of disorder. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1843, 1551-1558;
- Vassiliki A. Iconomidou, Georgios D. Chryssikos, Vassilis Gionis, Athanassios S. Galanis, Paul Cordopatis, et. al.. (2006). Amyloid fibril formation propensity is inherent into the hexapeptide tandemly repeating sequence of the central domain of silkmoth chorion proteins of the A-family. Journal of Structural Biology. 156, 480-488;
- Ute Slotta, Simone Hess, Kristina Spieß, Thusnelda Stromer, Louise Serpell, Thomas Scheibel. (2007). Spider Silk and Amyloid Fibrils: A Structural Comparison. Macromol. Biosci.. 7, 183-188;
- Sinan Keten, Zhiping Xu, Britni Ihle, Markus J. Buehler. (2010). Nanoconfinement controls stiffness, strength and mechanical toughness of β-sheet crystals in silk. Nat Mater. 9, 359-367;
- B. Guyonnet, N. Egge, G. A. Cornwall. (2014). Functional Amyloids in the Mouse Sperm Acrosome. Molecular and Cellular Biology. 34, 2624-2634;
- Douglas M Fowler, Atanas V Koulov, Christelle Alory-Jost, Michael S Marks, William E Balch, Jeffery W Kelly. (2005). Functional Amyloid Formation within Mammalian Tissue. PLoS Biol. 4, e6;
- JOHN M. PAWELEK, AARON B. LERNER. (1978). 5,6-Dihydroxyindole is a melanin precursor showing potent cytotoxicity. Nature. 276, 627-628;
- Graça Raposo, Michael S. Marks. (2002). The Dark Side of Lysosome-Related Organelles: Specialization of the Endocytic Pathway for Melanosome Biogenesis. Unknown journal title.. 3, 237-248;
- Silvers W.K. The coat colors of mice: a model for mammalian gene action and interaction. NY: Springer-Verlag, 1979. — 382 p.;
- S. K. Maji, M. H. Perrin, M. R. Sawaya, S. Jessberger, K. Vadodaria, et. al.. (2009). Functional Amyloids As Natural Storage of Peptide Hormones in Pituitary Secretory Granules. Science. 325, 328-332;
- R. Kelly. (1985). Pathways of protein secretion in eukaryotes. Science. 230, 25-32;
- Peter Arvan, Bao-yan Zhang, Lijun Feng, Ming Liu, Regina Kuliawat. (2002). Lumenal protein multimerization in the distal secretory pathway/secretory granules. Current Opinion in Cell Biology. 14, 448-453;
- Sharon A Tooze. (1998). Biogenesis of secretory granules in the trans-Golgi network of neuroendocrine and endocrine cells. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1404, 231-244;
- Svein Olav KOLSET, Kristian PRYDZ, Gunnar PEJLER. (2004). Intracellular proteoglycans. Biochem. J.. 379, 217-227;
- Robert Kisilevsky. (2000). Review: Amyloidogenesis—Unquestioned Answers and Unanswered Questions. Journal of Structural Biology. 130, 99-108;
- The Nobel Prize in physiology or medicine 2000. Nobelprize.org;
- Kausik Si, Susan Lindquist, Eric R. Kandel. (2003). A Neuronal Isoform of the Aplysia CPEB Has Prion-Like Properties. Cell. 115, 879-891;
- James Shorter, Susan Lindquist. (2005). Prions as adaptive conduits of memory and inheritance. Nat Rev Genet. 6, 435-450;
- L. Goldschmidt, P. K. Teng, R. Riek, D. Eisenberg. (2010). Identifying the amylome, proteins capable of forming amyloid-like fibrils. Proceedings of the National Academy of Sciences. 107, 3487-3492;
- β-амилоид: невидимый враг или тайный защитник? Запутанная тропка болезни Альцгеймера.







