
Александра Лугинина: «Наука — тоже отчасти искусство!»
09 декабря 2024
Александра Лугинина: «Наука — тоже отчасти искусство!»
- 298
- 0
- 1
Героиня нашего интервью за работой.
Центр научных коммуникаций МФТИ, Надежда Андреенко
-
Автор
-
Редакторы
Казалось бы, жизнь ученого — это рутина, дисциплина, режим и расписание. Однако даже в таком жестком ритме есть место для ярких эмоций. Как делаются открытия? Как найти свой путь в науке? Какие чувства испытывает ученый, получивший нужный результат после многочисленных неудач? Об этом мы поговорили с Александрой Лугининой, старшим научным сотрудником Лаборатории структурной биологии рецепторов, сопряженных с G-белком МФТИ — в рамках продолжения спецпроекта «Биология в Московском физтехе». Александра за свою работу в 2022 году получила медаль Российской академии наук с премией для молодых ученых и премию правительства Москвы, присуждаемую молодым ученым, а годом раньше — премию губернатора Московской области.
Биология в Московском физтехе
XXI век называют «веком живых систем», изучение которых возможно только на стыке наук — математики, физики, химии и биологии. «Биомолекула» представляет серию материалов о том, как занимаются биологией в Московском физико-техническом институте (МФТИ).
— В чем состоит ваша задача? Какие цели перед вами стоят? Или какие вы перед собой ставите цели?
— Мы определяем пространственную структуру рецепторов, сопряженных с G-белком [1]. Это такие молекулярные машины, которые находятся на поверхности клеток и отвечают за межклеточную передачу сигналов. Извне приходит сигнал, и клетка решает, что ей делать: делиться, умирать или перемещаться в пространстве.
Таких рецепторов, кратко называемых GPСR, в геноме человека порядка восьми сотен. Они участвуют в большинстве процессов в нашем организме и, соответственно, вовлечены в огромное количество заболеваний.
Мы как ученые определяем то, как они физически выглядят, как расположены в пространстве атомы этих белков и как устроены эти машины. Для этого мы пользуемся структурными методами [2], такими как рентгеноструктурный анализ или криоэлектронная микроскопия.
— Зачем это нужно?
— То, что мы делаем, прежде всего нужно для фармакологии. Если мы точно будем знать, как устроен белок, мы сможем очень специфично и селективно создать к нему лекарство.
Обычно создание лекарств происходит следующим образом: есть определенный набор химических соединений, которые в пробирках прогоняют через мишень, на которую нацелен препарат, и смотрят, есть эффект или нет [3], [4]. А если мы будем знать структуру белка, то сможем это сделать виртуально [5]. У нас есть большие библиотеки химических соединений, и виртуально мы можем гораздо быстрее и дешевле их проскринировать и посмотреть, будут ли они связываться с рецептором. Соответственно, мы можем в среднем в полтора раза ускорить и удешевить процесс изготовления препаратов. А это в среднем сейчас составляет 10–15 лет и стоит более миллиарда долларов.
Кроме того, мы сможем более фокусированно воздействовать на сам белок. Мы сможем подобрать как бы ключ к замку, определенное соединение исключительно для данного рецептора.
Мы делаем генно-инженерное конструирование. Для этого прогнозируем модификации, благоприятные для дальнейшего эксперимента и не затрагивающие функционирование белка. Затем занимаемся молекулярным клонированием, рекомбинантной экспрессией, которая представляет собой наработку белка в искусственных системах. После этого белок нужно очистить и провести анализ качества выделенного рецептора. Последний этап — кристаллизация.
— Для терапии каких болезней вы разрабатываете лекарства?
— Мы занимались увеальной меланомой. Это очень агрессивный вид рака. С мутацией в исследуемом нами лейкотриеновом рецепторе очень высокая вероятность именно увеальной меланомы, а среди больных этим видом рака высок процент людей с мутацией именно данного рецептора. То есть для исследования мы имеем хорошо пересекающееся множество.
Мы уже получили структуру рецептора без мутации [6], а теперь пытаемся определить структуру мутантной формы белка, чтобы понять, как именно мутация влияет на функционирование данного GPCR. Это еще не результат, а наша текущая работа.
Что касается результата работы нашей лаборатории, в частности, мой личный результат, — получение пространственной структуры цистеинил-лейкотриеновых рецепторов класса GPCR 1-го и 2-го типа (рис. 1) [6], [7]. Также мы с коллегами смогли определить структуру сфингозин-фосфатного рецептора 5-го типа [8].
В России мы единственные, кто этим занимается. Я горжусь, что непосредственно участвовала в организации нашей лаборатории, и моя структура появилась первой. Мне хочется решить как можно больше структур и, конечно, очень хочется дойти до создания реального лекарства.
Рецепторы, которые мы сейчас изучаем, связаны с аллергическими реакциями (астма, аллергический ринит, крапивница) и некоторыми видами онкологии. Мы пока не составили окончательный список белков-мишеней. Но очень хочется выйти на фармакологический рынок, вылечить реальную болезнь. Это немножко утопично звучит, поэтому сформулирую так: просто очень хочется внести свой вклад в развитие медицины. Какой-то вклад внесен, несколько структур получено, но создать конкретное лекарство — куда более ощутимо.
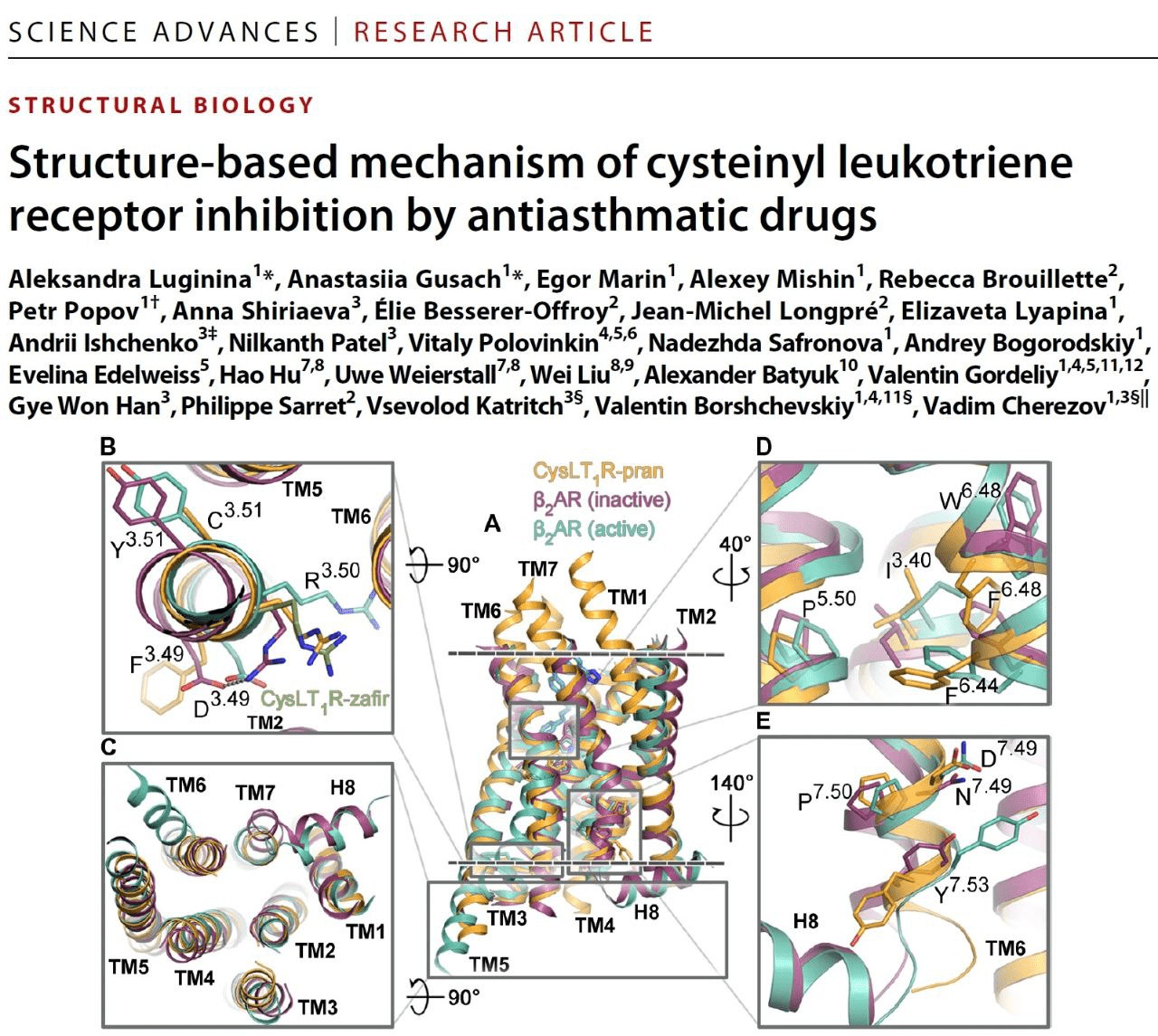
Рисунок 1. Анонс статьи по получению пространственной структуры цистеинил-лейкотриенового рецептора первого типа (CysLT1R).
журнал Science Advances, 2019 год [7]
— Как вы могли бы кратко описать вашу лабораторию?
— Наша лаборатория уникальна для России — других таких в нашей стране нет. В России структурами GPCR никто, кроме нас, не занимается. За такие белки особо никто не берется. Объекты очень сложные, интересные и, главное, фармакологически значимые. На современном рынке 30–40% лекарств нацелены именно на GPCR.
Получается, что наши мишени более чем актуальны. Это обусловлено тем, что, во-первых, они участвуют большинстве процессов, а во-вторых, они расположены на клеточной мембране, и лекарству легко к ним подступиться. Не нужно придумывать, как доставить их, например, внутрь клетки.
Но это очень сложные мишени. Мембранные белки очень плохо нарабатываются в искусственных системах. Они нестабильны и поэтому представляют собой очень сложные объекты исследования. В мире всего десяток-другой лабораторий занимаются такими исследованиями.
Мы сейчас только начали заход в криоэлектронную микроскопию. Некоторые иностранные лаборатории нас довольно сильно в этом опередили. Самые «прозвучавшие» лаборатория Брайана Кобылки в Стэнфорде, Институт iHuman в Шанхае, с которым мы активно сотрудничаем, лаборатория Вадима Черезова в Университете Южной Калифорнии, Университет Монаша в Австралии, Шанхайская группа Эрика Зю. Пожалуй, здесь я бы остановилась.
Рисунок 2. Александра Лугинина в кампусе МФТИ.
Центр научных коммуникаций МФТИ, Надежда Андреенко
— Как, если так можно выразиться, ваша лаборатория появилась на свет?
— Вадим Черезов, выпускник МФТИ, был у нас заведующим. Он первый человек в мире, который закристаллизовал GPCR и получил структуру высокого разрешения, скажем так. Он соединил методы рентгеноструктурного анализа и кристаллизацию в липидной кубической фазе. Его работа на эту тему была опубликована в 2007 году [9].
«Биомолекула» давно и пристально следит за структурной биологией G-белок сопряженных рецепторов. В частности, мы публиковали обзор первой определенной структуры GPCR: «Зрительный родопсин — рецептор, реагирующий на свет» [1], а также структуры Вадима Черезова, о которой рассказывает Александра: «Новый рубеж: получена пространственная структура β2-адренорецептора» [10]. — Ред.
Вадим Черезов согласился вернуться в альма-матер и с нами поработать. Мы, можно сказать, с коробок начали организовывать нашу лабораторию. Это было в 2012 году . Не было оборудования, не были поставлены методы. Мы начинали совсем малым коллективом — с коллегами Алексеем Мишиным и Валентином Борщевским. Потом другие ребята подтянулись.
«Биомолекула» в рамках спецпроекта «Биология в Московском физтехе» уже рассказывала об одной родственной лаборатории: «Лаборатория перспективных исследований мембранных белков: от гена к ангстрему» [11], а недавно на нашем конкурсе вышла публикация от автора из еще одной родственной лаборатории МФТИ, также посвященная семиспиральным рецепторам: «Пособие по слежке за GPCR, или как флуоресценция поможет найти новые лекарства» [12]. — Ред.
Это вообще очень интересная история, потому что как раз-таки Вадим, еще будучи аспирантом, изучал липидные пленки. Это исследование частично легло в основу исследований липидно-кубической фазы, которые стали основой метода кристаллизации белков. То есть речь идет не только о научных связях, но и об общем предмете изучения.
— Кого вы могли бы назвать своим учителем?
— Конечно, мой непосредственный учитель — Вадим Черезов. Вадим в нашей области — одна из ключевых личностей мирового уровня. Выше только два Нобелевских лауреата, которые получили премию за открытия в этой области в 2012 году: «Нобелевская премия по химии (2012): за рецепторы наших первого, третьего и четвертого чувств» [13].
Но Вадим Черезов с Рэем Стивенсом — это альтернативное направление. Они привнесли в исследование G-белков липидную кубическую фазу — метод кристаллизации. А затем занимались поиском новых белков-партнеров для стабилизации белков и формирования кристаллов. В коллекции их научных групп огромное количество решенных структур.
— Известно, что ваша лаборатория активно сотрудничает с китайскими коллегами. В чем конкретно заключается сотрудничество?
— Мы обмениваемся опытом, материалами, ездим к ним на стажировки, а они приезжают к нам, проводим совместные конференции. Идет плотное сотрудничество. Мы хорошо освоили метод рентгеноструктурного анализа, но в 2017 году стала активно развиваться криоэлектронная микроскопия: «Крупные подробности микроскопического мира: Нобелевская премия по химии 2017» [14]. У нас в этом деле опыта маловато, поэтому снова приходится практически с нуля начинать. Нужно осваивать и новые методы работы, и приборы. Здесь китайские коллеги нам помогают.
Криоэлектронная микроскопия сама по себе проще, если есть хороший прибор. Наш прибор применим пока только для каких-то базовых исследований, поэтому мы ездим в тот же Шанхай (рис. 3), в том числе, и для того, чтобы получать данные. Наши китайские коллеги с радостью предоставляют нам такую возможность.

Рисунок 3. На конференции в университете iHuman (Шанхай), представление полученной структуры CysLT1R, 2017 год.
фото предоставлено Александрой Лугининой
— Как вы дошли до жизни такой? Какое у вас образование?
— Я окончила МФТИ, затем работала в Институте биоорганической химии имени М. М. Шемякина и Ю. А. Овчинникова РАН, а потом опять вернулась на Физтех. Работая в лаборатории, ездила на стажировки в США, Германию, Францию и Китай. Кандидатскую работу выполняла и защищала тоже на Физтехе. То, что я делаю здесь, действительно амбициозно. Я по-настоящему делаю что-то новое. Проект очень смелый, очень тяжелый. Но делать его с нуля, все делать с нуля — очень интересно.
— У вас и гранты, наверное, есть?
— В 2022 году мы выиграли грант РНФ в категории «Проведение инициативных исследований молодыми учеными» президентской программы исследовательских проектов, реализуемых ведущими учеными, в том числе молодыми учеными, а в этом году мы выиграли конкурс РНФ, тоже в рамках молодежной президентской программы, в категории «Проведение исследований научными группами под руководством молодых ученых». Это уже более серьезный грант — на три года с бюджетом 6 млн в год. В августе приступили. Как раз будем изучать селективность подтипов рецепторов и онкогенную мутацию.
— А почему вас заинтересовала именно тема GPCR?
— Знаете, это вызов прежде всего себе самой, потому что никогда не знаешь, получится или нет. У меня не было конкретной мечты: вот, мол, хочу всю свою жизнь работать с GPCR. Просто у нас была молодая лаборатория, молодой центр, и нужны были люди. А я как раз искала себе место, и так совпало, что я туда пошла и по-настоящему втянулась. В некотором роде случайность, но удачно сложилось. У нас действительно очень здорово. Классный коллектив, очень разные проекты. Можно предлагать свои идеи, и они всегда будут услышаны.
— Что вас больше всего увлекает в занятиях наукой?
— Наверное, трудности и то, что результат достижим в конце концов. Эти несчастные кристаллы у меня только на четвертый год получились. Но когда они наконец получились, наверное, это был самый большой пик эйфории за всю мою жизнь, и к тому же самый длительный. Это, наверное, месяц продолжалось. Просто какое-то сумасшествие. Когда наконец-то вот получилось, и ходишь как в тумане. Даже когда научная статья вышла, когда диссертацию защитила, это все не так, как когда вот эти самые кристаллы, которых четыре года добиваешься, наконец-то вырастают.
— Все, что вы рассказываете, выглядит как киносценарий. Есть что-то, что вы хотели бы добавить?
— Наверное, можно так сказать, что мы работаем вопреки. Когда проект начинали, велик был шанс, что вообще ничего не получится. А у меня был срок защиты диссертации. Я, естественно, протянула с защитой, из-за того что проект не был завершен. Мне мой руководитель сказал: «всё, в 2016 году ты будешь защищаться, что бы там у тебя ни случилось».
А у меня ничего нет, кристаллов нет, и я говорю: «нет, не буду защищаться, пока не будет кристаллов!» Так решила, уже почти руки опустила. Потом думаю: ну нет, надо сделать еще один скрининг. Делаю скрининг, и наконец-то они вырастают. И все! Вот самая захватывающая история. Киносценарий по ней писать — это, конечно, перебор, но эмоций много было.
А потом, знаете, случился такой джекпот. Семь лет работали над проектом с семиспиральным белком (другое название GPCR), и только в седьмом научном журнале нашу статью приняли. Но это уже было немножко грустно, потому что как раз в этот момент выстрелила криоэлектронная микроскопия, и структуры, которые мы долго и кропотливо выращивали чуть ли не вручную, стали просто штамповать. А мы тут со своим образцом искусства, когда над этим белком работаешь кропотливо, руками, сотни конструкций, пробуешь и так далее…
В общем, масса эмоций положительных и отрицательных была, но слава богу, что-то сделали. После этого думаешь: всё, пора на пенсию. Но нет, беремся за следующий белок. Вот еще один GPCR себе взяла на днях.
Наверное, нужно добавить, что у нас собралась целая коллекция премий за эти проекты: премия правительства Москвы, Московской области, премия «Надежда России», медаль РАН. Но мы их стали получать, естественно, когда был получен научный результат. Кто же раздает награды, так сказать, на вырост? Все эти знаки признания мы получили буквально за последние года три.
— Расскажите, пожалуйста, для «чайников»: в чем прелесть метода криоэлектронной микроскопии?
— Криоэлектронная микроскопия — это когда вы берете и замораживаете раствор белкового комплекса на специальных сетках, помещаете сетки в электронный микроскоп и прогоняете через образцы пучки электронов.
В результате прохождения электронов на детекторе снимается фотография всей сетки, а дальше полуавтоматически вырезаются кусочки, соответствующие отдельным молекулам комплекса, и обрабатываются.
Необходимы миллиарды микрофотографий для получения хороших данных, потому что, если мы получим только одну фотографию, то будет расплывчатое облачко. А если мы сложим вместе много-много таких снимков, то мы уже сможем их усреднить до чего-то вразумительного.
Эти фотографии затем объединяют по принципу, в какую сторону повернут белок, компьютерным методом обрабатывают данные и получают структуры высокого разрешения комплексов GPCR .
Подробнее про эту методику можно прочесть в статьях: «12 методов в картинках: структурная биология» [2] и «Крупные подробности микроскопического мира: Нобелевская премия по химии 2017» [14]. — Ред.
Почему именно комплекс? У метода криоэлектронной микроскопии есть ограничение «снизу» на размер белка. Можно снимать только относительно «крупные» объекты. Для GPCR это очень хорошо, потому что они в основном и функционируют при образовании комплекса, чаще всего, со своим естественным партнером — G-белком. В этом случае они получаются и более стабильными.
— Какие знания нужны, чтобы этим заниматься?
— Нужно уметь и работать руками, то есть, условно, капать в пробирки, нужно уметь обрабатывать данные, то есть обладать математическими навыками. Естественно, нужно разбираться в теме, чтобы знать, что и зачем варьировать.
Ну и, конечно, немножко везения тоже нужно, потому что иногда долго вообще ничего не получается, а потом придумаешь, как, например, белок модифицировать, — и сразу успех!
— Каких знаний вам не хватает? В чем вам хотелось бы быть более компетентной?
— Конечно, не хватает! Мне еще учиться и учиться! К тому же и новые результаты постоянно коллеги получают — только успевай отслеживать. Но, скажем так, они все доступны. В частности, недавно прошла школа по структурной биологии в Москве (рис. 4), можно было поучиться как раз обработке данных криоэлектронной микроскопии. В принципе, все реально. То есть по мере необходимости берешь и как-то готовишься дополнительно

Рисунок 4. На конференции по крио-электронной микроскопии в МГУ с Вадимом Черезовым и женской составляющей коллектива Лаборатории.
фото предоставлено Александрой Лугининой
— Что бы вы еще хотели освоить?
— Интересно заниматься проектированием лекарств. Лично я этим еще пока не занималась. Молекулярный докинг, применяемый для поиска подходящих соединений, это как пазл. Вот у вас есть одна фигурка, а вы потом из миллиона подгоняете, какая именно подойдет под эту вашу фигурку в пазле. Есть ряд таких тонкостей, вроде того как можно отсеивать ненужные молекулы и так далее. Не получится, что берешь и бездумно, с полпинка, все делаешь.
Хотя, наверное, в науке везде так. Ничего не делается по прописям, по которым можно все сразу получить. Всегда нужно от себя немножко подумать, где-то оптимизировать, что-то добавить, где-то по-своему сделать. Наука — тоже отчасти искусство!
Опубликовано при поддержке гранта Минобрнауки России в рамках федерального проекта «Популяризация науки и технологий» № 075-15-2024-571.
Литература
- Зрительный родопсин — рецептор, реагирующий на свет;
- 12 методов в картинках: структурная биология;
- Драг-дизайн: как в современном мире создаются новые лекарства;
- Виртуальные тропы реальных лекарств;
- 12 методов в картинках: «сухая» биология;
- Anastasiia Gusach, Aleksandra Luginina, Egor Marin, Rebecca L. Brouillette, Élie Besserer-Offroy, et. al. (2019). Structural basis of ligand selectivity and disease mutations in cysteinyl leukotriene receptors. Nat Commun. 10;
- Aleksandra Luginina, Anastasiia Gusach, Egor Marin, Alexey Mishin, Rebecca Brouillette, et. al. (2019). Structure-based mechanism of cysteinyl leukotriene receptor inhibition by antiasthmatic drugs. Sci. Adv. 5;
- Elizaveta Lyapina, Egor Marin, Anastasiia Gusach, Philipp Orekhov, Andrey Gerasimov, et. al. (2022). Structural basis for receptor selectivity and inverse agonism in S1P5 receptors. Nat Commun. 13;
- V. Cherezov, D. M. Rosenbaum, M. A. Hanson, S. G. F. Rasmussen, F. S. Thian, et. al. (2007). High-Resolution Crystal Structure of an Engineered Human 2-Adrenergic G Protein-Coupled Receptor. Science. 318, 1258-1265;
- Новый рубеж: получена пространственная структура β2-адренорецептора;
- Лаборатория перспективных исследований мембранных белков: от гена к ангстрему;
- Пособие по слежке за GPCR, или как флуоресценция поможет найти новые лекарства;
- Нобелевская премия по химии (2012): за рецепторы наших первого, третьего и четвертого чувств;
- Крупные подробности микроскопического мира: Нобелевская премия по химии 2017.







