
Аллополиплоидия, или Как разные геномы научились жить под одной крышей
01 ноября 2013
Аллополиплоидия, или Как разные геномы научились жить под одной крышей
- 14154
- 0
- 2
«Легко ли быть аллополиплоидом?»
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Аллополиплоидия, или объединение чужеродных геномов в одном ядре, — чрезвычайно распространенный феномен среди высших растений. Чтобы понять механизмы этого явления, ученые научились его моделировать путем создания синтетических аллополиплоидов. В данном обзоре представлены современные данные, касающиеся путей реорганизации геномов аллополиплоидов, начиная с самых ранних стадий их формирования.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Значение аллополиплоидии в эволюции высших растений

Рисунок 1. Иван Иванович Герасимов (1867 – ок. 1920)
Помните сказку про трех поросят? Эта история — прекрасная иллюстрация того, что происходит, когда различные геномы объединяются в одном ядре. Но начнем по порядку. В 1892 году русский ботаник Иван Иванович Герасимов (рис. 1) исследовал влияние температуры на клетки зеленой водоросли спирогиры и обнаружил удивительное явление — изменение числа ядер в клетке. После воздействия низкой температурой или снотворным (хлороформом и хлоралгидратом) он наблюдал появление клеток без ядер, а также с двумя ядрами. Первые вскоре погибали, а клетки с двумя ядрами успешно делились. При подсчете хромосом оказалось, что их вдвое больше, чем в обычных клетках.
Так было открыто наследственное изменение, связанное с мутацией генотипа, т.е. всего набора хромосом в клетке. Оно получило название полиплоидии, а организмы с увеличенным числом хромосом — полиплоидов. Как оказалось, полиплоидия гораздо более характерна для растений, чем для животных. Дело в том, что у последних имеет место хромосомное определение пола, и любое нарушение баланса половых хромосом приводит к фатальным последствиям для организма (исключение составляют некоторые насекомые, рыбы и земноводные, у которых яйцеклетки способны развиваться без оплодотворения). Существует две формы полиплоидии: аллополиплоидия, или объединение чужеродных геномов в результате скрещивания (отдаленной гибридизации), и аутополиплоидия — когда происходит мультипликация одного и того же генома. В эволюционном плане наиболее важна аллополиплоидия, и именно ей посвящен этот обзор.
Новейшие исследования по расшифровке геномов высших растений показали, что подавляющее большинство известных видов растений в своей истории подвергались полиплоидизации [1]. У некоторых видов это происходило многократно. Почти все культурные растения, без которых человечество не смогло бы существовать, — аллополиплоиды. Всем известная мягкая пшеница содержит в своем составе целых три генома (A, B и D); хлопчатник имеет два генома (A и D); кукуруза и рис относятся к древним полиплоидам, у которых в результате длительной эволюции исчезли границы между отдельными геномами.
Так что же является причиной победоносного шествия полиплоидов по планете? Почему наиболее ценные культурные растения выходят из этих рядов, и не являются ли их ценные свойства (высокая продуктивность, способность к широкой адаптации) следствием полиплоидии? Согласитесь, что без ответа на эти вопросы никакая плодотворная селекция невозможна, а в теоретическом смысле остается тайной за семью печатями один из важнейших механизмов эволюции. Если вернуться к сказке про трех поросят — как заставить их жить под одной крышей, если в силу различий характера, темперамента и т.д. они поначалу этого не хотят? Так же и геномы: чем более отдаленные и непохожие друг на друга — тем сильнее конфликт между ними внутри общего ядра. И выхода только два: либо оставаться поодиночке, наедине с враждебной внешней средой, либо научиться жить вместе, принеся в жертву свои разногласия ради единственной цели — выживания.
«Геномный шок» и мобильные генетические элементы
Занимаясь цитогенетикой кукурузы, Барбара Мак-Клинток еще в середине прошлого столетия нарушила существовавшую тогда в генетике догму о геноме как о стабильной совокупности неподвижных генов. Она сформулировала гипотезу «геномного шока» под действием контролирующих генетических элементов, способных к перемещению (МГЭ; мобильные генетические элементы) [2]. Материальные носители этих элементов — транспозоны — были открыты только спустя несколько десятков лет. Оказалось, что транспозоны являются одними из основных действующих лиц драмы, происходящей внутри полиплоидного ядра. Увидеть эту драму, начиная с самых первых актов, ученые смогли с помощью синтетических (искусственно созданных) аллополиплоидов (гибридов).
На «Биомолекуле» уже публиковались статьи о мобильных генетических элементах и транспозонах: «Alu: история одной последовательности» [3], «Новое в изучении „прыгающих генов“» [4], «Тайны „молекулярных паразитов“, или Как путешествовать по геному» [5], «Разнообразия много не бывает: чем занимаются мобильные элементы генома в мозге» [6]. — Ред.
Увеличение активности транспозонов, в норме вполне спокойных и не склонных менять свое месторасположение, наблюдалось практически сразу после скрещивания — аллополиплоидизации [7]. Следует сразу сказать, что активация эта не носит тотальный характер, иначе это бы привело к разрушительным для генома последствиям. Активируется только часть транспозонов — как правило, более молодые и «здоровые» элементы, не успевшие накопить мутации. Они находятся в меньшинстве, тогда как подавляющая часть транспозонов представлена неактивными «старичками-дегенератами». Транспозиции могут приводить к модификациям генов, изменяющим их работу (экспрессию) [8]. Достигается это либо непосредственным встраиванием в регуляторную или кодирующую часть гена, либо встраиванием на некотором расстоянии от гена, что приводит к изменению упаковки хроматина. Последний способ относится к эпигенетическим изменениям, не связанным с первичной структурой ДНК [9]. Оба способа увеличивают диапазон генетической, а значит и фенотипической изменчивости, что является необходимым условием для «перезагрузки» генома, — формирования новых паттернов генной экспрессии, обеспечивающих координированную работу отдельных субгеномов в рамках полиплоидного ядра. Однако не следует полагать, что транспозоны «знают», куда им прыгать: их перемещения стохастичны , и какой вариант наиболее оптимальный — решать, в конечном счете, естественному отбору.
Однако не все молекулы, «самостоятельно» перемещающиеся по ДНК, делают это случайно: некодирующая РНК Xist, например, регулирующая активность X-хромосомы, планомерно эту хромосому «облепляет» и инактивирует транскрипцию генов на ней: «Загадочное путешествие некодирующей РНК Xist по X-хромосоме» [10]. — Ред.
Вот важнейший вопрос, на который пока нет точного ответа: каким образом геном контролирует атаку транспозонов? Следует сказать, что большинство транспозонов в геномах растений размножается по механизму самокопирования [11]. Это так называемые ретротранспозоны, в отличие от ДНК-транспозонов, которые перемещаются путем вырезания-встраивания. Понятно, что чрезмерное размножение ретротранспозонов, коих и так много, нежелательно. Поэтому параллельно процессу активации транспозонов в полиплоидном ядре происходит их ликвидация. Что же касается того, каким транспозонам активироваться, а каким — отправляться на свалку, — определяет эпигенетический механизм, а именно: геном как бы метит разными метками тех и других, не нарушая первичной структуры ДНК [12]. В качестве меток используются различные реакционные группы (метильные, ацетильные, фосфатные и др.), которые прикрепляются либо к ДНК (метильные группы), либо к белковым молекулам гистонов. Последние, как известно, и отвечают за специфическую укладку ДНК в составе хроматина.
Но это еще не все. Существуют короткие молекулы РНК, считанные с самих транспозонов, — так называемые пиРНК (Piwi-interacting RNA) длиной 24–29 нуклеотидов [13] . Эти пиРНК объединяются в комплексы со специальными белками (Piwi), которые затем находят молекулы мРНК, считанные с МГЭ, и режут мРНК МГЭ на кусочки, тем самым не давая МГЭ прыгать и размножаться. Интересно, что некоторые из этих кусочков сами потом могут служить в качестве пиРНК. Получается нечто вроде цепной реакции. Именно пиРНК является сдерживающим фактором, ограничивающим экспансию транспозонов.
Мы уже писали, и довольно подробно, об известных на текущий момент разновидностях РНК: «Обо всех РНК на свете, больших и малых» [14]. — Ред.
В полиплоидном ядре — после слияния материнской и отцовской гамет — транспозиционная активность контролируется только материнской цитоплазмой. Понятно, что количества материнской пиРНК не хватит на то, чтобы «держать в узде» транспозоны обоих субгеномов. Поэтому на ранних стадиях аллополиплоидизации и происходит активация мобильных элементов. Со временем уровень пиРНК возрастает, и контроль инсерций по всему геному восстанавливается. Но это произойдет уже после того, как транспозоны примут участие в «перезагрузке» генных сетей, направленной на восстановления работы полиплоидного генома в ходе геномного конфликта [15] (рис. 2).
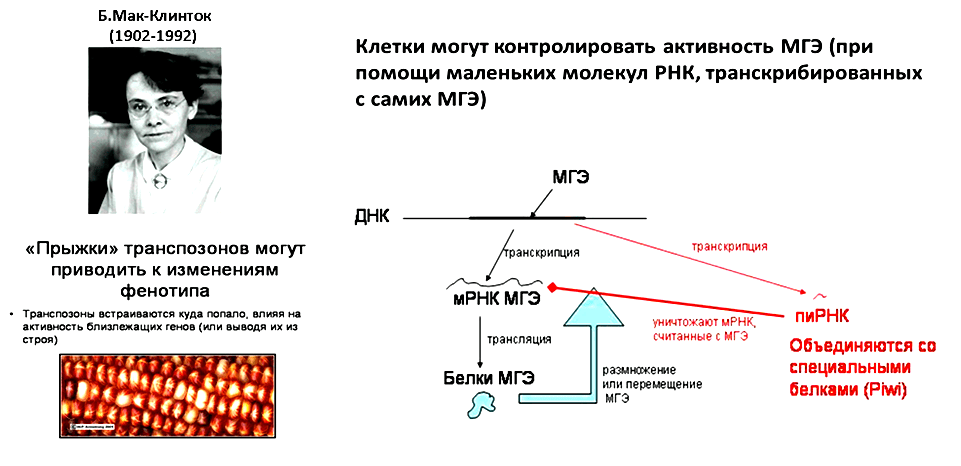
Рисунок 2. Роль МГЭ в геноме и механизм контроля их активности с участием пиРНК.
Хромосомные перестройки и мейоз
Пожалуй, самыми первыми событиями, которые обнаружили ученые в полиплоидных клетках с помощью микроскопа, являются хромосомные перестройки. Большинство этих аномалий (особенно в ходе мейоза) приводят если не к летальному исходу, то, как правило, к стерильности. Однако нельзя сказать, что эти изменения не важны для эволюции. Некоторые из них могут приводить к радикальным фенотипическим изменениям, которые могут быть востребованы при резкой смене среды обитания («сальтаторное» возникновение нового вида) [16].
В основе различных хромосомных перестроек лежит один и тот же механизм гомологичной рекомбинации [17]. Другими словами, рекомбинировать могут любые участки ДНК, имеющие гомологию: как внутри одного генома, так и между отдельными геномами у полиплоида. Если в диплоидном ядре рекомбинация, как правило, не нарушает правильного расхождения хромосом-гомологов, то в случае полиплоидного ядра образуются мультиваленты, состоящие из гомо- и гомеологичных (из разных геномов) хромосом. Этот процесс напоминает заплетание косичек — двойных, тройных и т.д. Ясно, что чем больше переплетений, тем меньше шансов, что коса распустится. На хромосомном уровне это проявляется в неправильном расхождении, — когда, к примеру, в одну гамету попадают все четыре хромосомы квадривалента, а в другую — ни одной. Результат — хромосомная нестабильность, весьма нежелательная для организма. И если даже расхождение происходит, то с разного рода дефектами: делециями, транслокациями, инверсиями и т.п.
Как этого избежать и обеспечить спаривание и расхождение только гомологичных хромосом, исключив из этого процесса хромосомы гомеологичные? Для этого природа создала генетический механизм подавления гомеологичной рекомбинации. Например, у пшеницы данный механизм контролируется локусом Ph1, содержащим ряд генов со сходной функцией [18]. Продукты этих генов модифицируют гистоновые белки хромосом. При наличии данного локуса (Ph1+) происходит наработка дефектных белков, что приводит к снижению модификации гистонов и задержке деконденсированного состояния хромосом в профазе первого деления мейоза. Именно тогда и происходит синапсис хромосом с последующей рекомбинацией.
А, как известно, для осуществления синапсиса и формирования синаптонемного комплекса необходимо, чтобы хромосомы конденсировались. Теперь вернемся к процессу заплетания косичек. Для правильной укладки пряди должны быть равной длины. Если же они будут неравными или будут разделены значительным расстоянием — ничего не получится. Точно так же спаривание хромосом в профазе мейоза зависит от их сходства, — чем оно больше (а у гомологов оно максимальное), тем больше шансов, что они первыми образуют пару. Если же процесс конденсации или выравнивания хромосом по длине ограничить во времени под влиянием локуса Ph1, то в спаривание будут вовлечены преимущественно гомологи (рис. 3).
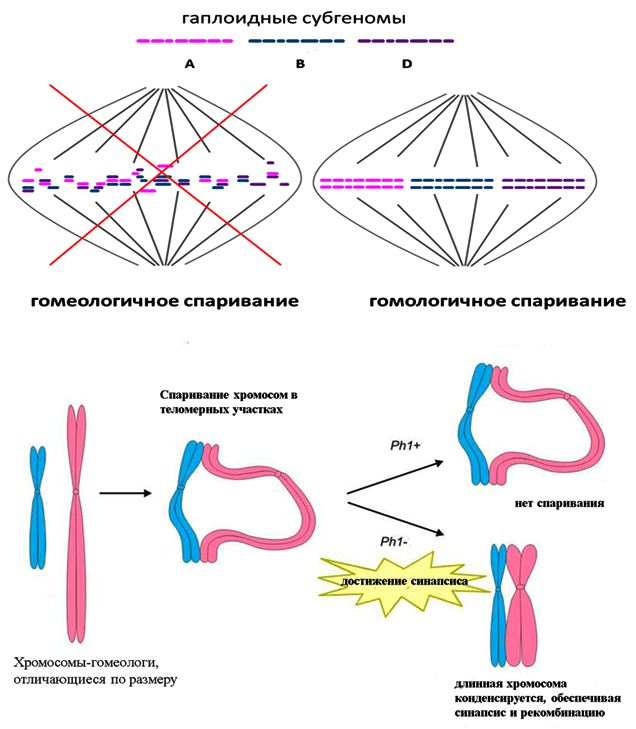
Рисунок 3. Модель влияния локуса Ph1 на синапсис гомеологичных хромосом и рекомбинацию
Здесь мы подходим к весьма важному условию сосуществования двух и более геномов в одном ядре. Оказывается, что чем больше структурных различий накопили их хромосомы, тем больше шансов преодоления цитогенетической несовместимости в ходе мейоза. Это звучит парадоксально, поскольку генетические системы и механизмы их функционирования при этом должны оставаться сходными. Иначе получится как в известной басне про лебедя, рака и щуку. Чтобы этого избежать, нужен дифференцированный подход, т.е. геном может накапливать различия только в той части, которая не столь существенна для его функционирования и воспроизводства.
Уже на ранних стадиях аллополиплоидизации происходит элиминация весьма значительной части генома [19]. Это преимущественно некодирующий материал — разного рода повторы, главным образом, тандемные. Последние образуют гетерохроматиновые блоки — генетически инертные, плотно упакованные хромосомные образования. Следует отметить односторонний характер элиминации, т.е. элиминируются повторы только в одном из субгеномов. Причина такой односторонней элиминации до сих пор не ясна. Способность элиминировать часть ДНК отрицательно коррелировала с частотой образования мультивалентов и положительно — с фертильностью гибридов. Таким образом, успех аллополиплоида во многом определяется тем, насколько быстро и эффективно он избавится от «генетического балласта» — избыточной ДНК, нейтральной или оказывающей отрицательное влияние на генетические функции и протекание мейоза.
Транскриптомные изменения и феномен «ядрышкового доминирования»
Что касается кодирующей части генома, то тут, по понятным причинам, любые крупные реорганизации недопустимы. Однако нельзя сказать, что в этой части совсем ничего не происходит. Самым распространенным и ранним эффектом аллополиплоидизации является изменение транскрипционной активности генов (транскриптомные изменения) [20]. Эти изменения могут индуцировать транспозоны (см. выше), хотя это и не обязательно. Наиболее ярким примером является феномен ядрышкового доминирования.
Вначале — несколько слов о ядрышках. Это цитологические структуры хромосом, в которых осуществляется сборка субъединиц рибосом; состоят они из генов, кодирующих рибосомальную РНК (рРНК). Получается, что ядрышко — своего рода фабрика по производству рибосом, где количество генов рРНК определяет объем выпускаемой продукции . В полиплоидном ядре число таких фабрик кратно количеству субгеномов. Однако, как правило, фабрики рРНК работают только в одном из субгеномов, а остальные временно простаивают, хотя и могут активизироваться в других тканях. Это явление, было впервые открыто Навашиным в 1934 г. [21] и с тех пор обнаружено практически у всех изученных аллополиплоидов.
Ядрышко обладает многоуровневой регуляцией. В частности, его размер находится под контролем десятков генов, определяющих активность различных РНК-полимераз: «Размер имеет значение» [22]. — Ред.
Пока не ясно, по какому принципу отбираются функционирующие ядрышки. Недавно был раскрыт эпигенетический механизм ядрышкового доминирования и показано участие в этом механизме малой интерферирующей РНК (миРНК), наподобие той, что участвует в контроле над мобильными элементами. Только эта малая РНК не расщепляет мРНК, как в случае транспозонов, а направляет метилирование промоторных районов генов рРНК, тем самым блокируя процесс их транскрипции [23] (рис. 4).
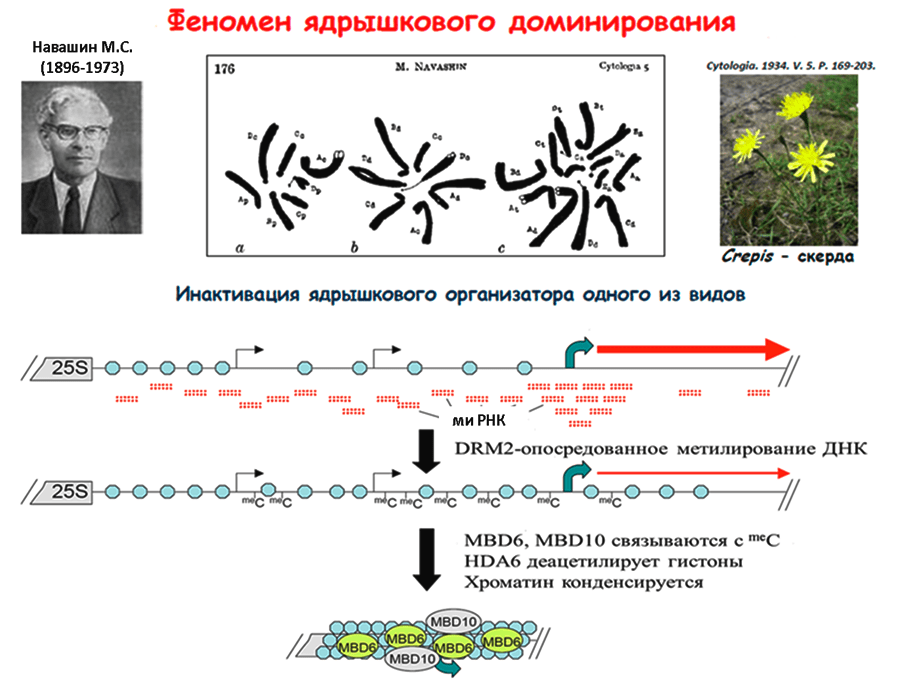
Рисунок 4. Феномен ядрышкового доминирования. Внизу — модель РНК-управляемого метилирования генов рРНК. Гены рРНК (18S, 5,8S, 25S) разделены промежутками — спейсерами. Кружочки обозначают нуклеосомы. Транскрипция внутри некодирующего спейсера (тонкие черные стрелки) инициирует продукцию миРНК. Последняя направляет de novo-метилирование спейсерной последовательности с помощью белка DRM2. Присоединение белков MBD6 и MBD10 к метилированной ДНК в сочетании с деацетилированием гистонов приводит к подавлению транскрипции и последующей компактизации хроматина.
[23] (внизу)
Существует такой термин — «аддитивная экспрессия». Он означает, что эффекты тождественных генов суммируются в результате их объединения. Так вот, в ходе аллополиплоидизации очень часто наблюдаются отклонения от этого правила [24–26]. Зачастую происходит изменение картины экспрессии (транскрипции) генов таким образом, что в некоторых тканях гибрида доминирует один ген гомеологичной пары, а в других тканях — его дублер. Между этими крайними состояниями доминирования наблюдается непрерывный спектр состояний, характеризующихся различными соотношениями активности генов — гомеологов. Это напоминает посменный график трудового дня (онтогенеза), когда один ген работает, а его напарник в это время отдыхает, либо в той или иной степени участвуют оба. Рациональный подход, не правда ли? Кто-то более склонен работать в ночную смену, кто-то — в дневную; работу, требующую большой отдачи (количества белковых продуктов) выполняет более сильный ген, а там, где больших усилий не требуется — включается ген послабее.
Аналогия вполне простая и понятная на уровне социума, однако на геномном уровне пока не ясно — почему из двух генов, выполняющих одну и ту же функцию, один работает в одних условиях, а другой — в других. И кто этот невидимый диспетчер, который управляет их работой? Судя по всему, термин «шок» применим не только к геному, но и к его продукту («транскриптомный шок») [20]. Это следует из того, что только небольшая часть генов, у которых произошли транскрипционные изменения на ранних стадиях аллополиплоидизации, в дальнейшем сохранила эти изменения. У большей части генов на более отдаленных стадиях происходит коррекция их экспрессии, связанная с непрерывно протекающей структурно-функциональной дивергенцией гомеологичных генов.
В результате этой дивергенции закрепляется наиболее эффективное «разделение труда» между гомеологами на уровне первичной структуры ДНК. А этот уровень более основательный и требующий более длительной эволюции, нежели эпигенетический, как раз характерный для ранних «шоковых» стадий. То, что транскриптомные изменения на ранних стадиях аллополиплоидизации происходят по эпигенетическому механизму, было убедительно показано на синтетическом аллотетраплоиде арабидопсиса [27] (рис. 5).

Рисунок 5. Генетические изменения у аллополиплоидов: эпигенетические и структурные. Нарушение эпигенетической регуляции на ранних стадиях аллополиплоидизации приводит к появлению многочисленных морфозов — отклонений в развитии отдельных частей растения (слева внизу).
[27] (слева)
Авторы этой работы обрабатывали растения аллотетраплоида и исходных родителей 5-азацитидином — веществом, ингибирующим ДНК-метилтрансферазу . В результате этой обработки нарушается процесс метилирования ДНК, а значит и важнейший элемент эпигенетической регуляции (наряду с модификацией гистоновых белков). Что характерно, в наименьшей степени данная обработка повлияла на родительские формы, тогда как у аллотетраплоида она индуцировала появление многочисленных морфозов — грубых изменений фенотипа. В ходе анализа транскрипции ряда генов было установлено, что гены, неактивные у необработанных тетраплоидных растений и находящиеся в метилированном состоянии, подвергались деметилированию и активации у обработанных растений. Следовательно, регуляция генов развития у вновь образованного аллополиплоида находится под строгим эпигенетическим контролем, и любое нарушение этого контроля приводит к существенным сбоям в развитии вплоть до появления нежизнеспособных форм.
Именно на ДНК-метилазу (а еще гистондеацетилазу) направлено действие немногочисленных пока «эпигеномных» лекарств нового поколения: «Пилюли для эпигенома» [28]. — Ред.
Структурно функциональная дивергенция генов-гомеологов
Теперь поговорим о дальнейшей судьбе генов-гомеологов. Как видно из вышесказанного, и тот, и другой гомеолог в той или иной степени задействованы на разных стадиях онтогенеза аллополиплоида. Однако, поскольку и один гомеолог может работать за двоих (троих и т.д.) у диплоидных форм, то давление отбора у полиплоида (по сравнению с диплоидом) становится меньше, и каждый ген получает возможность накапливать мутации (рис. 5).
На этом пути имеется несколько возможностей [8], [29] (рис. 6). Первая возможность — субфункционализация. В этом случае один гомеолог дополняет другой для более эффективного выполнения определенной функции в тех или иных условиях. Как следствие, происходит расширение адаптивного потенциала. В качестве примера можно привести ген VRN (от англ. vernalization) мягкой пшеницы, определяющий чувствительность к яровизации и срок колошения. Каждая из трех гомеологичных копий этого гена (соответствующих трем субгеномам — A, B и D) имеет ряд аллелей, влияющих на указанные физиологические параметры. Комбинаторика доминантных и рецессивных аллелей по всем трем VRN-локусам определяет разнообразие фенотипов, различающихся по сроку колошения и типу развития (озимые и яровые формы ). Это разнообразие во многом способствовало успеху мягкой пшеницы как мировой культуры, возделываемой от умеренных до тропических широт [30].
Вопрос генетики и селекции культурных сортов пшеницы драматично освещен в романе В. Дудинцева «Белые одежды», описывающем конфликт между учеными и правящей верхушкой в послевоенном СССР. — Ред.
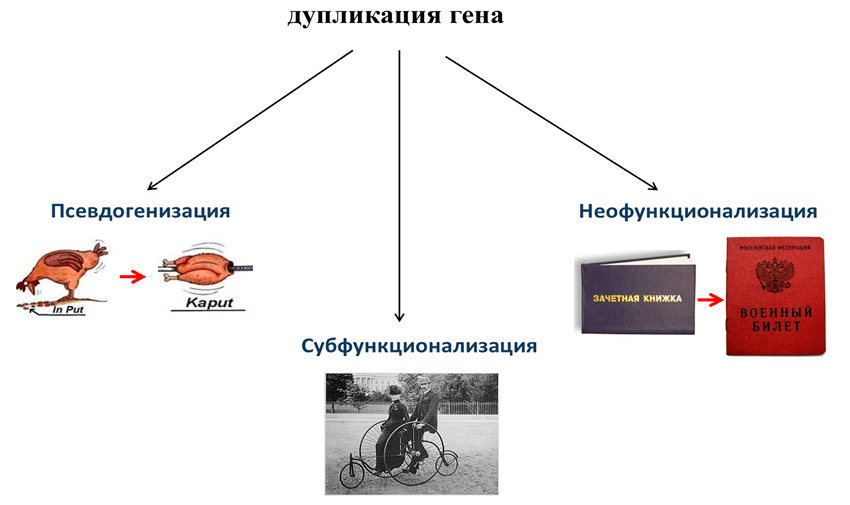
Рисунок 6. Различные пути структурно-функциональной дивергенции дуплицированных генов. Эта схема справедлива как для дупликаций внутри одного генома (хромосомы), так и для дупликаций генов в результате объединения геномов.
Второй путь эволюции гомеологичных генов — неофункционализация, когда один из гомеологов приобретает принципиально иную функцию. Этот путь, как правило, требует более существенных структурных изменений в гене, нежели первый, а значит, и более длительной эволюции. Трудно найти пример неофункционализации у полиплоидов, поскольку у синтетических гибридов времени для формирования новых генов явно недостаточно, а у природных аллополиплоидов — наоборот: длительная эволюция «перетасовала» и изменила гены настолько, что зачастую довольно трудно определить их происхождение. И, наконец, есть еще путь псевдогенизации, или полной утраты функции одним из гомеологов и превращение его в псевдоген (рис. 6).
В процессе тотального секвенирования генома и транскриптома у ряда полиплоидов была выявлена значительная скорость эволюции гомеологичных генов и существенные изменения картины экспрессии у части из них (неофункционализация), что является косвенным подтверждением указанных путей эволюции [31], [32]. Так, у гексаплоидной пшеницы процесс псевдогенизации затронул 38% экспрессирующихся генов, как было установлено по наличию в этих генах терминирующих кодонов [31].
Заключение
Таким образом, накопленные научные данные подтвердили правильность гипотезы Б. Мак-Клинток о геномном шоке, который является мощным фактором ремоделирования генома, — своего рода испытанием на прочность вновь образованного полиплоидного организма. Использование уникальной модели синтетических аллополиплоидов позволило установить, что уже на ранних стадиях формирования аллополиплоида происходят: хромосомные реорганизации, изменения паттерна метилирования ДНК, активация мобильных генетических элементов и изменения транскриптома. Все эти изменения обеспечивают стабилизацию генотипа аллополиплоида, восстановление его фертильности и расширение адаптационного потенциала, что позволяет осваивать новые экологические ниши и обусловливает эволюционный успех полиплоида в конкуренции с диплоидными видами.
И, возвращаясь к сказке про трех поросят: жить вместе в одном доме оказывается намного надежней и безопасней. Если только научиться ладить друг с другом. «Хоть полсвета обойдешь, обойдешь, обойдешь — лучше дома не найдешь, не найдешь, да!».
Автор выражает благодарность д.б.н. Е.К. Хлесткиной за талантливое оформление отдельных рисунков (рис. 3, сверху; рис. 4, сверху; рис. 5, справа; рис. 6).
Литература
- L. Cui. (2006). Widespread genome duplications throughout the history of flowering plants. Genome Research. 16, 738-749;
- McClintock B. (1953). Induction of instability at selected loci in maize. Genetics. 38, 579–599;
- Alu: история одной последовательности;
- Новое в изучении «прыгающих генов»;
- Тайны «молекулярных паразитов», или Как путешествовать по геному;
- Разнообразия много не бывает: чем занимаются мобильные элементы генома в мозге;
- Christian Parisod, Karine Alix, Jérémy Just, Maud Petit, Véronique Sarilar, et. al.. (2010). Impact of transposable elements on the organization and function of allopolyploid genomes. New Phytologist. 186, 37-45;
- Z. Jeffrey Chen, Zhongfu Ni. (2006). Mechanisms of genomic rearrangements and gene expression changes in plant polyploids. Bioessays. 28, 240-252;
- R. Keith Slotkin, Robert Martienssen. (2007). Transposable elements and the epigenetic regulation of the genome. Nat Rev Genet. 8, 272-285;
- Загадочное путешествие некодирующей РНК Xist по X-хромосоме;
- Thomas Wicker, François Sabot, Aurélie Hua-Van, Jeffrey L. Bennetzen, Pierre Capy, et. al.. (2007). A unified classification system for eukaryotic transposable elements. Nat Rev Genet. 8, 973-982;
- Ray K. Ng, John B. Gurdon. (2008). Epigenetic inheritance of cell differentiation status. Cell Cycle. 7, 1173-1177;
- Alberts B., Johnson A., Lewis J., Raff M., Roberts K., Walter P. Molecular Biology of the Cell (5th Edition). Garland Science, 2008. — 1392 p.;
- Обо всех РНК на свете, больших и малых;
- M. Ha, J. Lu, L. Tian, V. Ramachandran, K. D. Kasschau, et. al.. (2009). Small RNAs serve as a genetic buffer against genomic shock in Arabidopsis interspecific hybrids and allopolyploids. Proceedings of the National Academy of Sciences. 106, 17835-17840;
- Matthew J. Hegarty, Simon J. Hiscock. (2004). Hybrid speciation in plants: new insights from molecular studies. New Phytologist. 165, 411-423;
- Robert T. Gaeta, J. Chris Pires. (2010). Homoeologous recombination in allopolyploids: the polyploid ratchet. New Phytologist. 186, 18-28;
- Simon Griffiths, Rebecca Sharp, Tracie N. Foote, Isabelle Bertin, Michael Wanous, et. al.. (2006). Molecular characterization of Ph1 as a major chromosome pairing locus in polyploid wheat. Nature. 439, 749-752;
- Moshe Feldman, Avraham A. Levy. (2009). Genome evolution in allopolyploid wheat—a revolutionary reprogramming followed by gradual changes. Journal of Genetics and Genomics. 36, 511-518;
- Richard J.A. Buggs, Linjing Zhang, Nicholas Miles, Jennifer A. Tate, Lu Gao, et. al.. (2011). Transcriptomic Shock Generates Evolutionary Novelty in a Newly Formed, Natural Allopolyploid Plant. Current Biology. 21, 551-556;
- Navashin M.S. (1928). «Amphiplastie» — eine neue karyologische Erscheinung. Verh. V Intern. Kongr. Vererbungswissenschaft. Berlin; Leipzig. 2, 1148–1152;
- Размер имеет значение;
- Sasha B. Preuss, Pedro Costa-Nunes, Sarah Tucker, Olga Pontes, Richard J. Lawrence, et. al.. (2008). Multimegabase Silencing in Nucleolar Dominance Involves siRNA-Directed DNA Methylation and Specific Methylcytosine-Binding Proteins. Molecular Cell. 32, 673-684;
- Bao Qi, Wei Huang, Bo Zhu, Xiaofang Zhong, Jianhua Guo, et. al.. (2012). Global transgenerational gene expression dynamics in two newly synthesized allohexaploid wheat (Triticum aestivum) lines. BMC Biology. 10, 3;
- R. Hovav, J. A. Udall, B. Chaudhary, R. Rapp, L. Flagel, J. F. Wendel. (2008). Partitioned expression of duplicated genes during development and evolution of a single cell in a polyploid plant. Proceedings of the National Academy of Sciences. 105, 6191-6195;
- Jianlin Wang, Lu Tian, Hyeon-Se Lee, Ning E. Wei, Hongmei Jiang, et. al.. (2006). Genomewide Nonadditive Gene Regulation in Arabidopsis Allotetraploids. Genetics. 172, 507-517;
- Andreas Madlung, Ricardo W. Masuelli, Brian Watson, Steve H. Reynolds, Jerry Davison, Luca Comai. (2002). Remodeling of DNA Methylation and Phenotypic and Transcriptional Changes in Synthetic Arabidopsis Allotetraploids. Plant Physiol.. 129, 733-746;
- Пилюли для эпигенома;
- Bhupendra Chaudhary, Lex Flagel, Robert M. Stupar, Joshua A. Udall, Neetu Verma, et. al.. (2009). Reciprocal Silencing, Transcriptional Bias and Functional Divergence of Homeologs in Polyploid Cotton (Gossypium). Genetics. 182, 503-517;
- Christian Jung, Andreas E. Müller. (2009). Flowering time control and applications in plant breeding. Trends in Plant Science. 14, 563-573;
- Eduard D. Akhunov, Sunish Sehgal, Hanquan Liang, Shichen Wang, Alina R. Akhunova, et. al.. (2013). Comparative Analysis of Syntenic Genes in Grass Genomes Reveals Accelerated Rates of Gene Structure and Coding Sequence Evolution in Polyploid Wheat. Plant Physiol.. 161, 252-265;
- M-J Yoo, E Szadkowski, J F Wendel. (2013). Homoeolog expression bias and expression level dominance in allopolyploid cotton. Heredity. 110, 171-180.







