
Фаговый домик. А в ваши строительные магазины уже завезли фаговые нанопровода?
11 ноября 2016
Фаговый домик. А в ваши строительные магазины уже завезли фаговые нанопровода?
- 1038
- 4
- 0
Избушка на «фаговых ножках»
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Что для вас бактериофаги? Какие ассоциации возникают, когда вы слышите слово «фаг»? Лично мне на ум приходит фаговый дисплей, фаговая терапия, фаговая группа (основанная Дельбрюком и Лурией). Предполагаю, что кто-то сначала вспомнит о строении бактериофагов, другие — о жизненном цикле. Но, как мне кажется, про наноматериалы на основе фагов почти никто не подумает (разумеется, кроме тех, кто уже занят разработкой подобных инноваций). Идея «фагового домика» крепко засела у меня в голове. Давайте вместе посмотрим на современное состояние «рынка» фаговых наноматериалов.
«Био/мол/текст»-2016
Эта работа опубликована в номинации «Бионанотехнология» конкурса «био/мол/текст»-2016.

Спонсор номинации — Фонд инфраструктурных и образовательных программ Роснано.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
Спонсор публикации этой статьи — Ольга Посух.
Действие даже самого крохотного существа приводит к изменениям во всей вселенной.
Н. Тесла
Бактериофаги (или просто фаги) — это вирусы, поражающие бактерий. Открыты бактериофаги были в 1915 и 1917 годах благодаря способности вызывать клеточный лизис на бактериальном газоне [1]. И уже тогда стал очевиден потенциал фагов как антибактериальных агентов и средств терапии. Правда, из-за открытия антибиотиков интерес к фагам как к лекарственным средствам немного угас. Однако фаги играли важнейшую (если не лидирующую) роль в развитии молекулярной биологии. В 1940-х годах появились разные группы физиков и биологов, которые для того, чтобы понять природу генов, использовали фаги в качестве экспериментальной модели [1]. А в последнее время интерес к фаговой терапии снова возрос, появилось много разных лекарств на основе фагов в связи с увеличением количества антибиотико-резистентных бактерий (рис. 1). Кроме того, фаги используют как средства доставки лекарств и вакцин, а также для сборки наноматериалов. Наноматериалы на основе фагов? Звучит экзотично. Но на самом деле все оказалось красиво и логично, как и сами эти материалы (по моему скромному мнению, они именно такие).

Рисунок 1. Бактериофаг, который хочет лечить.
сайт redbubble.com
Для начала нужно посмотреть на бактериофаг с другой стороны. Теперь для нас фаг —это бионановолокно, обладающее поверхностью, которую можно «настроить» по вашему желанию, используя генно-инженерные методы. То есть, как личинка ручейника строит себе домик из песчинок, растительных остатков, раковинок, так и бактериофаг строит себе домик из своих поверхностных белков. Однако если вмешивается человек, то, как ручейник может начать строить домик из несвойственных ему в природе материалов (ручейники-пижоны строят домики из золотых обрезков, кусочков опала, бирюзы, рубина и жемчуга — рисунок 2), так и фаг начинает экспрессировать на поверхности несвойственные ему белки, «пришитые» к своим родным, а то и «строить домик» из магнитных наночастиц.

Рисунок 2. Вот такой могла бы быть обложка журнала «Mode for Insects», если бы французский дизайнер Хьюберт Дюпрат предоставил свои модели.
изображения личинок ручейников с ювелирными домиками взяты с сайта infoniac.ru
Намагниченные фаги
Фаги можно «украсить» магнитными наночастицами (МНЧ) , чтобы затем, создав внешнее магнитное поле, уложить полученные комплексы в горизонтально ориентированный выровненный массив. МНЧ как компонент бионановолокон были выбраны не случайно. Люди часто обращаются к природе за вдохновением. Вот и этот случай не является исключением. Источником вдохновения стали магниточувствительные бактерии (magnetotactic bacteria, MTB) [2], [3], способные использовать железо и переводить его в магнитные наночастицы in vivo (такие как Fe3O4 или Fe3S4). В результате эти бактерии ориентируются вдоль линий магнитного поля Земли, так как содержат МНЧ. Собственно такая управляемая магнитным полем ориентация бактерий вдохновила ученых на использование магнитного поля для сборки бионановолокон с помощью МНЧ [4]. Вспоминается детский мультфильм: «По щучьему велению, по моему хотению, ступайте, фаги, укладываться в структуры сами» (рис. 3). «Щучьим велением» в данном случае, будет магнитное поле.
О вирусах как платформах для создания принципиально новых наноматериалов «биомолекула» рассказывала в статье «Вирусы-платформы: яд во благо» [5]. Конкретно адресная доставка медпрепаратов с помощью вируса мозаики огурца рассмотрена в конкурсной работе 2013 года «„Огуречная“ мечта» [6]. А в этом году в «био/мол/тексте» участвует много авторов с разноплановыми работами по наночастицам — здесь и проза, и стихи, и даже повесть в стиле Эразма Роттердамского: «„Мал золотник, да дорог“, или об использовании золотых наночастиц в бионанотехнологиях» [7], «Баллада о чудо-гантелях» [8] и «Повесть о наночастицах» [9]. — Ред.

Рисунок 3. Фаги, повинуясь словам Емели, идут укладываться в горизонтально ориентированные выровненные структуры
Итак, магнитное поле способно управлять сборкой нитевидных надмолекулярных структур (рис. 4). Это происходит за счет того, что положительно заряженные магнитные наночастицы (состоящие из Fe3O4) взаимодействуют с отрицательно заряженными бионановолокнами. В результате формируется комплекс МНЧ-бионановолокна [4]. Такие комплексы как раз и можно «укладывать» с помощью магнитного поля в один слой, несколько слоев или же вертикально (рис. 4б–г).
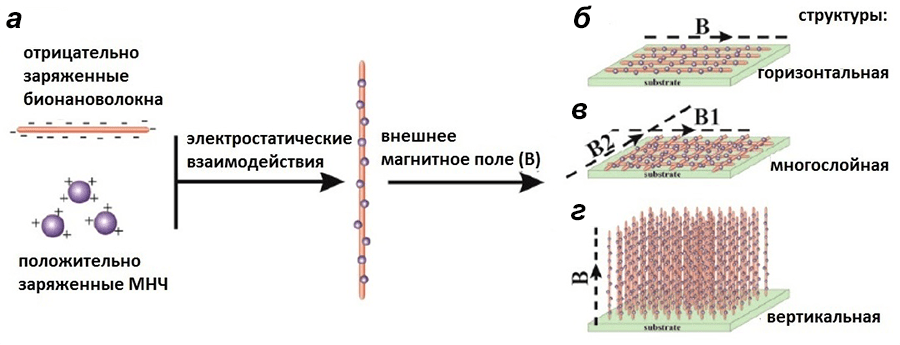
Рисунок 4. Использование магнитного поля для управления сборкой нитевидных надмолекулярных структур, взаимодействующих с магнитными наночастицами (МНЧ). а — Общая схема метода. б — Ориентированные в одной плоскости параллельно-выровненные структуры. в — Множественно-ориентированные многослойные бионановолоконные структуры, сформированные вращением направления действия магнитного поля для каждого соседнего слоя. Первый параллельный бионановолоконный слой формируется под действием одного магнитного поля (В1), другой Fe3O4-слой параллельно выровненных бионановолокон укладывается под действием магнитного поля с другим направлением (B2). г — Вертикально выравненные бионановолоконные структуры за счет магнитного поля, направленного перпендикулярно к субстрату.
[11], рисунок адаптирован
Расскажу немного подробнее о создании таких структур. Это — несложный процесс, особенно если у вас завалялась пара неодимовых магнитов. Сначала раствор с магнитными наночастицами Fe2O3 смешивают с раствором бионановолокон (рис. 5) — если вы используете фаги, то с концентрацией 1013 бляшко-образующих единиц на 1 мл (БОЕ/мл). Далее, в течение всего 10 секунд (!) при комнатной температуре образуются комплексы МНЧ-бионановолокна. После этого смесь сушат на воздухе на специальном покрытии в постоянном магнитном поле с определенным направлением и силой. Результаты смотрят в световом микроскопе или, если у вас оказалось в заначке немного платины, то покрывают платиной и далее характеризуют с помощью растровой электронной микроскопии (РЭМ) — рисунок 6. Чтобы создать подходящее магнитное поле, ученые используют два параллельно расположенных цилиндрических неодимовых магнита [4].

Рисунок 5. МНЧ и комплексы МНЧ-бионановолокна, полученные с помощью просвечивающего электронного микроскопа (ПЭМ). а — Синтезированные МНЧ из Fe3O4. б — Комплексы МНЧ-фаги. Наночастицы располагаются на поверхности бионановолокон.
[4], рисунок с изменениями

Рисунок 6. Ориентированные в одном направлении горизонтально выровненные Fe2O3 МНЧ и комплексы МНЧ-бионановолокна при воздействии магнитного поля (В, направление указано стрелкой). a — Выровненные МНЧ. б — Выровненные комплексы МНЧ-фаги. Изображения получены с помощью растрового электронного микроскопа (РЭМ)
[4], рисунок с изменениями
С тех пор, как появилась возможность «программировать» бионановолокна для отображения функциональных пептидов на их поверхностях и «украшать» функциональными наночастицами, ориентированный комплекс таких модифицированных бионановолокон стало возможным применять при разработке функциональных приборов в материаловедении, магнетизме, электронике, тканевой инженерии и наномедицине. В тканевой инженерии данные магнитные «строительные леса» могут использоваться для улучшения адгезии, пролиферации и дифференцировки резидентных клеток [4].
На пути к фаговым проводам
Было показано, что с помощью фага, экспрессирующего на своей поверхности способный связывать полупроводники пептид, можно получить монокристаллические полупроводниковые нанопровода . Стратегия получения таких нанопроводов состоит из трех шагов.
Шаг первый: определить мишень-связывающий пептид с помощью метода biopanning (аффинной селекции белков, связывающихся с заданной мишенью).
Шаг второй: генетически модифицировать фаг таким образом, чтобы данный пептид был встроен в боковую стенку фага.
Шаг третий: полученный фаг использовать в качестве шаблона для синтеза или сборки наночастиц.
Вдохновленные этой стратегией ученые создали уникальные наноструктуры из оксида кремния, гидроксиапатита и золота [10], [11].
Нанопровода можно делать и из бактериальных пилей. По крайней мере, так предлагают ученые из Университета Массачусетса: «Металлическая проводимость биологических структур» [12]. — Ред.
Сначала был разработан общий метод использования поверхностных белков — «биошаблонов» — для катализа гидролиза органосиликатных предшественников и последующей поликонденсации с образованием диоксида кремния. Затем этот метод применили для создания высокоупорядоченных мезопористых (а значит, с диаметром пор 2–50 нм) кремнеземных волокон с использованием в качестве биошаблона нитевидного фага fd. Поры организованы в шестиугольники [11].
Снова обращаясь к природе за вдохновением, можно заметить, что нитевидные бактериофаги (такие как М13 и fd) являются морфологически сходными со стержнеобразными мицеллами, а также обладают большей монодисперсностью, чем мицеллы поверхностно-активного вещества. Кроме того, бактериофаги легко образуют лиотропную жидкокристаллическую (ЖК) фазу посредством самосборки. В качестве примера можно привести полугибкие нитевидные фаги fd и M13 с размерами около 880 нм в длину и 7 нм в ширину, которые можно изобразить как упорядоченную сборку оболочечных белков вдоль замкнутой одноцепочечной ДНК. Эти фаги обладают высоким процентным соотношением сторон и способны к самоорганизации в ЖК-структуры [13]. Такие высокие уровни монодисперсности и анизотропности бактериофагов, однако, раньше не были использованы для успешного синтеза мезопор оксида кремния, организованных в пространственную решетку.
В природе встречаются невероятно сложные минерализованные структуры, которые образованы путем самосборки специфических белков, управляющих биоминерализацией в условиях окружающей среды. В качестве одного из самых ярких примеров можно привести диатомовые водоросли, которые образуют наноструктурированные диоксидом кремния стенки под руководством ряда специализированных поликатионных пептидов — силаффинов (silaffins или siliffins) (рис. 7) [13]. Силаффины способны в течение нескольких секунд полимеризовать наносферы диоксида кремния после добавления кремниевой кислоты. Силаффины содержат ковалентно модифицированные пары лизин-лизин, которые существенно влияют на их активность по отношению к диоксиду кремния [14].
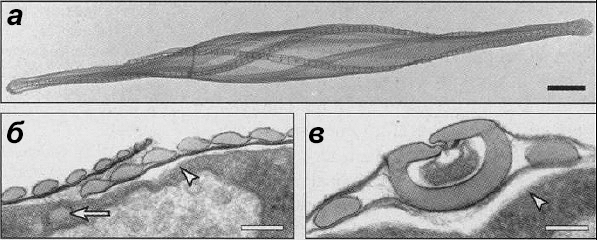
Рисунок 7. Ультраструктура клеточной стенки диатомовой водоросли Cylindrotheca fusiformis. Изображение получено с помощью ПЭМ. а — Изолированная клеточная стенка. Ряды параллельных полос кремнезема идут по спирали вдоль продольной оси клетки. б и в — Подробное изображение клеточной стенки в поперечном разрезе. Стрелки указывают на положение плазматической мембраны и на внеклеточное пространство. б — Боковая зона. Каждый овал — это одинарная полоска кремнезема в клеточной стенке. Стрелка указывает на появление новой полоски из диоксида кремния. в — Область клапана. Кольцеобразный и два овальных элемента — окремненные элементы клеточной стенки.
Так как чужеродные пептиды могут быть «пришиты» к поверхностным белкам бактериофагов, а заряд поверхностных белков очень сильно влияет на самосборку фагов, то можно управлять созданием наноструктур на их основе, контролируя плотность заряда поверхности. Разместив пептиды с различными зарядами на боковой стенке нитевидного бактериофага, ученые продемонстрировали способность успешно контролировать образование кремниевых наноструктур через управление поверхностной плотностью заряда бактериофага и сопутствующее «самосборочное поведение» фага. Чужеродный пептид «генетически пришивали» к N-концевому домену белка p8, что позволило контролировать химические свойства поверхности стенки фага [13].
Механизм образования мезопористных волокон из оксида кремния представлен на рисунке 8. Получение этих структур было достигнуто за счет использования 3-аминопропилтриэтоксисилана (APTES) в качестве структурно-направляющего агента и предварительно гидролизованного тетраэтоксисилана (TEOS) в качестве ростового фактора [13].
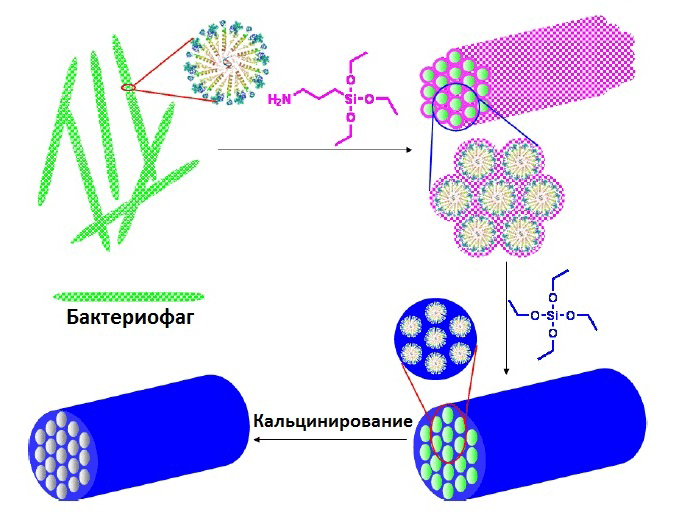
Рисунок 8. Механизм образования гексагональных мезопор оксида кремния, управляемый бактериофагами. Вставки показывают поперечный разрез комплекса, образованного бактериофагами. Точки фуксинового цвета показывают поли- и олигогидролизованные APTES, которые заякорены в поверхности бактериофага. Они функционируют как «ядро» для последующей поликонденсации с TEOS. Голубым цветом обозначены сформированные связи из оксида кремния с помощью TEOS-поликонденсации на «ядре».
[13], рисунок адаптирован
И растровая, и просвечивающая электронные микроскопии позволили выявить образование волокон из оксида кремния с длиной в диапазоне от нескольких микрометров до нескольких десятков микрометров (рис. 9а). После получения изображений с более высоким разрешением (ПЭМ) стало ясно, что на самом деле эти волокна — пучки узких кремниевых волокон с однородным диаметром от 70 до 80 нм (рис. 9б, 9в). Чтобы освободить нановолокна от фагов, их прокаливают (кальцинируют) при температуре 550 °С в течение четырех часов на воздухе. За счет этого получаются параллельно выровненные и одинаковые по размеру каналы, которые проходят через все волокно из оксида кремния (рис. 9в).

Рисунок 9. Регулируемые фагами мезопористые кварцевые волокна. а — Крупные волокна из оксида кремния (длиной до десяти микрометров), позже оказавшиеся скоплениями нановолокон с диаметром 70–80 нм. Фотографии с РЭМ. б и в — Фотографии в высоком разрешении с ПЭМ, только синтезированных (б) и уже кальцинированных (в) нановолокон.
Чтобы проверить, действительно ли внутри получилась выровненная структура в соответствии со структурой выбранных шаблонов-фагов, были изготовлены срезы с помощью микротома и проведена последующая ПЭМ. Изображения, полученные с просвечивающего электронного микроскопа, показывают шестиугольное расположение фагов и каналов в полученных нановолокнах из диоксида кремния (рис. 10а и 10в). Также было отмечено, что добавление APTES к суспензии фага fd индуцирует агрегацию вируса и образование слоистых структур (рис. 10б).

Рисунок 10. ПЭМ-изображения поперечного сечения нановолокон после синтеза (а) и кальцинирования (в). б — Взаимодействия, индуцированные APTES.
[13], рисунок с изменениями
Другой интересный момент — в зависимости от того, какой фаг выбран в качестве шаблона, морфологическая структура итоговых кремниевых нановолокон будет различна. Образование гексагональных комплексов оксида кремния и фагов управляется за счет согласования плотности поверхностных зарядов между бактериофагом и силикатной породой. Так, сконструировали три отличающихся друг от друга фага (E8-M13, M13 и R4-M13) с различными поверхностными зарядами за счет изменения поверхностных белков. В результате даже длины волокон оказались разными: 2–3 мкм, 10–15 мкм и примерно 1 мкм соответственно (рис. 11) [13].
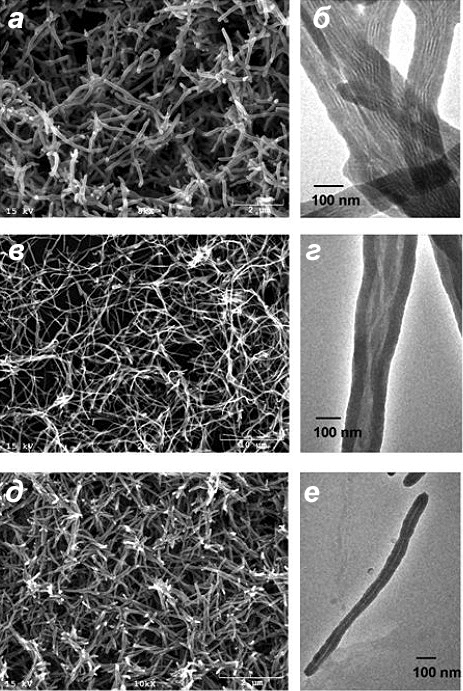
Рисунок 11. Электронная микроскопия кварцевых волокон, синтезированных с использованием различных фагов в качестве шаблонов: E8-M13 (а — РЭМ, б — ПЭМ), дикого типа М13 (в — РЭМ, г — ПЭМ) и R4-M13 (д — РЭМ, е — ПЭМ). Фаг Е8-М13 несет анионные пептиды, а R4-М13 катионные пептиды на поверхности.
Высокоорганизованные мезопористые структуры на основе оксида кремния обладают рядом привлекательных качеств, таких как большая площадь поверхности и равномерные размеры пор. Поэтому есть множество возможностей применения данных структур в катализе, биоадсорбции, в нанореакторах и для доставки лекарственных средств [13].
Батарейки PhageEatsCell — работают до 10 раз дольше
Ученые использовали бактериофаг M13 для синтеза и сборки нанопроводов из оксида кобальта с целью последующего изготовления электродов батарей (рис. 12). Оксид кобальта обладает прекрасными электрохимическими свойствами: он из семейства новых литий-активных веществ, обладает очень большой обратимой емкостью хранения, возникающей в результате реакций замещения, — примерно в три раза большей, чем емкость карбоновых анодов, применяемых в настоящее время в коммерческих батареях [15].

Рисунок 12. Батарейка PhageEatsCell
Все это позволило оксиду кобальта стать одним из основных кандидатов при выборе материала электродов для создания улучшенных литиевых батарей. «Как же связаны фаги и литиевые батареи?» — спросите вы. Суть метода проста: связывающие золото пептиды были «пришиты» к белку оболочки (p8), что позволило создать прекрасный каркас для направленного синтеза полупроводниковых и магнитных материалов (рис. 13) [15], [16].
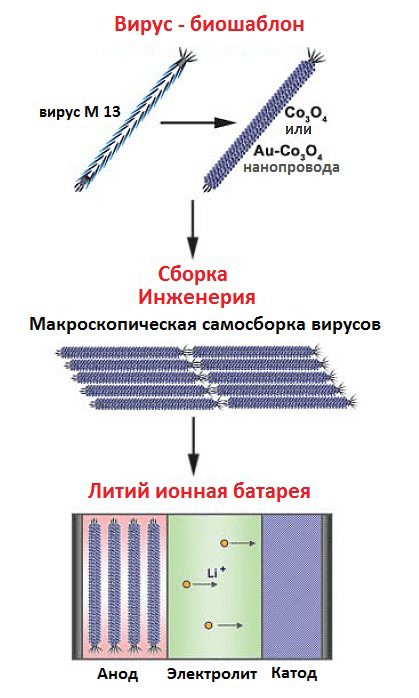
Рисунок 13. Схема синтеза и сборки нанопроводов с помощью вируса-шаблона. Специфические (или специально созданные) пептиды определяются методом biopanning. Выбранные белки экспрессируются на главном поверхностном белке фага М13 (белке p8) для «выращивания» Co3O4- и Au-Co3O4-нанопроводов. Макроскопическое упорядочивание созданных вирусов нужно для формирования монослоя из Co3O4-проводов с получением в результате гибких, легких и прекрасных во всех отношениях литий-ионных батарей.
[15], рисунок адаптирован
После сборки нанопроводов наступает черед избавиться от «расходных материалов». Бактериофаги становятся не нужными, их отжигают. Этот шаг обеспечивает ориентированный, основанный на агрегации рост кристаллов, при этом формируются единичные кристаллические нанопровода.
Сам бактериофаг М13 в качестве шаблона был выбран не случайно. Это высокопродуктивный вирус (200 мг/л), содержащий пять белков, которые можно генетически модифицировать: p3, p6, p7, p8 и p9. Белок p8 является основным поверхностным белком, и около 2700 его копий формируют капсид фага М13. Как раз белок p8 и был генетически изменен и экспрессирован с помощью фагмидной технологии. К N-концевому домену белка p8 «пришили» субстрат-специфичные пептиды [15], [16]. Изменения в фаговых белках использовали при последующем формировании функциональных шаблонов с различной структурой для точного расположения наноматериалов.
Ученые сначала «вырастили» нанопровода из Co3O4, в которых нанокристаллы оксида кобальта диаметром примерно в 2–3 нм были равномерно минерализованы по всей длине вируса (рис. 14).

Рисунок 14. Нанопровода из оксида кобальта, полученные на фаговом шаблоне. а — ПЭМ-изображение нанопроводов, образованных на фаге М13. Чтобы можно было различить отдельные провода, исходный раствор развели в 100 раз. б — ПЭМ-изображение нанопровода, полученное с высоким разрешением. Справа сверху — изображение электронной дифракции образца, подтверждающее кристаллическую структуру Co3O4. Справа снизу — увеличенное изображение провода, показывающее края решетки из нанокристаллов оксида кобальта вдоль вирусного белка p8.
Затем, вставив связывающие золото пептиды в белки оболочки, создали гибридные провода из золото-кобальтовых оксидов (рис. 15), которые еще увеличили емкость батарей. Идея добавить золотые наночастицы в «фагобатарейку» появилась на основе того, что золотые наночастицы способны обеспечить высокую электрическую проводимость там, где это необходимо, способны поддерживать термодинамически устойчивое взаимодействие с Co3O4, а также обладают потенциалом для катализа электрохимических реакций на наноуровне [15].

Рисунок 15. Гибридные наноструктуры из наночастиц золота, внедренных в нанопровода из Co3O4. а — Изображение генетически модифицированного фага М13. Белки p8, содержащие золото-связывающие мотивы, обозначены желтым цветом. б — ПЭМ-изображения собранных на вирусе золотых наночастиц. Контрольные эксперименты показали, что золотые наночастицы связаны золото-специфичными пептидами. в — ПЭМ-изображение гибридных нанопроводов из частиц золота и оксида кобальта.
[15], рисунок адаптирован
Упорядочивание сконструированных вирусов обусловлено конкурентными электростатическими взаимодействиями, а также взаимной диффузией полиэлектролита и анизотропной формы вирусов M13. Используя эту технику для спонтанного упорядочивания вирусов Е4 с последующим ростом нанокристаллов Co3O4 на белках оболочки, ученые изготовили двухмерно организованные сборки нанопроводов размером в 10 см (рис. 16) [15].
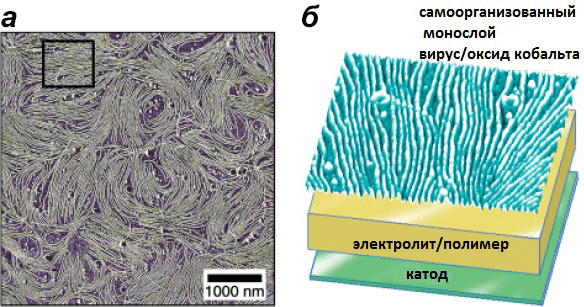
Рисунок 16. Двухмерная сборка нанопроводов из Co3O4, управляемая жидкокристаллическим упорядочиванием сконструированных бактериофагов М13 (а и б). Изображение получено в фазовом режиме атомно-силового микроскопа. Видны макроскопически упорядоченные монослои из вирусов, «одетых» в оксиды кобальта.
[15], рисунок адаптирован

Рисунок 17. Гибкая и прозрачная пленка, на которой Co3O4-вирусные нанопровода собраны в наноструктурированный монослой с размерами 10×4 см.
Изменять промежутки между нанопроводами и упорядочивающее поведение нанопроводов можно путем контроля поверхностного заряда и жидкостных сил. Более того, толщина многослойного полимера может варьировать от 10 нм до нескольких микрометров независимо от субстрата. Благодаря процессу самосборки получаются легкие, эластичные и прозрачные активные материалы или субстратные мультислои, сконструированные как свободно стоящие пленки простым методом погружения (рис. 17) [15].
Таким образом, сочетание синтеза на фаге-шаблоне с методами контроля двухмерной сборки вирусов на полиэлектролитных мультислоях предоставляет систематическую платформу для использования этих материалов при формировании тонких и гибких литиево-ионных батарей .
А в пущинском Институте белка РАН предлагают альтернативу фаговому аноду — анод на основе жгутиков архей: «Аноды для новых аккумуляторов на основе жгутиков архей» [17]. — Ред.
Вирусные провода в ассортименте
Ученые разработали схему общего синтеза одномерных наноструктур на основе генетически модифицированных фагов как шаблонов для направленного роста и сборки кристаллических наночастиц в одномерные массивы с последующим отжигом вирусных частиц. Полученные структуры характеризовались высоким соотношением кристаллических нанопроводов за счет ориентированного роста агрегированных кристаллов [16].
Сама минерализация сульфидов цинка или кадмия на фаге-шаблоне включает в себя инкубирование фага с предшественниками солей металлов при пониженной температуре, что способствует однородной ориентации молекул белков в процессе образования «ядра». Эта процедура приводит к желаемой кристаллографической ориентации «ядросодержащих» нанокристаллов (рис. 18а–в). Отжиг минерализованных вирусов при температуре ниже точки плавления частиц ZnS и CdS (400–500 °С) позволяет образовывать поликристаллические структуры с образованием монокристаллических нанопроводов (рис. 19) путем удаления органической матрицы и минимизации энергии на границе раздела фаз [16].
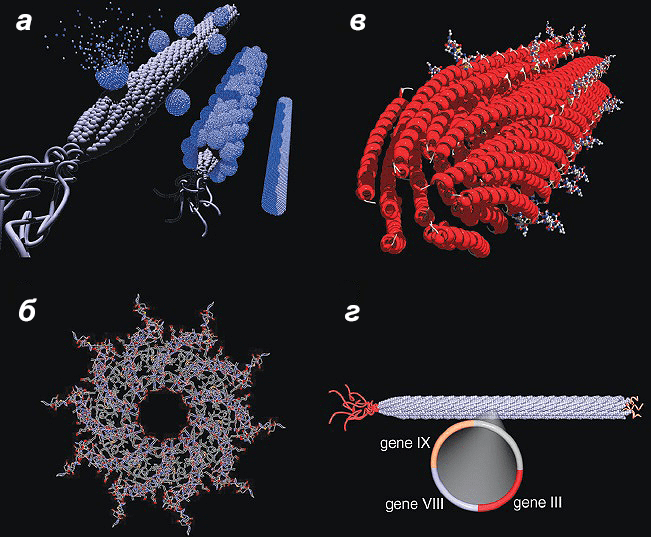
Рисунок 18. Бактериофаг М13 и последующий синтез нанопроводов. Белки р3 и р9 изображены без соблюдения масштаба. а — Схема синтеза нанопроводов: образование «ядра», упорядочивание элементов, отжиг фагов. б — Симметрия вируса позволяет упорядочивать ядросодержащие частицы вдоль осей х, у и z, выполняя необходимые требования для отжига на основе агрегирования. в — Высокоупорядоченная природа самособирающихся фагов М13 способствует ориентации «ядер» в нужном направлении за счет жестокости и упаковки экспрессируемых пептидов. г — Схема фага М13, показывающая генетически измененные капсид и концы фага.

Рисунок 19. Электронные микрофотографии нанопроводов из сульфида цинка. а — Типичное ПЭМ-изображение нанопровода из единичных кристаллов ZnS, полученное с высоким разрешением. Видно «решетку», которая простирается по всей длине провода. Наличие решетки подтверждает, что данный провод имеет однокристальную природу. Плоскости решетки располагаются под углом в 30°. б — Однокристальные ZnS нанопровода, которые отжигали на кремниевой пластине. Изображение получено с помощью просвечивающего растрового электронного микроскопа (ПРЭМ) методом кольцевого темнопольного изображения под большим углом (high-angle annular dark-field imaging, HAADF).
Аналогичным образом были созданы нанопровода из сульфида кадмия. Также данный подход вирус-направленного синтеза использовали для разработки ферромагнитных систем на основе кобальта-платины и железа-платины (рис. 20). Это направление служит как для демонстрации разнообразия применяемых материалов, так и для решения текущих технических вопросов, касающихся развития низкоразмерных магнитных материалов [16].

Рисунок 20. ПЭМ-изображения FePt нанопроводов: а — до отжига, б — после отжига. Врезка — изображение дифракции электронов, подтверждающее железо-платиновую и кристаллическую природу нанопроводов.
Поскольку вирусы могут собираться в структуры различной длины, существует возможность для проектирования иерархических самособирающихся батарей.
Уникальная способность изменять субстрат-специфичные пептиды в линейных самоорганизующихся нитчатых конструкциях фагов приводит к возможности «легкой настройки» материала. Достигнуть подобной настройки было невозможно, используя уже имеющиеся пути синтеза нанопроводов. Поэтому можно сказать, что данная система обеспечивает генетический набор инструментов для выращивания и упорядочивания нанопроводов из различных полупроводниковых и магнитных материалов. Дальнейший прогресс в изготовлении наноразмерных материалов и устройств может быть достигнут за счет модификации остальных четырех белков вируса, чтобы добавить «векторы» сборки. Модификация биологических систем введением субстрат-специфичных пептидов представляет собой средство получения высокоупорядоченных наноматериалов экономически эффективным и масштабируемым образом [16].
В заключение хочется еще раз отметить широкий диапазон возможностей применения бактериофагов. Здесь была рассмотрена лишь часть наноматериалов, созданных на основе фагов. Такие наноматериалы также используют для создания биодатчиков в процессе регенерации тканей и даже в качестве антибактериальных материалов [18]. А я надеюсь, что теперь в вашем ряду «фаговых ассоциаций» закрепятся фаговые бионановолокна, фаговые батарейки и нанопровода.
Литература
- Knipe D.M. and Howley P.M. Fields virology (6th Edition), vol. 2. Philadelphia, 2013. — 2384 p.;
- Роль биогенных нанокристаллов в работе биологической «машины времени»;
- Нобель vs Шнобель, или Механизмы магниторецепции;
- Cao B., Zhu Y., Wang L., Mao C. (2013). A general approach to controlled alignment of filamentous supra-biomolecular assemblies into centimeter-scale highly-ordered patterns through nature-inspired magnetic guidance. Angew. Chem. Int. Ed. Engl. 52, 11750–11754;
- Вирусы-платформы: яд во благо;
- «Огуречная» мечта;
- «Мал золотник, да дорог», или об использовании золотых наночастиц в бионанотехнологиях;
- Баллада о чудо-гантелях;
- Повесть о наночастицах;
- Гидроксилапатит — самый главный из фосфатов кальция;
- Cao B., Yang M., Mao C. (2016). Phage as a genetically modifiable supramacromolecule in chemistry, materials and medicine. Acc. Chem. Res. 49, 1111–1120;
- Металлическая проводимость биологических структур;
- Mao C.B., Wang F.K., Cao B.R. (2012). Controlling nanostructures of mesoporous silica fibers by supramolecular assembly of genetically modifiable bacteriophages. Angew. Chem. Int. Ed. Engl. 51, 6411–6415;
- Kröger N., Deutzmann R., Sumper M. (1999). Polycationic peptides from diatom biosilica that direct silica nanosphere formation. Science. 286, 1129–1132;
- Nam K.T., Kim D.W., Yoo P.J., Chiang C.Y., Meethong N., Hammond P.T. et al. (2006). Virus-enabled synthesis and assembly of nanowires for lithium ion battery electrodes. Science. 312, 885–888;
- Mao C., Solis D.J., Reiss B.D., Kottmann S.T., Sweeney R.Y., Hayhurst A. et al. (2004). Virus-based toolkit for the directed synthesis of magnetic and semiconducting nanowires. Science. 303, 213–217;
- Аноды для новых аккумуляторов на основе жгутиков архей;
- Pires D.P., Cleto S., Sillankorva S., Azeredo J., Lu T.K. (2016). Genetically engineered phages: a review of advances over the last decade. Microbiol. Mol. Biol. Rev. 80, 523–543.







