Биофизика для каждого
23 октября 2019
Биофизика для каждого
- 11174
- 3
- 15
Липидный бислой с рецепторами
кадр из анимации с YouTube
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Биофизика — наука на стыке биологии, физики и... химии, а также медицины и математики. Биофизика проникает во все разделы биологии и является бесспорным помощником при анализе результатов. Быть биофизиком — значит уметь читать спектры. Быть биофизиком — значит уметь увидеть за одинокой вспышкой молекулы целую жизнь клетки. Быть биофизиком — значит моделировать сложные биохимические и биофизические процессы в клетках, мембранах, ДНК и даже биостанциях. В этом году состоялся VI Съезд биофизиков России, на котором были обнародованы многие достижения современной биофизики.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Немного о биофизике
Когда человек впервые слышит слово «биофизика», в его голове сразу же всплывают сложные образы. Особенно страшные встают перед глазами биологов, ведь, казалось бы, откуда в биологии взяться физике? Ответ прост — все биологические процессы очень тесно связаны с химией и физикой, ведь жизнь биологических объектов осуществляется главным образом за счет передвижения биологических молекул и ионов совместно с протеканием электрических импульсов. Откуда взяться физике при изучении отдельных биологических молекул? Всё опять просто — дело в том, что все биологические молекулы состоят из атомов, а значит, имеют электронное облако, заряд и спин.
Что же такое биология? Согласно определению Джона Бернала, «биология — это в основном описательная наука, больше похожая на географию... Несомненно, должна существовать также подлинная и общая биология. Истинная биология в полном смысле этого слова была бы наукой о природе и активности всех организованных объектов, где бы они ни находились — на нашей планете, на других планетах солнечной системы или в иных звездных системах» [1].
Физика, в свою очередь, это область естествознания: наука о простейших и вместе с тем наиболее общих законах природы, о материи, ее структуре и движении. Законы физики лежат в основе всего естествознания [2].
Определение у такого понятия, как «биофизика», много, вот некоторые из них:
- Биофизика — раздел биологии, изучающий физические аспекты существования живой природы на всех ее уровнях, начиная от молекул и клеток и заканчивая биосферой в целом; раздел современной математической физики, изучающий биологические объекты как разновидность сложных нелинейных физических систем; наука о физических процессах, протекающих в биологических системах разного уровня организации, и о влиянии на биологические объекты различных физических факторов. Биофизика призвана выявлять связи между физическими механизмами, лежащими в основе организации живых объектов, и биологическими особенностями их жизнедеятельности.
- Биофизика — это наука, изучающая физические и физико-химические явления в живых организмах, структуру и свойства биополимеров, влияние различных физических факторов на живые системы («Энциклопедический словарь»).
- Юрий Мешалкин (заведующий лабораторией лазерной фотобиофизики, г. Новосибирск) дает следующее определение: «биофизика — наука, изучающая физические явления и свойства, важные для функционирования биологических систем, и использующая для этого комплекс экспериментальных и теоретических методов физики и физической химии».
- Андрей Рубин (заведующий кафедрой биофизики биологического факультета МГУ имени М.В. Ломоносова) характеризует биофизику как «науку о наиболее простых и фундаментальных взаимодействиях, лежащих в основе биологических процессов» [3]. В то же время, «важнейшее содержание биофизики составляют: нахождение общих принципов биологически значимых взаимодействий на молекулярном уровне, раскрытие их природы в соответствии с законами современной физики, химии с использованием новейших достижений математики и разработка на основе этого исходных обобщенных понятий, адекватных описываемым биологическим явлениям» [4].
- Михаил Волькенштейн (советский физикохимик и биофизик) предложил определение биофизики через ее задачи: «Задачи биофизики состоят в познании явлений жизни, основанном на общих принципах физики, и изучении атомно-молекулярной структуры вещества».
Таким образом, биофизика — это сложная, многозадачная наука, которая изучает организацию и перераспределение вещества и энергии на биологическом уровне организации. Главным инструментом биофизики служат спектральные приборы, способные зарегистрировать спектры от молекул. Например, экологическая биофизика по спектрам флуоресценции хлорофилла (рис. 1) может определить состояние фотосинтетического аппарата фитопланктона, а в сочетании с оптическими спектрами по форме пиков и положению максимумов пигментов, участвующих в фотосинтезе, можно сделать вывод о том, какие именно виды фитопланктона обитают в исследуемой области, а по изменению популяций сделать вывод о произошедших изменениях в экосистеме исследуемой области. С другой стороны, биофизики активно пользуются флуоресценцией от одиночных молекул (например, с методами PALM и STORM подробнее можно ознакомиться в других статьях «Биомолекулы» [5–7]). Есть и совсем высокотехнологичные методы биофизики, способные по физическим сигналам (электронной или рентгеновской дифракции, а также ядерному магнитному резонансу) восстанавливать пространственное (трехмерное) строение биомолекул — эта область получила название структурной биологии [8].
Наконец, важнейшую роль в биофизике играют математическое и компьютерное моделирование, позволяющие строить реалистичные имитации различных биологических систем — от молекулярных до популяционных [9].
Одна из самых интересных задач биофизики...
Много научных работ проведено на зафиксированных препаратах, выделенных веществах, либо же помещенных в искусственную среду. Ученые долгое время изучали биологические объекты вне их естественной среды обитания, создавая условия из буферных растворов, лишь отдаленно соответствующие естественным. Благодаря этому был накоплен бесценный опыт о природе и механизмах взаимодействия/работы тех или иных веществ. Однако в современной биофизике наблюдается тенденция к изучению биологических объектов не in vitro, а in vivo, что позволит получить картину процессов, в реальном времени происходящих в биологических объектах [10]. Это становится возможным благодаря развитию новых технологий и современного оборудования. Так, уже ведутся работы по разработке приборов, которыми можно идентифицировать опухолевые клетки и ткани органов при помощи методов флуоресценции, спектроскопии комбинационного рассеяния и масс-спектрометрии (рис. 2). Разработка новых диагностических методов позволит врачам в режиме реального времени определять и удалять участки органов и тканей, поврежденных опухолью.
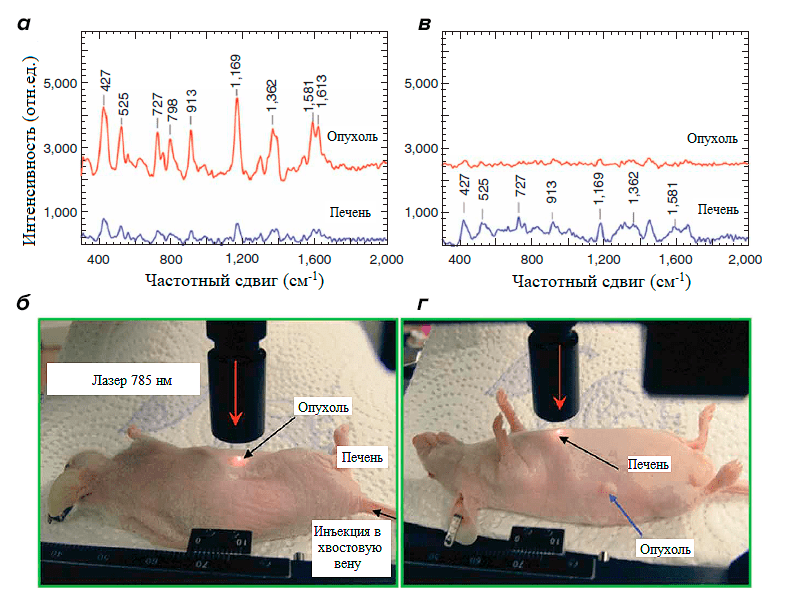
Рисунок 2. Использование метода спектроскопии комбинационного рассеяния при определении локализации клеток опухоли на теле крысы. а — Спектры с поверхности кожи в месте локализации опухоли (б — изображение места, с которого снимается сигнал). в — Спектры с поверхности кожи на произвольном участке тела крысы без опухоли (г — изображение места, с которого снимается сигнал). На спектрах красной кривой видно, что сигналы с места локализации опухоли значительно отличаются по интенсивности, набору пиков и их положению относительно мест без опухолевых клеток.
[11], рисунок адаптирован
VI Съезд биофизиков России

Рисунок 3. Эмблема Съезда биофизиков России
В научном мире существует несколько мест, где можно увидеть многих биофизиков одновременно. Самым большим из них является EBSA ICBP-IUPAP Congress — конгресс Европейского биофизического сообщества, который проходит раз в два года. Съезд Белорусского общественного объединения фотобиологов и биофизиков проходит раз в три года. Съезд биофизиков России (рис. 3) проходит раз в пять лет.
VI Съезд биофизиков России состоялся 16–21 сентября 2019 г. в Сочи на базе Образовательного центра «Сириус» (фонд «Талант и успех») в Парке науки и искусств. Перед началом съезда была организована молодежная школа для студентов-грантополучателей, в ходе которой под руководством преподавателей кафедры биофизики биологического факультета МГУ им. М.В. Ломоносова и Института молекулярной биологии им. В.А. Энгельгардта РАН студенты ознакомились с основами молекулярного моделирования, комбинационного рассеяния света и способами определения действия тяжелых металлов и гербицидов на процессы фотосинтеза в одноклеточных водорослях методом индукции флуоресценции хлорофилла.
Работа съезда состояла из двух частей — пленарных докладов и устных выступлений на секциях. Отдельно была проведена стендовая сессия, где каждый мог познакомиться с интересующей работой или более детально изучить уже освещенную на устных докладах тематику.
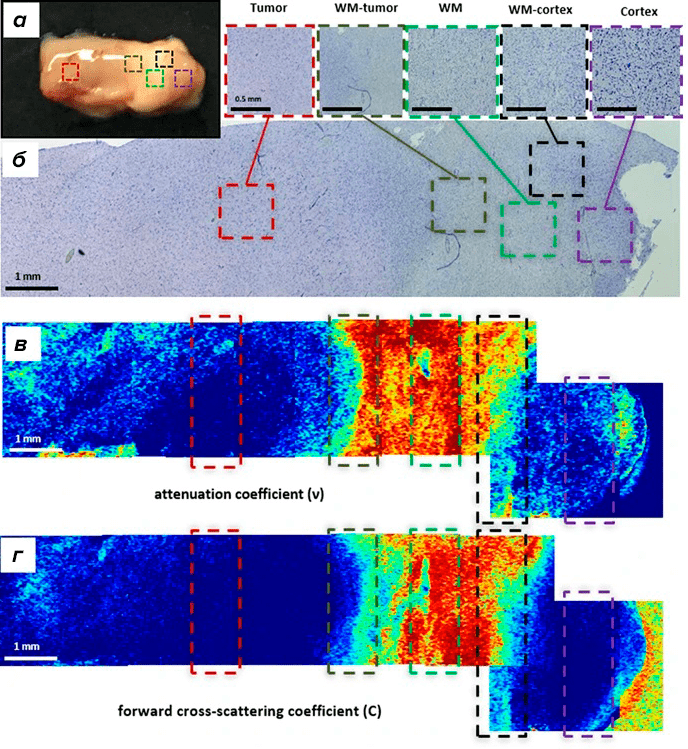
Например, один из стендовых докладов секции «Медицинская биофизика» — «Значение метода кросс-поляризационной оптической когерентной томографии в хирургии глиом головного мозга» — был посвящен определению локализации опухолевых клеток в глиомах головного мозга. Метод кросс-поляризационной оптической когерентной томографии (ОКТ) позволяет с большей специфичностью, чем традиционная ОКТ, визуализировать миелиновые волокна в исследуемой ткани. На основе данных биопсии авторам удалось сформулировать критерии дифференцировки белого вещества и опухолевой ткани на основании оценки кросс-поляризационных ОКТ-изображений и построения двумерных карт в псевдоцветовой палитре. В работе показано, что сигнал нормальной и опухолевой тканей заметно отличается, что позволяет ex vivo интерпретировать прижизненные изображения. Использование кросс-поляризационных ОКТ-критериев позволяет уточнять границы опухолевых процессов на поверхности коры и белого вещества мозга, что уже было доказано в ходе оперативных вмешательств у пациентов с глиомой [12], [13].
На секции «Биофизика одиночных молекул. Нанобиотехнологии» состоялся доклад о фотоконверсионных полимерных покрытиях, усиливающих интенсивность видимого света в синей и красной областях спектра. В докладе освещался альтернативный подход к решению освещения теплиц. Сейчас в теплицах используют натриевые лампы широкого спектра, которые также обладают термическим эффектом. Реже используют специальные светодиодные лампы, которые имеют индивидуальный оптический спектр для каждого вида растений (рис. 5)

Рисунок 5. Светодиодные лампы типа Plantador с индивидуальным оптическим спектром. Эти лампы расположены в оранжерее московского ботанического сада «Аптекарский огород». Видно, что для растений слева предпочтительнее спектр с выраженной красной и синей областями, в то время как для растений справа — диапазон желтого цвета.
«Экоград»
Авторы работы предлагают использовать в теплицах светопреобразующие ансамбли, способные эффективно конвертировать УФ-излучение, часть зеленого и желтого света в синий и красный свет, необходимый растениям. В работе предлагается использовать в качестве источника освещения не лампы и светодиоды, а специальные пленки (паронепроницаемые фторполимерные матрицы), содержащие различные флуорофоры (атомы, молекулы и молекулярные комплексы, способные флуоресцировать — излучать свет), которые нанесены или стабилизированы наночастицами золота на поверхности пленки. Показано, что при освещении модельным солнечным светом через фотоконверсионное полимерное покрытие наблюдается увеличение накопления биомассы растений салата до 30%.
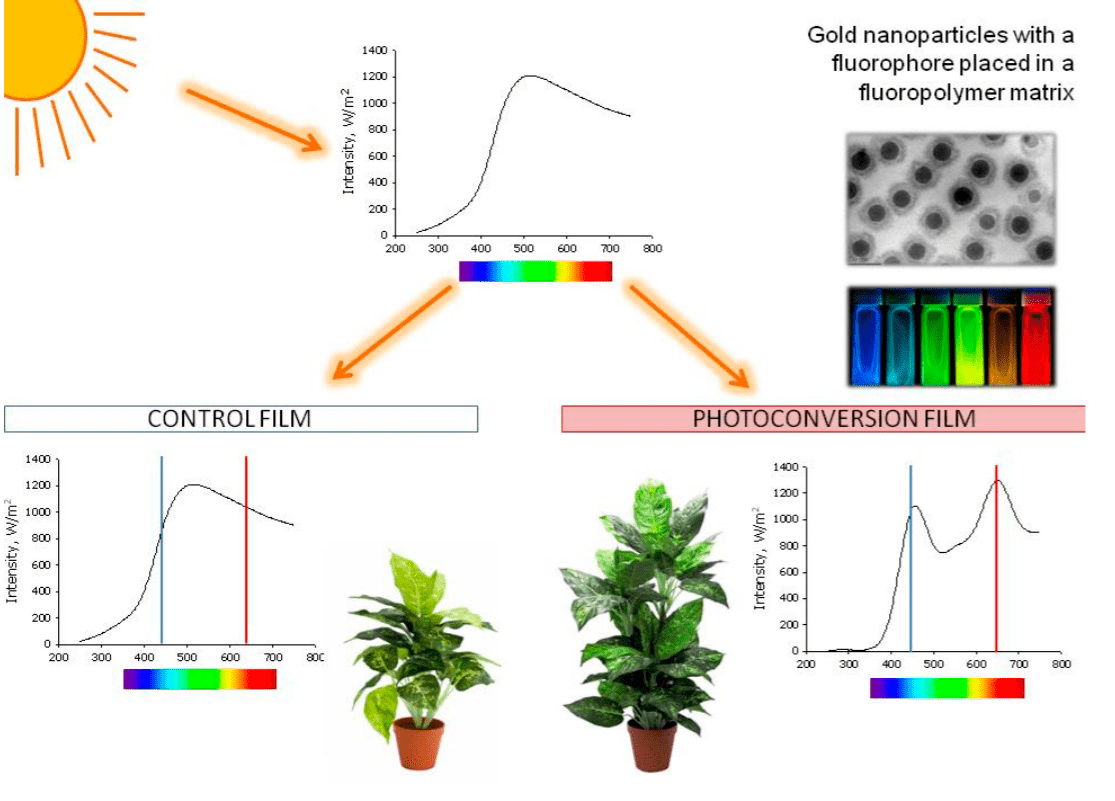
Рисунок 6. Концепция представленной работы. Верхний график показывает энергетический спектр Солнца на поверхности Земли. При прохождении контрольной пленки он существенно не меняется (нижний левый график). При прохождении фторполимерных фотопреобразовательных пленок (содержащих золотые наночастицы с флуорофором) увеличивается вклад синей и красной компонентов спектра (нижний правый график). В результате растения, растущие под фторполимерным фотопреобразующим покрытием, имеют преимущество.
На пленарных докладах освещались такие темы, как:
Дальний транспорт и межклеточный перенос фотометаболитов у харовой водоросли
В этом докладе на примере исследования клеток междоузлий водоросли Chara применяли микроскопию модулированной флуоресценции хлорофилла в соответствии с локальным освещением клетки со стороны места измерения (рис. 7). В выступлении освещалось, что метаболитическая сигнализация разобщенными хлоропластами ярко выражена в участках клетки, где активен H+-насос, и сильно ослаблена в зонах с высокой проводимостью плазматической мембраны для Н+ или OH–.
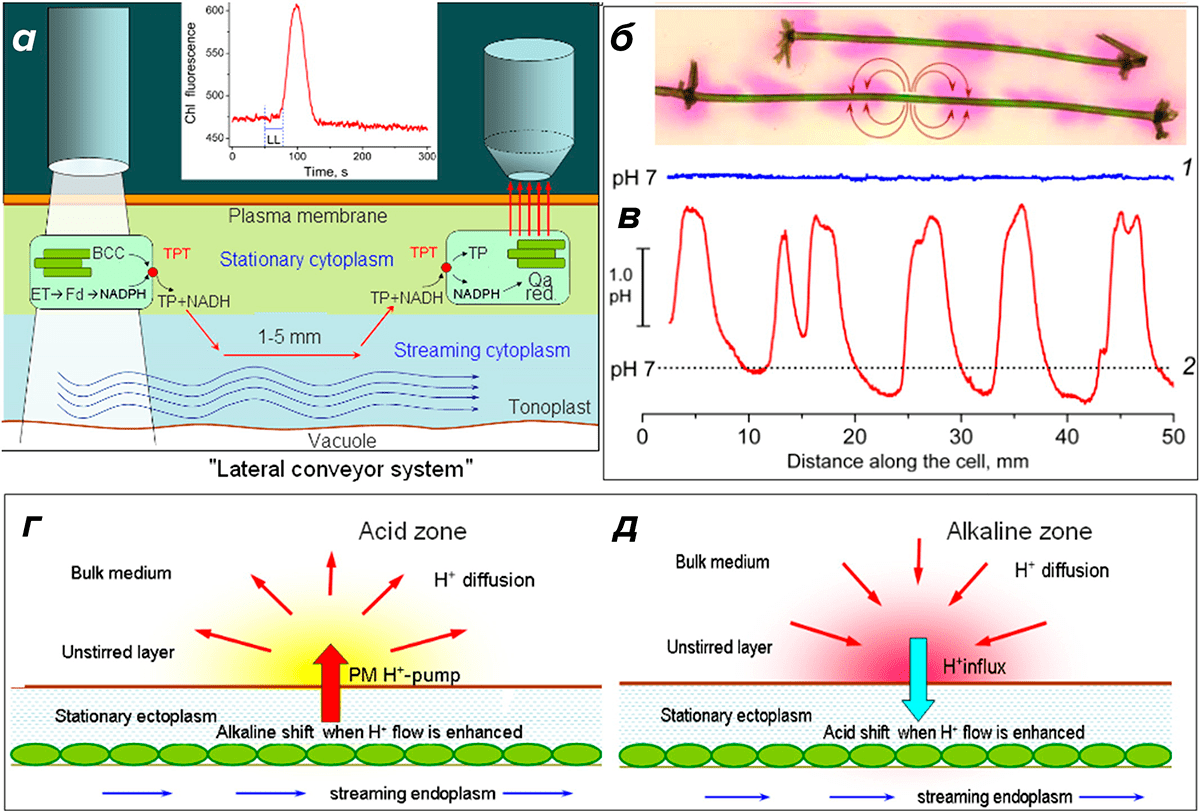
Рисунок 7. Метаболитические и протонные потоки в освещенных клетках междоузлий водорослей Chara.
а — Опосредованный циклозисом перенос триозофосфата (TP) и восстановительных эквивалентов (NADH) из ярко освещенных хлоропластов в затененные области клеток, где прослеживается флуоресценция хлорофилла (Chl). На вставке показаны изменения флуоресценции Chl F в ответ на локальный 30-секундный импульс белого света (LL), подаваемый на расстоянии 1,5 мм выше по потоку цитоплазмы от анализируемой области. Вертикальными пунктирными линиями отмечен период применения LL. Условные обозначения: BCC — цикл Бенсона-Кальвина; ТРТ — триозофосфатный транслокатор; ET — фотосинтетический транспорт электронов; Fd — ферредоксин. Последовательность высвобождения, переноса и повторного использования метаболитов, опосредованных непрерывным цитоплазматическим потоком, имеет условное название «система боковых конвейеров».
б — Характер распределения рН-полос в клетках междоузлий Chara corallina, визуализированный феноловым красным. Цвет красителя меняется с желтого на красный с увеличением рН от 6,8 до 8,2. Дугообразные стрелки показывают круговые электрические токи, генерируемые плазматической мембраной Н+-насоса при стимуляции клеток белым светом.
в — Кривая изменения рН визуализирует изменения поверхностного рН по длине клетки водоросли Chara. Кривые 1 и 2 показывают, соответственно, равномерное распределение pH в затемненной ячейке и изменение щелочных и кислотных полос в той же ячейке, подверженной воздействию белого света (100 мкмоль × м−2 × с−1). Шкалы длины в б и в аналогичны.
г и д — Смещения pH в неперемешанных поверхностных слоях при стимуляции внешнего потока H+ (г) и связанного внутреннего потока H+ в соседних доменах междоузлий Chara. Желтый и красный цвета поверхностных слоев соответствуют окрашиванию кислотной и щелочной зон феноловым красным.
Анализ трансклеточного переноса метаболитов, экспортируемых освещенными пластидами в подвижную цитоплазму, оригинален и неинвазивен, так как перемещение фотометаболитов регистрируется без загрузки в клетку флуоресцентных зондов и красящих веществ. Важно, что регистрация данным методом возможна в естественных условиях, когда градиенты концентрации транспортируемых веществ создаются в ходе физиологических процессов в интактной клетке. В качестве способа стимуляции работы клеток используется локальное удаленное освещение, что позволяет регистрировать также и распространение волны флуоресценции хлорофилла по клетке после выключения света. Трансклеточная фоторегуляция активности хлоропластов обратимо нарушается при снижении гидростатического давления в клетках.
NO в биофизике и биомедицине
Отдельное внимание было уделено монооксиду азота — NO. Большой интерес к нему вызван непрерывным ферментативным синтезом практически во всех живых организмах, а также фактом, что NO — один из универсальных регуляторов разнообразных биохимических и физиологических процессов (регуляция работы сердечно-сосудистой системы, центральной и вегетативной нервных систем, мочеполовой системы, желудочно-кишечного тракта и т.д.).
В докладе озвучивалось, что существовавшее прежде предположение о возможности влияния на состояние здоровья путем внешней регуляции уровня NO несколько ошибочно. В действительности оказалось, что сделать это не так просто, и основная причина этого состоит в свободно-радикальной природе молекул NO. Дело в том, что эти молекулы легко вступают в реакцию диспропорционирования, в результате которой происходит взаимное окисление-восстановление этих молекул с их переходом в ионы нитрозония (NO+) и нитроксила (NO−). В результате гидролиза при сохранении нейтральных значений рН первый в водной среде превращается в анион нитрита, а второй — в воду и закись азота (N2O). Тем самым реализуется убыль молекул NO, для предотвращения которой используется пул лабильного (слабо связанного) двухвалентного железа (рис. 8).
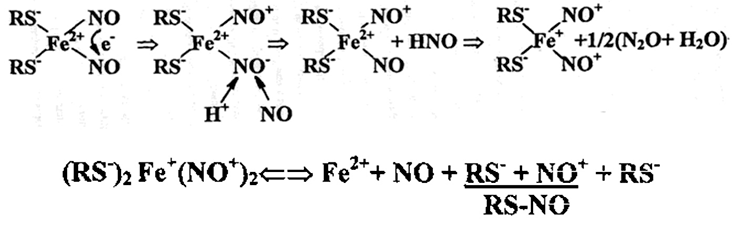
Рисунок 8. Образование динитрозольных комплексов железа (ДНКЖ) с тиолсодержащими лигандами (сверху). Процесс диспропорционирования двух молекул NO обеспечивается их связыванием с ионом Fe2+ c последующим удалением из комплекса протонированного иона молекулы нитроксила и включением на освободившееся место в комплексе другой молекулы NO. В результате возникает парамагнитный моноядерный ДНКЖ (М-ДНКЖ). При установлении химического равновесия между М-ДНКЖ и составляющими его компонентами (схема снизу) при выходе тиолсодержащих лигандов, он снова превращается в ион нитрозония (NO+), связывающийся (вместо иона гидроксила ОН–) с одним из тиолсодержащих лигандов с образованием стабильного S-нитрозотиола (RS-NO). Включение NO в живых организмах в ДНКЖ с тиолсодержащими лигандами обеспечивает его стабилизацию и депонирование и последующий перенос к мишеням его биологического действия.
Включение NO в живых организмах в ДНКЖ с тиолсодержащими лигандами обеспечивает его стабилизацию и депонирование и последующий перенос к мишеням его биологического действия. При этом, ДНКЖ выступают не только как доноры нейтральных молекул NO, но и ионов нитрозония, связывающихся с тиолсодержащими белками клеток и тканей. Есть все основания полагать, что именно эти комплексы — причем как моноядерные, так и биядерные ДНКЖ с тиолсодержащими лигандами — выступают в качестве основной «рабочей формы» системы эндогенного NO, обеспечивающей его функционирование в организме животных и человека. Уже созданные препараты, содержащие в качестве активных компонентов ДНКЖ с глутатионом, оказывают эффективное, дозозависимое гипотензивное действие на человека, длящееся несколько часов при одноразовом введении препарата. Такие препараты способны резко ускорять заживление кожных ран, подавлять агрегацию тромбоцитов (тромбообразование), подавлять развитие незлокачественных эндометриоидных опухолей у животных с экспериментальным эндометриозом, повышать эластичность эритроцитов и тем самым улучшать микроциркуляцию. В заключение была озвучена идея, что использование NO в биомедицине будет наиболее успешным в форме его доноров — ДНКЖ с тиолсодержащими лигандами.
Динамика межмолекулярных взаимодействий в воде
Несколько работ было посвящено моделям постоянных динамических переходов. Остановимся на пленарном докладе «Динамика межмолекулярных взаимодействий в воде» о том, что вода имеет локальные различия структуры с постоянной динамикой взаимных переходов [16]. Динамические процессы (биоритмы — периодическое изменение характера и интенсивности биологических процессов и явлений) играют большую роль в науках о живом. Предполагается, что динамика взаимных переходов в воде — самом распространенном веществе на нашей планете — может отвечать за многие биологические явления, в числе которых следует отметить и биоритмы. Одним из самых известных примеров биоритмов являются так называемые «биологические часы» [17], [18], однако для них не существует общепринятой теории функционирования. В научных кругах в основном обсуждают три основные молекулярно-биохимические гипотезы:
- автоколебания биохимических процессов;
- генетическая регуляция;
- автоколебания мембранной проницаемости.
При исследовании физико-химических свойств воды было выявлено, что их изменения подчиняются определенным закономерностям. Во всех экспериментах, независимо от используемого метода молекулярно-структурного анализа (ИК-спектроскопия, спектроскопия комбинационного рассеяния, кондуктометрия, СВЧ-радиометрия, ЯМР в магнитном поле Земли и др.), наблюдались близкие по значению и хорошо воспроизводимые периоды колебаний измеряемых величин. Значения этих периодов составляют: 1–3; 5–9; 10–13; 14–18; 20–28; 30–39; 41–55 и ~60 мин [19].
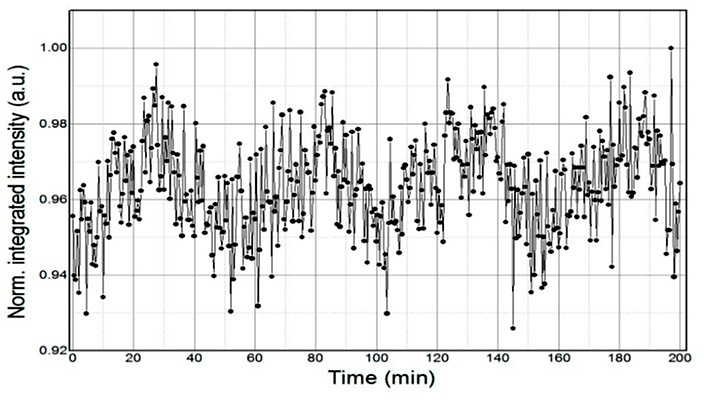
Рисунок 9. Динамика интегральной интенсивности ЯМР-сигнала в магнитном поле Земли. Процессы взаимных переходов между локальными структурными неоднородностями в воде — упорядочены (или квазипериодичны). На графике видны динамические периоды, самые крупные из которых равны примерно 50 минутам.
Для того чтобы в молекулярной системе наблюдался колебательный суммарный эффект внутри- и межмолекулярных преобразований, необходима синхронизация квантовых переходов между различными состояниями во всех молекулах среды (или большей ее части) одновременно, синфазно. Для проявления эффекта периодичности нужен резонанс между состояниями, отвечающими основным уровням энергии, что маловероятно в реальных условиях. Однако эффект периодичности может наблюдаться при постоянном внешнем воздействии, когда все уровни системы находятся в возбужденном состоянии.
Обнаруженные периоды в изменениях физико-химических свойств воды, периоды биологической активности целостного организма, а также хорошая сопоставимость этих значений с ритмами космической погоды [20], [21] могут указывать на важную роль воды в передаче сигналов физической природы биологическим объектам. Поэтому одним из важных факторов, определяющих формирование в водосодержащих жидкостях устойчивых колебательных процессов, является взаимодействие молекул воды с внешними электромагнитными полями и излучениями. В частности, наличие в составе воды молекул с магнитными моментами (орто-молекулы) может быть причиной изменения параметров межмолекулярного взаимодействия в переменных и постоянных магнитных полях.
В заключение было высказано предположение, что факторы, влияющие на магнитное поле Земли, могут быть причиной синхронизации работы живых клеток любого биологического организма. Возможно, в основе биоритмов лежит периодичность физико-химических процессов, определяемая как колебательной природой межмолекулярных взаимодействий в воде, так и изменениями проницаемости клеточных мембран за счет изменения соотношения орто-/пара-молекул, приводящего к изменению физических свойств внутриклеточной воды.
Определение параметров барьерной функции рогового слоя кожи методом спектроскопии комбинационного рассеяния в эксперименте in vivo
В одном из докладов был представлен метод определения барьерной функции рогового слоя кожи при помощи спектроскопии комбинационного рассеяния (КР). Барьерная (по-другому, защитная) функция кожи — это защита от воздействий окружающей среды. При нарушении барьерной функции могут измениться рН и липидный состав кожи, что приведет к преждевременному старению кожи и снижению ее бактерицидных свойств [22].
Метод КР позволяет неинвазивно детектировать состояние кожи, в то время как существующие методы измерения состояния ее барьерной функции in vivo ограничиваются косвенными методами, наиболее популярный из которых — измерение трансэпидермальной потери воды. Регистрация спектров КР рогового слоя кожи (толщина рогового слоя 15–30 мкм, проникающая способность КР-зондирования — около 50 мкм), позволяет получить спектральные линии от кератина и липидов в широком диапазоне волновых чисел [23], определить профили изменения концентрации компонентов [24], а также впервые «прозондировать» барьер кожи «вглубь» в эксперименте in vivo [25]. КР-спектроскопия позволяет охарактеризовать гош/транс-конформационный порядок в липидах (их ламмелярную организацию), а также соотношение орторомбической и гексагональной степени латеральной организации липидов в роговом слое.
Декомпозиция линий воды в КР-спектрах (в диапазоне волновых чисел ≈3000–3700 см–1) позволила измерить подвижность молекул воды в зависимости от силы водородных связей по глубине рогового слоя. Анализ вторичной и третичной структур кератина позволил определить эффективность связывания этими молекулами воды на разных глубинах рогового слоя. Разработанная методика помогает и исследованию влияния ксенобиотиков (медицинских или косметических средств наружного применения) на параметры барьерной функции кожи, в частности механизмов увлажнения кожи; а также мониторингу физиологических процессов, происходящих в роговом слое кожи в норме и при патологии.
Бифотохромные цветные флуоресцентные белки: феномен и перспективы использования
Популярность флуоресцентных белков (ФБ) объясняется тем, что это уникальные и незаменимые инструменты при изучении разнообразных молекулярных событий в живых клетках и организмах. Сегодня из более 100 описанных и охарактеризованных исходных ФБ особенную роль играет группа всего из семи фотоконвертируемых и фотопереключаемых белков . Один из таких белков — Kaede — сыграл ключевую роль в развитии методов субдифракционной микроскопии, в частности в создании метода PALM [5–7]. Поэтому открытие каждого гена, кодирующего такой белок, играет важную роль в разработке новых и развитии уже созданных методов изучения живых организмов.
Фотоконверсия — фотохимический процесс, связанный с изменением структуры хромофора.
Фотопереключение — фотофизический процесс, связанный со значительным изменением квантового выхода хромофора.
Ранее считалось, что в природе процессы фотоконверсии и фотопереключения не встречаются в одном и том же белке, однако путем метаногенеза можно достичь совмещения этих двух свойств в одной молекуле, как например это было сделано для белка IrisFP (рис. 10). Он способен к необратимой фотоконверсии из зеленого в красный цвет, а также он может обратимо фотопереключаться при освещении разными лазерами [25].
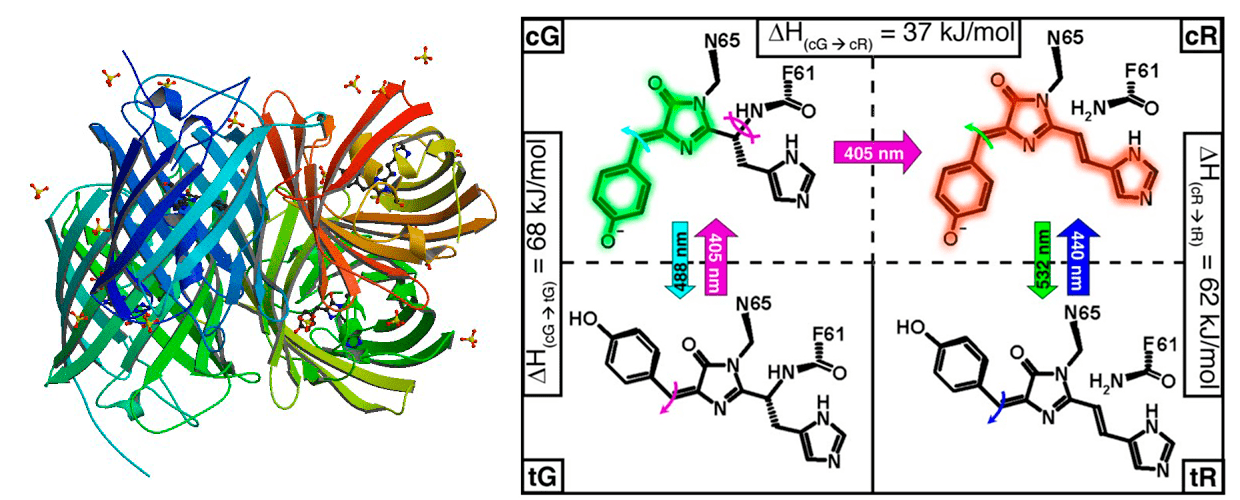
Рисунок 10. Фотоперключаемый белок IrisFP обратимо фотоперключается (цис/транс-изомеризация хромофора) из нативного (зеленого) и фотоконвертированного (красного) цвета по следующей схеме: 488 нм — фотообесцвечивание; 405 нм — зеленое свечение. Переключение на красный: 405 нм — из зеленого в красное свечение; 532 нм — выключение белка; 440 нм — красное свечение. Слева представлена структурная форма (PDB ID: 2VVH, 2VVI, 2VVJ), справа схематически изображены фотопереключение и фотоконверсия хромофора.
Открытый белок SAASoti из коралла Stylocoeniella armata — первый пример, когда фотоконверсия и фотопереключение совмещаются в одном природном ФБ. Полученные методом компьютерного моделирования данные показывают, что введенные в структуру IrisFP мутации (придававшие ему свойство фотопереключения) не являются необходимыми в случае SAASoti. Таким образом, механизм фотопереключения значительно более сложен, особенно в свете установленного методом фемтосекундной кристаллографии факта, что в процессе возбуждения хромофор в фотопереключаемом белке rsEGFP2 осуществляет сложное вращательное движение вдоль бета-бочонка. Образующееся новое конформационное состояние в большинстве случаев кинетически «заторможено», и возвращение в исходное состояние занимает минуты и часы.
Аналогичный процесс наблюдается в SAASoti и ранее изученном методами фемтосекундной спектроскопии и молекулярной динамики белке KFP. Считается, что дальнейшее изучение свойств белка SAASoti (рис. 11) позволит выявить тонкие молекулярные механизмы взаимодействия хромофора с окружающими его аминокислотными остатками, что является теоретической основой для рационального дизайна новых сенсорных молекул для молекулярного имиджинга и кинетической субдифракционной микроскопии, позволяющей отслеживать движение и релокализацию отдельных молекул [26], [27].
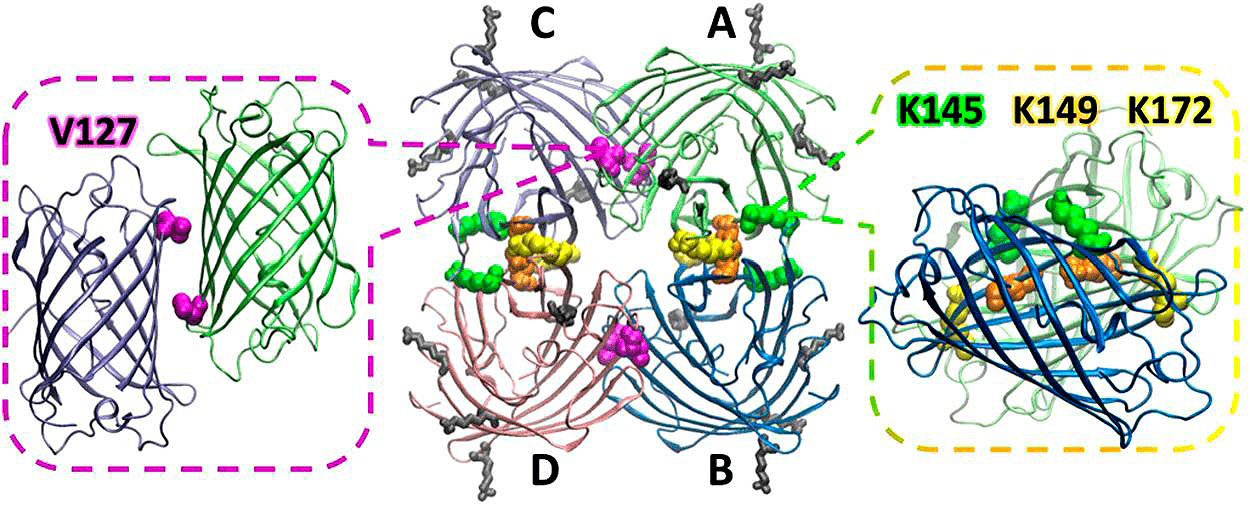
Рисунок 11. Структура тетрамерной модели фотопереключаемого и фотоконвертируемого белка SAASoti, полученного из коралла Stylocoeniella armata (на основе PDB структуры Kaede: 2GW3). Справа: заряженный интерфейс AB белка; аминокислотные остатки K145, K149 и K172 показаны зеленым, оранжевым и желтым, соответственно. В центре: 3D-модель с двумя различными интерфейсами — AB и AC. Слева: гидрофобный интерфейс; остаток V127 показан пурпурным цветом; обращенные к поверхности лизины К39, К41, К112 и К139 показаны серым цветом.
В заключительный день съезда доклады были посвящены проблемам искусственного интеллекта, а именно, обсуждались вопросы о существовании предела сходства робота и человека, каково принципиальное различие между искусственным и естественным интеллектами. Стоит отметить, что в данном случае под понятием «робот» понимается не механизм, обученный выполнять только определенный набор функций, будь то уборка по дому, сбор техники или сортировка продуктов. Но что же тогда? Правильный ответ — нейросеть (иногда можно встретить «элементарные когнитивные системы»). Начиная с машины Тьюринга , которая могла выполнять простейшие задачи, нейросети постепенно учили и обучали, пока не были созданы самообучаемые нейросети.
Машина Тьюринга — абстрактный исполнитель (абстрактная вычислительная машина). Была предложена Аланом Тьюрингом в 1936 году для формализации понятия алгоритма. Машина Тьюринга является расширением конечного автомата и, согласно тезису Чёрча—Тьюринга, способна имитировать всех исполнителей (с помощью задания правил перехода), каким-либо образом реализующих процесс пошагового вычисления, в котором каждый шаг вычисления достаточно элементарен. Всякий интуитивный алгоритм может быть реализован с помощью некоторой машины Тьюринга [28].
Архитектуры нейросетей, представляющих собой универсальные модули для разного вида сигналов, пространственно-временных масштабов выполняемых операций, целевых функций и областей применения, зависят от выбранных приоритетов системы уровней обобщенных средств управления. В то же время, в результате использования алгоритмов из элементарных модулей в моделях когнитивных систем можно конструировать различные иерархические системы для интерпретации поведения реальных живых систем (суперсистем), а также предлагать разработки технических устройств с функциональными возможностями, как у живых прототипов. При конструировании нейросетей часто используются литературные данные, описывающие опыт практических психологов, что позволяет наглядно показать существующие различия между возможностями приспособления технических и естественных когнитивных систем к реальным условиям природной среды.
Основное различие связано с особенностями управления через два блока «Я» в живых системах, в то время как технические системы обычно управляются через один канал управления. При этом одно «Я» основывается на опыте организма за один период жизнедеятельности, а другой блок «Я», предположительно более высокого управленческого уровня, основывается на целевых функциях, формирующихся на основе нескольких периодов обучения в природной среде. Данное отличие в режимах управления системами приводит к тому, что система ориентирована на снижение ошибок в заданных разработчиками областях, в то время как для живых систем так же важно снижать возможные «ошибочные» влияния на другие когнитивные системы, с которыми они вольно или невольно взаимодействуют (например, моральное и этическое поведение в человеческом социуме). Поэтому при работе с нейросетями встает вопрос — что важнее для исследователя и разработчика: развитие его человеческих качеств у него самого или сообщества, в котором он функционирует, или только те его достижения, которые оцениваются качеством работы технических систем для предоставленной ему социумом «искусственной реальности»?

Рисунок 12. Как было озвучено на одном из докладов, «...у робота может быть человеческое лицо и внешность, но это лишь технические и конструктивные элементы ... с момента создания первого робота изменились только его размеры, скорость работы и внешняя оболочка, что связано с созданием новых материалов, основной принцип работы остался прежним...».
К сожалению, осветить все области биофизики в одной статье невозможно. В VI Съезде биофизиков России принимало участие более 500 человек. Каждый из докладов был по-своему уникален и представлял собой отдельный кусочек из совершенно разных областей, связанный с медициной, биохимией, экологией, математикой, физикой — и, конечно же, биологией. Таким образом, биофизика — это многогранная наука, в которой занятие по душе может найти каждый человек, знакомый с естественными науками.
Литература
- Кратасюк В.А., Немцева Е.В., Есимбекова Е.Н., Свидерская И.В., Суковатая И.Е. История и методология биологии и биофизики. Красноярск: СФУ, 2008. — 613 с.;
- Физика. Большая советская энциклопедия / Прохоров А.М. М.: «Советская энциклопедия», 1969–1978;
- Рубин А.Б. Теоретическая биофизика // Биофизика в 3-х томах. Москва-Ижевск: Институт компьютерных исследований, 2013. — 472 с.;
- Рубин А.Б. Биофизика в 2-х томах. М., 2002;
- Лучше один раз увидеть, или Микроскопия сверхвысокого разрешения;
- Флуоресцентные репортеры и их молекулярные репортажи;
- 12 методов в картинках: микроскопия;
- 12 методов в картинках: структурная биология;
- 12 методов в картинках: «сухая» биология;
- In vivo — in vitro — in silico;
- Ximei Qian, Xiang-Hong Peng, Dominic O Ansari, Qiqin Yin-Goen, Georgia Z Chen, et. al.. (2008). In vivo tumor targeting and spectroscopic detection with surface-enhanced Raman nanoparticle tags. Nat Biotechnol. 26, 83-90;
- V. M. Gelikonov, V. N. Romashov, D. V. Shabanov, S. Yu. Ksenofontov, D. A. Terpelov, et. al.. (2018). Cross-Polarization Optical Coherence Tomography with Active Maintenance of the Circular Polarization of a Sounding Wave in a Common Path System. Radiophys Quantum El. 60, 897-911;
- Konstantin S. Yashin, Elena B. Kiseleva, Alexander A. Moiseev, Sergey S. Kuznetsov, Lidia B. Timofeeva, et. al.. (2019). Quantitative nontumorous and tumorous human brain tissue assessment using microstructural co- and cross-polarized optical coherence tomography. Sci Rep. 9;
- S V Gudkov, A V Simakin, V E Ivanov, E V Barmina, I V Baimler, et. al.. (2019). Creation and application of fluoropolymer photoconversion films for greenhouses: Concept.. IOP Conf. Ser.: Mater. Sci. Eng.. 525, 012087;
- Alexander A. Bulychev, Anna V. Komarova. (2017). Photoregulation of photosystem II activity mediated by cytoplasmic streaming in Chara and its relation to pH bands. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1858, 386-395;
- Самойлов О.Я. Структура водных растворов электролитов и гидратация ионов. М.: АН СССР, 1957;
- Молекулярные часы нашего сердца;
- Прообраз биологических часов;
- Дроздов А.В. и Нагорская Т.П. (2014). Квазипериодический характер межмолекулярных взаимодействий в воде. «Биофизика». 6, 1195–1208;
- Владимирский Б.М. и Конрадов А.А. (2007). Космическая физика, геофизика и внутрисуточные биологические ритмы. «Ученые записки Таврического национального университета», серия «Биология, химия». 1, 92–100;
- Дроздов А.В., Гpомозова Е.Н., Гpецкий И.А. (2015). Анализ динамики интенсивности биолюминесценции светящихся бактерий Photobacterium phosphoreum. «Биофизика». 2, 316–321;
- Генетика псориаза: иммунитет, барьерная функция кожи и GWAS;
- Maxim E. Darvin, Johannes Schleusener, Franziska Parenz, Olaf Seidel, Christoph Krafft, et. al.. (2018). Confocal Raman microscopy combined with optical clearing for identification of inks in multicolored tattooed skin in vivo. Analyst. 143, 4990-4999;
- ChunSik Choe, Johannes Schleusener, Jürgen Lademann, Maxim E. Darvin. (2018). Human skin in vivo has a higher skin barrier function than porcine skin ex vivo-comprehensive Raman microscopic study of the stratum corneum. J. Biophotonics. 11, e201700355;
- V. Adam, M. Lelimousin, S. Boehme, G. Desfonds, K. Nienhaus, et. al.. (2008). Structural characterization of IrisFP, an optical highlighter undergoing multiple photo-induced transformations. Proceedings of the National Academy of Sciences. 105, 18343-18348;
- Ilya D. Solovyev, Alexandra V. Gavshina, Aditya S. Katti, Alexey I. Chizhik, Leonid M. Vinokurov, et. al.. (2018). Monomerization of the photoconvertible fluorescent protein SAASoti by rational mutagenesis of single amino acids. Sci Rep. 8;
- Ilya Solovyev, Alexandra Gavshina, Alexander Savitsky. (2017). Reversible photobleaching of photoconvertible SAASoti-FP. JBPE. 3, 040303;
- Нефёдов В. Н. и Осипова В. А. Курс дискретной математики. М.: МАИ, 1992. — 260 с..