
Эта ночь не похожа на ночь, или Что нужно знать о влиянии светового загрязнения на наши биоритмы
24 февраля 2021
Эта ночь не похожа на ночь, или Что нужно знать о влиянии светового загрязнения на наши биоритмы
- 983
- 0
- 4
Немногие знают, что изначально самая известная картина норвежского художника-экспрессиониста Эдварда Мунка выставлялась под названием «Отчаяние», однако сам автор предпочитал использовать другой вариант — «Крик природы». Думаю, что это неслучайно. Кто-то видит в ней яркий закат, кто-то — душевные терзания; я же, взглянув со своей «колокольни» на этот шедевр, подумала о световом загрязнении: кроваво-алое небо на фоне темного залива, преклонный возраст центрального персонажа, а также его эмоциональная неустойчивость как следствие нарушенных биоритмов. Вдруг художник предвидел будущее?
Edvard Munch, картина «Крик», масло, 1893 г.
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Сложно представить, что с момента изобретения первой лампы накаливания прошло всего лишь 150 лет! За это время внедрение электрической энергии в различные отрасли хозяйства и в быт достигло глобальных масштабов. Так, согласно данным Нового всемирного атласа искусственной освещённости неба (New World Atlas of Artificial Night Sky Brightness), воздействию света в ночное время подвергаются более 80% мирового населения и почти 99% жителей США. Каковы молекулярные механизмы восприятия света и стоит ли нам опасаться его ночью? С какими сложностями сталкивается человек в условиях постоянного освещения? Вредны ли «белые ночи» для жителей северных регионов? И как бороться со световым загрязнением, являющимся частью современного образа жизни? Ответы на эти и многие другие вопросы вы найдёте в данной статье.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2020/2021.

Партнер номинации — Российский научный фонд.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
«Да был ли день? И ночь ли это?»
Ежедневные циклы чередования света и темноты, создаваемые вращением Земли — центральный фактор, влияющий на поведение живых организмов [1], [2]. Дневной свет необходим для согласования режима повседневной активности у многих животных: некоторые из них активны ночью, в то время как другие — днём. Практически все живые организмы воспринимают природные циклы «свет-темнота» в виде суточных (циркадных, циркадианных) биологических ритмов с длительностью периода около 24 часов .
На «Биомолекуле» опубликовано много статей, посвящённых циркадным ритмам: «Найдена связь между обменом веществ и циркадным ритмом», «Прообраз биологических часов», «Скрытая наследственность», «Молекулярные часы работают не так, как мы думали», «Бессонные ночи дрозофилы», «Молекулярные часы нашего сердца» [3–8].
Возможно, вы уже знаете, что свет считается наиболее мощным суточным регулятором ритмов у человека, хотя другие сигналы, такие как время приёма пищи, физическая активность и социальное взаимодействие также играют роль в синхронизации циркадной системы. Информация о световых условиях окружающей среды фиксируется светочувствительными нервными клетками сетчатки глаза (intrinsically photosensitive retinal ganglion cells, ipRGC), клеточные тела и аксоны которых образуют ретиногипоталамический тракт (RTH) (рис. 1) [9]. Восприятие света зависит от его интенсивности и продолжительности, а также от его спектральных свойств, поскольку ганглиозные клетки сетчатки глаза содержат меланопсин — светочувствительный пигмент фоторецепторов у млекопитающих. Показано, что пиковая спектральная чувствительность меланопсина находится в диапазоне коротких длин волн (460–484 нм) (синяя область спектра); минимально он чувствителен к длинным волнам (около 600 нм) [10]. Это означает, что синие волны оказывают более сильное влияние на циркадную систему человека по сравнению с другими источниками света с бо́льшей длиной волн. Подобно другим рецепторам-фотопигментам, меланопсин содержит опсин (рецептор, связанный с G-белком) и хромофор ретиналь . После поглощения фотона хромофор изомеризуется, вызывая конформационные изменения молекулы меланопсина, что, в свою очередь, запускает каскад реакций. В результате активируются ионные каналы и увеличивается ток ионов через мембрану, приводя к деполяризации клетки [11]. Этот ответ противоположен реакции колбочек и палочек на свет, мембрана которых гиперполяризуется, но очень схож с таковым у беспозвоночных (фруктовая дрозофила, мечехвосты) [11].
Более подробный молекулярный механизм фотоизомеризации можно посмотреть в статьях «Разные глаза — разные возможности» и «Зрительный родопсин — рецептор, реагирующий на свет» [12], [13].
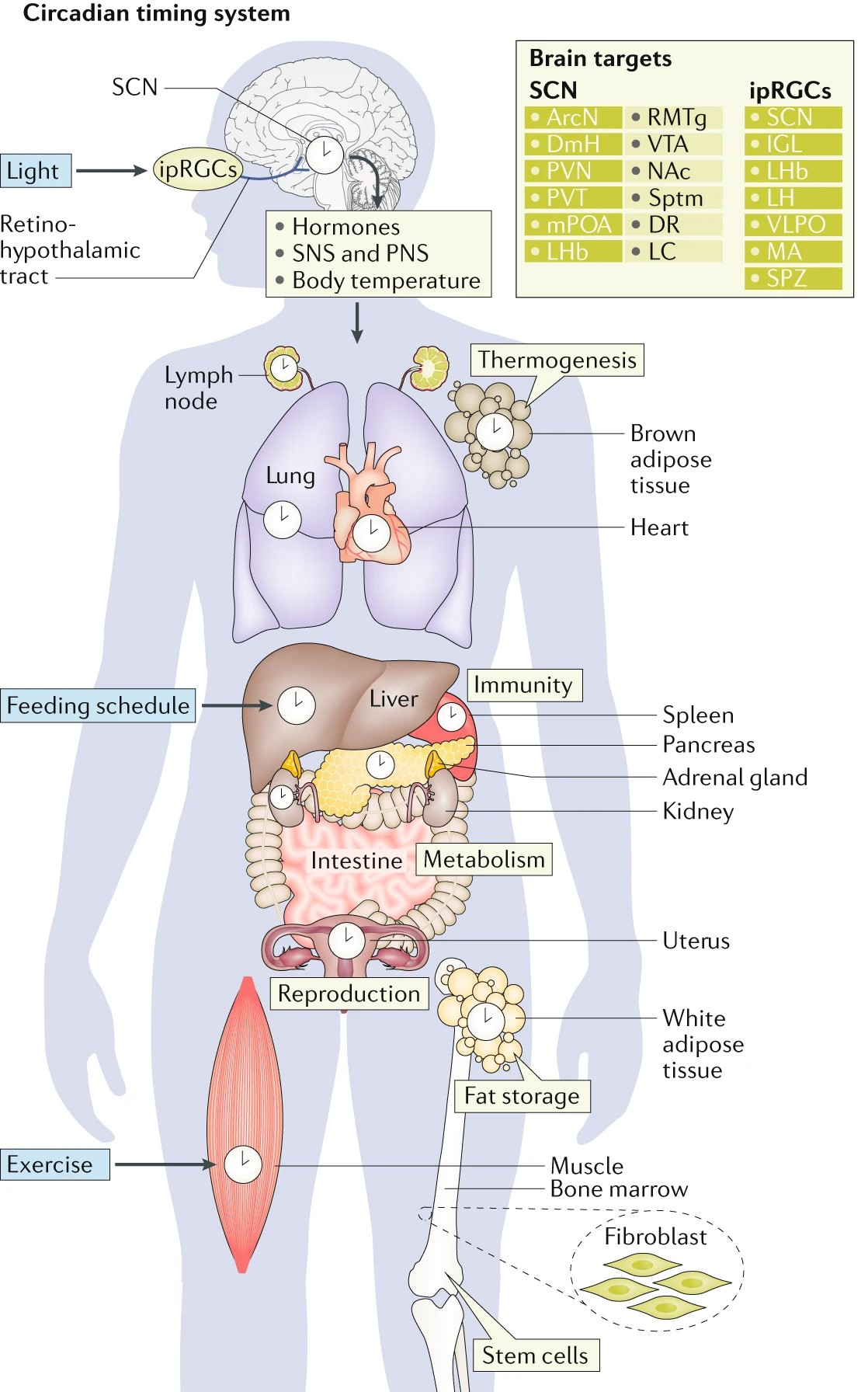
Рисунок 1. Циркадная система у человека. Информация о свете от светочувствительных нервных клеток сетчатки глаза (ipRGC) по ретиногипоталамическому тракту (RHT) поступает в центральные циркадные «биологические часы» — супрахиазматические ядра передней части гипоталамуса SCN). SCN передаёт сигнал о времени в другие области мозга через прямые (темно-зелёные прямоугольники) и косвенные (светло-зелёные прямоугольники) проекции (таблица Brain targets). Информация от SCN распространяется с помощью гормонов, а также симпатической SNS) и парасимпатической (PNS) нервной систем в периферические «биологические часы», которые находятся в большинстве органов и тканей.
Таким образом, благодаря ipRGC и меланопсину свет преобразуется в нервный сигнал, который по волокнам RTH, входящих в состав зрительного нерва, поступает в центральные циркадные «биологические часы» — супрахиазматические ядра (СХЯ) передней части гипоталамуса (SCN) (рис. 1). Каждое из парных СХЯ состоит примерно из 10 000 взаимосвязанных нейронов, которые координируют периферические «биологические часы» тканей и органов [14]. Сигналы от центральных «биологических часов» распространяются за пределы циркадианного ритмоводителя СХЯ по всему организму и синхронизируют периферические «биологические часы» — часовые гены и белки, присутствующие практически во всех тканях и органах (сердце, лёгкие, печень, почки, скелетные мышца и другие) [9]. Такие физиологические функции и процессы, как сердцебиение, кровяное давление, температура тела, секреция гормонов, иммунитет, сон и бодрствование подвержены циркадианной ритмике.
Молекулярный механизм генерации циркадианных временных сигналов сложный — недаром в 2017 за открытие молекулярных механизмов, лежащих в основе циркадных ритмов, дали Нобелевскую премию в области физиологии и медицины [15]! Свет активирует экспрессию нескольких генов в СХЯ с различными паттернами экспрессии. Автономные молекулярные «биологические часы» у млекопитающих состоят из нескольких взаимосвязанных петель транскрипции/трансляции, работающих по механизму отрицательной обратной связи (рис. 2) [16]. Хотя общие черты этой системы определены, более тонкие молекулярные механизмы, с помощью которых эти белки генерируют самоподдерживающийся ритм с такой периодичностью и точностью, до сих пор остаются предметом многих исследований [17].
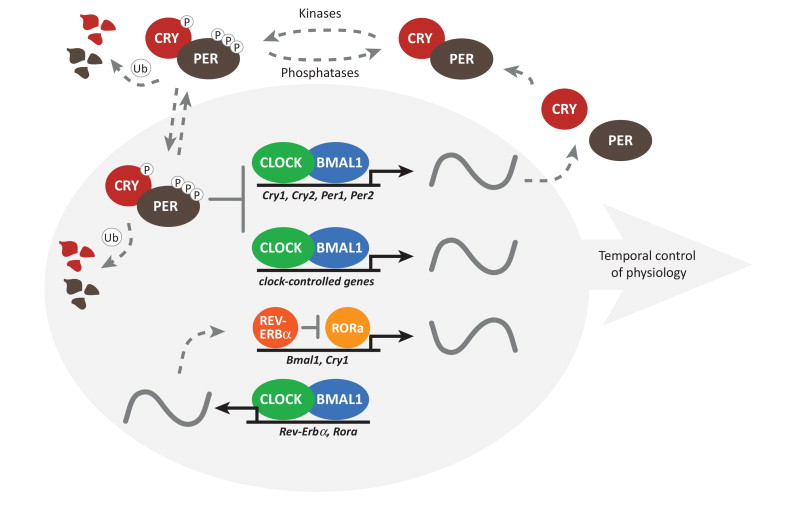
Рисунок 2. Молекулярные «биологические часы» млекопитающих. В состав основной петли входят четыре белка: два активатора — CLOCK (circadian locomotor output cycles kaput) и BMAL1 (brain and muscle arnt-like protein 1); два репрессора — PER (period) и CRY (cryptochrome), а также киназы и фосфатазы, которые регулируют локализацию и стабильность этих интегральных часовых белков. Белки CLOCK и BMAL1 являются субъединицами гетеродимерного фактора транскрипции CLOCK/BMAL1, который активирует транскрипцию репрессорных генов Per и Cry. Образующиеся в результате этого мРНК транслируются в цитоплазме клеток СХЯ в белки (PER1-3, CRY1,2), которые накапливаются в течение циркадного дня, т.е. бодрствования. Достигнув критических уровней, белки PER и CRY соединяются в цитоплазме и проникают в ядра клеток для взаимодействия с гетеродимером CLOCK/BMAL1, ингибируя свою собственную транскрипцию. Поскольку периоды полураспада у белков PER и CRY относительно короткие, они разрушаются через убиквитин-зависимые пути, и взаимосвязь с CLOCK/BMAL1 разрушается — цикл начинается снова с около 24-часовой периодичностью. Вспомогательная петля включает ядерные рецепторы, связанные с ретиноевой кислотой (RORα и RORβ) и REV-ERBs (REV-ERBα и REV-ERBβ), которые также транскрипционно регулируются гетеродимером CLOCK/BMAL1. Транскрипция гена Bmal1 индуцируется белком PER2 и тормозится белком REV-ERBα.
В дополнение к этому механизму существует нейрогуморальный путь распространения циркадианного сигнала по всему организму с вовлечением пинеальной железы (эпифиза мозга), которая осуществляет многочисленные модулирующие влияния на физиологические системы организма — в основном посредством своих гормонов. Одним из таких гормонов является мелатонин, о котором будет подробнее рассказано в следующей главе.
«В ночи рождается гормон»
Белой ночью спать совсем не хочешь.
Не стихает город за окном,
Потому, что можно белой ночью
Делать все, как будто это днём.
Н.М. Полякова
Наверно, ранее вы слышали, что мелатонин — это «гормон сна» или «гормон ночи». Это связано с тем, что у человека секреция мелатонина в кровь совпадает с часами сна — максимальный уровень этого гормона наблюдается в ночные часы, а минимальный — в утреннее и дневное время. Однако рост уровня мелатонина в крови у млекопитающих не является обязательным сигналом к началу сна. Свет стимулирует транскрипцию часовых генов в СХЯ, нейроны которых посылают ингибирующие сигналы через верхний шейный симпатический ганглий и норадренергические волокна в эпифиз (рис. 3) [18]. Ритм синтеза мелатонина зависит от силы (интенсивность и спектральные свойства) световых воздействий, времени их начала и продолжительности [14]. Так, фототерапия ярким светом утром приводит к более раннему наступлению пика выработки этого гормона. Если же воздействие света началось до суточного минимума температуры «ядра» тела, который обычно наступает в 4–6 ч утра, то происходит задержка фазы сна (тяжелое пробуждение и недосыпание). Наряду с этими эффектами, световое излучение, подаваемое в ночное время между полуночью и 4 часами утра, то есть во время пика секреции мелатонина, приводит к полному подавлению продукции гормона в период воздействия [14].
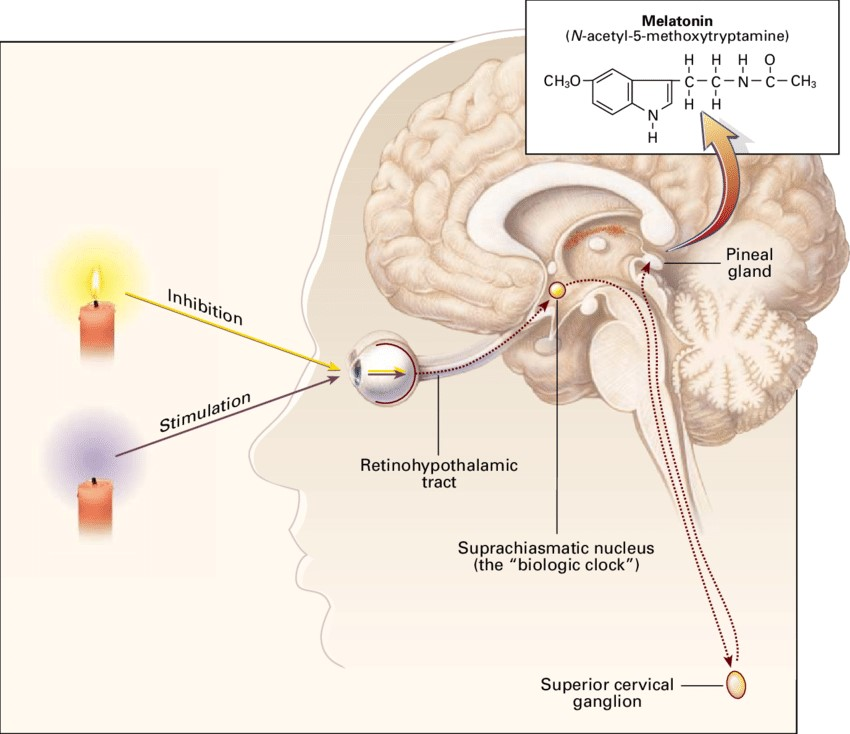
Рисунок 3. Продукция мелатонина пинеальной железой. Информация о световых условиях поступает по ретиногипоталамическому тракту (RHT) в центральные «биологические часы» (SCN), нейроны которых посылают либо ингибирующие (свет), либо стимулирующие (темнота) сигналы через верхний шейный симпатический ганглий в пинеальную железу.
Именно с ингибирующим действием на уровень мелатонина в крови связывают негативное влияние искусственного или естественного («полярный день» или «белые ночи» на Севере) освещения ночью (рис. 3). Нарушение нормального режима выработки мелатонина вызывает сбой циркадных ритмов и различные патологии, такие как: джетлаг; инсомния (бессонница), обусловленная сменным графиком работы; бессонница выходного дня; синдром задержки фазы сна [19].
Почему так важен мелатонин и какие функции он выполняет? Прежде всего, мелатонин известен своими антиоксидантными, противовоспалительными и иммуномодулирующими свойствами [20], [21]. Мелатонин относится к наиболее изученным адаптогенам и потенциальным геропротекторам, или, говоря другими словами, употребление мелатонина вызывает повышение сопротивляемости стрессу и увеличение продолжительности жизни [21].
К сожалению, все мы не молодеем с годами, и наш эпифиз тоже. Так, ранее было показано, что с возрастом структура пинеальной железы изменяется, а уровень мелатонина в крови ночью значительно снижается [20], [22]. Именно поэтому люди пожилого возраста часто страдают от инсомнии (бессонницы). Приём препарата мелатонина (циркадин) пациентами с инсомнией в возрасте 55 лет и старше приводит к значительному улучшению их качества сна и жизни [23].
Подробнее о связи сна, старения и уровня мелатонина можно прочитать в ранее опубликованных на «Биомолекуле» статьях: «Сон и старение I: Часы в мозге и влияние генов на ритм жизни» и «Сон и старение II: Чем отличается сон пожилых и больных от сна молодых и здоровых?» [24], [25].
Помимо этого, гормон участвует в регуляции энергетического баланса и скорости обменных процессов в организме млекопитающих, в том числе человека [26]. Мелатонин играет роль «дирижёра», изменяя уровень секреции других гормонов (концентрация которых зависит от времени суток), и участвует в регуляции большинства суточных (циркадных) и годовых (циркануальных) ритмов у млекопитающих. Многочисленные эффекты мелатонина реализуются через рецептор-зависимые и независимые пути. На данный момент известно несколько типов рецепторов к этому гормону: мембранные (МТ1 и МТ2, связанные с G-белками), внутриклеточный (МТ3 или фермент хинон-редуктаза 2) и ядерные (RZR/ROR — транскрипционные факторы, принадлежащие к семейству связанных с ретиноевой кислотой орфанных рецепторов) (рис. 4) [27]. Благодаря наличию рецепторов во многих органах и тканях (мозг, сетчатка глаза, сердце, артерии, печень и желчный пузырь, почки, различные отделы кишечника, иммунные и репродуктивные клетки, кожа и даже плацента), мелатонин участвует в регуляции функционирования следующих систем: эндокринной, сердечно-сосудистой, репродуктивной, иммунной, пищеварительной и выделительной [28].
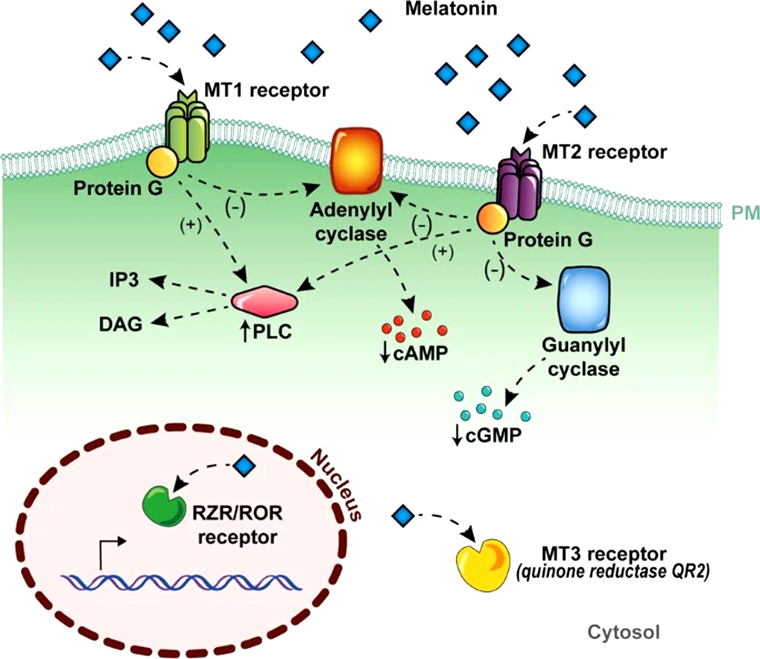
Рисунок 4. Внутриклеточные пути передачи сигнала, активируемые посредством рецепторов, специфичных к мелатонину. Мембранные рецепторы МТ1 и МТ2 — белки, состоящие из 7α спиральных трансмембранных доменов, связанных с G-белками. Так, активация рецептора мелатонина MT1 ингибирует активность аденилатциклазы (adenylate cyclase) и образование цАМФ (cAMP). В некоторых клетках рецепторы MT1 активируют фосфолипазу C (PLC), которая, в свою очередь, повышает уровни диацилглицерина (DAG) и инозитолтрифосфата (IP3), запускающие высвобождение кальция. Активация рецепторов мелатонина MT2 приводит к усилению активности фосфолипазы C, ингибированию активности ферментов (аденилатциклазы; гуанилатциклазы, guanylate cyclase) и образования цАМФ и цГМФ (cGMP). Существует третий рецептор МТ3, идентифицированный как цитозольный фермент хинон-редуктаза 2 (QR2), с помощью которого, как полагают, мелатонин участвует в поддержании окислительно-восстановительного статуса клетки. Меньшим сродством к гормону, по сравнению с мембранными рецепторами, обладают ядерные рецепторы RZR /ROR — транскрипционные факторы, принадлежащие к семейству связанных с ретиноевой кислотой орфанных рецепторов. Эти факторы в ядре регулируют транскрипцию путём связывания с промоторной областью генов-мишеней (антиоксидантных ферментов, интерлейкинов и других).
Среди многочисленных функций гормона наиболее «разрекламированная» — антиоксидантная. И это неслучайно: доказано, что мелатонин играет важную роль в регуляции равновесия между прооксидантными и антиоксидантными процессами в клетке, нейтрализуя напрямую активные формы кислорода (ROS) и азота (RNS), а также повышая экспрессию генов и ферментативную активность антиоксидантов [28]. Несмотря на окислительные (повреждающие) свойства ROS и RNS, полностью «ликвидировать» их нельзя, так как они могут выступать в клетках в качестве «двойных агентов»: либо инициируя интенсивный окислительный стресс, либо действуя в качестве вторичных посредников в биохимических реакциях [29]. Здесь, как говорится: «Главное — сохранять баланс»!
В интернете встречается много информации о мелатонине, и, прочитав про этот чудо-гормон, можно подумать, что это панацея — универсальное лекарство от всех болезней. Но не стоит обольщаться. Несмотря на множественные положительные эффекты мелатонина у млекопитающих, полученные ранее результаты дают основание полагать, что введение этого гормона на фоне нормального уровня его синтеза может приводить к негативным последствиям. В дополнение к этому, нерешённым остается вопрос о специфичности влияния мелатонина на физиологические системы детей, подростков, беременных и кормящих женщин [30].
Световое загрязнение как фактор риска преждевременного старения в модельных экспериментах
Исследования по влиянию световых режимов на физиологические параметры млекопитающих чаще всего проводятся на грызунах, ведущих сумеречный образ жизни. Несмотря на то, что ритмы двигательной активности дневных и ночных видов млекопитающих отличаются, структуры, лежащие в основе молекулярных «биологических часов», идентичны. Важно отметить, что механизмы влияния света на суточные ритмы и на секрецию мелатонина очень похожи между ночными и дневными животными. Начиная с 2004 года, коллективы лаборатории экологической физиологии животных Института биологии Карельского научного центра Российской академии наук и кафедры фармакологии, организации и экономики фармации Медицинского института Петрозаводского государственного университета проводят совместные экспериментальные исследования по влиянию различных световых режимов на физиолого-биохимические показатели лабораторных животных (крыс и сирийских хомяков) [31–38]. Впервые установлено, что содержание крыс при постоянном (круглосуточном) освещении и в световых условиях Севера (Республика Карелия) приводит к нарушению функционирования основных систем организма по сравнению с контрольными животными, содержащимися в стандартном режиме (12 ч свет: 12 ч темнота) (рис. 5) [31–33]. А именно: в условиях светового загрязнения у крыс обнаружено ускорение полового созревания, увеличение потребления корма, снижение когнитивной функции и физической выносливости, более раннее возникновение нарушений водно-солевого обмена, ускорение процессов «старения» антиоксидантной, пищеварительной и репродуктивной (у самок) систем, увеличение количества опухолей различного гистогенеза и, как следствие, преждевременное старение животных (рис. 5) [31–33]. В экспериментах на сирийских хомяках были получены схожие результаты, свидетельствующие о негативном влиянии «белых ночей» на физиолого-биохимические показатели [37], [38].
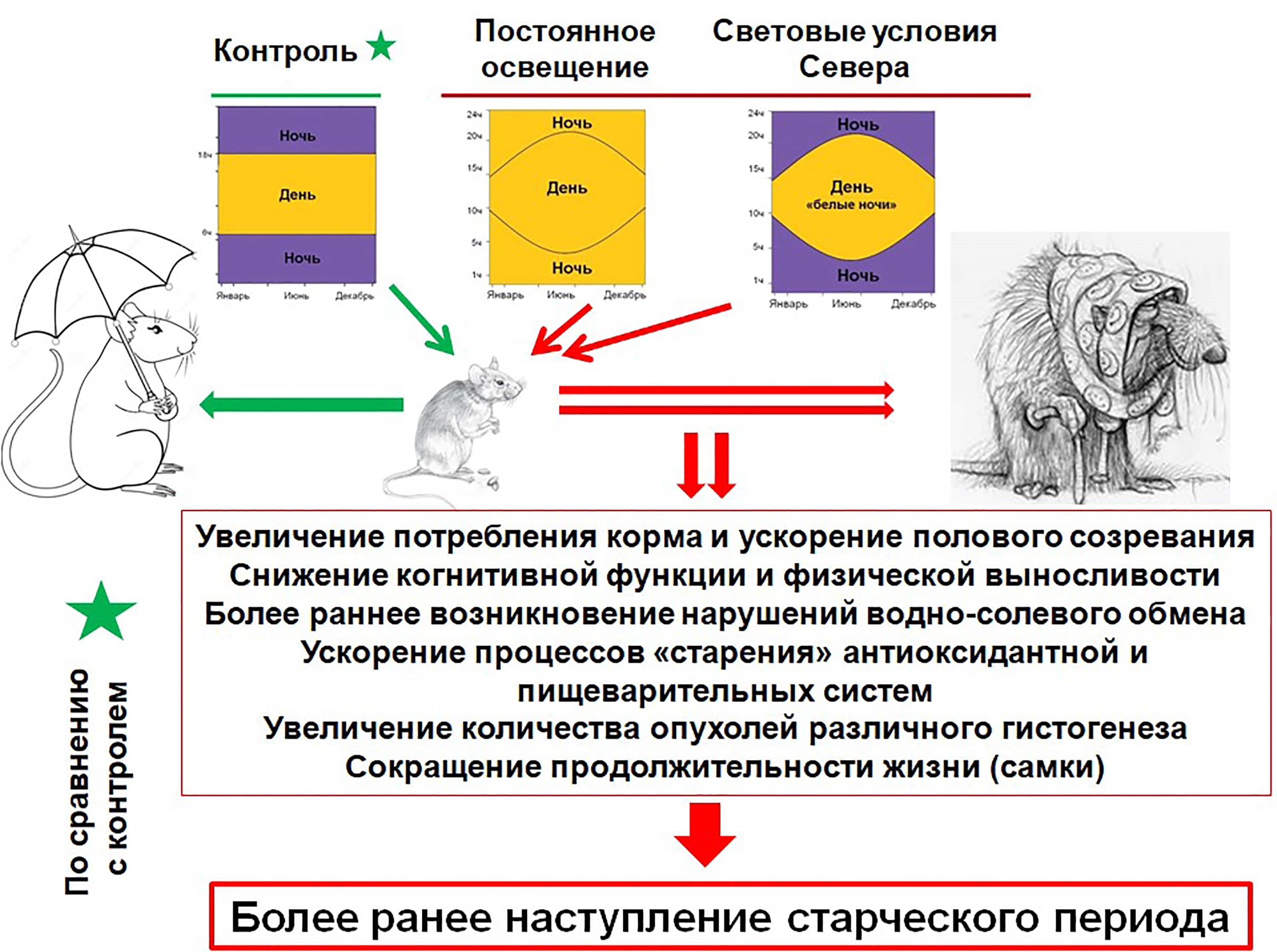
Рисунок 5. Схематическое изображение обобщённых данных по влиянию разных световых режимов. Контроль — 12 ч свет: 12 ч темнота; световое загрязнение — постоянное освещение и световые условия Севера. В результате проведённых исследований выявлено, что у животных, содержавшихся в условиях светового загрязнения, наблюдается нарушение функционирования многих систем организма и преждевременное старение по сравнению с контрольными особями.
рисунок автора статьи
В последние годы проводится большое количество подобных исследований на лабораторных животных, но можно ли интерпретировать эти данные на человека? Однозначно ответить на данный вопрос нельзя, поэтому предлагаю для начала узнать, каким образом световое загрязнение может повлиять на наш организм.
Световой десинхроноз у человека
Воздействие света на человека в ночное время рассматривается как один из ведущих факторов, приводящих к нарушению гомеостаза [19]. В группе риска прежде всего находятся люди, работающие посменно и/или ночью (данный тип занятости распространен во многих сферах услуг, таких как здравоохранение, транспорт и связь, полиция, гостиничный бизнес и другие). Даже свет низкой интенсивности, излучаемый современным приборами, такими как компьютерные экраны или телевизоры, мобильные телефоны и планшеты, способен воздействовать на наши «биологические часы», вызывая смещение ритмов и изменение секреции мелатонина [39]. Считается, что возникающее циркадное смещение, которое часто связано с недостатком сна, лежит в основе десинхронизации «биологических часов» [40]. Это состояние, при котором нарушается координация биологического (т.е. внутренние часы) и астрономического времён. Независимо от происхождения (сменная работа, джетлаг или синдром смены часового пояса, слепота и др.), десинхронизация проявляется через нетипичные клинические симптомы: постоянную усталость, нарушения сна, плохой аппетит и частые изменения настроения, хотя некоторые «десинхронизированные» люди не испытывают ни одного из этих клинических признаков (рис. 6) [40], [41].
Как правило, последствиями сбоев циркадианных ритмов у человека является ожирение, снижение умственной и физической работоспособности, инсомния, депрессия и расстройство пищеварения [26], [41]. К сожалению, нерешённым остается вопрос о канцерогенности светового загрязнения — это прежде всего связано с методическими сложностями. Но определённые успехи в этом направлении уже есть: в июне 2019 года рабочая группа, созванная Международным агентством по изучению рака (IARC), пришла к выводу, что работа в ночную смену, вероятно, канцерогенна для человека (канцероген группы 2A) [42].
В одной из статей я встретила интересную мысль, что люди, работающие по ночам — это «канарейки в угольной шахте», однако использование электроники и освещения ночью, вероятно, привело к тому, что большинство из нас также подвергается влиянию светового загрязнения.
Необходимо отметить, что не только человек страдает от воздействия света в ночное время. Световое загрязнение оказывает значительное влияние на экосистемы [43]. Несмотря на масштабность и экологические последствия данной проблемы, не все знают о её наличии. Именно поэтому активисты организуют различные мероприятия, чтобы привлечь внимание к световому загрязнению. Возможно, самым известным из них является ежегодное международное событие «Час Земли» (Earth Hour), проводимое Всемирным фондом дикой природы (WWF), в ходе которого организаторы призывают выключить свет на один час в знак неравнодушия к будущему планеты. В 2021 году международный «Час Земли» состоится в пятнадцатый раз (в России — в тринадцатый раз) — акция будет проведена в субботу, 27 марта в 20:30 по Московскому времени.
Что же нужно делать, чтобы не превратить себя в главного героя фильма «Бойцовский клуб»?
Пожалуй, начну с банальных основ: оптимально ложиться спать до полуночи и рассчитывать время таким образом, чтобы длительность сна была не менее 7–8 часов в день. В выходные дни желательно вставать в то же время, что и в рабочие дни, дабы не вызвать смещение биологических ритмов (рис. 6). Конечно же, не стоит забывать про физические упражнения — они подкрепляют наши циркадные ритмы, «Движение — это жизнь».

Рисунок 6. Световой десинхроноз у человека. Этот интернет-мем, на мой взгляд, лучше всего подходит для описания симптомов десинхронизации биологических ритмов. Кадр взят из известного фильма «Бойцовский клуб»; на нём изображен главный персонаж (актер Эдвард Нортон), страдающий бессонницей.
сайт Ferra
Помимо воздействия света от гаджетов в течение дня, некоторые из нас являются заядлыми пользователями этих устройств в ночное время. Не включайте ночью телефоны, а также свет, ночники, не оставляйте работающим компьютер! Если необходимо вставать ночью, лучше использовать красную лампу (красный свет меньше подавляет синтез мелатонина) [10].
Стоит отметить, что, к сожалению для нас, в последние годы в России уличные лампы накаливания, которые излучают свет более длинных волн видимого электромагнитного спектра (т.е. желтоватый), заменяют компактными флуоресцентными лампами (генерируют короткие волны голубоватого спектра). Синие волны оказывают более сильное влияние на циркадную систему человека по сравнению с другими источниками света [10]. Поэтому, если вы ощущаете, что за окном ночью светло как днём (особенно это касается периода «белых ночей» на Севере), необходимо повесить на окна плотные шторы или надеть очки для сна. Конечно же, не следует перед сном пить алкоголь и напитки, содержащие кофеин (чай, кофе, кока-колу, энергетики) — это снижает выработку мелатонина [44], [45].
Несомненно, повседневные способы борьбы со световым загрязнением хороши, и если их использовать, то организм скажет нам «спасибо». Однако проблема требует решения на мировом уровне. На данный момент нет точных прогнозов, что нас ждёт через несколько десятилетий. Прежде всего это связано с тем, что, с одной стороны, продолжается электрификация в наименее развитых странах, с другой — некоторые государства уже приняли законы о контроле уровня искусственной освещённости ночью [46]. Несмотря на кажущуюся простоту решения обозначенной выше проблемы, при разработке ограничительных мер возникают серьёзные трудности из-за отсутствия соответствующей законодательной базы [46]. Помимо этого, требуется постоянный мониторинг уровня светового излучения ночью для последующего анализа результатов нововведений на практике. В заключение хочется добавить «нотку» оптимизма: благодаря возможности создания онлайн-петиций, каждый из нас может внести свою лепту в защиту окружающей среды от светового загрязнения [47].
Литература
- Fabio Falchi, Pierantonio Cinzano, Dan Duriscoe, Christopher C. M. Kyba, Christopher D. Elvidge, et. al.. (2016). The new world atlas of artificial night sky brightness. Sci. Adv.. 2, e1600377;
- F. Falchi, R. Furgoni, T.A. Gallaway, N.A. Rybnikova, B.A. Portnov, et. al.. (2019). Light pollution in USA and Europe: The good, the bad and the ugly. Journal of Environmental Management. 248, 109227;
- Найдена связь между обменом веществ и циркадным ритмом;
- Прообраз биологических часов;
- Скрытая наследственность;
- Молекулярные часы работают не так, как мы думали;
- Бессонные ночи дрозофилы;
- Молекулярные часы нашего сердца;
- Ryan W. Logan, Colleen A. McClung. (2019). Rhythms of life: circadian disruption and brain disorders across the lifespan. Nat Rev Neurosci. 20, 49-65;
- Abhishek Prayag, Mirjam Münch, Daniel Aeschbach, Sarah Chellappa, Claude Gronfier. (2019). Light Modulation of Human Clocks, Wake, and Sleep. Clocks & Sleep. 1, 193-208;
- Michael Tri H. Do. (2019). Melanopsin and the Intrinsically Photosensitive Retinal Ganglion Cells: Biophysics to Behavior. Neuron. 104, 205-226;
- Разные глаза — разные возможности;
- Зрительный родопсин — рецептор, реагирующий на свет;
- Yvan Touitou, Alain Reinberg, David Touitou. (2017). Association between light at night, melatonin secretion, sleep deprivation, and the internal clock: Health impacts and mechanisms of circadian disruption. Life Sciences. 173, 94-106;
- Тик-так по-шведски. Нобелевская премия за циркадные ритмы;
- Carrie L. Partch, Carla B. Green, Joseph S. Takahashi. (2014). Molecular architecture of the mammalian circadian clock. Trends in Cell Biology. 24, 90-99;
- Priya Crosby, Carrie L. Partch. (2020). New insights into non-transcriptional regulation of mammalian core clock proteins. J Cell Sci. 133, jcs241174;
- Amnon Brzezinski. (1997). Melatonin in Humans. N Engl J Med. 336, 186-195;
- Randy J. Nelson, Souhad Chbeir. (2018). Dark matters: effects of light at night on metabolism. Proc. Nutr. Soc.. 77, 223-229;
- Dun Tan, Bing Xu, Xinjia Zhou, Russel Reiter. (2018). Pineal Calcification, Melatonin Production, Aging, Associated Health Consequences and Rejuvenation of the Pineal Gland. Molecules. 23, 301;
- Rüdiger Hardeland. (2019). Aging, Melatonin, and the Pro- and Anti-Inflammatory Networks. IJMS. 20, 1223;
- M. Karasek. (2004). Melatonin, human aging, and age-related diseases. Experimental Gerontology. 39, 1723-1729;
- G. V. Kovrov, M. V. Agaltsov, Z. N. Sukmarova. (2016). Effectiveness of prolonged-release melatonin in Improving Quality of Sleep in Patients Aged 55 or Over. RJTAO. 8, 24-30;
- Сон и старение I: «Часы в мозге» и влияние генов на ритм жизни;
- Сон и старение II: Чем отличается сон пожилых и больных от сна молодых и здоровых?;
- Jennette P. Moreno, Stephanie J. Crowley, Candice A. Alfano, Debbe Thompson. (2020). Physiological mechanisms underlying children's circannual growth patterns and their contributions to the obesity epidemic in elementary school age children. Obesity Reviews. 21;
- Anna Tarocco, Natascia Caroccia, Giampaolo Morciano, Mariusz R. Wieckowski, Gina Ancora, et. al.. (2019). Melatonin as a master regulator of cell death and inflammation: molecular mechanisms and clinical implications for newborn care. Cell Death Dis. 10;
- Mucahit Emet, Halil Ozcan, Lutfu Ozel, Muhammed Yayla, Zekai Halici, Ahmet Hacimuftuoglu. (2016). A Review of Melatonin, Its Receptors and Drugs. Eurasian J Med. 48, 135-141;
- Lidija Milkovic, Ana Cipak Gasparovic, Marina Cindric, Pierre-Alexis Mouthuy, Neven Zarkovic. (2019). Short Overview of ROS as Cell Function Regulators and Their Implications in Therapy Concepts. Cells. 8, 793;
- Lars Peter Holst Andersen, Ismail Gögenur, Jacob Rosenberg, Russel J. Reiter. (2016). The Safety of Melatonin in Humans. Clin Drug Investig. 36, 169-175;
- Irina A. Vinogradova, Vladimir N. Anisimov, Andrey V. Bukalev, Viktor A. Ilyukha, Evgeniy A. Khizhkin, et. al.. (2010). Circadian disruption induced by light-at-night accelerates aging and promotes tumorigenesis in young but not in old rats. Aging. 2, 82-92;
- A. V. Morozov, E. A. Khizhkin, E. B. Svechkina, I. A. Vinogradova, V. A. Ilyukha, et. al.. (2015). Effects of Geroprotectors on Age-Related Changes in Proteolytic Digestive Enzyme Activities at Different Lighting Conditions. Bull Exp Biol Med. 159, 761-763;
- Evgeniy A. Khizhkin, Victor A. Ilukha, Irina A. Vinogradova, Lyudmila B. Uzenbaeva, Tatiana N. Ilyina, et. al.. (2017). Physiological and Biochemical Mechanisms of Lifespan Regulation in Rats Kept Under Various Light Conditions. CAS. 10, 49-55;
- Svetlana Kalinina, Viktor Ilyukha, Evgeniy Khizhkin, Irina Baishnikova, Ekaterina Antonova, Artem Morozov. (2019). Constant darkness conditions modulate the effects of melatonin and luzindole on the antioxidant enzyme activities and levels of retinol and α-tocopherol in rats. BioComm. 64;
- E. A. Khizhkin, V. A. Ilyukha, I. A. Vinogradova, E. P. Antonova, A. V. Morozov. (2018). Circadian Rhythms of Antioxidant Enzyme’s Activity in Young and Adult Rats under Light Deprivation Conditions. Adv Gerontol. 8, 328-338;
- Svetlana Sergina, Viktor Ilyukha, Lyudmila Uzenbaeva, Evgeniy Khizhkin, Ekaterina Antonova. (2016). Morphologic changes in the pineal gland of rats exposed to continuous darkness. Biological Rhythm Research. 47, 691-701;
- П. А. Астафьева, Е. П. Антонова, А. В. Морозов, В. А. Илюха. (2020). ВЛИЯНИЕ ФОТОПЕРИОДИЧЕСКИХ УСЛОВИЙ СЕВЕРО-ЗАПАДА РОССИИ И МЕЛАТОНИНА НА АКТИВНОСТЬ ПИЩЕВАРИТЕЛЬНЫХ ФЕРМЕНТОВ У СИРИЙСКОГО ХОМЯКА (MESOCRICETUS AURATUS). Ж. эвол. биохим. и физиол.. 56, 533-533;
- E. P. Antonova, V. A. Ilyukha, S. N. Kalinina. (2020). Effects of Northwest Russia’s Photoperiodic Conditions and Exogenous Melatonin on Physiological and Biochemical Parameters in Syrian Hamsters (Mesocricetus auratus). Moscow Univ. Biol.Sci. Bull.. 75, 117-124;
- Siegfried Wahl, Moritz Engelhardt, Patrick Schaupp, Christian Lappe, Iliya V. Ivanov. (2019). The inner clock—Blue light sets the human rhythm. J. Biophotonics. 12;
- Gregory D. M. Potter, Debra J. Skene, Josephine Arendt, Janet E. Cade, Peter J. Grant, Laura J. Hardie. (2016). Circadian Rhythm and Sleep Disruption: Causes, Metabolic Consequences, and Countermeasures. Endocrine Reviews. 37, 584-608;
- Josiane L. Broussard, Eve Van Cauter. (2016). Disturbances of sleep and circadian rhythms. Current Opinion in Endocrinology & Diabetes and Obesity. 23, 353-359;
- Thomas C. Erren, Peter Morfeld, J. Valérie Groß, Ursula Wild, Philip Lewis. (2019). IARC 2019: “Night shift work” is probably carcinogenic: What about disturbed chronobiology in all walks of life?. J Occup Med Toxicol. 14;
- Dirk Sanders, Kevin J. Gaston. (2018). How ecological communities respond to artificial light at night. J. Exp. Zool.. 329, 394-400;
- Lotan Shilo, Hussam Sabbah, Ruth Hadari, Susy Kovatz, Uzi Weinberg, et. al.. (2002). The effects of coffee consumption on sleep and melatonin secretion. Sleep Medicine. 3, 271-273;
- Katri Peuhkuri, Nora Sihvola, Riitta Korpela. (2012). Dietary factors and fluctuating levels of melatonin. Food & Nutrition Research. 56, 17252;
- Wu Guanglei, Jack Ngarambe, Gon Kim. (2019). A Comparative Study on Current Outdoor Lighting Policies in China and Korea: A Step toward a Sustainable Nighttime Environment. Sustainability. 11, 3989;
- Karolina M. Zielińska-Dabkowska, Kyra Xavia, Katarzyna Bobkowska. (2020). Assessment of Citizens’ Actions against Light Pollution with Guidelines for Future Initiatives. Sustainability. 12, 4997.






