
Фотодинамическая терапия: подсвети проблему рака
16 января 2024
Фотодинамическая терапия: подсвети проблему рака
- 730
- 0
- 3
Рисунок в полном размере.
рисунок автора
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Мы доверяем себе больше, чем кому-либо другому, поэтому особенно страшно осознавать, что наши собственные клетки могут превратиться из ближайших друзей в столь же ближайших врагов. Полностью защититься от рака, к сожалению, нельзя, однако наука не стоит на месте: появляются новые способы диагностики и лечения этого коварного заболевания. В данном обзоре мы сконцентрируемся на использовании фотодинамической терапии в лечении рака — уничтожении раковых клеток с помощью активных форм кислорода, образующихся в ходе фотохимических реакций под действием света. Как выбрать фотосенсибилизатор, отправить его прямо в цель, а потом достать до него светом с нужной длиной волны — скоро во всем разберемся.
Конкурс «Био/Мол/Текст»-2023/2024
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Как подступиться к лечению рака?
Несмотря на прочную связь понятий «неизлечимое заболевание» и «рак» в наших головах, существует множество способов лечения, которые заметно замедляют развитие заболевания, а нередко приводят к полной ремиссии [1–4].
Когда у человека диагностируют рак, первым делом следует задать вопрос, операбельна ли опухоль, то есть можно ли просто вырезать из организма все опухолевые клетки, пусть и с частью окружающих их тканей, без вреда для пациента. Если ответ «да», такой случай считается везением, а грамотное хирургическое вмешательство помогает больному навсегда оставить в прошлом страшный диагноз. Однако если ответ «нет», в ход идет лучевая терапия, направленная на воздействие на опухолевые клетки высокими дозами излучения с целью смертельно повредить их. Еще одним наиболее применяемым на сегодняшний день в медицине методом лечения является химиотерапия, в которой используются цитотоксические лекарства. Такая терапия действительно сильно «бьет» по опухоли, однако здоровые клетки тоже без внимания не оставляет, так что токсическое воздействие оказывается в той или иной степени на весь организм.
Помимо этих трех столпов, на которых стоит лечение онкологических заболеваний, существует множество различных нетривиальных способов лечения. Однако тут стоит сразу внести немного ясности: все новые перспективные подходы, которые будут описаны ниже, не применяются повсеместно и не используются в одиночку. Несмотря на свой потенциал, они все еще недостаточно эффективны, чтобы с их помощью можно было излечить онкобольного, однако они берут на себя большу́ю часть работы, благодаря чему можно использовать традиционные средства в меньшей концентрации или не так продолжительно. Они также незаменимы для борьбы с метастазами, которые расположены в разных частях организма и редко поддаются хирургическому лечению. Нередко их можно применять и после операции, так как в попытках найти баланс между максимальным сохранением здоровых тканей без нарушения их функций и полным вырезанием опухоли можно оставить так называемые положительные края, то есть края опухоли, которые затем снова вызовут болезнь [5].
Одним из новых, но уже успешно используемых в больницах в ряде стран, методов является фототермическая терапия, основанная на облучении клеток радио- или микроволнами, магнитным полем или ультразвуком до температуры, несовместимой с дальнейшим их функционированием. Выборочное воздействие именно на опухоль достигается благодаря пониженной термоустойчивости: раковые клетки погибают при нагревании до 42–44 oС, тогда как здоровые клетки при такой температуре не повреждаются (ощутимые изменения начинаются лишь при температуре выше 46 oС). За превращение поглощенного излучения в тепло ответственны биосовместимые наноматериалы или красители, которые вводятся пациенту за некоторое время до облучения (рис. 1). Однако некоторые наноматериалы могут нагреться до 60 oC и повредить здоровые клетки. Также пока недостаточно исследований, описывающих изменения наноматериалов после гипертермии, и, в конце концов, в некоторых раковых клетках повышена экспрессия белков теплового шока, благодаря чему их температурный порог тоже повышается, так что фототермическая терапия не может гарантировать стопроцентный результат [6].
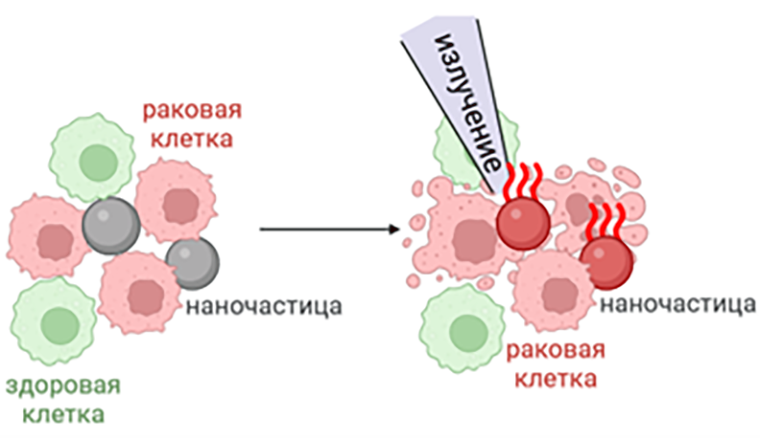
Рисунок 1. Фототермическая терапия. После накопления наночастиц в опухоли на нее воздействуют излучением (подробности в тексте), из-за чего наночастицы нагреваются. Раковые клетки погибают за счет сниженной термоустойчивости, тогда как здоровые клетки не повреждаются.
рисунок автора
Похожим способом лечения является фотодинамическая терапия. В ней также участвуют соединения, способные поглощать свет с определенной длиной волны, но они не нагреваются, а переходят в возбужденное состояние, то есть у них появляется электрон, который они готовы отдать другим соединениям в клетке, что приводит к образованию свободных радикалов и окислительному стрессу (рис. 2) [7].
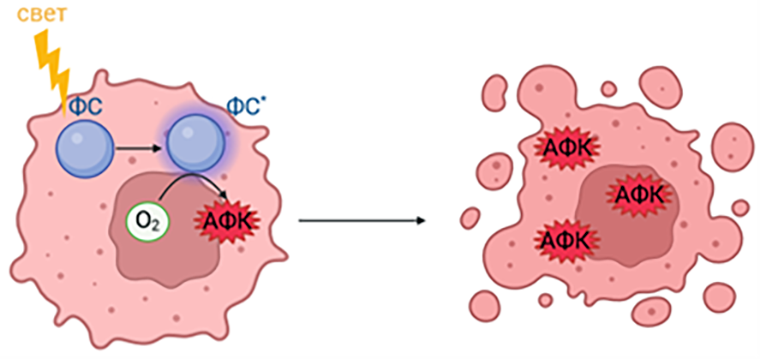
Рисунок 2. Фотодинамическая терапия. Под действием света фотосенсибилизатор (ФС) переходит в возбужденное состояние (ФС*). При возвращении фотосенсибилизатора в исходное состояние электрон с него переносится на находящиеся рядом соединения с образованием свободных радикалов, в том числе на кислород с образованием активных форм кислорода (АФК), что приводит к повреждению клеточных структур, нарушению целостности плазмалеммы и клеточной гибели.
рисунок автора
«Стой в своем свете и ярко сияй, потому что так ты побеждаешь тьму».
Лесли Эсперанса Эспайлат
Фотодинамическая терапия: почему клетка погибает
Теперь, в общем рассмотрев основные пути борьбы с онкологией, остановимся поподробнее на темной светлой лошадке этого парада — фотодинамической терапии (ФДТ). В ней участвуют три главных игрока: фотосенсибилизатор, то есть вещество, способное переходить в возбужденное состояние под действием света, собственно, сам свет и молекулярный кислород. При облучении опухоли светом с определенной длиной волны, подходящей фотосенсибизатору, последний переходит в возбужденное состояние и обретает свободный электрон, от которого хочет немедленно избавиться, чтобы вернуться в стабильное состояние. Такой «мешающийся» электрон может быть сброшен на любое соединение, находящееся в ближайшей доступности, зачастую рядом оказывается именно кислород, которого в клетке достаточно много. По отдельности все составляющие ФДТ не токсичны, однако когда происходит фотохимическая реакция, образуются опасные для клетки свободные радикалы, в том числе и активные формы кислорода (АФК). Разумеется, попадание не стопроцентное, ведь у клетки есть антиоксидантная защита, которую обеспечивают ферменты каталаза, глутатионпероксидаза и супероксиддисмутаза, однако большое количество свободных радикалов способно прорвать оборону даже самой подготовленной клетки и уничтожить ее [8].
Фотохимическая реакция представляет собой переход фотосенсибилизатора в возбужденное состояние под действием света. Затем такой фотосенсибилизатор возвращается исходное состояние, сбросив электрон или избыток энергии на субстрат — так происходит первичная фотохимическая реакция, а образовавшиеся в итоге свободные радикалы взаимодействуют друг с другом с появлением новых токсичных для клетки соединений (рис. 3). Опасность этих соединений для клетки будет зависеть от их реакционной способности, времени жизни, а также способности проходить через мембрану. Так, например, супероксидный анион-радикал сам по себе не очень опасен, однако в клетке он может прореагировать с оксидом азота NO и образовать куда более опасный пероксинитрит. Не дает этому случиться супероксиддисмутаза, которая забирает на себя два супероксидных анион-радикала и делает из них одну не очень приятную проникающую через мембраны перекись водорода, а она, в свою очередь, может провзаимодействовать с еще одним супероксидным анион-радикалом, и получится гидроксильный радикал, который может окислить в клетке почти что угодно [9].
Однако на кислороде свет клином не сошелся: клетка не безгранична, и рано или поздно при обширном окислительном стрессе АФК наткнутся на липиды клеточной мембраны и прореагируют с ними, а свободные радикалы жирных кислот запустят перекисное окисление липидов, заканчивающееся повреждением мембраны и гибелью клетки.
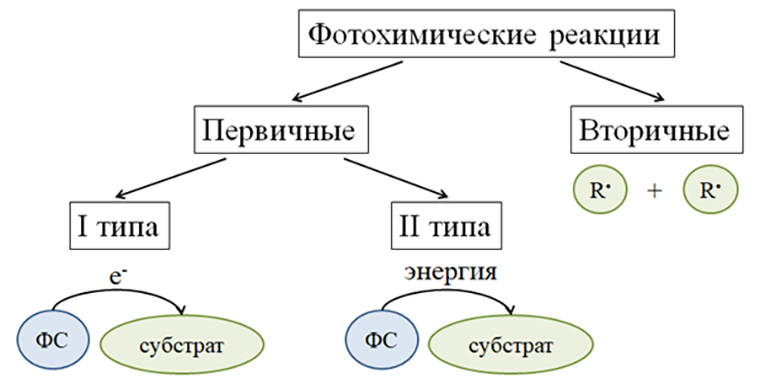
Рисунок 3. Разновидности фотохимических реакций. ФС — фотосенсибилизатор, R• — свободный радикал.
рисунок автора, за основу взята статья [9]
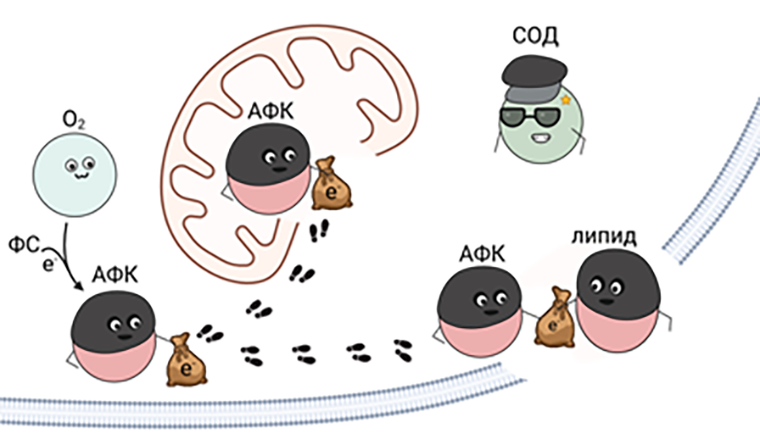
Рисунок 4. Схема появления активных форм кислорода (АФК) в клетке и вызванное ими повреждение органелл и плазмалеммы клетки на примере грабителей (АФК) и полицейских — антиоксидантная система клетки, представленная на рисунке супероксиддисмутазой (СОД). ФС — фотосенсибилизатор в возбужденном состоянии.
рисунок автора
Кастинг для фотосенсибилизаторов
Фотодинамическая терапия начинается с выбора фотосенсибилизатора. Во-первых, он должен быть нетоксичным в темноте и быстро выводиться из здоровых тканей, чтобы избежать пагубного воздействия на здоровые клетки. Во-вторых, он должен поглощать в окне прозрачности биологических тканей, то есть в дальнем красном и инфракрасном диапазоне (700–1000 нм), иначе мощности света просто не хватит, чтобы достать до фотосенсибилизатора [10]. В-третьих, плюсом для фотосенсибилизатора является фотообесцвечивание спустя некоторое время, потому что существует пороговая доза ФДТ, после которой может произойти некроз тканей. Если фотосенсибилизатор обесцветится до этого и перестанет работать, он не сможет вызвать чрезмерное повреждение тканей. Однако важно, чтобы фотообесцвечивание не наступало слишком быстро, иначе цитотоксический эффект на раковые клетки будет недостаточным [11].
Фотосенсибилизаторы могут быть небелковыми и белковыми. Небелковые фотосенсибилизаторы обычно имеют в основе тетрапиррольный макроцикл (рис. 5), то есть имеют порфириновую природу, но бывают и непорфириновые фотосенсибилизаторы, все они поглощают свет за счет системы сопряженных связей. В основном в клинике используются именно небелковые фотосенсибилизаторы, так как с ними проще работать [12].
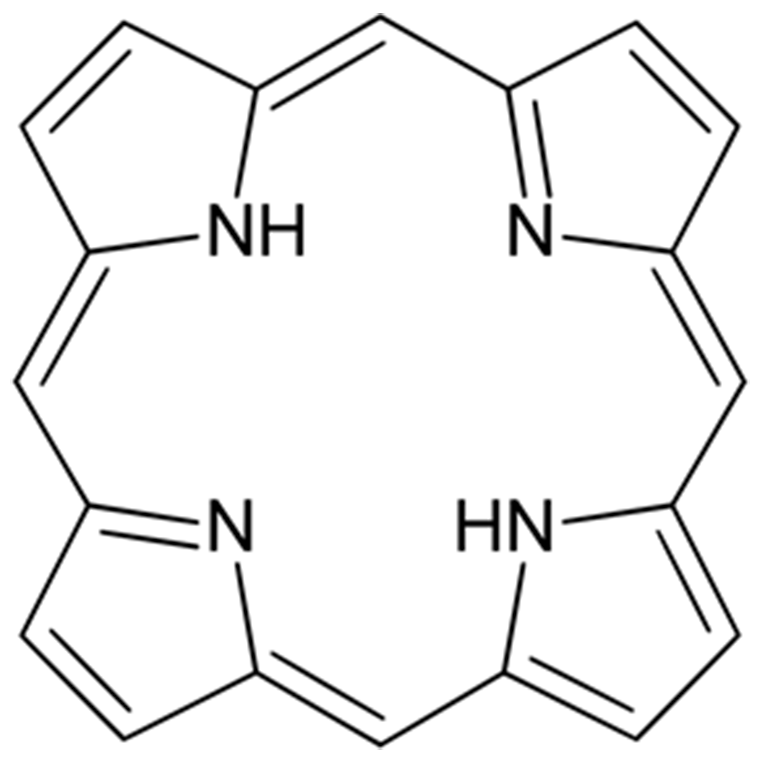
Рисунок 5. Тетрапиррольный макроцикл, составляющих основу небелковых фотосенсибилизаторов.
Принципиальной чертой белковых фотосенсибилизаторов является наличие хромофора, который подвергается физико-химическим и структурным изменениям под действием света. Наиболее часто роль хромофоров выполняют такие кофакторы белков, как FAD, FMN и рибофлавин [13]. Генетически кодируемых фотосенсибилизаторов существует ни много ни мало два: Killer Red и miniSOG [14], [15]. Killer Red — красный флуоресцентный белок, полученный на основе нефлуоресцентного и нетоксичного хромопротеина медузы [16]. Его фототоксичность обусловлена генерацией супероксидного анион-радикала. Из недостатков «красного убийцы» можно отметить быстрое фотовыцветание при облучении возбуждающим светом.
Флавопротеин miniSOG — генно-инженерный конструкт, созданный на основе домена light-oxygen-voltage (LOV) рецептора синего света (фототропина) арабидопсиса. За аббревиатурой названия кроется две расшифровки: mini Singlet Oxygen Generator или mini Super Oxide Generator. Первое название было дано, так как раньше считалось, что miniSOG вступает в фотохимические реакции II типа, при которых фотосенсибилизатор сбрасывает на субстрат энергию без передачи электронов, с образованием синглетного кислорода, однако позже было доказано, что miniSOG, как и KillerRed, является в основном источником супероксидного анион-радикала. Полученные данные отразились в новом названии, а исходная аббревиатура идеально легла на него. Особенностью LOV домена, на основе которого создан miniSOG, является способность нековалентно связывать флавин (рис. 6). Чтобы понять, как работает miniSOG, нужно сначала разобраться в его предшественнике. Под действием солнечного света флавинмононуклеотид (FMN) в LOV-домене фототропина растения переходит в возбужденное состояние, энергию которого он может потратить на образование ковалентной связи с белком. В такой форме фототропин играет роль протеинкиназы, что важно для осуществления светозависимых реакций в растении. В темноте связь между белком и кофактором вновь разрывается. Чтобы превратить фототропин в генератор активных форм кислорода, потребовалась аминокислотная замена. При поглощении кванта синего света модифицированным фототропином его кофактор FMN также переходит в возбужденное состояние, однако из-за невозможности потратить энергию на образование ковалентной связи с белком происходит перенос энергии или электрона на находящиеся рядом соединения с образованием свободных радикалов, в том числе АФК [17]. Во время фотохимических реакций всегда происходит конкуренция за электрон между ароматическим аминокислотным окружением кофактора и FMN. Чтобы уменьшить тушение флуоресценции и увеличить выход активных форм кислорода, было произведено еще пять замен ароматических аминокислот, таким образом получилась более токсичная версия miniSOG с более долгим временем жизни — SOPP3 [18].
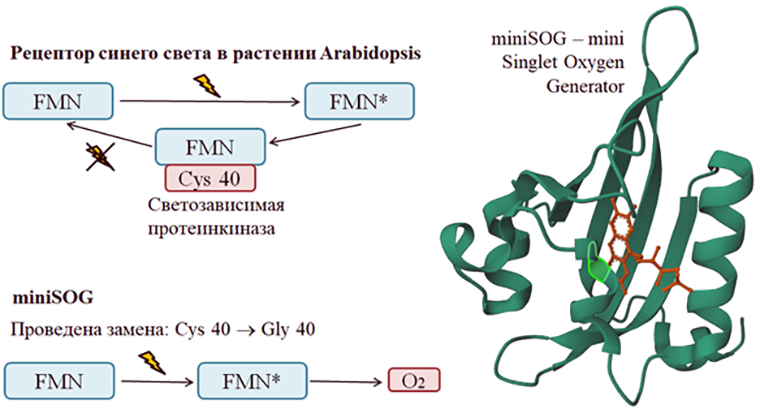
Рисунок 6. Слева на рисунке представлена схема перехода FMN (в составе LOV-домена растения Arabidopsis и в качестве кофактора miniSOG) в возбужденное состояние и возвращение в исходное состояние [19]. Справа на рисунке показано строение miniSOG, созданного на основе LOV домена фототропина Arabidopsis (PDB ID: 6QQH). Молекула FMN показана оранжевым, ярко-зеленым выделен глицин 40, с которым FMN образует ковалентную связь [18], [20].
рисунок автора
Доставка света
Говоря о необходимых свойствах фотосенсибилизатора, мы упоминали о поглощении в окне прозрачности биологических тканей, однако любой биологический объект не может быть абсолютно прозрачным, поэтому приходится искать баланс между максимальным облучением, достающим вглубь тканей, но повреждающем все на своем пути, и слабым безобидным облучением, лишь малая часть которого доходит до фотосенсибилизатора. Выбранный диапазон прозрачности от 700 до 1000 нм приходится также урезать до диапазона 700–800 нм, так как более длинноволновые источники излучения не используются, несмотря на их достаточную проницаемость в биологические ткани из-за малой энергии, которой зачастую не хватает для возбуждения фотосенсибилизатора [21]. Повысить энергию длинноволнового излучения можно за счет использования фотосенсибилизаторов, способных поглощать не один, а два фотона света из ближнего инфракрасного диапазона (БИК).
Увеличить число пригодных в облучении фотосенсибилизаторов можно, используя флуоресцентный резонансный перенос энергии (FRET). FRET представляет собой передачу энергии без промежуточного испускания фотонов, то есть колебания электрона одной молекулы передаются на электрон другой молекулы, если молекулы расположены достаточно близко друг к другу [22]. Это можно представить как качающийся маятник, который, ударив другой неподвижный маятник, потеряет свою энергию, а второй маятник, наоборот, получив энергию, начнет качаться. Если ввести в организм частицу, способную поглощать свет в БИК диапазоне и передавать энергию на фотосенсибилизатор, то можно избавиться от ограничения длины волны возбуждающего фотосенсибилизатор света [23].
Можно также избавиться и от ограничения непрозрачности биологических тканей, если создать систему на основе биолюминесцентного резонансного переноса энергии (BRET). BRET является частным случаем FRET и происходит между люциферазой и флуоресцентным белком. Такой системой является, например, генно-инженерная конструкция, содержащая люциферазу NanoLuc и уже знакомый нам флавопротеин miniSOG. При добавлении в эту систему субстрата люциферазы фуримазина происходит его окисление и перенос энергии с него на miniSOG, что переводит флавопротеин в возбужденное состояние, делая возможным генерацию свободных радикалов (рис. 7) [24]. Мораль: нет смысла светить прожектором сквозь стенки пещеры, лучше взять с собой маленький карманный фонарик.
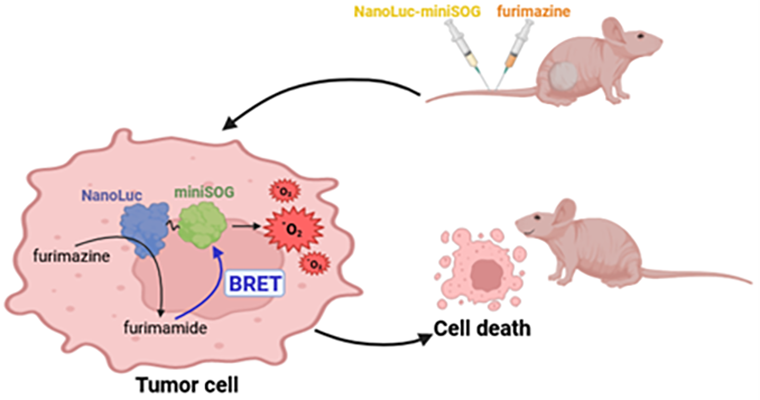
Рисунок 7. Схема образования АФК в раковой клетке после введения в кровоток белка NanoLuc-miniSOG и субстрата люциферазы фуримазина.
Как попасть в точку с лекарством?
Несмотря на все трудности, свет можно доставить прямо к опухоли, осталось доставить туда же лекарство. После введения фотосенсибилизатора в кровоток нужно дождаться его накопления в опухоли и только затем облучать пациента. Чаще всего в клинике используют безадресные лекарства, то есть пациенту вводят фотосенсибилизатор, а через какое-то время облучают. Фотосенсибилизатор за это время действительно успевает накопиться в опухоли в достаточном количестве благодаря высокой скорости метаболизма опухоли. Однако концентрация фотосенсибилизатора в здоровых тканях при таком лечении тоже достаточно высока, из-за чего пациентам приходится находиться в темноте, пока фотосенсибилизатор не выйдет из организма, иначе при попадании света на кожу у них может быть обширное повреждение тканей [25].
Чтобы избежать всех описанных сложностей и побочных эффектов, ученые разрабатывают лекарства для адресной фотодинамической терапии. В качестве мишеней, на которые может быть нацелено лекарство, обычно используются рецепторы, гиперэкспрессированные на поверхности раковых клеток, что связано с их активной пролиферацией и потребностью в большом количестве питательных веществ. Такими рецепторами могут быть, например, рецепторы факторов роста, липопротеинов низкой плотности, фолиевой кислоты [26]. Поглощение лекарства раковой клеткой происходит в данном случае за счет рецепторно-опосредованного эндоцитоза. Для доставки фотосенсибилизатора к рецептору используются адресные молекулы: антитела и их части, липопротеины низкой плотности, миметики антител, гибридные белки и другие. В идеале адресная молекула должна быть максимально специфичной, чтобы связываться именно с рецепторами на раковых клетках, и маленькой, чтобы пролезть в плотный комок клеток опухоли.
Эпилог
Рак — очень разношерстное заболевание, для лечения которого не существует одного стопроцентного подхода, поэтому приходится комбинировать и придумывать что-то новое. Такие базовые методы как операция, химиотерапия и лучевая терапия зачастую не справляются в одиночку, так что им нужны помощники, которые добьют остатки опухоли и смогут побороть метастазы.
Фотодинамическая терапия — один из таких помощников. Она уже относительно давно используется в клинике, но все время развивается, сметая с пути любые ограничения: на данный момент существуют системы, основанные на биолюминесцентном резонансном переносе энергии, что позволяет достать даже самые глубоко расположенные опухоли, и таргетные молекулы, которые сделают так, чтобы стрела в виде фотосенсибилизатора летела всегда прямо в цель.
Литература
- Многофакторная аутентификация помогает бороться с раком;
- Что будет, если человек попадет в ускоритель частиц, и при чем тут лечение опухолей?;
- На пути к безопасной химиотерапии;
- Вирусы против рака;
- Ofer Yossepowitch, Alberto Briganti, James A. Eastham, Jonathan Epstein, Markus Graefen, et. al.. (2014). Positive Surgical Margins After Radical Prostatectomy: A Systematic Review and Contemporary Update. European Urology. 65, 303-313;
- Elham Bidram, Yasaman Esmaeili, Hadi Ranji-Burachaloo, Nuha Al-Zaubai, Ali Zarrabi, et. al.. (2019). A concise review on cancer treatment methods and delivery systems. Journal of Drug Delivery Science and Technology. 54, 101350;
- Claire Donohoe, Mathias O. Senge, Luís G. Arnaut, Lígia C. Gomes-da-Silva. (2019). Cell death in photodynamic therapy: From oxidative stress to anti-tumor immunity. Biochimica et Biophysica Acta (BBA) - Reviews on Cancer. 1872, 188308;
- Vidosava B. Djordjević. (2004). Free Radicals in Cell Biology. International Review of Cytology. 57-89;
- K. Plaetzer, B. Krammer, J. Berlanda, F. Berr, T. Kiesslich. (2009). Photophysics and photochemistry of photodynamic therapy: fundamental aspects. Lasers Med Sci. 24, 259-268;
- Ковбой-фотосенсибилизатор;
- Barbara W. Henderson, Thomas J. Dougherty. (1992). HOW DOES PHOTODYNAMIC THERAPY WORK?. Photochem & Photobiology. 55, 145-157;
- Emma S Nyman, Paavo H Hynninen. (2004). Research advances in the use of tetrapyrrolic photosensitizers for photodynamic therapy. Journal of Photochemistry and Photobiology B: Biology. 73, 1-28;
- Aba Losi, Wolfgang Gärtner. (2011). Old Chromophores, New Photoactivation Paradigms, Trendy Applications: Flavins in Blue Light‐Sensing Photoreceptors†. Photochem & Photobiology. 87, 491-510;
- Флуоресцентные белки: разнообразнее, чем вы думали!;
- Флуоресцентный белок miniSOG убивает клетки светом;
- Sergei Pletnev, Nadya G. Gurskaya, Nadya V. Pletneva, Konstantin A. Lukyanov, Dmitri M. Chudakov, et. al.. (2009). Structural Basis for Phototoxicity of the Genetically Encoded Photosensitizer KillerRed. Journal of Biological Chemistry. 284, 32028-32039;
- Xiaokun Shu, Varda Lev-Ram, Thomas J. Deerinck, Yingchuan Qi, Ericka B. Ramko, et. al.. (2011). A Genetically Encoded Tag for Correlated Light and Electron Microscopy of Intact Cells, Tissues, and Organisms. PLoS Biol. 9, e1001041;
- Joaquim Torra, Céline Lafaye, Luca Signor, Sylvain Aumonier, Cristina Flors, et. al.. (2019). Tailing miniSOG: structural bases of the complex photophysics of a flavin-binding singlet oxygen photosensitizing protein. Sci Rep. 9;
- Sean Crosson, Sudarshan Rajagopal, Keith Moffat. (2003). The LOV Domain Family: Photoresponsive Signaling Modules Coupled to Diverse Output Domains†. Biochemistry. 42, 2-10;
- Rubén Ruiz-González, Aitziber L. Cortajarena, Sara H. Mejias, Montserrat Agut, Santi Nonell, Cristina Flors. (2013). Singlet Oxygen Generation by the Genetically Encoded Tag miniSOG. J. Am. Chem. Soc.. 135, 9564-9567;
- Patrizia Agostinis, Kristian Berg, Keith A. Cengel, Thomas H. Foster, Albert W. Girotti, et. al.. (2011). Photodynamic therapy of cancer: An update. CA: A Cancer Journal for Clinicians. 61, 250-281;
- Рулетка для спектроскописта;
- Wenpei Fan, Peng Huang, Xiaoyuan Chen. (2016). Overcoming the Achilles' heel of photodynamic therapy. Chem. Soc. Rev.. 45, 6488-6519;
- Elena I. Shramova, Victoriya P. Filimonova, Anastasiya Yu. Frolova, Eugene B. Pichkur, Vlad R. Fedotov, et. al.. (2023). HER2-specific liposomes loaded with proteinaceous BRET pair as a promising tool for targeted self-excited photodynamic therapy. European Journal of Pharmaceutics and Biopharmaceutics. 193, 208-217;
- Jean-Yves Matroule, Chris M Carthy, David J Granville, Olivier Jolois, David W C Hunt, Jacques Piette. (2001). Mechanism of colon cancer cell apoptosis mediated by pyropheophorbide-a methylester photosensitization. Oncogene. 20, 4070-4084;
- Raphaël Schneider, Frédéric Schmitt, Céline Frochot, Yves Fort, Natacha Lourette, et. al.. (2005). Design, synthesis, and biological evaluation of folic acid targeted tetraphenylporphyrin as novel photosensitizers for selective photodynamic therapy. Bioorganic & Medicinal Chemistry. 13, 2799-2808.






