Генная терапия гемопоэтическими стволовыми клетками
21 марта 2024
Генная терапия гемопоэтическими стволовыми клетками
- 1013
- 0
- 5
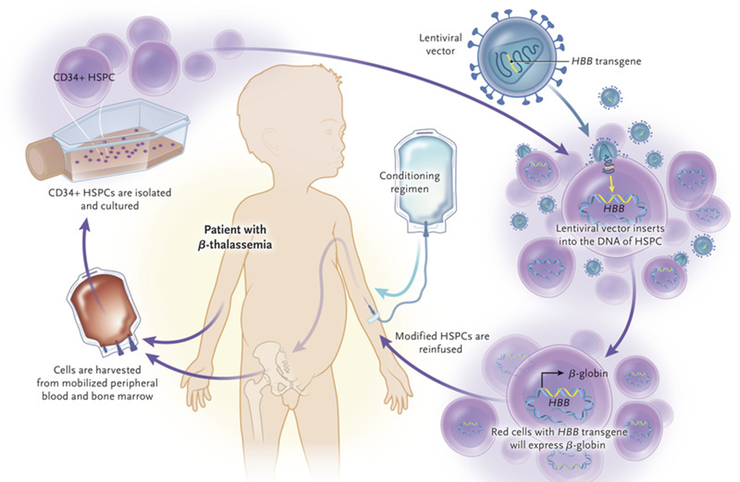
Схема генной терапии при β-талассемии с помощью лентивируса.
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Мы знаем, как сделать операцию на разные органы и исправить какие-то недостатки в них. Но как исправить то, что находится в каждой клетке нашего организма — наши гены? Этим и занимается генная терапия стволовых клеток, к которым и относятся гемопоэтические стволовые клетки (ГСК).
Конкурс «Био/Мол/Текст»-2023/2024
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Разберемся для начала с генной терапией
Можно дать много определений, но воспользуемся готовым: согласно FDA (Управление по лекарствам и пищевым продуктам США), «генная терапия — это медицинское вмешательство, основанное на модификации генетического материала живых клеток. Клетки могут быть модифицированы ex vivo для последующего введения человеку или изменены in vivo непосредственно в организме» .
Кстати, на «Биомолекуле» есть целый спецпроект, посвященный генной и клеточной терапии.
Есть два варианта осуществления генной терапии:
- ex vivo, когда вносят изменения в извлеченные из организма клетки, и затем снова вводят их. Данный вариант и используют в генной терапии ГСК;
- in vivo, когда модифицируют клетки прямо в живом организме.
Для этой модификации используют РНК для краткосрочного эффекта и ДНК (или вирусную РНК, на матрице которой путем обратной транскрипции синтезируется вирусная ДНК) для долгосрочного эффекта.
Что же должны содержать вводимые молекулы?
Для каждой терапии разрабатываются кассеты экспрессии (специально сконструированные молекулы ДНК, запускающие клеточные процессы для экспрессии генов), в состав которых входят (рис. 1):
- терминальные повторы ─ сигналы упаковки в вирусные капсиды (в случае, если планируется вирусная доставка кассеты);
- промотор ─ стартовая площадка ДНК для начала транскрипции;
- интрон ─ в данном случае стабилизирует мРНК;
- трансген ─ ген, который нужно экспрессировать;
- WPRE (посттранскрипционный регуляторный элемент вируса гепатита cурка) ─ увеличивает экспрессию трансгена;
- сигнал терминации ─ останавливает транскрипцию, стабилизирует мРНК.
Такие кассеты варьируют по составу и подбираются под необходимые задачи.
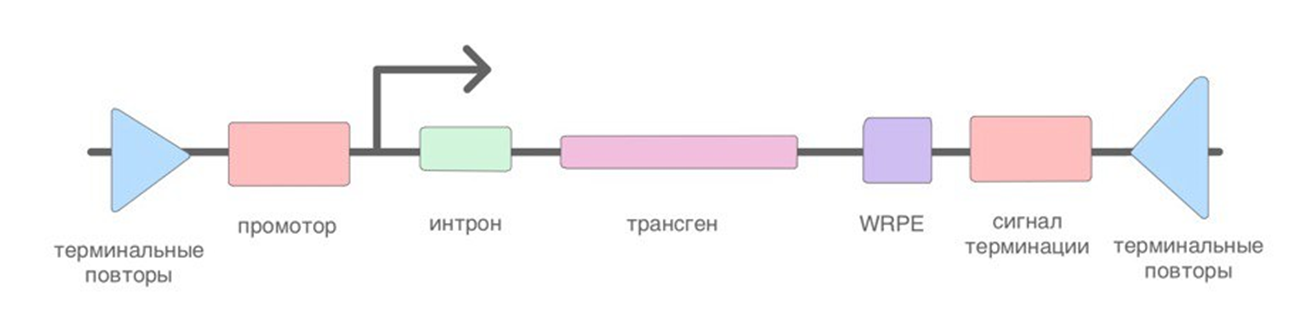
Рисунок 2. Упрощенная схема работы системы CRISPR-Cas9.
рисунок автора статьи
Как модифицируются клетки?
Поговорим о популярной технологии CRISPR-Cas9 (на «Биомолекуле» выходило много статей на эту тему) (рис. 2). CRISPR-система пришла к нам от бактерий, но мы научились использовать ее в своих интересах. В генной терапии эта технология применяется так: искусственно создаются плазмиды, которые содержат cas-9 гены, кодирующие белок Cas-9, и гены, кодирующие модифицированную crРНК (короткие РНК, которые являются копиями РНК, которую мы в будущем будем разрезать. Они нарезаются комплексом из Cas-белков из длинных первичных РНК-предшественников). Эти плазмиды доставляются в клетки, и на их основе собираются комплексы, состоящие из crРНК, которые узнают поврежденный ген, ставший причиной заболевания, и белков Cas-9, которые разрезают ДНК в нужном участке. Поврежденный участок теперь нужно восстановить, делается это по матрице комплементарной ДНК, не содержащей мутации.
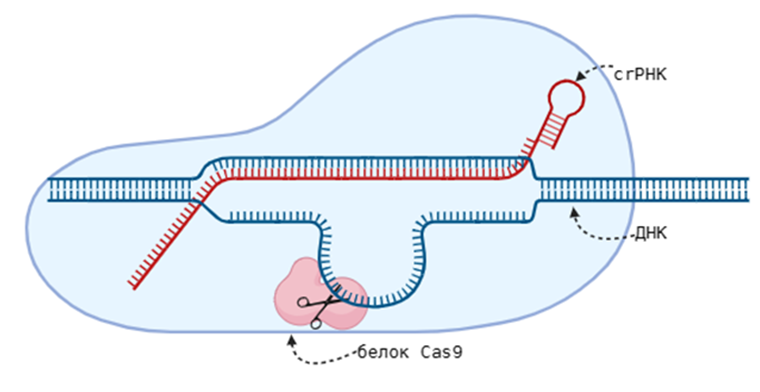
Рисунок 2. Схема кассеты экспрессии.
рисунок автора статьи
К сожалению, эта технология не совершенна, так как работает недостаточно специфично и вносит двойной разрыв цепи ДНК, который может повлечь образование новых мутаций. На помощь приходит технология prime editing [1]. При данном редактировании не требуется производить двойной разрез, вместо этого присутствует pegРНК (гидовая РНК для праймированного редактирования), которая определяет место разреза и несет информацию, которую нужно вставить в ген. pegРНК вместе с ферментом обратной транскриптазой прилипают к разрезанной Cas-белками цепи. Обратная транскриптаза строит ДНК по матрице pegРНК. В результате у нас получается две не комплементарных версии ДНК. Чтобы цепи стали комплементарными, нужно исправить ошибку на одной из них, что осуществляется благодаря системам репарации в клетке и еще одной pegРНК, наводящей нуклеазу на «неправильную» старую цепь. Превосходство этой технологии состоит в точности и универсальности, так как ранее для каждого типа редактирования нужна была своя разновидность CRISPR, а prime editing может выполнять и удаление генов, и вставку новых последовательностей, и замену отдельных нуклеотидов в генетическом коде.
Существуют и другие способы модификаций генома: ZFN и TALEN.
Их объединяет сходство в том, что они основаны на нуклеазах (белки, способные проводить специфическое вырезание и встраивание участка гена).
Их различие состоит в типе нуклеаз: цинковые пальцы в ZFN (белок стабилизируются благодаря иону цинка), которые способны распознавать последовательность из 3 нуклеотидов, и белки TALE, распознающие по одному нуклеотиду и являющиеся более специфичными. Чтобы распознать целевую последовательность нужной длины, сочетают несколько ZFN или TALE в одной нуклеазе.
Такой способ позволяет проводить гораздо более точную модификацию нарушенных генов [2], однако гибкость этих методов хуже, чем у CRISPR и prime editing, потому что для них требуется построение сложной конструкции ДНК-связывающего домена для большей точности нацеливания.
Хорошо, мы разобрались, как происходит модификация и что для нее нужно.
Но как доставить необходимые нам молекулы для дальнейшего геномного редактирования?
Для этого чаще всего, но далеко не всегда, используют вирусы (рис. 3) [3].
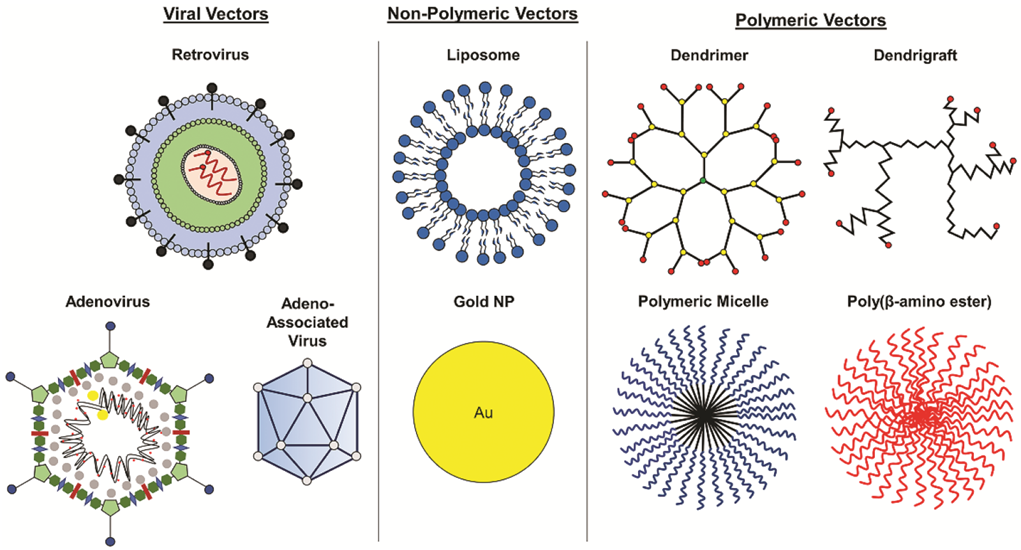
Рисунок 3. Материалы, используемые для доставки генов при генной терапии.
Как можно заметить по диаграмме (рис. 4), при выборе переносчиков модифицированных генов лидируют аденоассоциированные вирусы (AAV), которые преимущественно используются в терапии in vivo, и лентивирусы (относятся к семейству ретровирусов), которые, напротив, используются ex vivo. Подробно об AAV рассказывается в статье спецпроекта «Генная и клеточная терапия» на «Биомолекуле» [4], другая статья посвящена лентивируной доставке [5].
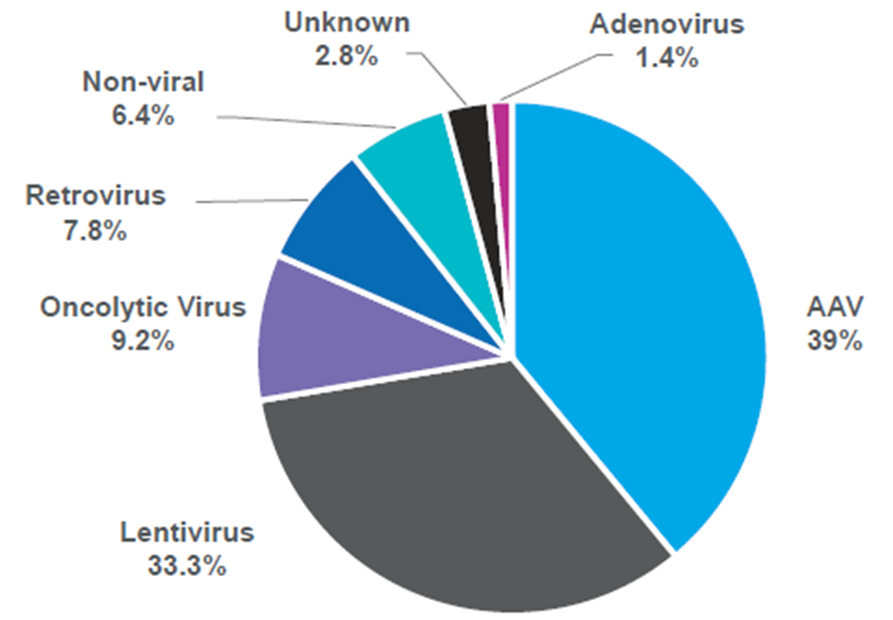
Рисунок 4. Распределение типов векторов доставки генов, используемых в клинических испытаниях лекарственных препаратов для передовой терапии 2021 года.
Каковы причины такого выбора?
Разберемся по пунктам:
- AAV практически непатогенны [4] (но лучше говорить, что эти вирусы менее патогенны, чем другие, потому что клеточный ответ все равно присутствует) [6].
- AAV имеют нескольких серотипов — вариаций вируса, которые могут заражать разные виды тканей и клеток. Это хорошо для внутреннего введения, так как целевые клетки могут находится в разных местах.
- Лентивирусы же способны интегрировать свой генетический материал в геном клеток организма-хозяина; это означает, что они будут наследоваться потомством клеток после деления (рис. 5) [7].
- Существуют векторы лентивируса — самоинакивирующиеся лентивирусы, в которых вирусный промотор инактивируется при интеграции в геном, что подавляет транскрипционную трансактивацию (трансактивация — повышенная скорость экспрессии генов, посредством экспрессии промежуточного белка-трансактиватора) клеточных генов. Это предотвращает образование репликационно-активных вирусных частиц после введения векторного генома в геном клетки-хозяина [5].
По этим причинам лентивирусы используют в генной терапии гемопоэтических клеток, которую преимущественно проводят ex vivo.
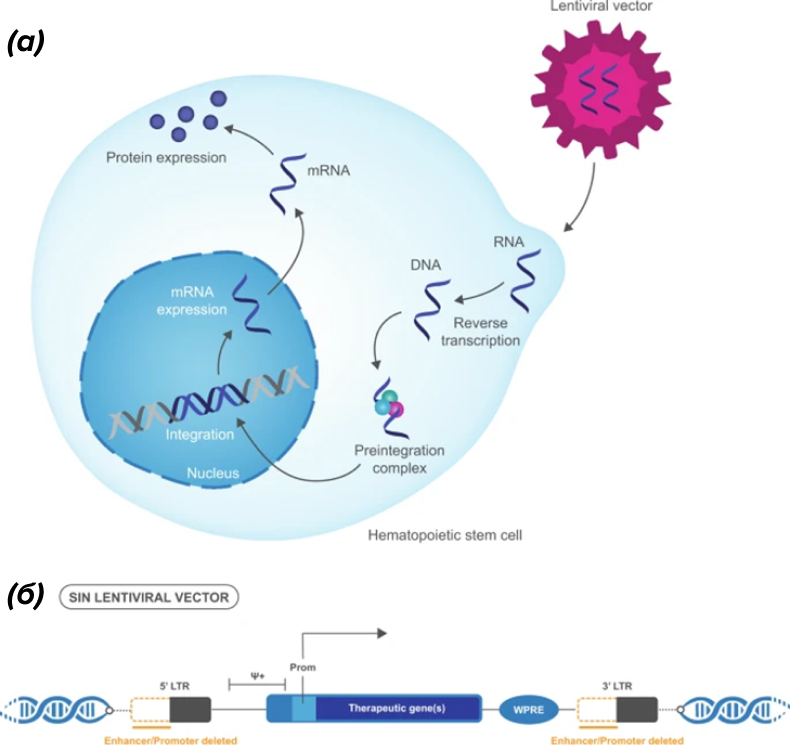
Рисунок 5. (а) — интеграция генетического материала с помощью лентивируса; (б) — состав кассеты лентивирусного вектора.
При чем тут стволовые клетки?
Исправить причины заболевания, тысячи копий которых находятся в клетках организма, очень сложно, поэтому ученые не исправляют, а замещают «бракованные» клетки. Для этого используют стволовые клетки.
Что же такое стволовые клетки и почему они гемопоэтические?
Термин «стволовая клетка» (СК) введен еще в 1908 г. А. А. Максимовым: «Стволовые клетки — отдельная группа клеток, обладающих способностью к самообновлению, пролиферации и дифференцировке в специализированные ткани». Таким образом, они являются «бабушками» других, более специализированных клеток.
Существует несколько типов стволовых клеток по степени того, насколько различные клетки из них образуются:
- Тотипотентные: яйцеклетка, зигота, клетки, образованные при первых делениях зиготы. Из них образуются практически все клетки организма.
- Плюрипотентные: клетки трех зародышевых листков.
- Мультипотентные: клетки разных тканей.
- Олигопотентные: могут дифференцироваться в близкие по функциям клетки; пример такого процесса — миелопоэз.
- Унипотентные: незрелые клетки, которые дают начало только одному типу клеток.
В генной терапии находят свое применение унипотентные, олигопотентные и мультипотентные клетки. Например, эти клетки используют для лечения ряда аутоиммунных и наследственных болезней. О клеточной терапии рассказывает статья «Клетки, которые лечат людей» [8] в рамках спецпроекта «Генная и клеточная терапия».
Рассмотрим гемопоэтические стволовые клетки (ГСК), которые дают начало специализированным клеткам крови и иммунной системы в результате гемопоэза (рис. 6) [9].
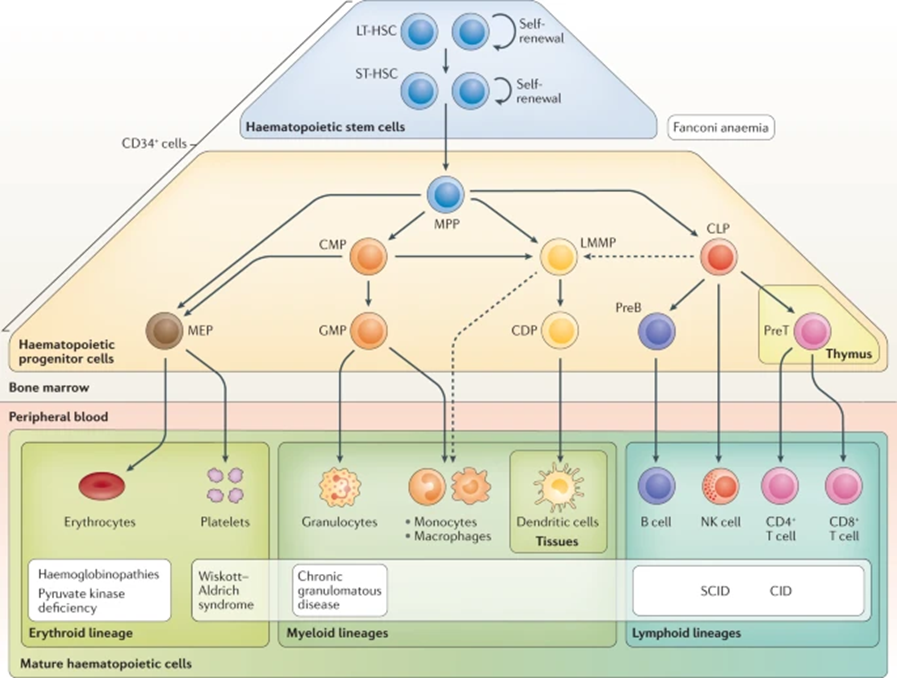
Рисунок 6. Схема гемопоэза — процесса созревания и дифференцировки клеток крови из ГСК.
LT-HSC — длительно репопулирующие (восстанавливающие) костный мозг ГСК;
ST-HSC — краткосрочно репопулирующие (восстанавливающие) костный мозг ГСК;
MPP — мультипотентные предшественники;
CMP — общий миелоидный предшественник;
LMMP — лимфомиелоидный предшественник дендритных клеток;
CLP — общий лимфоидный предшественник;
MEP — мегакариоцит — эритроидный предшественник;
GMP — гранулоцитарно-макрофагальный предшественник;
CDP — общий предшественник дендритных клеток;
preB — предшественник B-лимфоцитов;
preT — предшественник Т-лимфоцитов.
Конечно, при наличии каких-либо наследственных заболеваний крови можно обойтись обычной пересадкой костного мозга, в котором происходит процесс созревания рассматриваемых клеток. Так и поступают при аллогенной трансплантации ГСК (аллогенная — значит, что стволовые клетки берут у другого человека) еще с конца 1960-х годов для лечения Х-сцепленного тяжелого комбинированного иммунодефицита и синдрома Вискотта-Олдрича. Но этим заболеванием медицина не ограничилась, и аллогенную трансплантацию ГСК используют для лечения разных типов лейкемий, лимфом и анемий. Однако существуют недостатки данного метода: например, инфекционные риски или проблематичный поиск подходящего донора костного мозга. Если его не удается найти, используют несоответствующих по HLA (комплекс генов, которые контролируют иммунный ответ и, соответственно, приживаемость донорского органа) доноров, что приводит к большим проблемам, ухудшающим качество жизни пациента. Такие методы, конечно, не подходят и их нужно исправлять.
Как работает генная терапия ГСК?
Клетки ГСК — оптимальные клетки-мишени для терапевтических технологий редактирования генома из-за их способности к самообновлению и дифференцировке [10], потому что введение генетически модифицированных ГСК предоставляет постоянный источник самообновляющихся стволовых клеток, дифференцирующихся в любые клетки крови. Тем самым они обеспечивают пожизненную терапевтическую пользу [11].
Так, у пациента забирают ГСК, которые обогащают и культивируют ex vivo в присутствии факторов роста. Затем эти клетки подвергают трансфекции с помощью ретровирусов, которые и производят доставку правильной версии гена (подробнее об этом — в статье «Лентивирусные векторы: как они стали лучшими векторами для терапии ex vivo» [5]). Далее с помощью нуклеаз и технологии CRISPR осуществляется редактирование генов. При этом происходит разрыв исходной последовательности, после чего существует два пути для восстановления ДНК: гомологичная направленная репарация (HDR), когда матрица ДНК-донора предоставляется матрицей для исправления ошибки, или негомологичное концевое соединение (NHEJ), которое приводит к образованию небольших врезок (вставок или делеций), потому что поврежденные концы цепи соединяются без шаблона.
Далее модифицированные клетки вводятся пациенту. Исправленные клетки производят гемопоэтические клетки, которые экспрессируют правильный ген (рис. 7) [12].
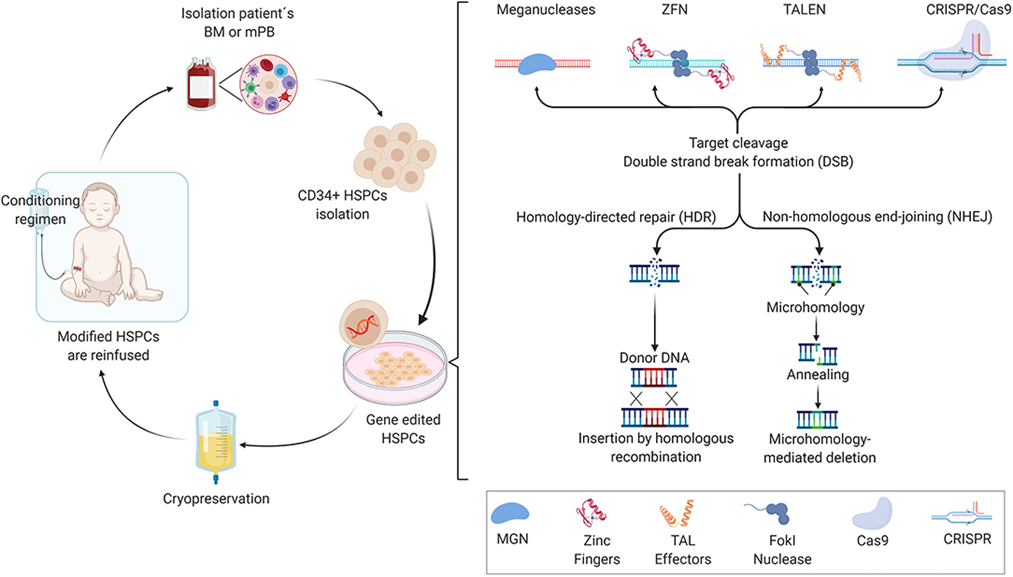
Рисунок 7. Схема редактирования гемопоэтических клеток.
Какие заболевания лечат с помощью генной терапии ГСК?
Генная терапия ГСК стала эффективным методом лечения многих моногенных заболеваний системы крови. Подробно о генной терапии заболеваний крови рассказано в статье «Как болезни крови генной терапией лечили» [13].
К ним относятся первичные иммунодефициты ─ группа заболеваний, для которых характерно нарушение работы различных звеньев иммунитета. Именно эта группа заболеваний была первой, которую лечили с помощью генной терапии.
Так, причиной 20% тяжелых комбинированных иммунодефицитов является дефицит аденозиндезаминазы (ADA) — фермента, нарушение функции которого приводит к накоплению пуриновых метаболитов, особенно токсичных для клеток костного мозга и иммунной системы.
Испытания генной терапии для выявления дефицита ADA привели к восстановлению гуморального и клеточного иммунитета, снижению восприимчивости к инфекциям и коррекции костных аномалий [14]. Все пациенты с дефицитом ADA, получавшие генную терапию в США и Европе, выжили, и ни у кого не было аномальных разрастаний и других нарушений.
Однако не все попытки применения генной терапии могут похвастаться таким же результатом. Один из трагических случаев применения генной терапии описан в статье «Три поколения лекарств» [15], когда пациент с дефицитом орнитиндекарбоксилазы умер от иммунной реакции на генный препарат.
Другое заболевание, при котором наблюдались тяжелые последствия генной терапии — синдром Вискотта-Олдрича (рис. 8). Его причиной является мутация в гене WAS, который кодирует цитоплазматический белок WAS. Он, в свою очередь, влияет на полимеризацию актина в гемопоэтических клетках, что важно для миграции лейкоцитов и формирования иммунологического синапса (процесс при иммунном ответе).
Результаты исследования генной терапии, проведенного с 2006 по 2009 год в Мюнхене, разочаровали, так как терапия привела к развитию у пациентов острого лейкоза, причиной которого, скорее всего, стала повышенная склонность ретровирусов к интеграции вблизи онкогенов.
Однако последующие генные терапии показывают более положительные результаты, так как теперь применяются самоинактивирующеся лентивирусные векторы, о которых говорилось ранее [16].
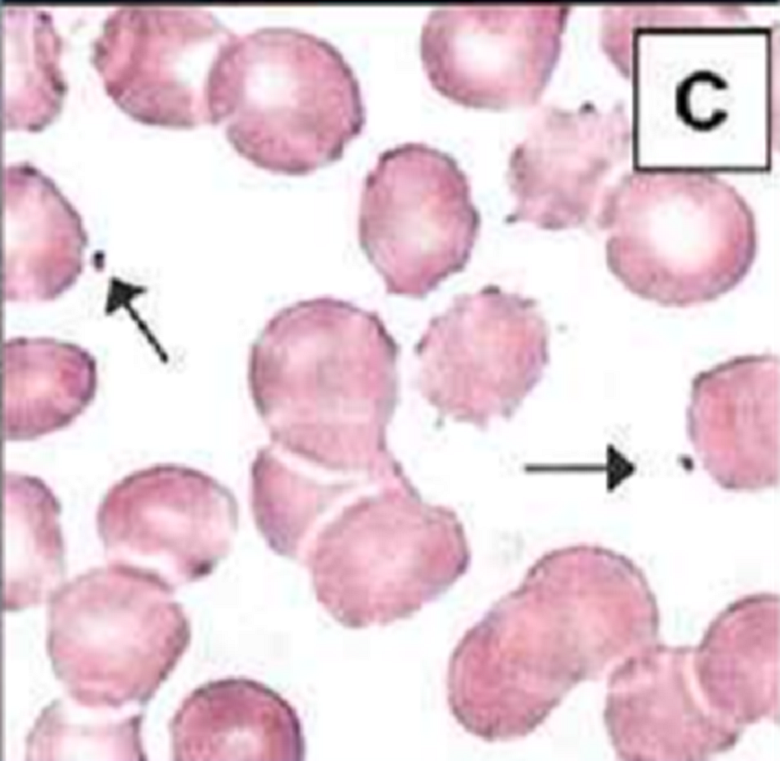
Рисунок 8. Клетки при синдроме Вискотта-Олдрича, аномальные обозначены стрелками.
Гематологические злокачественные новообразования развились у пациентов с Х-сцепленным тяжелым комбинированным иммунодефицитом (это группа редких и опасных для жизни генетических заболеваний, характеризующихся отсутствием или очень низким количеством Т-лимфоцитов в сочетании с отсутствием или дисфункцией В-лимфоцитов и, в некоторых формах, естественных клеток-киллеров) и хронической гранулематозной болезнью (при которой нарушается способность лейкоцитов синтезировать активные соединения кислорода, что, в свою очередь, приводит к проблемам осуществления фагоцитоза).
Еще одно моногенное заболевание крови — является β-талассемия (рис. 9). Это наследственное заболевание, при котором одной из цепей гемоглобина в эритроцитах мало или вообще нет, что приводит к снижению образования гемоглобина и проблемам с переносом кислорода по организму.
К счастью для больных, биотехнологическая компания Bluebird Bio получила одобрение на использование в США генной терапии Zynteglo, что, несмотря на высокую стоимость данной процедуры, является большим достижением для генной терапии в целом, а не только для генной терапии с использованием ГСК.
Также по бета-талассемии в январе 2024 года была одобрена генная терапия Casgevy на основе геномного редактирования CRISPR, о котором говорилось ранее. Она была разработана компаниями CRISPR Therapeutics и Vertex.
И Zynteglo, и Casgevy одобрены для еще одного моногенного заболевания крови — серповидноклеточной анемии [17].
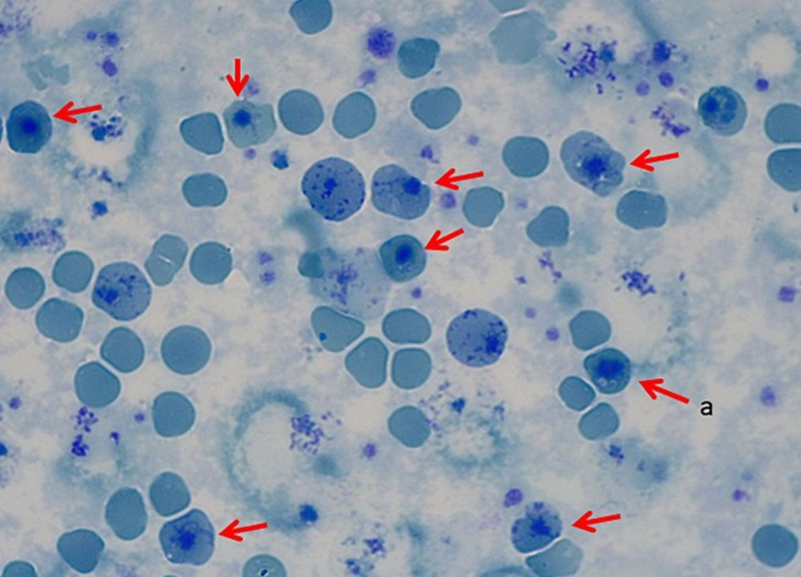
Рисунок 9. Клетки больного β-талассемией (обозначены стрелочками).
В настоящее время в клинической разработке находится несколько генных терапий с помощью ГСК для лечения гемоглобинопатий (группа заболеваний, связанная с нарушением в составе или работе эритроцита, к ним относится β-талассемия), все они направлены на восстановление функциональной выработки белка глобина. Результаты клинических испытаний продемонстрировали стабильное приживление и высокую эффективность.
Ген-скорректированные ГСК обладают способностью дифференцироваться в макрофаги и микроглию (клетки, осуществляющие захват чужеродных частиц и организмов и функционирующие во всем организме, в том числе в головном мозге [18]), что открывает возможность лечения органов за пределами кроветворной системы, например, костей, мышц и мозга. Следовательно, нейрометаболические и нейродегенеративные расстройства являются привлекательными мишенями для генной терапии ГСК.
Недавние данные клинических испытаний при нейрометаболических заболеваниях показали, что существует популяция генно-модифицированных ГСК, которые могут естественным образом преодолевать гематоэнцефалический барьер, распространяться по всему мозгу, встраиваться в мозговую ткань в виде макрофагов и микроглии и экспрессировать терапевтические ферменты, которые поглощаются локальными нейронами [7]. Сейчас уже изучают лечение болезней Паркинсона и Альцгеймера с помощью генной терапии.
А какие проблемы могут возникнуть при терапии?
- Существует возможность внесения ошибок и повреждений в ДНК в процессе редактирования генома, поэтому необходимо придумывать более точные технологии для данной процедуры.
Так, например, предложены мегануклеазы (ферменты, работающие как рестриктазы, но способные при этом распознавать необычно длинные последовательности), сайт-специфические рекомбиназы (осуществляют перестройку сегментов ДНК благодаря распознаванию и связыванию с короткими специфическими последовательностями ДНК). Та же система CRISPR-Cas9 активно используется в генной терапии ГСК, хоть она и несет некоторые риски, о которых говорилось ранее. В ноябре 2023 г. первое одобрение для коммерческого применения получила терапия серповидноклеточной анемии компаний CRISPR Therapeutics и Vertex. - Другая задача, которую нужно решить, — это испытание при терапии in vitro. Дело в том, что тестирование проводится на клеточных линиях, которые отличаются от своих первичных аналогов по некоторым параметрам: способность к трансфекции (внесение невирусных векторов в клетки животных), склонность к гибели клеток, потеря способности к дифференцировке, плоидность, доступность хроматина. Это приводит к различиям в процессах in vivo и in vitro и некоторой непредсказуемости результатов [12].
- Трудности появляются и после введения: трансплантированные клетки обладают низкой приживляемостью из-за низкой жизнеспособности после редактирования генов [19].
Существует решение этой проблемы, а именно обогащение CD34+ фракцией с использованием комбинации дополнительных гемопоэтических поверхностных маркеров (уникальные молекулы на поверхности клеток). Но и тут возникает проблема возможности потери стволовости и гибели клеток. - Также существует риск появления инсерционного мутагенеза (мутагенез, вызванный интеграцией генома вируса в геном человека и приводящий к онкогенезу) и нерегулируемой экспрессии трансгенов, возникающей в результате случайной хромосомной интеграции внесенных ДНК [20].
- Следующие проблемы напрямую затрагивают пациентов и являются наиболее заметными.
Во-первых, это необходимость проведения лимфодеплеции ─ процедуры по устранению собственных клеток для снижения конкуренции между Т-клетками хозяина и донора и риска отторжения аллогенных клеток.
Во-вторых, неизвестно, насколько долговременной окажется модификация после генной терапии ГСК, так как прошло лишь чуть более 20 лет с первых клинических испытаний, продемонстрировавших терапевтический эффект [21].
Из-за этих сложностей, перед использованием стволовых клеток необходимо определить, какие конкретные инструменты и стратегии редактирования генов лучше всего подходят для каждого заболевания, и рассмотреть, дают ли модифицированные клетки преимущество, которое может увеличить способность клеток к приживлению.
Что следует ожидать от будущего?
Как мы заметили, существует множество проблем: от создания технологий редактирования генов до применения их в клинике. Для их преодоления важно разработать и объединить средства доставки и молекулы для редактирования генов, которые позволят проводить эффективное и точное редактирование генов. Также эти процедуры должны быть осуществимы в условиях масштабного производства и, конечно, не должны быть токсичными.
Уже сейчас достигнут большой прогресс в генной терапии, однако из-за жесткого контроля со стороны правительства [22], сложности масштабного производства, токсичности и всего, о чем мы говорили до этого, на данный момент лишь несколько препаратов было одобрено и выпущено в производство. Но стоят они очень дорого, из-за тех же сложностей в их производстве, а также из-за того, что производителям необходимо компенсировать затраты на их разработку.
О процессе формирования стоимости лекарств рассказывается в статье «Фармакоэкономика: лечить или экономить?» [23].
Так что, несмотря на бурное развитие генной терапии, у нее есть еще много трудностей, которые нужно решить.
Литература
- Andrew V. Anzalone, Peyton B. Randolph, Jessie R. Davis, Alexander A. Sousa, Luke W. Koblan, et. al.. (2019). Search-and-replace genome editing without double-strand breaks or donor DNA. Nature. 576, 149-157;
- Птицина С.Н. (2021). Применение методов редактирования генома и генной терапии в лечении заболеваний человека. РМЖ. 10, 57–62;
- Breanne Caffery, Jeoung Lee, Angela Alexander-Bryant. (2019). Vectors for Glioblastoma Gene Therapy: Viral & Non-Viral Delivery Strategies. Nanomaterials. 9, 105;
- Время первых: как аденоассоциированные вирусы стали лучшими в доставке генов in vivo;
- Лентивирусные векторы: как они стали лучшими векторами для терапии ex vivo;
- Joseph Rabinowitz, Ying Kai Chan, Richard Jude Samulski. (2019). Adeno-associated Virus (AAV) versus Immune Response. Viruses. 11, 102;
- Pervinder Sagoo, H. Bobby Gaspar. (2023). The transformative potential of HSC gene therapy as a genetic medicine. Gene Ther. 30, 197-215;
- Клетки, которые лечат людей;
- Giuliana Ferrari, Adrian J. Thrasher, Alessandro Aiuti. (2021). Gene therapy using haematopoietic stem and progenitor cells. Nat Rev Genet. 22, 216-234;
- Federica Zatterale, Michele Longo, Jamal Naderi, Gregory Alexander Raciti, Antonella Desiderio, et. al.. (2020). Chronic Adipose Tissue Inflammation Linking Obesity to Insulin Resistance and Type 2 Diabetes. Front. Physiol.. 10;
- Richard A. Morgan, David Gray, Anastasia Lomova, Donald B. Kohn. (2017). Hematopoietic Stem Cell Gene Therapy: Progress and Lessons Learned. Cell Stem Cell. 21, 574-590;
- Stefanie Klaver-Flores, Hidde A. Zittersteijn, Kirsten Canté-Barrett, Arjan Lankester, Rob C. Hoeben, et. al.. (2021). Genomic Engineering in Human Hematopoietic Stem Cells: Hype or Hope?. Front. Genome Ed.. 2;
- Как болезни крови генной терапией лечили;
- Три поколения лекарств;
- Xiaobai Xu, Chetankumar S. Tailor, Eyal Grunebaum. (2017). Gene therapy for primary immune deficiencies: a Canadian perspective. Allergy Asthma Clin Immunol. 13;
- Обзор новостей биофармы за 2023 год;
- Ликбез по ЦНС;
- Luigi Naldini. (2019). Genetic engineering of hematopoiesis: current stage of clinical translation and future perspectives. EMBO Mol Med. 11;
- Paul R. Crisostomo, Meijing Wang, George M. Wairiuko, Eric D. Morrell, Andrew M. Terrell, et. al.. (2006). HIGH PASSAGE NUMBER OF STEM CELLS ADVERSELY AFFECTS STEM CELL ACTIVATION AND MYOCARDIAL PROTECTION. Shock. 26, 575-580;
- Fischer A. (2000). Severe combined immunodeficiencies (SCID). Clin Exp Immunol. 122, 143–149;
- Sofieke de Wilde, Delphi G.M. Coppens, Jarno Hoekman, Marie L. de Bruin, Hubert G.M. Leufkens, et. al.. (2018). EU decision-making for marketing authorization of advanced therapy medicinal products: a case study. Drug Discovery Today. 23, 1328-1333;
- Фармакоэкономика: лечить или экономить?.