
Как старение влияет на синтез белка
21 августа 2020
Как старение влияет на синтез белка
- 1872
- 0
- 6
Старая (слева) и молодая (справа) мыши существенно различаются по уровню экспрессии генов, связанных с работой иммунной системы, метаболизмом и способностью организма к восстановлению
-
Автор
-
Редактор
В последние годы старение как биологический процесс привлекает все большее внимание молекулярных биологов, которые исследуют, что происходит в стареющем организме на молекулярном уровне. Группа исследователей из НИИ ФХБ имени А.Н. Белозерского, Института молекулярной биологии РАН имени В. А. Энгельгардта и Гарвардской медицинской школы изучила, как в ходе старения изменяются транскрипция и трансляция ряда генов, связанных с работой иммунной системы, метаболизмом и защитой от повреждений, а также описала некоторые любопытные возрастные изменения, затрагивающие динамику трансляции.
Старение как биологический феномен привлекает внимание не только биохакеров, стремящихся максимально увеличить продолжительность жизни, но и молекулярных биологов, занимающихся фундаментальной наукой. И их старания не проходят даром.
Например, сейчас известно, что в ходе жизни организма в его тканях накапливаются неправильно уложенные, окисленные или иным образом модифицированные белки, которые не только не выполняют свою функцию должным образом, но и могут образовывать нерастворимые скопления, нарушающие функционирование целых тканей [1].
Несколько исследований продемонстрировали, что с возрастом в организме в целом снижается интенсивность синтеза белка, уменьшается концентрация факторов инициации и элонгации трансляции, замедляется аминоацилирование тРНК. Сообщается, что в ходе старения происходит интенсивное метилирование промоторов генов рРНК, а концентрация самих рРНК уменьшается [1].
Вместе с тем биологические виды, отличающиеся необычно высокой для своей таксономической группы продолжительностью жизни, как правило, характеризуются очень стабильным протеомом и высокой устойчивостью к окислению белков. Примечательно, что виды, у которых в целом интенсивность синтеза белка понижена, характеризуются повышенной продолжительностью жизни, кроме того, видам-долгожителям вроде голого землекопа [2] часто присущи высокоточный аппарат трансляции и низкий кругооборот белков [1].
Показано также, что экспериментальный нокаут или нокдаун некоторых компонентов аппарата трансляции у червей-нематод [3] существенно увеличивает продолжительность их жизни [1]. Да и в целом широко распространенное представление о положительном влиянии на продолжительность жизни низкокалорийного питания хорошо вписывается в идею о том, что интенсивный метаболизм, в том числе и активный биосинтез белка, по крайней мере частично лежит в основе старения организма . Но что именно происходит с трансляцией как со сложнейшим молекулярным процессом в ходе старения организма? Трансляция каких генов при старении меняется сильнее всего?
О нокауте, нокдауне и других методах генной инженерии рассказывает статья «12 методов в картинках: генная инженерия. Часть II: инструменты и техники» [4].
Подробнее о существующих теориях старения, влиянии питания на старение и различных аспектах этого любопытнейшего биологического явления читайте в нашем спецпроекте «Старение и долголетие» [5], а также в статьях [6], [7].
Для ответа на эти вопросы группа ученых из НИИ ФХБ имени А.Н. Белозерского, ИМБ РАН имени В. А. Энгельгардта и Гарвардской медицинской школы досконально изучила паттерны транскрипции и трансляции генов в печени и почке у мышей в возрасте от 1–3 месяцев до 32 месяцев — весьма преклонного для мышей возраста [1]. Анализ профиля транскрипции исследователи проводили с помощью секвенирования РНК, а для изучения трансляции использовали метод, известный как рибосомный профайлинг. Он заключатся в моментальной остановке рибосом на читаемых ими мРНК с последующим точным определением их положения и количества . В комбинации с секвенированием транскриптома метод позволяет выяснить, на каких мРНК рибосом больше и, следовательно, с каких транскриптов синтезируется больше белка (рис. 1). Включение в исследование мышей нескольких возрастных групп позволило построить зависимость экспрессии определенных генов от возраста. Так, оказалось, что для большинства мышиных генов зависимость уровня экспрессии конкретного гена от времени имеет U-образную выпуклую или вогнутую форму с максимумом в случае одних генов или минимумом в случае других генов в районе 3–11 месяцев, вероятно, отражая переход от ювенильного к взрослому состоянию.
О рутинной работе рибосом и их неожиданных функциях читайте в статьях «Рибосома за работой» [8] и «Чего вы не знаете о рибосоме...» [9]. — Ред.
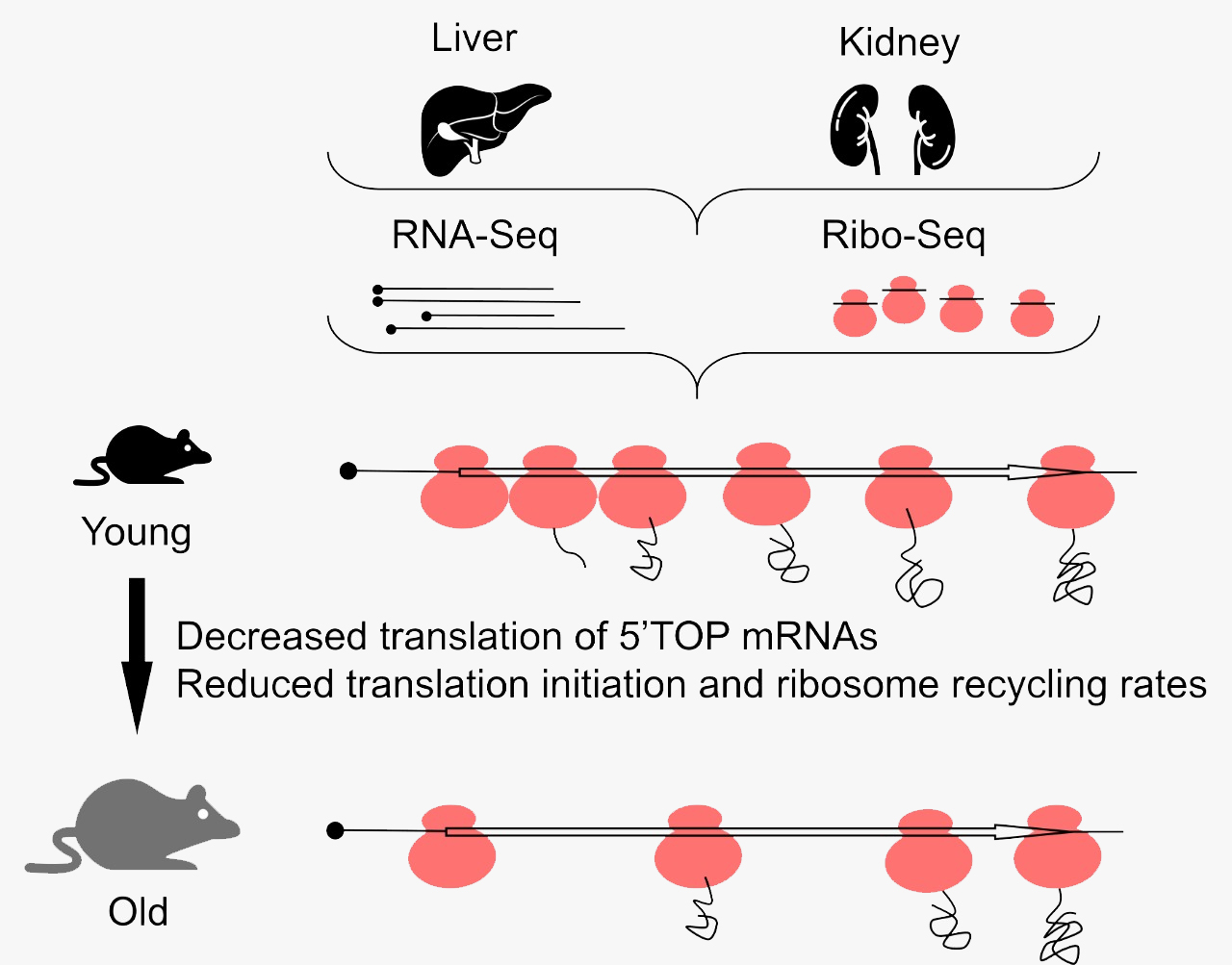
Рисунок 1. Схема исследования, проведенного авторами статьи. Ткани почек и печени, взятые от мышей различных возрастов, были проанализированы с помощью секвенирования РНК и рибосомного профайлинга. Полученные данные позволили оценить, какой вклад вносит трансляция в возрастные изменения экспрессии генов и установить некоторые другие любопытные эффекты, связанные с возрастными изменениями трансляции.
схема выполнена авторами обсуждаемой публикации
Так, по данным экспериментов, в печени и почках мышей с возрастом заметно повышается экспрессия генов, связанных с воспалением и другими иммунными процессами, что соответствует представлениям о развитии хронического воспаления. Сравнив свои данные с результатами более ранних работ на эту тему, авторы смогли выявить четкую и устойчивую возрастную зависимость уровня экспрессии пяти генов, связанных с воспалением и лизосомной деградацией белков (Ctss, C1qa, C1qb, C1qc и Laptm5), так что их можно рассматривать в качестве потенциальных биомаркеров старения.
В отличие от воспалительных процессов, функции митохондрий с возрастом не усиливаются, а угасают. Постепенное возрастное снижение экспрессии некоторых ядерных генов, кодирующих митохондриальные белки, было обнаружено в клетках почек (в клетках печени тоже наблюдалось, но оказалось менее выраженным). Кроме того, синтез компонентов, ответственных за поддержание окислительно-восстановительного баланса, менялся и в печени, и в почках, что хорошо согласуется с широко распространенной теорией о роли окислительного стресса в процессе старения. В то же время в обеих тканях удалось выявить возрастное увеличение экспрессии генов, связанных с регуляцией давления в кровеносных сосудах, а также генов, кодирующих предшественники амилоидов. Также с возрастом в почках снижается синтез белков, связанных с ответом на глюкокортикоидные гормоны, биосинтезом кофакторов и метаболизмом липидов. Примечательно возрастное снижение экспрессии в почках двадцати одного гена компонентов пероксисом, что также согласуется с текущим взглядом на роль возрастных изменений в метаболизме липидов и развитии некоторых заболеваний почек.
О том, как работают митохондрии и какую роль они играют в жизни клетки и целого организма, повествует спецпроект «Биоэнергетика». — Ред.
В общем и целом, большинство возрастных изменений уровня трансляции коррелирует с изменениями уровня транскрипции как в печени, так и в почках, поэтому, вероятнее всего, ключевые изменения экспрессии генов, связанные со старением, происходят именно на уровне транскрипции. Авторы исследования сумели выявить несколько транскрипционных факторов, которые, предположительно, отвечают за возрастные изменения транскрипции. Бóльшая часть генов-мишеней этих факторов задействована в функционировании иммунной системы и воспалении. Многие из транскрипционных факторов, отвечающих за возрастные изменения профилей транскрипции, оказались общими для печени и почек, но среди них есть и тканеспецифичные факторы. В частности, в почках многие транскрипционные факторы, изменяющие профили транскрипции с возрастом, так или иначе связаны с метаболизмом липидов и функционированием пероксисом.
Авторы работы впервые продемонстрировали, что многие гены, экспрессия которых понижается по мере старения организма, связаны с биосинтезом белка, метаболизмом некодирующих РНК и образованием рибосом. В их числе есть гены рибосомных белков, транскрипционных факторов, а также компонентов, задействованных в биогенезе рРНК и рибосом, процессинге некодирующих РНК и других процессах, имеющих ключевое значение для экспрессии генов и ее регуляции. Стоит отметить, что предыдущие исследования, рассматривавшие преимущественно только транскрипционные возрастные изменения, не могли выявить снижение синтеза этих белков, поскольку оно связано с подавлением трансляции, а не транскрипции.
Некодирующие РНК, впрочем, могут кодировать, вопреки своему названию, функциональные пептиды [10]. Примечательно, что длинные некодирующие РНК есть и у бактерий [11], хотя об их функциях известно гораздо меньше, чем о функциях длинных некодирующих РНК эукариот.
Для того чтобы данные по трансляции с определенных мРНК можно было сравнивать не только с аналогичными данными для организма другого возраста, но и с данными по трансляции с других транскриптов, авторы работы использовали специальную нормированную метрику — «занятость» рибосом (RO от англ. ribosome occupancy). Для каждого гена RO вычисляется как количество рибосом, «пойманных» на синтезе его белкового продукта, деленное на общее количество транскриптов гена. Иными словами, RO позволяет понять, насколько интенсивно, по сравнению с другими генами, рибосомы взаимодействуют с мРНК данного гена и синтезируют белок по ее матрице (как правило, чем больше рибосом «сидят» на мРНК гена, тем больше белка с него синтезируется).
Анализ данных рибосомного профайлинга, переведенных в термины RO, показал, что с возрастом и в печени, и в почках увеличивается трансляция с мРНК, связанных с воспалением и дифференцировкой клеток различных типов. В то же время в почках с возрастом заметно снижается экспрессия генов, связанных с образованием и функционированием митохондрий, таких как гены компонентов электрон-транспортной цепи [12]. Примечательно, что трансляция многих ядерных генов, кодирующих белки митохондриального назначения, регулируется сигнальным путем mTOR, причем главную роль в этом процессе играет белок 4E-BP1. Этот же белок отвечает за возрастное снижение экспрессии гена интерферонового регуляторного транскрипционного фактора 7 (Irf7). С возрастом показатель RO для этого гена снижается почти в шесть раз. Стоит отметить, что по мере старения в печени увеличивается синтез субъединиц важнейшего регулятора метаболизма железа — ферритина [13], — трансляция которых зависит от особого железозависимого элемента в 5′-нетранслируемых областях их транскриптов. Вероятно, этот эффект связан с хорошо известными возрастными нарушениями метаболизма и запасания железа, которые зачастую являются последствиями возрастного хронического воспаления. Дело в том, что у грызунов по мере старения в тканях организма накапливается железо, а повышение его концентрации приводит к активации экспрессии гена ферритина и других генов, имеющих железозависимый элемент.
Сигнальный путь mTOR был упомянут выше неслучайно. Авторы исследования установили, что именно уменьшение активности этого сигнального пути по мере старения отвечает за возрастное снижение трансляции большой группы генов, которые объединяет наличие на 5′-конце особой олигопиримидиновой последовательности (5′-TOP от англ. 5′-terminal oligopyrimidine). Известно, что mTOR на уровне трансляции активирует экспрессию генов, продукты которых сами играют важнейшую роль в трансляции, поэтому снижение активности или ингибирование протеинкиназы mTOR подавляет интенсивность белкового синтеза в целом . Однако сильнее всего ингибирование mTOR сказывается именно на трансляции транскриптов с 5′-TOP. Анализ RO для таких mTOR-зависимых транскриптов показал, что с возрастом их синтез в печени падает сильнее всего по сравнению с остальными генами. В частности, существеннее всего при старении в печени «проседает» экспрессия генов, кодирующих некоторые рибосомные белки и фактор элонгации трансляции Eef2. У всех них в транскриптах имеется 5′-TOP, поэтому трансляция этих мРНК существенно зависит от сигнального пути mTOR. Похожие, хотя и менее выраженные изменения были выявлены в почках. Авторы работы полагают, что синтез рРНК и тРНК также претерпевает существенные возрастные изменения, поскольку он находится под сильным влиянием пути mTOR.
Активная работа mTOR не только поддерживает клеточный цикл и трансляцию белка, но и ухудшает процесс аутофагии [14] — избавления клетки от накопившегося за всю её жизнь «мусора» (дефектных и ненужных молекул). В том числе и поэтому ингибирование mTOR (и, как следствие, интенсификация аутофагии) приводит к увеличению продолжительности жизни модельных животных. — Ред.
Но самый неожиданный и любопытный эффект старения, который выявили авторы работы, состоит в перераспределении рибосом на транскриптах. Оказалось, что с возрастом частота встречаемости рибосом на 5′-концах транскриптов падает и увеличивается на 3′-концах как в печени, так и в почках. Для мышиной печени «точкой невозврата» является возраст 11 месяцев, после которого локализация рибосом становится сильно «перекошенной» в сторону 3′-конца. Особенно выражен эффект смещения рибосом при сравнении образцов тканей от мышей возрастом 11 месяцев и 32 месяца. Наиболее яркий эффект смещения рибосом — вблизи старт- и стоп-кодонов, но его можно пронаблюдать и по всей длине транскрипта.
Один из авторов работы, Сергей Дмитриев, комментирует ее результаты следующим образом: «Наверное, наиболее важным результатом нашей работы с точки зрения понимания механизмов старения является то, что мы показали существенное падение уровня синтеза компонентов трансляционного аппарата в органах стареющих мышей. Интенсивность наработки некоторых рибосомных белков в печени 32-месячных грызунов, например, оказалась в три раза ниже, чем у молодых животных. Причем это снижение происходит именно благодаря регуляции трансляции, поэтому до нас оно не было замечено. То, что белковый синтез у “пожилых” животных идет менее интенсивно, было известно и раньше — но теперь стало понятно, почему это происходит: в клетке просто производится меньше “машин” для биосинтеза белка. Интересный аспект всего этого — что в этой регуляции, по-видимому, замешана протеинкиназа mTOR, которую уже давно “подозревают в связях” со старением. Существуют фармакологические ингибиторы этой киназы (например, рапамицин), которые значимо продлевают жизнь многим модельным организмам. Правда, здесь мы сталкиваемся с парадоксом: с одной стороны, снижение активности белкового синтеза такими лекарствами продлевает жизнь, а с другой — пониженная активность, по нашим данным, характерна как раз для старых животных. Объяснением могло бы быть то, что падение скорости синтеза белка — это не причина старения, а следствие, попытка организма справиться с меняющимися условиями (накоплением в клетке всякого “мусора” и “поломок” — в частности, неправильных белков). Понятно, что когда в квартире не делают уборку, то можно прожить в ней чуточку дольше, если меньше мусорить. Именно это, по-видимому, делает стареющая клетка, и точно так же работают продлевающие жизнь ингибиторы mTOR. К сожалению, эта стратегия лишь отодвигает печальный финал: рано или поздно мусор погребет под собой постояльца. А как провести в клетке “генеральную уборку”, мы пока не придумали».
Литература
- Aleksandra S. Anisimova, Mark B. Meerson, Maxim V. Gerashchenko, Ivan V. Kulakovskiy, Sergey E. Dmitriev, Vadim N. Gladyshev. (2020). Multifaceted deregulation of gene expression and protein synthesis with age. Proc Natl Acad Sci USA. 117, 15581-15590;
- Преодолевшие старение. Часть II. Дети подземелья;
- Модельные организмы: нематода;
- 12 методов в картинках: генная инженерия. Часть II: инструменты и техники;
- Старение: остановить нельзя смириться;
- Старение и долголетие: эпигеном раскрывает тайны;
- Почему мы не боимся смерти? Первый шаг к победе над старением;
- Рибосома за работой;
- Чего вы не знаете о рибосоме...;
- Кодирующие некодирующие РНК;
- Длинные некодирующие РНК бактерий;
- Болезни и изменения клеточного метаболизма;
- Jinze Xu, Zhenhua Jia, Mitchell D. Knutson, Christiaan Leeuwenburgh. (2012). Impaired Iron Status in Aging Research. IJMS. 13, 2368-2386;
- Аутофагия, протофагия и остальные.





