
Карманная лаборатория для новых лекарств
10 октября 2017
Карманная лаборатория для новых лекарств
- 586
- 0
- 2
Стеклянный слайд размером с половину кредитной карты позволяет ученым проводить тысячи экспериментов одновременно, экономя время, оборудование, ценные клетки и дорогие реактивы.
сайт www.pt-magazin.de
-
Автор
-
Редакторы
Темы
Статья на конкурс «био/мол/текст»: Вдохновением для поиска новых лекарств являются так называемые «библиотеки» химических веществ, действие которых необходимо проверить на клетках. Традиционные способы такого скрининга слишком трудоемкие, дорогие и медленные. Группа ученых из Германии создала платформу на основе одновременно водоотталкивающего и смачиваемого полимера, благодаря которой за считанные минуты можно образовать тысячи капель, содержащих клеточную культуру. Платформа делает возможным одновременное проведение тысяч токсикологических экспериментов на обычных и стволовых клетках. Это ускоряет процесс нахождения новых биоактивных веществ и делает возможным индивидуальный подбор медикаментов.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Романтики с восхищением смотрят на звездное небо, а ученые, разрабатывающие новые лекарства, черпают вдохновение в химическом пространстве (от англ. chemical space). Как Вселенная состоит из звезд, так химическое пространство населяют миллиарды и миллиарды самых разных химических веществ. И подобно тому, как звезды объединяются в галактики, ученые группируют химические вещества в так называемые «библиотеки». Когда приходит время для поиска нового лекарства, тысячи, а то и миллионы веществ из одной библиотеки сначала тестируют на клетках, в надежде, что будет найден достойный кандидат на доклинические (на животных), а затем и клинические (на людях) испытания. При этом используют разные виды клеток — раковые, стволовые или, например, клетки почек. Для того чтобы клетки чувствовали себя хорошо, их помещают в питательную среду и растят в атмосфере углекислого газа и практически стопроцентной влажности в специальных инкубаторах .
Подробнее о процессе создания новых лекарств можно узнать из статьи Антона Чугунова «Драг-дизайн: как в современном мире создаются новые лекарства» [1], а про жизнь клеток в лабораториях — из статьи Георгия Шаронова и Ольги Пташник «Методы в картинках: клеточные технологии» [2].
В отличие от Александра Флеминга, открывшего пенициллин по счастливой случайности, современные исследователи пользуются в процессе создания новых лекарств достижениями робототехники и информатики. Молекулярное моделирование помогает отсеять совсем бесперспективные вещества еще до начала эксперимента [3], а роботы выполняют за ученых многие рутинные задачи [4]. Новые лаборатории буквально напичканы компьютерами и лабораторными киборгами. Но какому ученому не хотелось бы иметь настолько маленькую лабораторию, что она помещается в карман, да еще и проводить на ней по тысяче экспериментов за раз?
Прототип такой миниатюрной высокопроизводительной лаборатории сделали в немецком Технологическом институте города Карлсруэ. В Северном кампусе этого института раньше проводили регенерацию ядерного топлива, а сейчас у окошка с видом на захоронение 60 000 тонн мало- и среднерадиоактивных ядерных отходов живет моя кофейная чашка, ободряющая в суровые аспирантские будни. Я работаю в группе функциональных и «умных» материалов, которой руководит московский химик Павел Левкин. Именно в этой группе придумали, как превратить обычный стеклянный слайд в целую лабораторию для исследования стволовых и обычных клеток и при этом находить новые лекарства.
Исследование стволовых клеток — полоса препятствий
Стволовые клетки — настоящие маги-оборотни. Они могут превращаться (дифференцироваться) в практически любую клетку нашего организма, например в клетку сердца или в нервную клетку. Эта способность называется плюрипотентностью. В то время как обычная клетка просто умирает от старости или повреждений, стволовые клетки могут самообновляться и размножаться. Именно плюрипотентность и самообновление отличает стволовые клетки от остальных клеток и делает их уникальным объектом для исследований. Самая большая в мире биомедицинская исследовательская организация National Institutes of Health (США) планирует потратить в 2018 году более 1,2 млрд долларов на исследования, связанные со стволовыми клетками — столько же, сколько выделяет на исследования коронарной болезни сердца, рака груди и атеросклероза вместе взятые, а «Биомолекула» публикует десятки статей об открытиях в этой области .
Например, о сложном судьбоносном выборе стволовой клетки можно почитать в статье «Кем быть? Как гемопоэтическая стволовая клетка выбирает профессию» [5], а про обратимость этого выбора — в обзоре Нобелевской премии по медицине: «Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки» [6].
Сохранить характерную стволовость (от англ. stemness) стволовых клеток в лабораторных условиях тяжело, потому что ученые еще не знают всех факторов, которые влияют на превращение стволовых клеток в обычные клетки [7]. Как только стволовая клетка дифференцировалась, она перестает быть стволовой, и хотя получившиеся клетки можно использовать в регенеративной медицине и тканевой инженерии (или чтобы сделать искусственное мясо для гамбургера [8]), их драгоценные качества утеряны.
Чтобы узнать, в каких условиях стволовость сохраняется дольше всего, ученые добавляют к стволовым клеткам всевозможные вещества и смотрят, сохранили ли клетки это свойство или превратились в другие клетки. Чтобы как можно быстрее получить точные данные, сотни таких экспериментов проводят одновременно. Этот процесс сбора информации называется высокопроизводительным скринингом (от англ. high-throughput screening). С этой целью во многих лабораториях мира используют микротитрационные планшеты, которые представляют собой прямоугольные пластиковые пластинки с большим количеством углублений, где и хранят стволовые клетки, и куда потом добавляют тестируемые вещества. Количество таких микропробирок обычно не превышает 1536 — столько веществ или их комбинаций можно за раз опробовать на клетках. Чтобы не заполнять многие сотни микропробирок самостоятельно, ученые используют роботов, которые с помощью пипетки переносят нужное количество исследуемых веществ в соответствующее углубление планшета .
Больше о том, как роботы упрощают жизнь исследователям, рассказывает Юлия Кондратенко: «Автоматические лаборатории и светлое будущее естественнонаучных исследований» [4].
Однако эта работа очень кропотливая и занимает много времени даже у самого дорогого и современного робота. Кроме того, несмотря на то, что углубления в планшете достаточно маленькие (но не меньше 40 микролитров, то есть 40 миллионных долей литра), в каждом эксперименте расходуется большое количество дорогих стволовых клеток. Это тормозит работу многих исследовательских лабораторий [9].
Спонтанные капли для выращивания клеток
Как же уменьшить количество используемых стволовых клеток и исключить из уравнения дорогого и медленного робота? Для этого перенесемся обратно в Германию. Представьте, что мы едем по скоростному немецкому автобану ко мне на работу в Северный кампус. С самого утра сыплется мелкий дождь — типичная немецкая осень. К лобовому стеклу прилипают капли. В какой-то момент две маленькие капли обнимаются и начинают лениво стекать вниз, подминая под себя другие капли и становясь все больше и больше. Можно делать ставки, какая лужица быстрее доберется до дворников.
А теперь попробуем мысленно прокрутить этот процесс в обратную сторону. Берем лужицу (большую материнскую каплю) и тащим ее по стеклу, а она оставляет за собой след в виде одинаковых капель до тех пор, пока не закончится. Конечно, с обычным автомобильным стеклом такое не получится — лужица будет размазываться, менять свою форму, вытягиваться, но так и не станет рассаживать капли по нужным нам местам. Что же делать?
Павел Левкин и аспиранты (чьи кофейные чашки смотрели на ядерное захоронение задолго до моей) придумали такое покрытие для стекла, которое позволяет из одной большой материнской капли делать тысячи упорядоченных маленьких (до 3 нанолитров —трёх миллиардных долей литра!) капель одним движением руки [10], [11] (рис. 1).

Рисунок 1. Процесс создания капель с помощью пипетки — справится даже ребенок!
Чтобы увидеть рисунок в полном размере, нажмите на него.
Это полимерное покрытие состоит из участков, задерживающих капли воды (так называемых гидрофильных регионов), и участков, которые воду отталкивают (гидрофобных регионов). Участки чередуются друг с другом, образуя нужный шаблон (рис. 2).
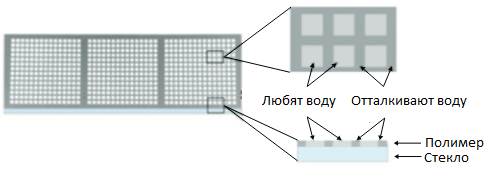
Рисунок 2. Схематическое распределение гидрофильных и гидрофобных участков на DMA-слайде.
[12], рисунок адаптирован
Таким образом, если мы тянем материнскую каплю через все покрытие, она оставляет маленькие дочерние капельки только на гидрофильных участках, в то время как гидрофобные участки ее отпугивают (эффект гидрофобности рассмотрен со всех сторон Антоном Чугуновым в статье «Физическая водобоязнь» [13]).
Этот cпонтанный процесс называется прерываемым каплеобразованием, а слайд с гидрофильно-гидрофобным полимерным покрытием — Droplet Microarray Platform (сокр. DMA-слайд).
Зачем нам нужны эти капли? Биологи в нашей группе используют их взамен углублений в микротитрационных планшетах [10], [11]. Классически (как описано в «Клеточных технологиях» [2]) мы бы заполнили чашку Петри или микропланшеты питательной средой вместе с клетками и поместили их в инкубатор. Однако чтобы заполнить углубления в планшетах, нужно большое количество клеток. Вместо этого мы набираем в пипетку немного питательной среды вместе с клетками, делаем материнскую каплю на DMA-слайде и катим ее через всю полимерную поверхность. Так в течение пары минут мы получаем до 4563 капель объемом в 3 нанолитра каждая, и в каждой можно проводить отдельный эксперимент, вместо того, чтобы для каждого отдельного эксперимента пипетировать в углубления микротитрационного планшета или напрягать для этих целей робота. То есть этот процесс экономит большое количество клеток и не требует роботов или другого дорогого оборудования. Так DMA-слайд c 4563 гидрофильными регионами в 15 000 раз экономнее, чем стандартные микротитрационные планшеты с 384 углублениями. Этот эффект достигается за счет радикального уменьшения объема используемой питательной среды с клетками. Другими словами, если изготовить DMA-слайд размером с микротитрационный планшет, то один DMA-слайд заменяет до 75 планшетов с 384 углублениями каждый.
Скрининг на раз-два
Теперь исследовать влияние различных веществ на сохранение или потерю стволовыми клетками своих уникальных качеств гораздо проще. Необходимо нанести на гидрофильные регионы DMA-слайда нужные вещества, а затем провести по слайду материнской каплей, содержащей стволовые клетки, которые затем распределятся по гидрофильным регионам (рис. 3). По тому, дифференцировались ли стволовые клетки после взаимодействия с веществами или нет, можно судить о сохранении стволовости. Аспиранты в нашей группе также показали, что сам DMA-cлайд поддерживает стволовость клеток за счет особой шероховатой структуры полимера, выгодно отличаясь от гладких микротитрационных планшетов [7], [14].
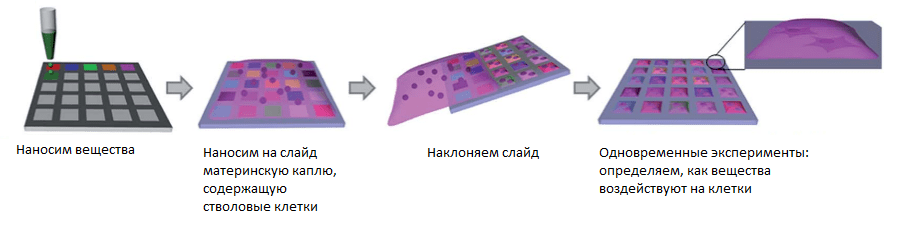
Рисунок 3. Cхема эксперимента взаимодействия разных веществ и стволовых клеток.
Чтобы увидеть рисунок в полном размере, нажмите на него.
Другие виды клеток (например, раковые клетки шейки матки, клетки почек человеческого эмбиона или клетки аденокарциномы) тоже можно культивировать на DMA-слайдах [11]. Таким образом можно сканировать огромные библиотеки веществ и определять их взаимодействие с разными видами клеток. Цель подобных экспериментов — выявление тенденций в жизнеспособности клеток в зависимости от химической структуры молекул, предварительно нанесенных на слайд. Чтобы определить, остались ли клетки живыми после контакта с веществом, или вещество оказалось для них токсичным, клетки необходимо окрасить .
Классически для этого используют смесь йодистого пропидия и ацетометоксикальцеина. Ацетометоксикальцеин проникает через мембрану живых клеток и расщепляется ферментом эстеразой, образуя кальцеин. Благодаря зеленой флуоресценции (свечению) кальцеин можно увидеть под флуоресцентным микроскопом. Йодистый пропидий, напротив, не может проникнуть через мембрану живых клеток. Если клетка погибла, то ее мембрана разрушается, пропидий попадает внутрь мертвой клетки и внедряется в ее ДНК. Красная флуоресценция йодистого пропидия указывает на то, что клетка мертва.
Чтобы одновременно добавить красящие реагенты ко всем клеткам в каплях, используют второй DMA-cлайд, на который с помощью прерываемого каплеобразования мы наносим окрашивающую смесь [12]. Этот слайд потом совмещается со слайдом с клетками — мы в лаборатории называем этот процесс сэндвичингом (от англ. sandwich), потому что два слайда напоминают булочки, из которых делают сэндвич (рис. 4). Окрашенные таким образом клетки можно микроскопировать [15]. Так как добавление окрашивающей смеси происходит одновременно во все капли, использование двух DMA-слайдов позволяет окрашивать все клетки паралелльно и таким образом экономит время. Расход окрашивающей смеси также значительно уменьшается по сравнению с микротитрационными планшетами.
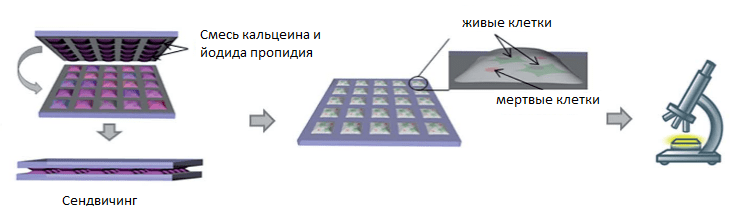
Рисунок 4. Процесс сэндвичинга — параллельного добавления красящих реагентов к клеткам.
Новые лекарства и точная диагностика
Реакция клеток на различные вещества очень важна в процессе создания новых лекарств. За счет низкой стоимости производства слайдов и тысячекратного уменьшения количества расходуемых клеток и других расходных материалов, эксперименты можно повторять бóльшее число раз для более точной статистики. В крупных фармацевтических компаниях за день сканируют до 100 тысяч химических соединений [16], и новая технология может значительно ускорить процесс появления новых лекарственных средств. Побочный проект нашей группы — компания AquArray — недавно выиграла грант от Федерального министерства экономики и технологии и теперь занимается выведением DMA-технологии на рынок.
В будущем DMA-слайды могут быть использованы в персонализированной диагностике различных болезней [9]. Каждый пациент получит лечение, подобранное специально для него. Например, бывает тяжело точно подобрать химиотерапию для конкретного пациента, больного раком, так как разные опухоли индивидуально и иногда непредсказуемо реагируют на разные противораковые препараты. В этом случае выделенные при биопсии раковые клетки можно исследовать на DMA-слайде, на который нанесены химиотерапевтические препараты, и таким образом определить, на какой из препаратов опухоль отреагирует наилучшим образом. Так лечение будет подобрано под конкретного пациента, и шансы на успех терапии повысятся. Кроме того, раковые стволовые клетки, которые могут быть выделены из раковых опухолей в совсем небольшом количестве, и которые предположительно влияют на образование метастазов и возвращение болезни, также можно будет быстро и недорого исследовать на DMA-слайде, и при необходимости скорректировать курс лечения. Эти исследования не нуждаются в дорогостоящем оборудовании, оптимально подходят для небольшого количества клеток и могут спасти многих раковых больных или повысить качество их жизни.
Почти сто лет назад счастливый случай подарил нам пенициллин, а сегодня открытие нового лекарства — динамичный, развивающийся, относительно управляемый, пусть и очень трудоемкий процесс. Миниатюризация и упрощение протоколов не оставят его без изменений. Возможно, когда-то вся вселенная химических веществ поместится на ладони.
Литература
- Драг-дизайн: как в современном мире создаются новые лекарства;
- 12 методов в картинках: клеточные технологии;
- Виртуальные тропы реальных лекарств;
- Автоматические лаборатории и светлое будущее естественнонаучных исследований;
- Кем быть? Как гемопоэтическая стволовая клетка выбирает профессию;
- Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки;
- Tina Tronser, Anna A Popova, Pavel A Levkin. (2017). Miniaturized platform for high-throughput screening of stem cells. Current Opinion in Biotechnology. 46, 141-149;
- Ott S. (2013). Have a taste of the world’s first stem cell burger. CNN;
- Landgraf M. (2017). Minireagenzgläser aus Wassertropfen. Karlsruher Institut für Technologie;
- Anna A. Popova, Claire Depew, Katya Manuella Permana, Alexander Trubitsyn, Ravindra Peravali, et. al.. (2017). Evaluation of the Droplet-Microarray Platform for High-Throughput Screening of Suspension Cells. SLAS TECHNOLOGY: Translating Life Sciences Innovation. 22, 163-175;
- Anna A. Popova, Konstantin Demir, Titus Genisius Hartanto, Eric Schmitt, Pavel A. Levkin. (2016). Droplet-microarray on superhydrophobic–superhydrophilic patterns for high-throughput live cell screenings. RSC Adv.. 6, 38263-38276;
- Anna A. Popova, Sebastian M. Schillo, Konstantin Demir, Erica Ueda, A. Nesterov-Mueller, Pavel A. Levkin. (2015). Droplet-Array (DA) Sandwich Chip: A Versatile Platform for High-Throughput Cell Screening Based on Superhydrophobic-Superhydrophilic Micropatterning. Adv. Mater.. 27, 5217-5222;
- Физическая водобоязнь;
- Mona Jaggy, Ping Zhang, Alexandra M. Greiner, Tatjana J. Autenrieth, Victoria Nedashkivska, et. al.. (2015). Hierarchical Micro-Nano Surface Topography Promotes Long-Term Maintenance of Undifferentiated Mouse Embryonic Stem Cells. Nano Lett.. 15, 7146-7154;
- 12 методов в картинках: микроскопия;
- Adam Smith. (2002). Screening for drug discovery: The leading question. Nature. 418, 453-459.






