
Куда девалась уриказа?
24 сентября 2019
Куда девалась уриказа?
- 2889
- 3
- 3
Истина где-то рядом ©
коллаж автора статьи
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Эта загадочная пропажа произошла около 17 миллионов лет назад, когда на нашей планете жили древние человекообразные обезьяны. Исчез фермент. «А что в этом загадочного? — спросите вы. — Такое регулярно случается: одни белки рождаются, другие перестают работать». А я отвечу вам, что герой этой истории — фермент, отсутствующий у человекообразных обезьян, — необходим другим млекопитающим. Например, трансгенные мыши, не способные его синтезировать, живут всего месяц. Безусловно, загадка исчезновения такого белка не осталась без внимания ученых.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Как же это произошло?
Уриказа, или уратоксидаза, — древний фермент, который нашли у представителей всех доменов жизни: бактерий, архей и эукариот. У животных она работает в печени и участвует в катаболизме пуринов. Уриказа катализирует превращение малорастворимой мочевой кислоты (моноурата натрия, а для краткости — урата) в 5-гидроксиизоурат — короткоживущее соединение, быстро переходящее в водорастворимые аллантоин, мочевину и аммиак, которые успешно выводятся из организма. В связи с отсутствием уриказы, у человекообразных обезьян физиологическая концентрация мочевой кислоты в крови в несколько раз выше, чем у других млекопитающих [1].
Человекообразные обезьяны — не единственные животные без уриказы (рис. 1). Среди позвоночных ее не имеют птицы, большинство рептилий и кенгуровая крыса — житель пустыни. Тут история особая: у этих животных мочевая кислота вообще является основным конечным продуктом всего азотистого обмена. Такие организмы называются урикотельными. Альтернативные варианты — уреотелия (выделение мочевины) и аммонителия (выделение аммиака) — требуют растворения конечных продуктов обмена в большом количестве воды. Мочевая кислота является менее токсичным соединением и может выделяться в более концентрированном виде [2–4]. Тем не менее большинство млекопитающих предпочитает с ней не связываться и выделять более растворимые азотистые соединения, расходуя воду. У мышей с поврежденным геном уриказы кристаллы урата забивают почечные канальцы, в большинстве случаев в течение месяца приводя к нарушениям функции почек, не совместимым с жизнью [5].
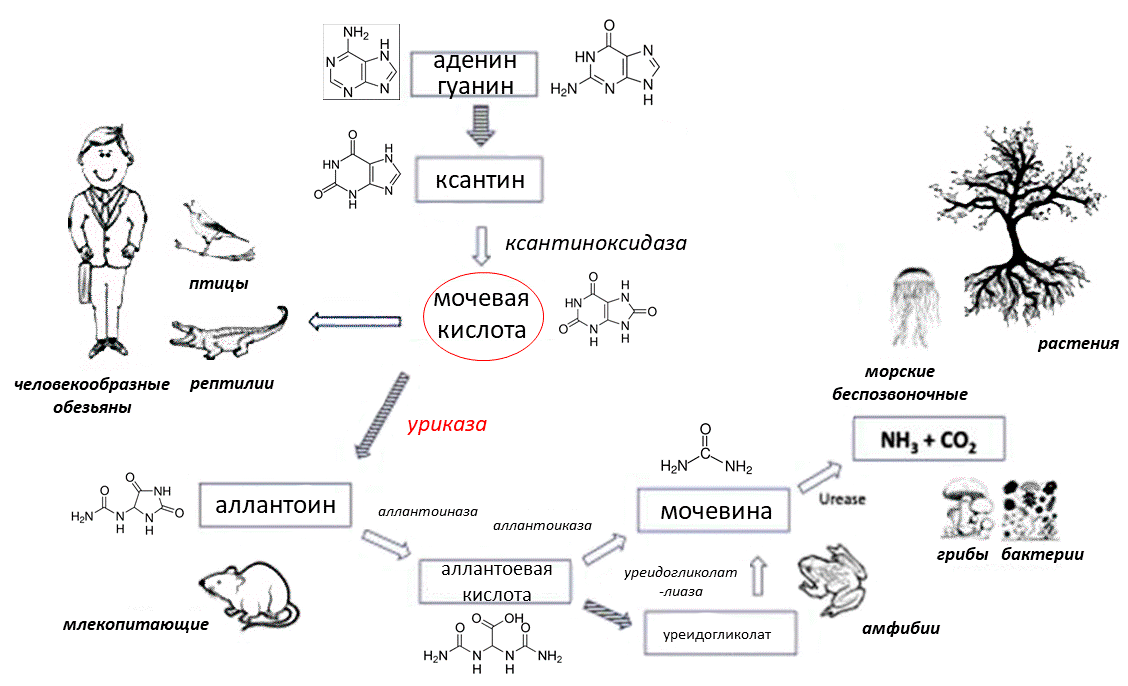
Рисунок 1. Катаболизм пуринов у разных организмов. Большинство млекопитающих выделяют в качестве конечного продукта пуринового обмена аллантоин, а человекообразные обезьяны и сам человек — мочевую кислоту. Закрашенные стрелки обозначают, что некоторые промежуточные реакции опущены.
[4], рисунок адаптирован
Итак, фермент, без которого не может жить мышь [6], отсутствует у человека и его ближайших родственников. Ген уриказы остался на месте, а белка нет. Пропажу обнаружили в 1980-х [7], но распутать клубок удалось только 30 лет спустя. Ученые предположили, что процесс выключения фермента шел постепенно, параллельно с развитием адаптаций к высокой концентрации урата в крови. Исследователи проверили эту гипотезу с помощью метода восстановления предковых генов: определили аминокислотные последовательности древних уриказ на эволюционной линии человека, синтезировали соответствующие белки и проверили их каталитическую активность.
Сначала на основании последовательностей генов уриказы семнадцати ныне живущих видов млекопитающих ученые построили эволюционное дерево и определили последовательности генов восьми предковых уриказ. Самый древний ген принадлежал общему предку человека и свиньи, жившему 94,2 миллиона лет назад, а самый молодой (уже неработающий) — общему предку человека и шимпанзе возрастом всего лишь 6,3 миллиона лет.
Затем синтезировали последовательности восстановленных генов, наработали в бактериях белки (в случаях, когда ген кодировал работающий белок) и измерили их активность. Наиболее активным оказался самый древний из восстановленных белков: он с двукратным преимуществом победил уриказу свиньи — одну из самых активных уриказ современных млекопитающих. А вот активность уриказы древнего примата, который жил 42,6 миллиона лет назад, составляла уже 0,6 от активности свиного фермента и продолжала снижаться. Получается, что фермент стал «портиться», когда приматы только начали свой эволюционный путь. В миоцене (20–15 млн лет назад) уриказа окончательно потеряла работоспособность (рис. 2) [1].
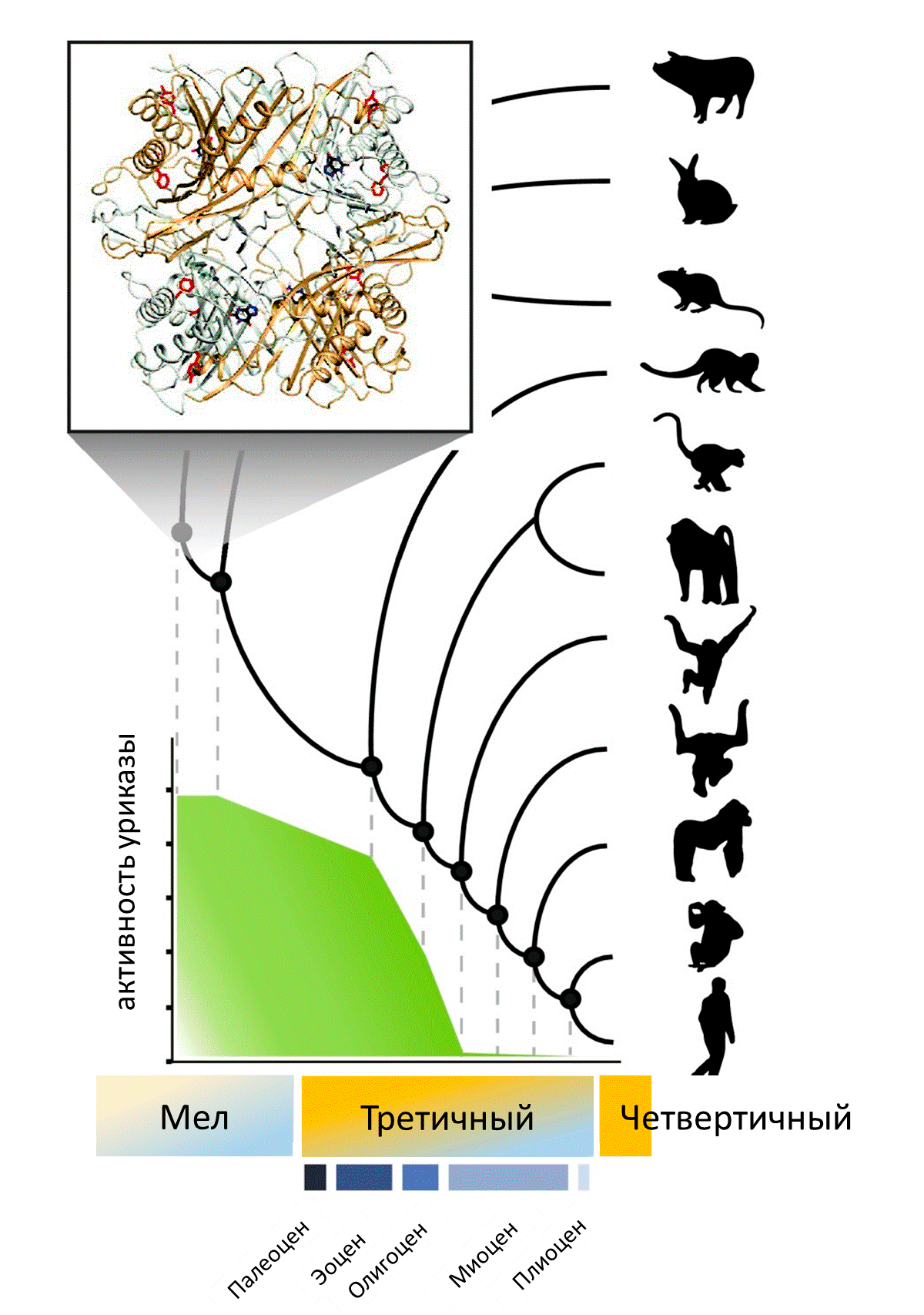
Рисунок 2. Кристаллическая структура уриказы общего предка человека и свиньи, полученной методом восстановления предковых последовательностей, и изменение активности фермента на эволюционной линии человека
Зная последовательности гена во всех узлах эволюционного дерева, можно восстановить историю происходивших с этим геном событий. За 74 миллиона лет, ведущих от самого древнего рассмотренного предка к предку человекообразных обезьян, в уриказе поменялись 10 аминокислот. (То есть в гене произошло 10 нуклеотидных замен, приводящих к изменению аминокислоты, — так называемых несинонимичных замен. Замены — это мутации, распространившиеся во всех особях популяции.) За это время фермент практически потерял свою активность. А потом ген уриказы и вовсе превратился в псевдоген: в нем произошла замена одного из кодонов на стоп-кодон, заставляющий рибосому закончить синтез белковой молекулы раньше времени. Появление внутренних стоп-кодонов не всегда приводит к псевдогенизации [8], но с уриказой случилось именно это.
URAT1: не исчез, но стал другим
Параллельно со снижением активности уриказы интересные изменения происходили и в другом белке, взаимодействующем с мочевой кислотой, — URAT1. Этот молекулярный переносчик возвращает в наш кровоток 90% мочевой кислоты, поступающей в почки. В экспериментах in vitro ученым удалось показать, что URAT1 человека и бабуина имеют большее сродство к мочевой кислоте, чем URAT1 крысы и мыши. При этом максимальная скорость работы переносчика у приматов ниже, чем скорость работы такового у грызунов. Поэтому при опасном повышении концентрации мочевой кислоты в организме скорость ее обратного транспорта не увеличивается, и она активней выводится почками.
Таким образом, нормальный уровень мочевой кислоты в крови быстро восстанавливается: URAT1 играет роль «предохранителя», не дающего сывороточной концентрации мочевой кислоты подняться до опасных значений, когда в организме начинают образовываться кристаллы урата. Исследователи синтезировали предковые последовательности URAT1 на линии приматов и изучили их активность. Оказалось, что на эволюционной линии, ведущей к человекообразным обезьянам, белок испытал два важных функциональных преобразования (рис. 5). Примерно 42 миллиона лет назад сродство URAT1 к мочевой кислоте возросло на порядок, а максимальная скорость снизилась вчетверо. Уриказа в это время потеряла около 70% своей каталитической активности. Затем, около 27 миллионов лет назад, когда каталитическая активность уриказы была уже всего 10% от исходной, произошло еще одно четырехкратное падение скорости работы URAT1. И только после этого уриказа перестала работать совсем [17]. Возможно, именно преобразования URAT1 позволили некоторым обезьянам остаться без уриказы. Хотя не исключено, что у этой истории есть еще много героев, пока остающихся в тени.
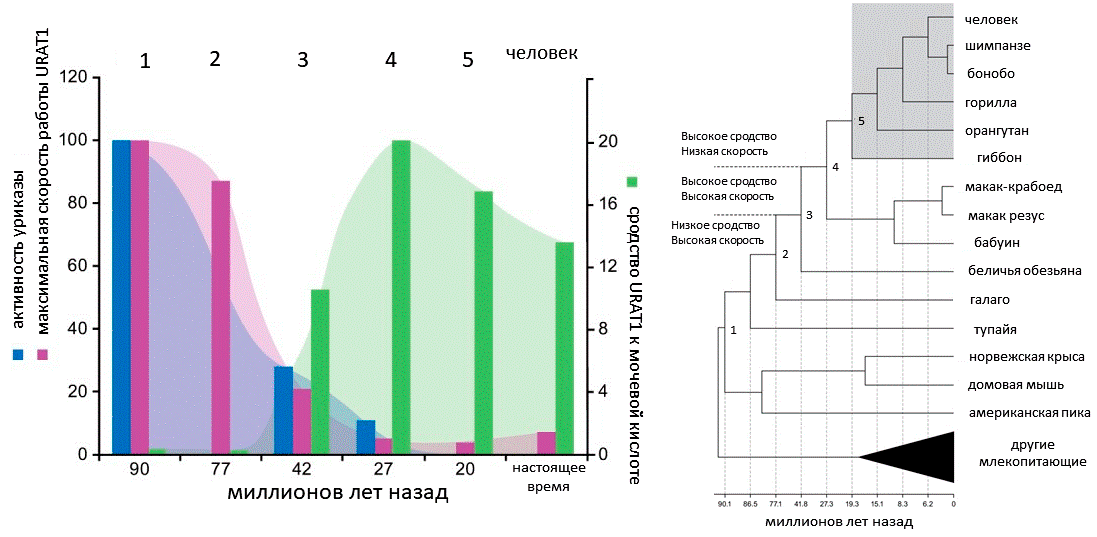
Рисунок 5. Изменения относительных значений максимальной скорости работы URAT1 и его сродства к мочевой кислоте и параллельное снижение активности уриказы на линии человекообразных обезьян. Активность уриказы и скорость URAT1 для общего предка приматов и грызунов приняты за 100 единиц, а сродство его URAT1 к мочевой кислоте — за 1 единицу. Положение на эволюционном дереве предковых точек 1–5 с измеренными характеристиками белков показано справа. Серый прямоугольник обозначает отсутствие уриказы.
[17], рисунок адаптирован
Причины и следствия
Предполагают, что описанные изменения могли происходить под давлением отбора на повышение содержания мочевой кислоты в организме. По одной из гипотез, увеличение концентрации урата в печени за счет снижения активности уриказы помогло нашим предкам, питающимся фруктами, эффективнее накапливать жиры. Оказалось, что, если научить клетки из печени человека синтезировать уриказу предка человека и свиньи, накопление триглицеридов в ответ на фруктозу в этих клетках понижается [1]. Дело в том, что фруктоза способствует образованию триглицеридов как минимум двумя путями, и в одном из них задействован урат (рис. 6). Первая реакция прямого производства жиров из фруктозы — ее фосфорилирование с участием молекулы аденозинтрифосфата (АТФ). Потеряв один из трех фосфатов, аденозин в несколько реакций превращается в мочевую кислоту. А та, в свою очередь, каким-то образом активирует фермент NADPH-оксидазу, которая образует супероксидные радикалы в митохондриях и вызывает окислительный стресс, который тормозит цикл Кребса на этапе цитрата, что приводит к его накоплению и выходу в цитоплазму. А цитрат уже служит субстратом для синтеза триглицеридов. Если уриказа работает, мочевой кислоты становится меньше, поэтому и жиров образуется меньше [18].
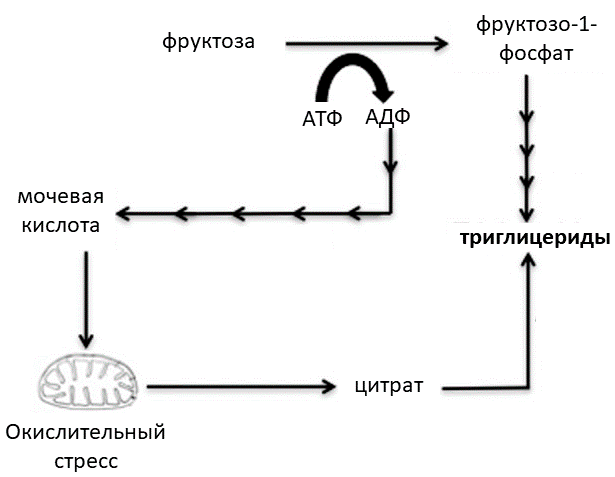
Рисунок 6. Классический и альтернативный пути синтеза жиров в ответ на поступление фруктозы. Классический путь — прямое образование триглицеридов из фруктозы с помощью последовательных ферментативных реакций. В альтернативном пути задействована мочевая кислота, которая образуется в ходе фосфорилирования фруктозы. Мочевая кислота способствует возникновению в митохондриях окислительного стресса, в результате которого в цитоплазму поступает цитрат — субстрат для синтеза триглицеридов.
[19], рисунок адаптирован
По этой же гипотезе, в позднем миоцене, когда на нашей планете стремительно менялся климат, и влажные тропические леса остались только у экватора, окончательная потеря уриказы могла дать нашим предкам, питающимся фруктами, преимущество при сокращении источников пищи [6].
Другая гипотеза, напротив, связана со способностью мочевой кислоты обезвреживать активные формы кислорода в просвете сосудов — то есть работать как антиоксидант (про вред и пользу активных форм кислорода можно узнать из [20]): ионы урата успокаивают активные радикалы, отдавая им электроны. Согласно этой гипотезе, повышение уровня урата в крови человекообразных обезьян происходило как компенсация потери способности синтезировать витамин С, тоже являющийся антиоксидантом [21].
Также есть сведения о способности мочевой кислоты активировать иммунный ответ при паразитарных инфекциях [22]. Однако слишком высокое содержание урата в сыворотке крови — гиперурикемия — может пагубно сказываться на здоровье человека. Большая концентрация мочевой кислоты может стать причиной подагры, синдрома лизиса опухоли, ожирения, диабета, нарушений функции почек, сердечно-сосудистых заболеваний [1], [22].
Восстановление предковых последовательностей уриказы не только пролило свет на процесс ее исчезновения, но и помогло найти потенциальное лекарство от гиперурикемии. Для контроля этого состояния сейчас применяют рекомбинантную уриказу, которая вобрала в себя активный центр свиного фермента — самой действенной уриказы млекопитающих — и окружение из фермента бабуина (pig-baboon chimera, PBC). Однако такой белок живет всего несколько минут и требует дополнительных стабилизирующих навесок, раздражающих человеческую иммунную систему. При введении в культуру клеток печени человека разных вариантов гена уриказы оказалось, что древний фермент, работавший 90 млн лет назад, почти в три раза более активен в них, чем PBC. А при введении в организм крысы предковый белок был в 100 раз более живучим, чем химерная уриказа [1]. Метод применения предковых уриказ для терапии гиперурикемии запатентован США в 2015 году [23], но сведений о его дальнейшем развитии пока нет.
Возвышенное заключение
Что приносит нам отсутствие уриказы — пользу или вред? Ответ очевиден: и то, и другое. Уриказа могла бы работать в клетках человека, но эволюция выбрала иной путь, и нам остается только догадываться, почему. И радоваться, что мы такие, какие есть.
Литература
- James T. Kratzer, Miguel A. Lanaspa, Michael N. Murphy, Christina Cicerchi, Christina L. Graves, et. al.. (2014). Evolutionary history and metabolic insights of ancient mammalian uricases. Proc Natl Acad Sci USA. 111, 3763-3768;
- Ehrlich P., Dobkin D.S., Wheye D. Birder's handbook. Simon and Schuster, 1988. — 785 p.;
- Википедия: Metabolic waste;
- Rashad Barsoum, Mohammed El-Khatib. (2017). Uric acid and life on earth. Journal of Advanced Research. 8, 471-474;
- X. Wu, M. Wakamiya, S. Vaishnav, R. Geske, C. Montgomery, et. al.. (1994). Hyperuricemia and urate nephropathy in urate oxidase-deficient mice.. Proceedings of the National Academy of Sciences. 91, 742-746;
- Belinda S. W. Chang. (2014). Ancient insights into uric acid metabolism in primates. Proc Natl Acad Sci USA. 111, 3657-3658;
- Thomas B. Friedman, George E. Polanco, Jerry C. Appold, James E. Mayle. (1985). On the loss of uricolytic activity during primate evolution—I. Silencing of urate oxidase in a hominoid ancestor. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry. 81, 653-659;
- Как нонсенс-мутации ген обижали, и что потом было;
- Сверим часы;
- Joseph W. Thornton. (2004). Resurrecting ancient genes: experimental analysis of extinct molecules. Nat Rev Genet. 5, 366-375;
- Синтетическая жизнь;
- Amanda K. Garcia, Betül Kaçar. (2019). How to resurrect ancestral proteins as proxies for ancient biogeochemistry. Free Radical Biology and Medicine. 140, 260-269;
- Муковисцидоз — первые надежды;
- Кольман Я. и Рем К.-Г. Наглядная биохимия. М.: «Мир», 2000. — 469 с.;
- Bender D.A. The effect of substrate concentration on enzyme activity. University College London;
- Nath A. (2007). A quick guide to enzyme kinetics & simulations. University of Washington;
- Philip K. Tan, Jennifer E. Farrar, Eric A. Gaucher, Jeffrey N. Miner. (2016). Coevolution of URAT1 and Uricase during Primate Evolution: Implications for Serum Urate Homeostasis and Gout. Mol Biol Evol. 33, 2193-2200;
- R. J. Johnson, T. Nakagawa, L. G. Sanchez-Lozada, M. Shafiu, S. Sundaram, et. al.. (2013). Sugar, Uric Acid, and the Etiology of Diabetes and Obesity. Diabetes. 62, 3307-3315;
- Miguel A. Lanaspa, Laura G. Sanchez-Lozada, Yea-Jin Choi, Christina Cicerchi, Mehmet Kanbay, et. al.. (2012). Uric Acid Induces Hepatic Steatosis by Generation of Mitochondrial Oxidative Stress. J. Biol. Chem.. 287, 40732-40744;
- Активный кислород: друг или враг, или О пользе и вреде антиоксидантов;
- B. Alvarez-Lario, J. Macarron-Vicente. (2010). Uric acid and evolution. Rheumatology. 49, 2010-2015;
- Rashika El Ridi, Hatem Tallima. (2017). Physiological functions and pathogenic potential of uric acid: A review. Journal of Advanced Research. 8, 487-493;
- Gaucher E.A. (2015). Variants of ancestral uricases and uses thereof. Patent US8940861B2.






