
Лаборатория стволовых клеток мозга: мир новых нервных клеток у взрослых животных
28 августа 2016
Лаборатория стволовых клеток мозга: мир новых нервных клеток у взрослых животных
- 3635
- 2
- 9
рисунок Елены Беловой
-
Автор
-
Редакторы
-
Иллюстратор
Нервные клетки мозга — залог успеха человечества, да и, что таить, каждого отдельно взятого человека. Поэтому мало кто равнодушен к этой области науки — нейробиологии. Тем не менее, до сих пор мысль о том, что новые нейроны рождаются у нас в голове постоянно, недостаточно популяризована. Как и зачем они появляются у взрослых животных, изучают в лаборатории стволовых клеток мозга московского Физтеха, про некоторые проекты которой расскажем в этой статье. На сегодняшний день открытыми остаются ключевые вопросы. Например, каковы функции новых нейронов? Что определяет их количество? Можно ли управлять их появлением? И многие другие.
Биология в Московском физтехе
XXI век называют «веком живых систем», изучение которых возможно только на стыке наук — математики, физики, химии и биологии. «Биомолекула» представляет серию материалов о том, как занимаются биологией в Московском физико-техническом институте (МФТИ).
Лаборатория стволовых клеток мозга Московского физико-технического института (МФТИ) располагается на территории Курчатовского НИЦ. Руководитель лаборатории — Григорий Николаевич Ениколопов, известный исследователь в области биологии мозга. Его индекс цитируемости по Хиршу составляет 40 (по данным сайта «Корпус экспертов»). Григорий Николаевич закончил кафедру молекулярной биологии биологического факультета МГУ им. Ломоносова и потом работал в лаборатории Георгия Павловича Георгиева Института молекулярной биологии в Москве. В 1989 году по приглашению Джеймса Уотсона — лауреата Нобелевской премии за открытие структуры ДНК — он начал свою работу в лаборатории Колд Спринг Харбор (CSHL) в США.

Григорий Николаевич Ениколопов
Его исследования развития мозга привели к ряду открытий. Например, в 1995 году Наталья Пеунова и Григорий Ениколопов показали важную роль монооксида азота (NO) в процессе появления нейронов из клеток-предшественников. Ученые обнаружили, что NO останавливает деление клеток, что является ключевым моментом для успешного развития нейрона [1]. Исследование было опубликовано в самом престижном научном журнале — Nature, как и ряд некоторых других статей Ениколопова [2–5]. В 2011 году под его руководством была открыта лаборатория в МФТИ по программе мегагрантов (программа по привлечению ведущих ученых в вузы России).
Григорий Николаевич остается профессором в США, и, по его словам, работа двух его лабораторий тесно связана:
«Между лабораториями в Америке и России очень тесное сотрудничество. Так я и планировал, поскольку бессмысленно полностью разделять их работу. Уже более десяти сотрудников московской лаборатории приезжали работать в американскую. И в настоящий момент там находится пять человек, которые потом вернутся назад в Москву. Мы стараемся создать постоянный обмен между двумя лабораториями. При этом есть какие-то исследования, которые ведутся только в Москве, но не в США, а есть работы, которые ведутся в Америке, но не в Москве. При этом часть исследований и здесь, и там ведут одни и те же люди. Благодаря этому между двумя лабораториями налажен большой обмен опытом».
Сейчас в лаборатории МФТИ ведутся работы по нескольким направлениям: в частности, исследуется взаимосвязь между поведением взрослых животных и появлением у них новых нейронов, изучаются эффекты малых доз радиации на нейрогенез, разрабатываются сенсоры для детектирования молекулярных процессов в мозге и методы трехмерного картирования новых клеток в органах. Заведующий лабораторией так комментирует научную задачу:
«Мы изучаем нейрогенез, то есть появление новых нейронов во взрослом мозге. До недавнего времени существовала долгоживущая догма, что во взрослом мозге новые нейроны не появляются. Затем было показано, что в некоторых его областях новые нейроны могут появляться в течение жизни. Это было доказано сначала на животных, а потом подтверждено для человека. В частности, оказалось, что новые нейроны появляются в течение жизни в структуре, называемой гиппокамп, которая, как давно уже было известно, ответственна за память и обучение, а также за поддержание эмоционального фона. Нейрогенез во взрослом гиппокампе мы и изучаем. Главным образом, мы исследуем, как ведут себя стволовые клетки, из которых появляются новые нейроны, а также хотим понять, как ведут себя эти новые нейроны; для чего мы разрабатываем новые подходы к визуализации сигналов, которыми обмениваются клетки мозга».
Некоторые из проектов, которыми занимается лаборатория, будут подробно рассмотрены ниже, а пока ответим на вопрос, что такое взрослый нейрогенез [6] и как его изучают?
Взрослый нейрогенез
До недавнего времени была широко распространена идея о том, что все нейроны рождаются во время развития — «нервные клетки не восстанавливаются». Данная догма появилась благодаря работам Сантья́го Рамо́на-и-Каха́ля [7], лауреата Нобелевской премии по физиологии и медицине 1905 года (рис. 1) [8], но оказалась не совсем правильной. Впервые появление новых нейронов в уже сформировавшемся мозге обнаружил Джозеф Альтман в шестидесятых годах прошлого века [9], [10] (рис. 2).
Рисунок 1. Сантьяго Рамон-и-Кахаль, лауреат Нобелевской премии по физиологии и медицине 1905 года.
сайт redem.org

Рисунок 2. Джозеф Альтман — ученый, открывший взрослый нейрогенез.
сайт diariodemallorca.es
Дальнейшие опыты показали, что, действительно, в некоторых областях мозга новые нейроны появляются в течение всей жизни . Они рождаются из стволовых клеток, которые располагаются в гиппокампе — отделе мозга, отвечающем за память и эмоции, а также в зоне вокруг желудочков (рис. 3).
Подробнее о том, где именно активен нейрогенез, написано в другой статье на «биомолекуле»: «Все, что вы всегда хотели знать о взрослом нейрогенезе, но боялись спросить» [6].
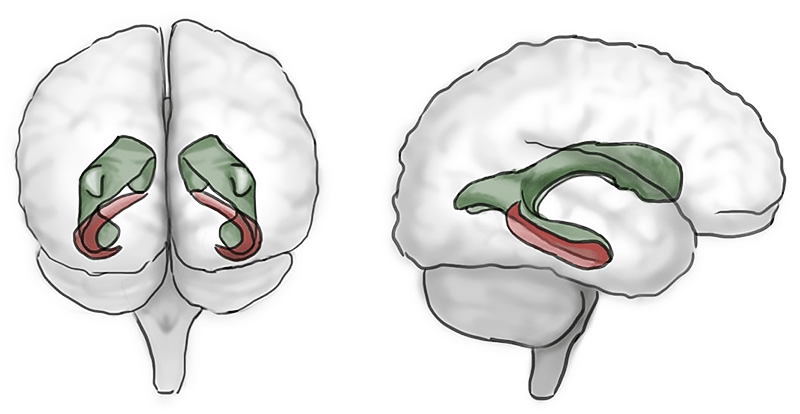
Рисунок 3. Мозг человека. Красным цветом выделен гиппокамп — зона, ответственная за память и обучение. Также в ней активен взрослый нейрогенез. Зеленым цветом обозначены желудочки (особые полости) в мозге человека. Они достойны внимания, в частности, потому, что в их окружении зарождаются новые нейроны, функция которых изучена у животных лучше, чем у человека.
рисунок Елены Беловой
Как обнаружить делящиеся клетки в мозге? Перед делением клетка удваивает свой генетический материал. Для этого она синтезирует копии молекул ДНК, которые состоят из нуклеотидов. Аденин, гуанин, тимин и цитозин — четыре азотистых основания, которые входят в состав ДНК и формируют наш генетический код. Обычно их просто обозначают буквами А, Г, Т и Ц, соответственно. Для детектирования клеток, содержащих вновь скопированный генетический материал, ученые применяют хитрость — вводят животным бромодезоксиуридин. Это синтетическая молекула, которая встраивается вместо Т в последовательность ДНК. Бромодезоксиуридин можно специфически окрасить с помощью антител и за счет этого выявить, какие клетки удвоили свою ДНК и готовятся к делению или уже поделились с момента введения им данного вещества. К настоящему моменту синтезирован целый ряд подобных синтетических аналогов тимидина, некоторые из которых даже можно использовать совместно для того, чтобы сделать видимыми несколько эпизодов деления клетки (видео 1).
Видео 1. Трехмерная микрофотография среза головного мозга мыши. Эта область мозга называется зубчатой извилиной гиппокампа. В ней в течение всей жизни животного (и у человека в том числе) наблюдается нейрогенез — образование новых нейронов из стволовых клеток. Зеленые клетки с длинными отростками — покоящиеся стволовые клетки, зеленые клетки, лишенные отростков, — их делящиеся потомки. Они выявлены при помощи трансгенной экспрессии GFP. Некоторые из стволовых клеток промаркированы синтетическими аналогами тимидина — BrdU (голубой) и EdU (красный). С помощью этих искусственных молекул, встраивающихся в ДНК клеток, было «поймано» два разных эпизода клеточных делений. Из рабочих материалов лаборатории стволовых клеток мозга.
Наблюдать за превращениями стволовых клеток стало также возможным благодаря трансгенным животным, у которых генетически помечены стволовые клетки (рис. 4). Созданием таких линий мышей достаточно давно занимаются исследователи под руководством Г.Н. Ениколопова:
«Некоторое время назад мы вывели новые линии животных, у которых стволовые клетки и предшественники нейронов производят флуоресцирующие белки. Благодаря этому, когда мы смотрим на мозг таких животных, то можем легко увидеть сами стволовые клетки и их непосредственное потомство, которое светит, скажем, ярко-зеленым светом. Их очень мало в мозгу. Мы изучаем свойства этих клеток, можем смотреть, как и во что они превращаются, постепенно дифференцируясь. (Когда из стволовой клетки появляется клетка печени или кожи, например, такой процесс называется дифференцировкой.) В частности, нас интересует, как из нервной стволовой клетки появляется новый нейрон и как различные воздействия влияют на этот процесс».
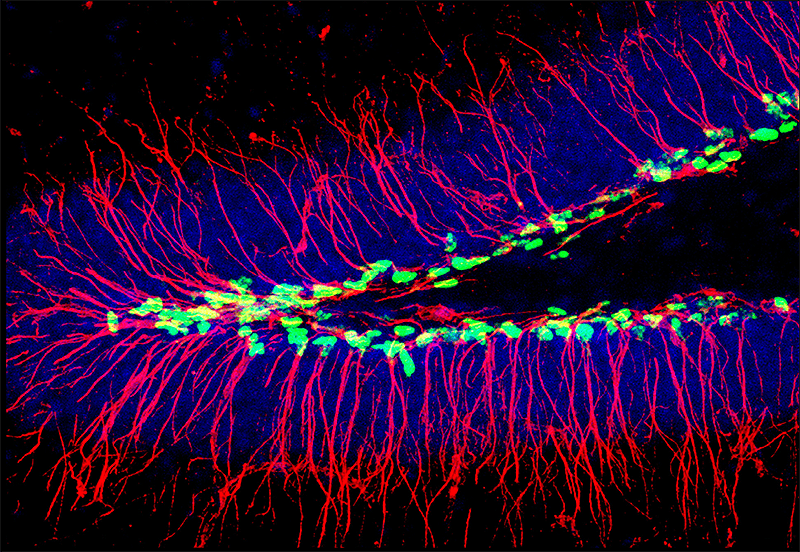
Рисунок 4. Зубчатая извилина гиппокампа, в которой с помощью трансгенной экспрессии CFP выявлены ядра стволовых клеток (зеленый), а также их тела и отростки — при помощи антител к GFAP (красный). Зрелые гранулярные нейроны окрашены антителами к NeuN (синий).
[11] и обложка январского номера The Journal of Comparative Neurology за 2011 год
Благодаря описанным и другим методам сейчас известно, что нейроны появляются из стволовых клеток мозга не за один этап. Сначала рождаются клетки-дочки, которые затем дают еще несколько одинаковых потомков. Интересно, что большинство из них беспощадно съедается клетками глии. Однако те, что выживают, могут дифференцироваться в нейроны. Стволовая клетка, после того как произведет на свет пару клеток-дочек, превращается в астроцит, являясь в этом смысле одноразовой. Данный принципиальный механизм был во многом описан группой Ениколопова [11], о чем он рассказал в своей лекции на Всероссийском фестивале науки (видео 2).
Видео 2. «Стволовые клетки мозга: резерв памяти и эмоций» — выступление Григория Ениколопова на Всероссийском фестивале науки в 2014 году
Стволовые клетки мозга и радиация
Нейрогенез во взрослом мозге находится под влиянием большого числа внешних и внутренних факторов. Сюда входят факторы роста, нейротрансмиттеры (серотонин, дофамин, глутамат, ацетилхолин и моноокись азота [12–15]), гормоны (эстроген, пролактин и кортикостероиды), антидепрессанты (флуоксетин) и наркотики (опиаты и психостимуляторы). Кроме того, нейрогенез зрелого мозга находится под влиянием старения, беременности, стресса, различных заболеваний, физической активности, обогащенной среды, пищевых ограничений и обучения. Некоторые из воздействий способны угнетать клеточные деления и образование новых нейронов (например, стресс, депрессия, радиация), тогда как другие обладают противоположным действием (антидепрессанты, физическая активность и др.).
Сотрудники лаборатории стволовых клеток мозга, в числе других проблем изучают влияние радиации на деление стволовых клеток и появление новорожденных нейронов. Григорий Ениколопов рассказал про этот проект:
«Мы изучаем, как очень низкие дозы радиации влияют на нейрогенез. Не такие дозы, которые вызывают опасность для жизни, а такие, с которыми люди встречаются повседневно. Мы все проходим высокотехнологичные медицинские процедуры, летаем на самолетах, и вообще вокруг нас очень много радиации низкого уровня, помимо естественного фона, конечно. Такой уровень радиации не вызывает какие-то явные нарушения, например, увеличение вероятности возникновения раковых заболеваний. Но при этом неизвестно, как низкие дозы радиации действуют на стволовые клетки, в частности, на стволовые клетки мозга, и на появление новых нейронов. Именно это мы и изучаем.
Вовсе не обязательно, что низкие дозы ионизирующего излучения — это плохо. Мы все время живем в радиационном фоне. Мы эволюционировали на Земле, и все живые организмы существуют в присутствии некоего уровня радиации, включая людей. Нас волновал вопрос, а нет ли какой-то опасности для нервных стволовых клеток, которую мы еще не осознаем. Например, неожиданного расходования запаса невосполнимых стволовых клеток. А с другой стороны, нет ли какого-то обратного влияния. Не подстегивается ли с помощью этих низких доз нейрогенез, не появляется ли больше нейронов, чем обычно? Не способствует ли радиация улучшенной памяти, улучшенному эмоциональному фону и так далее».
Известно, что делящиеся и дифференцирующиеся клетки организма реагируют на умеренную и высокую радиацию (больше 1 Гр) пропорционально уровню воздействия: чем больше доза, тем сильней негативный эффект. Однако в области низких доз (меньше 0,5 Гр) эффекты радиации трудно предсказать: может наблюдаться как резкое ухудшение метаболизма клеток и нарушение их размножения, так и улучшение обоих процессов. По крайней мере, в органах кроветворения и иммунной системе часто наблюдают позитивные изменения после облучения сверхмалыми дозами. Это явление получило название радиационного гормезиса [16].
А что происходит в мозге при подобном воздействии? Ольгой Минеевой, аспиранткой лаборатории, было выполнено исследование, в котором она изучала эффекты разных доз гамма-излучения на стволовые клетки мозга:

Ольга Минеева, аспирант лаборатории стволовых клеток мозга
«Несмотря на наши оптимистические ожидания позитивных эффектов малых доз гамма-излучения (а самая малая доза, которую мы исследовали, составляла всего 0,05 Гр), пока мы не обнаружили влияния подобного рода воздействий на наиболее чувствительные к радиации популяции клеток — стволовые клетки и делящиеся предшественники. Их число никак не отличалось от контрольных животных. По крайней мере это справедливо для того диапазона мощностей, который мы использовали в работе. Тем не менее, эффекты облучения выше 0,5 Гр носили уже негативный характер, при этом гибель клеток-предшественников напрямую зависела от дозы. Если ионизирующее излучение в дозе 1 Гр большей частью убивало только делящиеся клетки, то гамма-излучение дозой 5 Гр начинало негативно сказываться на клетках, вышедших из деления: созревающих нейронах. К счастью, эффект 1 Гр гамма-излучения оказался обратимым, и популяции пострадавших клеток восстанавливались менее чем через 2 месяца после облучения. Восстановление после 5 Гр также наблюдалось, но, видимо, оно требует гораздо большего времени.
Таким образом, мы показали, что чувствительность к радиации молодых клеток-предшественников, которая в разных тканях обычно убывает с ослаблением стволового статуса клетки и усилением интенсивности ее делений, также в целом убывает и в нейрогенной нише. Однако если сравнивать аналоги похожих популяций клеток в разных тканях, то становится понятным, что между кроветворными и нейрогенными стволовыми клетками существуют различия в радиационной устойчивости.
Такие различия выводят нас за рамки радиационных исследований, напрямую обращая к сфере интересов биологов стволовых клеток в целом: быстроте и точности починки структуры ДНК, поддержанию определенного окислительно-восстановительного статуса, и, что немаловажно, к способу поддержания стволовой популяции и генерации потомков.
Что оказалось для нас неожиданным, это то, что обратимые эффекты в мозге, полученные нами при облучении всего тела животных, не наблюдались в экспериментах других лабораторий, использующих прицельное облучение только гиппокампа или всего мозга (методы, максимально приближенные к протоколам радиотерапии). Возможно, в случае облучения всего тела большую роль играет измененный ответ кроветворной ниши. Несомненно, облучение всего тела не является желательным, если оценивать общий биологический ущерб от радиационного воздействия. Однако возможность иной и более выгодной для восстановления реакции тотально облученного организма помимо нас уже была отмечена другими учеными, занимающимися сравнением способов или масштабов облучения и соответствующей устойчивости другой нейрогенной зоны мозга — субвентрикулярной зоны боковых желудочков. В этом свете полученные нами данные представляют не только экспериментально-научный, но и практический клинический интерес. О результатах нашей работы можно будет скоро прочитать в статье, над которой я только что закончила работу».
Стволовые клетки мозга и поведение
Зачем нужны новые нейроны в мозге? По словам старшего научного сотрудника лаборатории в МФТИ Александра Лазуткина, согласно современным представлениям в гиппокампе они отвечают за ряд когнитивных функций, в частности, за способность мозга различать схожие воспоминания. Это задача, с которой мы сталкиваемся каждый день, узнавая похожих друг на друга людей, ориентируясь в метро или на улицах города. Рассказывает Александр Лазуткин:
«Зачем нужны новорожденные нейроны в мозге — это один из самых открытых вопросов. Сначала предполагалось, что взрослый нейрогенез может быть необходим для восстановления мозга. Был проведен ряд исследований, в которых пытались это доказать. К сожалению, оказалось, что новые нейроны, появляющиеся во взрослом мозге, скорее всего, не участвуют в процессах его репарации. Тем не менее, было обнаружено вовлечение молодых нейронов в работу мозга. Сейчас активно изучаются функции новых нейронов в гиппокампе. Было показано, что благодаря их повышенной активности на ранних этапах созревания, они способны участвовать в процессах модификации памяти, в частности, новые нейроны вовлечены в забывание воспоминаний, а также в механизмы разграничения сходных следов памяти — явление, известное сейчас как pattern separation. От взрослого нейрогенеза в гиппокампе также зависит наше эмоциональное поведение. Сниженный нейрогенез может быть одним из клеточных механизмов или следствий развития депрессивного состояния: показано, что во время депрессии уменьшается количество новых нейронов, а антидепрессанты способны восстанавливать нейрогенез до исходного уровня».
Видео 3. «Функции новых нейронов в мозге», лекция Александра Лазуткина
В лаборатории МФТИ ученые ищут новые функции стволовых клеток мозга и нейронов, которые из них формируются. Интересно, как связаны эмоциональное поведение и появление новых нервных клеток? Григорий Ениколопов рассказал про проект по этой теме:
«Мы изучаем, как появление новых нейронов вплетено в какие-либо модели поведения, в частности, мы очень интересуемся моделью социального конфликта, которую можно исследовать на мышах. А именно, мы изучаем поведение агрессоров. Во время конфликта появляются победители и побежденные, и нас интересует, что происходит при этом в их мозге. Мы используем модель, которая была создана в Институте цитологии и генетики СО РАН замечательным ученым Наталией Николаевной Кудрявцевой. Ею много лет разрабатывалась система — модель социальной агрессии мышей. И мы ее сейчас используем в работе вместе с Н.Н. Кудрявцевой и ее сотрудниками. В самом начале эксперимента участвуют два обычных очень похожих друг на друга самца мыши, которые содержатся так, что могут контактировать друг с другом, но не взаимодействовать напрямую из-за того, что их разделяет специальная перегородка (рис. 5). Через какое-то время перегородку убирают, и между самцами происходят взаимодействия, в ходе которых один самец начинает доминировать над другим. При повторении таких взаимодействий, поведение одних самцов превращается в очень сильное доминирование, а других — в очень сильное подчинение. Со временем доминирующий самец начинает проявлять агрессию по отношению ко всем другим самцам. При этом у побежденных самцов развиваются реакции, подобные депрессивным. Такие изменения в поведении сохраняются у мышей довольно долгое время. В данном исследовании мы изучали не только поведение, но и его эффекты на продукцию новых нейронов. Оказалось, что нейрогенез снижен у побежденных животных, а увеличен у победителей».
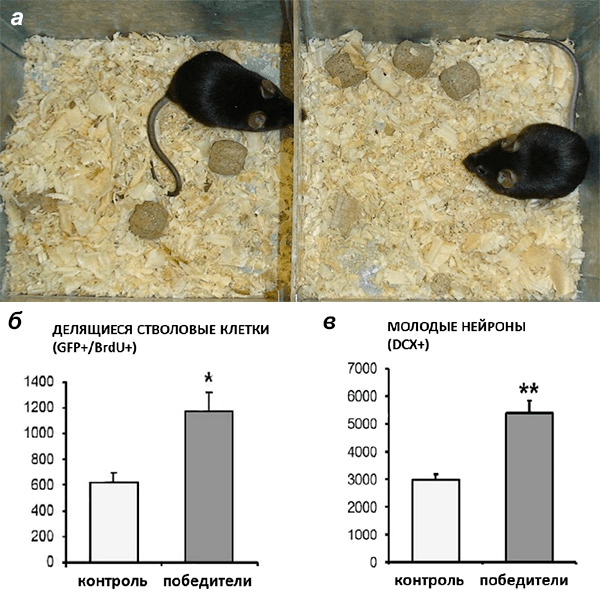
Рисунок 5. Нейрогенез в опытах социального доминирования. а — Экспериментальная клетка с самцами, разделенными перегородкой. б — Подсчет стволовых клеток мозга (в них содержится зеленый флуоресцентный белок — GFP), включивших бромодезоксиуридин (BrdU) в свой генетический материал, то есть тех клеток, что готовятся к делению или уже поделились с момента введения животным BrdU. в — Подсчет числа новых нейронов, выявляемых с помощью антител к белку даблкортину (DCX). В случае мышей, которые часто выигрывали драку (группа «победители»), таких клеток больше, чем в контрольной группе животных.
[17], рисунок адаптирован
На данную тему в 2015 году в журнале Frontiers in Neuroscience была опубликована работа под руководством Кудрявцевой и Ениколопова [17]. В ходе исследования ученые изучали мышей с многократным опытом побед в социальном конфликте, который повышает уровень агрессии и приводит к патологии агрессивного поведения. В работе создавали ситуацию, когда подопытные животные проявляли агрессию, после чего лишали их этой возможности на некоторое время. Затем исследователи анализировали изменения в поведении, нейрогенезе и активности нервных клеток у тех мышей, которые многократно выходили победителями из драки. Ученым удалось показать, что опыт побед в ежедневных драках приводил к повышенному делению клеток-предшественников нейронов и, как следствие, появлению молодых нервных клеток в большем количестве (рис. 5). Интересно, что данный эффект был воспроизведен с использованием четырех линий мышей, и он не уменьшался после того, как мышей лишали возможности драться [17].
Трехмерная визуализация делящихся клеток мозга
Одной из самых интенсивно развивающихся областей в современной нейробиологии является разработка новых способов визуализации мозга. Это направление не обошло стороной и лабораторию стволовых клеток мозга МФТИ. Под руководством Г.Н. Ениколопова проводят масштабные работы по улучшению методов наблюдения за стволовыми клетками и новыми нейронами. Обычно нейрогенез исследуют на гистологических срезах, а как делящиеся клетки выглядят в объеме целого мозга? Как изменяется картина клеточных делений после различных воздействий или в ходе нормальных взросления и старения? Такой работой в лаборатории занимается кандидат биологических наук, старший научный сотрудник Александр Лазуткин:

Александр Лазуткин
«Исходно я занимался развитием головного мозга, и моя диссертация посвящена развитию его коры. Тема взрослого нейрогенеза и стволовых клеток мозга тесно пересекается с развитием, поэтому, когда я узнал об организации лаборатории, занимающейся этой проблематикой, то решил попробовать свои силы в ней. До того, как прийти работать в лабораторию Ениколопова, я занимался разработкой методов иммунногистохимии в цельных образцах мозга (специальное окрашивание при помощи антител, авт.) и их трехмерной визуализацией (так называемой оптической томографией, авт.). Я работал под руководством Константина Владимировича Анохина (профессора, нейробиолога из Курчатовского института в Москве, авт.), и накопленный опыт перенес в новую лабораторию. Здесь мы стали разрабатывать методы трехмерного маркирования делящихся клеток в цельных образцах.
Делящиеся клетки выявляют с помощью синтетических аналогов тимидина. Этот нуклеотид всегда присутствует в клетке, и когда ДНК делится, он встраивается в нее. Если тимидин в клетке заменить синтетическим аналогом, то его можно выявлять различными путями. Чаще всего используют бромодезоксиуридин, который регистрируют с помощью специфических антител. Однако антитела очень плохо проникают в ткань мозга, ими легко красить срезы, но тяжело красить целые образцы.
В последние годы появилось новое направление — так называемая биоортогональная химия. Это целый комплекс манипуляций, с помощью которых можно вводить животному молекулы с некоторыми радикалами, отсутствующими от природы в живых организмах. Затем используют химические реакции, которые позволяют эти радикалы выявлять. Самой распространенной такой реакцией сейчас является азид-алкиновое циклоприсоединение. По-другому ее еще называют клик-реакцией (click-reaction), потому что она, как щелчок, происходит очень быстро! Сейчас появились новые синтетические аналоги тимидина, такие как этинилдезоксиуридин, содержащий алкин этин. Эту синтетическую молекулу также можно вводить животному, и она будет встраиваться в ДНК. Таким образом можно маркировать делящиеся клетки. Дальше к тканям добавляют флуоресцентно-меченный азид. Это маленькая молекула, она легко проникает в ткань целого мозга и там взаимодействует со встроенным в ДНК этинилдезоксиуридином. Алкины с азидами взаимодействуют с образованием устойчивого соединения. После таких процедур начинают светиться клетки, которые делились, когда мы вводили аналог тимидина. Собственно, это мы и положили в основу нашего метода.
Мы научились маркировать целые гиппокампы; потом мы научились маркировать целый мозг новорожденных животных — мышат (рис. 6). Сейчас мы умеем визуализировать делящиеся клетки в целом взрослом мозге с двумя полушариями. Мы можем все это наблюдать в трехмерном объеме. У нас есть трехмерные изображения для всех этих образцов. Далее мы стали разрабатывать способы анализа таких 3D-изображений, чтобы понять, где и когда происходит деление клеток в мозге.
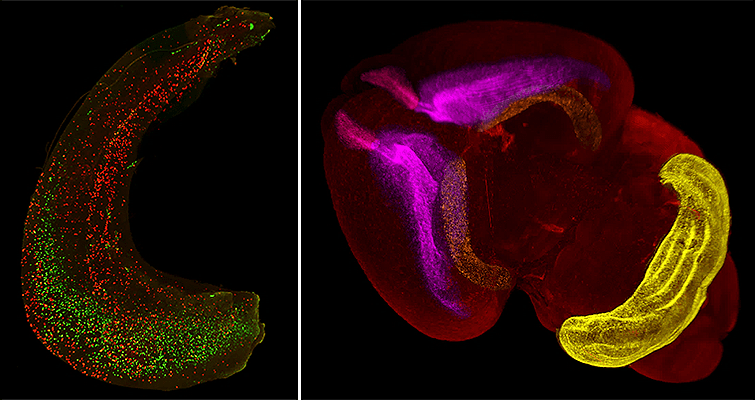
Рисунок 6. Гиппокамп (слева) и целый мозг мыши (справа), окрашенные целиком. На изображении гиппокампа делящиеся клетки обозначены красным. Область с высокой плотностью красных клеток — зубчатая извилина гиппокампа. На трехмерном изображении мозга новорожденного мышонка делящиеся клетки в разных областях раскрашены в различные цвета: розовый — обонятельная луковица, фиолетовый — субвентрикулярная зона и ростральный миграционный путь, оранжевый — гиппокамп, желтый — поверхность мозжечка.
Одно из направлений — это разработка количественных методов анализа. В частности, нашим бывшим студентом, а теперь аспирантом, Сергеем Шуваевым были разработаны очень эффективные алгоритмы для автоматического подсчета клеток в трехмерных образцах. Современные коммерческие программы не позволяют с такой точностью осуществлять количественный анализ в отличие от того, что разработано в нашей лаборатории. Сейчас у нас написана статья по этому поводу, она находится в завершающей стадии, и, надеюсь, скоро будет опубликована. У нас также готовится к публикации статья о том, как красить цельный мозг.
Следующее направление — это качественный анализ. Он не совсем качественный, в нем тоже заложены количественные методы на тот случай, когда у вас есть большое количество образцов мозга, и вам надо их математически сравнить один с другим. Сергей Шуваев трудится над этим, выполняя свою аспирантскую работу, и он разработал очень хорошие методы, которые позволяют сравнивать мозги. Мы работали с новорожденными мышатами, маркировали их делящиеся клетки на разных возрастах, начиная от момента рождения. Потом сравнивали мозги автоматически в трехмерном объеме: один день с последующим днем. Таким образом у нас получились карты, показывающие, где в мозге мышонка увеличивается пролиферация клеток и где она уменьшается с возрастом. Над этим мы еще продолжаем работать и надеемся, что в скором времени работа тоже закончится публикацией».
Отметим, что у проекта есть прямое практическое применение. Ведь если мы умеем узнавать делящиеся клетки в мозге и подсчитывать их, то это открывает большие возможности. В частности, можно искать вещества, которые будут увеличивать/уменьшать количество новых нейронов. Отметим, что, например, антидепрессанты стимулируют деление клеток мозга. Более подробно о применении разработок лаборатории нам также рассказал Александр Лазуткин:
«В рамках гранта РФФИ мы обязуемся создать технологию для автоматического трехмерного детектирования пролиферации клеток в целых гиппокампах и создать на этой основе тест, который позволил бы очень точно производить поиск веществ, способных увеличивать/уменьшать нейрогенез. В общем, каким-то образом его модулировать. И мы сейчас над этим активно работаем. Сюда заложены те методы, о которых я рассказывал. То есть методы окраски гиппокампов, их трехмерная съемка. Также мы разрабатываем методы автоматического выделения зоны интереса и дальнейшего автоматического подсчета числа пролиферирующих клеток. Через эту тестовую систему можно будет прогнать сразу несколько веществ. Мы думаем, что это позволит нам и другим людям производить быстрый, практически автоматический поиск новых соединений, изменяющих нейрогенез в гиппокампе. Я сейчас говорю про гиппокамп (рис. 7), но на самом деле таким же образом можно обработать любую другую структуру мозга. Можно не ограничиваться мозгом, а взять другие органы и таким же образом окрасить и провести трехмерный математический анализ. Можно брать образцы биопсии и использовать эти технологии в экспериментальной онкологии».
Рисунок 7. Гиппокамп — ключевая структура взрослого нейрогенеза.
картина Грега Данна с сайта gregadunn.com
Разработка новых биологических сенсоров
Другое направление развития новых методов в лаборатории связано с детектированием молекулярных процессов в мозге. Ученые, используя генно-инженерные конструкции, хотят получить инструмент, который позволит описывать, в какой области органа выделяются те или иные вещества. Это, в свою очередь, позволит анализировать работу мозга.
Г.Н. Ениколопов рассказал про данные исследования:
«У нас есть большое направление по разработке рекомбинантных сенсоров. Можно сделать флуоресцирующие белковые молекулы, которые меняют свое свечение, когда встречаются с неким сигналом. Например, с пероксидом (на что мы сейчас делаем большой упор). Это так называемая редокс-сигнализация. В клетке синтезируется много супероксида, который потом превращается в пероксид, который, в свою очередь, узнается белками. Так происходит передача сигнала. И вот мы разработали большое количество новых реагентов, новых сенсоров разных цветов, которые бы узнавали эти сигналы. И это большое направление, которое ведется в лаборатории Федором Субачем. Федор и Оксана Субач вернулись в Москву после исключительно плодотворной работы в США и возглавили это направление. Наша точка роста в данном проекте в большой степени была основана на взаимодействии с Всеволодом Белоусовым и Сергеем Лукьяновым (учеными из Института биоорганической химии в Москве; С.А. Лукьянов также профессор кафедры молекулярной биологии МГУ и ректор РНИМУ им. Пирогова, авт.), которые давно начали эту тематику и являются пионерами и мировыми лидерами в этой области».
Итак, задача проекта — получение новых сенсоров, которые позволили бы анализировать процессы в живом мозге. Цель уже частично достигнута, потому что в 2015 году ученые из МФТИ с коллегами из России, Германии и США опубликовали совместную работу, посвященную индикатору перекиси водорода, который был назван HyPerRed [19]. Дело в том, что кислород участвует в регуляции многих физиологических процессов, причем ключевую роль в этом часто играют его активные формы [20]. Клетки сами производят такие вещества, строго контролируя данный процесс из-за их токсичности [21]. Например, перекись водорода Н2О2 занимает центральное место в так называемой редокс-сигнализации, обратимо окисляя органические молекулы в организме [22].
Речь идет про обратимое окисление производных тиолов. Тиолы — соединения, содержащие серу (S) в своем составе, — имеют общую формулу R-S-H. В данном случае R — это обозначение радикала, который состоит из атомов углерода (C) и водорода (Н), но может иметь разную химическую формулу.
Редокс-сигнализация важна для целого ряда биологических процессов от защитных механизмов до передачи сигнала в мозге. Регистрация перекиси водорода в живых тканях позволит понять, какие клетки обмениваются информацией и в какой ситуации. Разработанный сенсор обладает несколькими важными преимуществами. Во-первых — это белок, а значит, с помощью генно-инженерных приемов его можно закодировать в геноме животного и получить организм, который будет сам нарабатывать данную биомолекулу в своих клетках. Следовательно, отменяется необходимость применять какие-то инвазивные методы для ее ввода во время исследования. Важно, что данный белок может светиться, флуоресцировать. Поэтому у экспериментатора есть возможность за ним наблюдать [23]. Основное свойство сенсора в данном случае заключается в том, что флуоресценция меняется при взаимодействии с перекисью водорода. Поэтому получаемый сигнал от генно-инженерной конструкции будет уже другим. Например, в случае с HyPerRed в присутствии H2O2 интенсивность флуоресценции увеличивается на 80%. То есть сотрудникам лаборатории стволовых клеток мозга с коллегами из группы Белоусова удалось получить и охарактеризовать новый сенсор, причем флуоресцирует он красным цветом [19].
Для того, чтобы доказать, что HyPerRed может чувствовать перекись водорода в организме млекопитающих, провели эксперименты с клеточными линиями человека. Клетки продуцировали данный белок и, когда к ним в среду добавляли H2O2, интенсивность флуоресценции сенсора менялась (рис. 9). Те же результаты были получены и для клеток бактерий.
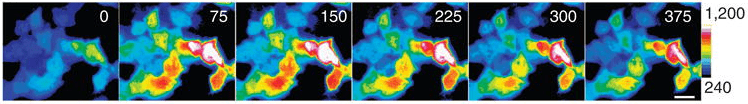
Рисунок 9. Если в клетках есть сенсор HyPerRed, то при добавлении к ним перекиси водорода они начинают ярко светиться. В левом углу каждой панели цифрами показано время в секундах с момента поступления перекиси в среду. Цветом показана разная интенсивность флуоресценции. Шкала яркости расшифрована в правой части рисунка: от синего к белому — от слабого свечения к сильному, соответственно.
Оксана Михайловна Субач занимается разработкой сенсоров в лаборатории стволовых клеток мозга и является соавтором описанной выше работы. Она так пишет о своем проекте:
«Генетически кодируемые биосенсоры реагируют на определенные низкомолекулярные вещества в клетке и могут быть использованы для визуализации ферментативной активности, конформационного состояния белков, изменений концентраций определенных молекул, для наблюдения за различными физиологическими событиями in vivo, включая живые клетки, ткани и целые организмы. Наша работа направлена на разработку флуоресцентных белков и биосенсоров для изучения работы мозга, особенно для исследования деления и дифференцировки стволовых клеток мозга и функционирования нейронов. Сотрудники нашей группы имеют длительный опыт работы за рубежом и публикации в журналах с высоким импакт-фактором [24]».
Григорий Николаевич Ениколопов рассказал, что, по его мнению, главное в хорошем сотруднике лаборатории, на что он обращает внимание при приеме в коллектив новых людей:
«Самое главное, чтобы они были заинтересованы, потому что без интереса, без энтузиазма в науке мало что можно сделать. Интерес — это и есть главное, что человека ведет. Любого — хоть студента, хоть профессора. Поэтому главное, на что я обращаю внимание, — это на то, насколько сильно человек хочет работать, насколько серьезно интересуется именно этой проблемой. Это, естественно, должен быть хороший и умный студент. Но если честно, хороших и умных больше, чем энтузиастов. Умный энтузиаст — это подгруппа умных. Плюс не надо забывать, что у нас экспериментальная работа, все результаты получают долго, они трудные. И здесь просто быть одаренным математиком или вычислителем недостаточно. Поэтому нужен живой интерес к работе мозга и организма и понимание того, что требуется вкладывать очень много труда, чтобы получить интересный результат».
Статья написана в соавторстве с Александром Лазуткиным.
Литература
- Peunova N. and Enikolopov G. (1995). Nitric oxide triggers a switch to growth arrest during differentiation of neuronal cells. Nature. 375, 68–73;
- Peunova N. and Enikolopov G. (1993). Amplification of calcium-induced gene transcription by nitric oxide in neuronal cells. Nature. 364, 450–453;
- Méndez-Ferrer S., Michurina T.V., Ferraro F., Mazloom A.R., Macarthur B.D., Lira S.A. et al. (2010). Mesenchymal and haematopoietic stem cells form a unique bone marrow niche. Nature. 466, 829–834;
- Ding L., Saunders T.L., Enikolopov G., Morrison S.J. (2012). Endothelial and perivascular cells maintain haematopoietic stem cells. Nature. 481, 457–462;
- Flesken-Nikitin A., Hwang C.I., Cheng C.Y., Michurina T.V., Enikolopov G., Nikitin A.Y. (2013). Ovarian surface epithelium at the junction area contains a cancer-prone stem cell niche. Nature. 495, 241–245;
- Всё, что вы всегда хотели знать о взрослом нейрогенезе, но боялись спросить;
- Ramón y Cajal S. Degeneration and regeneration of the nervous system. London: Oxford university press, 1928;
- Сотворивший нейробиологию: Сантьяго Рамон-и-Кахаль;
- Altman J. (1962). Are new neurons formed in the brains of adult mammals? Science. 135, 1127–1128;
- Altman J. (1963). Autoradiographic investigation of cell proliferation in the brains of rats and cats. Anat. Rec. 145, 573–591;
- Encinas J.M., Hamani C., Lozano A.M., Enikolopov G. (2011). Neurogenic hippocampal targets of deep brain stimulation. J. Comp. Neurol. 519, 6–20;
- Серотониновые сети;
- Дофаминовые болезни;
- Очень нервное возбуждение;
- Молекула здравого ума;
- Ивановский Ю.А. (2006). Радиационный гормезис. Благоприятны ли малые дозы ионизирующей радиации? Вестник ДВО РАН. 6, 86–91;
- Smagin D.A., Park J.H., Michurina T.V., Peunova N., Glass Z., Sayed K. et al. (2015). Altered hippocampal neurogenesis and amygdalar neuronal activity in adult mice with repeated experience of aggression. Front. Neurosci. 9, 443;
- Encinas J.M., Michurina T.V. Peunova N., Park J.H., Tordo J., Peterson D.A. et al. (2011). Division-coupled astrocytic differentiation and age-related depletion of neural stem cells in the adult hippocampus. Cell Stem Cell. 8, 566–579;
- Ermakova Y.G., Bilan D.S., Matlashov M.E., Mishina N.M., Markvicheva K.N., Subach O.M. et al. (2014). Red fluorescent genetically encoded indicator for intracellular hydrogen peroxide. Nat. Commun. 5, 5222;
- Активный кислород: друг или враг, или О пользе и вреде антиоксидантов;
- Dröge W. (2002). Free radicals in the physiological control of cell function. Physiol. Rev. 82, 47–95;
- D’Autréaux B. and Toledano M.B. (2007). ROS as signalling molecules: mechanisms that generate specificity in ROS homeostasis. Nat. Rev. Mol. Cell Biol. 8, 813–824;
- Флуоресцентные репортеры и их молекулярные репортажи;
- Субач Оксана Михайловна. Сайт факультета биоинженерии и биоинформатики МГУ.







