
Метастазирование злокачественных опухолей: враг, который всегда впереди
21 февраля 2022
Метастазирование злокачественных опухолей: враг, который всегда впереди
- 5878
- 1
- 14
За любыми, казалось бы, сугубо клиническими моментами, такими как принятие решений врачами, их взаимодействие с пациентами, лежат фундаментальные исследования, которые плавно перетекают в практику. Только так можно прийти к прогрессу даже в лечении самых тяжелых заболеваний.
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: В современном мире «рак» — это то слово, которое боятся услышать, о котором не хотят говорить, а узнав о таком диагнозе, нередко прощаются с жизнью. Эта болезнь ассоциируется с чем-то абсолютно обреченным. И, конечно, такую репутацию рак заработал не без основания. Эффективно лечить опухолевую патологию научились не так давно, да и не везде, но даже сейчас долгое лечение не приносит уверенности в том, что болезнь ушла навсегда.
Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2021/2022.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
В чем же кроется корень зла? Почему опухоли бывает так сложно вылечить, а в развитых странах рак стремится стать первой причиной смерти? Ответ можно выразить лишь в одном слове — «метастазирование», которое означает распространение опухоли в отдаленные органы и ткани организма. Считается, что 90% смертей от рака связано именно с этим явлением. Давайте попробуем разобраться в механизмах этого смертоносного процесса и найдем точки приложения для возможной терапии.
Образование первичной опухоли
Все процессы в здоровом организме регулируются с удивительной точностью, в том числе и процессы размножения, роста и гибели клеток. Иногда в этой сложнейшей машине происходит сбой, который позволяет клеткам бесконтрольно расти, избегать апоптоза и иммунного надзора, что приводит к неограниченному увеличению их численности (рис. 1). Результатом такого сбоя является образование первичной опухоли — места «рождения» злокачественных клеток в организме.
В наглядной форме с процессом апоптоза можно ознакомиться в комиксе «Апоптоз, или Путь самурая» [1].

Рисунок 1. Образование первичной опухоли. В одной из нормальных клеток организма произошел сбой регуляции роста, размножения и/или гибели, что привело к образованию массы похожих клеток — опухолевого клона.
рисунок автора статьи
Такие вышедшие из-под контроля клетки довольно ограничены в своих желаниях. Все, что они хотят — это есть, размножаться и распространяться. Но не будем их упрекать за это: маленькие клеточки в масштабах, ограниченных человеческим организмом, всего лишь отражают суть существования всего живого на земле — выживание любыми путями.
После достижения определенного размера клеткам становится недостаточно питательных веществ, поступающих за счет диффузии из близлежащего сосуда. В попытке найти дополнительный источник питания они начинают выделять определенные факторы роста (рис. 2), что приводит к образованию новых кровеносных сосудов — ангиогенезу. В связи с быстро растущими потребностями опухолевой массы, ангиогенез протекает довольно интенсивно и быстро. Но в результате такой спешности образуются «дефектные» сосуды: они извилисты, избыточно разветвлены, негерметичны, а поток крови в них беспорядочный.
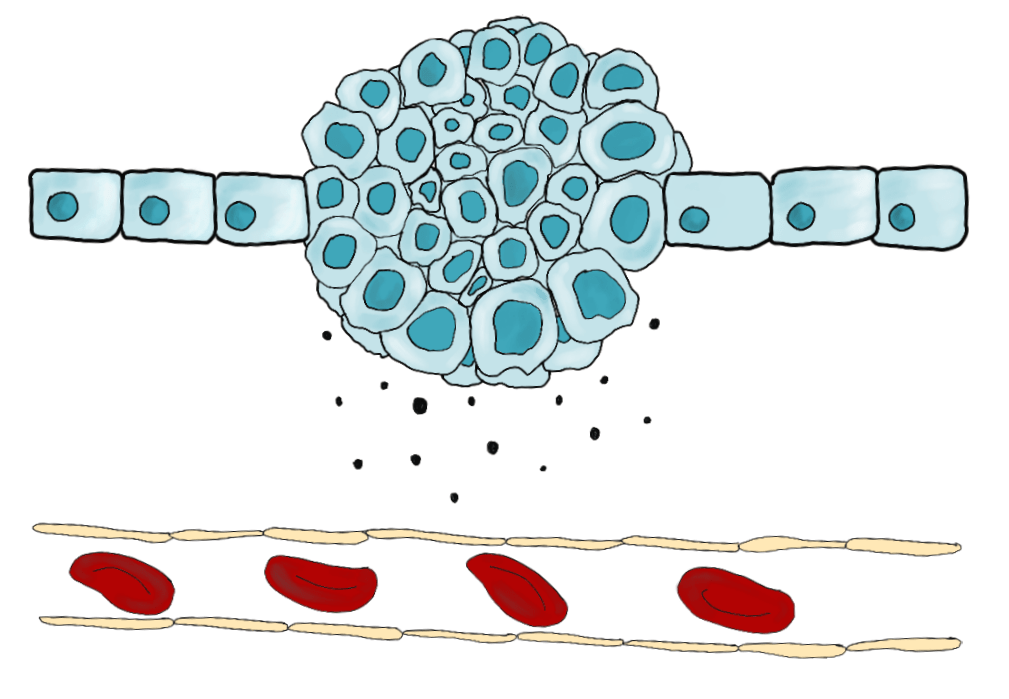
Рисунок 2. Ангиогенез. Опухолевые клетки выделяют факторы роста сосудов (например, VEGF — vascular endothelial growth factor, фактор роста эндотелия сосудов), чтобы обеспечить дополнительное поступление питательных веществ.
рисунок автора статьи
Метастазирование
Несмотря на увеличенную доставку питательных веществ за счет интенсивного ангиогенеза, растущей опухоли рано или поздно начинает не хватать места, и она решает освоить новые территории в других органах и тканях организма, что на языке онкологов называется метастазированием .
О процессе метастазирования также можно прочитать в других ранее опубликованных на «Биомолекуле» статьях: «Тернистый путь метастазов: через гипоксию в печень», «Метастазирование опухолей», «Во власти опухоли: почему метастазы так сложно остановить?», «Порочный цикл: от рака молочной железы до костных метастазов», «Маленькие пузырьки и большие проблемы: роль экзосом в раковом метастазировании» [2–6].
Метастазирование — это далеко не простой процесс, тайны которого еще предстоит изучить огромному количеству ученых. Считается, что это многоступенчатый каскад из связанных между собой событий. В дальнейшем мы рассмотрим каждое такое событие в контексте детально изученных карцином — опухолей эпителиального происхождения (также такой подвид называют раком, однако в обиходе так ошибочно называют все злокачественные новообразования). Предполагается, что метастазирование злокачественных опухолей из соединительной и нервной ткани часто следует похожим принципам [7].
1) Эпителиально-мезенхимальный переход
Итак, опухоль решила завоевать просторы человеческого организма. Однако перед ней встает немало проблем. Первая проблема состоит в том, что эпителиальные клетки предназначены для того, чтобы ограничивать различные пространства организма друг от друга. Поэтому они мало приспособлены к передвижению, зато всячески стараются держаться вместе и не двигаться. Для метастазирования такое поведение совершенно не подходит, поэтому опухолевые клетки претерпевают так называемый эпителиально-мезенхимальный_переход (ЭМП), то есть приобретают свойства мезенхимальных клеток:
- теряют связи с другими клетками эпителиального слоя и базальной мембраной;
- меняют форму на веретеновидную;
- реорганизуют цитоскелет;
- меняют профиль белков на мезенхимальный (рис. 3).
При этом способность клеток делиться в этом состоянии сильно уменьшается.
Следует отметить, что как опухолевые клетки являются потомками нормальных клеток организма, так и эпителиально-мезенхимальный переход в норме не является для нашего организма патологическим. Так, например, он реализуется в эмбриогенезе и при заживлении ран.
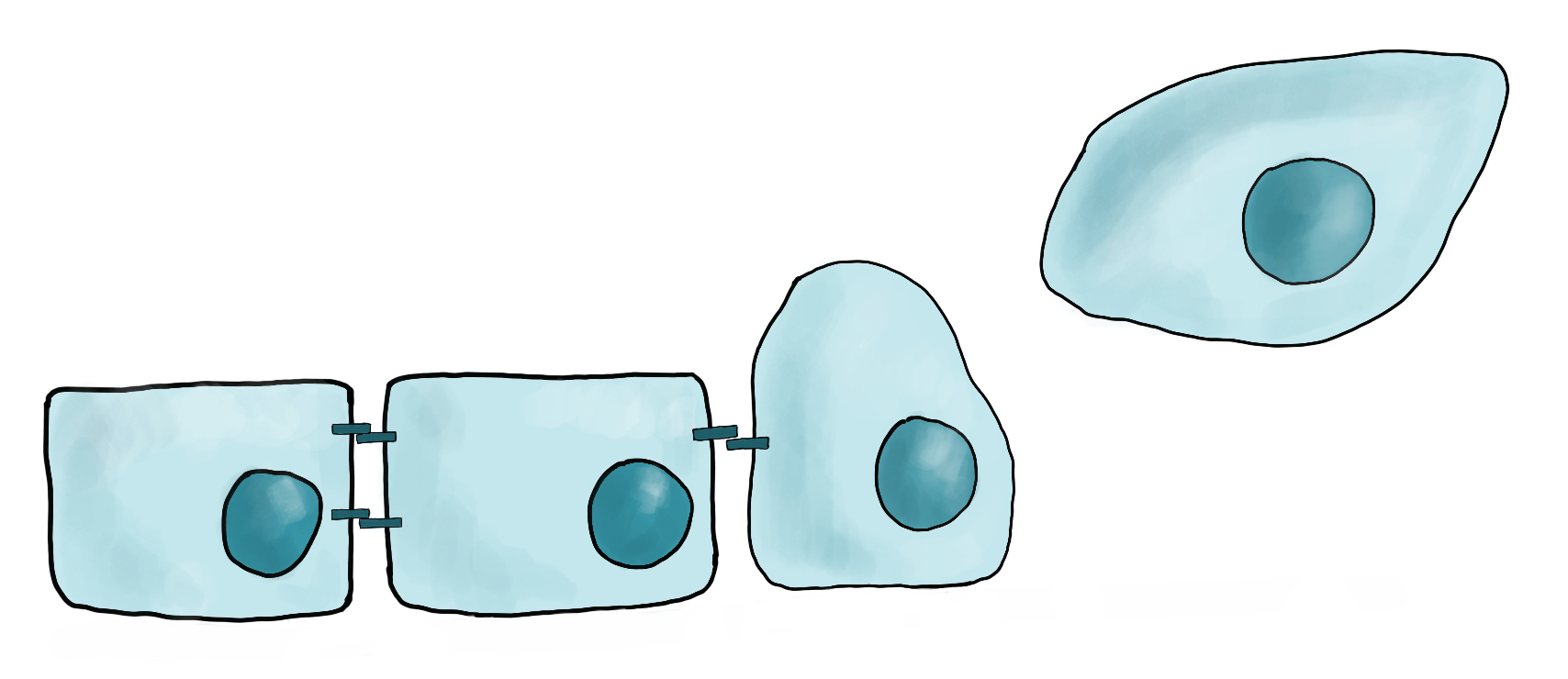
Рисунок 3. Эпителиально-мезенхимальный переход. При эпителиально-мезенхимальном переходе опухолевые клетки теряют связи с соседними эпителиальными клетками и базальной мембраной, меняют форму, становясь более мобильными.
рисунок автора статьи
Существует два варианта распространения метастазов: в виде отдельных клеток и в виде опухолевых кластеров. Кластеры морфологически неоднородны: в их структуре можно найти клетки-лидеры с мезенхимальными свойствами, клетки с промежуточным фенотипом и клетки с эпителиальными свойствами. Для того, чтобы такие конгломераты не распадались, клетки в них продолжают экспрессировать белок E-кадгерин, который помогает поддерживать связь между отдельными клетками [7].
2) Инвазия
После эпителиально-мезенхимального перехода клетки опухоли приспособились к передвижению, но возникает новая проблема: на пути в системный кровоток расположен барьер в виде базальной мембраны, который отделяет эпителиальный слой от стромы. На такой случай клетки-лидеры в опухолевых кластерах и одиночные клетки имеют решение: в инвадоподиях (выростах плазматической мембраны клетки) выделяются различные протеолитические ферменты, разрушающие внеклеточный матрикс. Так образуются «дырки» для проникновения клеток через базальную мембрану (рис. 4). Данный процесс называется инвазией.
Фактически, только те опухоли, которые могут разрушать базальную мембрану и проникать в окружающие ткани, считаются злокачественными. Многие опухоли долгое время не выходят за пределы эпителиального слоя и не вызывают клинически выявляемых симптомов. Для таких вариантов существует специальный термин — рак in situ (буквально, рак «на месте»).
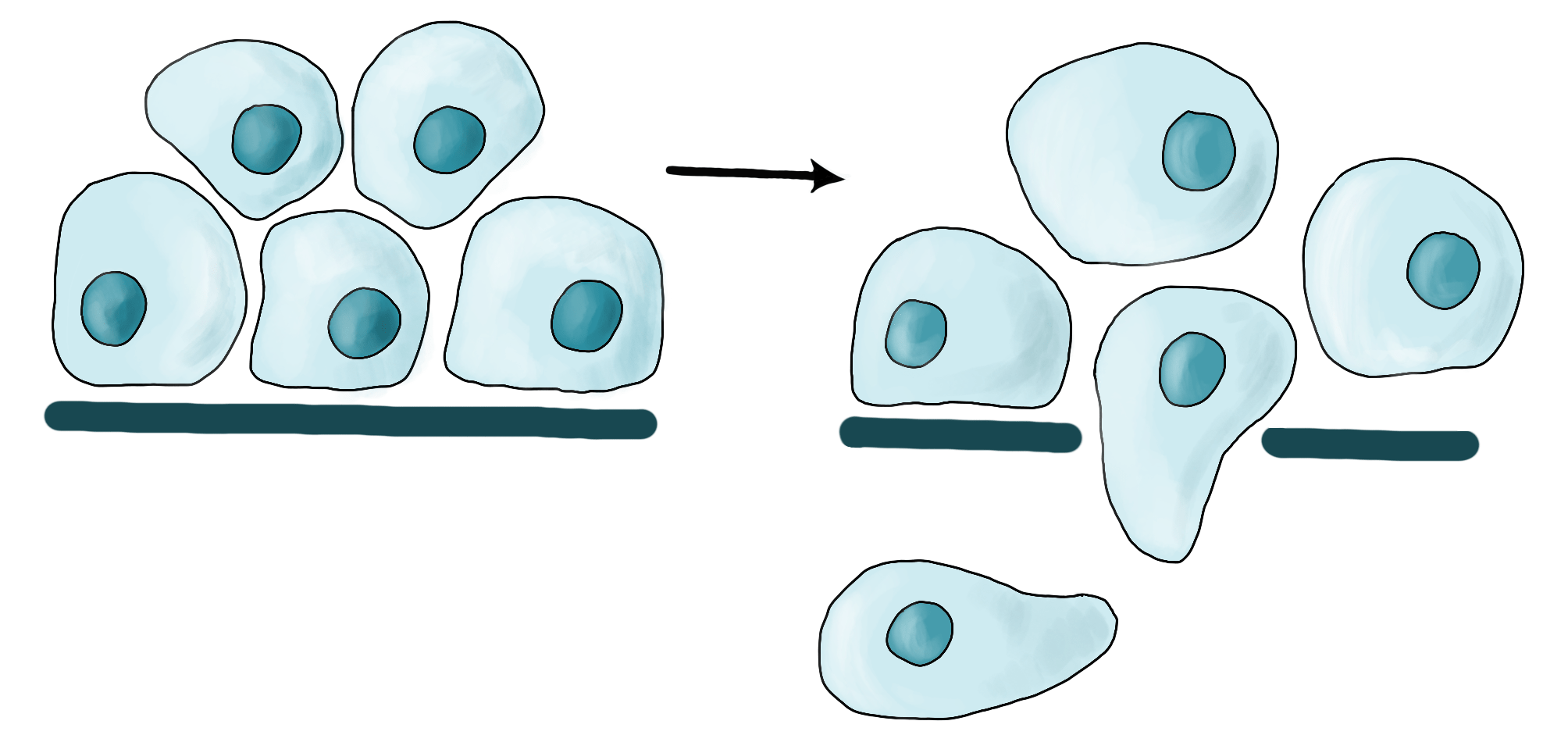
Рисунок 4. Инвазия. Опухолевые клетки (голубые) могут синтезировать ферменты, разрушающие базальную мембрану (темно-синяя), образуя «дырки», таким образом переходя из стадии рак in situ (слева) в инвазивную форму (справа).
рисунок автора статьи
3) Интравазация
Последним препятствием на пути в кровоток является стенка кровеносного сосуда. Интравазация, то есть проникновение в кровеносные сосуды, осуществляется посредством двух механизмов: активного и пассивного. В первом случае опухолевые клетки активно проходят через эндотелиальный слой, проникая в пространства между отдельными эндотелиоцитами и разрушая межклеточные контакты (рис. 5). Во втором случае опухолевые клетки просто «падают» в кровоток через дефекты вновь сформированных при ангиогенезе сосудов.
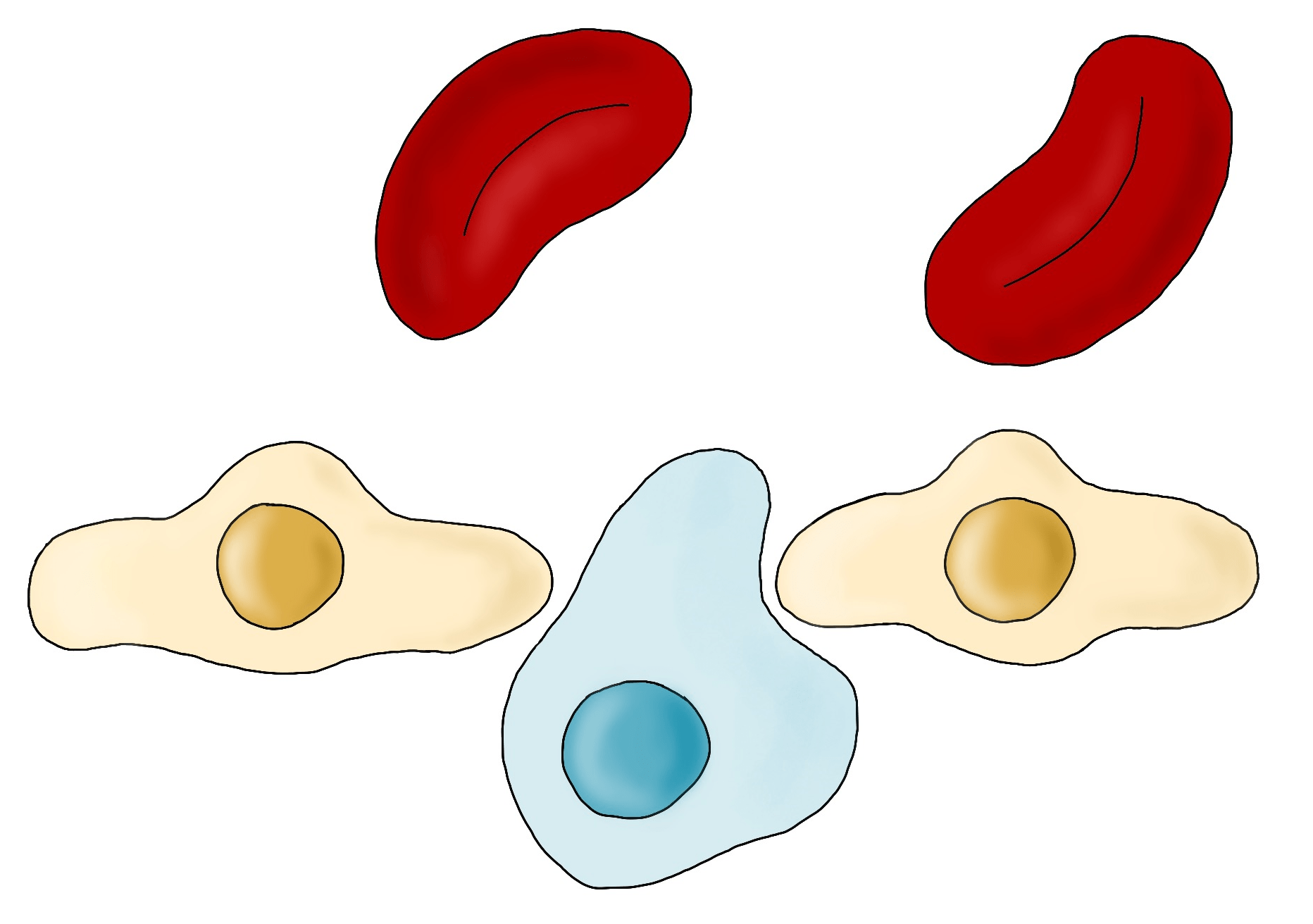
Рисунок 5. Интравазация. Опухолевая клетка (голубая) проникает между двумя эндотелиальными клетками (коричневые), чтобы попасть в кровоток.
рисунок автора статьи
Существует несколько путей распространения метастазов:
- Гематогенный путь, т.е. через кровеносные сосуды.
- Лимфогенный путь, т.е. через лимфатические сосуды.
- Имплантационный путь, т.е. через непосредственный контакт поверхностей (например, с висцерального листка брюшины на париетальный).
Далее будет обсуждаться гематогенный путь распространения, так как это, вероятно, основной путь метастазирования. Небольшие метастатические очаги, которые образуются в лимфатических узлах, представляют собой тупик для раковых клеток и функционируют скорее как важный клинический параметр распространения [7].
4) Выживание в системном кровотоке
Наконец, опухолевые клетки попадают на главную магистраль человеческого организма — в кровеносную систему. Здесь они меняют свой статус: теперь они носят название циркулирующих опухолевых клеток (ЦОК). Количество таких клеток в крови пациента потенциально является диагностическим и прогностическим маркером тяжести опухолевого процесса и уже сейчас оценивается в некоторых клиниках нашей страны [7].
Кровь не является дружелюбной средой: опухолевые клетки вынуждены преодолевать различные препятствия. Так, гидродинамическое давление стремится физически разорвать, а иммунный надзор (в лице натуральных киллеров) распознать и обезвредить опухолевые клетки. К тому же отсутствие прикрепления к субстрату может привести к особой форме апоптоза клетки — аноикису. Так же образование и поддержание опухоли сильно зависит от опухолевого микроокружения, которое теперь находится позади. Циркулирующие опухолевые клетки, подобно повзрослевшим детям, покидают привычную и комфортную, но неподходящую для развития среду, пробираясь через тернии к звездам. Но эта история не всегда имеет «счастливый» конец: большая часть клеток погибает в результате действия враждебных факторов.
Однако здесь происходит в определенном роде «предательство» со стороны нашего организма: некоторые клетки начинают всячески поддерживать распространение опухолевых клеток!
Например, тромбоциты, не опознав врага, «обволакивают» ЦОК вскоре после попадания в кровоток, обеспечивая им иммунную и физическую защиту (рис. 6). Тромбоциты выделяют различные факторы, которые подавляют активность натуральных киллеров — основных эффекторов противоопухолевого иммунитета. Кроме того, они физически экранируют опухолевые клетки путем образования защитных оболочек и активации отложения фибрина. Что еще более интересно, тромбоциты активируют внутриклеточные сигнальные пути в ЦОК, что в конечном итоге влияет на их способность вызывать рост метастазов [7].
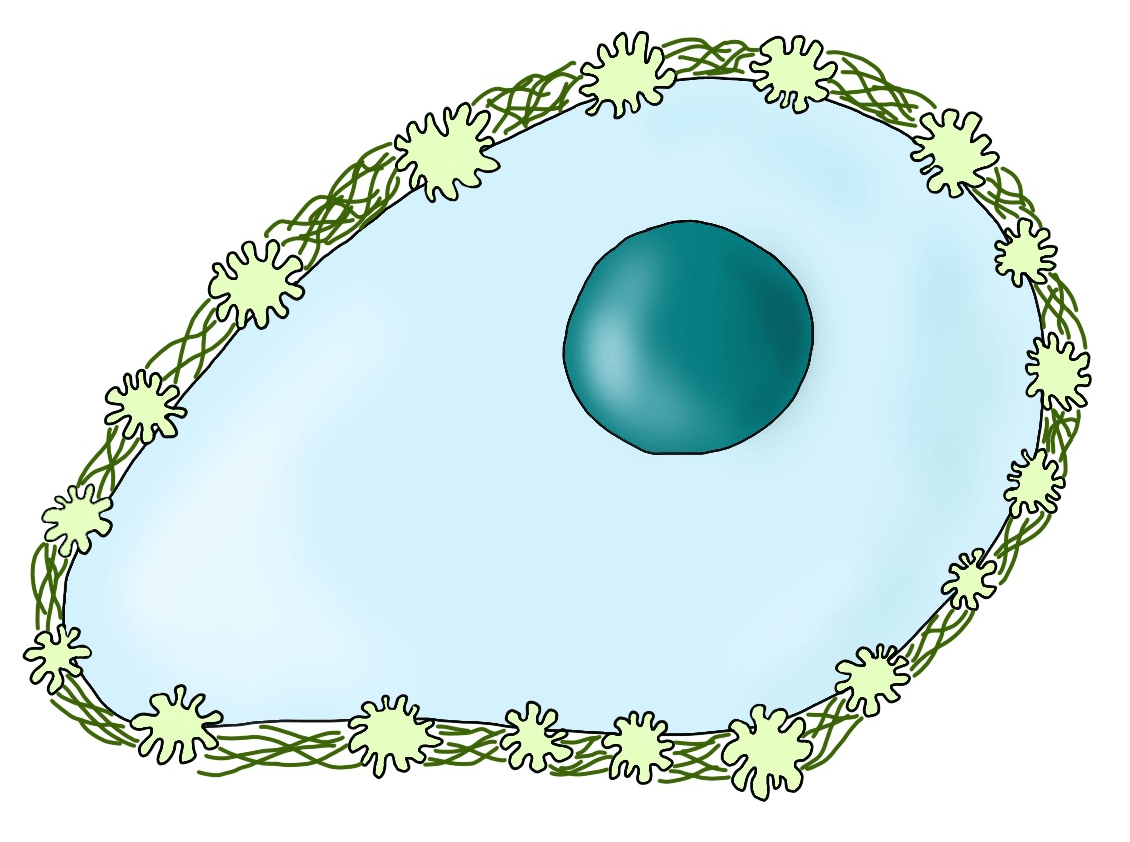
Рисунок 6. Взаимодействие опухолевой клетки с тромбоцитами. Защитная оболочка циркулирующей опухолевой клетки из тромбоцитов (зеленые частицы) и фибрина (темно-зеленые линии).
рисунок автора статьи
Нейтрофилы защищают ЦОК от действия натуральных киллеров, а также помогают экстравазации — выходу из кровеносного русла. Нейтрофилы формируют внеклеточные ловушки, которые образуются из деспирализованных молекул ДНК. Они предназначены для «ловли» патогенов в ходе иммунного ответа на инфекцию, но также могут быть использованы нейтрофилами для захвата опухолевых клеток в сосудистом русле. Таким «попавшим в ловушку» клеткам легче выживать в просвете сосуда, а также прилипать к эндотелиальным клеткам и выходить за пределы капилляра (рис. 7) [7].
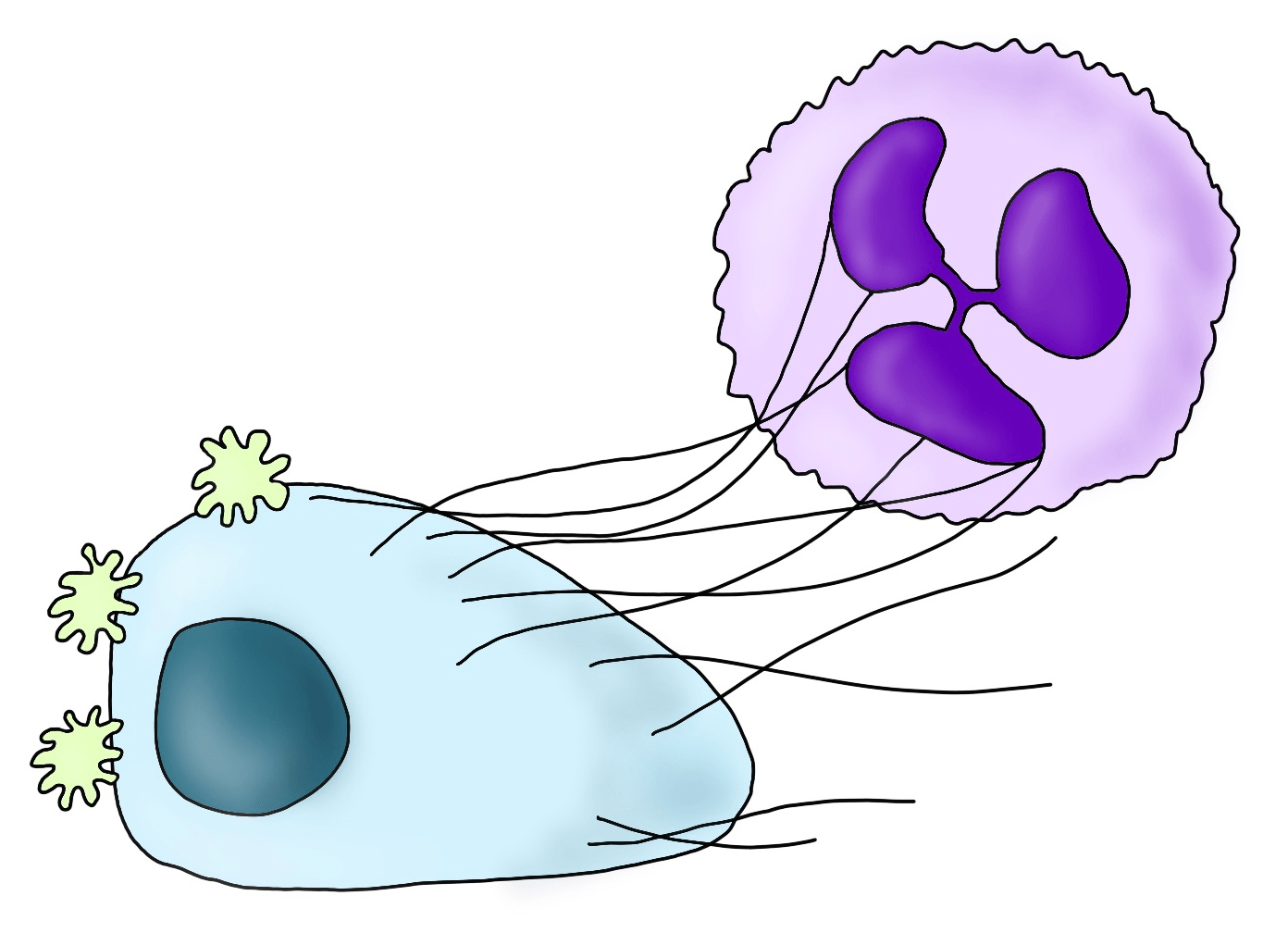
Рисунок 7. Взаимодействие опухолевой клетки с нейтрофилом. Внеклеточная деспирализованная ДНК нейтрофила (фиолетовый) «поймала» циркулирующую опухолевую клетку (голубая), покрытую тромбоцитами (зеленые).
рисунок автора статьи
5) Остановка и экстравазация
Теперь давайте проследим путь распространения циркулирующих опухолевых клеток (ЦОК). Попав в капилляры, они направляются в более крупные венозные сосуды, затем в правый желудочек и в малый круг кровообращения. Здесь они могут с большой вероятностью остановиться в капиллярах легкого, так как диаметр кластеров ЦОК значительно больше, да и деформируются они не так хорошо, как клетки крови. Однако часто они проходят через капилляры легкого и попадают в артериальную систему, чем обеспечивают себе доступ ко всем тканям организма (рис. 8). Как они это делают, остается не совсем понятным. Есть предположения, что ЦОК формируют цепочки диаметром в одну клетку, сбрасывают часть своей цитоплазмы, уменьшая объем клетки, проходят через артерио-венозные шунты [8]. Вы уже, конечно, поняли, что опухолевые клетки всегда найдут способ решить проблему!
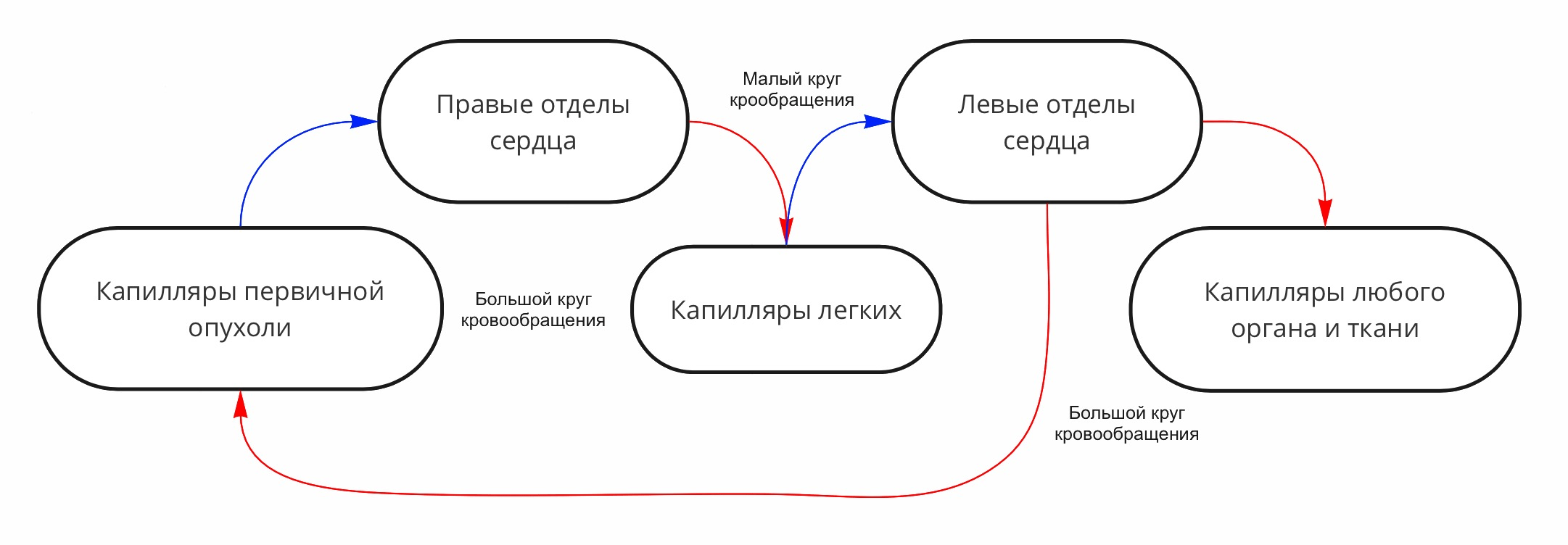
Рисунок 8. Схема миграции циркулирующих опухолевых клеток. По венозным сосудам (синие стрелки) опухолевые клетки/кластеры попадают в правые отделы сердца, затем по артериям (красные стрелки) малого круга кровообращения — в капилляры легких. Дальше они могут либо остановиться, образуя легочные метастазы, либо пройти дальше в вены малого круга, а затем в левые отделы сердца. Оттуда они попадают в артериальную систему большого круга кровообращения, откуда имеют доступ ко всем органам и тканям, потенциально имея возможность образовать метастазы во всех локализациях. Если выйти из кровеносного русла в других тканях у ЦОК не получается, они могут вернуться на место образования первичной опухоли.
рисунок автора статьи
Итак, артериальная система разносит ЦОК по всем органам человека. Остается только найти желаемое пристанище и выйти из кровеносной системы. Но как это сделать?
Взаимодействия ЦОК в кровеносном русле с клетками крови создают предпосылки для последующей остановки и экстравазации. Экстравазация сопровождается процессом, который называется трансэндотелиальной миграцией. Трансэндотелиальная миграция может осуществляться разными путями:
- Тромбоциты вырабатывают АТФ, которая увеличивает проницаемость стенки капилляров: эндотелиоциты как бы сокращаются и отступают друг от друга, давая пространство для проникновения [7].
- ЦОК вырабатывают различные белки, в том числе те, которые помогали при интравазации. Они разными путями увеличивают проницаемость сосудистой стенки [7].
- Иногда трансэндотелиальная миграция может вообще не понадобиться. Кластеры опухолевых клеток просто застревают в просвете капилляра и начинают пролиферировать (размножаться), что в конечном итоге приводит к разрыву сосуда. Этим обеспечивается прямой доступ к паренхиме органа [7].
- Был описан механизм, используя который опухолевые клетки могут выходить из сосуда и генерировать метастазы в легких посредством индукции запрограммированного некроза (некроптоза) в эндотелиальных клетках [7].
В основном, все модели экстравазации рассматриваются на капиллярах легких. Но так как капилляры в разных органах имеют разное строение, то и процесс выхода из кровеносного русла в разных органах будет иметь специфические признаки. Например, синусоидные капилляры печени позволяют пассивный выход в паренхиму органа и не требуют использования сложных приспособлений. А в головном мозге клеткам необходимо преодолеть гематоэнцефалический барьер, поэтому может потребоваться специфическая программа по экстравазации [7].
6) Состояние покоя
Казалось бы, дело за малым: опухолевые клетки добрались до стромы отдаленных органов, остается только начать пролиферировать. Но клетки (теперь они называются диссеминированными опухолевыми клетками, ДОК) попадают в новую микросреду, которая лишена привычных стромальных клеток, факторов роста и компонентов внеклеточного матрикса, а иногда содержит антипролиферативные факторы. В связи с невозможностью адаптироваться к новой среде, клетки переходят в состояние покоя (рис. 9). Иногда они все-таки не очень интенсивно, но делятся, однако часть клеток погибает под действием враждебных факторов, что, в конечном итоге, не приводит к увеличению численности клеток. Такие небольшие, клинически не проявляющие себя очаги называют микрометастатическими очагами [7].
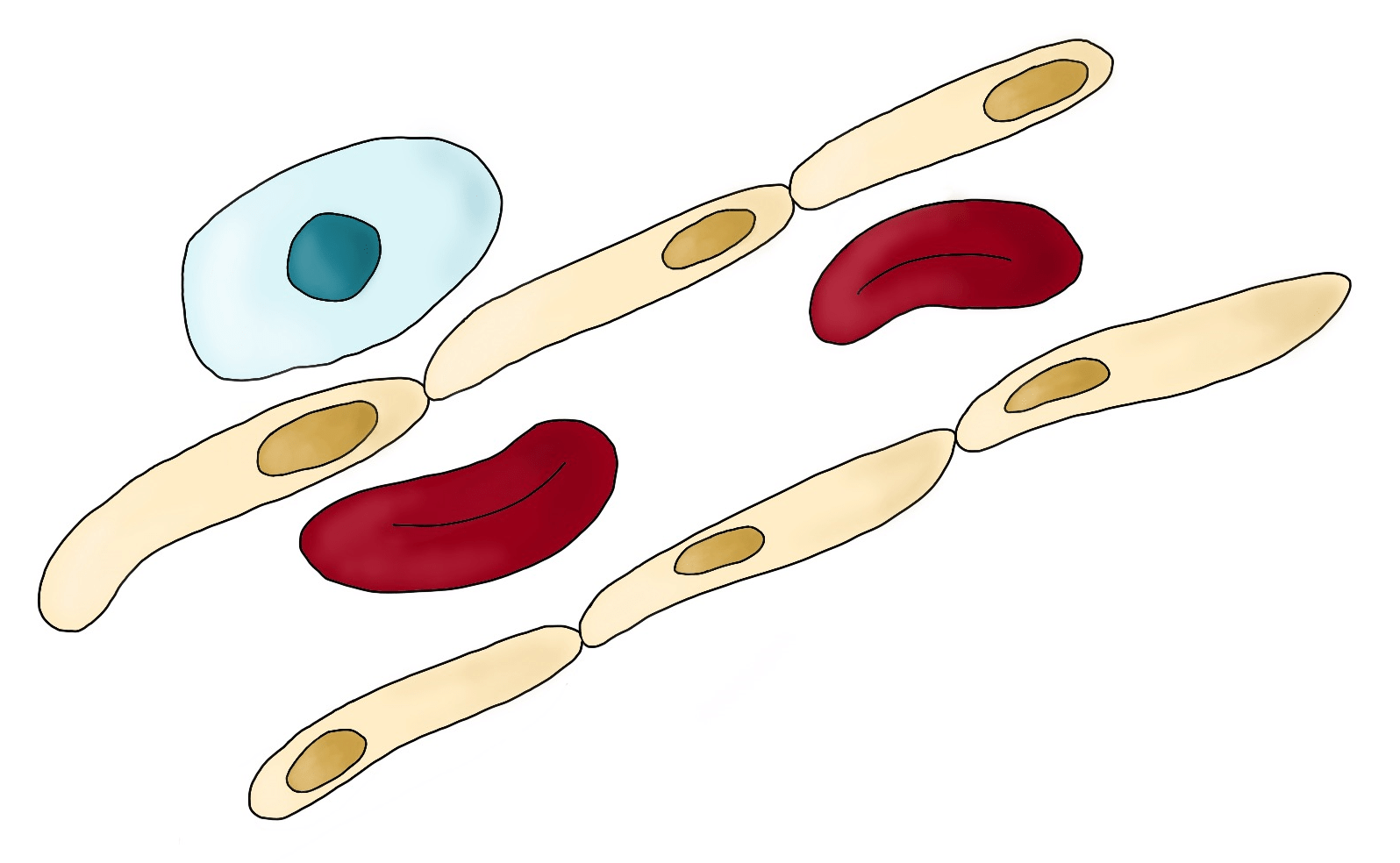
Рисунок 9. Дремлющая опухолевая клетка. Опухолевые клетки, находящиеся в состоянии покоя, часто располагаются около сосудов (т.е. занимают периваскулярную нишу). Почему так происходит, до конца неясно.
рисунок автора статьи
Пациенты, которые успешно излечились от первичных опухолей и находятся в ремиссии, но имеют такие дремлющие опухолевые клетки, имеют бессимптомное минимальное остаточное заболевание. Этот период покоя может продолжаться в течение многих лет, а иногда и десятилетий. Важно понимать, что уничтожить такие очаги практически невозможно: стандартная химио- и лучевая терапия действуют только на активно делящиеся клетки, поэтому дополнительные циклы терапии принесут массу побочных эффектов, а на микрометастатические очаги все равно никак не подействуют.
7) Вторичный опухолевый рост
Таким образом, полноценная, клинически выявляемая метастатическая колония может быть сформирована как сразу после экстравазации, так и после выхода микрометастатических колоний из состояния покоя. Выход из состояния покоя может быть спровоцирован изменениями в окружающей микросреде. Например, при воспалении или ангиогенезе, когда увеличивается уровень ростовых факторов.
Замечено то, что метастазы повторяют ключевые особенности первичной опухоли, среди них и эпителиальные свойства. Но как быть с тем фактом, что опухолевые клетки претерпели эпителиально-мезенхимальный переход и приобрели свойства мезенхимальных клеток? Многочисленные исследования предполагают наличие процесса, обратного ЭМП — мезенхимально-эпителиального перехода (МЭП) [7].
Интересный вопрос: почему определенные виды опухоли имеют характерные сайты метастазирования? Так, например, рак предстательной железы часто метастазирует в кости, а рак желудка — в печень. Английским хирург Стивен Педжет предложил теорию «семян и почвы», которая предполагает, что определенные типы опухолевых клеток (семена) имеют предрасположенность к метастазированию в определенные локализации организма (почву). Связано это с тем, что более предпочтительная «почва» требует более простых механизмов адаптации. Поэтому и определенные виды рака имеют более характерные сайты метастазирования. Но не нужно забывать, что иногда имеет значение строение местной системы кровообращения. Например, метастазирование при колоректальном раке в печень более предпочтительно просто потому, что портальная вена, дренирующая кишечник, направляет всю кровь через печень [7].
Почему метастазы так опасны?
Новообразованные метастатические колонии являются наиболее опасным проявлением опухолевого процесса, нанося большой ущерб организму. Например, распространение рака молочной железы (РМЖ) в пределах молочной железы не несет угрозу для жизни. Однако метастатические колонии РМЖ в костях могут приводить к разрушению костной ткани, вызывая патологические переломы и мучительную боль. Метастазы в головном мозге могут значительно нарушать функцию центральной нервной системы, тогда как метастазы в легких и печени угрожают жизни в связи с нарушением функций этих жизненно важных органов.
Как еще могут навредить метастазы:
- Вызвать смертельное кровотечение.
- Синтезировать цитокины, которые приводят к крайнему истощению организма (кахексии).
- Вызвать тромбоэмболию легочной артерии (экстренное, часто смертельное состояние).
- Вызвать вторичную инфекцию.
- Привести к нарушениям электролитного баланса.
Также агрессивное лечение метастатической болезни может привести к смертельным побочным эффектам. До сих пор метастатическая болезнь — это практически приговор для пациента.
Как могут помочь знания биологических основ метастазирования в клинической практике?
Понимание процессов, лежащих в основе формирования метастазов, критически важно для разработки эффективного лечения рака. Разберем по порядку, какие точки приложения уже используются и могут быть использованы в перспективе:
1) Ангиогенез.
Фактор роста эндотелия сосудов (vascular endothelial growth factor, VEGF) — один из самых известных регуляторов ангиогенеза. Подействовав на уровень этого фактора роста, можно контролировать рост опухоли (она не сможет вырасти больше определенного размера, ведь питается без новообразованных сосудов только за счет ограниченно эффективной диффузии). Таким образом, бевацизумаб (авастин) , представляющий собой моноклональное антитело против VEGF, используется при лечении метастатического колоректального рака, рака молочной железы, почечно-клеточного рака и т.д.
Об авастине также рассказывалось в статье «Краткая история открытия и применения антител» [9].
2) Инвазия, интравазация и экстравазация.
Заблокировав образование инвадоподий, можно ограничить такие процессы, как инвазия, интравазация и экстравазация. Ингибиторы тирозинкиназы BCR-ABL GNF-5, а также используемые в клинической практике иматиниб и нилотиниб могут тормозить образование предшественников инвадоподий [10]. Это блокирует полимеризацию актина, который является структурным элементом микрофиламентов. Без них образование инвадоподий невозможно.
3) Взаимодействие с ЦОК
Возможно, вы слышали о таком интересном подходе к лечению заболеваний, как тераностика. Суть этого подхода заключается в создании фармацевтических композиций, которые являются одновременно и средством диагностики, и терапевтическим агентом.
Было показано, что ЦОК могут возвращаться к месту своего происхождения. В связи с тем, что сформированные при ангиогенезе сосуды «протекают», экстравазация ЦОК может проходить в первичную опухоль или уже сформированные метастазы. Было предложено использовать такую особенность для доставки противоопухолевой терапии. Так, например, можно доставить онколитические вирусы , которые способны уничтожить опухоль. При этом мы таким образом модифицируем циркулирующую опухолевую клетку или онколитический вирус, что можем проследить их судьбу на позитронно-эмиссионной томографии (ПЭТ) [11]. Это ли не искусство?!
Про онколитические вирусы можно узнать больше в статье «Вирусы против рака» [12].
4) Взаимодействие с тромбоцитами.
Использование антитромбоцитарных препаратов может быть затруднено тем, что на фоне лучевой или химиотерапии зачастую возникает тромбоцитопения (уменьшение количества тромбоцитов ниже нормальных значений). Таким образом, мы можем еще больше увеличить риск кровотечений. Поэтому такие препараты назначаются с большой осторожностью.
- аспирин (блокатор циклооксигеназы) уменьшает агрегацию, адгезию тромбоцитов и тромбообразование за счет подавления синтеза тромбоксана А2 в тромбоцитах (вещества, активирующего агрегацию тромбоцитов). В связи с этим замечен эффект аспирина на сокращение количества метастазов и уменьшение смертности от разных видов опухолей.
- клопидогрел — еще один ингибитор агрегации тромбоцитов, показал свой эффект на сокращение роста и метастазирования опухолей [13].
Даже если мы не можем действовать против тромбоцитов, можно заставить их работать на нас. Так была предложена методика доставки противоопухолевых препаратов на мембранах тромбоцитов. Например, мы можем доставить ингибиторы контрольных точек. Иммунные контрольные точки — это такие регуляторные молекулы, которые находятся на Т-клетках и необходимы для защиты здоровых клеток организма от атаки собственной иммунной системой организма [14]. Опухолевые клетки используют этот механизм для избегания иммунного ответа (рис. 10). На животных моделях было показано, что доставка ингибиторов контрольных точек на мембранах тромбоцитов более эффективна, чем стандартная терапия данными препаратами.
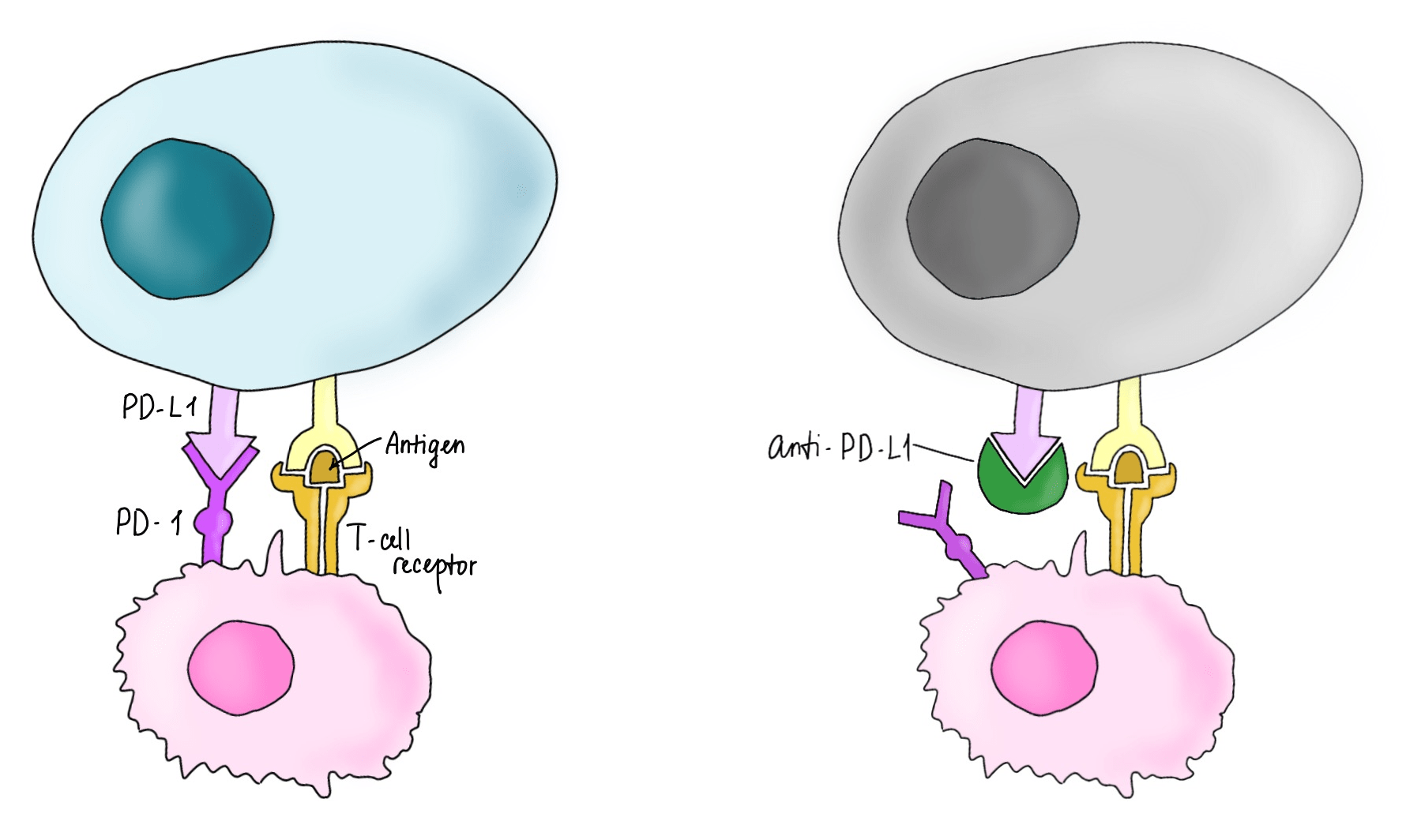
Рисунок 10. Взаимодействие опухолевой клетки с Т-клеткой.
Слева: опухолевая клетка (голубая) экспрессирует PD-L1 (programmed death-ligand 1), который связывается с молекулой PD-1 (programmed cell death protein 1) на T-клетке (розовая), что блокирует иммунный ответ против этой клетки.
Справа: ингибитор PD-L1 блокировал данное звено патогенеза, вызвав гибель опухолевой клетки.
рисунок автора статьи
5) Действие на диссеминированные опухолевые клетки (ДОК).
Как мы выяснили раньше, ДОК — это диссеминированные опухолевые клетки, которые зачастую переходят в состояние покоя. Как можно повлиять на такие покоящиеся клетки:
- увеличить длительность состояния покоя при помощи иммунотерапии;
- уничтожить ДОК за счет действия на сигнальные пути, которые помогают им выжить;
- вытолкнуть их из спящей ниши в менее благоприятную среду и затем уничтожить противоопухолевой терапией;
- вывести ДОК из состояния покоя с помощью факторов роста;
- избегать состояние покоя, действуя на сигнальные пути перехода в него [15].
Однако, как это можно сделать, не совсем понятно.
К чему мы пришли?
Метастазирование — сложный, пока что малоизученный процесс, в котором остается много непонятного. Но несмотря на такую таинственность, начинает проявляться ряд общих принципов:
- Метастазирование — это многоступенчатый процесс, стадии которого связаны между собой.
- Одним из ключевых процессов в этом каскаде является эпителиально-мезенхимальный переход, который позволяет клеткам перейти в более подходящее для распространения по организму состояние. После распространения клетки претерпевают обратный процесс, называемый мезенхимально-эпителиальным переходом.
- В кровотоке метастатические кластеры клеток и отдельные клетки ждут испытания, преодолеть которые им помогают нейтрофилы и тромбоциты.
- После выхода из кровеносного русла клетки могут долгое время оставаться в состоянии покоя, пока не настанет благоприятный момент для размножения. Подействовать на покоящиеся клетки пока представляется сложной задачей.
Знание биологических основ метастазирования необходимо для разработки эффективных методов лечения метастатического процесса. Некоторые из возможных точек приложения уже активно используются, однако большинство из перечисленных методик являются экспериментальными и на данный момент практического применения, к сожалению, не имеют. Будем надеяться, что ученые рано или поздно найдут ту самую уникальную особенность метастатических клеток, которая позволит улучшить прогноз онкологических пациентов — вплоть до их полного выздоровления.
Литература
- Апоптоз, или Путь самурая;
- Тернистый путь метастазов: через гипоксию в печень;
- Метастазирование опухолей;
- Во власти опухоли: почему метастазы так сложно остановить?;
- Порочный цикл: от рака молочной железы до костных метастазов;
- Маленькие пузырьки и большие проблемы: роль экзосом в раковом метастазировании;
- Arthur W. Lambert, Diwakar R. Pattabiraman, Robert A. Weinberg. (2017). Emerging Biological Principles of Metastasis. Cell. 168, 670-691;
- Weinberg R.A. The biology of cancer. W.W. Norton & Company, 2013. — 960 p.;
- Краткая история открытия и применения антител;
- Tomer Meirson, Alessandro Genna, Nikola Lukic, Tetiana Makhnii, Joel Alter, et. al.. (2018). Targeting invadopodia-mediated breast cancer metastasis by using ABL kinase inhibitors. Oncotarget. 9, 22158-22183;
- Katie M Parkins, Veronica P Dubois, John J Kelly, Yuanxin Chen, Natasha N Knier, et. al.. (2020). Engineering Circulating Tumor Cells as Novel Cancer Theranostics. Theranostics. 10, 7925-7937;
- Вирусы против рака;
- Omar Elaskalani, Michael Berndt, Marco Falasca, Pat Metharom. (2017). Targeting Platelets for the Treatment of Cancer. Cancers. 9, 94;
- Почему неклеточная иммунотерапия не способна победить все виды злокачественных опухолей?;
- Rana Jahanban-Esfahlan, Khaled Seidi, Masoud H. Manjili, Ali Jahanban-Esfahlan, Tahereh Javaheri, Peyman Zare. (2019). Tumor Cell Dormancy: Threat or Opportunity in the Fight against Cancer. Cancers. 11, 1207.






