Многоликая биодеградация
09 августа 2022
Многоликая биодеградация
- 1125
- 0
- 2
Современные цифровые технологии творят чудеса. Мы так привыкли к этому, что даже не воспринимаем их как чудо. А мне стало любопытно: что, если ставший за шесть с лишним лет весьма обширным материал из моих статей в «Биомолекуле» загрузить в компьютерную программу, генерирующую облака слов? Такая программа совершенно беспристрастно выдает в сжатой форме самую суть повествования. Вот она, созданная искусственным интеллектом выжимка из нашей работы, обобщенной в научно-популярной форме.
Рисунок в полном размере.
облако слов сгенерировано на сайте Word’s Cloud
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: С течением времени загрязнение окружающей среды химическими продуктами производств становится все более острой проблемой. Но сама природа миллиарды лет оттачивала эффективный способ переработки ядовитых и трудноусваиваемых веществ. Вездесущие микробы — и не только они — неусыпно стоят на страже чистоты и баланса биосферы, постоянно готовые переработать опасный отход во что-то безвредное и пригодное для дальнейшего использования. Биодеградация — природное явление, столь же древнее, как сама жизнь на Земле. Но теперь настало время применять ее для спасения планеты от вреда, который мы, люди, в конечном итоге причиняем самим себе. Сама по себе биодеградация — это, безусловно, сугубо прикладное направление науки. Однако она опирается на фундамент микробной метаболомики, беспрестанно эволюционирующей и бесконечно многообразной. В статье понемногу рассказано обо всем этом.
Конкурс «Био/Мол/Текст»-2022/2023
 Эта статья опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2022/2023 и заслужила приз Honoris causa.
Эта статья опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2022/2023 и заслужила приз Honoris causa.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
В предыдущих статьях цикла биодеградация была подробно освещена, рассмотрена под разными углами и в различных аспектах [1–6]. Что можно добавить теперь? По сути, только рассмотреть примеры, общеизвестные, но традиционно не рассматриваемые в качестве биодеградации. Несколько таких примеров я постарался привести здесь. Ведь иногда открытия совершаются «на кончике пера». Для этого необязательно открывать новое явление — иногда достаточно вспомнить старое, уже давно ставшее достоянием науки, рассмотрев его в неожиданном ракурсе.
Кроме того, я включил в статью интересные примеры биодеградации, про которые уже рассказывал в своих видеолекциях «Кто съел полиэтилен?», но которые (вот парадокс!) до сих пор не были освещены в моих статьях в «Биомолекуле». Конечно, давно следовало рассказать о том, что в биодеградации задействованы не только микробы, но и высшие организмы. Без этого всё рассказанное ранее выглядит однобоким! До сих пор я стремился быть оригинальным и рассказывать о чудесах природы, мало знакомых читателям. Но порой следует останавливаться на общеизвестных вещах (как сильно нашумевшее в свое время поедание полиэтилена гусеницами), которые служат своего рода «реперными точками» для оценки других, малоизвестных явлений. Обязательно следует рассказать о прогнозируемых явлениях, которые делают науку наукой — в исследовании биодеградации они тоже существуют.
Одним словом, эту статью я планировал как заключительную, в которой рассмотрено то, о чем еще не говорилось до сих пор.
Вторая жизнь
В большинстве примеров биодеградации, которые мы с вами, дорогие читатели, рассматривали, главный акцент ставился на том, что живые организмы разлагают неприродные вещества полностью, без остатка. В действительности это наблюдается не всегда. Во-первых, искусственные соединения могут разрушаться микробами очень медленно — ферменты, эффективно их разлагающие, в процессе эволюции еще не возникли. Во-вторых, никакой вид микроорганизмов не способен разлагать все классы соединений. Для полной биодеградации требуется сообщество разных видов. Но во всех ли случаях требуется полностью разложить вещество? Практика показывает — не во всех. Такая частичная биодеградация называется «биотрансформация» — превращение вещества в другое, обычно близкое по строению и свойствам.
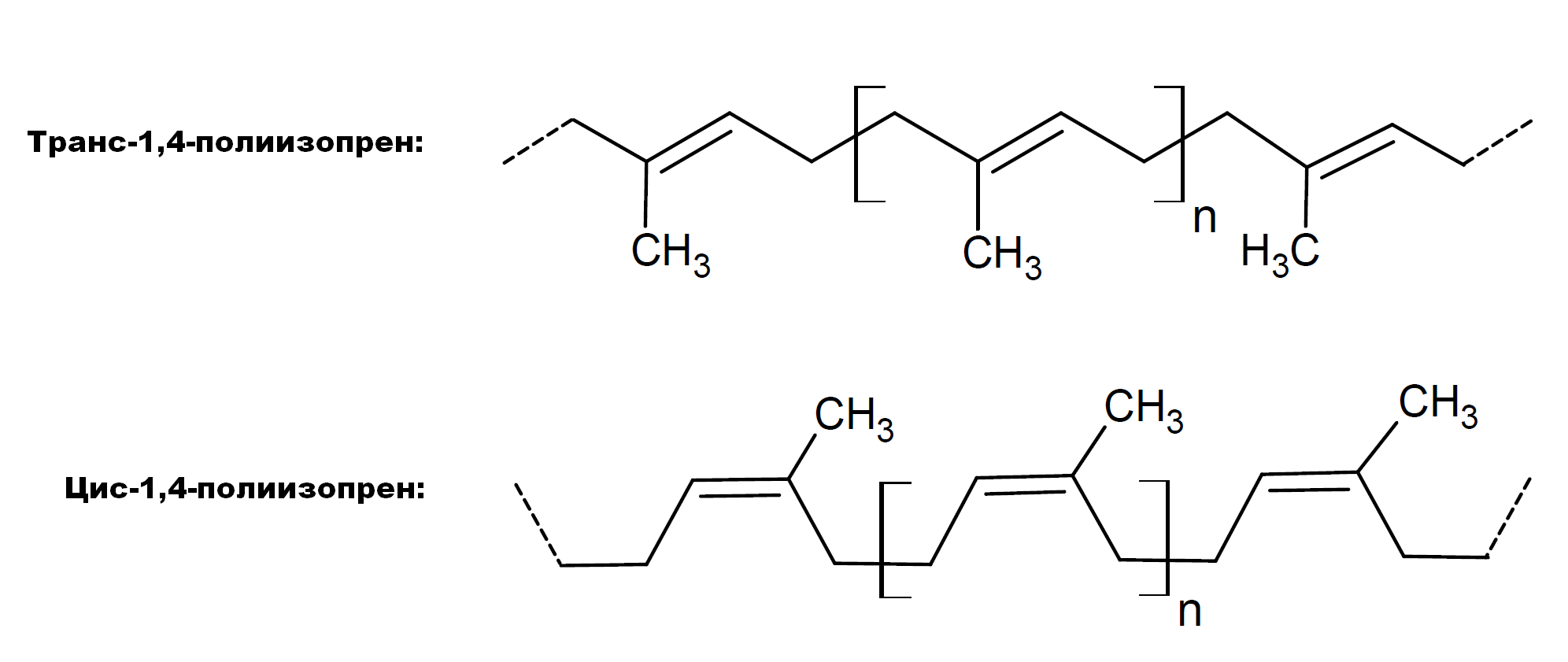
Жители тропических регионов испокон веков были знакомы с такими полезными материалами, как натуральный каучук и гуттаперча. Эластичные и водонепроницаемые, они идеально подходят для пропитки одежды, защищающей от дождя. Каучук к тому же упруг и эластичен. Натуральный каучук и гуттаперча являются полимерами углеводорода изопрена (2-метил-1,3-бутадиена, С5Н8) — высшими изопреноидами, различающимися пространственной структурой. Каучук — это поли-транс-изопрен, а менее эластичная гуттаперча, соответственно, — поли-цис-изопрен (рис. 1А). Низшие изопреноиды — терпены — намного более разнообразны. К ним относятся такие природные вещества, как камфора, ментол, сквален, оранжевый пигмент каротин и получивший дурную (незаслуженную!) славу холестерин. Все олигомеры и полимеры изопрена являются липидами, гидрофобными веществами [7]. А природными источниками каучука являются растения — так называемые каучуконосы. Наиболее известным продуцентом изопренового каучука является тропическое дерево гевея бразильская (Hevea brasiliensis) (рис. 1Г), а гуттаперчи — бересклет (род Euonymus).
Итак, жителям тропических стран каучук был известен многие века. Но настоящий бум производства каучука начался с европейской колонизации Юго-Восточной Азии, Зондского архипелага и Южной Америки. Плантации каучуконосов стали настоящими стержнями экономического развития. Апогея каучуковый бум достиг в первые десятилетия ХХ века, с развитием автомобилестроения. Тогда, как и сейчас, каучук шел на производство автомобильных покрышек. Автомобилестроение шло параллельно с электрификацией — а каучук, помимо прочего, является отличным изолятором, не пропускающим электрический ток. Из него стали делать обмотки кабелей и проводов. Впрочем, вначале он был исключительно натуральным, изопреновым. Довольно быстро стало известно, что спекание каучука с серой позволяет получать прочные материалы — резину и эбонит. Сера реагирует с макромолекулами каучука, образуя серные мостики, сшивающие их между собой (рис. 1Б). Такой «вулканизированный» каучук менее эластичен (эбонит с максимальным содержанием серы вообще хрупкий и твердый), зато более прочный и нерастворимый в любых растворителях (рис. 1В).
Впрочем, ближе к середине двадцатого столетия пошла тенденция заменять растительное сырье нефтепродуктами. Надо гордиться своими достижениями — производство синтетического каучука впервые наладили в Советском Союзе. Такие печально известные нам понятия как «санкции» и «импортозамещение» для нашей истории отнюдь не новы. Еще в конце 1920-х годов произошло обострение советско-британских отношений, после которых поставки каучука в нашу страну прекратились. Это поставило под угрозу само развитие отечественной промышленности. Проблему стали решать несколькими параллельными методами. Во-первых, в богатейшей отечественной флоре нашлись неплохие каучуконосы: всем знаком одуванчик. Каждый срывал этот жизнерадостного вида цветок и знает, что на изломе стебелька выделяется белый млечный сок (рис. 1Д). Сходство с молоком неслучайное — в обоих случаях чисто белая окраска обусловлена взвесью липидных капель в водной среде. Только в молоке это капли жира, а в соке одуванчика — частички каучука! Такой же белый цвет имеет сок всех каучуконосов, включая гевею. А в среднеазиатском одуванчике кок-сагызе (Taraxacum kok-saghyz) каучука вырабатывается еще больше! В общем, плантации как-сагыза стали «нашим ответом Чемберлену». Но более перспективным стал химический синтез каучука из 1,3-бутадиена, или дивинила — углеводорода, близкого к изопрену, отличающегося от него отсутствием боковой метильной группы. Мономерный бутадиен получают из природного газа, а бутадиеновый каучук по свойствам очень близок к натуральному. Синтез разработал русский химик Сергей Васильевич Лебедев, что сделало нашу страну полностью независимой от поставок импортного каучука.
Впоследствии формулы синтетических каучуков постоянно дорабатывались. Появились каучуки бутадиен-стирольные и хлоропреновые, устойчивые к истиранию и даже огню. Очевидно, что к ферментам микроорганизмов эти вещества тоже оказались устойчивы. Сегодня это приводит к печальным последствиям: отработавшие свой срок автомобильные покрышки стали одним из самых опасных загрязнителей окружающей среды. Разлагается покрышка очень долго, а производятся они в несметных количествах. И природа просто не успевает их переработать. В итоге некоторые свалки покрышек видны из космоса (рис. 1Ж)!
Разумеется, микроорганизмы, питающиеся каучуком, существуют. Уже более двадцати лет назад были известны пятьдесят видов актиномицетов, использующих в качестве источника углерода и энергии натуральный каучук [8]. Более тридцати лет назад японские исследователи описали бактериальную переработку бутадиенового каучука. Но слишком медленную! За производством резины эти несчастные микробы просто не поспевают. Конечно, старым покрышкам пытаются найти применение. Резиновую крошку добавляют в асфальтовые покрытия на дорогах. Или оформляют ими клумбы, иногда с большим вкусом (рис. 1З). Но всё это — капля в море.
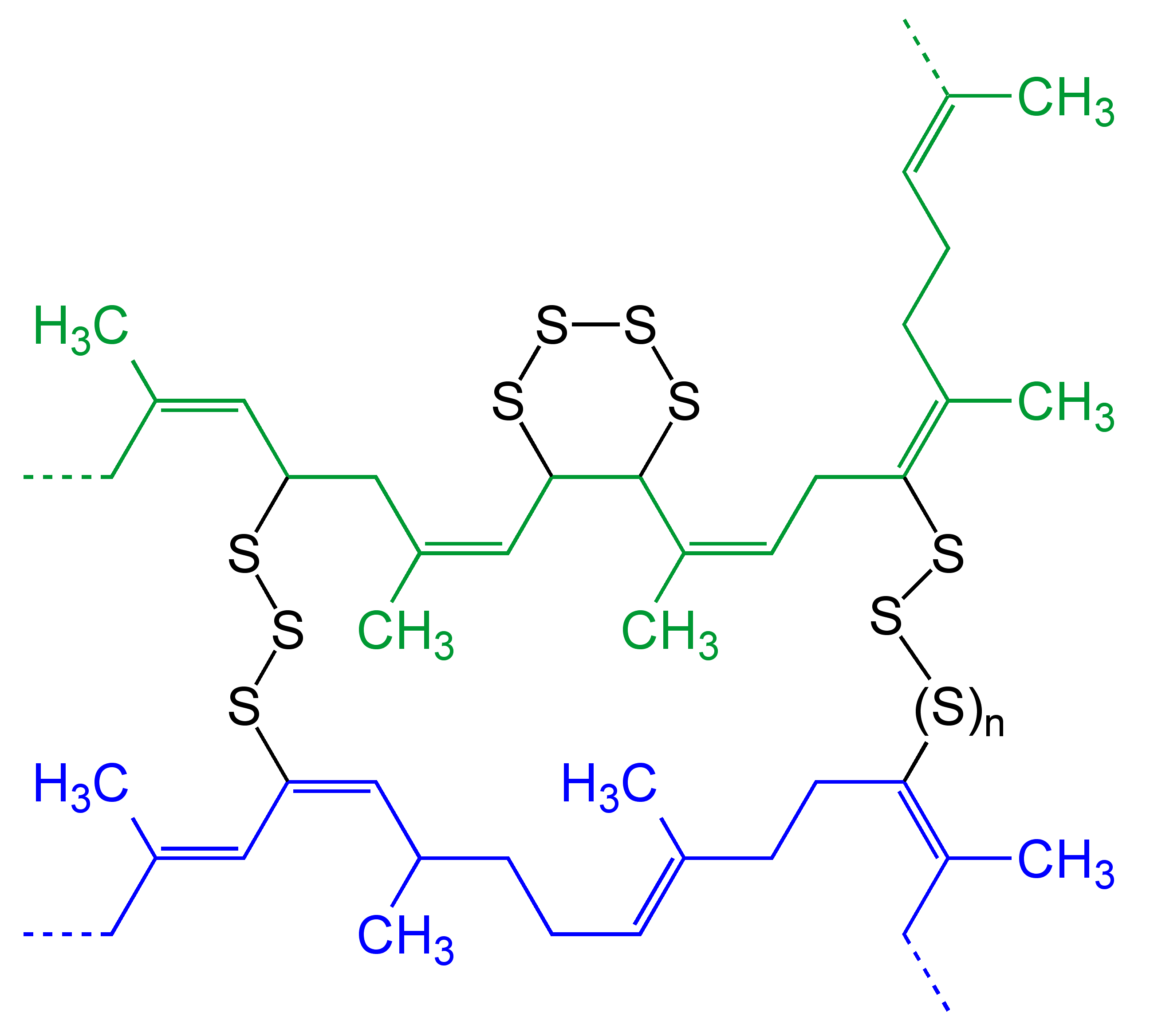
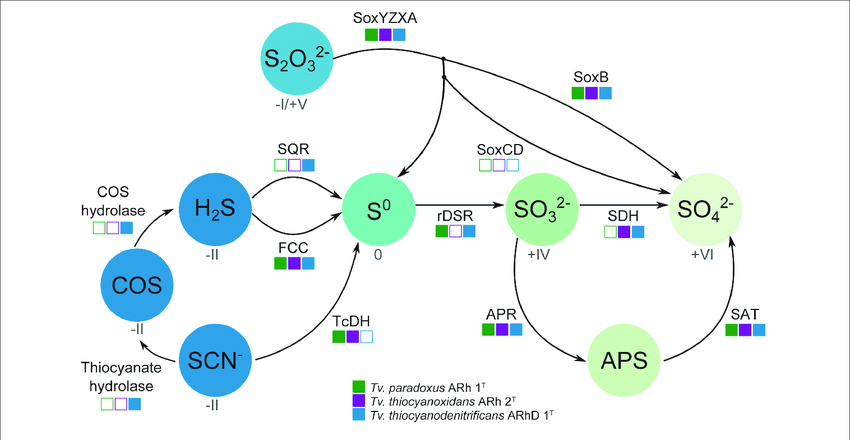
И вот я встретил патент, в котором предлагается резину покрышек измельчать в порошок и вносить в культуральную среду с серными бактериями (такими, как археи рода Sulfolobus). Серные бактерии используют восстановленные соединения серы — сульфиды и полисульфиды — в качестве источников электронов, окисляя их, в конечном счете, до сульфата (рис. 1И). Оказывается, они способны окислять и серные сшивки в макромолекулах резины (не затрагивая при этом углеводородный остов макромолекул) (рис. 1К) [9]. В результате из резины образуется масса, по свойствам очень близкая к исходному каучуку до вулканизации — очень эластичная и растворимая в углеводородных растворителях (например, петролейном эфире). Такой растворенный каучук прекрасно подходит на роль строительных и автомобильных герметиков (рис. 1Й). Вот так, благодаря биотрансформации старая и ненужная резина обретает вторую жизнь, и из загрязнителя превращается в востребованный товар.
Не только микробы!
Работая над этой статьей, я не расставался с мыслью: что-то не так! Уже седьмая статья в «Биомолекуле» про биодеградацию, постарался в подробностях описать все, что можно. А недосказанность осталась. Действительно, у читателя, знакомого с предыдущими моими статьями, может сложиться впечатление, что с загрязнениями на нашей планете борются только микробы. Так ли это? Жизнь слишком разнообразна для этого.
Эта глава призвана восполнить пробел. Действительно, у микроорганизмов, отличающихся от многоклеточных форм жизни значительно более простой морфологией, биохимия, как правило, намного сложнее и разнообразнее. Современные сложные многоклеточные организмы — животные, растения и (отчасти) высшие грибы — эволюционно произошли от немногих групп одноклеточных, а потому смогли унаследовать от них только сравнительно однообразные метаболические пути — малую толику от тех, которыми пользуются микробы. А дальнейшая их эволюция шла именно по пути усложнения морфологии, обеспечения целостности многоклеточного организма, а не разнообразия метаболизма. К тому же (запомним на будущее, это важно!), каждый многоклеточный организм представляет собой сложный симбиоз многих видов, разучившихся жить самостоятельно. Самые известные примеры — митохондрии и пластиды [10], [11]. Это бактерии, за миллиарды лет эволюции превратившиеся в органоиды клеток эукариот [12]. То есть, если сложному эукариотическому организму срочно понадобится разложить какое-то трудноусваиваемое соединение, он может обзавестись бактериями-симбионтами, которые сделают для него эту работу в обмен на комфортные условия жизни.
Например, кишечник животных заселен микрофлорой, усваивающей пищу. Общий вес кишечных бактерий человека составляет в среднем около двух килограммов — немалая часть от общей массы тела! У разных видов животных, с различными пищевыми предпочтениями, микрофлора сильно различается по видовому составу и биохимии.
Удивительного совершенства этот симбиоз достигает у жвачных парнокопытных (рис. 2К). Желудок коровы или овцы состоит из четырех отделов. Первый по порядку из них — рубец, представляющий собой утолщение пищевода, — населен удивительным сообществом симбиотических жгутиконосцев и инфузорий. А эти одноклеточные существа, в свою очередь, заселены симбионтными бактериями и археями, производящими ферменты, способные разлагать грубые растительные волокна [13]. Вдобавок, у жвачных выработалась сложная схема пережевывания пищи с многократной отрыжкой обратно в ротовую полость с целью сделать еду более доступной для симбионтов. Конечно, специализация в данном случае не зашла так далеко, как у митохондрий — рубец возник значительно позже эукариотической клетки. Да и распространился этот симбиоз не столь широко. И тем не менее, этот многоступенчатый симбиоз удивителен и чем-то напоминает волшебный случай из сказки («иголка в яйце, яйцо в утке, утка в зайце...»).
Очень похожее сложное взаимодействие симбионтов наблюдается у общественных насекомых термитов, основной (или даже единственной!) пищей которых служит древесина. Которая, как мы уже знаем из статьи [2], является очень «неудобным» источником пищи. У самого примитивного австралийского термита Mastotermes darwiniensis в кишечнике проживает самый «продвинутый» симбионт — гигантский жгутиконосец Mixotricha paradoxa, видимый невооруженным глазом и сам состоящий в симбиозе с тремя уникальными видами бактерий, обитающими кто на поверхности огромной клетки, кто внутри. Это сложно организованное сообщество совместными усилиями разлагает древесную целлюлозу [14].
Другой удивительный пример симбиоза представляют муравьи листорезы Attinae, которые в своих огромных жилищах разводят грибы лепиоты из семейства Leucocoprineae (рис. 2Л). Муравьи «приручили» гриб несколько миллионов лет назад, и с тех пор регулярно пересевают его чистую культуру. Крылатые царицы муравьев несут на своем теле фрагменты грибницы — без них основать новый муравейник не выйдет. За время культивирования гриб ни разу не размножался половым путем, поскольку муравьи старательно обрезают формирующиеся плодовые тела. Зато грибница этих специализированных грибов, не встречающихся за пределами муравьиных гнезд, формирует клубки — так называемые гонгилидии, богатые гликогеном и маслом. Именно они служат единственной пищей муравьям, общая биомасса которых в гнезде соответствует габаритам взрослой коровы [15]! А сами муравьи нескончаемым потоком носят в гнездо обрезки листьев тропических деревьев — на них развивается грибница. В старину думали, что эти листья служат пищей самим муравьям, но действительность, как часто бывает, оказалась намного сложнее.
Таким образом, многоклеточные организмы традиционно эволюционируют по пути симбиоза с микробами, а не роста разнообразия собственного метаболизма. Так результат достигается быстрее и эффективнее. А мы можем взять за правило, что биодеградацию осуществляют все-таки микробы. Но иногда в симбиозе с высшими организмами, которые могут тоже принять участие в этом процессе, облегчить микробам задачу. Например, ротовые органы и пищеварительная система животных могут измельчить и перемешать трудноусваиваемую пищу. Иногда даже состоящую из ксенобиотиков (к примеру, пластмасс). Температура тела животных, даже пойкилотермных, всегда выше температуры окружающей среды. А рост температуры ускоряет скорость химических реакций, в том числе ферментативных.
Здесь следует напомнить, что термин «животные» в обывательском сознании часто является синонимом слова «млекопитающие». Но с научной точки зрения он значительно шире, и царство животных включает несколько типов. А млекопитающие — это лишь один, не самый значительный по видовому разнообразию класс типа хордовых. То есть насекомые и черви — это тоже животные, и их кишечник так же, как у коров и людей, населен своей уникальной микрофлорой.
Как раз насекомые демонстрируют максимум примеров биодеградации с участием высших организмов. Пример поедания полиэтиленовых пакетов гусеницами пчелиной огневки Galleria mellonella (рис. 2Б) чрезвычайно интересен сам по себе и, будучи опубликованным в престижном научном журнале Current Biology [16], наделал много шума. Похоже, о гусеницах, грызущих полиэтиленовую пленку, сообщили все мировые новостные ленты. После этого я долго колебался, надо ли повторяться и снова приводить этот ставший широко известным пример? А теперь решил, что надо — именно потому, что он известен и обойти его вниманием нельзя. В природе пчелиные огневки, или большие восковые моли, как их еще называют, являются гнездовыми паразитами медоносных пчел (рис. 2А). На стадии гусеницы они питаются воском, из которого созданы пчелиные соты. Воск и полиэтилен имеют сходную структуру, являясь производными высших алканов —(СН2)n—, т.е. переход с одного пищевого субстрата на другой происходит сравнительно легко. Что и наблюдали авторы статьи. Согласно их описаниям, спустя сорок минут после появления гусениц на полиэтиленовом пакете, он начал покрываться дырами от погрызов, а за двенадцать часов сто гусениц съели 92 миллиграмма полиэтилена. Метаболитом полиэтилена в организме насекомых оказался этиленгликоль — это также установили авторы статьи [16].
Безусловно, описанный факт очень интересен и демонстрирует удивительные способности живых существ. С другой стороны, задолго до этого исследования было известно, что кишечник гусениц пчелиной огневки населен бактериями-симбионтами, которые непосредственно заняты расщеплением пчелиного воска. Воск, между прочим, так же, как полиэтилен, устойчив и с трудом вступает в химические взаимодействия, и питаться им могут очень немногие живые существа. Также достаточно давно известна способность грибов и бактерий к разложению полиэтилена — об этом я уже рассказывал в статье «Биодеградация ксенобиотиков как самозащита природы» [2]. В некотором смысле, описываемое исследование сложило разрозненные пазлы в строгую картину. Можно с определенностью сказать, что именно бактерии в кишечнике гусениц заняты биодеградацией. Будучи специализированными потребителями воска, они многие тысячелетия затачивали свой метаболизм на расщепление длинных гидрофобных углеводородных цепочек. Но в составе сложного многоклеточного организма, вооруженного мощными хитиновыми челюстями, железами наружной секреции, нервной системой, органами чувств и ногами для целенаправленного поиска пищи, они работают намного более эффективно и слаженно, чем свободноживущие микробы.
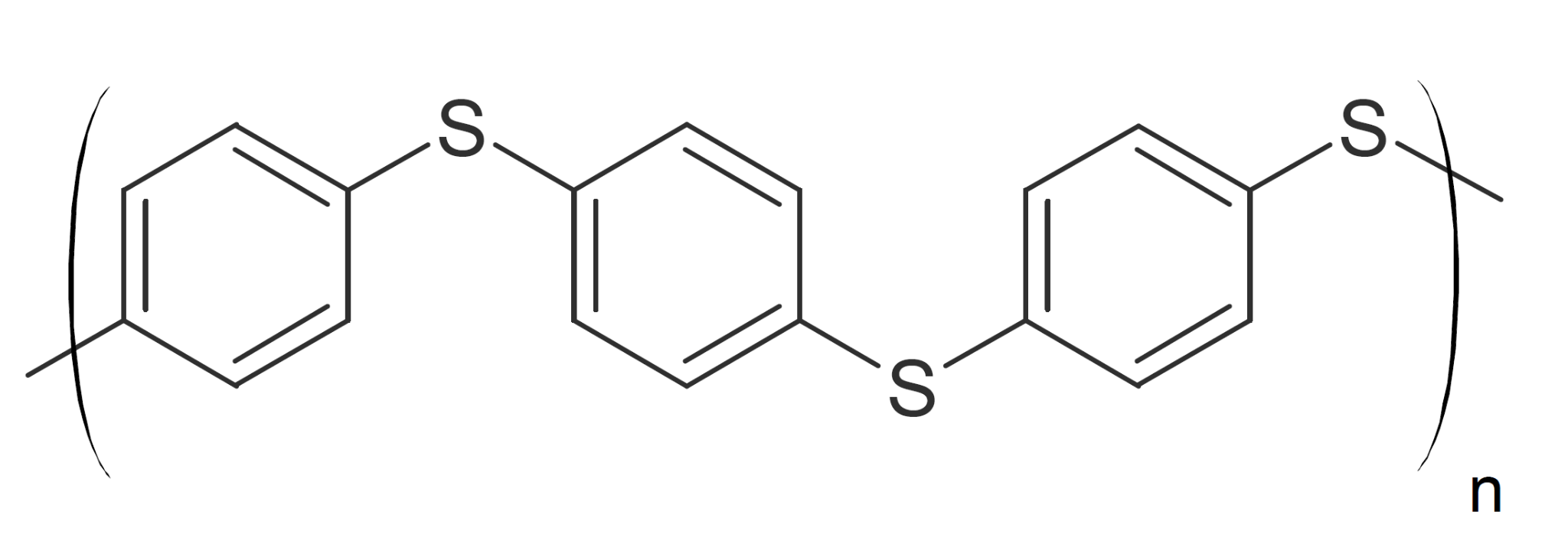
А ведь пример с огневкой не единственный. Другие, менее известные, но имеющие значительную научно-практическую ценность исследования только подтверждают, что в микроорганизмах-симбионтах заложен колоссальный потенциал биодеградации. Логично предположить, что, поскольку насекомые являются самой богатой видами и жизненными формами ветвью царства животных [17], то большинство примеров биодеградации должно быть связано с ними. Судя по литературным данным, это предположение соответствует действительности. Например, желтые мучные черви (личинки жука большого мучного хрущака Tenebrio molitor L.) (рис. 2В) способны не только портить запасы зерна и муки на складах. И не только служить излюбленным кормом для аквариумных рыбок, хотя ради этой цели хрущак, фактически, стал домашним животным. Они, помимо прочего, могут питаться полистиролом [18]. Из экскрементов мучных червей были выделены продукты метаболизма полистирола, содержащие карбонильные, карбоксильные и фенольные гидроксильные группы. После этого совсем не кажется удивительной способность тех же личинок питаться биоразлагаемыми пластиками полигидроксиалканоатами (ПГА) [19]. Бактерии Pseudomonas sp., выделенные из кишечного тракта личинок жука чернотелки Zophobas morio (близкого родственника мучного хрущака) и, вероятно, являющиеся их симбионтами, разлагают полиэтилен и полифениленсульфид [20]. Последний, известный под торговым названием «Ритон», представляет собой пластик, идущий на изготовление особо прочных деталей, по прочности, жесткости, стойкости к растворителям, износостойкости и термостойкости (выдерживает нагрев до более чем 200 градусов Цельсия!) мало уступающий металлическим сплавам (рис. 3А, 3Б). Тем удивительнее, что это вещество «сдается» перед маленькими невзрачными червяками.
Вот обитающее в Калифорнии уникальное насекомое — нефтяная муха Helaeomyia petrolei из семейства береговушек — точно способна вызвать изумление (рис. 3Г). Взрослое имаго этих насекомых вряд ли привлечет внимание — муха как муха, много таких жужжит вокруг жарким летним днем. Зато ее личинки обитают в сырой нефти, плавают на ее поверхности и даже могут питаться нефтью — опять-таки, благодаря специфической микрофлоре кишечника [21]. Хотя основой рациона этих поразительных существ служит все-таки не сама нефть, а тонущие в ней насекомые, принимающие калифорнийские нефтяные озера за привычную водную гладь и неосторожно пытающиеся утолить жажду.
В отличие от нефтяной мухи, платяная моль Tineola bisselliella (рис. 2З) представляется нам вполне заурядным насекомым. Мало того, что она обитает в наших домах и квартирах, она еще и досаждает своим присутствием. Если из шкафа вылетают невзрачные мелкие бабочки, значит, хранящиеся в нем шерстяные вещи наверняка погрызли гусеницы моли. Хорошо помню из детства противно пахнущие брикеты нафталина, которыми отпугивали моль. В природе гусеницы платяных молей специализируются на питании высохшими трупами животных, в первую очередь — их кожными покровами и шерстью. В тропических лесах Амазонии близкие родственницы наших молей живут в шерсти вполне себе живых ленивцев. А после того, как в древности люди научились шить одежду из меха и шерсти, моли стали синантропными видами и поселились в наших жилищах. Впрочем, как и многие обитающие в домах насекомые, моли приносят вред, и мы их не любим, травим и отпугиваем «химией». И не задумываемся при этом, всегда ли моль этого заслуживает? Недавние исследования показали, что с появлением одежды из синтетических тканей моль активно учится... ими питаться! Гусеницы платяных молей способны питаться тканями, состоящими из шерсти и синтетических волокон в соотношении от 30 до 70% [22], [23].
Конечно, можно дать волю фантазии и представить, что со временем (а у насекомых темпы эволюции бывают очень быстрыми) появятся виды рода Tineola, гусеницы которых смогут питаться чистым капроном или нейлоном. Возможно ли это? Науку на одной фантазии строить нельзя, хотя у ученых, даже авторитетных, часто возникает такой соблазн. Тем не менее, в своей предыдущей статье [6] я рассказывал про полимеры, из которых шьют одежду. Нейлон и капрон представляют собой полиамиды. Белки тоже полиамиды — пептидная связь является частным случаем амидной [24]. Только в природных белках пептидные связи образованы исключительно α-аминокислотами, а в синтетических полиамидах карбоксильные и аминогруппы могут быть в различных положениях (например, ε). Определенное сходство структур приводит к тому, что организмы, адаптированные к белковой диете (например, гусеницы молей, питающиеся шерстью), сравнительно легко приспосабливаются питаться полиамидами. Что мы наблюдаем сегодня, и можно предполагать, что со временем эта адаптация будет усиливаться (если производство синтетических волокон сохранится, конечно).
Однако примеры не ограничиваются только насекомыми. Установлена способность к переработке полиэтилена низкой плотности бактериями-симбионтами из кишечника обыкновенного дождевого червя Lumbricus terrestris (рис. 2Д) [25]. Этот факт может показаться курьезным, но в действительности имеет очень важное значение, причем не только для фундаментальной науки. Он указывает на возможность очищать почву от полимеров при помощи ее естественных обитателей — дождевых червей! А земляные черви и без того признаны санитарами почвы, поскольку заняты ее рыхлением при рытье нор и переработкой листового опада [26]. На это указывал еще сам Чарльз Дарвин, величайший натуралист. Вполне возможно, что вездесущие черви сыграют важную роль в постепенной ликвидации мусорных полигонов — настоящего бича современного мира.
Биодеструкторов можно встретить не только на суше. Среди морских двустворчатых моллюсков, к которым относятся мидии и морские гребешки, есть группа высокоспециализированных существ. Раковина им требуется не для защиты от хищников, а для совсем другой цели — сверления ходов в древесине, оказавшейся в морской воде. Вот поэтому она очень маленькая, не более сантиметра в длину, хотя тело существа может превышать метр! «Корабельные черви» — это на самом деле моллюски-древоточцы, обитающие в древесине и портящие деревянные корпуса кораблей. Во времена деревянного парусного флота они были большой бедой, особенно в тропических водах. Надо сказать, что корабельные черви не только живут в древесине, но и питаются ей. И в этом им, конечно, помогают симбиотические бактерии-целлюлолитики. Безусловно, такая специализация делает корабельных червей очень интересными как для зоологов-эволюционистов, так и для ученых-практиков, создающих средства для борьбы с этими вредителями. Однако способность питаться древесиной не очень-то впечатляет: этим занимаются самые разнообразные организмы, от грибов, про которые я рассказывал в статьях [2], [3], до личинок многочисленных насекомых. В отличие от настоящих корабельных червей — терединид — Martesia striata относятся к другой группе двустворчатых сверлильщиков — фоладам, приспособившимся к жизни в камне (рис. 2И). Фолады сверлят ходы в таких твердых породах, как мрамор, гранит, кальцит коралловых построек. Их раковина, напротив, мощная и покрыта шипами. Однако M. striata вторично приспособились жить в древесине, подобно терединидам. Впрочем, наблюдения показали, что эти удивительные моллюски могут селиться не только в древесине, но и в пластмассах. Даже славящийся прочностью и стойкостью к условиям среды пластик АБС — сополимер акрилонитрила, бутадиена и стирола — не выдерживает присутствия этих моллюсков: они сверлят в нем отверстия и живут в них [27]. Правда, нет достоверной информации о способности моллюсков питаться пластиком; но ведь чем-то же они должны питаться, а кроме как АБС там, собственно, и нечем.
Даже высшие позвоночные (такие как птицы) тоже могут осуществлять биодеградацию. Например, очень своеобразная южноамериканская птица гоацин (рис. 2Е) славится множеством уникальных черт. Ее птенцы имеют развитые пальцы на крыльях и похожи на предков птиц — оперенных динозавров. А взрослые гоацины — единственные птицы, питающиеся исключительно грубым и малопитательным растительным кормом — листьями деревьев. Гипертрофированный зоб этих птиц мешает полету (поэтому летают гоацины плохо) и издает неприятный запах навоза; зато, подобно многокамерному желудку жвачных, населен симбиотической микробиотой. В детской научно-популярной книге, написанной доктором биологических наук Борисом Федоровичем Сергеевым [28], упомянут факт, что гоацины способны переваривать каучук, содержащийся в листьях гевеи — одного из важных для них видов кормов!
Примеры биодеградации есть и в мире растений — другой крупнейшей группы многоклеточных организмов. Очень любопытны работы по превращению растений в биосенсоры [29]. Всем знаком шпинат огородный (Spinacia oleracea) — полезная и питательная овощная зелень. Однако интерес к данному растению не ограничивается кулинарией. Например, получен шпинат, флуоресцирующий в присутствии нитроароматических соединений — тринитротолуола или пикриновой кислоты (рис. 2Ё) [30]. Своим свечением растение сигнализирует о том, что рядом с ним в земле находится мина или неразорвавшийся боеприпас. Честно говоря, мне сложно представить, какое практическое применение найдет это чудо генной инженерии. Навряд ли кто-то сможет засеять минное поле трансгенным шпинатом. Тем не менее, сам пример, согласитесь, очень интересен и демонстрирует нам, сколько способностей скрыто в живых организмах. Каждая такая нераскрытая способность — потенциал для дальнейшей эволюции, порой идущей очень странными путями.
Катарант розовый (Catharanthus roseus) (рис. 2Ж) вполне может быть декоративным растением — он очень красиво цветет. Но катарант богат сильнодействующими алкалоидами, такими, как винбластин, и служит лекарством от онкологических заболеваний. Как и все представители семейства кутровых, он очень сильно ядовит. Вот такой многогранный кустарник. К тому же его каллусная культура способна метаболизировать 2,4,6-тринитротолуол, широко известный как «тротил» и «тол» (рис. 3 В, 3Г). Это основное взрывчатое вещество, используемое в военных целях, а также для горных работ. Тротил очень опасен в обращении, сильно ядовит и склонен к мощной детонации. Но растения постепенно обезвреживают его, восстанавливая сначала до соответствующих нитрозопроизводных, а затем аминов. Эти соединения уже менее опасны, по крайней мере, не взрываются [31].
Возможно, способность растений обезвреживать нитросоединения обусловлена ассимиляцией содержащихся в почве нитратов в качестве источника азота. Содержащийся в удобрениях нитрат растения легко восстанавливают до аммиака при помощи вырабатываемых в пластидах нитратредуктаз и нитритредуктаз, включая в свой азотный метаболизм. Нитросоединения по структуре и ряду свойств близки к неорганическим нитратам и, вероятно, восстанавливаются до аминов теми же самыми ферментами. Здесь надо отметить, что пластиды растений — тоже симбионты, потомки древних цианобактерий [32]. Значит, и в данном случае биодеградация не обходится без микроорганизмов, пускай и крайне специализированных!
Впрочем, является ли утверждение, что биодеградация невозможна без микроорганизмов, догмой? Вся история биологической науки демонстрирует, что догм она не любит. Вот и в бидеградации, похоже, не обошлось без исключений. Уже заканчивая работу над статьей, я прочитал интереснейший обзор, посвященный ферментам, обезвреживающим фосфорорганические нейротоксины [33], где почерпнул информацию о том, что некоторые виды водорослей, растущих в сточных водах, способны обезвреживать инсектициды монокротофос и хиналфос, а экстракты некоторых цветковых растений (например, ряски малой, Lemna minor, или маша, Vigna radiata) даже гидролизуют боевое отравляющее вещество зоман! В нервном ганглии представителя головоногих моллюсков обыкновенного кальмара (Loligo vulgaris) присутствуют ферменты, гидролизующие диизопропилфторфосфат (рис. 2Й). А ведь нервная система, в отличие от кишечного тракта, в норме свободна от микробов. Значит, клетки кальмара справляются с ДФФ своими силами.
Магия предсказаний
Всё рассказанное про биодеградацию — и в этой статье, и в предыдущих — демонстрирует, какое развитие получил этот метод. Без сомнения, у этого прикладного направления есть мощный теоретический базис в лице метаболомики, энзимологии, классической биохимии, теории эволюции, наконец. Статья [40], опубликованная в престижнейшем журнале Nature и посвященная ферментативному гидролизу полиэтилентерефталата до мономеров, великолепно отображает уровень современной белковой инженерии, насколько эта область продвинулась вперед. Фактически, команда исследователей синтезировала гены, кодирующие ферменты кутиназы с измененной аминокислотной последовательностью, более эффективно работающие при температурах выше 70o С!
Однако следует помнить о том, что настоящая наука начинается не с результатов (даже практически значимых), а с точных прогнозов. Если мы сумеем чисто теоретически представить новый метаболический путь, а потом наблюдать его на практике, это будет означать, что биодеградация — это уже больше, чем метод. Она станет самостоятельным научным направлением. Мы станем свидетелями перехода накопленного знания в качественно новое состояние!
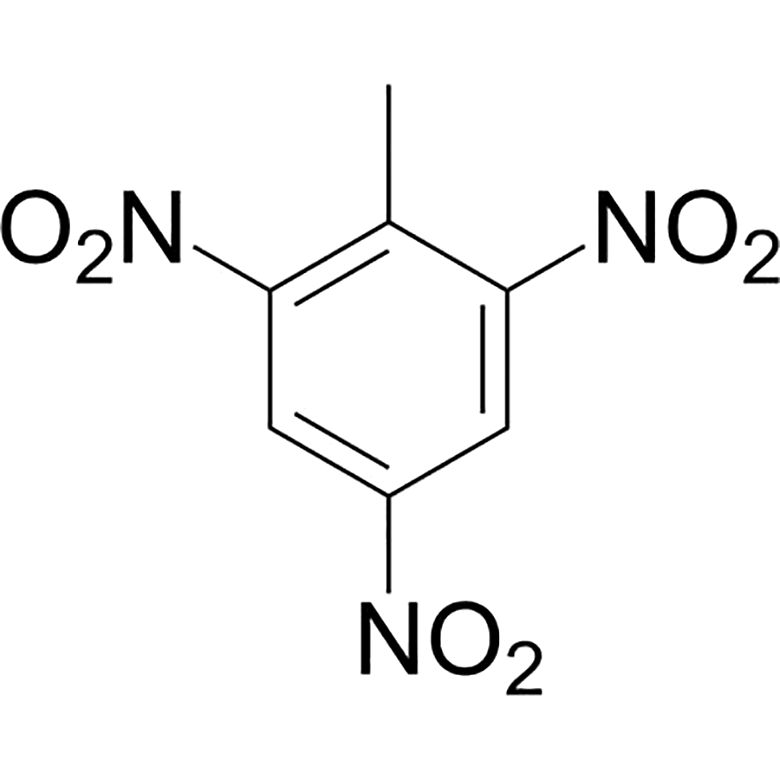
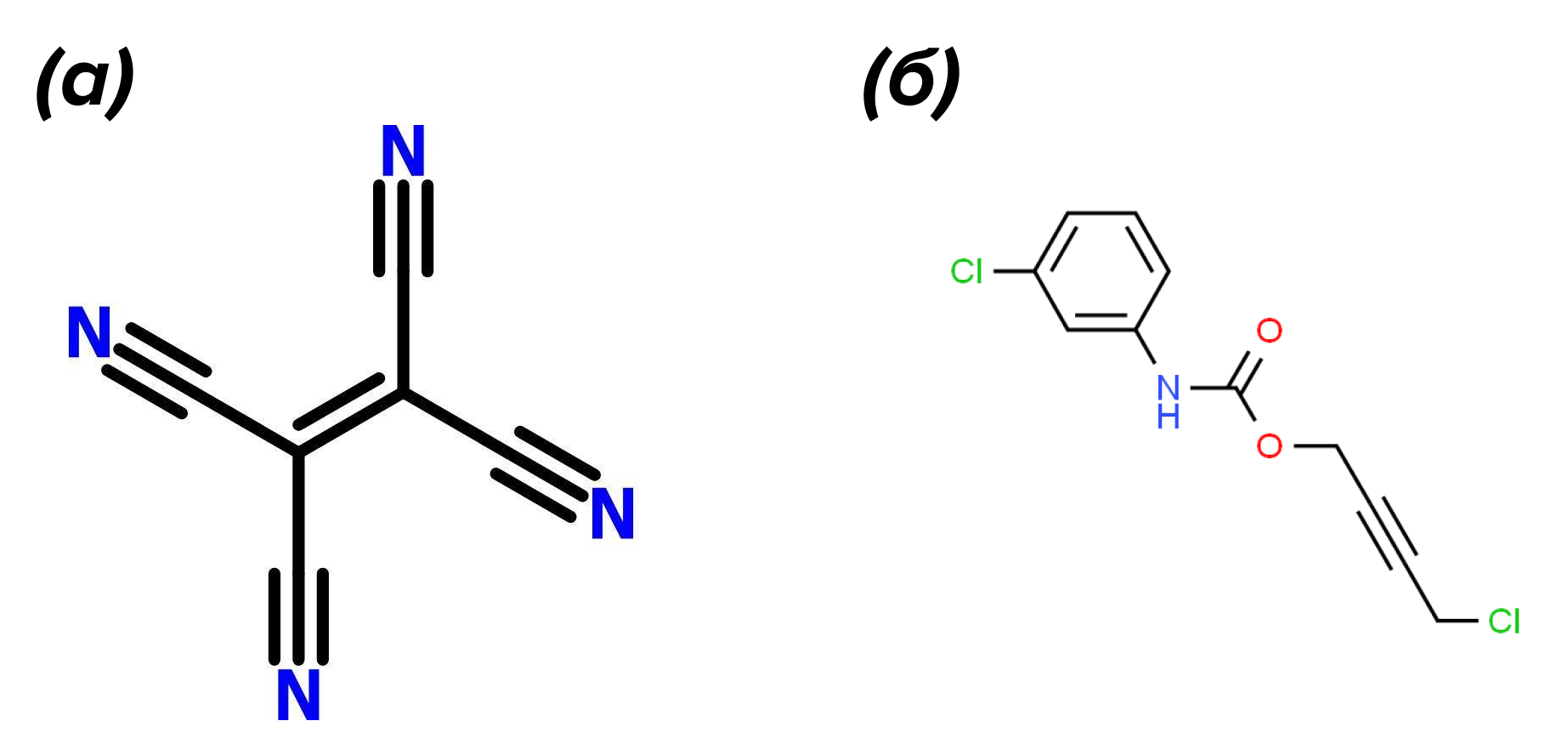
Я еще нигде не слышал определение биодеградации как новой науки. Тем не менее, прогнозирование уже ведется. По крайней мере, я встречал несколько статей, в которых описываются никогда не наблюдавшиеся метаболические пути биодеградации веществ, для которых способность служить пищей микробам еще неизвестна. Коллектив авторов, возглавляемый одним из крупнейших мировых специалистов в области биодеградации — Лоуренсом Ваккеттом из университета штата Миннесота (США) — собрал подробную информацию по метаболизму разнообразных радикалов в составе органических молекул. Затем, на основе собранных данных были написаны алгоритмы компьютерной программы Pathway prediction systems (PPS) for xenobiotic metabolism, которая вначале описывала только возможные пути детоксикации ксенобиотиков в организме млекопитающих, а затем была расширена до аэробного микробного метаболизма. Согласно публикации этого коллектива [41], уже к ставшему далеким 2004 году при помощи PPS удалось предсказать метаболические пути таких веществ, не встречающихся в природе и имеющих весьма необычные структуры, как тетрацианоэтилен, гидроксипивалевый альдегид, гербицид барбан и инсектицид перметрин (рис. 4).
Конечно, сегодня это выглядит как научная фантастика. Да и за точность предсказаний ручаться сложно. Но очевидно, что по мере усовершенствования программ, увеличения мощности суперкомпьютеров (а самое главное, роста объема данных по метаболизму и ферментам) точность подобных прогнозов будет возрастать. Поэтому то, что сейчас выглядит как научный курьез и «игры разума», завтра или послезавтра может стать мощным инструментом для обезвреживания ксенобиотиков. В самом деле, мы сможем представить путь метаболизма соединения, которое только-только начали производить крупнотоннажно. На основе этого можно методами генного проектирования создавать специализированные микроорганизмы — деструкторы данного вещества, и тем самым не допускать загрязнения.
Биодеградация в природе
Мы привыкли воспринимать биодеградацию как метод, разработанный биотехнологами для решения сравнительно узких задач. Но биодеградация как природное явление значительно шире и включает в себя, по сути, метаболизм любых веществ. Чтобы не путать биодеградацию с метаболизмом вообще, желательно ограничивать применение этого термина только усвоением сильнотоксичных веществ. Или трудноусваиваемых. Исходя из этого, к биодеградации можно отнести, например, азотфиксацию. Азотфиксация — микробиологическое связывание молекулярного атмосферного азота: явление широко известное, чрезвычайно интересное с точки зрения науки и имеющее важнейшее значение для сельского хозяйства. Но с биодеградацией его обычно не связывают. Наверное, потому, что азот не создан деятельностью человека, а является естественным и основным по содержанию компонентом атмосферы.
В предыдущей статье [6] я рассказывал про газообразный фтор F2, являющийся сильнейшим окислителем и чрезвычайно реакционноспособным газом. Говорил я и о причине экстремальной химической активности фтора: атомы в его молекулах связаны одинарной связью, которая легко рвется с образованием свободных радикалов атомарного фтора. С ростом кратности связи резко уменьшается ее длина и возрастает прочность. Поэтому молекулярный кислород О2, в молекуле которого атомы связаны двойной связью, значительно устойчивее фтора. Азот в виде простого вещества (рис. 5В) — газ N2, где атомы связаны прочнейшей тройной ковалентной связью (рис. 5А), что делает его чрезвычайно устойчивым, при комнатной температуре почти на уровне инертных газов. А поскольку азот намного доступнее и дешевле, его часто применяют для создания инертной атмосферы.
Земная атмосфера более чем на 78% состоит из этого практически инертного в нормальных условиях, бесцветного, безвкусного, негорючего и совершенно нетоксичного газа. Общее количество N2 в атмосфере оценивается в 3,87·1015 тонн. Азот вместе с инертными газами относится к группе аэрофильных элементов, накапливающихся в атмосфере. Подсчитано, что в состав соединений входит одна десятитысячная доля азота Земли, а в состав живых организмов — около одной миллиардной доли. Весь остальной азот содержится в воздухе. Явная диспропорция!
Тройная связь в молекуле азота буквально вдавливает электронные оболочки атомов друг в друга, сплющивая атомы. А прочность молекулы такова, что она распадается на атомы только при температуре выше 3000o С. При такой температуре даже железо испаряется и становится газом!
В этом месте следует вспомнить, что азот — важнейший биогенный элемент. Пресловутые доли азота, находящегося в связанном состоянии, практически целиком присутствуют в составе живых организмов, а также веществ биогенного происхождения, таких как уголь и нефть. Высочайшая химическая инертность молекулярного азота, таким образом, является одним из лимитирующих факторов, ограничивающих рост биомассы живых организмов.
Азот связывается при вспышках молний, превращаясь в оксиды азота, и далее в азотную кислоту и нитраты, доступные для растений. Дождевая вода во время грозового ливня всегда содержит крошечную примесь азотной кислоты! Однако такой атмосферной фиксации недостаточно для удовлетворения потребности биосферы в азоте. Большая часть биологического азота фиксирована микроорганизмами диазотрофами, которые целиком относятся к прокариотам. Среди азотфиксирующих микроорганизмов есть цианобактерии, некоторые археи и грамотрицательные бактерии (такие как Azotobacter). Некоторые диазотрофы вступают в симбиоз с растениями, например, бобовыми (рис. 5Г—Ё). Другие становятся симбионтами животных, например, не раз упоминавшихся в статье насекомых (рис. 5Ж). Для фиксации азота у этих микроорганизмов есть уникальные ферменты нитрогеназы [42] (рис. 5Б). Промежуточными продуктами восстановления азота при этом являются диазен и гидразин [43], [44], существующие в виде короткоживущих интермедиатов, а конечным — химически активный аммиак, доступный для микроорганизмов и растений.
Следует особо подчеркнуть, что весь процесс протекает при комнатной температуре и атмосферном давлении! Для сравнения, химический синтез аммиака из азота и водорода по методу Габера требует температур порядка 500o С и давлений до 3500 атмосфер! Понятно, что никакие другие живые организмы кроме человека (которого, таким образом, тоже можно отнести к азотфиксаторам, хотя эта способность возникла у нас независимо и основана на интеллекте и трудовой деятельности, способности к созданию сложных технологий) не могут создавать такие условия. Понятно и то, что природные технологии пока еще намного опережают созданные людьми. Разумеется, фиксация азота — чрезвычайно энергоемкий процесс. На один моль связываемого нитрогеназой N2 расходуется 12 моль АТФ, а на связывание 1 мг молекулярного азота — около 500 мг сахарозы! Но даже с такими издержками дело того стоит, если учесть, что без соединений азота жизнь невозможна.
Между прочим, нитрогеназы обладают широкой субстратной специфичностью и могут восстанавливать не только азот, но и значительное количество как органических, так и неорганических веществ, молекулы которых содержат кратные связи. Особенно эффективно нитрогеназы гидрируют ацетилены и нитрилы, содержащие тройные связи, аналогичные связи в молекуле N≡N [45]. Поэтому нитрогеназы имеют большие перспективы в биотехнологии.
Итак, фиксацию атмосферного азота умозрительно можно рассматривать как пример биодеградации. Действительно, микроорганизмы ассимилируют чрезвычайно труднодоступное вещество, превращая его в биодоступную форму и используя для этого изощренные ферментные системы, а зачастую не менее изощренные морфологические признаки (достаточно вспомнить аэробные цианобактерии, у которых нитрогеназа, чрезвычайно чувствительная к кислороду, спрятана в особых клетках — гетероцистах, не способных к фотосинтезу и выработке О2). Многие азотфиксаторы — узкоспециализированные организмы, способные только усваивать азот. Сходство с биодеструкторами налицо!
А вот другой пример, который еще ближе к классической биодеградации. Интересную и необычную экологическую нишу занимают организмы эндолиты, живущие в толще камней и формирующие в них тоннели. Их разнообразие велико и полностью еще не охарактеризовано. Среди эндолитов (это слово в переводе с древнегреческого буквально означает «живущие внутри камня») встречаются бактерии и археи, амебы, грибы, лишайники и даже губки.
Эти микроорганизмы выработали ряд адаптаций, позволяющих им обитать в экстремальных условиях (в частности, при острой нехватке питательных веществ и влаги). Главная из них — экстремально низкая скорость обмена веществ, при которой, фактически, стирается грань между жизнью и смертью. Действительно, некоторые бактерии-эндолиты, обитающие в толще горных пород, могут делиться один раз в несколько тысяч лет! Эти свойства эндолитов делают их рекордсменами, демонстрирующими возможности живой природы. А еще они интересуют астробиологов, потому что аналогичные им формы жизни могут обитать на других планетах с суровыми климатическими условиями — например, на Марсе.
Но самое удивительное свойство эндолитов, которое, собственно, и дало им это название, — способность сверлить тоннели в горных породах. То есть, эндолиты сами себе создают среду обитания, практически изолированную от внешнего мира. В предыдущей статье я рассказывал про биокоррозию металлов и бетонных конструкций Аналогичные процессы протекают и в природе, без вмешательства человека. Многочисленные силикатные бактерии при помощи выделяемых ими кислот проделывают сеть тоннелей даже в драгоценном камне гранате (алюмосиликат магния — железа), отличающемся высочайшей твердостью (тверже только алмаз и сапфир!), стойкостью к растворению и химической инертностью (рис. 6) [47].
Конечно, деятельность эндолитов неразрывно связана с абиотическими процессами выветривания горных пород. Им трудно заселить гладкую поверхность камня: первоначальные углубления на поверхности, которые заселяют эндолиты, образуются под воздействием перепадов температур и влаги. То есть разрушение горных пород в природе происходит под действием целого комплекса факторов, неотъемлемой частью которого является биологический фактор.
Почему биодеградация возможна?
В предыдущих статьях неоднократно звучал ответ на данный вопрос. Конечно, главная причина, почему биодеградация возможна — это громадное и далеко не описанное разнообразие природных веществ и путей, ведущих к их биосинтезу. Поэтому у большинства созданных человеком соединений есть природные аналоги. Или даже сами ксенобиотики неожиданно обнаруживаются в живой природе. Если живые организмы являются продуцентами многообразных (в том числе очень необычных) веществ, значит, они способны быть и их редуцентами, используя для этой цели одни и те же ферментные системы.
Тем не менее, не могу устоять перед соблазном привести еще несколько поразительных примеров природных соединений, доказывающих, что метаболизм живых организмов способен решать любые задачи.
Интересуясь фосфором и его соединениями, я встретил замечательный по полноте обзор [48], посвященный природным фосфорорганическим веществам, восстановленным соединениям фосфора, а также фосфорамидам, тиофосфатам и тиофосфорамидам. Разнообразие таких соединений достаточно велико — это при том, что в обзоре не фигурируют эфиры фосфорной и пирофосфорной кислоты, которых в живой природе еще значительно больше. На примере экзотических фосфорных соединений наглядно представлено богатство природной химии в целом. Например, чего стоят такие метаболиты, как фосфористая кислота и фосфин из фекалий термитов, птиц и млекопитающих. Для химиков эти вещества совершенно заурядны, они присутствуют даже в школьных учебниках химии. Но для живой природы они крайне необычны, потому что фосфат является чрезвычайно слабым окислителем; его восстановление происходит в достаточно жестких условиях. Тем более до фосфина, в котором фосфор имеет самую низкую степень окисления, −3. Соответственно, соединения фосфора с низкими степенями окисления представляют собой сильные восстановители. Фосфин и его производные — настолько сильные, что могут самовозгораться на воздухе!
Другими неотъемлемыми свойствами фосфинов являются высокая токсичность (у некоторых замещенных фосфинов она сравнима с токсичностью фосгена) и очень резкий запах. Даже следовые концентрации фосфина в воздухе легко обнаруживаются по запаху, похожему на запах чеснока. Токсичность фосфинов обусловлена тем, что, как другие известнейшие яды — угарный газ, цианид, роданид, изонитрилы, азид, сероводород — они являются мягкими основаниями Льюиса и мгновенно образуют прочные комплексы с мягкими льюисовыми кислотами — ионами переходных металлов (например, с двухвалентной медью). Соответственно, необратимо ингибируют ряд ферментов, в том числе в дыхательной цепи. Простейший, незамещенный фосфин РН3 давно применяется как фумигант и средство для борьбы с грызунами. Ряд комплексов фосфинов с благородными металлами, такими как золото и иридий, применяется в качестве катализаторов и даже лекарственных препаратов.
Свойства фосфинов объясняют причину, почему они присутствуют именно в фекалиях. В статье [2] я рассказывал, что в архейскую эру в атмосфере Земли отсутствовал молекулярный кислород и она носила восстановительный характер, а не окислительный, как сегодня. Однако на земном шаре до сих пор остались места с анаэробными условиями, как на первобытной Земле. К ним относятся и кишечные тракты животных, населенные анаэробной микробиотой. Конечно, в кишечнике условия максимально подходят для восстановления фосфора. Вероятно, микроорганизмы тоже играют роль в этом процессе, хотя он очень мало изучен.
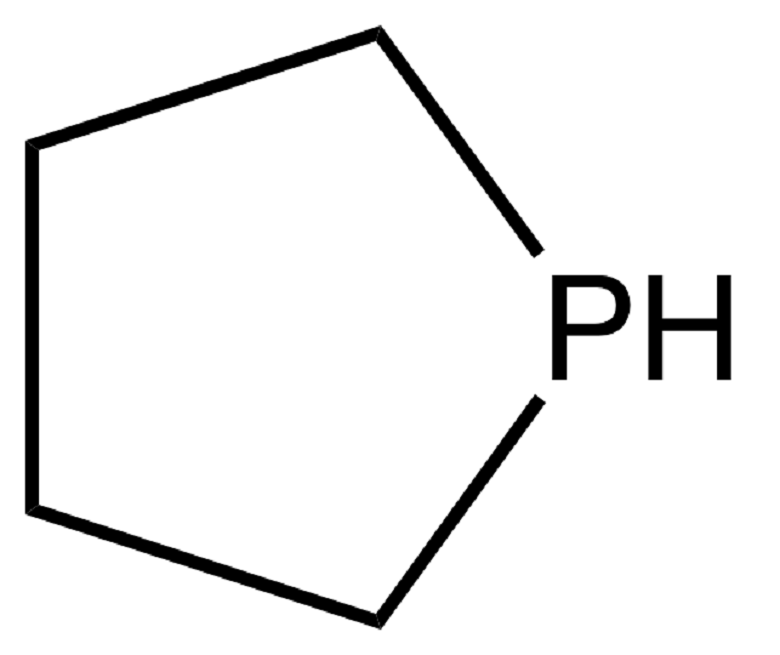
В помете обитателя наших среднерусских лесов европейского барсука (Meles meles) найден фосфин более сложного строения — фосфолан, представляющий собой фосфористый аналог пирролидина (рис. 7А, 7Б). Пожалуй, это первый и на сегодняшний день единственный природный фосфористый гетероцикл. И свидетельство того, что удивительное встречается не только в дальних странах. Образуется ли фосфолан в кишечнике барсуков в результате чисто химических процессов или его продуцирует кишечная микрофлора — неизвестно. Также сейчас нельзя сказать, является ли он побочным продуктом жизнедеятельности или выполняет в организме животного какую-то функцию. Например, резкий запах фосфолана может использоваться при нанесении меток — эффективного способа коммуникации у хищных млекопитающих. Но это — домыслы. Повторяю, восстановление фосфора в организме животных практически не изучено, это одно из белых пятен науки двадцать первого века.
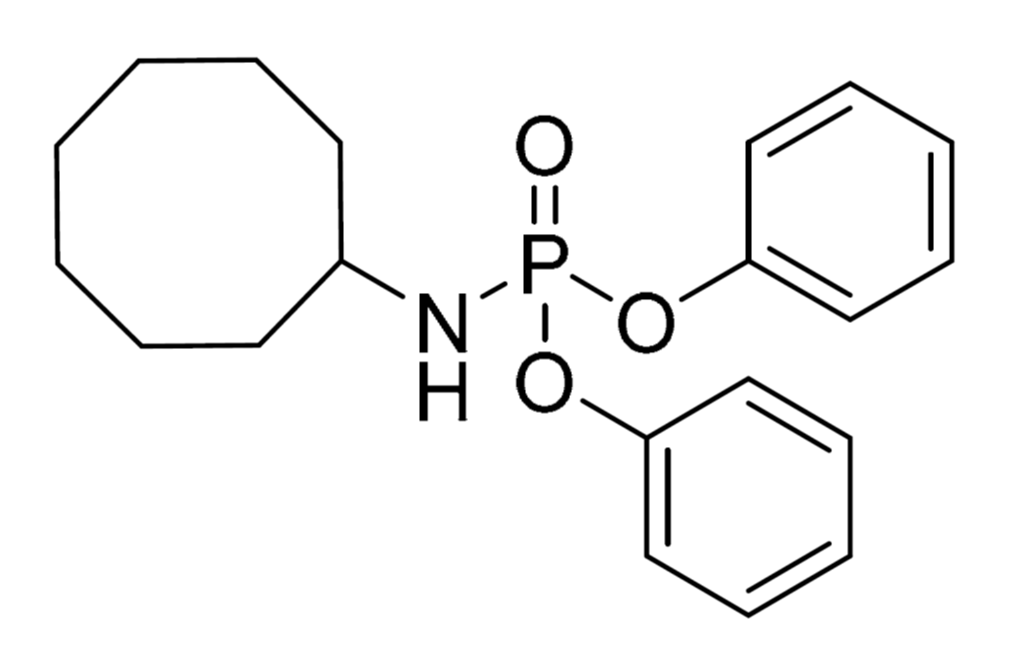
Другое очень необычное природное вещество, представленное в этом обзоре, — О,О’-дифенил-N-циклооктилфосфамат: токсин динофлагелляты Karenia brevis (рис.7В). Про динофлагеллят я неоднократно рассказывал ранее (в статьях [3], [5]). Всё дело в том, что эти одноклеточные водоросли в процессе эволюции стали специализированными продуцентами изощренных токсинов, самых ядовитых в природе и имеющих редкостное для биологических молекул химическое строение. Вот и представленный фосфамат — тоже токсин, и строение его тоже ни с чем не спутать. Чего стоит фрагмент циклооктиламина, да и фенильные группы имеют бросающееся в глаза сходство с фенолом — промышленным продуктом. Фенол однозначно образуется при гидролизе данного вещества. А молекула в целом очень похожа на созданный человеком пластификатор трифенилфосфат (рис. 7Д), который добавляют в полимеры для придания им пластичности, снижения хрупкости. Тоже токсичный для окружающей среды и человека, кстати.
На многие молекулы достаточно взглянуть, чтобы представить, из каких предшественников ведется их биосинтез и какими путями. А молекулы, подобные этой, — загадки. Их биосинтез следует изучать, вот только на практике сделать это не всегда просто. Динофлагелляты слишком мало подходят на роль модельных организмов. Хотя нет сомнений в том, что этот загадочный токсин синтезируется из самых обычных первичных метаболитов — природа слишком скупа на нововведения, чтобы было иначе.
Но на страницах предыдущих моих статей постоянно фигурируют не только динофлагелляты. Есть другая группа микроорганизмов, отличающаяся высочайшим химическим разнообразием. Это стрептомицеты — бактерии, внешне похожие на грибы. В отличие от динофлагеллят (специализированных морских водорослей), стрептомицеты — настоящие космополиты и обитают на всем земном шаре — от высокогорий до океанских глубин. Практически каждый известный штамм богатого видами рода Streptomyces является продуцентом характерных именно для него антибиотиков. Стрептомицеты изучают давно; эти микроорганизмы и продуцируемые ими вещества в целом хорошо исследованы. Однако повсеместное распространение рода привело к тому, что еще не все виды открыты, а открытых, но неисследованных — еще больше.
Группа исследователей, работавшая на принадлежащей Болгарии полярной научно-исследовательской станции, расположенной на острове Ливингстон (архипелаг Южные Шетландские острова в Антарктике; рис. 8А), обнаружила несколько видов местных микроорганизмов и исследовала, в частности, их химический состав. Бесспорно, эти микроорганизмы уникальны, поскольку формировались в условиях островной изоляции в тысячах километров от поселений человека, к тому же приспособлены к достаточно суровым условиям обитания.
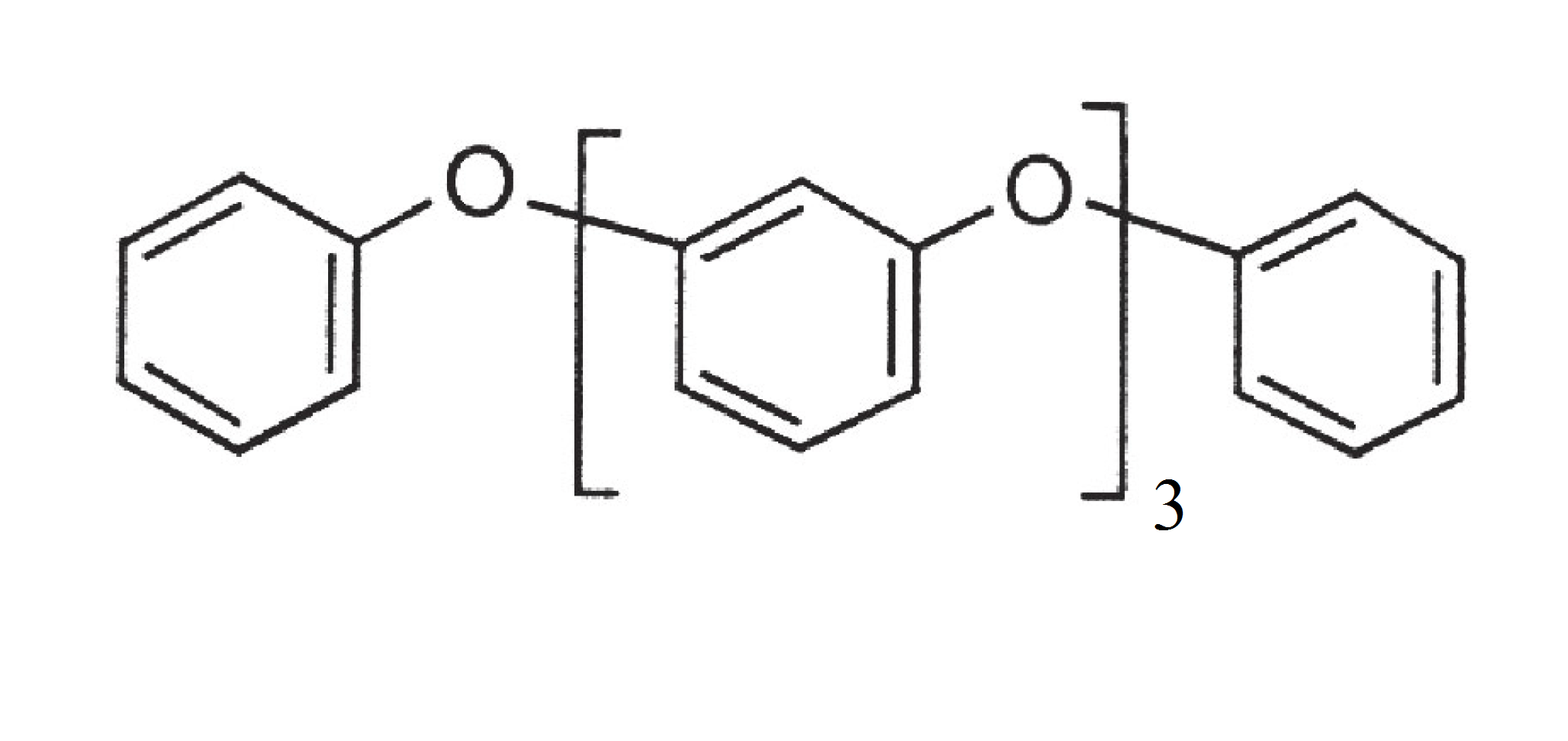
Но одним из самых поразительных в биохимическом плане микроорганизмов оказался стрептомицет Streptomyces sp. 1010 (рис. 8Б). Определение sp. означает, что видовая принадлежность этого микроба еще неизвестна. Для микроорганизмов это обычное явление, что весьма затрудняет их классификацию. В статье [49] представлены некоторые необычные метаболиты, вырабатываемые этим штаммом. Более других бросается в глаза фениленовый эфир 1,3-бис(3-феноксифенокси)бензол (рис. 8В). Про это соединение в очередной раз можно сказать, что для химиков-органиков оно совершенно заурядное. По крайней мере, сложностью структуры точно не выделяется. Но с позиций химии природных соединений — уникальное! По крайней мере, аналоги ему найти сложно. И, как в случае с фосфаматом из динофлагелляты, нелегко представить путь его биосинтеза.
Полифениленовые эфиры давно синтезированы в лабораториях и неплохо исследованы. Это вязкие жидкости или низкоплавкие твердые вещества. В жидком виде обладают очень высокой прочностью пленки поверхностного натяжения. Их применяют в качестве смазочных материалов в экстремальных условиях, например, в космических аппаратах. А какую роль они выполняют в антарктическом стрептомицете? Это неизвестно, и есть сильное опасение, что не будет известно никогда. Увы, перед наукой стоит множество неотложных задач, которые следует решать в первую очередь. И в них не входит изучение жизни невзрачного микроорганизма, населяющего скалы безлюдного острова на краю земли.
Хотел было поставить точку в этом повествовании, но, по обыкновению, заглянул на страничку «Элементы.ру». Каждое утро читаю на ней свежие научные новости. И вот, прочитал, что метаногенные бактерии способны обитать в угольных пластах и превращают уголь в метан.
Меня, между прочим, давно интересовал вопрос, могут ли живые организмы продуцировать углерод в виде простого вещества. В самом деле, наша планета населена углеродными формами жизни, хотя органические вещества, из которых состоят живые организмы — сложные. Про формирование элементного углерода в результате жизнедеятельности я нигде не находил информацию. И это при том, что элементный углерод на земном шаре есть, и большая его часть представлена углем — о нем я уже рассказывал в статье [2]. Древесный или костный уголь образуется из органического вещества в результате пиролиза (например, при неполном сгорании).
До сих пор считалось доказанным и не вызывало сомнений, что процесс карбонификации (превращения лигнина растений в торф и далее в бурый и каменный уголь) также является чисто физико-химическим, включая пиролиз в раскаленных земных недрах. Однако в самое последнее время доказано участие в нем метаногенных архей. Археи, фактически, кормятся углем — единственным доступным для них органическим веществом. При этом продуцируют биогаз — смесь метана и углекислого газа (рис. 9Е, 9Ё). Вместе с этими газами и образующейся в результате метаболизма водой из угля улетучиваются водород и кислород — основные, помимо углерода, компоненты исходного лигнина. Азот, серу и металлы исходного органического вещества археи тоже благополучно используют. В результате этой своеобразной биодеградации в угле постепенно нарастает концентрация углерода, которая в самых лучших сортах угля антрацита может достигать 98%, а в угле шунгите, добываемом в Карелии, даже 99,6% (рис. 9Д)! Такой уголь по составу, строению и свойствам вплотную приближается к аллотропной модификации элементного углерода графиту (рис. 9А). Это ведет к росту качества угольных месторождений [50], [51]. Авторы публикации [51] установили, что изотопный состав углерода в составе метана, накапливающегося в угольных пластах, очень сходен с составом углерода из метоксильных групп растительного лигнина. На основании этого авторы выдвинули гипотезу, согласно которой в процессе карбонификации углерод ароматических циклов лигнина входит в состав угля, а углерод метоксильных групп — в состав метана (того самого, который, увы, становится причиной взрывов в угольных шахтах и даже гибели шахтеров) в результате жизнедеятельности термофильных метилотрофных метаногенных архей. Если представленные в указанных публикациях выкладки действительно достоверны, значит, торф, каменный уголь и даже элементный углерод (рис. 9Б—Д) можно признавать продуктами метаболизма — своеобразными отходами жизнедеятельности термофильной и строго анаэробной микробиоты!
Итак, в самом конце настало время вернуться к сказанному в начале: эта статья планировалась как заключительная. Будет ли она действительно последней в серии? Вероятно, да. Потому что даже неисчерпаемая тема со временем исчерпывается. Или же... Сказать по правде, когда шесть с лишним лет назад я опубликовал статью «Биодеградация белого фосфора: как яд стал удобрением» [1], впоследствии завоевавшую призовое место на конкурсе «Био/мол/текст» и большую симпатию читателей (для автора главный приз именно это!), то не думал, что она станет началом серии из семи статей. Сам удивляюсь, но после выхода этой статьи каждый год испытывал вдохновение и знал, о чем писать. Когда всерьез увлекаешься научной темой, интересные примеры попадаются постоянно. А редакторы «Биомолекулы», жюри «Био/мол/текста» и широкий круг читателей не перестают вдохновлять меня писать продолжение. И, кто знает, может быть, через год родятся идеи для новой статьи? Ведь тема действительно бесконечно многообразная! Не буду загадывать наперед.
Одно могу сказать точно: буду очень рад и посчитаю миссию выполненной, если читатели (в первую очередь, юные) не только почерпнут из моих статей знания о биодеградации и природе в целом, но в процессе чтения сами загорятся той же страстью к науке, которую испытываю я на протяжении всей жизни.
Литература
- Биодеградация белого фосфора: как яд стал удобрением;
- Биодеградация ксенобиотиков как самозащита природы;
- Являются ли ксенобиотики ксенобиотиками? Одна из сторон разнообразия природных соединений;
- Раздумья о природной и неприродной химии;
- Биодеградация: что в ней удивительного?;
- От биодеградации к сюрпризам биохимии;
- Физическая водобоязнь;
- D JENDROSSEK, G TOMASI, R KROPPENSTEDT. (1997). Bacterial degradation of natural rubber: a privilege of actinomycetes?. FEMS Microbiology Letters. 150, 179-188;
- Tom Berben, Lex Overmars, Dimitry Y. Sorokin, Gerard Muyzer. (2017). Comparative Genome Analysis of Three Thiocyanate Oxidizing Thioalkalivibrio Species Isolated from Soda Lakes. Front. Microbiol.. 8;
- Jeferson Gross, Debashish Bhattacharya. (2011). Endosymbiont or host: who drove mitochondrial and plastid evolution?. Biology Direct. 6, 12;
- Ястребов С.А. От атомов к древу. Введение в современную науку о жизни. М.: Альпина нон-фикшн, 2018. — 704 с.;
- Внимание! Разыскивается предок митохондрий!;
- AR Castillo-González, ME Burrola-Barraza, J Domínguez-Viveros, A Chávez-Martínez. (2014). Rumen microorganisms and fermentation. Arch. med. vet.. 46, 349-361;
- König H., Fröhlich J., Li L., Wenzel M., Berchtold M., Dröge S., Breunig A., Pfeiffer P., Radek R., Brugerolle G. (2007). The flagellates of the Australian termite Mastotermes darwiniensis: Identification of their symbiotic bacteria and cellulases. Symbiosis. 44, 51–65;
- T. R. Schultz, S. G. Brady. (2008). Major evolutionary transitions in ant agriculture. Proceedings of the National Academy of Sciences. 105, 5435-5440;
- Paolo Bombelli, Christopher J. Howe, Federica Bertocchini. (2017). Polyethylene bio-degradation by caterpillars of the wax moth Galleria mellonella. Current Biology. 27, R292-R293;
- M. Alma Solis. (1999). Insect Biodiversity: Perspectives from the Systematist. American Entomologist. 45, 204-205;
- Shan-Shan Yang, Anja Malawi Brandon, James Christopher Andrew Flanagan, Jun Yang, Daliang Ning, et. al.. (2018). Biodegradation of polystyrene wastes in yellow mealworms (larvae of Tenebrio molitor Linnaeus): Factors affecting biodegradation rates and the ability of polystyrene-fed larvae to complete their life cycle. Chemosphere. 191, 979-989;
- Paramasivam Murugan, Lizhu Han, Chee-Yuen Gan, Frans H.J. Maurer, Kumar Sudesh. (2016). A new biological recovery approach for PHA using mealworm, Tenebrio molitor. Journal of Biotechnology. 239, 98-105;
- Jiaojie Li, Hong Rae Kim, Hyun Min Lee, Hee Cheol Yu, Eunbeen Jeon, et. al.. (2020). Rapid biodegradation of polyphenylene sulfide plastic beads by Pseudomonas sp.. Science of The Total Environment. 720, 137616;
- Dana R. Kadavy, Bradley Plantz, Christopher A. Shaw, Jill Myatt, Tyler A. Kokjohn, Kenneth W. Nickerson. (1999). Microbiology of the Oil Fly, Helaeomyia petrolei. Appl Environ Microbiol. 65, 1477-1482;
- Veer V., Chauhan R.S., Rao K.M. (1999). Studies of larval feedings of some new insect pests on wool-synthetic blend fabrics. Indian Journal of Fibre and Textile Research. 24, 139–141;
- Veer V., Prasad R., Rao K.M. (1989). Studies of feeding wool-synthetic blend fabrics by larvae of insect pests. Indian Journal of Fibre and Textile Research. 14, 169–171;
- Роль слабых взаимодействий в биополимерах;
- Esperanza Huerta Lwanga, Binita Thapa, Xiaomei Yang, Henny Gertsen, Tamás Salánki, et. al.. (2018). Decay of low-density polyethylene by bacteria extracted from earthworm's guts: A potential for soil restoration. Science of The Total Environment. 624, 753-757;
- Титов И.Н., Богуспаев К.К. Вермикультура: научные основы, достижения и перспективы. Алматы: НИИ проблем экологии, Казахский национальный университет им. Аль‐Фараби МОН РК. ТОО КХ Agromercur, 2019. — 366 с.;
- H.A. Jenner, S. Rajagopal, G. Van der Velde, M.S. Daud. (2003). Perforation of ABS pipes by boring bivalve Martesia striata: a case study. International Biodeterioration & Biodegradation. 52, 229-232;
- Сергеев Б.Ф. Жизнь лесных дебрей. М.: Мол. Гвардия, 1988. — 255 с.;
- Juan Pablo Giraldo, Markita P. Landry, Sean M. Faltermeier, Thomas P. McNicholas, Nicole M. Iverson, et. al.. (2014). Plant nanobionics approach to augment photosynthesis and biochemical sensing. Nature Mater. 13, 400-408;
- Min Hao Wong, Juan P. Giraldo, Seon-Yeong Kwak, Volodymyr B. Koman, Rosalie Sinclair, et. al.. (2017). Nitroaromatic detection and infrared communication from wild-type plants using plant nanobionics. Nature Mater. 16, 264-272;
- Zita Snellinx, Ales Nepovím, Safieh Taghavi, Jaco Vangronsveld, Tomás Vanek, Daniël van der Lelie. (2002). Biological remediation of explosives and related nitroaromatic compounds. Environ. Sci. & Pollut. Res. 9, 48-61;
- Patrick J. Keeling. (2010). The endosymbiotic origin, diversification and fate of plastids. Phil. Trans. R. Soc. B. 365, 729-748;
- Ефременко Е.Н., Варфоломеев С.Д. (2004). Ферменты деструкции фосфорорганических нейротоксинов. Успехи биологической химии. 44, 307–340;
- Andrew H. Moeller, Jon G. Sanders. (2020). Roles of the gut microbiota in the adaptive evolution of mammalian species. Phil. Trans. R. Soc. B. 375, 20190597;
- Andreas Brune. (1998). Termite guts: the world's smallest bioreactors. Trends in Biotechnology. 16, 16-21;
- Зиганшина Э.Э., Мохаммед В.Ш., Шулаев Н.В., Беспятых А.В., Зиганшин А.М. (2017). Особенности бактериального сообщества кишечника личинок жуков-ксилофагов (Cerambycidae). Вестник технологического университета. 20, 120 – 124;
- Michał Kolasa, Radosław Ścibior, Miłosz A. Mazur, Daniel Kubisz, Katarzyna Dudek, Łukasz Kajtoch. (2019). How Hosts Taxonomy, Trophy, and Endosymbionts Shape Microbiome Diversity in Beetles. Microb Ecol. 78, 995-1013;
- Atsushi Nakabachi, Atsushi Yamashita, Hidehiro Toh, Hajime Ishikawa, Helen E. Dunbar, et. al.. (2006). The 160-Kilobase Genome of the Bacterial Endosymbiont Carsonella. Science. 314, 267-267;
- Jörg Overmann Molecular Basis of Symbiosis — Springer-Verlag, 2006;
- V. Tournier, C. M. Topham, A. Gilles, B. David, C. Folgoas, et. al.. (2020). An engineered PET depolymerase to break down and recycle plastic bottles. Nature. 580, 216-219;
- Bo Kyeng Hou, Lynda B. M. Ellis, Lawrence P. Wackett. (2004). Encoding microbial metabolic logic: predicting biodegradation. J IND MICROBIOL BIOTECHNOL. 31, 261-272;
- Brian M. Hoffman, Dmitriy Lukoyanov, Dennis R. Dean, Lance C. Seefeldt. (2013). Nitrogenase: A Draft Mechanism. Acc. Chem. Res.. 46, 587-595;
- Brett M. Barney, Hong-In Lee, Patricia C. Dos Santos, Brian M. Hoffman, Dennis R. Dean, Lance C. Seefeldt. (2006). Breaking the N2 triple bond: insights into the nitrogenase mechanism. Dalton Trans.. 2277;
- Brett M. Barney, Jammi McClead, Dmitriy Lukoyanov, Mikhail Laryukhin, Tran-Chin Yang, et. al.. (2007). Diazene (HNNH) Is a Substrate for Nitrogenase: Insights into the Pathway of N2 Reduction. Biochemistry. 46, 6784-6794;
- Lance C. Seefeldt, Zhi-Yong Yang, Simon Duval, Dennis R. Dean. (2013). Nitrogenase reduction of carbon-containing compounds. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1827, 1102-1111;
- Stefanie Kautz, Benjamin E. R. Rubin, Jacob A. Russell, Corrie S. Moreau. (2013). Surveying the Microbiome of Ants: Comparing 454 Pyrosequencing with Traditional Methods To Uncover Bacterial Diversity. Appl Environ Microbiol. 79, 525-534;
- Magnus Ivarsson, Henrik Skogby, Bongkot Phichaikamjornwut, Stefan Bengtson, Sandra Siljeström, et. al.. (2018). Intricate tunnels in garnets from soils and river sediments in Thailand – Possible endolithic microborings. PLoS ONE. 13, e0200351;
- Janusz Petkowski, William Bains, Sara Seager. (2019). Natural Products Containing ‘Rare’ Organophosphorus Functional Groups. Molecules. 24, 866;
- Anna Bratchkova, Veneta Ivanova. (2011). Bioactive Metabolites Produced by Microorganisms Collected in Antarctica and the Arctic. Biotechnology & Biotechnological Equipment. 25, 1-7;
- Daisuke Mayumi, Hanako Mochimaru, Hideyuki Tamaki, Kyosuke Yamamoto, Hideyoshi Yoshioka, et. al.. (2016). Methane production from coal by a single methanogen. Science. 354, 222-225;
- M. K. Lloyd, E. Trembath-Reichert, K. S. Dawson, S. J. Feakins, M. Mastalerz, et. al.. (2021). Methoxyl stable isotopic constraints on the origins and limits of coal-bed methane. Science. 374, 894-897;
- Krishnan Balasubramanian. (2020). Combinatorics of Supergiant Fullerenes: Enumeration of Polysubstituted Isomers, Chirality, Nuclear Magnetic Resonance, Electron Spin Resonance Patterns, and Vibrational Modes from C70 to C150000. J. Phys. Chem. A. 124, 10359-10383;
- Inka Vanwonterghem, Paul N. Evans, Donovan H. Parks, Paul D. Jensen, Ben J. Woodcroft, et. al.. (2016). Methylotrophic methanogenesis discovered in the archaeal phylum Verstraetearchaeota. Nat Microbiol. 1.