Молекулярный насос жизни: как Na+/K+-АТФаза управляет клеткой
12 января 2026
Молекулярный насос жизни: как Na+/K+-АТФаза управляет клеткой
- 507
- 0
- 6
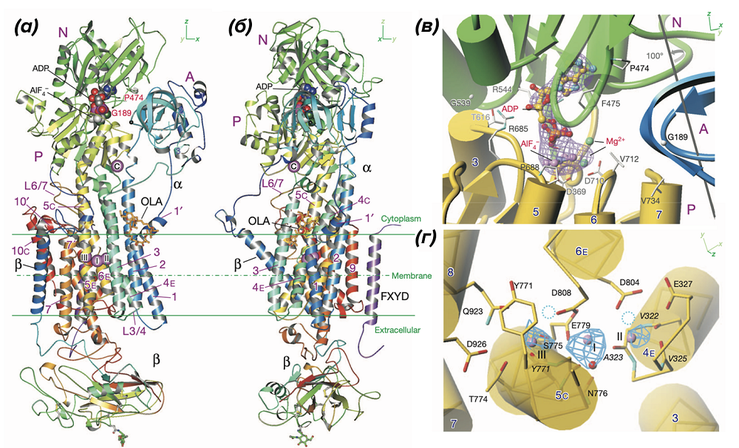
Кристаллическая структура Na+/K+-АТФазы в состоянии E1P·ADP·3Na+. (а), (б) — общая структура; (в) — сайт связывания нуклеотида и фосфорилирования; (г) — трансмембранные сайты связывания Na+.
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Na+/K+-АТФаза — это молекулярная машина, которая работает в мембране каждой клетки нашего организма, не останавливаясь ни на секунду. Она перекачивает ионы натрия и калия против их градиента концентрации, создавая электрический потенциал на мембране и обеспечивая множество важнейших процессов — от проведения нервных импульсов до сокращения сердца. За открытие этого фермента в 1997 году была присуждена Нобелевская премия, но и сегодня исследователи продолжают находить у него новые, порой совершенно неожиданные функции.
Конкурс «Био/Мол/Текст»-2025/2026
Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2025/2026.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Пролог: Нобелевское открытие из пробирки
Представьте себе Копенгаген, 1950-е годы. Молодой датский физиолог Йенс Кристиан Скоу изучает действие местных анестетиков на препаратах нервных волокон краба. Он заметил, что эти вещества блокируют какой-то фермент, расщепляющий АТФ — главную энергетическую валюту клетки. Но что это за фермент и зачем он нужен нервной ткани?
Скоу предположил, что этот фермент как-то связан с транспортом ионов через мембрану. В те годы уже было известно, что внутри клеток много калия и мало натрия, а вне клеток — наоборот. Также было понятно, что этот перекос не случаен и требует затрат энергии для своего поддержания. Но как именно работает этот процесс, оставалось загадкой.
Эксперименты Скоу показали: да, действительно существует фермент, который активируется ионами натрия и калия и расщепляет АТФ. Более того, он находится в мембране и способен переносить эти ионы против градиента концентрации [1]. Так была открыта Na+/K+-АТФаза — фермент, который мы теперь называем натрий-калиевым насосом. За это открытие в 1997 году Скоу получил Нобелевскую премию по химии, разделив ее с другими первопроходцами в изучении АТФаз.
Сегодня, спустя более 60 лет после первых экспериментов Скоу, мы знаем о Na+/K+-АТФазе невероятно много. Мы видели ее атомную структуру, разобрались в механизме работы, поняли, как она регулируется. Но самое удивительное — мы продолжаем открывать у этого «старого знакомого» совершенно новые функции.
В рамках научной работы мы изучаем Na+/K+-АТФазу в клетках головного мозга: определяем активность фермента в грубой микросомально-митохондриальной фракции КБП, исследуем влияние различных модуляторов и мембранотропных веществ на его работу [2], [3]. Это позволяет изучать молекулярный насос жизни не только в теории, но и на практике. Наша исследовательская работа проходит под научным руководством доц. кафедры физиологии и анатомии Дубровского В.Н. и д.б.н, профессора Шалабодова А.Д. Школы естественных наук Тюменского государственного университета.
Глава 1. Энергетический вампир клетки
Начнем с поразительного факта: Na+/K+-АТФаза потребляет колоссальное количество энергии. В среднем на ее работу уходит около 30% всей АТФ, производимого клеткой в состоянии покоя [4]. А в некоторых тканях эта цифра еще выше. Например, в нейронах головного мозга натрий-калиевый насос может съедать до 70% клеточной энергии [5], [6]! Фактически, это самый энергозатратный процесс в большинстве клеток.
Почему эволюция позволила ферменту быть таким расточительным? Ответ прост: он того стоит. Na+/K+-АТФаза создает и поддерживает фундаментальную асимметрию в распределении ионов, которая лежит в основе множества жизненно важных процессов, как показано на рисунке 1 [7].
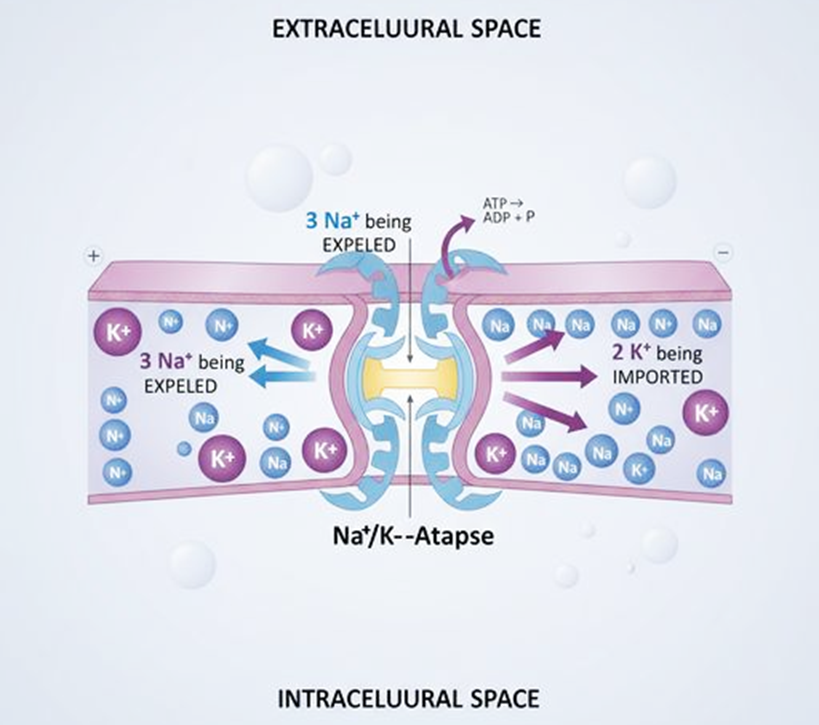
Рисунок 1. Ионная асимметрия клетки. Внутри клетки высокая концентрация K+ и низкая Na+, снаружи — наоборот. Na+/K+-АТФаза постоянно работает против градиентов, выкачивая три иона натрия и закачивая два иона калия за один цикл, что требует затраты одной молекулы АТФ. Такая асимметрия критически важна для поддержания мембранного потенциала, регуляции объема клетки и работы множества транспортных систем. У грибов и растений на плазматической мембране располагается H+-АТФаза, которая экспортирует один H+ на каждый гидролизованный АТФ; при этом противоион в обратном направлении не транспортируется. Таким образом, насосная реакция вызывает отток из клетки чистого положительного заряда, переносимого H+.
адаптировано из [13]
Вспомните школьный курс биологии: внутри клетки концентрация калия примерно в 30 раз выше, чем снаружи, а натрия — наоборот, в 10–15 раз ниже. Эта разница не возникает сама по себе [8]. Ионы постоянно стремятся выровнять свою концентрацию, проникая через мембрану по ионным каналам. И если бы не натрий-калиевый насос, который постоянно откачивает натрий обратно и закачивает калий внутрь, клетка быстро потеряла бы свои градиенты.
Что произойдет, если остановить насос? Эксперимент легко поставить с помощью уабаина — специфического ингибитора Na+/K+-АТФазы (кстати, это вещество из группы сердечных гликозидов, которые содержатся в наперстянке [9] и используются в медицине). Клетка начнет набухать, ее мембранный потенциал упадет, нейрон перестанет проводить импульсы, мышца не сможет сокращаться [10]. В конце концов клетка погибнет от осмотического отека.
Глава 2. Устройство молекулярной машины
Чтобы понять, как работает натрий-калиевый насос, нужно сначала разобраться, как он устроен. Долгое время это была настоящая головоломка для ученых. Белок находится в мембране, окружен липидами, его сложно выделить и очистить, не разрушив структуру. Но в 2007 году случился прорыв — команда Мортена Мадсена из Дании получила кристаллическую структуру Na+/K+-АТФазы с разрешением, достаточным чтобы рассмотреть детали [11]. Это было похоже на то, как если бы вы наконец-то смогли заглянуть внутрь часов и увидеть, как именно крутятся шестеренки.
Na+/K+-АТФаза состоит из двух основных субъединиц — α и β. α-Субъединица — это каталитическое «сердце» фермента, крупный белок массой около 110 килодальтон, который пронизывает мембрану десятью спиралями (рис. 2) [12–14]. Именно она связывает ионы, расщепляет АТФ и совершает всю механическую работу по перекачиванию. β-Субъединица поменьше (около 55 кДа) — это гликопротеин, который помогает α-субъединице правильно упаковаться, добраться до мембраны и стабилизирует всю конструкцию [15], [16]. Кроме того, к ферменту могут присоединяться небольшие регуляторные белки семейства FXYD (названные по характерной аминокислотной последовательности), которые тонко настраивают работу насоса в зависимости от типа ткани и физиологических условий [17], [18].
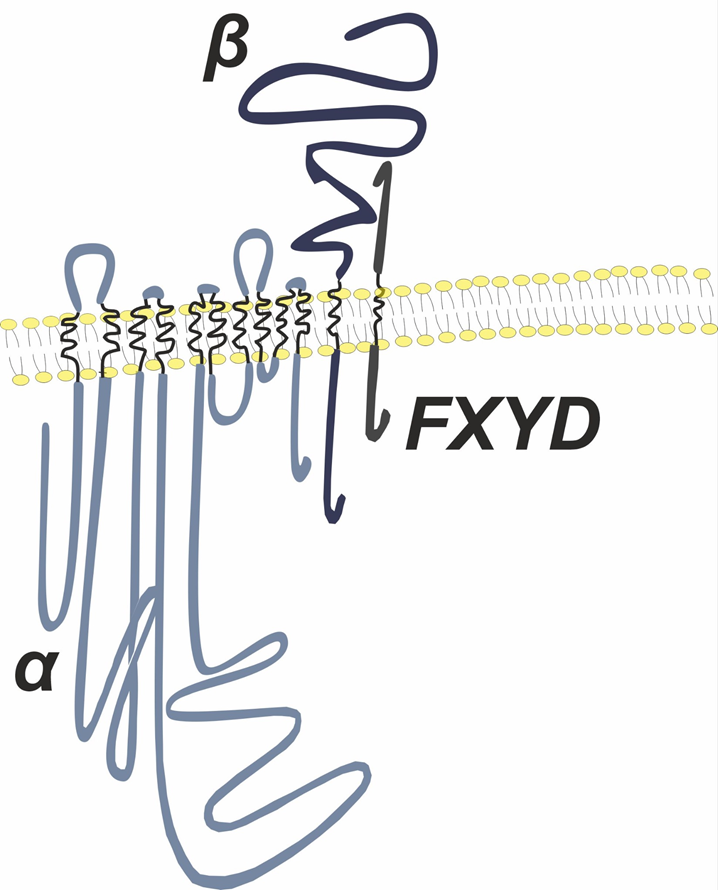
Рисунок 2. Модульная архитектура натрий-калиевого насоса. Структурное представление, показывающее модульную структуру Na+/K+-АТФазы. Белок включает трансмембранные спирали M7–M10 и специфические субъединицы, а именно β-субъединицу и γ-субъединицу (FXYD2). Показан основной участок взаимодействия между С-концевыми спиралями M7–M10 Na+K+-АТФазы и мембранным транспортным ядром (M1–M6), а также специфическая область С-концевого домена M7–M10 (обозначенная как С-конец), влияющая на сродство к Na+. Полная структура показана справа.
адаптировано из [13]
Интересно, что у млекопитающих существует несколько вариантов (изоформ) и α-, и β-субъединиц. У человека найдено четыре варианта α-субъединицы (α1—α4) и три варианта β-субъединицы (β1—β3) [19]. Они экспрессируются в разных тканях и немного различаются по свойствам. α1 — это «универсальный солдат», который есть почти везде и обеспечивает базовые нужды клетки. α2 особенно важна в мышцах и глиальных клетках мозга [20]. α3 работает в основном в нейронах, и мутации в ее гене приводят к тяжелым неврологическим заболеваниям [21]. α4 обнаружена только в сперматозоидах — видимо, для оплодотворения яйцеклетки нужен какой-то особенный вариант насоса!
Если посмотреть на α-субъединицу сбоку, можно выделить два больших блока: трансмембранный домен, погруженный в липидный бислой, и цитоплазматический домен, торчащий в клетку [22], [23] (рис. 2). Трансмембранная часть образует что-то вроде туннеля или шлюза, через который проходят ионы. А цитоплазматическая часть — это сложная трехдоменная конструкция, где происходит главное волшебство: связывание и гидролиз АТФ [7]. Эти три цитоплазматических домена носят буквенные обозначения [24]:
- N-домен (nucleotide-binding) — связывает АТФ;
- P-домен (phosphorylation) — принимает фосфатную группу от АТФ;
- A-домен (actuator) — действует как рычаг, передающий движение.
Современные методы визуализации, включая микроскопию сверхвысокого разрешения, позволяют не только рассмотреть статическую структуру Na+/K+-АТФазы, но и исследовать динамику и подвижность белковых молекул в мембране в реальном времени [25], [26]. Это особенно важно для понимания того, как фермент взаимодействует с другими мембранными белками и как организована его работа в естественном клеточном окружении.
Когда молекула АТФ связывается с N-доменом, она оказывается зажатой между N- и P-доменами, как орех в щипцах. Гидролиз АТФ приводит к тому, что фосфат переносится на аспартат в P-домене (Asp-369 у большинства изоформ) [27]. Это вызывает конформационные изменения, которые через A-домен передаются на трансмембранную часть — и там, в глубине мембраны, открываются и закрываются ворота для ионов [28], [29].
Глава 3. Танец конформаций: как работает насос
Теперь самое интересное — как именно этот белок перекачивает ионы? Механизм его работы описывается моделью Альберса–Поста, названной в честь ученых, которые предложили ее еще в 1960–70-х годах, задолго до получения структурных данных [30], [31]. Суть модели в том, что фермент может находиться в двух основных конформационных состояниях, которые назвали E1 и E2. Как дверь, которая может быть открыта либо внутрь, либо наружу, но не в обе стороны одновременно. На рисунке 3 показаны две различные конформации фермента — E1Na и E2(K), которые представляют собой ключевые состояния в цикле работы насоса. Таким образом, ионы натрия запускают фосфорилирование фермента, ионы калия — его дефосфорилирование [32].
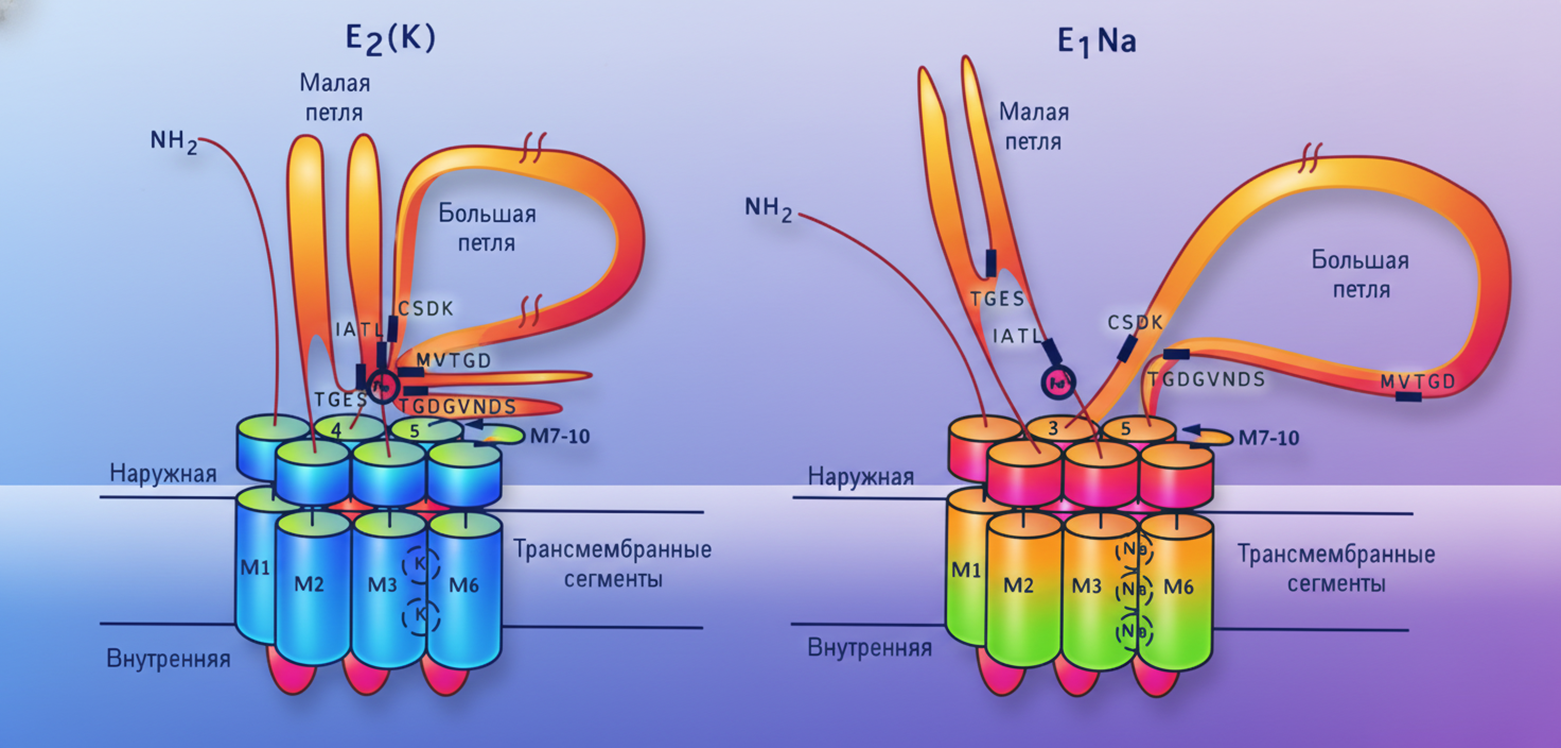
Рисунок 3. Две конформации Na+/K+-АТФазы и рабочий цикл натрий-калиевого насоса. Связывание трех ионов Na+ изнутри клетки с формой E1-АТФ запускает фосфорилирование белка с образованием закрытого состояния [Na3]E1P-АДФ. Затем следует переход в состояние E2P, которое слабо удерживает натрий. Это приводит к обмену: три иона Na+ выходят наружу, а два иона K+ (и один протон H+ в дополнительный центр связывания) входят внутрь. Закрытие формы E2P вызывает отщепление фосфата и образование окклюдированного состояния [K2]E2 с запертыми ионами калия. Присоединение новой молекулы АТФ возвращает насос в состояние E1 — калий освобождается в цитоплазму, а натрий снова связывается, и цикл повторяется.
адаптировано из [13]
Для экспериментального изучения этого сложного каталитического цикла исследователи разработали различные методы определения активности Na+/K+-АТФазы. Одна из ключевых задач — правильная подготовка мембранных фракций и выбор условий, в которых фермент сохраняет свою активность. Использование различных типов мембранотропных веществ при выделении и изучении фермента позволяет оптимизировать методику и получать более точные данные о кинетических параметрах насоса [33], [34]. Например, детергенты типа дезоксихолата натрия или Твин-20 могут по-разному влиять на активность и свойства Na+/K+-АТФазы в смешанной мембранной фракции, что необходимо учитывать при интерпретации результатов [34], [35].
Глава 4. Зачем клетке эти градиенты?
Хорошо, мы разобрались, что насос создает градиенты натрия и калия. Но зачем они нужны? Ответов на этот вопрос несколько, и все они важны.
Мембранный потенциал и возбудимость. Начнем с самого очевидного. Асимметричное распределение ионов создает разность потенциалов на мембране — обычно около −70 милливольт (внутри отрицательно). Это и есть мембранный потенциал покоя, который нейрофизиологи исследуют уже больше ста лет [36]. Для нервных и мышечных клеток это критически важно, потому что именно на основе этого потенциала работают натриевые и калиевые каналы, генерирующие потенциалы действия — быстрые электрические сигналы [37].
Когда нейрон возбуждается, натриевые каналы открываются, натрий лавиной входит внутрь, мембрана деполяризуется. Затем калиевые каналы открываются, калий выходит, мембрана реполяризуется. Но после каждого потенциала действия градиенты немного «проседают» — немного натрия зашло, немного калия вышло. И вот тут выходит на сцену Na+/K+-АТФаза: она восстанавливает градиенты, возвращая натрий назад, а калий внутрь [38].
В нейронах мозга, которые могут генерировать десятки потенциалов действия в секунду, насос работает, не переставая. Исследования показали, что даже небольшое снижение активности Na+/K+-АТФазы в нейронах приводит к нарушению их способности поддерживать высокочастотную импульсацию [38]. А полная остановка насоса (например, при ишемии) приводит к быстрой деполяризации и гибели нейронов.
Регуляция объема клетки. Ионные градиенты определяют не только электрические свойства клетки, но и ее объем. Дело в том, что вода свободно проходит через мембрану по аквапоринам, выравнивая осмотическое давление. Если внутри клетки соли больше, чем снаружи, вода будет входить, и клетка начнет раздуваться [39].
Вторичный активный транспорт. А вот это, пожалуй, самое интересное. Градиент натрия, создаваемый Na+/K+-АТФазой, используется массой других транспортеров для переноса различных веществ через мембрану. Это называется вторичным активным транспортом: первичный транспорт — это сам натрий-калиевый насос, работающий на АТФ, а вторичный — это транспортеры, работающие на градиенте натрия [40].
Примеров множество:
- Na+/глюкозный котранспортер (SGLT) в кишечнике и почках использует градиент натрия для всасывания глюкозы против ее концентрации. Натрий «тащит за собой» глюкозу внутрь клетки, а потом сам выкачивается обратно Na+/K+-АТФазой.
- Na+/Ca2+ обменник выбрасывает кальций из клетки, используя энергию входящего натрия. Это критически важно для сердца и мышц, где концентрация кальция должна строго регулироваться [40].
- Na+/H+ обменник регулирует внутриклеточный pH, выбрасывая протоны в обмен на входящий натрий.
- Na+-зависимые транспортеры аминокислот, нейромедиаторов (глутамата, ГАМК, серотонина) в нейронах [41].
Получается, что Na+/K+-АТФаза — это не просто насос для натрия и калия. Это энергетическая станция, которая обеспечивает работу множества других транспортных систем. Неслучайно на нее уходит так много АТФ!
Глава 5. Когда насос ломается: болезни и лекарства
Учитывая, насколько Na+/K+-АТФаза важна для жизни клетки, неудивительно, что ее дисфункция связана с множеством заболеваний. Рассмотрим несколько примеров.
Наследственные болезни. Мутации в генах, кодирующих субъединицы Na+/K+-АТФазы, встречаются редко, но приводят к тяжелым последствиям. Самый известный пример — мутации в гене ATP1A3 (α3-субъединица), которые вызывают быстроразвивающуюся дистонию-паркинсонизм [42]. Это неврологическое заболевание, при котором у пациентов внезапно (иногда за несколько часов или дней) развиваются мышечная ригидность, дистония и паркинсонизм. Болезнь обычно возникает в детстве или юности, часто провоцируется стрессом или инфекцией.
Другие мутации в том же гене вызывают другую форму — альтернирующую гемиплегию детства, при которой возникают эпизоды преходящего паралича то одной, то другой половины тела, а также судороги и задержка развития. Эти заболевания показывают, насколько критична α3-изоформа для нормальной работы нейронов, особенно в базальных ганглиях [43].
Инсульт и ишемия мозга. При ишемическом инсульте нарушается кровоснабжение участка мозга, клетки перестают получать кислород и глюкозу, прекращается синтез АТФ. Без АТФ Na+/K+-АТФаза останавливается [44]. Натрий начинает накапливаться внутри нейронов, за ним следует вода — развивается цитотоксический отек [45]. Нейроны набухают и в конечном итоге гибнут. Это один из ключевых механизмов повреждения мозга при инсульте.
Сердечная недостаточность и сердечные гликозиды. При хронической сердечной недостаточности сердце не может эффективно перекачивать кровь. Сердечные гликозиды (дигоксин, дигитоксин) — это вещества растительного происхождения (из наперстянки, ландыша, строфанта), которые специфически связываются с внеклеточной стороной α-субъединицы и блокируют насос [5]. При хронической сердечной недостаточности сердце не может эффективно перекачивать кровь. Одна из терапевтических стратегий — усилить сократимость сердечной мышцы. И здесь на помощь приходят... ингибиторы Na+/K+-АТФазы [9]! Звучит парадоксально, но это работает.
Казалось бы, зачем блокировать такой важный фермент? Логика такая: если заблокировать Na+/K+-АТФазу в кардиомиоцитах (в небольшой степени!), внутри клетки немного повысится концентрация натрия. Это снизит эффективность работы Na+/Ca2+ обменника, который выкачивает кальций. В результате в клетке накопится больше кальция, что усилит сокращение [5], [46].
Дигоксин используется в кардиологии уже более 200 лет (впервые описан Уильямом Уизерингом в 1785 году!) и до сих пор применяется, хотя и с осторожностью — терапевтическая доза близка к токсической.
Артериальная гипертензия. Снижение активности Na+/K+-АТФазы в гладкомышечных клетках сосудов может способствовать развитию гипертонии. Механизм похож: меньше работает насос → больше натрия внутри → больше кальция → сосуды сильнее сжимаются → давление растет [47].
Более того, есть гипотеза, что в организме существуют эндогенные аналоги сердечных гликозидов — вещества, которые вырабатываются самим организмом и регулируют артериальное давление через влияние на Na+/K+-АТФазу [5], [48]. Эта идея до сих пор обсуждается и исследуется.
Эпилог: что дальше?
Более 60 лет прошло с момента открытия Na+/K+-АТФазы Йенсом Скоу, но этот фермент продолжает удивлять исследователей. Мы узнали его структуру в атомных деталях, разобрались в механизме работы, выявили множество изоформ и регуляторов, обнаружили сигнальные функции. Но вопросы остаются.
Как именно конформационные изменения передаются от цитоплазматических доменов к трансмембранным воротам? Какова природа эндогенных «дигоксин-подобных» веществ и как они регулируются? Можно ли создать высокоселективные модуляторы для конкретных изоформ, которые помогли бы лечить болезни без побочных эффектов? Какова роль сигнальной функции насоса в норме и патологии?
Современные методы — криоэлектронная микроскопия [49], молекулярная динамика [50], оптогенетика [51], геномное редактирование [52], а также усовершенствованные биохимические подходы к изучению активности фермента в различных мембранных фракциях [33], [34] — открывают новые возможности для изучения этого удивительного белка. Возможно, следующие десятилетия принесут нам столь же революционные открытия, как первые 60 лет истории Na+/K+-АТФазы. Наша цель — создать фундаментальную базу данных о том, как различные детергенты и модуляторы влияют на активность разных изоформ Na+/K+-АТФазы в нервной ткани. Это знание в будущем может помочь в разработке новых фармакологических агентов с высокой селективностью к определенным типам клеток мозга, что откроет новые возможности для лечения эпилепсии, инсульта, нейродегенеративных заболеваний и других патологий центральной нервной системы.
А пока насос продолжает свою непрерывную работу в каждой клетке вашего тела, потребляя треть всей АТФ, поддерживая ионные градиенты и обеспечивая возможность читать эти строки — ведь без него нейроны вашего мозга не смогли бы проводить нервные импульсы. Неплохо для одного белка, не правда ли?
Литература
- Jens Chr. Skou. (1957). The influence of some cations on an adenosine triphosphatase from peripheral nerves. Biochimica et Biophysica Acta. 23, 394-401;
- Aitmukhambetova I.R. (2024). Sodium deoxycholate and tween-20 effect on Na+/K+-ATPase activity and properties in the mixed membrane fraction of rats cerebral cortex. Experientia est optima magistra: International collection of scientific papers. — Belgorod: Epicentre. – P. 162–165;
- Тремясов М.А., Айтмухамбетова И.Р. Влияние различных типов мембранотропных веществ для определения активности Na+/K+-АТФазы в грубой микросомально-митохондриальной фракции коры больших полушарий головного мозга крыс. Материалы IV межвузовской студенческой конференции. Москва, 2024. — С. 29;
- Jack H. Kaplan. (2002). Biochemistry of Na,K-ATPase. Annu. Rev. Biochem.. 71, 511-535;
- Käthi Geering. (2006). FXYD proteins: new regulators of Na-K-ATPase. American Journal of Physiology-Renal Physiology. 290, F241-F250;
- G.J. Lees. (1993). Contributory mechanisms in the causation of neurodegenerative disorders. Neuroscience. 54, 287-322;
- Takehiro Shinoda, Haruo Ogawa, Flemming Cornelius, Chikashi Toyoshima. (2009). Crystal structure of the sodium–potassium pump at 2.4 Å resolution. Nature. 459, 446-450;
- Lingrel J.B., Kuntzweiler T. (1994). Na+,K+-ATPase. J Biol Chem. 269, 19659–19662;
- Зеленые лекарства будущего;
- Биолого-музыкальное и научно-познавательное произведение «Трактат о естественных науках» (аннотация к рэп-альбому);
- J. Preben Morth, Bjørn P. Pedersen, Mads S. Toustrup-Jensen, Thomas L.-M. Sørensen, Janne Petersen, et. al.. (2007). Crystal structure of the sodium–potassium pump. Nature. 450, 1043-1049;
- Ryuta Kanai, Haruo Ogawa, Bente Vilsen, Flemming Cornelius, Chikashi Toyoshima. (2013). Crystal structure of a Na+-bound Na+,K+-ATPase preceding the E1P state. Nature. 502, 201-206;
- J. Preben Morth, Bjørn P. Pedersen, Morten J. Buch-Pedersen, Jens Peter Andersen, Bente Vilsen, et. al.. (2011). A structural overview of the plasma membrane Na+,K+-ATPase and H+-ATPase ion pumps. Nat Rev Mol Cell Biol. 12, 60-70;
- Peter L. Jorgensen, Kjell O. Håkansson, Steven J. D. Karlish. (2003). Structure and Mechanism of Na,K-ATPase: Functional Sites and Their Interactions. Annu. Rev. Physiol.. 65, 817-849;
- Käthi Geering. (2008). Functional roles of Na,K-ATPase subunits. Current Opinion in Nephrology and Hypertension. 17, 526-532;
- H.-J. Apell, S.J. Karlish. (2001). Functional Properties of Na,K-ATPase, and Their Structural Implications, as Detected with Biophysical Techniques. Journal of Membrane Biology. 180, 1-9;
- Alicia A. McDonough, Jang H. Youn. (2017). Potassium Homeostasis: The Knowns, the Unknowns, and the Health Benefits. Physiology. 32, 100-111;
- Лопина О.Д., Букач О.В., Сидоренко С.В., Климанова Е.А. (2022). Na⁺,K⁺-АТФ-аза как полифункциональный белок. Биологические мембраны: Журнал мембранной и клеточной биологии. 39, 271–282;
- Gustavo Blanco, Robert W. Mercer. (1998). Isozymes of the Na-K-ATPase: heterogeneity in structure, diversity in function. American Journal of Physiology-Renal Physiology. 275, F633-F650;
- I M Glynn. (1993). Annual review prize lecture. ‘All hands to the sodium pump’.. The Journal of Physiology. 462, 1-30;
- Kathleen J. Sweadner. (1989). Isozymes of the Na+/K+-ATPase. Biochimica et Biophysica Acta (BBA) - Reviews on Biomembranes. 988, 185-220;
- Z. Xie. (2003). Na+-K+-ATPase-Mediated Signal Transduction: From Protein Interaction to Cellular Function. Molecular Interventions. 3, 157-168;
- Jiang Liu, Riad Kesiry, Sankaridrug M. Periyasamy, Deepak Malhotra, Zijian Xie, Joseph I. Shapiro. (2004). Ouabain induces endocytosis of plasmalemmal Na/K-ATPase in LLC-PK1 cells by a clathrin-dependent mechanism. Kidney International. 66, 227-241;
- Cornelius F., Mahmmoud Y.A. (2003). Functional modulation of the sodium pump: the regulatory proteins "Fixit". News Physiol Sci. 18, 119–124;
- Tatjana Mijatovic, Laurent Ingrassia, Vincenzo Facchini, Robert Kiss. (2008). Na+/K+-ATPase α subunits as new targets in anticancer therapy. Expert Opinion on Therapeutic Targets. 12, 1403-1417;
- Коркунов Р.Ю., Айтмухамбетова И.Р. (2024). Изучение подвижности молекул пресинаптических белков в мембране с использованием микроскопии сверхвысокого разрешения. Биохимия человека: материалы всероссийской конференции с международным участием. Москва: ООО «Е-ното». — С. 324.;
- David Attwell, Simon B. Laughlin. (2001). An Energy Budget for Signaling in the Grey Matter of the Brain. J Cereb Blood Flow Metab. 21, 1133-1145;
- Chikashi Toyoshima, Hiromi Nomura. (2002). Structural changes in the calcium pump accompanying the dissociation of calcium. Nature. 418, 605-611;
- Alexander V. Chibalin, Adrian I. Katz, Per-Olof Berggren, Alejandro M. Bertorello. (1997). Receptor-mediated inhibition of renal Na+-K+-ATPase is associated with endocytosis of its α- and β-subunits. American Journal of Physiology-Cell Physiology. 273, C1458-C1465;
- R W Albers. (1967). Biochemical Aspects of Active Transport. Annu. Rev. Biochem.. 36, 727-756;
- Post R.L., Hegyvary C., Kume S. (1972). Activation by adenosine triphosphate in the phosphorylation kinetics of sodium and potassium ion transport adenosine triphosphatase. J Biol Chem. 247, 6530–6540;
- Болдырев А.А. (2008). Роль Na/K-насоса в возбудимых тканях (обзор). Journal of Siberian Federal University. Biology. 3, 206–225;
- Айтмухамбетова И.Р., Дерягина Е.В. (2024). Влияние дезоксихолата натрия, тритона х 100 и твин 20 на активность и свойства Na+/K+-АТФазы в смешанной мембранной фракции коры больших полушарий головного мозга крыс. Материалы Всероссийского научного форума с международным участием, посвященного 300-летию Российской академии наук. – Тюмень: ООО «Печатник». — С. 72;
- Айтмухамбетова И.Р., Абдурахимов А.А.У., Похазникова А.А. (2024). Влияние дезоксихолата натрия и твин-20 на активность и свойства Na+/K+-АТФазы в смешанной мембранной фракции коры больших полушарий головного мозга крыс. Вопросы биологической, медицинской и фармацевтической химии. 27, 52–59;
- T Clausen, C Van Hardeveld, M E Everts. (1991). Significance of cation transport in control of energy metabolism and thermogenesis.. Physiological Reviews. 71, 733-774;
- Формирование мембранного потенциала покоя;
- 12 методов в картинках: нейробиология;
- Stefan R Pulver, Leslie C Griffith. (2010). Spike integration and cellular memory in a rhythmic network from Na+/K+ pump current dynamics. Nat Neurosci. 13, 53-59;
- Else K. Hoffmann, Ian H. Lambert, Stine F. Pedersen. (2009). Physiology of Cell Volume Regulation in Vertebrates. Physiological Reviews. 89, 193-277;
- Mordecai P. Blaustein, W. Jonathan Lederer. (1999). Sodium/Calcium Exchange: Its Physiological Implications. Physiological Reviews. 79, 763-854;
- Robert N. Correll, Petra Eder, Adam R. Burr, Sanda Despa, Jennifer Davis, et. al.. (2014). Overexpression of the Na + /K + ATPase α2 But Not α1 Isoform Attenuates Pathological Cardiac Hypertrophy and Remodeling. Circulation Research. 114, 249-256;
- Mordecai P. Blaustein, Jin Zhang, Ling Chen, Hong Song, Hema Raina, et. al.. (2009). The Pump, the Exchanger, and Endogenous Ouabain. Hypertension. 53, 291-298;
- A M Bertorello, A Aperia, S I Walaas, A C Nairn, P Greengard. (1991). Phosphorylation of the catalytic subunit of Na+,K(+)-ATPase inhibits the activity of the enzyme.. Proc. Natl. Acad. Sci. U.S.A.. 88, 11359-11362;
- Alex G. Therien, Rhoda Blostein. (2000). Mechanisms of sodium pump regulation. American Journal of Physiology-Cell Physiology. 279, C541-C566;
- Patricia de Carvalho Aguiar, Kathleen J Sweadner, John T Penniston, Jacek Zaremba, Liu Liu, et. al.. (2004). Mutations in the Na+/K+-ATPase α3 Gene ATP1A3 Are Associated with Rapid-Onset Dystonia Parkinsonism. Neuron. 43, 169-175;
- Sanda Despa, Donald M. Bers. (2013). Na+ transport in the normal and failing heart — Remember the balance. Journal of Molecular and Cellular Cardiology. 61, 2-10;
- Wilhelm Schoner, Georgios Scheiner-Bobis. (2007). Endogenous and exogenous cardiac glycosides: their roles in hypertension, salt metabolism, and cell growth. American Journal of Physiology-Cell Physiology. 293, C509-C536;
- Bernard Beck, Sébastien Richy, Zoe A. Archer, Julian G. Mercer. (2012). Ingestion of Carbohydrate-Rich Supplements during Gestation Programs Insulin and Leptin Resistance but not Body Weight Gain in Adult Rat Offspring. Front. Physio.. 3;
- Цвет, 3D и сверхвысокое разрешение: новая разработка в микроскопии;
- Молекулярная динамика биомолекул. Часть I. История полувековой давности;
- Оптогенетика + голография = прозрение?;
- Переписывая код жизни: как инструменты генного редактирования могут навсегда изменить медицину?.