Переписывая код жизни: как инструменты генного редактирования могут навсегда изменить медицину?
06 июня 2025
Переписывая код жизни: как инструменты генного редактирования могут навсегда изменить медицину?
- 2869
- 0
- 18
Внедрение инструментов генного редактирования может открыть совершенно новые возможности в медицине. И хотя пока мы лишь в начале этого пути, приближающиеся перспективы уже завораживают.
иллюстрация Елены Беловой
-
Автор
-
Редакторы
-
Иллюстратор
Мы продолжаем увлекательное путешествие в мир инструментов для «генных правок». Если в предыдущей статье спецпроекта «Генная и клеточная терапии» мы познакомились с основами модификации генома животных, то теперь перейдем к самой интригующей части истории — изменению человеческой ДНК в медицинских целях. Теоретически уже сейчас можно переписывать «код жизни», превращая ранее неизлечимые недуги в поддающиеся коррекции. Но насколько далеко простираются границы этих возможностей? Что реально достижимо уже сегодня? Наше воображение будоражат соблазнительные картины: мы могли бы изменять врожденный цвет глаз, длину конечностей, уже с пеленок наделять детей исключительными способностями... Однако на практике передовые разработки сосредоточены на закрытии по-настоящему неудовлетворенных потребностей: исправлении ошибок природы, ведущих к тяжелым наследственным заболеваниям. Эта статья станет проводником в удивительный мир генной инженерии; раскроет секреты технологий, подаривших инструменты редактирования генома; подробно расскажет, как они появились и функционируют, какие перспективы открывают в науке и медицине; а также какие трудности стоят на пути ученых, и почему изменения в генах способны перевернуть представления человечества о здоровье и лечении.
Генная и клеточная терапии

Четвертый сезон спецпроекта о генной и клеточной терапиях рассказывает о конкретных применениях этих новейших методов для лечения нейромоторных, онкологических, офтальмологических и других заболеваний.
Партнер спецпроекта — Департамент разработки генотерапевтических препаратов одной из крупнейших российских биотехнологических компаний — BIOCAD. BIOCAD заслужил серьезные позиции на мировом фармацевтическом рынке благодаря выпуску лекарственных препаратов на основе антител.
Возможность управлять генетическим будущим нашего вида изумляет и одновременно пугает. Решение о том, как справляться с этой властью, может быть величайшим вызовом, с которым мы когда-либо сталкивались.
«Что в имени тебе моем»?
«Редактирование генома или генное редактирование — метод генной инженерии, позволяющий вставлять, удалять, модифицировать или заменять последовательности ДНК в живых организмах». Это определение, взятое из «Википедии», кажется на первый взгляд немного громоздким, но довольно точно отражает не только суть, но и потенциал, заложенный в этом виде генного лечения. Нужно лишь немного над ним призадуматься...
В самом деле, сегодня мы многое знаем про генную терапию (ей, например, посвящен этот спецпроект!), причем не только про ее завораживающие возможности, но и про серьезные недостатки. Один из них — необходимость доставки в клетку рабочей копии всего поломанного гена целиком, что не всегда бывает оптимально. Дело в том, что обычно достаточно изменить совсем крошечную часть гена, чтобы он снова заработал; то есть вовсе не обязательно включать в лечебную ДНК весь «джентльменский набор» кодирующих и регуляторных последовательностей.
В этом смысле идеальным решением было бы «чинить» дефектный ген в его естественном положении — прямо в хромосоме, просто заменяя несколько «букв» нуклеотидной последовательности, что сделало бы вмешательство гораздо более аккуратным и точным. Одно из преимуществ тут в том, что продукция целевого белка таким «родным» геном вряд ли «угаснет» со временем (как это иногда случается с доставленными извне полноразмерными генами) [2], что очень важно. Ведь вся идея геномного редактирования (как и любой другой генной терапии) — это одноразовое лечение с долгоиграющим эффектом: замедлением или остановкой прогрессирования заболевания на всю жизнь.
Как гласит философский принцип «бритвы Оккама»: не нужно множить сущности сверх необходимого; и для медицины эта пословица более чем актуальна. Обычно чем менее инвазивно, хирургически аккуратно и точно медицинское вмешательство, тем лучше. Генное редактирование позволяет реализовывать именно такую точечную инженерию, расширяя возможности существующих методов лечения и при этом сводя к минимуму вмешательство в естественные молекулярные процессы . Это обусловливает его недюжинный терапевтический потенциал, делая перспективным и привлекательным биомедицинским методом.
Оговоримся: тут речь о теоретическом преимуществе перед классической генно-заместительной терапией, которое в полной мере (как хочется верить!) еще только будет реализовано. Пока же ошибочное редактирование — одна из основных опасностей такого рода терапий, что вызывает недоверие к ним (об этом ниже еще поговорим). Конечно, такие опасения в небезопасности (стоит признать, небезосновательные) характерны и для «обычной» генной терапии, но пока к ней доверия все-таки немного побольше, ведь уже накоплен некоторый опыт ее использования. Подробнее обо всем многообразии генного лечения узнайте из предыдущих статей этого спецпроекта.
Как работает генное редактирование?
Немного истории
В 1985 году англо-американский генетик и биохимик Оливер Смитис продемонстрировал принципиальную возможность внедрять фрагменты ДНК в клетки млекопитающих. В своих экспериментах Смитис с коллегами использовали ген человеческого β-глобина, который смогли успешно интегрировать в нужный участок генома. Получилось сделать это у них за счет явления, ныне известного как «гомологичная рекомбинация», и далее мы о нем расскажем чуть подробней .
Между прочим, эти опыты легли в основу метода «нокаута» генов, широко используемого в биомедицине и доклинических исследованиях. В 2007 году Смитис вполне заслуженно получил за свои открытия Нобелевскую премию, разделив ее с двумя другими выдающимися исследователями: Марио Капекки и Мартином Эвансом [3].
Исследования Смитиса были, безусловно, новаторскими: в то время это был очень важный результат для фундаментальной науки; но для науки прикладной пока еще было мало толку. Дело в том, что эффективность генной интеграции тогда была очень низкой: примерно одно событие на тысячу клеток. К тому же, даже в успешно трансформированных клетках продукция целевого белка наблюдалась не всегда [4], так что до генного редактирования было еще далеко.
Чуть ближе эпоху «генных правок» приблизила группа ученых во главе с Лоиком Перруо из Национального центра научных исследований во Франции. Они синтезировали недлинные нуклеотидные цепочки, способные под воздействием активирующего их света расщеплять нуклеиновые кислоты в определенных местах [5]. Такие вот специфические искусственные фотоэндонуклеазы были своего рода прототипами-предшественниками современных режущих ДНК ферментов — рестриктаз. Последние, правда, ученым уже не пришлось искусственно синтезировать — они «позаимствовали» их из живой природы.
«Отбирая» дары эволюции
Сделаем небольшое (лирическое, но подводящее к главному) отступление. Когда для медицинских целей ученым потребовались обладающие биологической активностью крупные молекулы, они сначала пробовали синтезировать их химическим путем. Так, например, пытались делать инсулин, синтезировав его искусственно последовательным пришиванием по одной аминокислоте в цепь (до победного!)… Производство таким путем не особо «заладилось», что в целом неудивительно: даже для относительно небольшой молекулы инсулина это было чересчур долго, дорого и сложно. Здесь-то на помощь и пришли методы микробиологии и генной инженерии: «приручив» кишечную палочку (читай, генетически модифицировав ее для производства инсулина), исследователи смогли ее культивировать в биореакторах, а продуцируемый ею целевой белок снимать как сливки ко всеобщей пользе .
Во всем этом удивительного тоже мало: фармпромышленность так и развивалась — от производства природных экстрактов и препаратов из них к получаемым методами химического синтеза малым молекулам, а затем к крупным лекарствам-биомолекулам — и далее к передовой терапии. Собственно, производимый биотехнологически инсулин так и появился, а за ним и множество других замечательных биопрепаратов. Обо всех этих «метаморфозах» мы подробно рассказали в статье «Три поколения лекарств» спецпроекта «Современные лекарства» [6].
Этот простой пример показывает, что при выходе на новый уровень молекулярной сложности гораздо проще (а главное, эффективней) не изобретать велосипед, а просто взять его из природы, слегка (а может даже и существенно) модифицировав под нужды науки. В генном редактировании такой подход помог создать по-настоящему эффективные инструменты.
Что было дальше?
Ниже немного расскажем об исследованиях, без которых «генные редакторы» вряд ли бы появились, так что об этом трудно смолчать, ведь «из песни слов не выкинешь». Во всех красках история появления инструментов молекулярной биологии и генной инженерии рассказана в статье «12 методов в картинках: генная инженерия. Часть I, историческая» [7]; здесь же мы обозначаем лишь некоторые ее ключевые эпизоды.
Молекулярные ножницы из недр природы
В 1978 году Нобелевскую премию по физиологии и медицине «за открытие рестрикционных ферментов и их применение к проблемам молекулярной генетики» разделили микробиологи Вернер Арбер, Даниел Натанс и Гамильтон Смит [8]. Каждый из них внес свою лепту: Арбер показал, что кишечные палочки расщепляют ДНК фагов лямбда особыми ферментами-рестриктазами (или эндонуклеазами); Гамильтон такие ферменты выделил уже из гемофильной палочки; ну а Натанс выделил и охарактеризовал фрагменты нарезаемой рестриктазами ДНК, продемонстрировав практическую пользу этих «ножниц» [7].
После всех этих открытий, казалось бы, «карты в руки»! Рестриктазами можно разрезать ДНК, вставляя отрезанное из одного организма в другой: вот они возможности для генной инженерии и модификации! Стало быть, можно уже начинать «кройку и шитье» геномов, исправляя природные недостатки и заболевания?..
Как выяснилось, не совсем. Дело в том, что хотя природные эндонуклеазы разрезают ДНК в предопределенных местах, иногда это совсем не те места, что нужны ученым. Обладая своей собственной сайт-специфичностью, эти ферменты оказались «капризными лошадками», которых не так легко приручить. Вшитое эволюцией нацеливание на расщепление строго определенных последовательностей изменить не так просто, а потому для «свободного» редактирования генома потребовался гораздо более тонко настраиваемый инструментарий. Необходимо было продолжать поиск новых решений, и к счастью ученые здесь не сбавляли обороты.
Мегануклеазы
Важной вехой в преодолении ограничений стало открытие, что если разрезать сразу обе цепи ДНК (сделать двухцепочечный разрыв — double strand break; DSB) в образовавшуюся прореху будет гораздо легче интегрировать требуемый генетический материал.
В этих исследованиях использовали так называемую мегануклеазу I-SceI, полученную из обычных пекарских дрожжей (Saccharomyces cerevisiae). Как выяснилось, она способна разреза́ть обе цепи ДНК в строго определенном месте, причем ее уникальный сайт распознавания состоит из 18 пар нуклеотидов, что практически исключает его случайное присутствие в геноме (в отличие от паттернов расщепления «обычных» рестриктаз, образованных 4–8 парами оснований) [9]. Например, геном человека пришлось бы увеличить 20-кратно, чтобы «внезапное» появление в нем сайта мегануклеазы стало возможным. Такая эксклюзивность позволила редактировать гены гораздо точней и эффективней: в частности, производить «правки» внутри организмов (in vivo), а также детальнее изучить последствия двухцепочечных разрывов «молекулы жизни».
Оказалось, что после расщепления обеих нитей ДНК у клетки появляется два пути ее «ремонта»: путем негомологичного соединения концов (грубо говоря «сшиванием») и методом гомологичной рекомбинации. Первый способ чреват ошибками: образованием случайных инсерций и делеций (то есть нуклеотидных вставок и «утрат»); второй же позволяет внедрить в ДНК требуемую последовательность используемого шаблона для репарации, приводя тем самым к желанному результату (рис. 1). Тут не только с большей точностью восстанавливается ДНК, но и нужным исследователям образом меняется ее цепочка (а это, по сути, и есть редактирование).
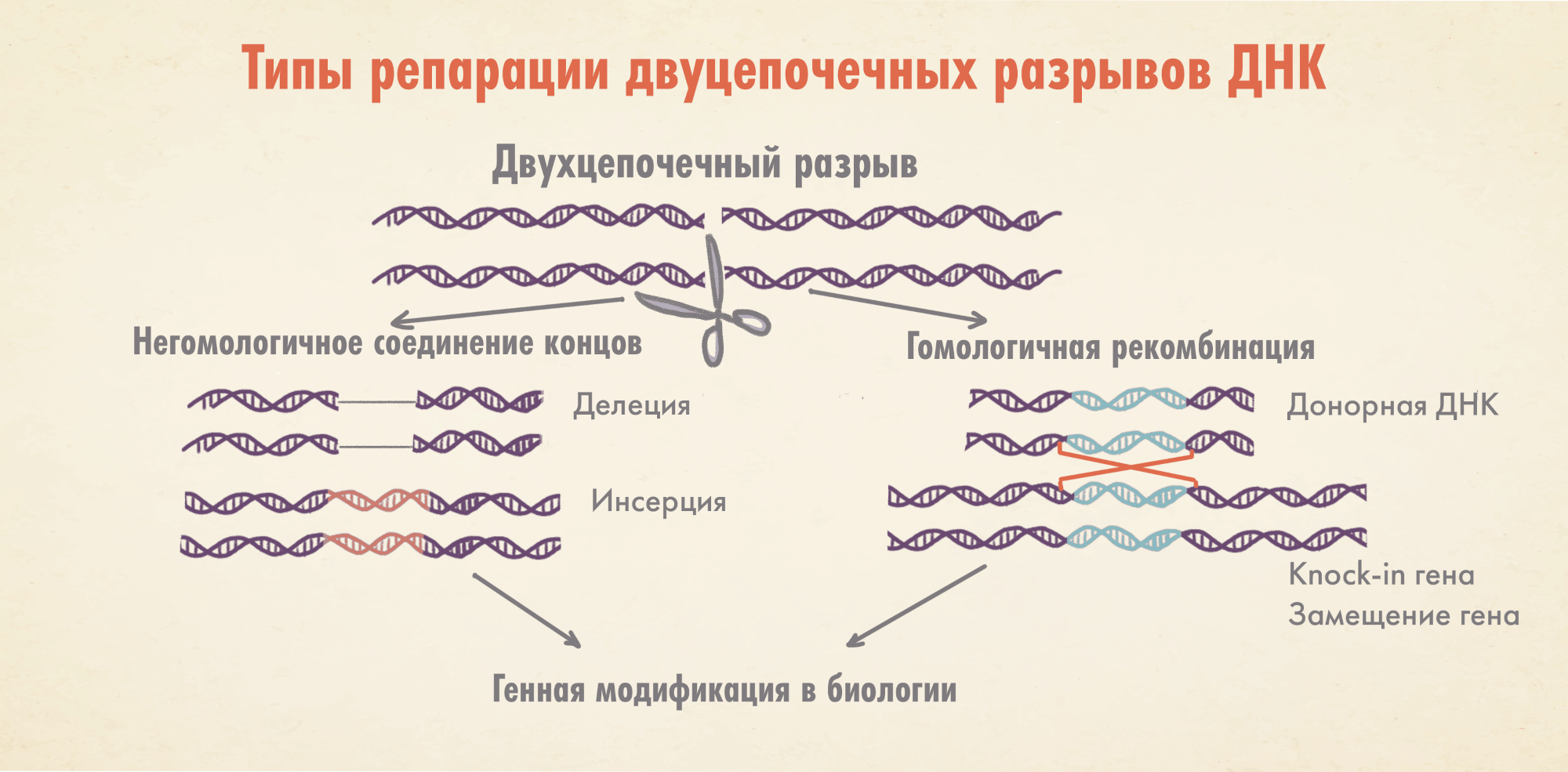
Рисунок 1. Типы репараций двухцепочечных разрывов и их применение в медицине и исследованиях. Такие разрывы могут восстановиться за счет негомологичного соединения концов, однако это ведет к ошибкам — небольшим (<10 нуклеотидов) делециям и инсерциям. Вот почему данный способ применяют при достаточно грубых операциях: когда, например, нужно вырезать участок цепи или отправить какой либо ген «в нокаут», навсегда отключив его. Более тонкий инструмент — гомологичная рекомбинация (известна также как гомологически-направленная репарация — HDR). Здесь брешь в цепи восстанавливается за счет «переписывания» генетической информации с внедренной матрицы ДНК-шаблона, в результате в месте разрыва появляется уже совсем новая последовательность. Точность (как и разрешение) этого способа гораздо выше: тут можно заменять/вставлять требуемый ген, или же изменять последовательность ДНК-цепи с точностью до одного нуклеотида, осуществляя истинное редактирование.
иллюстрация Елены Беловой из статьи «Трансгенные животные и современная медицина: сломать, чтобы починить» [1]
Мегануклеазы, собственно, и стали одними из первых по-настоящему годных инструментов генного редактирования; правда, оказались они совсем не без изъянов. Дело в том, что хотя в природе таких ферментов существуют сотни, их строго фиксированная сайт-специфичность резко ограничивала выбор возможных целевых локусов. Впоследствии сайты распознавания мегануклеаз переделали под более гибкую настройку (рис. 2), позволив проводить направленное редактирование в клетках млекопитающих — мышей и крыс. К сожалению, «перекраивать» мегануклеазы под каждую новую задачу оказалось делом затратным и (на первый взгляд) не особо перспективным [10]. Вот почему их применение в медицине пришлось отложить в долгий ящик, ну а поиск новых инструментов для модификации генома тем временем продолжился.
Сейчас уже есть пример их использования в медицине, расскажем о нем ниже.
Нуклеазы с цинковыми пальцами (Zinc-finger nucleases — ZFN)
Еще в 1980-х ученые выделили из бактерий Flavobacterium okeanokoites эндонуклеазу Fok1 [11], способную к неспецифическому разрезанию ДНК благодаря наличию особого каталитического домена. Фермент этот, казалось бы, универсален: бери и режь им геном в любых местах; но в том-то и дело, что для целей редактирования специфичности ему тогда как раз и не хватало…
Дабы наделить Fok1 «нацеливающими» свойствами, ученые соединили ее каталитический домен с так называемыми цинковыми пальцами — ДНК-связывающими фрагментами транскрипционных факторов.
Благодаря своей «природной миссии» каждый «палец» строго комплементарен определенному триплету, что уже задает специфичность. Эта природная особенность позволила настраивать инструменты геномного редактирования под нужды исследователей: варьируя тип и количество цинковых пальцев достигать требуемого «нацеливания». То есть в теории, имея «пальцы» для каждого из 64 возможных кодонов, можно собирать белковые модули, направленные на любую желаемую последовательность ДНК, что позволяет разреза́ть геном где угодно.
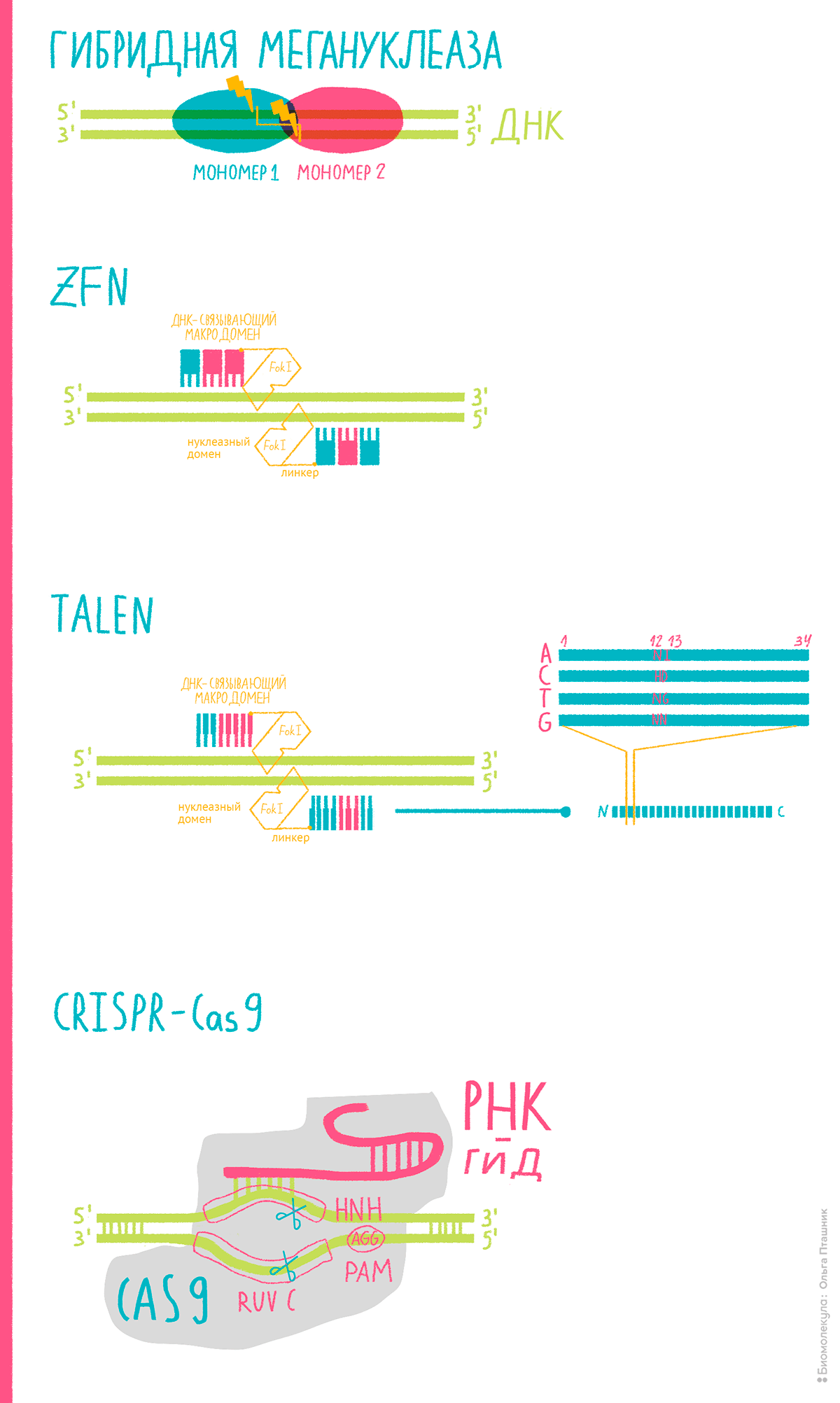
Рисунок 2. Различные инструменты генного редактирования. Генно-инженерные мегануклеазы с измененной сайт-специфичностью, способные разрезать ДНК в нужном месте. ZFN — «цинковые пальцы» — небольшие белковые структуры, способные специфично распознавать участки ДНК. Каждый такой «палец» способен распознать определенную последовательность длиной примерно 3–4 нуклеотида. Соединяя три–четыре подходящие структуры друг с другом, ученые получают белковую конструкцию, способную идентифицировать заданную область ДНК; а в соединении с нуклеазным доменом FokI — и специфично разрезать ее. TALEN — белки, подобные активаторам транскрипции в сочетании с той же FokI. Каждый белок строго специфичен к отдельному нуклеотиду, что и позволяет собранной из них конструкции более точечно нацеливаться на нужную ДНК-последовательность. У ZFN и TALEN есть особенность: «режущая» активность нуклеазы FokI зависит от образования димеров (то есть двух таких молекул соединенных вместе). Это означает, что одна молекула сама по себе неактивна и способна разрезать ДНК лишь тогда, когда объединится с другой молекулой FokI. Как мы далее увидим, это может быть и недостатком, которого, кстати, лишен CRISPR.
Так вот, связав структурные возможности цинковых пальцев с «режущими способностями» Fok1, ученые получили прекрасный модульный инструмент генного редактирования, пригодный под самые разные нужды (рис. 2). Когда его разработали, им не преминули воспользоваться для редактирования геномов различных организмов: мух Drosophila, нематод C. elegans, морских ежей, тутовых шелкопрядов, рыбок Danio rerio, шпорцевых лягушек, мышей [1], крыс, кроликов, свиней, коров и др.; но что самое важное — ZFN использовали при геномной модификации различных человеческих клеточных линий [13]. Этот этап редактирования клеток человека, запущенный в 2005 году нашим выдающимся соотечественником Федором Урновым [14], стал началом сложного пути, который в конечном итоге и привел к лечению наследственных заболеваний с помощью инструментов редактирования.
Впрочем, для полноценного использования у человека технологии генных манипуляций еще требовали значительного улучшения.
Эффекторные белки, подобные активаторам транскрипции
Следующим улучшением стало объединение «режущих» нуклеаз Fok1 со специфичностью белков TALE, выделенных из бактерий рода Xanthomonas. Эти белки, как и следует из их названия, подобны активаторам транскрипции (TALE = Transcription activator-like effectors). Xanthomonas впрыскивают их в растительные клетки, и там уже эти ферменты осуществляют совершенно особое действо: «садясь» на ДНК клеток-хозяев, начинают модулировать экспрессию их белков выгодным для этих бактериальных паразитов образом.
Чтобы вот так ловко перепрограммировать генетические механизмы белкового синтеза растений, ксантомонады наделили свое «оружие» TALE выдающимися свойствами. Каждый их тандемный повтор строго специфичен для определенного нуклеотида — это-то и сделало их использование в геномном редактировании привлекательным для исследователей. В паре с нуклеазами Fok1 они обеспечивают бо́льшую точность редактирования в сравнении с ZFN (рис. 2).
Недостающее звено
При всех плюсах TALEN и ZFN, существенный их минус — в недостаточной воспроизводимости и гибкости. Ведь для каждого нацеливания на новый геномный локус эти инструменты потребуют повторения сборки белковых модулей с заданной специфичностью, что занимает много времени, непрактично и обходится совсем недешево .
Что-то подобное можно сказать и про мегануклеазы, ведь их специфичность «настраивается» генной инженерией; о других недостатках и преимуществах различных систем редактирования см. предыдущую статью [1], а также материал «12 методов в картинках: генная инженерия. Часть II: инструменты и техники» [12] (там этот вопрос разобрали несколько подробней).
Прорыв, сделавший геномное редактирование гораздо более практичным и широкодоступным, связан с разработкой знаменитой системы CRISPR-Cas9, о которой на «Биомолекулe» писали много и со вкусом, что, кстати, неудивительно: метод этот со временем обрел заслуженную славу и популярность среди исследователей и медиков (ниже рассказываем, почему).
Как работает инструмент CRISPR-Cas9 и его более продвинутые аналоги?
То, что ранее ученые методично «собирали по кусочкам», уже существовало в природе, причем, как выяснилось, почти в готовом виде. Речь об адаптивном бактериальном иммунитете, собственно и известном как CRISPR (clustered regularly interspaced short palindromic repeats) и Cas (CRISPR associated proteins). Функционирует этот своеобразный иммунитет в чем-то схожим образом с человеческим (только гораздо проще): фрагменты фаговых геномов включаются в геном бактерии, затем по этим последовательностям она становится способна узнавать и уничтожать атакующих ее паразитов.
Собственно CRISPR — это паттерн генома бактерий и архей, в котором короткие повторяющиеся участки чередуются с более вариабельными, которые, как оказалось, имеют небактериальное происхождение. Работает все это в природе следующим образом: бактерия при помощи нуклеазы Cas расщепляет ДНК вторгающихся в нее патогенов, захватывая из их генетического материала небольшие локусы и вставляя затем в свой геном. Вставки этих чужеродных фрагментов (спейсеров) в ДНК бактерии разделяются «родными участками» — так называемыми палиндромными повторами. И вот, вся эта конструкция и представляет собой CRISPR-кассету (рис. 3)
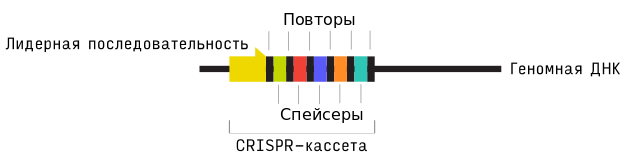
Рисунок 3. Структура CRISPR-кассеты.
С этой кассеты генетическая информация переносится (транскрибируется) на молекулу, известную как CRISPR RNA (crRNA), которая из-за комплементарности к «позаимствованным» у фагов геномным участкам будет при заражении такими паразитами специфично связываться уже с их ДНК, направляя на нее «режущую» нуклеазу Cas.
Ну а дальше: Cas разрежет геном фага, позаимствованные из него ДНК-фрагменты снова встроятся в CRISPR-кассету, став основой «узнавания» таких патогенов и борьбы с ними при последующих заражениях: то есть весь цикл вскоре повторится (более академично и точно см. в подписи к рисунку 4).
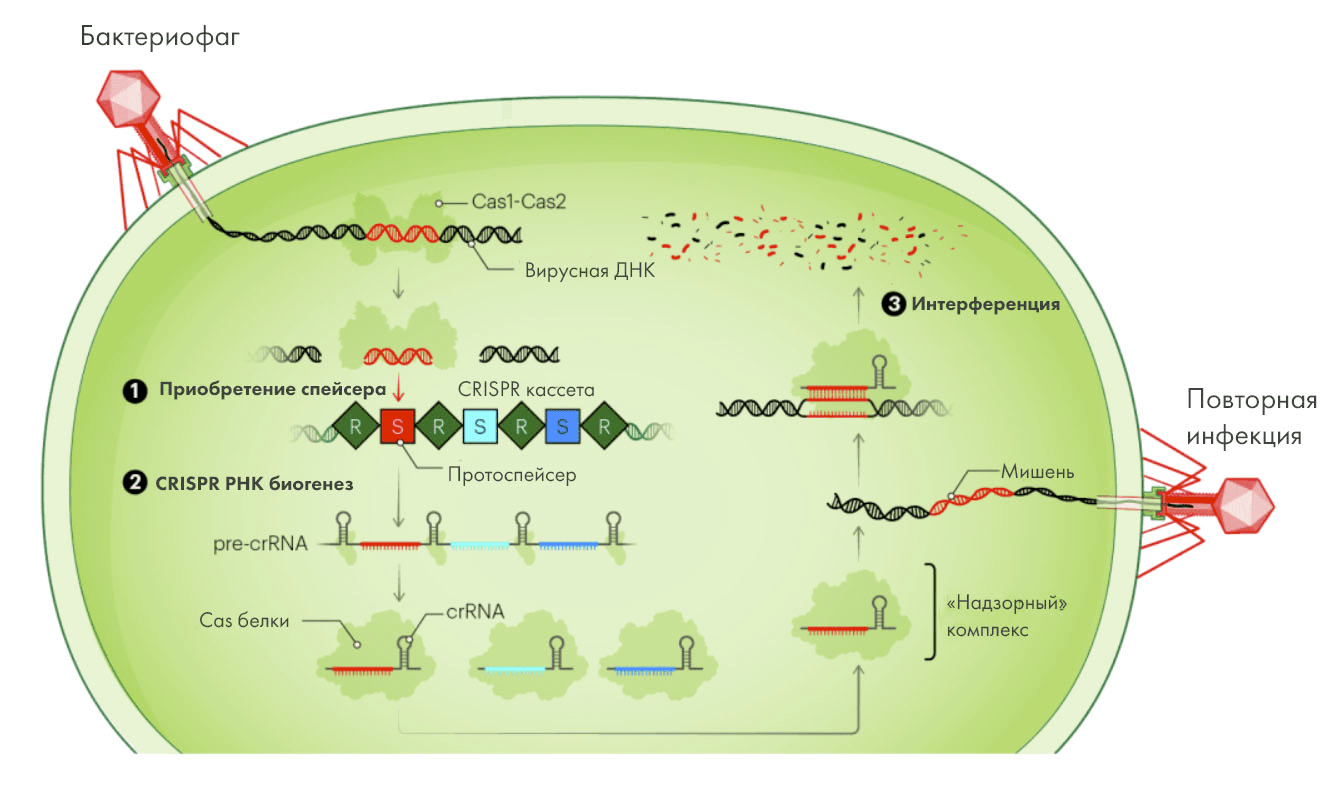
Рисунок 4. Цикл работы системы CRISPR-Cas в бактериальной клетке. 1. Первый этап известен как «приобретение спейсера»: здесь «впрыснутая» в клетку ДНК фага фрагментируется, а вырезанная из нее последовательность, известная как протоспейсер (показана красным) интегрируется в CRISPR-кассету, становясь новым спейсером. 2. На втором этапе (РНК биогенез) с последовательности CRISPR-кассеты транскрибируется длинная пре-crRNA, которая затем «нарезается» (процессируется) в короткие транскрипты crRNA. С геномной ДНК бактерии транскрибируется также транс-активирующая РНК (tracrRNA; на рисунке не показана), отвечающая за активацию эндонуклеазной активности фермента Cas9 (сама crRNA отвечает за связывание с целевой последовательностью «вражеской» ДНК). Обе эти короткие РНК затем связываются с нуклеазой Cas, образуя эффекторный «надзорный» комплекс . 3. На заключительном этапе интерференции crRNА «надзорного» комплекса «сканирует» вторгшуюся ДНК фага на предмет комплементарной нуклеиновой кислоты-мишени, и при точном совпадении мишень в конечном итоге разрушается нуклеазой Cas. Новые фрагменты чужеродной ДНК могут далее стать протоспейсерами, а затем и включится в CRISPR-кассету (то есть весь цикл пойдет на новый круг).
Innovative Genomics, рисунок адаптирован
Как CRISPR приспособили для редактирования генома?
CRISPR обнаружили в геноме кишечной палочки еще в 1987 году, но тогда еще функция ее была ясна не до конца, и ученым потребовалось немало времени, чтобы понять, что тут к чему и «с чем это едят». Только в 2006 году в статье научной группы одного из самых известных биологов российского происхождения Евгения Кунина было сделано предположение о роли CRISPR-Cas в бактериальном иммунитете [16], ну а дальше дело было «за малым». Осталось лишь определить, можно ли (и как?) использовать этот элегантный механизм для редактирования генов.
«Редактируй то, редактируй это»
Когда роль и механизмы CRISPR стали более-менее ясны, наступил новый этап. В попытках приспособить эту систему к нуждам человека работали многие , и вот, объединенными усилиями Эмманюэль Шарпантье и Дженнифер Даудны, удалось наконец «докрутить» этот созданный природой инструмент до пригодного в генном редактировании состояния.
про историю CRISPR мы тут рассказываем буквально «пробросом»: на самом деле в ней много этапов, оставленных здесь за скобками. Кто хочет подробнее во всем этом разобраться, приглашаем ознакомиться со статьей: «CRISPR-эпопея и ее герои» [17].
Если опустить некоторые детали, суть работы Шарпантье и Даудны свелась к следующему : «изъяв» из бактерии Streptococcus pyogenes основные рабочие блоки бактериального иммунитета и охарактеризовав их, они пришли к выводу о необходимости некоторой модификации данной системы. И сделали они это так: главный «режущий» инструмент — нуклеаза Cas9 — была оставлена без изменений, а вот направляющая РНК (crRNA) и ее «помощница» транс-активирующая РНК (tracrRNA) были сшиты в единую молекулу — single-guide RNA (sgRNA).
За проделанную ими работу эти выдающиеся исследователи получили Нобелевскую премию, что говорит об особой значимости данной технологии: «РНК, ножницы, геномы: объявлены лауреаты Нобелевской премии по химии 2020» [18].
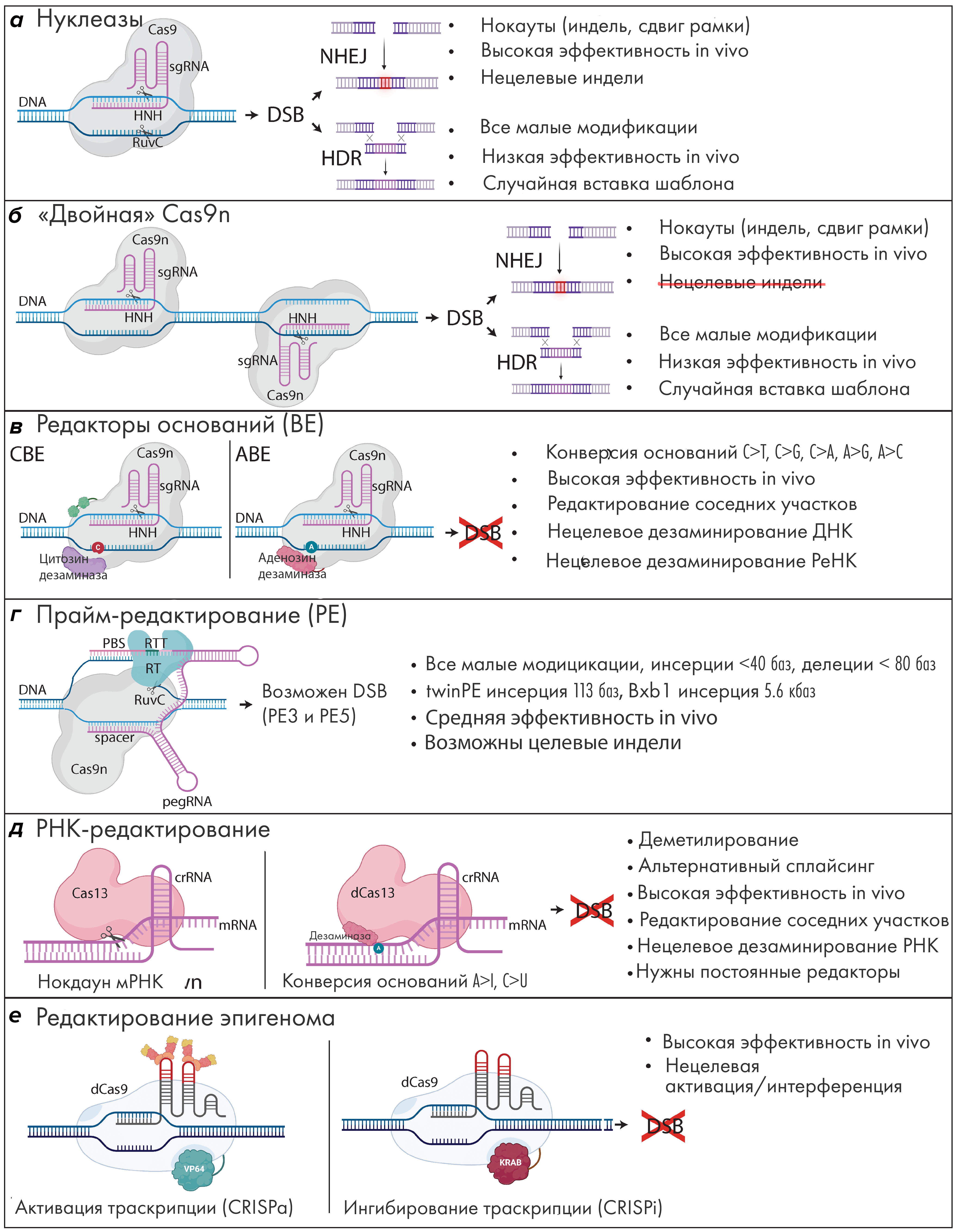
Рисунок 5. Сравнение инструментов редактирования генома семейства CRISPR. (а) Имея два нуклеазных домена, Cas9 «садится» сразу на две цепи ДНК и расщепляет их обе, создавая тем самым двойной разрыв. Затем он обычно восстанавливается с помощью подверженного ошибкам пути негомологичного соединения концов или более точной гомологичной рекомбинацией (гомологически-направленной репарацией). (б) «Двойная» Cas9n (один каталитический домен у каждой инактивирован) с двумя sgRNA создает два надреза поблизости на противоположных цепях, в результате чего получается двойной разрыв (вероятность возникновения нецелевых инделей здесь меньше, чем у классической CRISPR). (в) Редакторы оснований (CBE или ABE) включают в себя Cas9n, слитый с соответствующей дезаминазой, а также sgRNA для запуска различных типов конверсий оснований, без образования двойных разрывов. (г) Прайм-редактирование (PE): это Cas9n в сочетании с pegRNA для формирования различных типов модификаций ДНК. (д) РНК-редактирование: crRNA объединяется с Cas13 для разрушения целевой мРНК или с dCas13, слитым с цитозиновой или аденозиновой дезаминазой, для стимуляции конверсий оснований, без DSB. (е) Редактирование эпигенома: транскрипция целевых генов может быть повышена с помощью dCas9-VP64 или понижена с помощью dCas9-KRAB.
Расшифровка сокращений. Cas: белок, связанный с кластеризованными регулярно расположенными короткими палиндромными повторами (то есть с CRISPR). dCas: «мертвый» Cas; sgRNA:одиночная направляющая РНК; ДНК: дезоксирибонуклеиновая кислота; HNH: домен гистидина-аспарагина-гистидина; RuvC: домен варианта С эндонуклеазы RusA; DSB: двухцепочечный разрыв; NHEJ: негомологичное соединение концов; HDR: гомологически-направленная репарация; indel: небольшая вставка или делеция; CBE: цитозиндезаминаза; ABE: аденозиндезаминаза; PBS: сайт связывания праймера; RT: обратная транскриптаза; RTT: шаблон для RТ; pegRNA: направляющая РНК для прайм-редактирования; bp: пара оснований; kb: килобаза; CRISPRa: CRISPR-активация; CRISPRi: CRISPR-интерференция; crRNA: CRISPR-РНК; мРНК: матричная РНК; a/i: активация/интерференция; A: аденин; T: тимин; G: гуанин; C: цитозин; I: инозин.
[19], рисунок адаптирован
Собственно, открытие возможности простого и недорогого синтеза sgRNA, специфичной под любую ДНК-последовательность, и положило начало всемирному использованию CRISPR-Cas9 для целевого редактирования генов, и вот почему:
В чем преимущества CRISPR-Cas9 и ее продвинутых аналогов?
В CRISPR-Cas9 специфичность нацеливания полностью диктуется ее короткой «направляющей» — sgRNA; а ее последовательность можно полностью «кастомизировать». На практике это означает, что благодаря настраиваемой sgRNA всю систему CRISPR можно направить на редактирование любой части генома, что само по себе большое преимущество. Кроме того, на эффективность редактирования существенно влияет способ связывания и расщепления двух нитей ДНК: а ведь он принципиально различен для CRISPR, ZFN и TALEN.
Дело в том, что нуклеазы на базе Fok1 для расщепления обеих нитей требуют «воссоединения» (димеризации) фрагментов своих каталитических доменов─мономеров (рис. 2), и тут таится опасность. Ведь если хотя бы один из направляющих носителей (белковых комплексов) «сядет» на нецелевой сайт (а такое бывает), связывание его каталитического домена с таким же от второй нуклеазной единицы разрежет цепь в совсем ненужном исследователям месте. Для ZFN и TALEN — это один из механизмов ошибочного редактирования, приводящий к их цитотоксичности.
Нечто подобное вряд ли возможно для CRISPR, ведь нуклеаза Cas9 генерирует двойные разрывы без гомодимеризации мономеров, имея в своем распоряжении сразу два домена расщепления для обеих цепочек ДНК (рис. 5а).
Впрочем, у CRISPR есть другие механизмы ошибочного редактирования — в этом смысле система далеко не идеальна. Обычно связаны они с тем, что «воссоединение» созданных нуклеазой Cas9 разрывов берут на себя внутренние системы репарации клетки, реализующие сшивание двумя описанными выше методами: негомологичным соединением концов и гомологичной рекомбинацией. И тут есть нюанс: как клетке ни «подсовывай» ДНК-шаблон для репарации, быть полностью уверенным, что дело кончится гомологичной рекомбинацией, никак нельзя... Дело в том, что оба известных способа репарации между собой конкурируют, и так уж выходит, что менее точный из них (негомологичное соединение концов) часто выигрывает. Связано это с тем, что он всегда «под рукой» — активен на протяжении всего клеточного цикла; в то время как гомологичная рекомбинация может происходить лишь на поздних его этапах: во время подготовки к делению на S-фазе и G2-стадии. Приводит все это к тому, что при редактировании генома могут возникать уже описанные выше индель-мутации (инсерции и делеции), и если по своему размеру они не будут кратны трем нуклеотидам, это может вызвать сдвиг рамки считывания. В этом случае результатом перевода информации из ДНК в РНК во время белкового синтеза станет укороченный транскрипт, который, скорее всего, будет разрушен (расщепится на составляющие). То есть вместо целевого редактирования получаем «нокаут» …
Стоит отметить, что это «несчастье» можно использовать во благо: отключив таким способом ненужный ген, добиться терапевтического эффекта. Например, единственная пока одобренная терапия на основе «генных ножниц» работает именно по такому механизму. Ниже мы рассмотрим ее, а также другие подобные примеры.
И все же, несмотря на эти недостатки, CRISPR стала ощутимым прорывом в сравнении с более ранними системами во многом за счет своей большей практичности и легкой сборки. Обширные библиотеки sgRNA позволяют быстро подбирать подходящие направляющие для нацеливания на нужные геномные последовательности, — а значит оперативно собирать всю систему генной редакции под каждый конкретный случай. Такая беспрецедентная простота использования позволила апробировать систему для редактирования геномов самых разных организмов (включая человеческий), на практике подтвердив широкую применимость и эффективность. Все это довольно быстро позволило занять лидирующие позиции в клинических исследованиях (как мы увидим) и даже выйти на уровень одобрения для применения у людей (в качестве лекарственного препарата).
Ну а над увеличением точности редактирования все же пришлось еще поработать, и вот что из этого вышло…
За пределами классической CRISPR
Делая один надрез: ДНК-никазы
Для снижения нецелевых событий редактирования Cas9 модифицировали, превратив ее в ДНК-никазу — то есть в нуклеазу, способную к расщеплению лишь одной из нитей ДНК (Cas9n).
Ну а поскольку для редактирования все же нужен двойной разрыв, Cas9n взяли в двух экземплярах, к ним же прилагая и две направляющие sgRNA (рис. 5б). Преимущество тут в том, что отдельные разрывы восстанавливаются с высокой точностью, значительно уменьшая вероятность ошибок. В частности, одна из вариаций Cas9n — D10A — в экспериментах особо эффективно снижала индель-мутации в клеточных линиях зигот мышей [19].
Редактирование ДНК-оснований: Base Editing (BE) —
инновационный инструмент, в котором Cas9n соединена с ферментом дезаминазой, ответственным за прямую «конверсию» одних ДНК-оснований в другие. Например, редакторы цитозиновых оснований (cytosine base editors — CBEs) провоцируют переход цитозинов в тимины; аналогичные адениновые редакторы (ABEs) — переход аденинов в гуанины; ну а есть еще и такие, что способны триггерить одновременно оба этих перехода. И даже больше: есть редакторы, умеющие переводить цитозины как в гуанины, так и в аденины, а потом и обращать подобную конверсию вспять [19].
В целом, BE быстро показали свой потенциал в коррекции мутаций, ассоциированных с разными заболеваниями (далее мы еще рассмотрим это). А поскольку они не приводят к двойным разрывам ДНК, то и инделей почти не вызывают (рис. 5в).
Однако, несмотря на немалый потенциал, BE все же не лишены недостатков и ограничений. В частности, их рабочий фермент дезаминаза имеет строго определенное «окно редактирования»: диапазон из нескольких нуклеотидов, в котором он может эффективно модифицировать нужное основание. Казалось бы: это же отлично! Редактор будет действовать в целевом диапазоне — а значит, сработает точечно. Но не все так просто: в пределах своего узкого окна BE может изменять и близлежащие к целевому участку нуклеотиды, приводя к так называемым мутациям свидетеля («bystander mutations»). Более того, несмотря на высокую специфичность, редакторы оснований могут действовать и за пределами «окна редактирования», если обнаружат участок, очень похожий на это самое окно [19].
Добавим, что BE направлен в основном на однонуклеотидные замены, а потому практически бесполезен, если требуется вставить или удалить более крупный ДНК-фрагмент (а значит — терапевтическая применимость тут ограничена).
«Прайм»-редактирование: Prime Editing (PE)
В сравнении с описанными выше системами редактирования PE находится на новом уровне, обеспечивая большую точность и меньшее количество ошибок. Этот инструмент может выполнять всевозможные небольшие правки (рис. 5г) и почти не приводит ни к bystander-, ни к off-target-мутациям; а индели также ему не свойственны (за исключением некоторых его вариантов, см. ниже). Причина всего этого в особом механизме действия — кстати, довольно хитроумном. Дело в том, что вместо направляющей sgRNA тут используют pegRNA, содержащую в себе также матричную последовательность для внесения в геном соответствующих целевых правок.
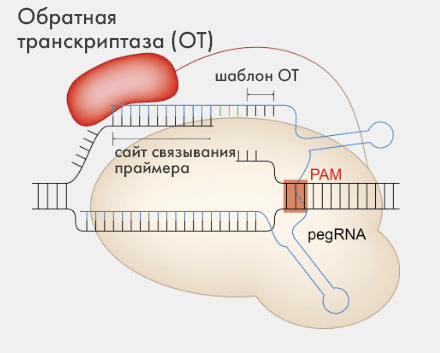
Рисунок 6. Общая схема редактирования с помощью PE. Нуклеаза Cas9n, садясь на геномную ДНК, разрезает одну из ее цепочек, после чего обратная транскриптаза по шаблону pegRNA достраивает оборванную цепь, приводя к ее восстановлению (но уже с новым геном). Дальнейшие событие разворачиваются в зависимости от типа используемого PE (см. пояснение в тексте ниже). Расшифровка сокращений: PAM — protospacer adjacent motif; pegRNA — prime editing guide RNA.
CRISPR Rgen tools, рисунок адаптирован
Погодите-ка, ведь для шаблона редактирования обычно берут цепочку ДНК, да и геном представлен именно этой нуклеиновой кислотой. Причем же здесь направляющая РНК? Вот в этом один из секретов! «Набор для генной редакции» в PE содержит позаимствованную у вирусов обратную транскриптазу, а фермент этот, как известно, умеет переписывать генетическую информацию в обратном порядке (с РНК на ДНК), что и позволяет использовать pegRNA в качестве шаблона для генетических правок.
В целом все это работает в клетке следующим образом. Когда нуклеаза Cas9n садится на геномную ДНК, она расщепляет одну из ее цепочек; после этого в образовавшуюся брешь нужно вставить новый ген, синтезирующийся обратной транскриптазой по матрице шаблона из pegRNA. Именно так сама редакция и происходит: на выходе мы имеем уже одну обновленную ДНК-цепь с исправленным генетическим дефектом (рис. 6). Далее наступает очередь второй ДНК-цепочки, и здесь есть разные варианты.
Дело в том, что существует множество модификаций PE, каждая из которых обладает разными свойствами. Что касается PE, PE2 и PE4 — они разрезают и затем модифицируют только одну цепь ДНК, вторую же «берут на себя» внутриклеточные системы репарации, призванные в данном случае устранить возникшую «асимметрию». Для этого они могут либо вырезать неотредактированную цепь, достроив на ее месте новую по принципу комплементарности (в этом случае редактирование генома будет успешным); либо же первая измененная цепь будет удалена (здесь уже редактирование не выполнено) .
То есть, как видим, есть существенный минус и у PE — он попросту срабатывает не всегда… Впрочем, PE4 (как, кстати, и PE5, см. ниже) содержит особые белки, способные ингибировать ошибочную репарацию (mismatch repair inhibiting proteins), что снижает вероятность подобных событий [19].
Если же речь о PE3 и PE5, то они надрезают и вторую нить ДНК, что улучшает ее репарацию и в целом повышает эффективность редактирования. Однако варианты, разрезающие обе нити ДНК, страдают теми же «болезнями», что и традиционный CRISPR: из-за формирования двойных разрывов могут спровоцировать нежелательные индели [19]. Существуют также и некоторые другие экспериментальные разновидности «праймовых» редакторов: PEMAX — с увеличенной скоростью редактирования; PE6 — со значительно повышенной эффективностью, twinPE — со способностью интегрировать в геном более крупные гены (см. ниже).
В целом, большинство экспериментальных PE имеют как свои достоинства, так и недостатки, а что из них лучше — покажет только время.
«Мостиковое» редактирование: Bridge editing (BrE)
Следующая экспериментальная технология, которую хотелось бы рассмотреть — Bridge editing: пока что она на начальных этапах изучения, но сама по себе сулит завораживающие возможности в будущем, представляя совершенно уникальный инструмент с принципиально инновационным механизмом действия.
Новая технология редактирования использует естественную способность мобильных генетических элементов, известных также как «прыгающие гены» (jumping genes), «вырезать и вставлять себя» по всему геному . Один из них — IS110 — обладает совершенно особыми свойствами: «выпрыгивая» из генома, он образует кольцевую структуру; причем, создавая такую «петлю», этот элемент формирует и промотор — последовательность, с которой может начаться белковый синтез (рис. 7).
Про «прыгучие гены» на «Биомолекуле» также написано уже немало: кому интересны подробности, приглашаем ознакомиться с соответствующим разделом.
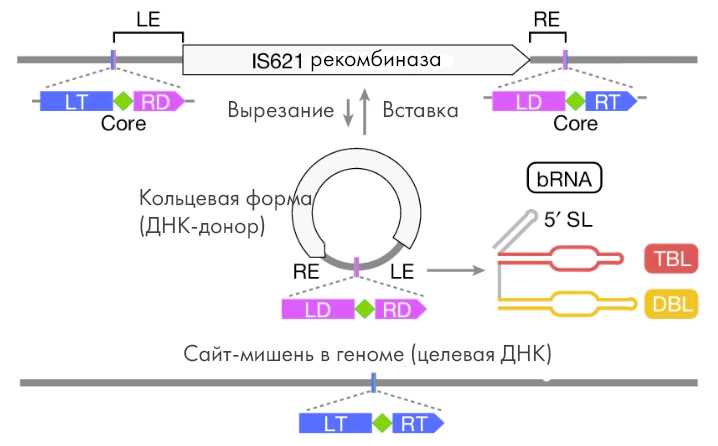
Рисунок 7. Формирование bridge RNA. Когда мобильный генетический элемент IS110 выходит из своего положения в геноме, его концы сближаются и соединяются вместе, образуя замкнутый круг. Это событие называется эксцизия (вырезание), и в ходе него в составе кольцевой ДНК формируется также активный промотор. С этого-то участка и начинается считывание ДНК-последовательности с элемента IS110 (транскрипция), результатом чего и становится «мостиковая» РНК. Расшифровка сокращений: LE — левый конец, RE — правый конец, LT — левая мишень, RT — правая мишень, LD — левый донор, RD — правый донор, SL — шпилька (stem loop), TBL — target binding loop (петля, связывающая мишень), DBL — donor binding loop (петля, связывающая донор), bRNA — мостиковая РНК.
[20], рисунок адаптирован
Продуктом такого синтеза в данном случае является «мостиковая» РНК (bridge RNA; bRNA) — она некодирующая, так что дальше транскрипции белковый синтез не идет. bRNA очень похожа на «обычную» направляющую (gRNA), но может распознать не одну цепь ДНК, а сразу две: целевой участок для редактирования и новый ген из донорской ДНК. Затем она привлекает фермент рекомбиназу, который и осуществляет фактическое редактирование [21]. Он связывается с bRNA и катализирует рекомбинацию между донорской ДНК (содержащей целевой ген) и геномным сайтом вставки, что и приводит к желаемому результату: требуемая последовательность интегрируется в нужное место [20].
bRNA можно запрограммировать на вставку, «вырезку» или инверсию самых разных геномных последовательностей, а потенциал тут выше, чем у «обычных» CRISPR: можно вставить последовательность длиной до 5000 пар оснований .
Это примерно соответствует заявленному для другой вышеупомянутой экспериментальной технологии — twinPE (два этих метода немного схожи). «Двойное» прайм-редактирование использует сразу две направляющие pegRNA в сочетании с сайт-специфической сериновой рекомбиназой, что позволяет, не делая двойных разрывов, интегрировать в геном материал размером >5000 пар оснований, а также инвертировать последовательности величиной до 40 000 пар оснований; удалять же из генома последовательности ДНК он может в диапазоне от 50 до >100 000 пар оснований (рис. 5г). Для сравнения: «обычный» PE может делать точечные вставки размером лишь до 40 пар оснований и делеции не более 80 пар [22].
При этом у BrE отсутствуют риски ошибочного редактирования из-за образования двойных разрывов — их она попросту не формирует. Да и весь механизм здесь проще и точнее: редактирование осуществляется самой BrE всего в один шаг, из-за чего не требуется подключение репарационных систем клетки (и нет связанных с этим рисков). Конечно пока что эта технология все еще очень «сырая» (апробирована лишь на бактериях), но в случае «докрутки» может занять важное место в ряду редактирующих инструментов (и даже «подвинуть с пьедестала» многие из них).
РНК-редактирование: RNA-editing (RE)
заботится о том, чтобы ненароком не дестабилизировать геном, предлагая направить всю мощь редактирующих инструментов на изменения не ДНК, а матричной РНК. Терапевтический эффект тут связан с изменением в «конечном продукте» — то есть, в белковой молекуле. А этого можно достичь, внося изменения как в ДНК, так и в синтезируемую на ее матрице РНК. В последнем случае геном останется нетронутым, а потому если с редактированием что-то пойдет не так, последствия должны быть менее плачевными.
Так-то оно так, только есть недостаток и у такого подхода. Дело в том, что мРНК — продукт промежуточный и временный, короткоживущий. Поэтому здесь для достижения стойкого терапевтического эффекта требуется непрерывно экспрессировать в клетке всю редактирующую РНК машинерию, а это само по себе несет риски нецелевых эффектов. Либо придется вводить продукт многократно, что снижает его привлекательность по сравнению с подходами на основе редактирования ДНК, которые обещают излечение одним уколом.
Несмотря на это, RE-таки сумели «приспособить» к редактированию клеток человека, и сейчас уже эту технологию даже используют в клинических исследованиях (причем подход здесь инновационный и крайне интересный, см. ниже).
Редактирование эпигенома: Epigenome editing —
это в каком-то смысле логическое продолжение предыдущего подхода: попытка изменить экспрессию генов, не затрагивая при этом первичную последовательность ДНК (дабы не дестабилизировать геном). Для этого вносятся мутации в оба расщепляющих нуклеазных домена Cas9, с целью лишить ее целевой ферментативной активности.
В итоге получаем такую «мертвую» нуклеазу (death Cas9 — dCas9): этот фермент уже не «режет», но по-прежнему обладает уникальной способностью «садиться» на ДНК (что и используют ученые). С dCas9 можно соединять различные эффекторные белки, вызывающие эпигенетические модификации и контролирующие экспрессию целевых генов. Это включает в себя такие классические для эпигенетики изменения, как модификации гистонов и метилирование ДНК, что потенциально может помочь в лечении тех заболеваний, на которые такие факторы влияют (рис. 5е).
Редактирование эпигенома не сразу «вышло из тени» доклинических исследований, хотя мощный потенциал этого вида терапии был понятен уже довольно давно. Сейчас уже этот инструмент начали изучать и в клинических испытаниях, но поскольку мы лишь в начале этого пути, перспективы его одобрения для использования у людей пока ясны не до конца.
Примеры использования генного редактирования в медицине
Итак, мы смогли убедиться, что биотехнологии развиваются стремительно, а генные редакторы начинают играть все более важную роль в поиске медицинских решений для заболеваний с неудовлетворенной потребностью (рис. 8).
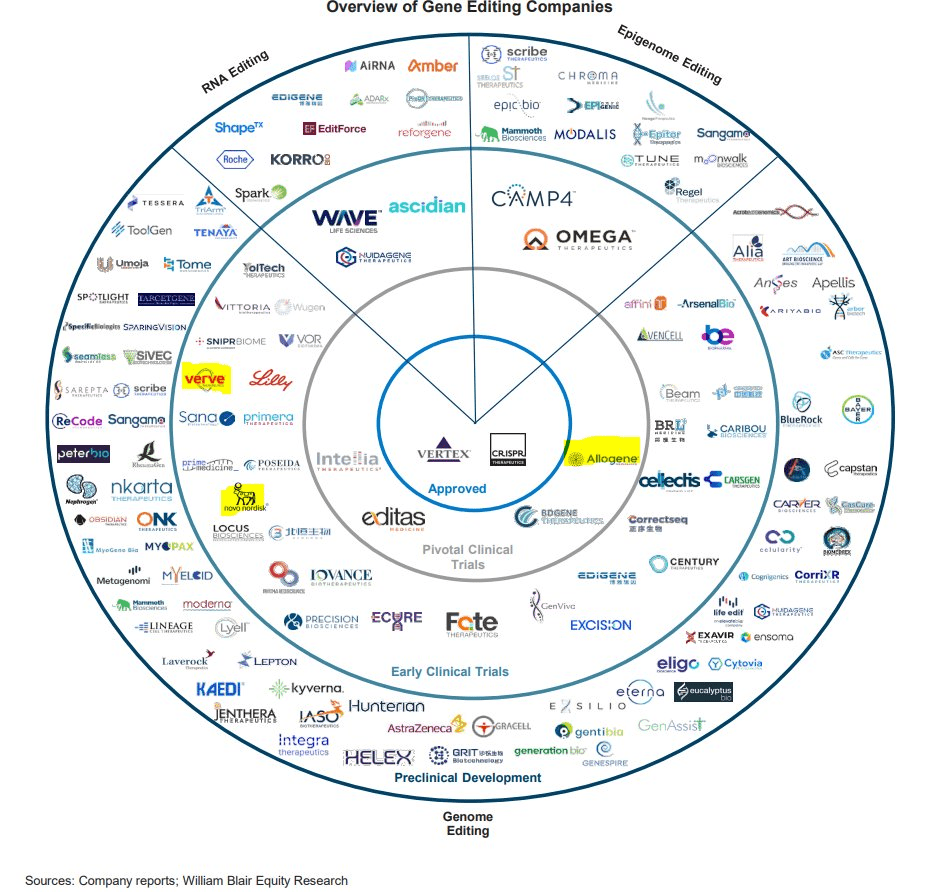
Рисунок 8. Ландшафт клинических испытаний геномного редактирования. Концентрические круги отражают нахождение терапий на стадиях клинических исследований: внешний круг — фаза 1; и далее по восходящей до фазы 3; по центру единственное одобренное лечение, прошедшее все стадии «клиники». Как видно из картинки, компании в основном занимаются «традиционным» геномным редактированием, хотя уже есть примеры исследований Epigenome и RNA editing, дошедших даже до второй фазы клинических исследований (два выделенных сверху сектора). Упоминаемые далее компании подчеркнуты красной чертой.
отчет инвестиционного банка William Blair
Ниже сравним некоторые продукты игроков на рынке генного редактирования, предлагающих новаторские подходы к решению проблем в области терапии неизлечимых (пока что) заболеваний; оценим перспективы и потенциал каждого из них.
Первая ласточка: Casgevy (CRISPR Therapeutics и Vertex)
Это пока что единственная одобренная терапия, основанная на генном редактировании. Мы уже неоднократно писали про нее: еще с момента, когда она находилась на стадии клинических исследований фаз 1/2 [25], и до этапа подачи заявки на одобрение для использования у людей [26]. Собственно одобрение после этого не заставило себя долго ждать: в ноябре 2023 года Casgevy получила статус Approved сначала в Соединенном Королевстве, а в декабре того же года и также в январе 2024-го (последовательно по двум разным показаниям) — и в США.
Сильно не повторяясь, опишем самую суть этого лечения: молекулярные ножницы CRISPR-Cas9 тут «отправляют» в клетки крови, выделенные у пациента, чтобы «нокаутировать» там ген BCL11A, отвечающий за производство белка-репрессора, подавляющего синтез фетального гемоглобина. Такой интересный «детский» вариант гемоглобина начинает вырабатываться еще внутриутробно, но после рождения постепенно замещается «взрослым» гемоглобином. Оказалось, что если у взрослых отключить ген-«подавитель» BCL11A, их организм снова начнет выработку «детского» гемоглобина, компенсируя недостачу его взрослого аналога.
Поскольку и β-талассемия, и серповидно-клеточная анемия вызываются мутациями в гене гемоглобина и связаны с его недостаточностью, Casgevy оказался применим сразу по двум этим показаниям (по которым и был одобрен).
Одобрения были получены по результатам клинических исследований фазы 3, показавших впечатляющие результаты: более 95% больных серповидно-клеточной анемией избавились от вазооклюзионных кризов ; ну а из страдающих β-талассемией больше 90% «пожизненно приговоренных» к постоянным переливаниям крови больше в этом не нуждались.
Одна из основных проблем при этой болезни: из-за закупорки капилляров деформированными эритроцитами возникают эпизоды внезапной и мучительной боли, что значительно снижает качество жизни. Больше об этом — в статье «Как болезни крови генной терапией лечили» [26].
Несмотря на эти более чем впечатляющие результаты, существенным недостатком Casgevy остается доступ к ней пациентов. Дело в том, что возможности получать ее ограничены как сугубо экономическими (это лечение оценивается примерно в $2 млн на одного больного), так и чисто технологическими затруднениями, ведь терапию эту довольно сложно производить и вводить пациентам. Немногие лечебные учреждения в США и Великобритании обладают техническими возможностями и опытом для организации в стационаре соответствующих условий. Связано это с тем, что Casgevy — терапия ex vivo: клетки пациента извлекаются из организма, редактируются, контролируются по качеству в специальной лаборатории, а затем возвращаются обратно после прохождения больным интенсивной химиотерапии (она тоже привносит существенные ограничения, так как не все пациенты могут ее хорошо перенести).
Возможным решением всех этих проблем может стать разработка (по тем же показаниям) терапии in vivo: то есть лекарства, доставляемого в клетки пациента прямой инъекцией . Такой подход для лечения серповидно-клеточной анемии изучает сейчас Beam Therapeutics, чей продукт на базе BE уже находится в фазе 1/2 клинических испытаний. Вполне возможно, что у Beam все получится, ведь определенного успеха они уже добились с препаратом аналогичного механизма действия (только для лечения дефицита ɑ1-антитрипсина, об этом ниже).
Если из сказанного все еще не до конца ясно, чем отличаются подходы ex vivo и in vivo, приглашаем ознакомиться с самой первой базовой статьей этого спецпроекта: «Генная терапия: познакомьтесь с лекарствами будущего» [25]: в ней все нужные азы разбираются достаточно подробно.
NTLA-2001 (Intellia Therapeutics) —
препарат на основе технологии CRISPR-Cas9, созданный для лечения наследственного транстиретинового амилоидоза (hATTR). Заболевание это вызывается мутацией в гене TTR, приводящей к образованию и накоплению кодируемого этим геном аномального белка транстиретина, способного агрегировать, образуя токсичные отложения амилоидных фибрилл в органах и тканях ; из-за чего зачастую поражаются сердце и нервы, приводя к прогрессирующей сердечной недостаточности, невропатиям и другим серьезным осложнениям. Недуг этот хоть и встречается редко, протекает тяжело, приводя к быстрому ухудшению и лишая возможности полноценной жизни (нередко заканчиваясь смертью).
Мы уже писали про эту болезнь в статье «Руку, ногу и сердце: редкий АТТR-амилоидоз» [27]; а также рассказывали и про другие нейродегенеративные заболевания, часто связываемые с накоплением амилоидоза: «На руинах памяти: настоящее и будущее болезни Альцгеймера» [28], «Лечение болезни Паркинсона нейротрофическими факторами: есть ли свет в конце туннеля?» [29].
Эффективных способов лечения hATTR долгое время не существовало, прогноз пациентов был весьма печальный, но не так давно одобрили тафамидис (малая молекула, стабилизирующая дефектный транстиретин), а также ряд препаратов на основе РНК-интерференции , что позволило улучшить прогноз и течение этой опасной болезни [27].
об одном из этих препаратов — Патисиране — мы уже подробно рассказывали: «Первый препарат на основе РНК-интерференции: смерть мРНК — жизнь пациенту!» [30]; также последние данные об исследованиях препарата Вутрисиран см. в обзоре: «Биофарма в первом полугодии 2024: неслыханные генные новости, новые показания GLP-1, непокорный Альцгеймер» [31].
Все же имеющееся на сегодня лечение имеет довольно ограниченную эффективность, позволяя стабилизировать заболевание и обеспечивать симптоматическое облегчение (а также улучшая выживаемость — для такого опасного заболевания этого немало!); то есть потребность до определенной степени остается все же неудовлетворенной; NTLA-2001 имеет потенциал улучшить данную ситуацию.
Механизм действия этого препарата следующий: CRISPR-Cas9, доставляемый в организм липидными наночастицами, достигает печени, где преимущественно и продуцируется патологическая форма транстиретина. Делая точечный надрез в кодирующей данный белок последовательности, нуклеаза Cas9 оставляет разрыв «на милость» репарационных систем. А поскольку ДНК-шаблон в данной системе не предусмотрен, негомологичное соединение концов вполне предсказуемо приводит к нокауту гена, снижая тем самым уровень аномального белка, причем довольно эффективно (рис. 9).
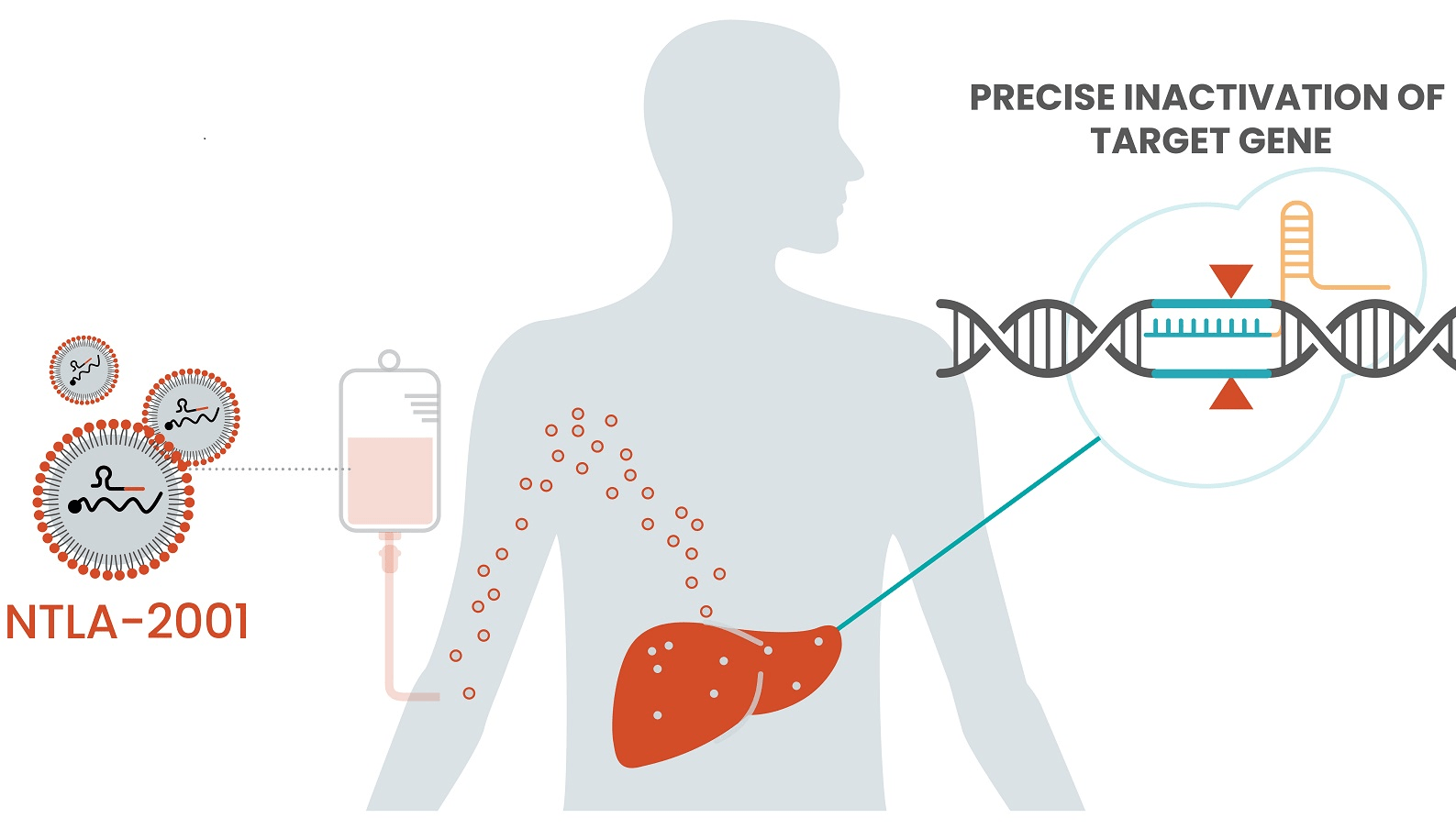
Рисунок 9. Препарат NTLA-2001 состоит из компонентов CRISPR, заключенных в липидные наночастицы, с помощью которых они доставляются в клетки печени, где и осуществляют свое терапевтическое воздействие. Лечение осуществляется в виде однократной дозы внутривенно; хотя было показано, что возможно и повторное дозирование.
Результаты клинических испытаний показали, что уже после однократного введения уровень токсичного белка в крови пациентов снижается более чем на 80%; эти результаты сохраняются длительно, и большинство участников хорошо переносят препарат.
Все это в целом позволяет оптимистично смотреть на перспективы NTLA-2001, находящегося ныне в фазе 3 клинических исследований. Возможно, совсем скоро это лекарство будет одобрено и откроет возможности улучшенного и более длительного контроля над болезнью .
У Intellia есть также хорошие данные по кандидату NTLA-2002 — лечению наследственного ангионевротического отека. Препарат этот похож на NTLA-2001: это также in vivo CRISPR-терапия в липидных наночастицах, «ломающая» ген одного из белков, задействованных в патогенезе (калликреина). По многообещающим данным исследований фазы 2 зафиксировано 75%-снижение приступов опасных для жизни отеков в течение 16-недельного периода после получения терапии. NTLA-2002 благополучно переходит в фазу 3.
BEAM-302 (Beam Therapeutics)
Новая терапия BEAM-302 разработана компанией Beam Therapeutics для лечения довольно опасного редкого наследственного заболевания — дефицита ɑ1-антитрипсина (AATD). Это состояние вызвано мутацией в гене SERPINA1, что приводит к неправильному сворачиванию кодируемого им фермента ɑ1-антитрипсина (ААТ) и его недостаточности.
ААТ обычно секретируется клетками печени, перемещаясь затем в легкие, где защищает здоровые ткани от фермента эластазы, выделяемого лейкоцитами для борьбы с инфекциями. Однако когда этот белок неправильно свернут, он накапливается внутри клеток печени, в конечном итоге вызывая там воспаление и цирроз. А оставшиеся без его защиты легкие становятся уязвимы для атаки эластазой, что зачастую приводит к их воспалению — и как следствие к неизлечимому заболеванию, известному как хроническая обструктивная болезнь легких (ХОБЛ).
Оба этих страшных последствия для печени и легких как раз и призвана предотвратить терапия BEAM-302. В основе этого лечения тот самый «редактор оснований» BE, доставляемый в клетки печени липидными наночастицами, и эффективно исправляющий там ген SERPINA1, переводя в его дефектной последовательности аденин в гуанин.
Лечебный эффект подтвержден первыми результатами клинических испытаний фазы 1/2: у девяти пролеченных пациентов было показано примерно двукратное (в сравнении с базовым уровнем) увеличение общего белка AAT. Поскольку наряду с этим у них наблюдалось также снижение циркулирующего в крови «дефектного» AAT, логично предположить, что более высокие уровни связаны как раз с продуцированием правильно свернутого белка.
Клинические данные также указывают на хорошую переносимость данной терапии, отсутствие серьезных нежелательных явлений и отчетливый целевой эффект (выраженный в дозозависимом повышении AAT), что позволяет надеяться на значительное улучшение качества жизни пациентов с тяжелой формой AATD.
И хотя BEAM-302 еще предстоит пройти полный цикл клинических испытаний, эта технология уже рассматривается как серьезный прорыв в сфере генного редактирования, дающий надежду людям с заболеванием, для которого сегодня просто нет другого лечения.
VERVE-101/102 (Verve Therapeutics) —
генная терапия для лечения семейной гиперхолестеринемии (FH) — наследственного заболевания, ведущего к высокому уровню «плохого» холестерина (ЛПНП) и, как следствие, к повышенному риску сердечно-сосудистых заболеваний (ССЗ). Такой препарат теоретически мог бы стать полезен и для самых обычных людей, поскольку повышенные риски ССЗ после определенного возраста характерны для очень многих (наверное, не будет преувеличением сказать, что для большей части человечества); а VERVE-101 как раз нацелен на устранение одной из основных причин подверженности этими заболеваниями.
Причина же эта кроется в повышенном уровне ЛПНП, грозящем различными сердечно-сосудистыми недугами: атеросклерозом, инфарктом, инсультом, ишемической болезнью сердца и другими осложнениями. Для пациентов с FH такие риски особенно велики ввиду наличия у них различных мутаций (их известно более двух тысяч), так или иначе нарушающих контроль холестеринового обмена, приводя к его повышенным уровням и вытекающим из этого последствиям. Особо интересны в этом смысле мутации гена PCSK9, ведь его белковый продукт играет немалую роль в развитии ССЗ и у формально генетически здоровых людей (рис. 10).
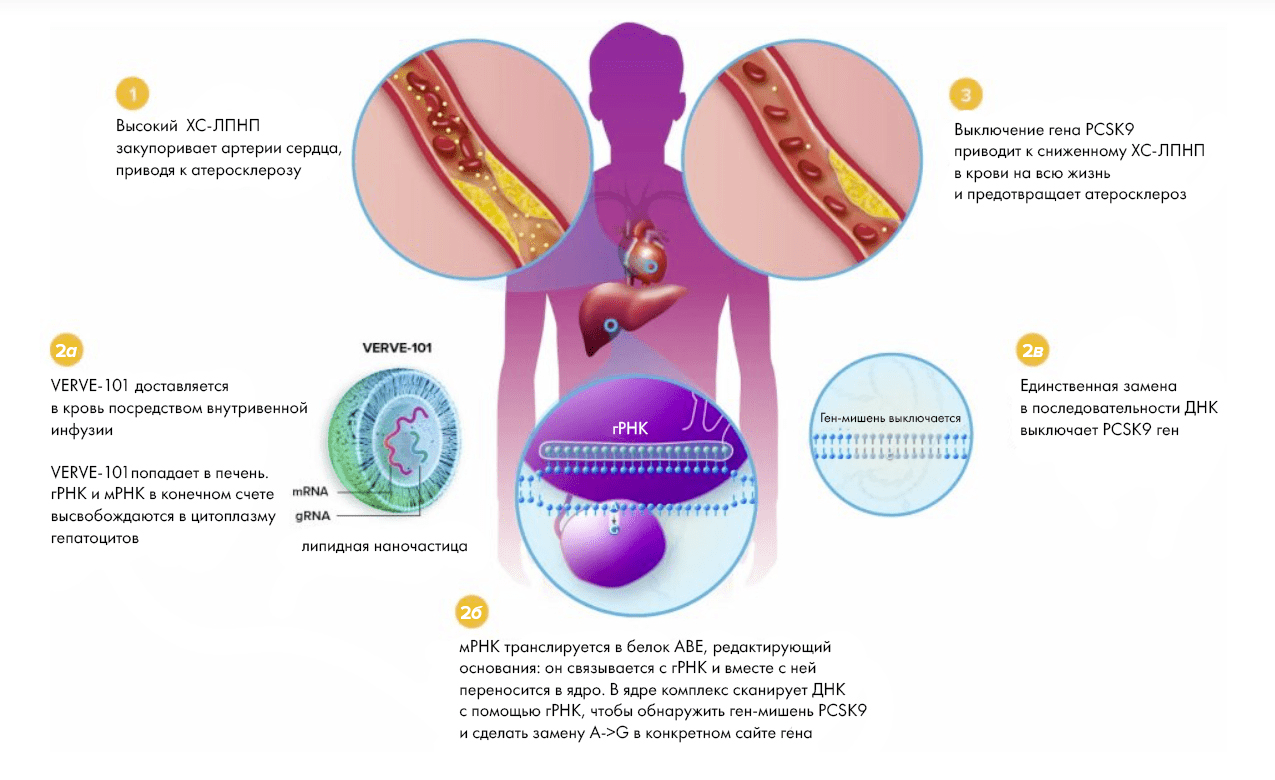
Рисунок 10. VERVE-101 отключает ген PCSK9, участвующий в метаболизме холестерина. Белковый продукт этого гена взаимодействует в организме с особым рецепторным белком на поверхности клеток, отвечающим за связывание молекул липопротеинов низкой плотности («плохого холестерина»), что приводит к деградации этих важных рецепторов. Вследствие этого клетки с разрушенным рецептором больше не могут связывать и поглощать (с последующей утилизацией) «плохой холестерин», что неминуемо повышает его уровни в организме (со всеми вытекающими). VERVE-101 представляет собой компоненты редактора оснований ABE, заключенные в липидные наночастицы, которые при проникновении в клетки печени (а именно в них в основном утилизируется холестерин) меняют в последовательности гена PCSK9 аденин на гуанин, что приводит к отключению этого гена (а значит и нивелированию вызванных его деятельностью разрушительных последствий). Поскольку это лекарство использует технологию BE, не ведущую к двойным разрывам, теоретически вероятность неточного редактирования здесь меньше, чем при использовании классической CRISPR.
Надо отметить, что у многих людей с семейной гиперхолестеринемией (а такой болезнью страдает примерно каждый 250-й житель планеты) традиционно назначаемые для снижения уровня холестерина препараты (такие как статины) зачастую оказываются недостаточно эффективными, что порождает неудовлетворенную потребность. Ген PCSK9 же оказался очень удачным кандидатом в мишени для создания новой терапии еще более 10 лет назад, когда выяснили, что люди с редкой природной мутацией в этом гене (отключающей его) обладают достоверно сниженным уровнем холестерина.
С тех пор были разработаны как блокирующие белковый продукт PCSK9 антитела, так и препарат на основе РНК-интерференции, подавляющий экспрессию этого «зловредного» гена (Инклисиран). Все это, очевидно, расширило медицинский арсенал для борьбы с ССЗ, однако болезни эти продолжают убивать, оставаясь по сей день основной причиной смертности во всем мире.
Вот почему разработка от Verve представляет собой уникальный кейс: если она будет одобрена для использования у людей по описанному выше редкому показанию, это теоретически может проложить дорогу к гораздо более широкому кругу применения: для профилактики ССЗ и у здоровых людей.
Пока же известные данные клинических испытаний фазы 1 для Verve-101 сообщают следующее: у пациентов наблюдалось достоверное дозозависимое (до 39–55%) нормализующее снижение холестерина ЛПНП. Касаемо переносимости: помимо легких побочных эффектов, наблюдались и тяжелые: у одного из пациентов был сердечный приступ, а у другого — остановка сердца с летальным исходом. Однако события эти были определены как вызванные тяжелой фоновой ишемической болезнью сердца (то есть напрямую с лечением не связанные).
Тем временем, Verve опубликовали данные исследований и для своей «второй ласточки»: Verve-102. Эта терапия во многом схожа с Verve-101, но использует улучшенный носитель для доставки — GalNAc-LNP: это липидные наночастицы с усиленным сродством к клеткам печени, что может улучшить адресность лечения. Данные испытаний фазы 1b для Verve-102 также демонстрируют неплохую эффективность: у получивших препарат зафиксировано дозозависимое снижение ЛПНП (до 53%); а вот по безопасности пока даже меньше вопросов: серьезных нежелательных явлений тут зафиксировано не было.
LBP-EC01 (Locus Biosciences): борьба с циститом
Эта инновационная терапия нацелена на борьбу с инфекциями мочевыводящих путей (ИМП), вызванными кишечными палочками (бактериями E. coli), в частности антибиотикорезистентными. И это проблема: хотя зачастую ИМП эффективно лечатся коротким курсом антибиотиков, в случае множественной устойчивости к ним (а это общемировая тенденция: см. спецпроект «Антибиотикорезистентность»), подобрать эффективный препарат не так-то просто . Учитывая, что болезнетворные E. coli поражают мочевыводящие пути очень многих (в основном конечно женщин: тут счет идет на миллионы), масштаб неудовлетворенной потребности становится более чем очевиден.
Нарастающее снижение эффективности антибиотиков уже давно заставляет ученых и медиков искать альтернативные способы антибактериального лечения, а потому исследования в области фаговой терапии кажутся все более перспективными. Об этом рассказывает спецпроект «Бактериофаги», в котором мы рассматриваем в том числе и успешные попытки использования генетически модифицированных фагов против инфекций, см.: «Бактериофаги в медицине» [33].
Рисунок 11. Атака фагов на бактерию.
иллюстрация Анастасии Самоукиной из материала «Бактериофаги в медицине» спецпроекта «Бактериофаги» [33]
LBP-EC01, которая в настоящее время проходит клинические испытания, представляет собой «коктейль» из трех бактериофагов в сочетании с CRISPR-Cas3, разработанный для «атаки на геном» трех штаммов E. coli, ответственных приблизительно за 95% всех ИМП (рис. 11).
В этом лечении в дополнение к естественному воздействию фагов содержится «надстройка»: сами эти бактериальные паразиты уже конструируются так, чтобы содержать молекулярные ножницы CRISPR-Cas3 в своем геноме. Ну а нуклеаза Cas3 хоть и не так известна, как ее знаменитая «сестрица» Cas9, но в отличие от нее режет геном сразу во множестве мест, эффективно разрушая целевую ДНК и приводя к гибели микроорганизма:
Cas3 похожа на Cas9, но с «моторчиком» — найдя свою конкретную цель в ДНК, она начинает бежать по ней, пережевывая нуклеиновую кислоту, как Па́кман.
Locus Biosciences завершила свое исследование фазы 1b в США в феврале 2021 года — первое в истории с использованием терапии на основе CRISPR для лечения инфекций, а также первое с использованием белка Cas3. В пресс-релизе Locus сообщили, что результаты подтверждают безопасность и переносимость терапии без каких-либо серьезных нежелательных явлений. Касаемо эффективности: у всех 16 пациентов наблюдалось полное разрешение симптомов ИМП, а у 14 из них (87,5% участниц) наблюдалось «микробиологическое излечение»: снижение бактериальной инфекции в моче до незначительного уровня (1×103 КОЕ/мл) к 10 дню после терапевтического вмешательства. Эти успешные промежуточные результаты позволили перейти в фазу 2 клинических исследований, где сейчас данная терапия и изучается.
ECUR-506 (iECURE и Precision Biosciences) —
терапия, нацеленная на коррекцию наследственного дефицита орнитинтранскарбамилазы (ornithine transcarbamylase, OTC). Болезнь эта характеризуется нарушением цикла образования мочевины, из-за чего содержащие аммиак продукты распада должным образом не перерабатываются, начиная накапливаться в организме. Происходит так потому, что ввиду наследственного дефекта в его кодирующем гене фермент OTC оказывается дисфункциональным, из-за чего один из этапов биохимических превращений (преобразование орнитина в цитруллин) в цикле мочевины уже не идет, и весь цикл оказывается заблокированным .
Терапия этой болезни имеет очень печальный бэкграунд: на заре разработки генного лечения его применение обернулось смертью пациента. Это был очень громкий случай, надолго затормозивший развитие всей области генной терапии. Мы подробно рассказывали об этом в статьях: «Три поколения лекарств» [6] и «Спутник V» и не только: сказ об аденовирусных вакцинах» [34].
Дефицит OTC — наиболее распространенное нарушение цикла мочевины, и заболевание это очень серьезное: повышенный уровень аммиака у пораженных людей может вызывать тяжелые, иногда необратимые неврологические повреждения, привести к развитию комы и даже к смерти.
Тяжелая форма этого расстройства обычно проявляется вскоре после рождения и преимущественно поражает мужчин. В настоящее время единственным корректирующим лечением тяжелого неонатального дефицита OTC является пересадка печени, поскольку другие терапевтические подходы не позволяют адекватно смягчить опасные для жизни симптомы.
ECUR-506 использует систему из двух аденоассоциированных вирусных векторов, работающих «в тандеме». Один несет режущую мегануклеазу ARCUS, специфичность которой настроена на последовательность небезызвестного нам теперь гена PCSK9, ну а второй — функциональную копию гена OTC. Разрез мегануклеазой в локусе гена PCSK9 служит точкой вставки для гена OTC, что потенциально приводит к постоянной экспрессии здорового гена.
Предварительные результаты исследований фазы 1/2, о которых сообщили iECURE в своем пресс-релизе, выглядят воодушевляюще. У первого пролеченного младенца был получен полный клинический ответ: через двенадцать недель после однократной дозы ECUR-506 поддерживающая симптоматическая терапия (прием препарата, поглощающего аммиак) была прекращена, а среднесуточное потребление белка ребенком было увеличено до уровня, соответствующего возрасту.
Поскольку терапевтическая стратегия здесь нацелена на долгосрочное лечебное воздействие (после однократной in vivo инфузии), ECUR-506 может стать радикально эффективным решением для этой острой неудовлетворенной потребности .
Впрочем, как и всегда в подобных случаях, долгосрочность действия терапии еще предстоит доказать.
Вместо заключения
Генное редактирование уже сейчас открывает невероятные перспективы в медицине, предлагая возможности радикального изменения подхода к лечению многих наследственных и приобретенных заболеваний. Одним из самых популярных инструментов до сих пор остается CRISPR: его преимущества — в простоте использования, гибкости и быстроте настройки под любую нужную ДНК-последовательность. По сравнению с «предшественниками» (ZFN, TALEN, мегануклеазы), CRISPR гораздо удобней и проще в применении, что позволяет эффективнее корректировать человеческий геном. Впрочем, технология эта имеет и недостатки: не всегда высокая точность редактирования порождает нежелательные мутации, потенциально снижая эффективность редактирования и неся серьезные риски для безопасности пациента.
Преодолеть ограничения традиционной CRISPR теоретически смогут основанные на ней более продвинутые системы, подобно разобранным выше (Prime/Base/RNA editing, и прочим). Как мы видели, многие из них уже проходят клинические испытания и медленно, но верно приближаются к выводу на рынок (хотя конечно далеко не все дойдут до этой стадии). Совокупность исследовательских усилий вселяет надежду, что рано или поздно удастся решить технологические сложности, связанные с точностью и эффективностью редактирования геномов.
К сожалению, на пути широкого внедрения таких современных решений существуют барьеры не только технического толка, но и серьезные этические вызовы. Яркий пример подобного конфликта — история китайского ученого Хэ Цзянькуя, который впервые попытался отредактировать геномы человеческих эмбрионов с использованием CRISPR: «Изменение генома и... мировой науки?» [35]. Цель была благородной — защитить младенцев от заражения вирусом иммунодефицита человека.
Однако его поступок вызвал бурную реакцию международного научного сообщества и поднял важные вопросы о пределах приемлемости вмешательства в геном человека, а сам Хэ Цзянькуй отсидел три года в тюрьме за нарушение этических норм при проведении клинических исследований. Насколько оправдано такое вторжение в естественный ход эволюции, безопасно ли так радикально менять фундаментальную биологию человека? Не грозят ли нам непредвиденные долгосрочные последствия для последующих поколений?
Не войдет ли медицина в фазу «игры в Бога», создавая «супердетей» с улучшенным физическим развитием или более высоким уровнем интеллекта? А что если эти «сверхлюди» начнут «вытеснять» представителей современной общей популяции? Не идет ли здесь речь уже о евгенике — неприемлемом способе улучшения наследственных качеств человека?
Все это очень сложные этические вопросы, которые, к сожалению, могут создать серьезные препятствия для более широкого внедрения технологий и замедлить научный прогресс, что, очевидно, будет очень печально. Ведь уже сейчас мы видим, насколько близко подступает к нам медицина будущего, и какие потрясающие перспективы совсем скоро смогут открыться в профилактике и лечении многих заболеваний.
Возьмем, к примеру, вышеупомянутый ген PCSK9. Да, пока что его редактируют по узкому показанию — для лечения редкой наследственной болезни, но уже очевиден потенциал выхода в более широкое применение. Отключение этого гена способно существенно уменьшить риски развития сердечно-сосудистых заболеваний — одной из основных причин смертности во всем мире. Теоретически, простой акт редактирования совсем маленького участка последовательности гена PCSK9 у эмбрионов мог бы спасать миллионы человеческих жизней ежегодно… Очевидно, что широкое внедрение одного только этого подхода могло бы навсегда изменить медицину в лучшую сторону; но редактирование генома эмбрионов ставит нас перед серьезными моральными дилеммами.
Пока что нет однозначного ответа в вопросе решения этических проблем, стоящих перед человечеством. Остается надеяться, что широкая общественная дискуссия с участием академических кругов в будущем сможет помочь достичь разумного консенсуса относительно возможностей более широкого использования инструментов редактирования геномов.
Ведь если мы сможем выйти за рамки сегодняшних границ применения, нам откроются совершенно захватывающие перспективы увидеть своими глазами «дивный новый мир» медицины будущего.
Литература
- Трансгенные животные и современная медицина: сломать, чтобы починить;
- D Carroll. (2008). Progress and prospects: Zinc-finger nucleases as gene therapy agents. Gene Ther. 15, 1463–1468;
- Нобелевскую премию по физиологии или медицине вручили за технологию нокаутирования мышей;
- Oliver Smithies, Ronald G. Gregg, Sallie S. Boggs, Michael A. Koralewski, Raju S. Kucherlapati. (1985). Insertion of DNA sequences into the human chromosomal β-globin locus by homologous recombination. Nature. 317, 230–234;
- L. Perrouault, U. Asseline, Christian Rivalle, N. T. Thuong, E. Bisagni, et. al. (1990). Sequence-specific artificial photo-induced endonucleases based on triple helix-forming oligonucleotides. Nature. 344, 358–360;
- Три поколения лекарств;
- 12 методов в картинках: генная инженерия. Часть I, историческая;
- Nobel Prize in Physiology or Medicine 1978. Press release. (2025). Nobelprize.org;
- Lorena T. Fernández-Martínez, Mervyn J. Bibb. (2014). Use of the Meganuclease I-SceI of Saccharomycescerevisiae to select for gene deletions in actinomycetes. Sci Rep. 4;
- Simon E Tröder, Branko Zevnik. (2022). History of genome editing: From meganucleases to CRISPR. Lab Anim. 56, 60–68;
- Sugisaki Hiroyuki, Kanazawa Susumu. (1981). New restriction endonucleases from Flavobacterium okeanokoites (FokI) and Micrococcus luteus (MluI). Gene. 16, 73–78;
- 12 методов в картинках: генная инженерия. Часть II: инструменты и техники;
- Закиян С. М. Редактирование генов и геномов: Том 1 / С.М. Закиян, С.П. Медведев, Е.В. Дементьева, Е.А. Покушалов, В.В. Власов. Новосибирск: Издательство СО РАН, 2018. — 369 с.;
- Fyodor D. Urnov, Jeffrey C. Miller, Ya-Li Lee, Christian M. Beausejour, Jeremy M. Rock, et. al. (2005). Highly efficient endogenous human gene correction using designed zinc-finger nucleases. Nature. 435, 646–651;
- CRISPR-системы: иммунизация прокариот;
- Kira S Makarova, Nick V Grishin, Svetlana A Shabalina, Yuri I Wolf, Eugene V Koonin. (2006). A putative RNA-interference-based immune system in prokaryotes: computational analysis of the predicted enzymatic machinery, functional analogies with eukaryotic RNAi, and hypothetical mechanisms of action. Biol Direct. 1;
- CRISPR-эпопея и ее герои;
- РНК, ножницы, геномы: объявлены лауреаты Нобелевской премии по химии 2020;
- Eric Deneault. (2024). Recent Therapeutic Gene Editing Applications to Genetic Disorders. CIMB. 46, 4147–4185;
- Masahiro Hiraizumi, Nicholas T. Perry, Matthew G. Durrant, Teppei Soma, Naoto Nagahata, et. al. (2024). Structural mechanism of bridge RNA-guided recombination. Nature. 630, 994–1002;
- Shah-Neville W. (2024). Bridge RNA: A new gene editing technique that could overcome the limitations of CRISPR. Labiotech;
- Andrew V. Anzalone, Xin D. Gao, Christopher J. Podracky, Andrew T. Nelson, Luke W. Koblan, et. al. (2022). Programmable deletion, replacement, integration and inversion of large DNA sequences with twin prime editing. Nat Biotechnol. 40, 731–740;
- Время первых: как аденоассоциированные вирусы стали лучшими в доставке генов in vivo;
- Лентивирусные векторы: как они стали лучшими векторами для терапии ex vivo;
- Генная терапия: познакомьтесь с лекарствами будущего;
- Как болезни крови генной терапией лечили;
- Руку, ногу и сердце: редкий АТТR-амилоидоз;
- На руинах памяти: настоящее и будущее болезни Альцгеймера;
- Лечение болезни Паркинсона нейротрофическими факторами: есть ли свет в конце туннеля?;
- Первый препарат на основе РНК-интерференции: смерть мРНК — жизнь пациенту!;
- Биофарма в первом полугодии 2024: неслыханные генные новости, новые показания GLP-1, непокорный Альцгеймер;
- Точный удар: как редактирование мРНК победит неизлечимые болезни;
- Бактериофаги в медицине;
- «Спутник V» и не только: сказ об аденовирусных вакцинах;
- Изменение генома и... мировой науки?.