
Позови меня с собой. Как иммунная клетка пошла за тромбоцитом в печень и помогла вырастить рак (и как это предотвратить)
04 марта 2021
Позови меня с собой. Как иммунная клетка пошла за тромбоцитом в печень и помогла вырастить рак (и как это предотвратить)
- 1133
- 10
- 6
Рисунок в полном размере.
рисунок Анны Подгорновой
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: В 2020 году отовсюду сквозит желание «поднять» свой иммунитет. Между тем, иммунитет, как и многое в жизни, хорош в меру. Чрезмерно активный, он грозит не только аутоиммунными заболеваниями. Хроническое воспаление, вызванное иммунным ответом, может быть предшественником рака. Недавно вышла статья, посвященная роли тромбоцитов в инициации воспаления в печени; эта статья служит очередным напоминанием о том, что иммунитет может играть не только роль спасителя, но и роль палача, когда речь идет о развитии рака. Так стоит ли столь яро желать бóльшей активности своего иммунитета?
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
В научном сообществе нет разногласий насчет того, что лучше рак предотвращать, чем лечить. Статья, опубликованная в 2019 году в Nature Medicine, предлагает способ предупреждения рака печени, который работает на мышах, и, кажется, может работать на людях [1]. Он напрямую связан с обезвреживанием вредных мигрантов — тромбоцитов, которые переселяются в печень, зовут за собой иммунные клетки и превращают неприятную неалкогольную жировую болезнь печени в потенциально смертельный рак.
Любовь к еде, похожая на сон: неалкогольная жировая болезнь печени, или еще раз о том, почему вредно много есть и мало двигаться
Ни для кого не секрет, что чрезмерное употребление калорий и недостаточная физическая активность — плохо. Такой образ жизни приводит не только к изменению внешнего вида, но и к накоплению жиров в печени — заболеванию, которое называется стеатоз (рис. 1) [2]. Если и дальше продолжать чревоугодие, инфильтрация печени иммунными клетками может привести к хроническому воспалению и развитию неалкогольного стеатогепатита (НАСГ). Стеатоз и НАСГ относятся к спектру хронических заболеваний печени, который называется неалкогольной жировой болезнью печени (НАЖБП). Опасность НАЖБП в том, что на поздних стадиях эта болезнь может привести к раку печени. Риск заболеть НАЖБП велик у людей с метаболическим синдромом (комплексом нарушений обмена веществ), ожирением и диабетом II типа.
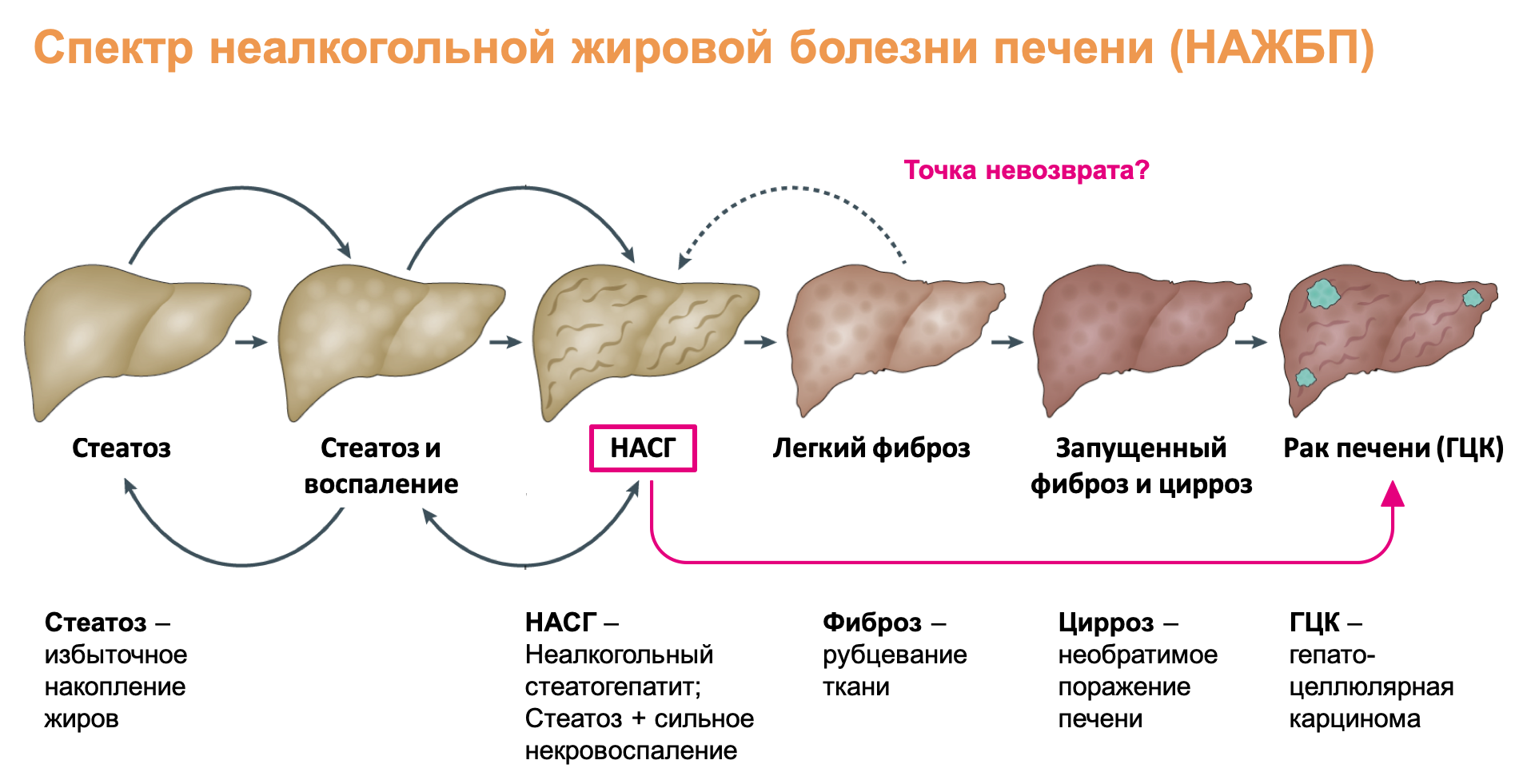
Рисунок 1. Спектр неалкогольной жировой болезни печени (НАЖБП) и модель прогрессирования заболевания.
адаптировано из [2]
Печень — один из немногих органов, способный при повреждении восстанавливаться за счет деления оставшихся клеток печени (подробнее можно прочитать в статье «Биомолекулы» «Резервный механизм восстановления печени» [3]), но бесконтрольное деление клеток может приводить к появлению опухоли. Подробнее об этом читайте в статье «Биомолекулы» «Вероятность возникновения рака зависит от количества делений стволовых клеток» [4]. При НАСГ гибнет часть гепатоцитов — клеток печени. В ответ печень запускает рост новых клеток, что приводит к повышенному риску развития рака печени — гепатоцеллюлярной карциномы (ГЦК). Кстати, ГЦК на данный момент обгоняет другие виды рака по росту количества случаев и в США, и в Европе [5].
Как можно догадаться, НАЖБП — заболевание динамичное (рис. 1). На его ранних стадиях прогрессирование в НАСГ может быть остановлено и даже улучшено до простого стеатоза при помощи смены образа жизни. Если ничего не предпринимать на стадии НАСГ, прогноз менее радужен. Согласно статистике, около 40% случаев НАСГ прогрессируют до фиброза (рубцевания поврежденной ткани), а вот возврат стадии заболевания с фиброза до НАСГ вероятен лишь в 20% случаев [6]. При этом фиброз — сильнейший предсказатель смерти от печеночных болезней. К сожалению, на поздних стадиях развернуть развитие болезни уже невозможно: цирроз — необратимое повреждение печени — приводит к раку. Когда достигнута точка невозврата, только трансплантация печени может спасти пациента. Фиброз и цирроз — это возможные промежуточные стадии между НАСГ и раком печени. Однако было показано, что НАСГ может привести к раку печени и в их отсутствие [7–9]. Именно поэтому эта статья рассказывает о НАСГ — стадии, на которой еще можно предотвратить рак печени.
Одна из обсуждаемых моделей развития НАСГ называется теорией двух «ударов». Первый «удар» — это накопление жиров в печени (стеатоз) в результате чрезмерного употребления еды. Стеатоз делает печень более уязвимой ко второму «удару» — оксидативному стрессу (повреждению или гибели клеток в результате окисления) из-за повышенной токсичности жиров и последующему воспалению в ответ на гибель клеток (некровоспалению). Более расширенная модель нутригеномики (подробнее — в статье «Биомолекулы» «Нутригеномика: питание vs. заболевания» [10]) подразумевает множественные «удары» по печени и дополнительно включает в себя другие маркеры заболевания, такие как, например, ассоциированные с болезнью варианты генов.
Дух силен, а плоть слаба: эпидемиология неалкогольной жировой болезни печени
Распространенность НАЖБП увеличивается примерно с той же скоростью, что и диабет, которым сегодня больна почти треть человечества (рис. 2). Исследования, моделирующие распространение заболевания, показывают, что этот показатель продолжит расти еще как минимум одно десятилетие [5]. Несмотря на то, что несколько препаратов (например те, что снижают уровень сахара в крови) сейчас проходят 2 и 3 стадии клинических испытаний , на данный момент нет одобренных фармакологических препаратов, которые бы эффективно предотвращали НАСГ. Единственная доступная опция — «просто» изменение образа жизни, — к сожалению, не так проста в исполнении. Именно поэтому потребность в терапевтической коррекции высока.
Подробнее про клинические испытания рассказано в статье «Биомолекулы» «Путь к тысячам аптек начинается с одной молекулы» [11].
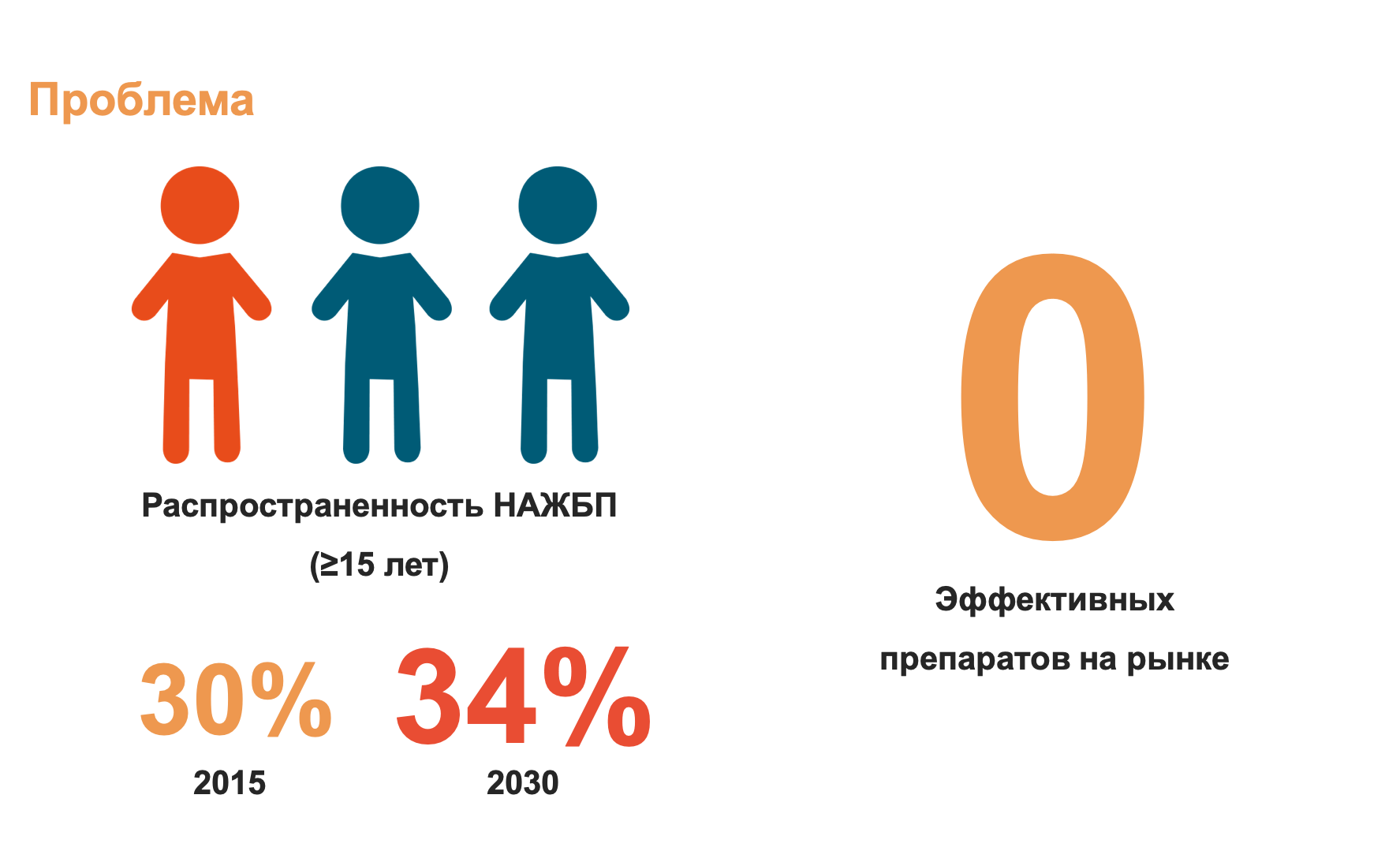
Рисунок 2. Неалкогольная жировая болезнь печени — распространенная проблема без эффективного лечебного препарата.
рисунок автора статьи
Темная сторона иммунитета: как иммунные клетки позволяют раку вырасти
Иммунные клетки могут играть различные роли: быть полицейскими, отважными солдатами, пожарными или уборщиками. Например, антигенпрезентирующие клетки в роли полицейских ищут чужаков. Находя одного чужого, они собирают фоторобот из антигенов (молекул, отличающих чужака от своих) для опознания других таких чужаков и показывают их другим иммунным клеткам-солдатам. Солдаты, такие как Т-киллеры и натуральные киллеры, отправляются в бой с целью уничтожить врага. Тут разворачивается грандиозная атака. В арсенале у клеток-киллеров особенные пули — перфорины — пробивают дыры в оболочке чужака, а гранзимы проникают внутрь и заставляют врага пойти на самоубийство. Война иммунных клеток с врагом называется воспалением, а разжигают ее цитокины. Подробнее о принципах работы иммунитета можно прочитать в статье «Биомолекулы» «Иммунитет: борьба с чужими и… своими» [12]. В роли пожарного Т-регуляторная клетка спешит на помощь, чтобы потушить огонь в зонах воспаления и заставить солдатов отдохнуть. Если блицкриг не удался, а военные действия затягиваются, воспаление становится хроническим.
В лучших традициях авторитарного государства, помимо врагов извне, иммунологическим солдатам порой приходится бороться и с взбунтовавшимися клетками собственного организма. Например, если клетка была заражена вирусом, солдатам придется ее устранить. При НАСГ клетки печени умирают из-за токсичности накопленных жиров. Погибая, клетка взрывается; все ее внутренности оказываются за пределами уже несуществующей клеточной оболочки. Некоторые высвободившиеся молекулы опасны для окружающих клеток, поэтому на место гибели для зачищения приходят фагоциты, иммунные клетки-уборщики. Ответ иммунной системы на такую смерть клеток организма тоже называется воспалением.
Работа иммунитета и опасна, и трудна, и на первый взгляд как будто не видна. Помимо зараженных и умирающих клеток, иммунитет каждую минуту борется и с мутирующими клетками. В каждом из нас клетки мутируют постоянно. Тем не менее, не у всех появляется рак — заболевание бесконтрольно растущих измененных клеток. Это заслуга иммунного надзора — дежурные иммунные клетки все время на посту и вычисляют клетки, начавшие трансформацию в злых предшественников рака, уничтожая их на самых ранних стадиях.
К сожалению, иммунные клетки — не роботы. У них нет бесконечного запаса сил для борьбы, они устают от долгой работы. Существует теория, что опухоли — как раны, которые не заживают (рис. 3). При нормальном заживлении ран иммунные клетки создают воспаление и вскоре исчезают. А рак печени, например, возникает чаще всего в условиях хронического воспаления. Клетки печени умирают, в ответ растут новые клетки, которые снова умирают. Их смерть доводит до изнеможения вынужденный все подчищать иммунитет. Пожарные тормозят действия. Сонные и вялые солдаты уже не зовут на помощь товарищей, готовых кинуться в бой. Усталый иммунный надзор больше неэффективен, он начинает пропускать мимо своего внимания измененные клетки. А раковая клетка пользуется затишьем на поле боя и вырастает в хитрую опухоль. Замаскировавшись под мирные и безопасные клетки, опухоль выделяет в пространство вокруг себя успокоительные молекулы, формируя лояльное к себе окружение из бывших солдат. Таким образом, воспаление, цель которого — борьба с врагом, в своей хронической форме дает противнику вырасти. В этом порочном круге иммунные клетки вовсе не эффективные работники, а пособники развития рака. Избегание уничтожения со стороны иммунной системы — один из ключевых признаков рака [13].

Рисунок 3. Иллюстрация теории о том, что опухоли — раны, которые не заживают. При постоянном воспалении, иммунные клетки могут допустить образование опухоли. Смерть гепатоцитов, клеток регенерирующего органа, и их компенсаторный рост в условиях хронического воспаления могут привести к развитию рака печени.
рисунок автора статьи
Получается, один из способов не допустить развитие рака печени — это предотвратить хроническое воспаление. Эксперименты на мышиных моделях (подробнее о том, как они проводятся — в статье «Биомолекулы» «Модельные организмы: грызуны») показали, что при метаболическом синдроме активируются иммунные клетки-киллеры [14], [15]. Они приходят в печень и переговариваются с гепатоцитами с помощью цитокинов. Со временем это общение приводит с НАСГ и раку. Однако, оставалось неясно, кто и как призывает иммунные клетки в печень для переговоров при НАСГ, и как это привлечение влияет на переход заболевания от НАСГ к раку? Кроме того, ранее было показано, что при вирусном гепатите использование антитромбоцитарной терапии (АТТ) останавливает приток иммунных клеток в печень и предотвращает повреждение печени и образование опухолей [16], [17]. Это говорит о важной роли тромбоцитов при вирусном гепатите. Но какую роль играют тромбоциты в НАСГ? И может ли антитромбоцитарная терапия предотвратить НАСГ и НАСГ-ассоциированный рак печени по аналогии с вирусным гепатитом?
Они всегда спешат туда, где ждет беда: как тромбоцит хотел помочь, а получилось как всегда
Для профилактики рака печени, вызванного НАСГ, необходимо разобраться, что именно призывает иммунные клетки мигрировать в печень и как этому противостоять. В 2019 году вышла статья, представляющая вариант потенциальной медикаментозной профилактики. Для того, чтобы смоделировать столь сложное заболевание, как НАСГ, ученые кормили мышей специальной холин-дефицитной высокожировой диетой, которая приводила к развитию НАСГ, метаболического синдрома и гепатоцеллюлярной карциномы (ГЦК). В поисках зачинщиков хронического воспаления в печени при НАСГ ученые выяснили, что тромбоциты — клетки крови, участвующие в свертывании, — первыми мигрируют в печень с прогрессированием жировой болезни в НАСГ. Это коррелирует и с данными, полученными у людей: повышенное количество внутрипеченочных тромбоцитов отличает пациентов с НАСГ от пациентов с простым стеатозом. Узнав, что тромбоциты каким-то образом важны для развития НАСГ, исследователи предположили, что АТТ может предотвратить развитие НАСГ. Действительно, оказалось, что комбинация аспирина и клопидрогеля (Асп-Кло), традиционная антитромботическая терапия, привела к снижению триглицеридов в печени мышей. Антитромботическая комбинация также снизила количество печеночного фермента аланинаминотрансферазы (АЛТ) в крови. АЛТ выделяется в кровоток при повреждении печени. Следовательно, снижение ее уровня в крови говорит о том, что использованная комбинация уменьшает повреждение печени. АТТ также снизила оценку по шкале активности заболевания. При этом употребление мышами еды и воды не отличалось между сравниваемыми группами. Из этого исследователи заключили, что применение комбинации аспирина и клопидрогеля эффективно предотвращает НАСГ в мышиной модели заболевания.
Зная о связи количества иммунных клеток в печени с развитием рака печени при вирусном гепатите, ученые решили проверить, сможет ли АТТ снизить миграцию иммунных клеток в печень и таким образом предотвратить рак печени, вызванный НАСГ. Подсчет различных типов клеток методом флуорометрии показал, что Асп-Кло снижает приток иммунных клеток в печень мышей (рис. 4) [18]. Большая разница в количестве клеток была замечена уже в возрасте 6 месяцев. Удлинив эксперимент с применением АТТ до 12 месяцев, ученым удалось сделать, пожалуй, главное открытие: АТТ не просто уменьшило НАСГ, но и предотвратило развитие рака печени. У 25% мышей на холин-дефицитной высокожировой диете к 12 месяцем появились опухоли в печени. А у мышей, получающих Асп-Кло, опухолей выявлено не было (рис. 4). Вдохновленные результатами, ученые стали искать способ преодолеть большое «НО» комбинированной терапии аспирином и клопидогрелом — кровотечения, нередко возникающие при приеме этих препаратов. Можно ли предотвратить наплыв тромбоцитов в пораженную стеатозом печень, при этом не влияя на свертываемость крови?
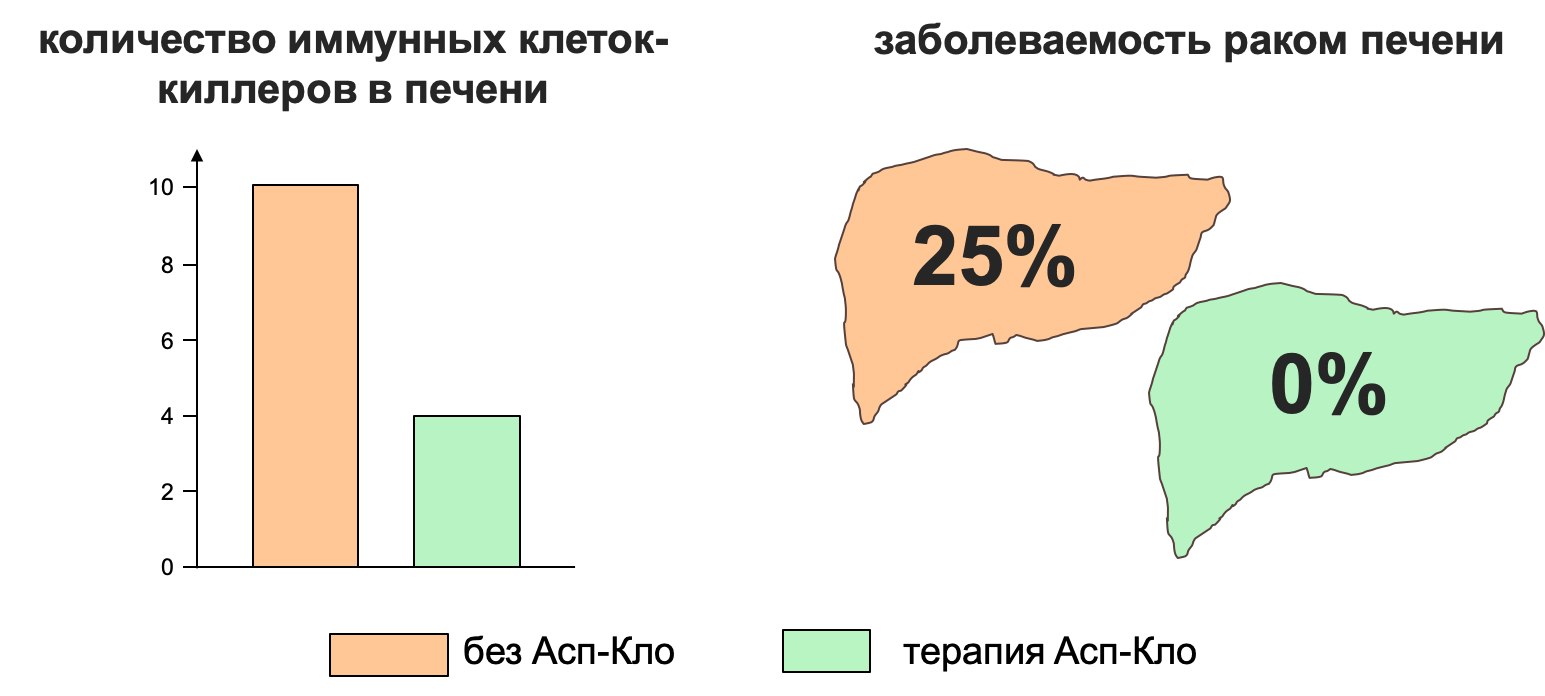
Рисунок 4. Антитромботическая комбинация аспирина и клопидрогеля снижает приток иммунных клеток в печень и предотвращает рак печени, вызванный НАСГ.
Слева: спустя 6 месяцев холин-дефицитной диеты, вызывающей НАСГ, методом флуометрии подсчитано количество иммунных клеток-киллеров. У мышей на терапии Асп-Кло (зеленый цвет) количество иммунных клеток в печени гораздо меньше, чем у мышей, которым не проводили терапию (оранжевый цвет).
Справа: у 13 из 51 мышей после 12 месяцев холин-дефицитной диеты были обнаружены опухоли печени. Ни у одной мыши на этой же диете, но при применении Асп-Кло, опухоли печени обнаружено не было. Рак печени здесь — гепатоцеллюлярная карцинома.
адаптировано из [1]
В жизни тромбоцита есть три важных события, каждое из которых играет свою роль в свертываемости крови (рис. 5):
- Как только появляется повреждение в организме, тромбоциты отважно спешат на помощь. Чтобы обозначить всем остальным спасателям, куда бежать, они прикрепляются к месту повреждения. Это называется адгезией.
- Понимая, что самим последствия катастрофы им не разгрести, тромбоциты активируются — выпускают сигнальные гранулы, которые призывают иммунные клетки и, как маяк, служат их ориентиром.
- «Один за всех, и все за одного» вполне могло быть девизом тромбоцитов. Понимая, что группа тромбоцитов сильнее, чем одиночка, они начинают агрегацию — прикрепление к другим тромбоцитам для формирование пробки, перекрывающей повреждение.
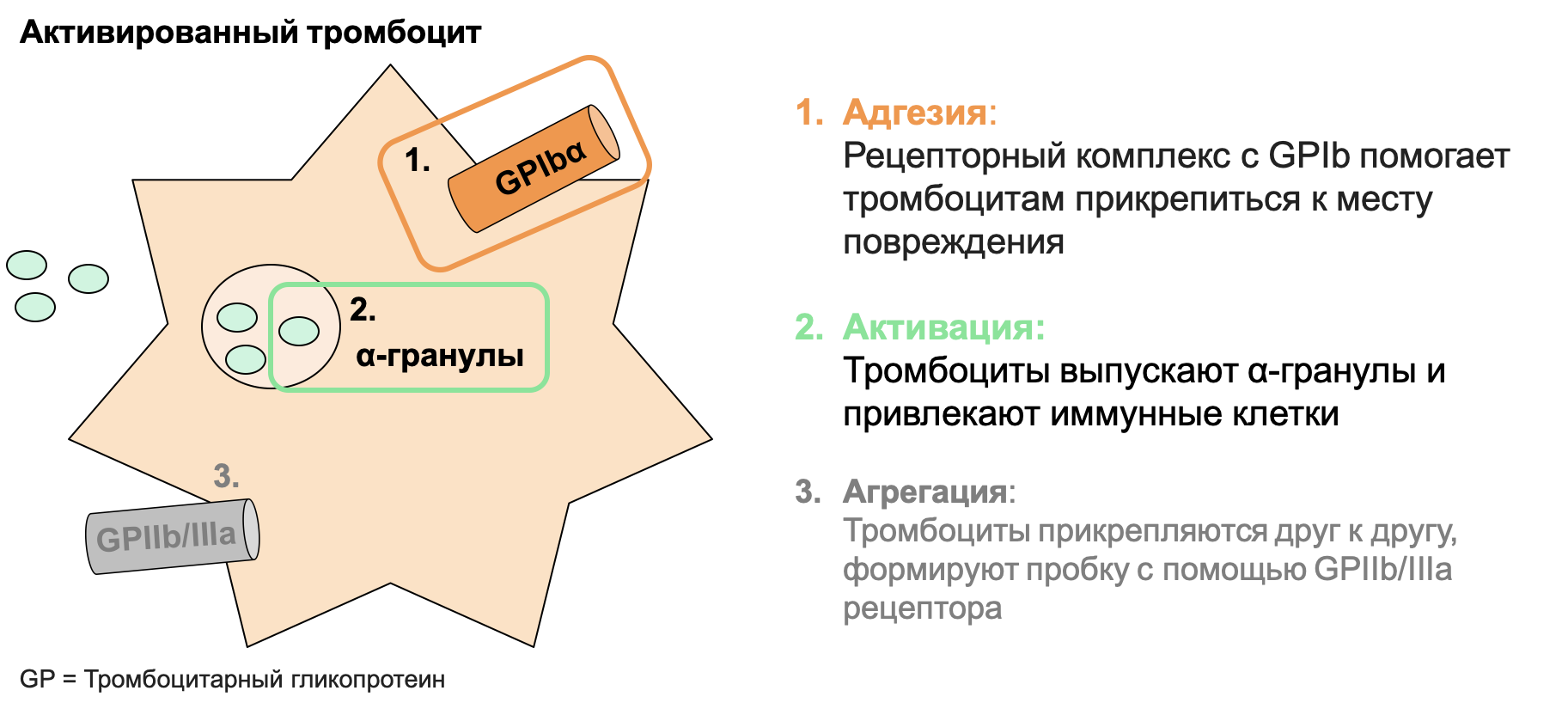
Рисунок 5. Три важных события в жизни тромбоцита: адгезия, активация и агрегация. Только адгезия и активация играют важную роль в развитии НАСГ.
рисунок автора статьи
Чтобы понять, какое из событий играет роль в развитии НАСГ, ученые с помощью генной инженерии и специальных молекул по очереди блокировали важные компоненты, включающие каждый этап. Тромбоцитарный гликопротеин IIb (GPIIb) нужен для агрегации тромбоцитов. Его отсутствие в трансгенных мышах не предотвратило развитие НАСГ, что позволило установить отсутствие роли агрегации в НАСГ. А у мышей, у которых с помощью генной инженерии не работает рецептор, участвующий в адгезии или нет специальных гранул, выпускаемыми тромбоцитами во время активации, ни стеатоз, ни НАСГ не развивались, несмотря на наличие холин-дефицитной диеты. Итак, методом исключения каждого из трех событий удалось установить, что только первые два этапа (адгезия и активация) участвуют в развитии НАСГ. Особо важную роль играет тромбоцитарный гликопротеин Ib (GPIb) — рецептор на поверхности тромбоцитов, участвующий в прикреплении к поврежденному участку.
Рецептор GPIb, как и другие рецепторы, имеет части, расположенные внутри и снаружи клетки. Например, альфа цепь находится снаружи и способна связываться с другими молекулами (лигандами) в межклеточном пространстве. Инъекция антитела к альфа цепи GPIb у мышей уменьшила накопление тромбоцитов в печени, снижая повреждение органа. Важность этого участка рецептора была подтверждена исследованиями на трансгенных мышах, в которых участок связывания лиганда с рецептором был заменен на структурно схожий, но не функционирующий. У таких мышей повторился успех антитромбоцитарной терапии: спустя 12 месяцев на диете, обычно вызывающей рак печени, ни у одной мыши рак не был найден. Таким образом, прицельное блокирование альфа цепи тромбоцитарного рецептора GPIb может быть эффективной профилактикой НАСГ и НАСГ-ассоциированного рака печени.
Лабораторные находки на мышах уже прошли первые испытания в клинической практике. Пилотное исследование на пациентах с риском развития НАЖБП показало, что АТТ снизила объем печени и накопление жира в органе (рис. 6). Это первое исследование поддерживает результаты, полученные на мышиных моделях и делает АТТ еще более перспективным вариантом терапии НАЖБП.
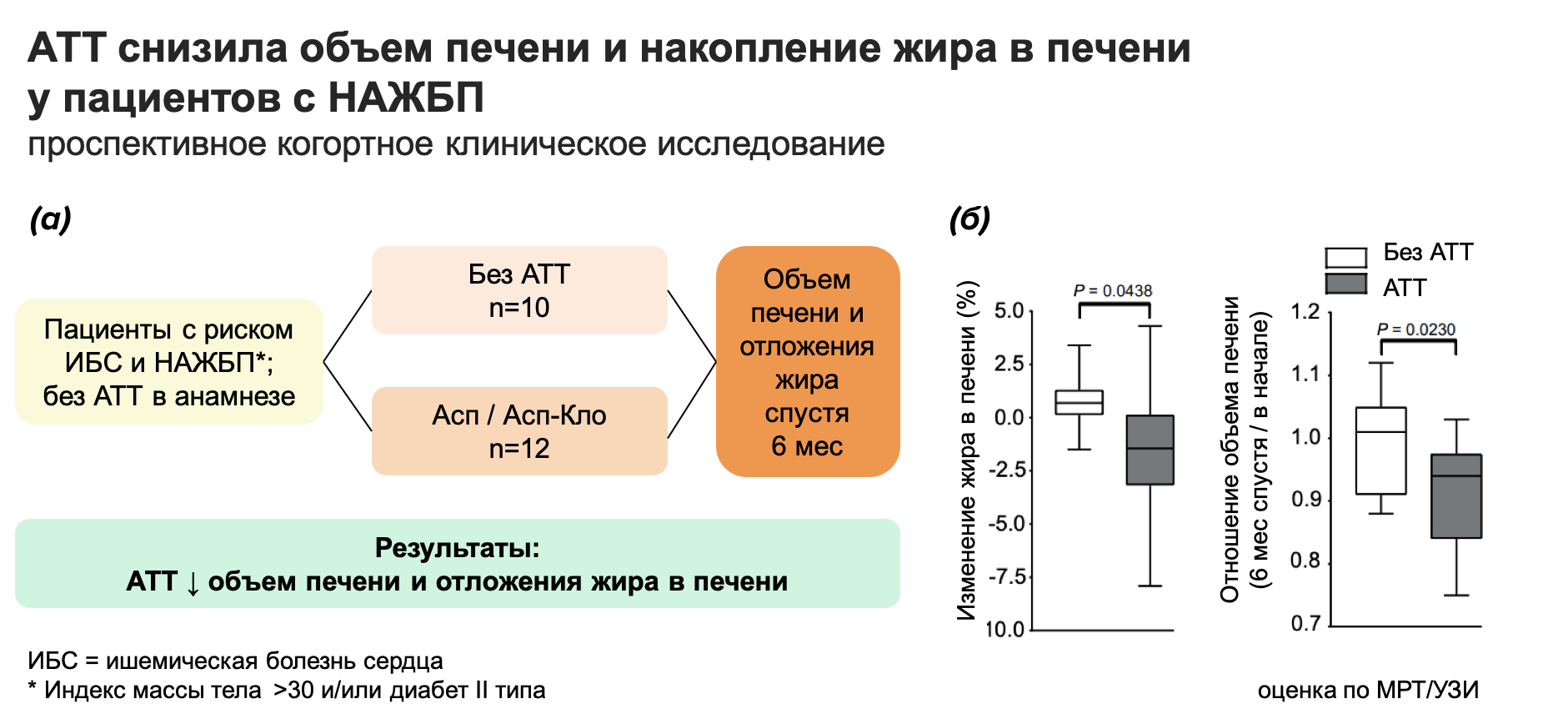
Рисунок 6. Клиническое исследование показало, что антитромботическая терапия снизила объем печени и накопление жира в печени у пациентов с НАЖБП.
(а) Дизайн проспективного когортного клинического исследования. В исследование были набраны пациенты с риском НАСГ и ишемической болезни сердца, но которые ранее не принимали АТТ. Основной целью исследования являлось определить, снижает ли АТТ объем печени и отложения жира.
(б) Слева: в группе, где пациенты принимали АТТ спустя 6 месяцев терапии, было снижение жира в печени по сравнению с пациентами, не принимающими АТТ.
Справа: спустя 6 месяцев объем печени уменьшился у пациентов, принимающих АТТ, по сравнению с пациентами без АТТ. Оценка проводилась с помощью МРТ и УЗИ.
рисунок автора статьи; адаптировано из [1]
Прекрасное далеко: фокус на профилактику
В 1971 году США объявили войну против рака государственного масштаба. С тех пор ученые потратили очень много времени и денег в попытках найти волшебную лекарственную пулю для победы. Изначально упор исследований был именно на лечение уже существующей опухоли. Суть профилактической медицины неприятна человеку, ведь она заставляет признать, что главный враг — мы сами. Тем не менее, чем больше средств тратилось на изобретение новых препаратов, тем яснее становилась необходимость смещения фокуса на профилактику рака.
С каждым годом все больше данных укрепляют взаимосвязь между хроническим воспалением и возникновением рака. К счастью, изобретаются и новые способы предупреждения развития рака, вызванного хроническим воспалением. Например, использование аспирина при синдроме Линча (наследственном синдроме, вызванном мутацией в гене системы восстановления ДНК, чье наличие коррелирует с высоким риском развития рака толстой кишки) помогает снизить риск развития рака толстой кишки [19]. Также недавно было показано, что антитромботическая терапия способна предотвратить развитие неалкогольного стеатогепатита и последующего рака печени (рис. 7). А использование молекул против конкретного участка рецептора (GPIbα) на поверхности тромбоцитов, отвечающего за развитие воспаления, может прервать опасный каскад воспаления и образования опухоли, не нарушая при этом важную функцию тромбоцитов — свертываемость крови.
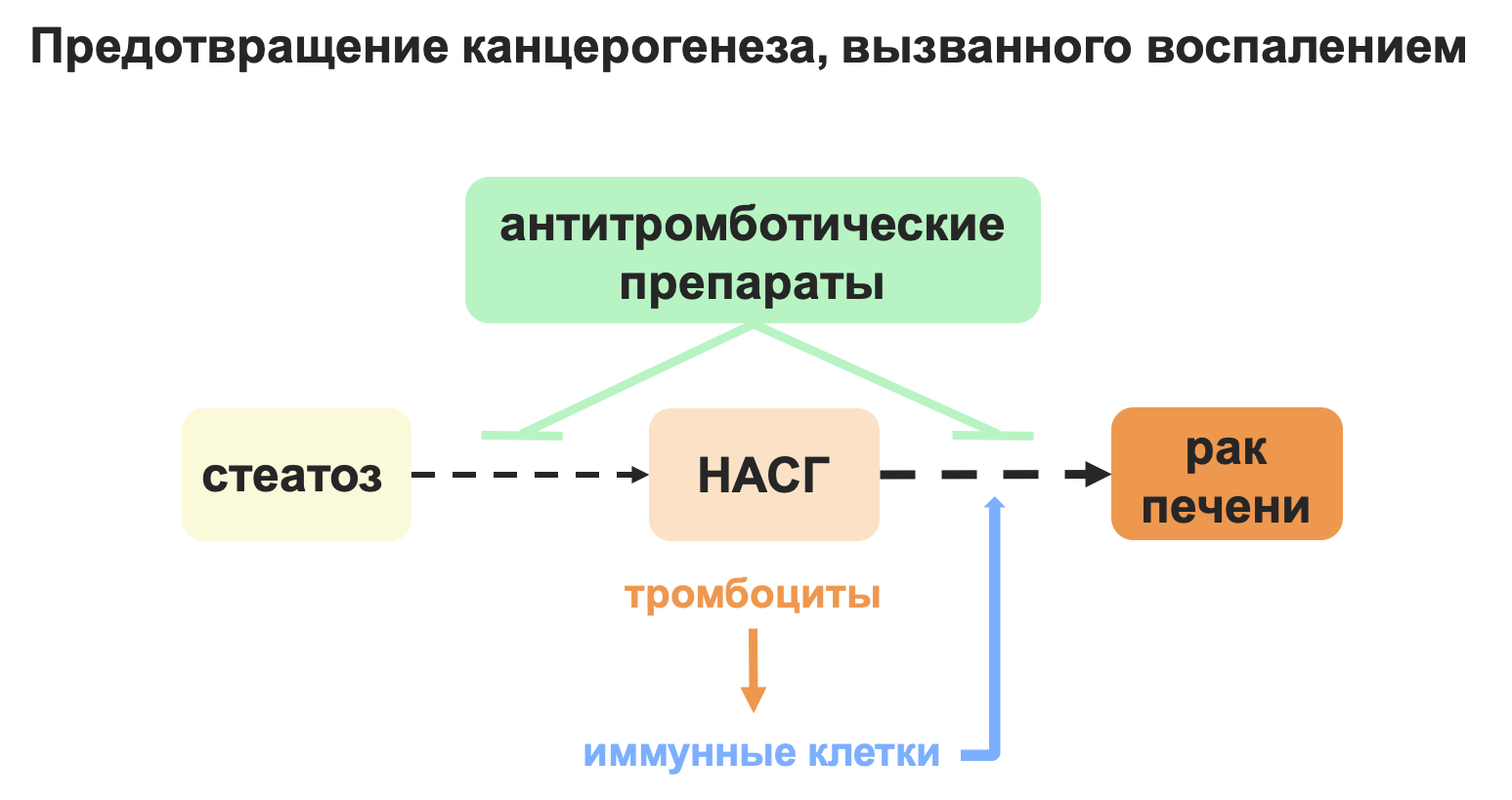
Рисунок 7. Схема возможного предотвращения рака печени, вызванного воспалением, с помощью антитромботических препаратов.
рисунок автора статьи
Остается ряд важных вопросов об использовании GPIbα как новой терапевтической мишени для НАСГ, на которые исследователи пока не могут дать ответ без дальнейших исследований. Так как опубликованные данные получены на грызунах, еще предстоит выяснить, может ли анти-GPIbα терапия быть эффективной против НАСГ у людей. Остается неясным и то, на какой именно стадии НАЖБП надо начинать анти-НАСГ терапию. Насколько жирной должна быть печень, чтобы решить, что изменения образа жизни не помогут достигнуть нужного результата и нужно прибегнуть к медикаментам? До сих пор нет точных неинвазивных (без использования хирургических инструментов) биомаркеров НАЖБП и НАСГ для диагностики и контроля лечения. На данный момент УЗИ, КТ и МРТ применяются для скрининга, но не заменяют биопсию печени, определяющую диагноз. Наконец, если АТТ можно применять для профилактики рака печени, возможен ли терапевтический эффект и уже после формирования опухоли? Учитывая, что лаборатория, опубликовавшая обсуждаемую статью, в этом году получила престижный грант для разработки специфичных антител к тромбоцитам для борьбы с раком печени, ответы на поставленные вопросы должны быть найдены. Скорее всего, будущее НАСГ терапии — за комбинацией метаболической мишени и противовоспалительного агента, такого как АТТ или статины.
Литература
- Mohsen Malehmir, Dominik Pfister, Suchira Gallage, Marta Szydlowska, Donato Inverso, et. al.. (2019). Platelet GPIbα is a mediator and potential interventional target for NASH and subsequent liver cancer. Nat Med. 25, 641-655;
- Quentin M. Anstee, Helen L. Reeves, Elena Kotsiliti, Olivier Govaere, Mathias Heikenwalder. (2019). From NASH to HCC: current concepts and future challenges. Nat Rev Gastroenterol Hepatol. 16, 411-428;
- «Резервный» механизм восстановления печени;
- Вероятность возникновения рака зависит от количества делений стволовых клеток;
- Chris Estes, Homie Razavi, Rohit Loomba, Zobair Younossi, Arun J. Sanyal. (2018). Modeling the epidemic of nonalcoholic fatty liver disease demonstrates an exponential increase in burden of disease. Hepatology. 67, 123-133;
- Donna L. White, Fasiha Kanwal, Hashem B. El–Serag. (2012). Association Between Nonalcoholic Fatty Liver Disease and Risk for Hepatocellular Cancer, Based on Systematic Review. Clinical Gastroenterology and Hepatology. 10, 1342-1359.e2;
- Helen L. Reeves, Marco Y. W. Zaki, Christopher P. Day. (2016). Hepatocellular Carcinoma in Obesity, Type 2 Diabetes, and NAFLD. Dig Dis Sci. 61, 1234-1245;
- György Baffy. (2018). Hepatocellular Carcinoma in Obesity: Finding a Needle in the Haystack?. Advances in Experimental Medicine and Biology. 63-77;
- Cristina Margini, Jean F. Dufour. (2016). The story of HCC in NAFLD: from epidemiology, across pathogenesis, to prevention and treatment. Liver Int. 36, 317-324;
- Нутригеномика: питание vs. заболевания;
- Путь к тысячам аптек начинается с одной молекулы;
- Иммунитет: борьба с чужими и… своими;
- Douglas Hanahan, Robert A. Weinberg. (2011). Hallmarks of Cancer: The Next Generation. Cell. 144, 646-674;
- Модельные организмы: грызуны;
- Monika Julia Wolf, Arlind Adili, Kira Piotrowitz, Zeinab Abdullah, Yannick Boege, et. al.. (2014). Metabolic Activation of Intrahepatic CD8+ T Cells and NKT Cells Causes Nonalcoholic Steatohepatitis and Liver Cancer via Cross-Talk with Hepatocytes. Cancer Cell. 26, 549-564;
- Matteo Iannacone, Giovanni Sitia, Iñigo Narvaiza, Zaverio M. Ruggeri, Luca G. Guidotti. (2007). Antiplatelet Drug Therapy Moderates Immune-Mediated Liver Disease and Inhibits Viral Clearance in Mice Infected with a Replication-Deficient Adenovirus. CVI. 14, 1532-1535;
- G. Sitia, R. Aiolfi, P. Di Lucia, M. Mainetti, A. Fiocchi, et. al.. (2012). Antiplatelet therapy prevents hepatocellular carcinoma and improves survival in a mouse model of chronic hepatitis B. Proceedings of the National Academy of Sciences. 109, E2165-E2172;
- 12 методов в картинках: проточная цитофлуориметрия;
- John Burn, Harsh Sheth, Faye Elliott, Lynn Reed, Finlay Macrae, et. al.. (2020). Cancer prevention with aspirin in hereditary colorectal cancer (Lynch syndrome), 10-year follow-up and registry-based 20-year data in the CAPP2 study: a double-blind, randomised, placebo-controlled trial. The Lancet. 395, 1855-1863.







