
Противник из хеликобанды: кто он?
09 ноября 2021
Противник из хеликобанды: кто он?
- 2029
- 0
- 0
На рисунке — вооруженный противник, хеликобактер собственной персоной. Пришедший на сигнал о помощи Т-лимфоцит еще не знает, на что он способен.
рисунок автора статьи
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Helicobacter pylori — патоген, который у человека ассоциируется с гастритом, язвой и прочими пагубными влияниями на слизистую желудка, в том числе раком. Молекулярный патогенез данной инфекции описан, и в то же время запутан. Кроме того, протекание болезни связано с другими патологиями. Например, бронхиальной астмой и тромбоцитопенической пурпурой. Недавно ученые раскрыли механизм, который бактерия использует для регуляции своей патогенности. Все эти звенья мы постараемся разобрать в данном обзоре. Правда, вместо отпечатков пальцев и случайно оставленной пуговицы в нашем распоряжении будут экспериментальные данные.
Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2021/2022.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Всякий преступник непременно делает
какую-нибудь оплошность и выдает себя.
Оскар Уайльд. Портрет Дориана Грея
Досье преступника
Helicobacter pylori — грамотрицательная спиралевидная бактерия. Она относится к семейству Helicobacteraceae, имеет несколько жгутиков, обеспечивающих перемещение клетки по слизистой желудка. Исходя из физиологических свойств, H. pylori является микроаэрофилом — микроорганизмом, растущим при низких концентрациях кислорода в среде, что частично объясняет место его колонизации. Важное биохимическое свойство этой бактерии — уреазная активность, то есть способность ферментативно расщеплять мочевину. Это нужно для защелачивания среды.
По данным метаанализа 2017 года [1] более половины населения планеты являются носителями хеликобактерной инфекции: среди 14 006 публикаций с 1970 по 2016 год, посвященных H. pylori, был произведен тщательный отбор всех случаев. Картину распространения можно увидеть на рисунке 1.
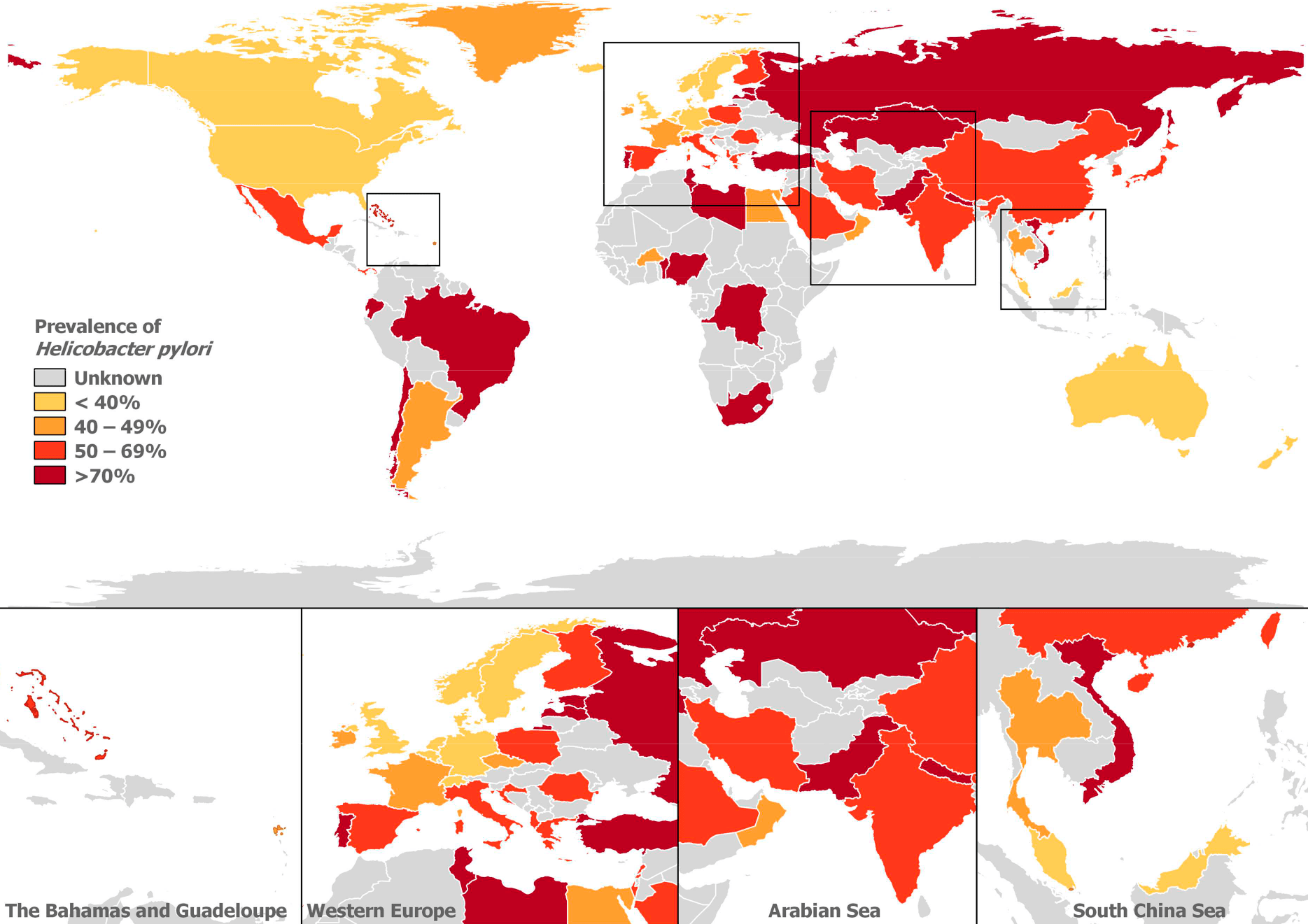
Рисунок 1. Распространенность инфицирования H. pylori на континентах. Бордовым цветом обозначены максимально инфицированные регионы и части света — большая часть Евразии, Бразилия, страны Центральной Африки.
CagA — опасное оружие
Почему многие люди могут спокойно сосуществовать с бактерией и не испытывать никакого дискомфорта, в то время как другие инфицированные наизусть знают дорогу в кабинет гастроэнтеролога? Дело в том, что у нашего преступника есть оружие — фактор патогенности, вызывающий структурные и функциональные изменения в клетках желудка — cagA (cytotoxin-associated gene A). В геноме бактерии есть так называемые островки патогенности (PAI) — области, где закодированы белки системы секреции IV типа. Это белковые комплексы, благодаря которым осуществляется транспорт различных белков-субстратов из бактериальной клетки в эукариотическую. В частности продукта гена — CagA — в клетку хозяина. Однако cagA не обладает сходной последовательностью у всех штаммов бактерии: в зависимости от аминокислотного состава выделяют западную специфическую последовательность этого гена (Western cagA specific sequence, WSS) и его восточно-азиатскую специфическую последовательность (East Asian cagA specific sequence, EASS) [2]. Кроме того, в участке, который непосредственно кодирует фактор патогенности, могут наблюдаться различия в нуклеотидной последовательности со стороны 3′-конца [3]. В других случаях кусок PAI может отсутствовать вовсе, на основании чего выделяют несколько участков полиморфизма 3′-конца (A, B, C, D), представленных на рисунке 2.
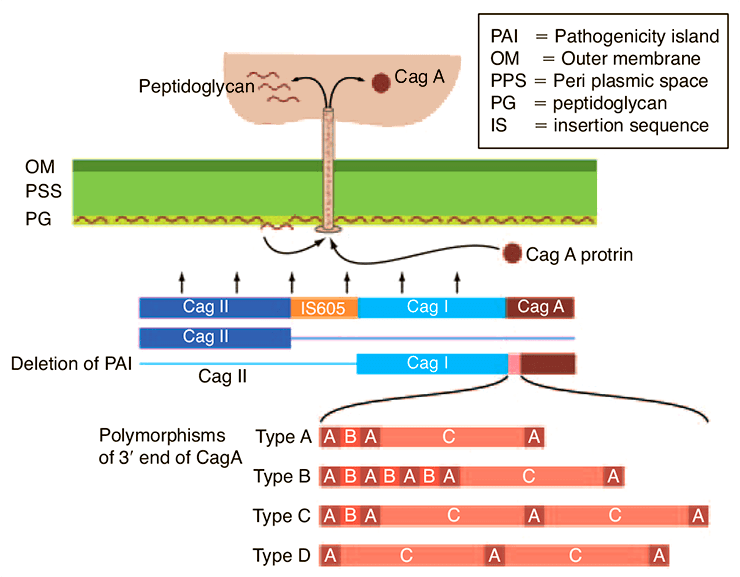
Рисунок 2. Схема PAI у H. pylori. Зеленым цветом обозначены внутренняя и наружная мембраны микроба с периплазматическим пространством между ними. В мембраны встроен белковый комплекс системы секреции IV типа, благодаря которой CagA попадет в эпителиоцит желудка.
Один в поле воин
Условно процесс инфицирования человека хеликобактером можно разделить на три основные стадии — активная фаза, стационарная фаза и фаза колонизации. В активную фазу бактерия быстро передвигается при помощи своих жгутиков в пилорический отдел желудка. Уреаза, о которой говорилось выше, сдвигает pH в сторону щелочного. Затем происходит связывание со специфическими рецепторами, в том числе фукозосвязывающим рецептором. CagA проникает в клетку, а микроб начинает колонизацию, после чего цикл повторяется вновь и вновь, индуцируя воспаление и другие дегенеративные процессы [4].
Именно из-за фукозосвязывающего рецептора микроб представляет бóльшую опасность для людей с первой группой крови по системе AB0 [5]. А все дело в том, что антиген Льюиса эритроцитов является одним из рецепторов, способствующим адгезии хеликобактера. Результаты очередного метаанализа показывают, что H. pylori имеет такое сродство только в этой группе крови и при этом не связан с другими и резус-фактором [6].
Улики — новые и не очень
Есть большое число публикаций, где описана роль матриксных металлопротеиназ в возникновении воспаления при инфицировании человека различными микроорганизмами — например, Pseudomonas aeruginosa [7] или Borrelia burgdorferi [8]. Матриксные металлопротеиназы (MMP) — это ферменты, которые разрушают внеклеточный матрикс. Они классифицируются по своей субстратной специфичности. Например, коллагеназы разлагают коллаген, эластазы — эластин. Исследование на клеточной линии AGS (клетки человеческой аденокарциномы желудка) и других клеточных линиях показало, что синтез MMP-7, MMP-1, MMP-25 и, в частности, MMP-10, повышается в ответ на присутствие микроба [9]. В клетках AGS уровень мРНК измеряли при помощи RT-qPCR (reverse transcription quantitative polymerase chain reaction) — ПЦР с использованием обратной транскриптазы. Уровень MMP-10 также определили путем вестерн-блоттинга. Если вы еще не знакомы с данными методами, прочитать о них можно здесь [35]. Однако я сделаю акцент на исследовании, где эксперименты проводились на мышах и биологическом материале пациентов с инфекцией H. pylori [10].
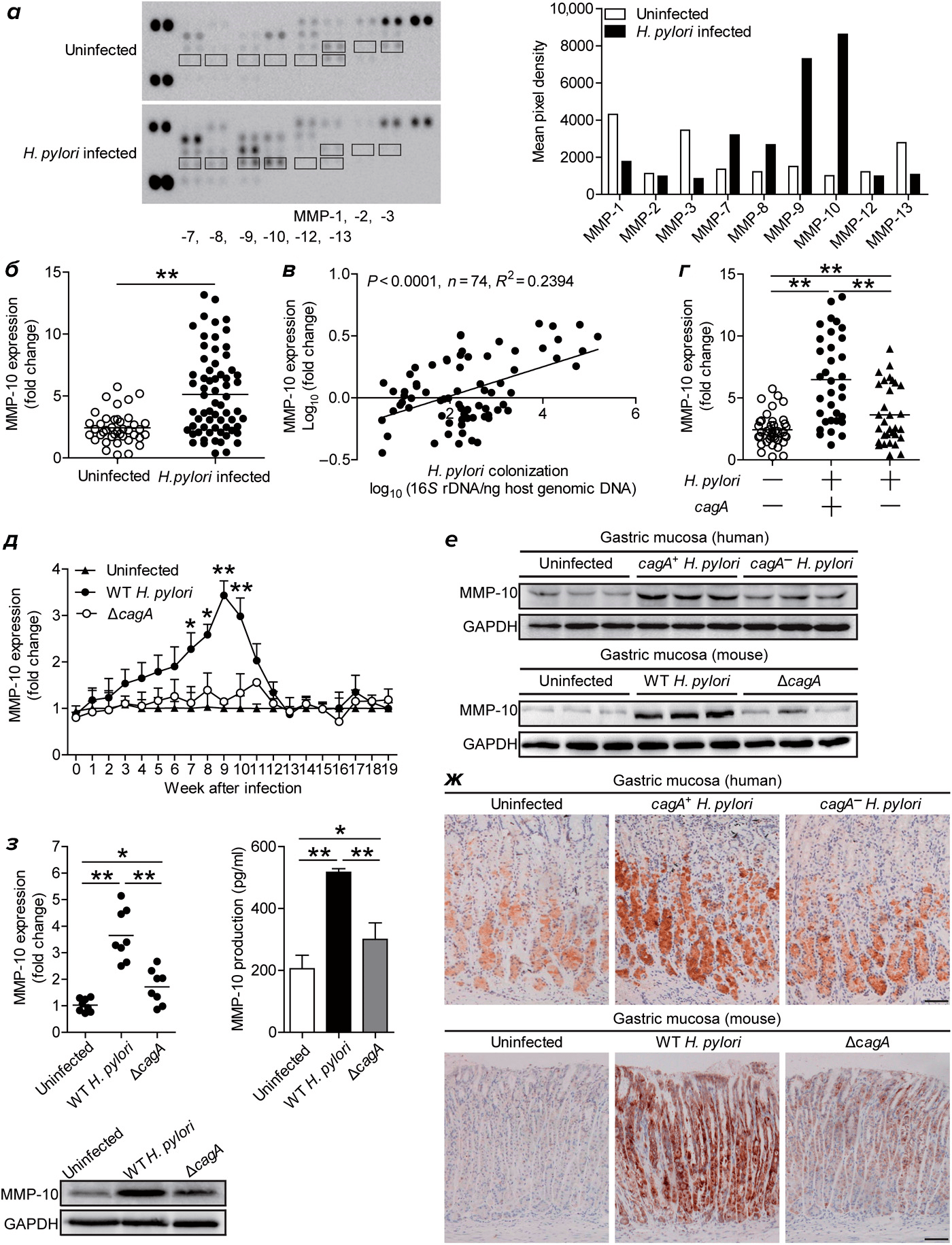
Рисунок 3. Индукция MMP-10 в ответ на H. pylori детектируется различными иммунологическими методами.
а — В образцах, обведенных прямоугольниками, представлены матриксные металлопротеиназы, уровень которых был зафиксирован антителами. Невооруженным глазом видно, что образцы с MMP-10 самые яркие из представленных.
б — Уровень продукции MMP-10 по результатам qPCR в группе инфицированных пациентов (n = 65) выше, чем в контрольной (n = 40).
в — Корреляция между уровнем синтеза MMP-10 и колонизацией микроорганизма, измеренной в логарифме от количества 16S рДНК на 1 нг ДНК хозяина.
г — Уровень производства MMP-10 высок в группе с H. pylori дикого типа (n = 34), но при этом разница между контрольной группой (n = 40) и группой со штаммом без CagA (n = 31) очень мала.
д — У мышей с инфицированием патогенным штаммом синтез MMP-10 сначала растет, а затем снижается после девятой недели, а при инфицировании △cagA, то есть штаммом с нокаутом этого гена, (по 5 мышей на группу) незначительно колеблется относительно контроля.
е и ж — Уровень MMP-10 сравнили в этих группах также на вестерн-блоттинге и иммуногистохимии соответственно. Результаты говорят сами за себя!
На рисунке 3D можно увидеть, что уровень синтеза MMP-10 возрастает в ответ на инфицирование H. pylori, ассоциированного с CagA, а в «непатогенном» штамме этот показатель повышен незначительно. Такой эффект наблюдается и на вестерн-блоттинге (рисунок 3е), а также отчетливо виден при иммуногистохимической окраске (рисунок 3ж) при сравнении всех трех групп среди мышей и пациентов.
Подробнее о методе иммуногистохимии можно почитать в статье «Работа с клетками: автоматизируй и властвуй» [36].
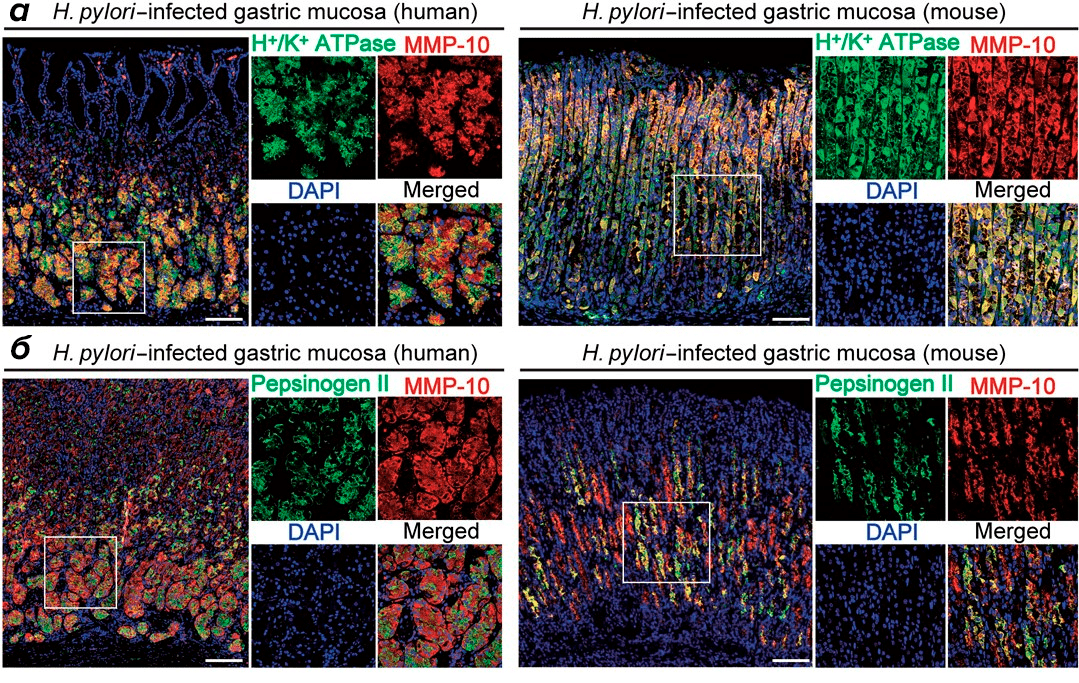
Рисунок 4. Только взгляните на эту красоту! Иммуногистохимия желудочного эпителия (окрашивание антителами и идентификация под флуоресцентным микроскопом).
а — Эпителий желудка человека слева и мыши справа с окрашиванием ядер (DAPI) — синий, H+/K+ATPазы — зеленый (маркер обкладочных клеток), а в красном цвете — наша главная улика, MMP-10.
б — Аналогичное окрашивание, но с нюансом — использовался маркер главных клеток — пепсиноген, на основании чего можно сделать вывод, что содержание MMP-10 высокое в обоих типах клеток.
В самое пекло
Представим себе такую ситуацию: в государстве К. у вас есть магазин и его грабят, срабатывает сигнализация, сигнал SOS сразу доходит до соответствующих органов. При этом в государстве К. очень суровое законодательство, поэтому последним разрешается открыть огонь на поражение. Итог — полуразрушенное дорогое имущество в вашем магазине, зато грабители ушли ни с чем (вернее, вообще не ушли). Примерно такой же сигнал SOS посылает и клетка при неблагоприятной обстановке для привлечения иммунной системы. В роли сигнализации выступают хемокины — белковые молекулы, обеспечивающие хемотаксис (движение, вызванное химическим раздражителем) клеток в очаг воспаления. Но к сожалению, всегда приходится чем-то жертвовать, и такие иммунные «атаки» заканчиваются не лучшим образом и для самой клетки. Соответственно, следующей гипотезой, которую нужно было проверить — связаны ли продукция MMP-10 с продукцией хемокина CXCL 16? Ответ — да. Чтобы понять, какие именно клетки собираются на сигнал, провели проточную цитометрию. Оказалось, что активнее всего по сравнению с другими клетками на место преступления слетаются Т-киллеры. Благодаря проведенному анализу in vitro transwell assay (метод, при котором клетки разделяются проницаемой только для молекул мембраной) исследователи выяснили, что меньше всего клеток мигрирует в лунках с добавлением siRNA против MMP-10.
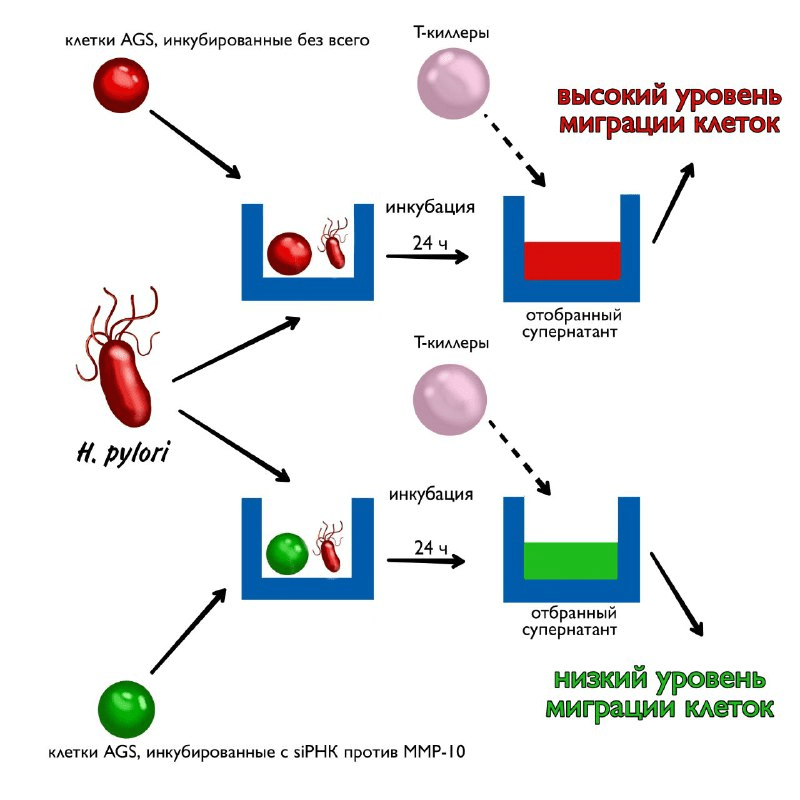
Рисунок 5. На поле выходит новый игрок — хемокин CXCL16, за которым следуют T-клетки. Клетки AGS проинкубировали с хеликобактером, затем собрали супернатант и переместили в лунку с полупроницаемой мембраной. Миграциию Т-клеток оценивали с помощью метода transwell assay: меньше всего клеток мигрирует в лунках с добавлением siRNA против MMP-10.
[10], рисунок адаптирован
А винить-то кого?
Мы постепенно приближаемся к разгадке — каким образом MMP-10 взаимодействует с эпителием желудка и как это приводит к гастриту и язве? Вернемся к исследованию [9]. В статье рассматривается роль сигнального пути EGFR — рецептора эпидермального фактора роста. Основная задача данного пути — стимуляция клеточного роста и дифференцировки. Оказалось, что он связан и с повышением синтеза MMP-10. Как мы уже хорошо усвоили, наиболее эффективный способ проверить, влияет ли та или иная молекула на активность другой — выключить что-то в середине и посмотреть, что будет в конце. Поэтому благодаря ингибированию отдельных белков каскада, исследователи смогли выстроить ось от EGF до MMP-10. Еще в одном раннем исследовании [11] показали, что EGF-зависимый каскад ингибируется белком p38, а вследствие этого снижается производство MMP-1.
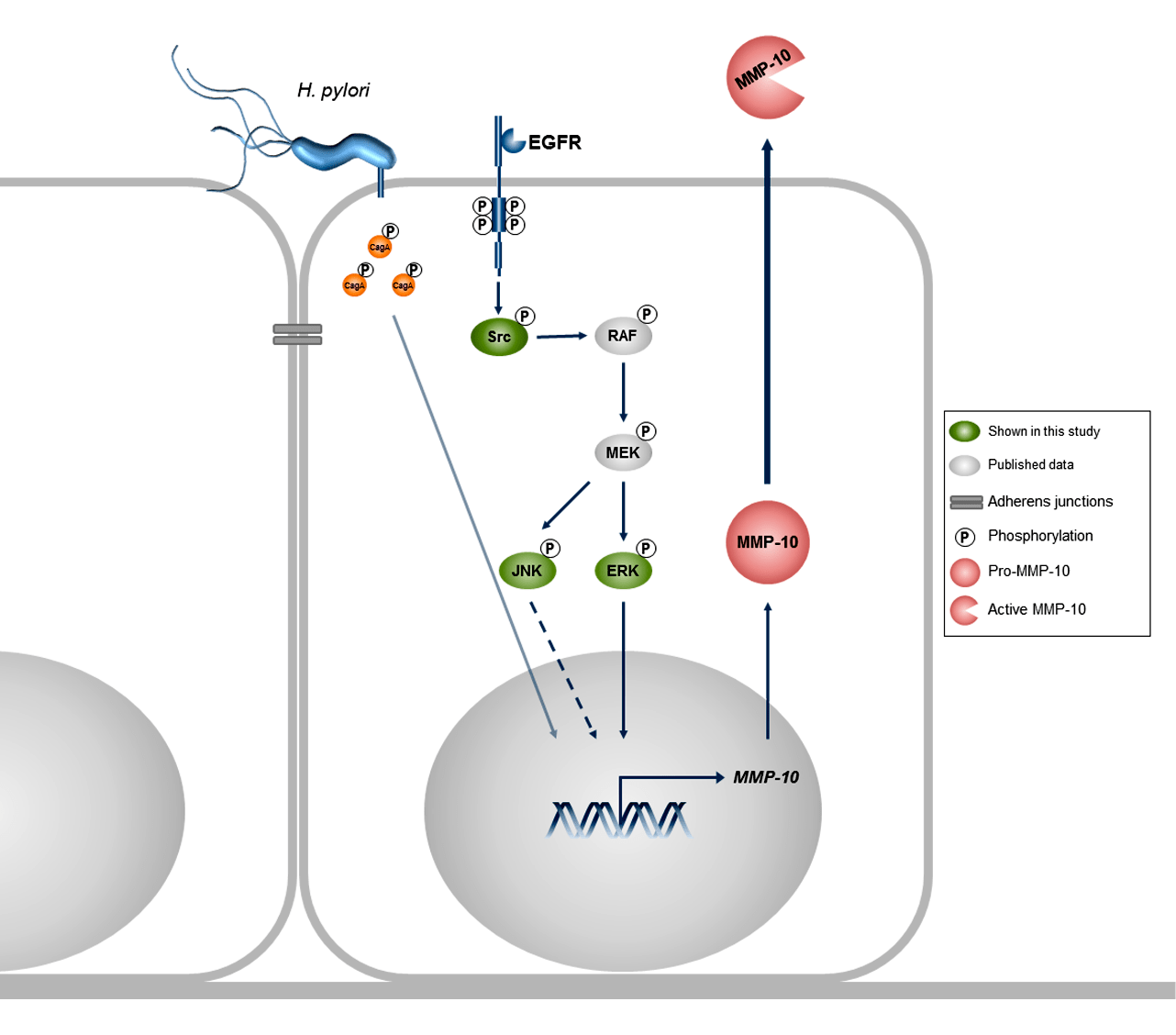
Рисунок 6. Сигнальный путь EGFR. После того, как СagA проникает в клетку, он фосфорилируется киназами и вместе с активацией Src-киназы через EGF-зависимый путь увеличивает синтез MMP-10.
Выходит, что на индукцию MMP-10 влияют минимум два фактора — IL-22 со стороны иммунной системы и СagA со стороны хеликобактера. А далее следует то, что мы так долго ждали: MMP-10 взаимодействует с белками собственной защиты организма — β-дефензинами и Reg3. Классическая роль Reg3 заключается в проявлении антимикробной активности, хотя сейчас его рассматривают даже как гормон [12]. В присутствии H. pylori содержание Reg3 падает. При этом на мышах, которые не могут вырабатывать MMP-10 и IL-22, наблюдается противоположный эффект.
Наконец, собрав все улики, мы с чистой совестью можем представить картину, изображенную на рисунке 7. Однако не спешите радоваться, ведь это лишь одно преступление.
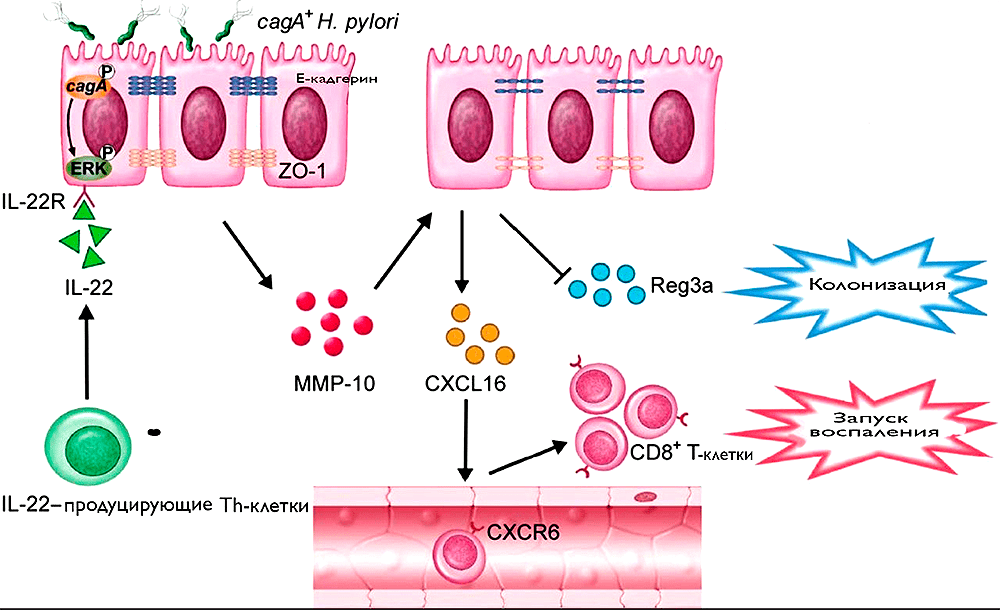
Рисунок 7. Схема раскрытого преступления. Продукт гена cagA проникает в эукариотическую клетку и фосфорилируется. В таком виде СagA и IL-22 активируют сигнальный путь EGPR, в результате чего с помощью киназы ERK в клетке повышается продукция MMP-10. Последняя нарушает естественную защиту клетки в лице Reg3a, что усиливает колонизацию хеликобактером. Эпителиоцит посылает сигнал в виде хемокина CXCL 16, что вызывает миграцию T-киллеров и прогрессию воспаления.
Другие орудия
На самом деле у H. pylori наряду с CagA есть еще одно весьма опасное оружие — VacA (vacuolating cytotoxin) [13]. Более 20 лет назад он вызывал у специалистов недоумение из-за противоречивых данных [14]. Одни работы показывали, что VacA имеет высокое сродство только к особым клеткам-мишеням [15], [16], другие утверждали обратное — вызываемые им адгезия и пиноцитоз неспецифичны [17]. Механизм действия VacA заключается в том, что он формирует каналы в мембране, после чего она становится проницаемой для низкомолекулярных веществ. Последующий транспорт организуется связываем цитоскелета, а именно F-актина [18] и проникновением в так называемые GEEC (англ. glycosylphosphatidylinositol-anchored protein-enriched endosomal compartments — области клетки, богатые белками, заякоренными гликозилфосфотидилинозитолом). Эти области также называют VCV — VacA containing vacioles (VacA-содержащие вакуоли) [19]. Интересно, что токсин неизвестным образом проникает в митохондрии. В статье [14] предположили несколько вариантов. Первая идея заключается в том, что Vac-содержащие вакуоли (VCV) сливаются с мембраной митохондрий и помогают переносить VacA внутрь них. Однако ей противоречит предположение, что VCV не сливаются с митохондриями, а лишь соприкасаются с ними. Еще одна гипотеза гласит, что VCV не задействованы в перемещении токсина VacA вовсе. Вместо вакуолей, транспорт осуществляет белок-переносчик, находящийся непосредственно в мембране митохондрий.
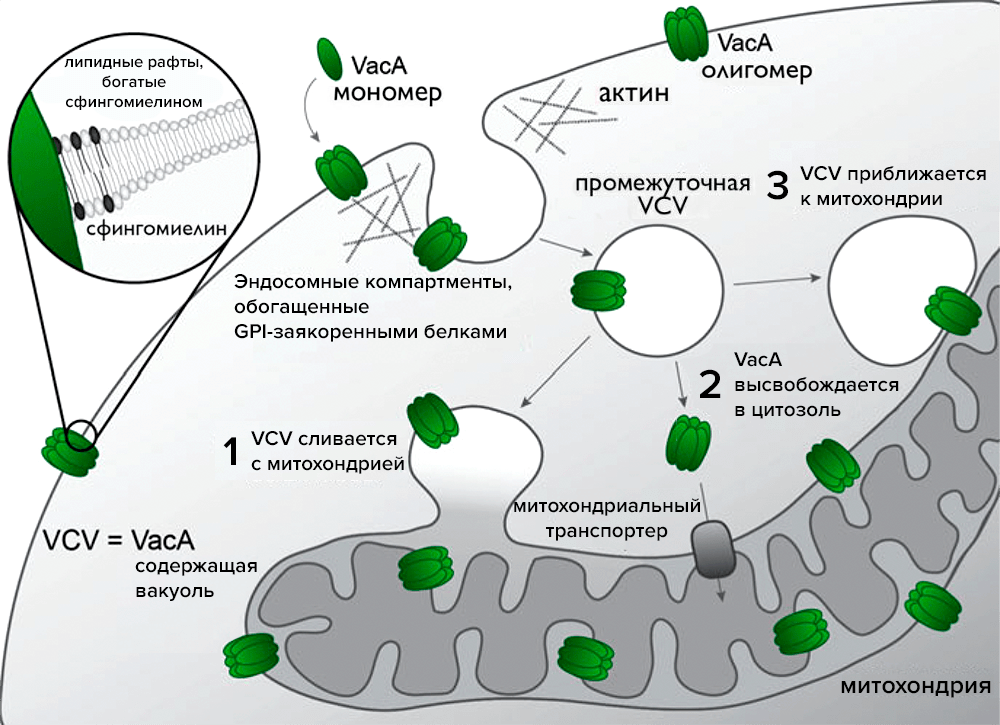
Рисунок 8. VacA хулиганит не меньше CagA. Загадочный внутриклеточный транспорт VacA с тремя возможными путями попадания в митохондрии:
1) Транспорт VacA при помощи VCVs (VacA containing vacuoles).
2) VacA проникает в митохондрии с помощью транспортера.
3) VacA находится между VCVs и митохондриями.
Часто бывает, что если какое-то вещество собирается идти в митохондрии, то явно не с добрыми намерениями. VacA — не исключение: он запускает один из митохондриальных механизмов апоптоза, когда из цепи переноса электронов «вылетает» цитохром C. Как можно уже догадаться, H. pylori с нокаутом vacA намного хуже колонизирует слизистые желудка по сравнению с диким типом [14].
Связь с бронхиальной астмой
На «Биомолекуле» эта тема уже поднималась в обзоре 2017 года [37]. Отрицательная корреляция между антителами к H. pylori и бронхиальной астмой — дело интересное. Проблема в том, что работы на эту тему имеют достаточно противоречивые результаты. Одни исследования подтверждают взаимосвязь вследствие влияния инфекции [20], [21], другие говорят об обратном [22]. В одном из свежих метаанализов по этой теме [23] были взяты случаи 197 детей с ECA (Environment and Childhood Asthma). Оказалось, что дети с титром антител к CagA в двухлетнем возрасте не сталкивались с бронхиальной астмой в 16 лет в отличие от детей без антител в том же возрасте. Однако как всегда есть «но»: гипотеза о том, что H. pylori в раннем детстве предотвращает развитие астмы, не поддерживается статистически. Исследователи подчеркнули, что данный эффект требует дальнейшего подтверждения. Только тогда можно будет смело заявить, что H. pylori помогает бороться с астмой.
Тромбоциту тоже досталось
Если с бронхиальной астмой еще не все понятно, то вот вам реальная жертва — ни в чем не повинные тромбоциты. Оказывается, H. pylori связан с такой патологией как идиопатическая тромбоцитопеническая пурпура (ITP) [24]. Это аутоиммунное заболевание, при котором в организме вырабатываются антитела к собственным тромбоцитам, что приводит к довольно тяжелым последствиям. В 2010-м обнаружили связь между антителами к CagA и пониженным содержанием тромбоцитов в крови у пациентов с H. pylori, причем количество тромбоцитов приходило в норму при проведении эрадикационной терапии (специальная схема приема антибиотиков для избавления от хеликобактера). Результаты подтвердились и в исследовании [25], где у пациентов отслеживали содержание тромбоцитов в зависимости от времени после эрадикации H. pylori, а также подтвердились в другой новой работе [26].
Он и здесь замешан...
Настало время подробнее поговорить о роли хеликобактера в канцерогенезе. Высказывались разные гипотезы на этот счет, но все равно было непонятно, каким образом бактерия может быть причастна к возникновению рака. Один из механизмов — печальная классика — ингибирование белка p53, известного благодаря своей способности отправлять клетку в апоптоз, путем активации определенных сигнальных каскадов [27].

Рисунок 9. Сигнальные пути, индуцируемые CagA, которые регулируют продукцию белка p53. Последовательная активация протеинкиназ посредством CagA приводит к снижению активности белка p53. Другой путь — влияние на экспрессию гена p53. Результат один — снижение надзора за возникновением опухолевых процессов в клетке.
Однако совсем недавно вышла статья, в которой исследователи описали молекулу РНК, регулирующую продукцию онкопротеинов H. pylori [28]. Когтистых песчанок и мышей заразили патогенным штаммом H. pylori ATCC 43504, а затем изолировали хеликобактера из желудков. После исследователи посмотрели, какие молекулы РНК синтезируются у бактерии больше остальных. Одна из них — HPnc4160 — вызвала неподдельный интерес. Именно эта некодирующая РНК регулирует адаптацию микроба к среде хозяина. Причем степень канцерогенности бактерии растет со снижением уровня HPnc4160. Происходит это за счет того, что РНК снижает продукцию CagA, который, как мы уже выяснили, играет одну из ключевых ролей в патогенезе инфекции. Что нам может дать эта находка? С одной стороны, пока нет данных о возможном применении этой молекулы, например, в лечении, поскольку исследование свежее. С другой стороны, нахождение подобной «ахиллесовой пяты» дает целый пласт для новых исследований. Нам остается только с предвкушением ждать их.
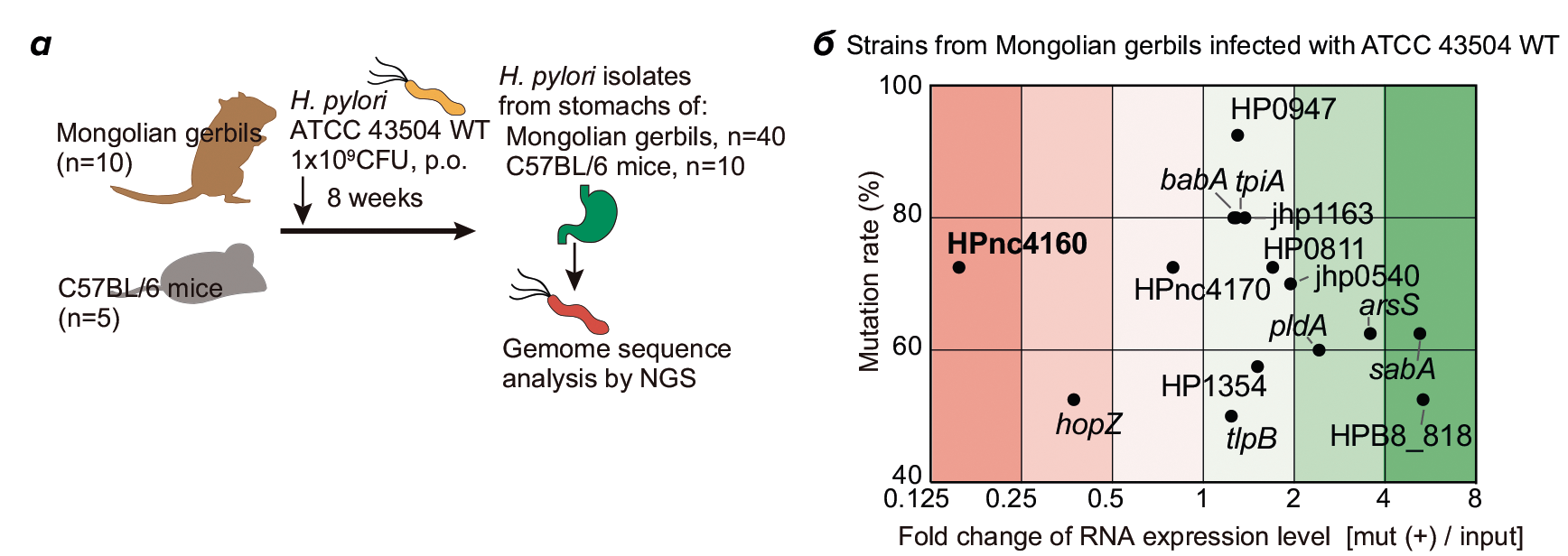
Рисунок 10. Схема эксперимента. а — Изъятие биологического материала и последующий анализ NGS. б — Скорость мутаций в молекулах различных РНК.
Есть достаточно интересные данные о том, что диффузные В-крупноклеточные лимфомы (DBCL) у пациентов с инфекцией H. pylori являются более чувствительными к химиотерапии по сравнению с лимфомами неинфицированных [29]. Для этого проанализировали случаи 95 пациентов, 46 из которых были HP-позитивными и 49 — HP-негативными, а затем у них оценили индексы выживаемости — пятилетней (англ. event-free survival, EFS) и общей (англ. overall survival, OS). Более того, у инфицированных с высокой экспрессией cagA в опухолевых клетках ситуация обстояла лучше: оба индекса выживаемости были выше, чем у неинфицированных. Возникает резонный вопрос — как это работает? Возможно, хеликобактер настолько агрессивно действует на все компоненты клеточного звена желудка, что опухоль больше не может активно продолжать рост и становится уязвимой для лечения.
Как с этим бороться?
Все выходки хеликобактера, описанные выше, «заманчивы», но возникает главный вопрос — а делать-то что? Наиболее тривиальный подход к лечению инфекции — эрадикационная терапия, о которой было сказано выше, включающая в себя прием стандартного курса антибиотиков по определенной схеме [30], [31]. Кроме того, успехов достигла и терапия с использованием висмута [32]. На фоне постепенного повышения антибиотикорезистентности [33] она является особенно актуальной. И тут мы вспоминаем про одну из наших улик — MMP-10: ее же можно ингибировать. Не так давно были описаны эффекты применения антител против этого белка, полученные и сконструированные при помощи иммунизации лам [34]. Особенностью данных антител является то, что у них отсутствует константный домен тяжелой цепи и полностью отсутствует легкая цепь (рисунок 11) . Эта деталь в строении позволяет данным антителам быть более селективными по сравнению с каноническими.
Подобные антитела есть и, например, у верблюдов — «От рака вылечит... верблюд!» [38].
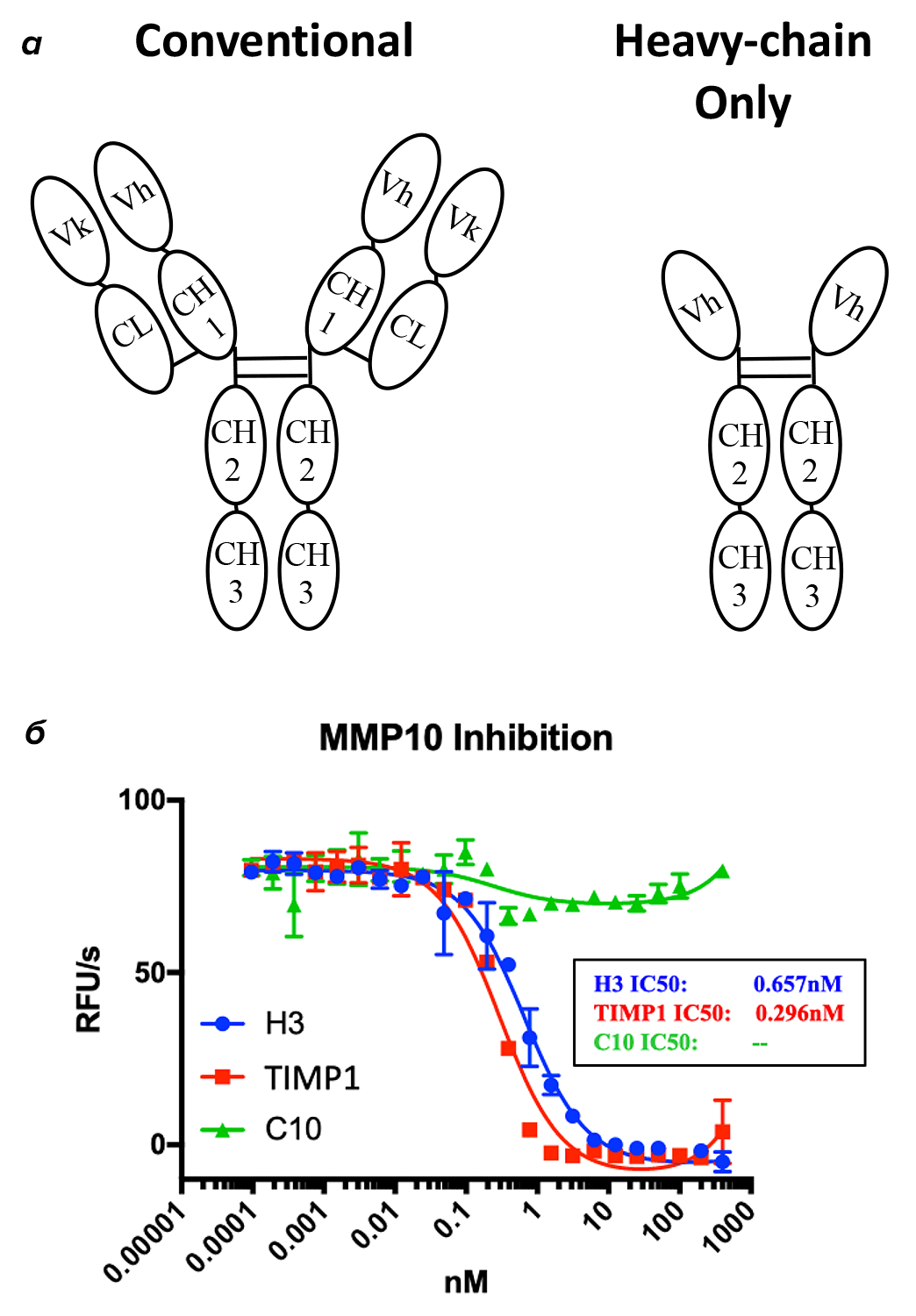
Рисунок 11. Необычные антитела против MMP-10 — новый шаг на пути к лечению. а — Сравнение структуры канонических антител и использованных в работе. б — Протестированные антитела продемонстрировали селективное ингибирование MMP-10.
Исследователи полагают, что данный подход можно будет использовать как таргетную терапию во многих заболеваниях, к которым причастна MMP-10, не только H. pylori. Вы спросите: зачем нам знать про каких-то там лам? Дело в том, что работа является экспериментальной. Не исключено, что подобные антитела можно синтезировать и при помощи иммунизации человека. Должно быть проведено необходимое количество исследований, показывающих, что все это работает как надо. На это нужно лишь время.
Эпилог
В заключение хочу сказать следующее:
Мы рассмотрели только что
Его опасные повадки.
Неуязвимость и коварство,
а в организме — неполадки.
Надежда робкая питает,
Что выбраны мишени верно,
Преодоления день настанет,
Долой злодея непременно!
Литература
- James K.Y. Hooi, Wan Ying Lai, Wee Khoon Ng, Michael M.Y. Suen, Fox E. Underwood, et. al.. (2017). Global Prevalence of Helicobacter pylori Infection: Systematic Review and Meta-Analysis. Gastroenterology. 153, 420-429;
- Jianchang Zhou, Jianzhong Zhang, Caipu Xu, Lihua He. (2004). cagA genotype and variants in Chinese Helicobacter pylori strains and relationship to gastroduodenal diseases. Journal of Medical Microbiology. 53, 231-235;
- John Holton. (2010). Peptic Ulcer Disease. Essentials of Genomic and Personalized Medicine. 627-642;
- Kierszenbaum A.L. and Tres L.L. Histology and cell biology: an introduction in pathology (5th Edition). Elsevier, 2019. — 824 p.;
- Thomas Borén, Per Falk, Kevin A. Roth, Göran Larson, Staffan Normark. (1993). Attachment of Helicobacter pylori to Human Gastric Epithelium Mediated by Blood Group Antigens. Science. 262, 1892-1895;
- Zakaria Chakrani, Karen Robinson, Bineyam Taye. (2018). Association Between ABO Blood Groups and Helicobacter pylori Infection: A Meta-Analysis. Sci Rep. 8;
- Sean Y. Kassim, Sina A. Gharib, Brigham H. Mecham, Timothy P. Birkland, William C. Parks, John K. McGuire. (2007). Individual Matrix Metalloproteinases Control Distinct Transcriptional Responses in Airway Epithelial Cells Infected with Pseudomonas aeruginosa. Infect Immun. 75, 5640-5650;
- Aruna K. Behera, Ethan Hildebrand, Joanna Scagliotti, Allen C. Steere, Linden T. Hu. (2005). Induction of Host Matrix Metalloproteinases by Borrelia burgdorferi Differs in Human and Murine Lyme Arthritis. Infect Immun. 73, 126-134;
- Angela M. Costa, Rui M. Ferreira, Ines Pinto-Ribeiro, Ioanna S. Sougleri, Maria J. Oliveira, et. al.. (2016). HelicobacterpyloriActivates Matrix Metalloproteinase 10 in Gastric Epithelial Cells via EGFR and ERK-mediated Pathways. J Infect Dis.. 213, 1767-1776;
- Yi-pin Lv, Ping Cheng, Jin-yu Zhang, Fang-yuan Mao, Yong-sheng Teng, et. al.. (2019). Helicobacter pylori –induced matrix metallopeptidase-10 promotes gastric bacterial colonization and gastritis. Sci. Adv.. 5;
- Michael H. Pillinger, Nada Marjanovic, Seok-Yong Kim, Yong-Chan Lee, Jose U. Scher, et. al.. (2007). Helicobacter pylori Stimulates Gastric Epithelial Cell MMP-1 Secretion via CagA-dependent and -independent ERK Activation. Journal of Biological Chemistry. 282, 18722-18731;
- Jae Hoon Shin, Randy J Seeley. (2019). Reg3 Proteins as Gut Hormones?. Endocrinology. 160, 1506-1514;
- Victor J. Torres, Susan E. Ivie, Mark S. McClain, Timothy L. Cover. (2005). Functional Properties of the p33 and p55 Domains of the Helicobacter pylori Vacuolating Cytotoxin. Journal of Biological Chemistry. 280, 21107-21114;
- Timothy L. Cover, Robin L. Holland, Steven R. Blanke. (2016). Helicobacter pylori Vacuolating Toxin. Helicobacter pylori Research. 113-141;
- Paola Massari, Roberto Manetti, Daniela Burroni, Sandra Nuti, Nathalie Norais, et. al.. (1998). Binding of the Helicobacter pylori Vacuolating Cytotoxin to Target Cells. Infect Immun. 66, 3981-3984;
- Wen-Ching Wang, Hung-Jung Wang, Chun-Hsien Kuo. (2001). Two Distinctive Cell Binding Patterns by Vacuolating Toxin Fused with Glutathione S-Transferase: One High-Affinity m1-Specific Binding and the Other Lower-Affinity Binding for Variant m Forms. Biochemistry. 40, 11887-11896;
- Vittorio Ricci, Antoine Galmiche, Anne Doye, Vittorio Necchi, Enrico Solcia, Patrice Boquet. (2000). High Cell Sensitivity toHelicobacter pyloriVacA Toxin Depends on a GPI-anchored Protein and is not Blocked by Inhibition of the Clathrin-mediated Pathway of Endocytosis. MBoC. 11, 3897-3909;
- Nils C. Gauthier, Pascale Monzo, Vincent Kaddai, Anne Doye, Vittorio Ricci, Patrice Boquet. (2005). Helicobacter pyloriVacA Cytotoxin: A Probe for a Clathrin-independent and Cdc42-dependent Pinocytic Pathway Routed to Late Endosomes. MBoC. 16, 4852-4866;
- Nils C. Gauthier, Pascale Monzo, Teresa Gonzalez, Anne Doye, Amanda Oldani, et. al.. (2007). Early endosomes associated with dynamic F-actin structures are required for late trafficking of H. pylori VacA toxin. Journal of Cell Biology. 177, 343-354;
- M. J. Blaser, Y. Chen, J. Reibman. (2008). Does Helicobacter pylori protect against asthma and allergy?. Gut. 57, 561-567;
- Yu Chen, Martin J. Blaser. (2008). Helicobacter pyloriColonization Is Inversely Associated with Childhood Asthma. J INFECT DIS. 198, 553-560;
- Yan Wang, Yutian Bi, Liang Zhang, Changzheng Wang. (2012). Is Helicobacter Pylori Infection Associated with Asthma Risk? A Meta-Analysis Based on 770 Cases and 785 Controls. Int. J. Med. Sci.. 9, 603-610;
- Kjetil K. Melby, Karin L. Carlsen, Geir Håland, Helvi H. Samdal, Kai-Håkon Carlsen. (2020). Helicobacter pylori in early childhood and asthma in adolescence. BMC Res Notes. 13;
- Шумихин А.В., Туев А.В., Желобов В.Г., Хлынова О.В. (2010). Иммунная тромбоцитопения, ассоциированная с инфекцией Helicobacter pylori: патогенез, диагностика и лечение. «Пермский медицинский журнал». 6, 13–18;
- Hee Sang Tag, Ho Sup Lee, Su-Hyeon Jung, Bu-Kyung Kim, Sung-Bin Kim, et. al.. (2010). Effects ofHelicobacter pylorieradication in patients with immune thrombocytopenic purpura. Korean J Hematol. 45, 127;
- Ayoung Lee, Junshik Hong, Hyunsoo Chung, Youngil Koh, Soo-Jeong Cho, et. al.. (2020). Helicobacter pylori eradication affects platelet count recovery in immune thrombocytopenia. Sci Rep. 10;
- Xin Yong, Bo Tang, Bo-Sheng Li, Rui Xie, Chang-Jiang Hu, et. al.. (2015). Helicobacter pylori virulence factor CagA promotes tumorigenesis of gastric cancer via multiple signaling pathways. Cell Commun Signal. 13;
- Ryo Kinoshita-Daitoku, Kotaro Kiga, Masatoshi Miyakoshi, Ryota Otsubo, Yoshitoshi Ogura, et. al.. (2021). A bacterial small RNA regulates the adaptation of Helicobacter pylori to the host environment. Nat Commun. 12;
- S-H Kuo, K-H Yeh, L-T Chen, C-W Lin, P-N Hsu, et. al.. (2014). Helicobacter pylori-related diffuse large B-cell lymphoma of the stomach: a distinct entity with lower aggressiveness and higher chemosensitivity. Blood Cancer Journal. 4, e220-e220;
- Javier Molina–Infante, Marco Romano, Miguel Fernandez–Bermejo, Alessandro Federico, Antonietta G. Gravina, et. al.. (2013). Optimized Nonbismuth Quadruple Therapies Cure Most Patients With Helicobacter pylori Infection in Populations With High Rates of Antibiotic Resistance. Gastroenterology. 145, 121-128.e1;
- Wei Zhang, Qi Chen, Xiao Liang, Wenzhong Liu, Shudong Xiao, et. al.. (2015). Bismuth, lansoprazole, amoxicillin and metronidazole or clarithromycin as first-lineHelicobacter pyloritherapy. Gut. 64, 1715-1720;
- David Y. Graham, Sun-Young Lee. (2015). How to Effectively Use Bismuth Quadruple Therapy. Gastroenterology Clinics of North America. 44, 537-563;
- Chun Gao, Shi-Yu Du, Long Fang, Yan-Hua Fan, Ai-Ping Song, Huang Chen. (2020).
Eradication Treatment of Helicobacter pylori Infection Based on Molecular Pathologic Antibiotic Resistance
. IDR. Volume 13, 69-79; - Amir S. Razai, Brendan P. Eckelman, Guy S. Salvesen. (2020). Selective inhibition of matrix metalloproteinase 10 (MMP10) with a single-domain antibody. Journal of Biological Chemistry. 295, 2464-2472;
- 12 методов в картинках: полимеразная цепная реакция;
- Работа с клетками: автоматизируй и властвуй;
- Хеликобактер попадает в плохую компанию;
- От рака вылечит... верблюд!.






