Работа с клетками: автоматизируй и властвуй
16 апреля 2021
Работа с клетками: автоматизируй и властвуй
- 2650
- 0
- 8
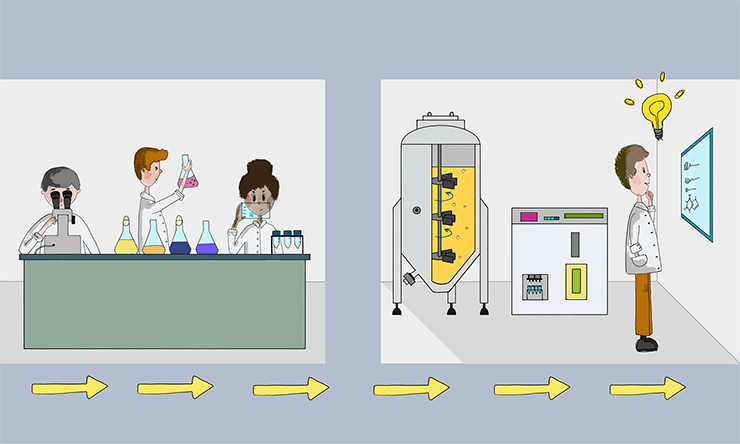
Автоматизация работы с клетками: от чашек Петри и малых объемов к большим биореакторам и новым методам анализа. Рисунок в полном размере.
рисунок Анастасии Волчок
-
Автор
-
Редакторы
-
Иллюстратор
Темы
Работа с живыми клетками в современном мире нужна не только для научных исследований, но и для разработки лекарств, и для диагностики в медицине. Автоматизация в этих отраслях позволила вывести производительность на новый уровень и открыла совершенно новые горизонты. В этой статье спецпроекта «Автоматизация в биологии» мы поговорим о том, как автоматизируют работу с клетками прокариот и эукариот для самых разных задач.
Автоматизация в биологии

Работа в современной биологической лаборатории кардинально отличается от той, что велась в ней каких-то 100–150 лет назад. Многие процедуры давно превратились в рутину, которую зачастую выполняет не сам экспериментатор, а автоматизированные приборы. Это позволяет не только упростить процесс, но и высвободить время для новых творческих задач. В спецпроекте «Автоматизация в биологии» мы проследим, какой путь прошли современные приборы, повсеместно использующиеся в экспериментах по геномике и протеомике, цитометрии, генной инженерии и драг-дизайну.
Куратором спецпроекта стал Денис Баев — глава центра коллективного пользования по проточной цитометрии и сортировке клеток Института канцерогенеза Кандиоло, Италия.
Партнер спецпроекта — компания Beckman Coulter Life Sciences, мировой лидер в разработке решений для автоматизации сложных биомедицинских лабораторных процессов.
Работа с клетками , как прокариотическими, так и эукариотическими — одна из основ современной медицины, биотехнологии и генной инженерии. Клетки — это удобные модели для изучения сложных процессов, незаменимые в разработке лекарств: они становятся «фабриками» по производству белков, а иногда и самими лекарствами. Культивирование эукариот и бактерий, а также любые манипуляции с ними требуют немалого количества действий: от приготовления питательных сред до анализа бактериальных колоний или клеточных линий.
Клеточные технологии как совокупность методик, позволяющих культивировать клетки in vitro, рассмотрены в одноименной статье нашего спецпроекта «12 методов» [4]. Читатели, которых интересуют подробности, благоволят ознакомиться с этим трудом.
Безусловно, ученый в лаборатории, врач клинической диагностики или лаборант фармацевтического производства мог бы делать вручную все необходимые ему процессы: уже десятилетия известно, как культивировать самые разные клетки, как их анализировать под микроскопом, как идентифицировать микроорганизмы... И многие годы действительно приходилось работать только вручную. Однако в современном мире открываются огромные возможности для автоматизации процессов, позволяющие не только сэкономить время и деньги, но и снизить негативное влияние человеческого фактора: никто не застрахован от случайных ошибок, плохого настроения или невнимательности.
В первых двух статьях спецпроекта «Автоматизация в биологии» мы уже рассказали об истории развития автоматизации в научных исследованиях [5], а также представили современные омиксные технологии [6].
Что такое «человеческий фактор» в лаборатории? Людям свойственно ошибаться. Человек может забыть добавить реагент или случайно нарушить условия его хранения. В ситуации, когда время эксперимента (скажем, из-за необходимости многочасовой инкубации клеток) превышает длительность рабочего дня, одному сотруднику трудно вести задачу «от и до», а значит, возникает проблема стандартизации действий между сотрудниками. При визуальной оценке разные люди также могут по-разному интерпретировать результат. Самое большое же ограничение — это производительность. Даже несколько человек не смогут сделать столько же экспериментов, сколько одна платформа для высокопроизводительного скрининга. Конечно, когда речь идет о единичных экспериментах, это может быть не так критично: в конце концов, можно потратить чуть больше времени или повторить исследование. Но как быть, если необходимо наладить стабильное производство или массовую диагностику, и цена ошибки становится очень высокой? Здесь на помощь приходят роботы или, как их еще называют, автоматизированные платформы, в которых можно запрограммировать выполнение однотипных действий и вести работу непрерывно, а человек получает возможность сконцентрироваться на анализе результатов и планировании. В разных сферах уровень автоматизации отличается: работа современной фармацевтической компании уже невозможна без многофункциональных автоматизированных систем в R&D и производственных отделах, а в научных лабораториях чаще автоматизируются только отдельные процессы.
В следующих главах мы рассмотрим, как работа с клетками прокариот и эукариот ведется в ручном режиме, какие есть варианты для полной и частичной автоматизации и что они дают.
Автоматизация работы с бактериями
Без бактерий уже невозможно представить современный биотех: без них не обойтись как в академической науке, так и в фармацевтике. Бактерии помогают понять сложные биологические процессы (например, как работает система репарации — «ремонта» ДНК) на более простой модели или становятся удобной в использовании «фабрикой» по производству белков. Для этого в геном бактерии «добавляют» ген нужного белка, в результате чего клетка производит его наравне со своими собственными.
Подробнее о том, как сделать так, чтобы бактерия «делала» нужный белок, читайте в статье «12 методов в картинках: Генная инженерия» [3].
Продукты генной инженерии достаточно прочно вошли в нашу жизнь: лекарства (вспомним про рекомбинантный инсулин), вакцины против вируса гепатита В, высокоселективные аллергены для кожных проб, реагенты для проведения различных тестов и многое другое. Ну а с анализом бактерий каждый из нас сталкивался хотя бы в рамках клинической диагностики: врач часто просит сдать мочу или мазок со слизистой оболочки, чтобы определить возбудителя болезни.
Культивирование прокариот
Первое, за чем необходимо следить, если работаешь с клетками в лаборатории, — условия их жизни. Правильный ли состав у питательной среды, стерильная ли она? Какая температура необходима для роста бактерий? Какова концентрация бактерий? Не изменился ли pH среды?
При традиционном подходе всё это делает человек: в зависимости от вида бактерий, с которыми идет работа, он выбирает оптимальный состав среды, смешивает все необходимые реагенты, проверяет кислотность, обеззараживает, охлаждает, разливает по колбам или чашкам Петри, помещает на них бактерии, ставит в инкубатор и засекает время, анализирует количество колоний или концентрацию клеток. Дел немало, особенно если не прибегать к помощи!
С простой автоматизацией сегодня знакомы все, кому доводилось работать в лаборатории. Культивирование бактерий в жидкой среде требует перемешивания, поэтому существуют мешалки для колб и флаконов, часто объединенные с инкубаторами. Инкубаторы и термостаты имеют датчики температуры, а автоклав для обеззараживания сред сам выполняет заданную программу, достигая нужной температуры и давления.
Культивирование прокариот может быть необходимо для двух глобальных целей: микробиологической (для последующей идентификации возбудителя заболевания и определения его устойчивости к антибиотику — например, в лаборатории клинической диагностики) и биотехнологической (для наработки большого количества бактерий при производстве нужного белка). Перед тем, как мы поговорим о биотехнологиях, кратко коснемся автоматизации в микробиологических применениях.
Идентификация бактерий и определение их резистентности
Клиническая микробиология — та область медицины, которая занимается идентификацией бактерий и определением их резистентности к антибиотикам. К сожалению, классические методы анализа, полностью выполняемые человеком и включающие в себя выращивание бактерий, последующую идентификацию при помощи различных биохимических реакций, подсчет количества колониеобразующих единиц и определение их лекарственной устойчивости, требуют времени: почти сутки на каждую стадию. В результате анализ занимает несколько дней, и это не учитывая времени на доставку образца из клиники в лабораторию. А ведь такие анализы нужны, чтобы врач мог правильно и вовремя назначить лекарственную терапию, поэтому дорог каждый час: иначе придется назначать пациенту антибиотики наугад, а через несколько дней получать правильный ответ.
Колониеобразующие единицы (КОЕ, англ. Colony Forming Unit, или CFU) — это показатель количества жизнеспособных микроорганизмов в единице объема (1 см3), в жидкости (1 мл), или в твердом/сухом материале (1 г).
Автоматизация в клинической микробиологии позволяет сокращать время анализов до двух раз! Она может быть как полной, когда роботизированные платформы способны готовить среды, чашки и пластины, рассеивать и отбирать колонии, добавлять реагенты, проводить инкубацию и визуальный анализ, так и частичной, когда автоматизирован только отдельный шаг — например, идентификация. Подходы, основанные на микрофлюидных системах, позволяют существенно уменьшить объем образца и сделать возможным одновременное тестирование одной пробы на множество параметров. Кроме того, за счет миниатюризации устройств и автоматизации процессов в перспективе появится возможность проводить анализ непосредственно в клинике или даже в кабинете врача в рамках набирающей популярность концепции Point of Care (диагностики по месту лечения).
Современные решения, широко используемые лабораториями клинической диагностики по всему миру, представляют собой полностью автоматизированные устройства, рассчитанные на беспрерывную работу с большим потоком образцов и определение максимального количества параметров за один раз (видео 1). Тем не менее даже в них по-прежнему остается ряд задач, которые выполняются человеком. Сотрудники все еще размещают расходные материалы и пластик в приборах, участвуют в сортировке образцов, иногда вручную переносят образцы между разными устройствами, подтверждают автоматические отчеты для врачей и так далее.
Видео 1. Лаборатория клинической диагностики Northwell’s Brand
Любопытно, что не всегда в автоматизированной лаборатории используются те же методики анализов, что и в «классической». Яркой иллюстрацией служит масс-спектрометрическая идентификация микроорганизмов (MALDI-TOF MS) [7], которая не имеет аналогов с точки зрения короткого времени для получения результата, универсальности и количества идентифицируемых видов за один раз. Конечно, масс-спектрометр — очень большой и дорогой прибор: окупиться (с точки зрения стоимости одного анализа) он может, только находясь в большой лаборатории со стабильным потоком образцов. Но зато если образцов много, то масс-спектрометрический анализ почти не имеет конкурентов с точки зрения точности и цены в пересчете на каждую пробу.
Одна из важных характеристик бактерий с точки зрения клинической диагностики (да и некоторых научных исследований) — резистентность к различным лекарствам [8–11]. Идентифицировать бактерии и определять их устойчивость к антибиотикам можно по-разному, при этом выбор конкретного метода зависит от целей и возможностей лаборатории. Упомянутые микрофлюидные системы позволяют проводить анализ резистентности к антибиотикам в очень малых объемах и тем самым существенно уменьшать время инкубации, но не столь чувствительны, как традиционные методы оценки роста бактерий, и могут не сработать, если бактерий в образце очень мало [12]. На видео 2 представлен принцип работы такого анализатора MilliDrop.
Видео 2. Анализатор MilliDrop — пример микрофлюидной платформы для роста и анализа бактерий
Про исследования резистентности стоит поговорить чуть подробнее: как и в других случаях, подходы к автоматизации существуют разные! Что можно сделать? Можно автоматизировать стадию визуальной детекции. В этом случае нужно определить, растут ли бактерии в среде, содержащей антибиотик, что может быть сделано при измерении оптической плотности раствора (если речь о бактериях в жидкой среде) или компьютерного анализа изображений (для бактерий на чашках Петри). А можно анализировать молекулярные маркеры, что удобно при работе с некультивируемыми видами бактерий, но требует тщательной очистки образца и увеличивает стоимость анализа. Активно разрабатываются методы идентификации и определения резистентности бактерий [12], основанные на электрохимических сенсорах, микрочипах, масс-спектрометрии или секвенировании. Такое многообразие связано с тем, что при автоматизации рутинных анализов не всегда сразу однозначно понятно, какой метод в итоге окажется лучше, быстрее, дешевле и проще в масштабировании.
Несмотря на то, что автоматизация в общем и целом направлена на оптимизацию всех процессов, иногда стремление любой ценой сократить время анализа играет злую шутку: изменение протоколов анализа требует внимательности и многоступенчатой валидации каждой из методик, иначе результат может получиться непредсказуемым! Например, при классических анализах бактерии выращивают на плашках с агаром более суток, и только после этого определяют их чувствительность к антибиотикам. Но исследования показывали, что в новой автоматической системе тесты на антибиотикорезистентность могут быть считаны уже спустя несколько часов [13]. Позже оказалось, что некоторые механизмы резистентности E. coli проявляются только по прошествии суток, поэтому новая методика давала значительный процент ложноотрицательных результатов. Пришлось вернуться к классическому протоколу исследования — ничего не поделаешь!
Генная инженерия и биотехнологии: наработка белков в бактериях
Последние десятилетия бактерии стали своеобразной «фабрикой» для наработки белков, которые затем можно использовать не только в науке, но и в медицине. Конечно, белки-лекарства можно просто выделять из органов животных и растений — например, раньше инсулин для пациентов с сахарным диабетом получали из поджелудочных желез свиней или крупного рогатого скота. Он, казалось бы, незначительно (всего на несколько аминокислот) отличается от человеческого, но даже это вызывало побочные реакции. Кроме того, для получения 100 г сухого инсулина необходимо почти 4 тонны (!) свиных поджелудочных желез. Сравните это с 25 литрами культуральной среды с модифицированными E. coli, которые дают те же 100 г сухого инсулина [14]. Получение белковых препаратов в бактериях позволяет избежать сложных этапов очистки, которые неизбежно возникают при выделении молекул из органов или биологических жидкостей, а также очевидно является гораздо более этичным по отношению к животным. В результате пациент получает более дешевое, качественное и эффективное лекарство.
Из каких стадий состоит получение рекомбинантного белка в бактериях в лабораторных условиях? Первое, что необходимо сделать — выбрать подходящий вид и линию бактерий (например E. coli), а также внести плазмиду с геном для производства нужного белка и предусмотреть способ контроля этого процесса: например, добавить еще ген устойчивости к антибиотику. Это поможет отследить, успешно ли нужный нам ген встроился в геном бактерии, и отобрать только «правильные» колонии, которые появятся на чашках с питательной средой (и антибиотиком) после инкубации. Существуют и другие методы контроля, например, визуальный: в этом случае в бактерию встраивают ген флуоресцентного белка, такого как GFP.
Подробнее о том, как работать с бактериями и получать рекомбинантные белки, можно прочитать в статье «Генная инженерия» [3].
Мы уже упоминали один очевидный факт: человек или даже группа людей может проанализировать только ограниченное количество материала. А вот с помощью робота можно собрать необычайно много различных генных конструкций, протестировать все возможные варианты трансфекции (внесения нужного гена в бактерию), условия культивирования и виды бактерий, а затем выбрать лучшее. Реактивы и пластик помещаются в прибор, который далее самостоятельно разливает их в нужные пробирки и плашки, регулирует температуру, контролирует скорость роста бактерий... словом, выполняет все те действия, которые обычно делает человек (или даже несколько людей!), но очень точно и в любое время суток: посмотрите видео 3, чтобы понять, как это выглядит!
Видео 3. Система отбора клонов, реализованная на платформе Biomek от Beckman Coulter Life Sciences
Когда отлажен способ выбора нужной колонии и условия для культивирования (температура, интенсивность перемешивания, время), бактерии помещают в большой объем культуральной среды и растят до нужной концентрации (например, контролируя изменение оптической плотности раствора), чтобы наработать большое количество белка. Тут важно соблюдать баланс: с одной стороны, если остановить инкубацию слишком рано, то белка получится мало, но и максимальная концентрация бактерий не всегда означает максимальный выход белка — бактерии реагируют на избыточное присутствие «соседей», в результате чего выход целевого белка снижается. В ситуациях, когда нужно регулярно нарабатывать большие количества белка, в ход идут биореакторы (рис. 2), незаменимые при работе с большими объемами и на предприятиях полного цикла, когда все процессы должны быть непрерывными и стандартизированными. А еще биореакторы сами анализируют перечисленные выше параметры. На последнем этапе наработанный белок выделяют из бактериальной культуры, очищают и определяют концентрацию.

Рисунок 2. Биореактор, оснащенный устройствами для измерения и регулирования параметров процесса культивирования: температуры, рН, аэрации и перемешивания среды и других в режиме реального времени. Биореакторы могут быть укомплектованы датчиком концентрации растворенного кислорода, сигнализатором уровня пены и системой пеногашения, устройством подачи O2 и CO2, барботером, резервуарами для хранения компонентов питательной среды и насосами для их непрерывной подачи в биореактор.
Автоматизация работы с клетками эукариот
Работа с бактериями не может обеспечить полный спектр биотехнологических потребностей современной фармацевтики и науки. Во-первых, некоторые белки удается получить только в эукариотических клетках из-за их сложных посттрансляционных модификаций (например гликозилирования). Во-вторых, клеточные линии человека — прекрасная модель для первоначального скрининга терапевтических молекул, чтобы определиться с дальнейшим направлением разработки лекарства. В-третьих, сами клетки могут быть лекарственными препаратами (см. статью спецпроекта «Генная терапия» «Генная терапия: познакомьтесь с лекарствами будущего» [15]).
Клеточные культуры и первичные клетки — достаточно капризный материал. То, как они себя будут чувствовать, какие дадут результаты, зависит от множества факторов, среди которых температура, содержание углекислого газа, отсутствие контаминаций, соблюдение временных интервалов и стандартизация всех экспериментальных действий. Точно ли наблюдаемый эффект существует или он является всего лишь следствием неточностей при повторении эксперимента? Наибольшую важность эти вопросы приобретают тогда, когда нужно принимать решения о вложении значительного количества денег и времени в разработку, например, при выведении препарата в доклинические испытания.
Подробнее о разработке лекарств в фармацевтике мы поговорим в следующей статье, а в этой рассмотрим, как автоматизируют выделение нужных исследователю клеток, их быстрый скрининг, культивирование и другие процессы, которые в том или ином виде используются теперь почти везде — от научно-исследовательских лабораторий до передовых R&D-отделов фармацевтических корпораций.
Культивирование клеток эукариот
Перед тем, как мы перейдем к современному скринингу и многопараметрическому анализу эукариотических клеток, кратко поговорим об особенностях их культивирования.
Для ведения культур клеток эукариот, как стабильных клеточных линий, например, опухолевых, так и первичных клеточных культур (клеток из органа или ткани пациента или лабораторного животного) необходимо соблюдать некоторые правила. Исследователю приходится обеспечивать стерильные условия, готовить подходящую питательную среду, добавлять в нее необходимые компоненты (сыворотка, антибиотики, ростовые факторы и т.д.), вовремя рассеивать клетки, проверять, что в пробах нет контаминации и инфекций, например, бактерий или микоплазмы. Также нужен контроль постоянства условий: для стабильного роста клеток важна температура, влажность и содержание углекислого газа. В большинстве лабораторий работы по культивированию проводятся в так называемом «клеточном блоке», куда нередко ограничен доступ. Чем меньше людей, тем проще понять, кто или что стало причиной гибели клеточной линии и других неприятностей, а значит и сделать «работу над ошибками».
С описанными выше задачами успешно справляются автоматические платформы: они часто представляют собой большой короб, по габаритам похожий на ламинарный шкаф или химическую тягу, оснащенный различными манипуляторами, системами дозирования и другими встроенными приборами. На видео 4 можно посмотреть, как автомат перемещает фальконы с клетками, открывает и закрывает пробирки, добавляет заданные исследователем реагенты. Сотрудник лаборатории в этом случае следит за наполнением платформы нужными реактивами и пластиком, а также программирует протоколы работы — меньше времени на ручной труд, больше на то, чтобы придумать новые эксперименты или проанализировать полученные результаты. А еще робот гораздо точнее в дозировании и почти никогда не ошибается, а значит, получается существенная экономия на реактивах. Сплошные плюсы!
Видео 4. Автоматизация работы с клетками. Платформа-робот полного цикла для ведения клеточных линий от компании Advanced Technology Inc. и демонстрация ее работы.
Но удобные платформы-роботы есть далеко не в каждой лаборатории. Почему? Основной причиной, по которой в большинстве научно-исследовательских лабораторий культивирование клеток все еще остается «ручной» задачей сотрудников является высокая цена автоматических платформ: от 0,5 до 1,5 миллиона долларов. Впрочем, такие инвестиции прекрасно окупаются в очень больших коммерческих лабораториях, особенно тех, где проводят высокопроизводительный скрининг лекарственных препаратов — для анализа такого же количества проб вручную пришлось бы нанять целую армию лаборантов!
Эукариотические клетки в биомедицине и фармацевтике
Эксперименты на эукариотических клетках, выделенных из тканей или представленных в виде стабильных клеточных линий, помогают изучить, как именно проходят процессы на клеточном уровне. Например, можно протестировать цитотоксичность потенциальной лекарственной молекулы или понять механизм ее действия перед тем, как переходить к доклиническим испытаниям. Нельзя не упомянуть и про наиболее современное и перспективное направление в медицине — генную терапию, которая направлена на компенсацию неправильной работы генов (например из-за мутаций), являющейся первопричиной многих заболеваний: от редких генетических синдромов до онкологических. В клетку может быть добавлен ген, который научит ее производить нужный белок и выполнять утраченные функции — идея примерно такая же, что и в «фабрике белков» внутри бактерий, о которой мы говорили в первой части статьи.
Допустим, мы решили посмотреть, получилось ли ввести в клетку гены нужного нам белка и как они себя после этого «чувствуют». Такого рода задачи, безусловно, можно решить классическими методами — например, посмотреть в флуоресцентный микроскоп или поставить вестерн-блотинг. Флуоресцентная микроскопия [19] позволяет оценить, правильно ли подействовал вирусный вектор, особенно, если вместе с целевым геном мы вносили еще и ген флуоресцентного белка. А если исследователь лизирует (разрушит) клетки и выделит белки, то при помощи вестерн-блоттинга он сможет увидеть, произвела ли клетка новый белок. Эти методы известны и относительно недороги, но весьма трудоемки. Какие есть альтернативы? Ответ уже звучал: автоматические платформы.
Другая важная задача — фармацевтическая. Например, необходимо изучить молекулу лекарства-кандидата и определить ее токсичность в разных концентрациях. Да и молекул таких, на самом деле, десятки — соответственно, придется работать с сотнями и тысячами проб. На первое место выходит не только скорость, но и необходимость серьезно сократить количество используемых реагентов. Для подобных скрининговых исследований, от тестов лекарственных кандидатов до масштабных генетических скринингов, могут применяться дозирующие системы — например, акустические платформы для дозирования типа Echo SynBio. В основе таких систем лежат звуковые волны, при помощи которых создаются мельчайшие капли (до 25 нл); работают же платформы с различным количеством образцов, вплоть до плашек на 1536 лунок. В результате время исследования может быть уменьшено в четыре раза только за счет более эффективного дозирования, а сами процессы становятся дешевле за счет малого объема и минимизации ошибок. Дозирующие системы активно используются при разработке лекарственных препаратов, оценке действия лекарственных кандидатов в различных концентрациях на клетки и их функции или анализа их потенциальной токсичности.
Часто у исследователей возникает необходимость более детально изучить клетки в образце — понять, из каких популяций он состоит, сколько из них живых, в какой стадии клеточного цикла они находятся, и даже отобрать нужные клетки со строго определенными характеристиками для дальнейшей работы. И тут на помощь приходит проточная цитометрия и основанный на ней сортинг клеток.
Сортинг и проточная цитометрия
Проточные цитометры дают исследователю возможность проанализировать сотни тысяч клеток менее чем за минуту, а в случае сортеров — отобрать клетки, которые можно исследовать (или культивировать) на дальнейших этапах работы. В англоязычной литературе для этого процесса используется аббревиатура FACS, от fluorescence-activated cell sorting — «активированный флуоресценцией сортинг клеток».
Как сортинг, так и проточная цитофлуориметрия основаны на одних и тех же принципах; главное различие — что происходит с клетками после анализа. В случае проточного цитофлуориметра клетки «выбрасываются» и больше не используются, а вот цитометр-сортер может поместить разные популяции клеток в отдельные пробирки для дальнейшей работы.
Основная идея проточной цитометрии — «поштучный» анализ клеток в потоке, проходящий с большой скоростью (видео 5). Суспензия клеток, предварительно помеченных светящимися молекулами (флуорохромами), движется очень тонким потоком через ячейку для анализа: исследуемые клетки выстраиваются в цепочку по одной и пересекают пучок световых (обычно лазерных) лучей, служащих для анализа каждой отдельно взятой клетки .
Подробнее о принципах и особенностях проточной цитометрии мы писали в спецпроекте «12 методов» [20]. А о том, как автоматизировать не всегда простую пробоподготовку, сделать много измерений и стандартизировать каждый шаг, расскажет видео ниже.
Видео 5. Система Biomek i-Series интегрируется с проточным цитометром CytoFLEX S и позволяет автоматизировать протоколы подготовки проб, включая сложные комплексные анализы и сложные многоцветные панели, а также делать скрининговые исследования.
Как выглядит работа исследователя, у которого нет проточного цитометра? Можно «закрепить» клетки на стекле, окрасить флуоресцентными красителями (например, флуоресцентно меченными антителами или интеркалирующими в нуклеиновые кислоты соединениями) и посмотреть под микроскопом: оценить размер клеток, их структуру и наличие или отсутствие каких-то белков, а также сделать красивые яркие фотографии. К сожалению, минусы очевидны: увиденное сложно объективно измерить (либо это займет очень много времени), в поле зрения оказывается не очень много клеток, при смещении объектива легко что-то пропустить, да и работать с этими клетками после исследования под микроскопом уже невозможно. Кроме того, флуоресцентная микроскопия, как правило, не позволяет работать более чем с пятью маркерами одновременно.
Безусловно, микроскопия сейчас тоже подверглась автоматизации, и уже появляются решения, которые могут на основе искусственного интеллекта анализировать изображения — например, так автоматизируют скрининговые исследования на рак шейки матки [21]. Однако пока область применения этих программ ограничена — достаточное количество образцов и статистики, чтобы научить компьютер правильно обрабатывать изображения, набирается только при рутинных анализах [22], [23], а если говорить про онкологию, то не все виды рака легко однозначно классифицировать.
В области исследований и разработок (как в научных институтах, так и в фармацевтических компаниях) задачи бывают очень разными, поэтому и инструменты требуются более универсальные. Современная проточная цитофлуориметрия (рис. 4) позволяет окрашивать клетки значительным числом флуоресцентных меток одновременно — десятки! А это значит, что клетки можно оценивать сразу по множеству параметров. Скорость и производительность тоже потрясают: за одну минуту можно проанализировать сотни тысяч клеток, получив огромное количество данных. Сами приборы тоже представлены в разных конфигурациях — от «настольных» для нерегулярной работы с небольшим количеством флуоресцентных каналов до машин для рутинного анализа (например, в клинической диагностике): такие приборы работают с планшетами на 96 или даже 384 лунки. Оператор размещает пробы в цитометре и настраивает протокол работы, после чего измерения происходят автоматически.
Цитофлуоримерический сортинг клеток основан на тех же принципах, но только теперь в систему добавлены электромагниты, которые определяют, в какую пробирку «упадет» проанализированная клетка (рис. 5). Какие клетки сортировать (и куда), а какие «выбрасывать», задает оператор при настройке протокола. В качестве критериев могут быть использованы, например, размер клеток и интенсивность флуоресценции одного маркера или их комбинации. Сортеры устроены сложнее проточных цитометров, а необходимость разделять клетки приводит к некоторому замедлению скорости работы. В любом случае, возможность сортировки клеток открыла новые горизонты для исследователей — ведь раньше разделить клетки можно было, только основываясь на их отличиях в физических свойствах. Например, эритроциты и тромбоциты крови оседают на дно пробирки с разной скоростью. А традиционное разделение лейкоцитов основано на их различающемся «поведении» в градиентах концентраций специальных растворов.

Рисунок 5. Принцип работы сортера. Клетки в растворе по одной проходят через лазерный луч, делятся на капли (одна капля — одна клетка) и в зависимости от наличия или отсутствия флуоресценции (и ее типа, если флуорофоров больше одного) получают положительный, нейтральный или отрицательный заряд. Затем заряженные капли с клетками проходят через электростатическую отклоняющую систему, которая направляет капли в пробирки исходя из их заряда.
рисунок Анастасии Волчок по схемам Boster и Sino Biological
Развитие проточной цитометрии продолжается: проточные цитометры можно совмещать с платформами для пробоподготовки, что позволяет проводить сложные анализы быстро и точно. Цитометрический принцип сортировки сейчас применяется в анализе единичных клеток для разделения объектов, о чем мы говорили во второй статье этого спецпроекта: «Автоматизация омиксных технологий» [24]. А еще появляются решения и для работы с многоклеточными объектами.
Современные научные исследования и производства невозможно представить без автоматизации: как мы видим, она позволяет не только экономить время и деньги, но и получать в разы больше данных. Есть области, в которых автоматизация имеет особенно большое значение — например, фармацевтическая индустрия или клиническая диагностика. Высокопроизводительные системы скрининга позволяют изучать тысячи молекул-кандидатов за короткое время. О том, как происходит разработка настоящих лекарств, мы расскажем в следующей, заключительной статье спецпроекта.
Литература
- Биотехнология. Генная инженерия;
- 12 методов в картинках: генная инженерия. Часть I, историческая;
- 12 методов в картинках: генная инженерия. Часть II: инструменты и техники;
- 12 методов в картинках: клеточные технологии;
- История автоматизации: от сифона к лаборатории роботов;
- Автоматизация омиксных технологий;
- 12 методов в картинках: протеомика;
- Антибиотики и антибиотикорезистентность: от древности до наших дней;
- Антибиотикорезистентность: How to make antibiotics great again*?;
- Антибиотики vs Бактерии. «Война Бесконечности» или всему есть предел?;
- Что делать с резистентностью к антибиотикам? Новые данные: распространение между странами и борьба с мультилекарственной устойчивостью;
- Yiyan Li, Xing Yang, Weian Zhao. (2017). Emerging Microtechnologies and Automated Systems for Rapid Bacterial Identification and Antibiotic Susceptibility Testing. SLAS TECHNOLOGY: Translating Life Sciences Innovation. 22, 585-608;
- Michael Hombach, Marion Jetter, Nicolas Blöchliger, Natalia Kolesnik-Goldmann, Erik C. Böttger. (2017). Fully automated disc diffusion for rapid antibiotic susceptibility test results: a proof-of-principle study. Journal of Antimicrobial Chemotherapy. 72, 1659-1668;
- Nabih A Baeshen, Mohammed N Baeshen, Abdullah Sheikh, Roop S Bora, Mohamed Morsi M Ahmed, et. al.. (2014). Cell factories for insulin production. Microb Cell Fact. 13;
- Генная терапия: познакомьтесь с лекарствами будущего;
- Генная терапия против рака;
- Три поколения лекарств;
- Клетки, которые лечат людей;
- 12 методов в картинках: микроскопия;
- 12 методов в картинках: проточная цитофлуориметрия;
- Ewert Bengtsson, Patrik Malm. (2014). Screening for Cervical Cancer Using Automated Analysis of PAP-Smears. Computational and Mathematical Methods in Medicine. 2014, 1-12;
- Народные сказки об искусственном интеллекте в распознавании медицинских изображений;
- Заглянем в окошко московской кибер-поликлиники;
- Автоматизация омиксных технологий;
- Dakota A. Watson, Daniel F. Gaskill, Leif O. Brown, Stephen K. Doorn, John P. Nolan. (2009). Spectral measurements of large particles by flow cytometry. Cytometry. 75A, 460-464;
- Carole Couillault, Nathalie Pujol, Jérôme Reboul, Laurence Sabatier, Jean-François Guichou, et. al.. (2004). TLR-independent control of innate immunity in Caenorhabditis elegans by the TIR domain adaptor protein TIR-1, an ortholog of human SARM. Nat Immunol. 5, 488-494;
- Maren Hertweck, Ralf Baumeister. (2005). Automated assays to study longevity in C. elegans. Mechanisms of Ageing and Development. 126, 139-145;
- Luis A. Fernandez, Eric W. Hatch, Barbara Armann, Jon S. Odorico, Debra A. Hullett, et. al.. (2005). Validation of Large Particle Flow Cytometry for the Analysis and Sorting of Intact Pancreatic Islets. Transplantation. 80, 729-737;
- Jenny Tjernberg, Kristina N. Ekdahl, John D. Lambris, Olle Korsgren, Bo Nilsson. (2008). Acute Antibody-Mediated Complement Activation Mediates Lysis of Pancreatic Islets Cells and May Cause Tissue Loss in Clinical Islet Transplantation. Transplantation. 85, 1193-1199;
- James P. Freyer, Mark E. Wilder, James H. Jett. (1987). Viable sorting of intact multicellular spheroids by flow cytometry. Cytometry. 8, 427-436;
- Kristi R. Harkins, David W. Galbraith. (1987). Factors governing the flow cytometric analysis and sorting of large biological particles. Cytometry. 8, 60-70;
- James H. Jett, Robert G. Alexander. (1985). Droplet Sorting of Large Particles. Cytometry. 6, 484-486;
- C. B. Rohde, F. Zeng, R. Gonzalez-Rubio, M. Angel, M. F. Yanik. (2007). Microfluidic system for on-chip high-throughput whole-animal sorting and screening at subcellular resolution. Proceedings of the National Academy of Sciences. 104, 13891-13895.