Проточная цитометрия: где вы были эти пять лет?
03 июня 2022
Проточная цитометрия: где вы были эти пять лет?
- 4614
- 0
- 8
Можем ли мы проанализировать все клетки в суспензии по множеству параметров и отделить только те, которые нас интересуют? Конечно, да. И возможно это благодаря проточной цитофлуориметрии и сортингу.
Рисунок в оригинальном разрешении.
иллюстрация Елены Беловой
-
Автор
-
Редакторы
-
Иллюстратор
Проточная цитофлуориметрия — относительно молодой и мощный метод, позволяющий «на лету» анализировать клетки по десяткам разнообразных параметров, а также сортировать их физически. Продолжая спецпроект «Ультрасовременные методы», сегодня мы расскажем, какие тенденции есть в этой области и какие метаморфозы претерпели цитометрия и сортинг за пять лет — с момента выхода публикации «12 методов в картинках: проточная цитофлуориметрия».
Ультрасовременные методы
Методы, которыми оперирует современная наука, постоянно совершенствуются. Некоторые области развиваются настолько стремительно, что порой даже специалистам сложно уследить за новейшими приборами и модификациями методик. Так происходит, например, в геномике. Другие же области (такие как гистология и связанные с ней световая и флуоресцентная микроскопия) развиваются куда медленнее, но всё равно расширяются и обзаводятся более высокопроизводительными методами. В статьях нового спецпроекта (он продолжает наш хит — «12 биологических методов в картинках») мы хотим рассказать, какие методы помогают ученым совершать новые открытия сегодня, и чего нам ждать в будущем.

Партнер публикации — компания ООО «Биокоммерц»: поставщик современного оборудования, реагентов, расходных материалов и сервисной поддержки в сфере клеточных технологий, проточной цитометрии и продукции клинического применения.
Команда квалифицированных и опытных специалистов при работе с клиентами придерживается индивидуального подхода и предоставляет современные решения для реализации смелых научных проектов. Среди клиентов ООО «Биокоммерц» — крупнейшие институты и научные центры страны, ведущие фармацевтические и биотехнологические компании.
Эта статья продолжает первый материал о проточной цитофлуориметрии из уже ставшего классическим цикла «12 биологических методов в картинках», в котором мы рассказали о принципах метода, истории развития и основных применениях [1]. Там же были рассмотрены ключевые практические приложения цитометрии и сортинга в науке и клинике. Незнакомым с проточной цитометрией читателям мы рекомендуем начать именно с прочтения первой части; ну а в этой статье мы расскажем о том, что поменялось в проточной цитометрии и сортинге клеток за прошедшие пять лет, какие новинки крепко завоевали место на рынке, а что, вероятно, еще ждет нас впереди.
Кратко напомним, что суть проточной цитометрии заключается в автоматизированном оптическом анализе клеточных суспензий, который становится возможным благодаря «выстраиванию» клеток в очередь в сжимающемся потоке. Идущие «гуськом» клетки по очереди проходят через лазерный луч, регистрация рассеяния от которого позволяет охарактеризовать каждую клетку в потоке индивидуально. Кстати, клетки можно разделить и физически: это приложение называется сортинг, и о нем мы поговорим ниже. Клетки, сами по себе прозрачные и довольно невзрачные, для исследований цитометрией метят флуорохромами; поэтому лазерный луч возбуждает вторичное свечение (флуоресценцию). Сигналы флуоресценции и светорассеяния регистрируются различными детекторами, данные с которых позволяют компьютерным алгоритмам «посчитать» клетки и разделить их на отдельные популяции, отличающиеся друг от друга по каким-то важным параметрам, интересующим исследователя (рис. 1).
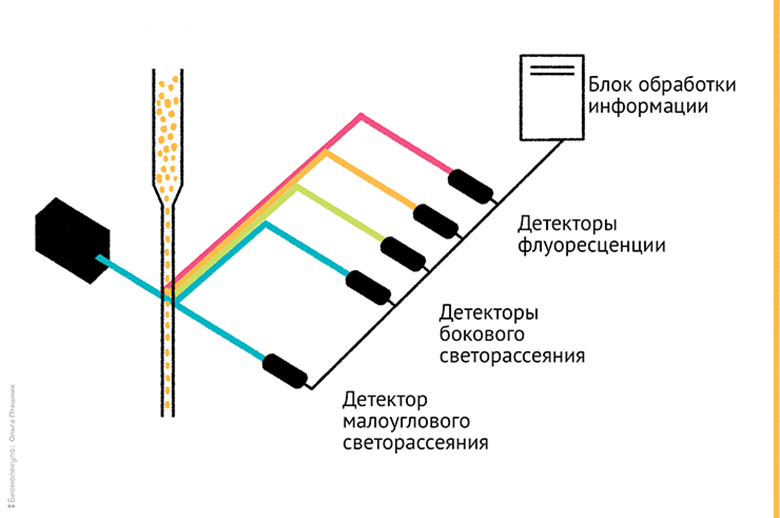
Рисунок 1. Схема проточного цитометра: сжимающийся поток клеточной суспензии облучают лазером, и сигналы рассеяния от каждой конкретной клетки регистрируются прибором, позволяя разделять клетки по целому массиву параметров.
иллюстрация Ольги Пташник из статьи «12 методов в картинках: проточная цитофлуориметрия» [1], к которой мы и отсылаем читателя за подробностями
Преимущества проточной цитометрии — возможность анализа большого количества клеток (до 106–108 в образце) по массе параметров; получение «портрета» каждой конкретной клетки; параллельный анализ разных процессов и параметров; мощное программное обеспечение — работать с данными можно как по ходу получения, так уже и после исследований; возможность выделения и исследования целевой популяции клеток компьютерными методами; а также статистическая достоверность. Кроме того, исследование занимает мало времени: цитометр анализирует от нескольких тысяч до сотен тысяч событий в секунду (событие — прохождение отдельной клетки через лазерный луч).
Недостатки в основном следуют из достоинств. Проточные цитометры — сложные и дорогие приборы. Кроме того, возможность анализировать огромное количество параметров означает прямую зависимость результата от квалификации сотрудника, планирующего эксперимент. Использование большого количества лазеров и флуорохромов требует учитывать их спектральные пересечения и компенсировать «мешающие» сигналы при настройке прибора. Критичным моментом является также относительность получаемых данных (например, интенсивность сигнала флуоресценции выражается в условных, а не абсолютных единицах), что накладывает определенные требования к сравнению данных, полученных на разных приборах при разных настройках мощности лазеров, компенсаций и других параметров. Увеличение скорости анализа влечет снижение точности: поэтому, несмотря на заявляемое производителем максимальное количество событий в секунду, в реальной жизни стараются не превышать скорость ≈3–5 тысяч событий в секунду.
Все эти недостатки и ограничения привели к тому, что проточная цитометрия не очень массово применяется в медицине, хотя потенциал ее, безусловно, очень велик. Главный образом это гематологический анализ в формате 5-diff , ну а продвинутые проточные цитофлуориметры применяются в основном в онкогематологии для определения точного подвида лейкемии и оценки прогресса лечения.
Анализ крови в современных гемоанализаторах может проводиться в формате 3-diff или 5-diff. Разделение клеток крови на три популяции — гранулоциты, моноциты и лимфоциты — осуществляется на принципах ячейки Культера (электроимпеданса). А вот для анализа пяти основных популяций, когда гранулоциты дополнительно подразделяются на нейтрофилы, базофилы и эозинофилы, используется еще и цитометрия. В более сложных анализаторах применяются и флуоресцентные красители.
Современные цитометры и сортеры отличаются от своих предшественников 10–20-летней давности возросшей скоростью анализа, бóльшим количеством лазеров и флуоресцентных детекторов, позволяющих исследовать десятки параметров, а также сочетанием цитометрии с другими методами. Например, появляются комбинации цитометров с микрофлюидными системами или флуоресцентными микроскопами; разработаны методики для сортинга многоклеточных организмов и многое другое, о чем мы поговорим в этой статье.
Мультицветная цитометрия
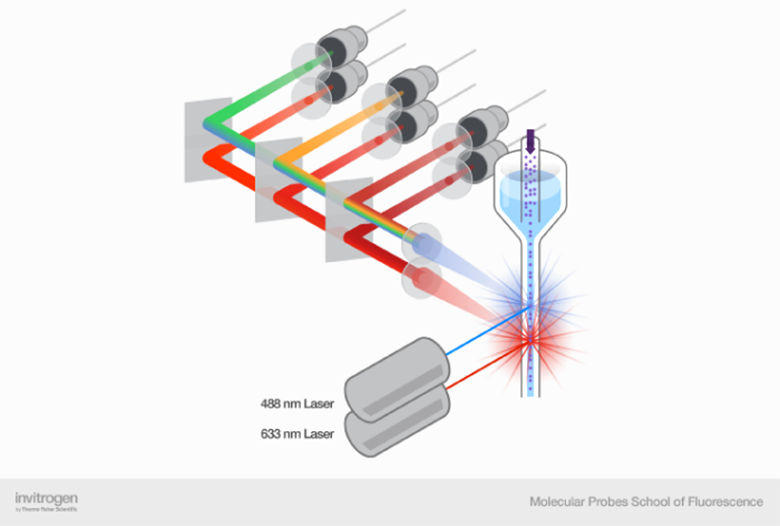
Клинические приборы обычно используют до четырех длин волн лазера и до 25 детекторов. В трехлазерные приборы обычно ставят 10–16 детекторов, а в четырехлазерные — до 25. Новейшие исследовательские приборы используют до девяти длин волн лазера и 60 детекторов. В обоих случаях речь идет о быстром анализе десятков и сотен тысяч клеток в секунду [2].
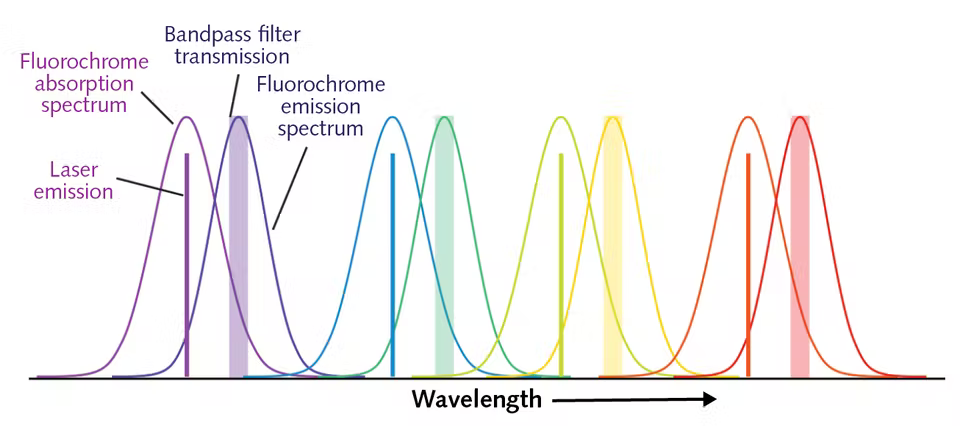
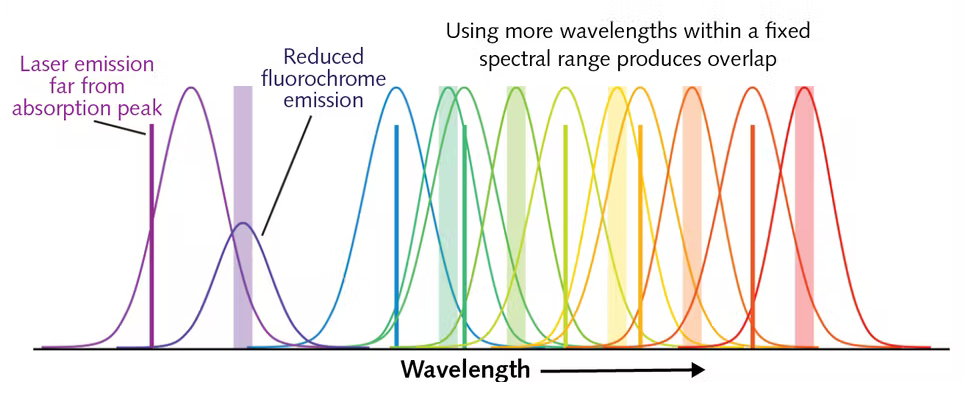
Увеличение количества лазеров и детекторов порождает свои проблемы и сложности. Мы касались выбора флуорохромов, понятия компенсации спектральных пересечений и других частых проблем в статье «12 методов в картинках: проточная цитофлуориметрия» [1]. Тем не менее, расширение функционала приборов становится возможным благодаря использованию как новых типов лазеров, так и различных типов расположения лазеров и детекторов, связанных с пересечением спектральных диапазонов флуорофоров. В таблице 1 приведены лазеры и длины и их волн, а на рисунке 2 проиллюстрирована проблема пересечения спектральных диапазонов.
| Цвет лазера | Длина волны, нм | Флуорофоры для этого лазера |
|---|---|---|
| Ультрафиолетовый (УФ) | 355 | DAPI, Hoechst, LIVE/DEAD Blue, Brilliant Ultraviolet |
| Фиолетовый | 405–407 | Pacific Blue, eFluor 450, Pacific Orange, eFluor 506, Super Bright 436, Super Bright 600, Brilliant Violet, LIVE/DEAD Yellow, LIVE/DEAD Aqua, LIVE/DEAD Violet, CFP |
| Синий | 488 | FITC, Alexa Fluor 488, Dylight 488, PE, PE tandems, PerCP, PerCP tandems, PI, 7AAD, eGFP, YFP |
| Зеленый | 532 | PE, PE tandems, Alexa Fluor 532, PI, mCherry, dTomato, RFP |
| Желтый | 561–568 | PE, PE tandems, PI, mCherry, dTomato, RFP |
| Красный | 633–647 | APC, Alexa Fluor 647, Alexa Fluor 700, APC tandems |
Частично эти проблемы решаются появлением новых лазеров: диодных и полупроводниковых с оптической накачкой (OPSL), которые светят в неиспользуемых ранее диапазонах. Например, OPSL с длиной волны 552 нм — хорошая альтернатива желтому лазеру (561 нм), снижающая спектральные пересечения с флуорохромами для оранжевого и красного лазеров. Диодный лазер с длиной волны 458 нм предпочтительнее, чем стандартный синий 488-нм лазер, так как меньше влияет на флуорохромы с возбуждением в зеленом диапазоне. Появились и ультрафиолетовые лазеры (скажем, с длиной волны 349 нм) — это дает возможность работать с несколькими новыми флуорохромами.
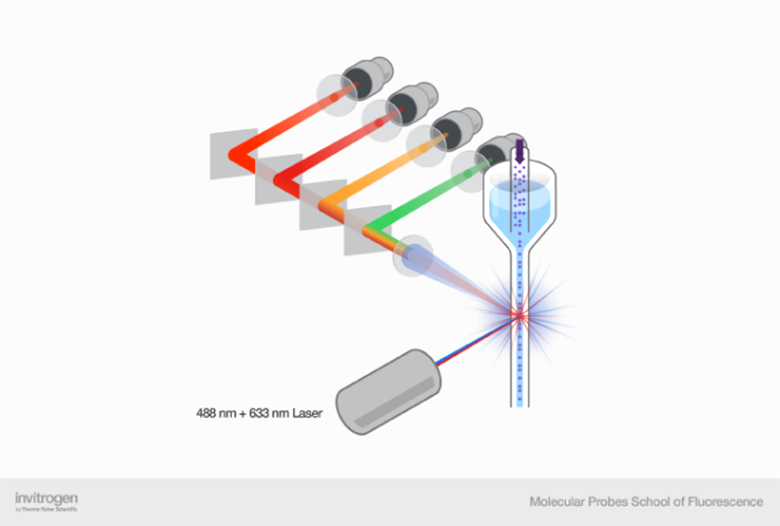
Кроме появления новых лазеров, позволяющих добавлять дополнительные флуорохромы и уменьшать их взаимное влияние, большую роль играет конфигурация самого прибора, включая режим работы лазеров и расположение детекторов. Лазеры могут быть расположены коллинеарно или параллельно (см. рис. 3).
Из рисунка выше может показаться, что параллельная конфигурация лазеров всегда лучше, ведь мы, очевидно, разрешаем часть спектральных проблем многоцветной цитометрии за счет физического разделения лазеров и детекторов. У такой конфигурации действительно много плюсов и она часто используется, но нужно понимать и несколько ограничений. В параллельной конфигурации существует временнáя задержка из-за переключения между лазерами и сбора воедино данных, полученных в разные моменты времени. Хотя задержка обычно устанавливается автоматически, при необходимости ее можно регулировать вручную; и если она установлена неправильно, то пользователь может столкнуться с потерей или смешением сигналов.
Современный сортинг
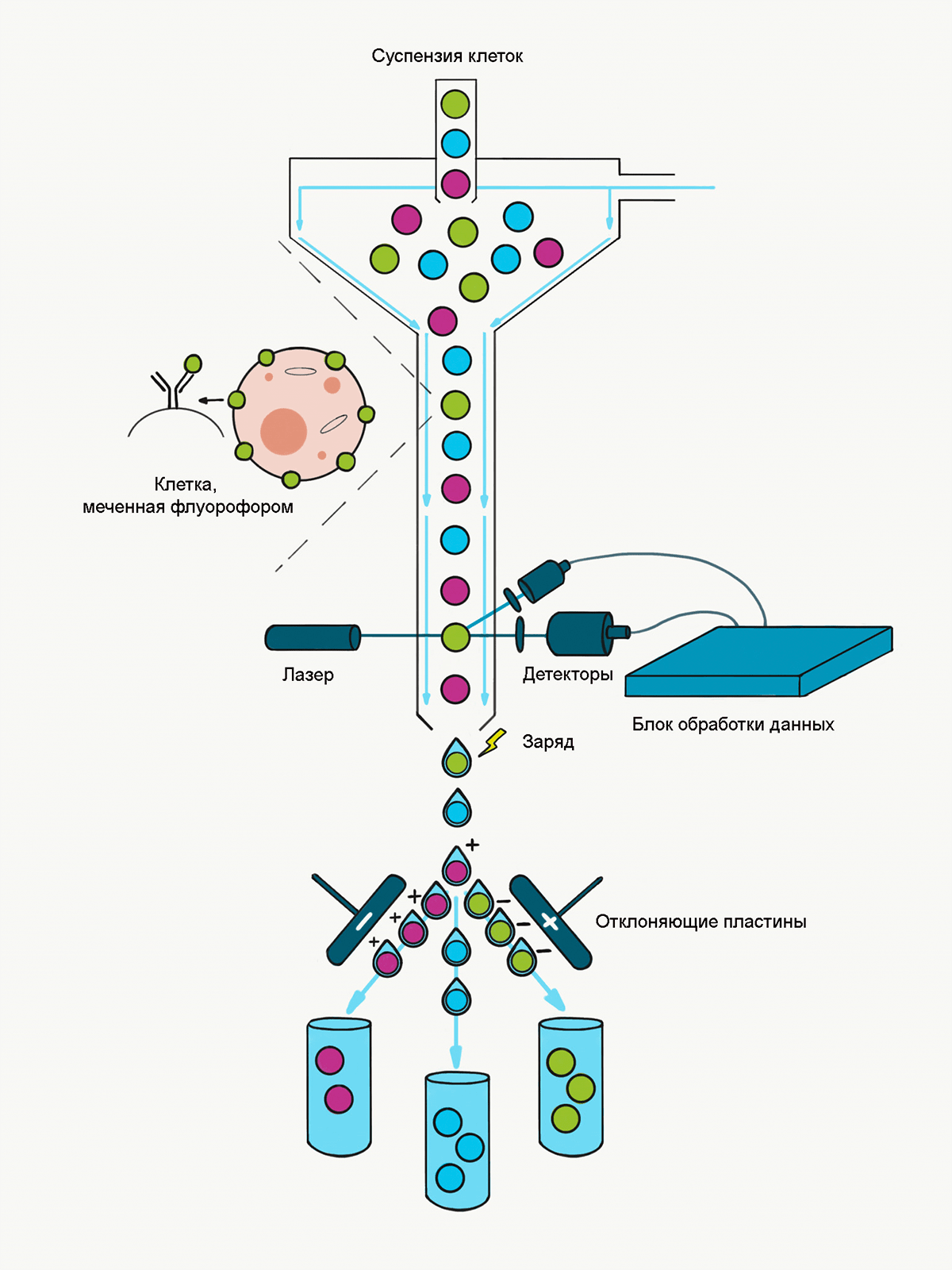
Рисунок 4. Принцип работы сортера. Клетки в растворе по одной проходят через лазерный луч, делятся на капли (одна капля — одна клетка) и в зависимости от наличия или отсутствия флуоресценции (и ее типа, если флуорофоров больше одного) получают положительный, нейтральный или отрицательный заряд. Затем заряженные капли с клетками проходят через электростатическую отклоняющую систему, которая направляет капли в пробирки, исходя из их заряда.
иллюстрация Анастасии Волчок из статьи «Работа с клетками: автоматизируй и властвуй» [3].
Классический цитофлуориметрический сортинг (часто обозначаемый аббревиатурой FACS, от Fluorescence Activated Cell Sorting) также использует лазерные лучи и детекторы, чтобы перво-наперво охарактеризовать клетки в суспензии. То есть первая часть сортера — это тот же проточный цитометр. Но вот далее клетки разделяются на нужные исследователю фракции физически: под влиянием управляемых воздействий; в режиме реального времени; и исходя из тех параметров, которые были обнаружены шагом ранее. В классическом варианте разделение означает, что в систему добавлены электромагниты, которые определяют, в какую пробирку «упадет» проанализированная клетка (см. рис. 4). В зависимости от настроек протокола и нужд исследователя, в качестве критериев могут быть использованы, например, размер клеток и интенсивность флуоресценции одного маркера или их комбинации. Сортеры устроены сложнее проточных цитометров, а необходимость разделять клетки приводит к некоторому замедлению скорости их работы [3].
К сожалению, у такой конструкции и сортировки на основе заряда есть свои минусы: во-первых, при разделении клеток неизбежно образуется аэрозоль, во-вторых — некоторые особенно чувствительные клетки могут изменить или потерять свои свойства в результате сортинга; дальнейшая работа с ними в этом случае не имеет смысла. Образование аэрозоля критично, если стоит задача работы с материалом, который может быть опасен. Исследователи, которые изучают иммунные клетки в образцах, положительных на те или иные вирусные заболевания (или в случае риска заражения), сталкиваются с необходимостью размещения обычного сортера в «красной зоне» или лаборатории с уровнем биологической безопасности BSL3. Но такой лаборатории в институте может просто не быть; в клинике туда будет ограничен доступ: всё это накладывает значительные ограничения на скорость и порядок работы и в ряде случаев делает ее и вовсе почти невозможной.
Комбинация с микрофлюидикой — новый подход в сортинге
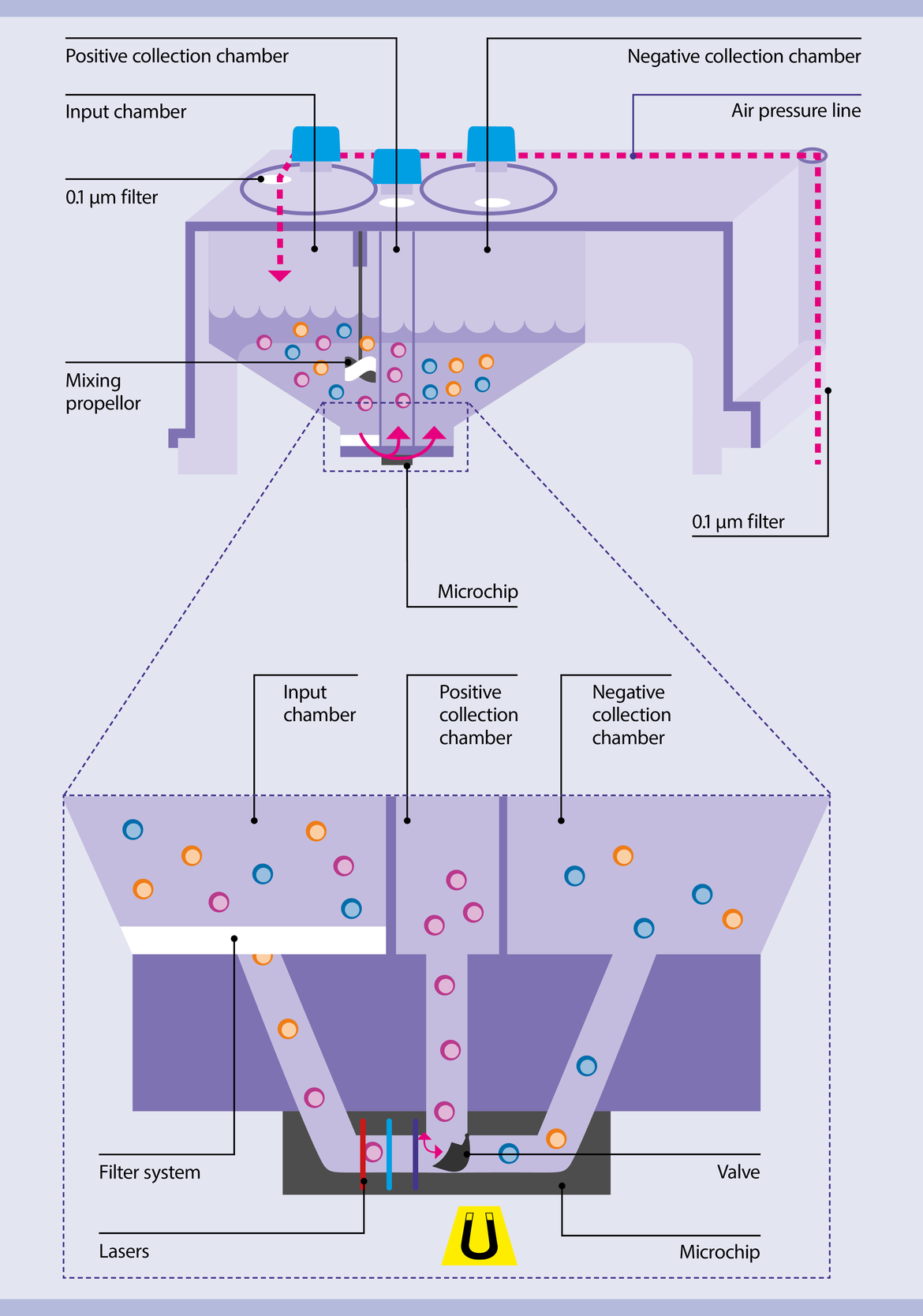
Значимым изменением стало появление сортеров, которые делят клетки на микрофлюидном чипе. Хороший пример — прибор MACSQuant Tyto, инновация которого в том, что для каждой сортировки используется индивидуальный стерильный картридж (рис. 5), включающий микрофлюидный чип, работающий без электризации клеток, что убирает упомянутый выше недостаток классического сортинга.
Исследователь помещает пробу для разделения в «стартовую» ячейку, после чего загружает картридж в прибор. Под давлением стерильного воздуха (проходящего через два фильтра с порами 0,1 мкм) образец попадает в микрофлюидный канал на чипе, где клетки характеризуются при помощи трех лазеров как нужные исследователю (они далее попадут в так называемую положительную ячейку) и остальные (они окажутся в отрицательной). Разделение происходит физически: при появлении нужной клетки короткий магнитный импульс меняет положение створки на выходе из чипа, направляя нужную клетку в положительную ячейку (процесс показан на видео 1).
Видео 1. Устройство сортера MACSQuant Tyto и процесс сортировки.
Подобный подход позволил решить сразу несколько проблем. Во-первых, теперь можно не бояться контаминации внутри самого сортера. Во-вторых, полностью исключается образование аэрозоля, а значит, и риск заражения сотрудников при работе с патогенными образцами. Это уже оценили исследователи, занимающиеся изучением терапий и вакцин для ВИЧ и SARS-CoV-2. Новая технология позволяет работать с патогенными образцами без риска заражения, а также существенно снижает требования к квалификации персонала для рутинной работы, когда все протоколы уже настроены. В-третьих, давление воздуха минимально, а электрический разряд перед разделением клеток и вовсе отсутствует, то есть клетки остаются в своем нативном состоянии — этим активно пользуются исследователи и врачи, работающие со стволовыми клетками и клетками иммунной системы. Разделение этих клеток в стандартном сортере существенно ограничивало их дальнейшее использование: стволовые клетки могли начать дифференцировку, а клетки крови, в частности нейтрофилы, уйти в апоптоз или активировать иммунный ответ — и достаточно непредсказуемым способом.
Любопытно и другое: использование реагентов и стерильных одноразовых картриджей, произведенных в соответствии со стандартами GMP (Good Manufacturing Practice), позволяет сортировать клетки для последующего клинического применения, если это допускает законодательство страны. Например, для сортинга Т-клеток в терапии болезни «трансплантат против хозяина».
В статье «Работа с клетками: автоматизируй и властвуй» [3] мы также писали о многоклеточном сортинге, т.е. сортировке достаточно крупных объектов: например, эмбрионов дрозофил. Это направление не получило на данный момент широкой известности и пока не может применяться для решения клинических задач, однако всё может поменяться в ближайшем будущем.
Цитометрия в клинике
В клинической практике проточная цитометрия — это мощный, хорошо зарекомендовавший себя метод эффективного измерения свойств клеток, в первую очередь с использованием CD-антигенов. Основные применения — в области онкогематологии [4].
Наиболее удобные и показательные образцы — это периферическая кровь, продукт лейкафереза, аспират костного мозга и спинномозговая жидкость. Чаще всего проточная цитометрия позволяет уточнить диагноз или отследить эффективность лечения за счет анализа субпопуляций разных типов клеток крови в доброкачественных и злокачественных гематологических процессах.
Фенотипирование (идентификация конкретных наблюдаемых характеристик) — одно из главных применений цитометрии — наравне с анализом жизнеспособности клеток и стадии их клеточного цикла. Существует множество фенотипических особенностей, позволяющих отличать здоровые клетки от опухолевых . Проточная цитометрия часто может обнаружить рецидив рака до того, как микроскопия позволит выявить морфологические изменения клеток.
Опухолевые клетки часто экспрессируют характерные поверхностные рецепторы. Например, у пациентов с острым промиелоцитарным лейкозом (APL) фенотип миелоидных клеток будет CD11b– и CD11c–, а у здорового человека — наоборот: CD11b+ и CD11c+ [5]. И если есть возможность автоматически анализировать наличие этих рецепторов, то можно отличать здоровые и трансформированные клетки прямо «в потоке».
Но есть у проточной цитометрии и минусы: во-первых, клетки должны находиться в суспензии (что ограничивает анализ твердых тканей и опухолей); а во-вторых, экспериментальные протоколы очень сложны и требуют высокой квалификации оператора прибора.
Как правило, в клинической иммунологии оценивается от 4 до 20 субпопуляций клеток. Например, популяции лимфоцитов, а также маркеры их активации и параллельный анализ NK-клеток. Это даст нам 15 параметров и необходимость использовать 10 различных красителей. То есть пробоподготовка к такому анализу становится отдельной трудоемкой задачей, а кроме того, необходимо правильно настроить все компенсации и поля анализа, поставив необходимые контроли.
На рынке стали появляться решения для конкретных клинических задач, в которых автоматизируется пробоподготовка и уже преднастроены протоколы, а корректность анализа можно проверить при помощи коммерческих реагентов. Клинические цитометры содержат встроенные модули пробоподготовки, системы мониторинга реагентов и образцов, конвейерную загрузку образцов, подключение к лабораторным информационным системам и автоматизированный контроль качества (рис. 6).
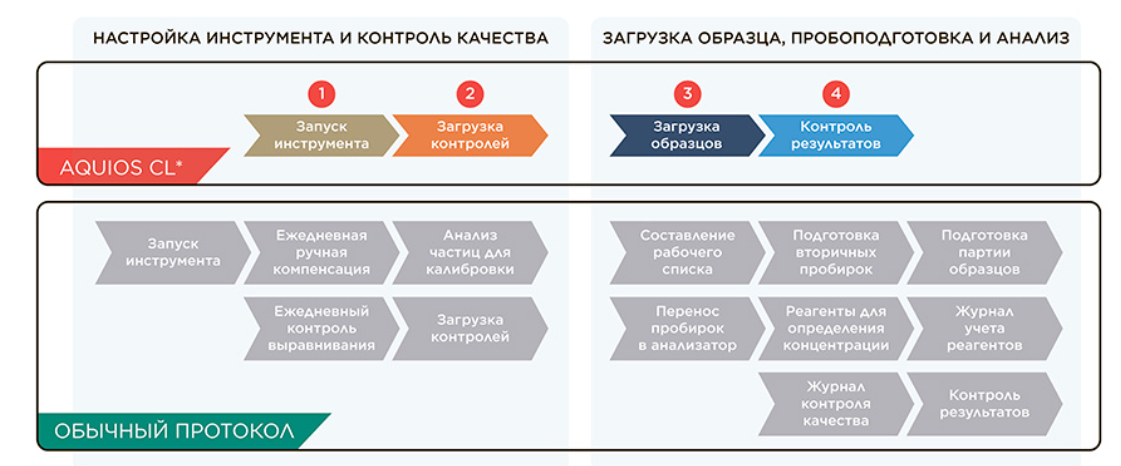
Рисунок 6. Сокращение действий, где необходимо вмешательство оператора, за счет автоматизации на примере клинического цитометра AQUIOS CL.
Конь и трепетная лань: как «скрестить» цитометрию и другие методы
Микрофлюидика
Современное развитие цитометрии и сортинга подразумевает в том числе объединение их с другими методами. Совмещение с микрофлюидикой часто применяется в набирающих популярность методах анализах единичных клеток. Один прибор может сначала отсортировать клетки на основе FACS, затем разделить выбранное на микрокапли при помощи микрофлюидных технологий, провести в каждой из них необходимые реакции и «передать» дальше. Скажем, чтобы осуществить секвенирование, как это происходит в системах типа 10х Genomics для анализа транскриптомов единичных клеток .
О геномике единичных клеток мы писали в статье «Автоматизация омиксных технологий» [6].
Микроскопия
Другое популярное современное решение — это объединение проточной цитометрии и флуоресцентной микроскопии. Таким приборам уже более 10 лет, хотя относительную популярность они завоевывают только сейчас — сказывается стоимость оборудования. Идея достаточно проста: если и цитометр, и флуоресцентный микроскоп позволяют посмотреть на каждую клетку в отдельности, то хотелось бы сделать это внутри одного устройства. Тем более что клетка уже окрашена соответствующими флуорофорами, то есть объедение двух технологий позволило бы сэкономить не только время, но и реагенты.
Что касается получаемых данных, тут выгода тоже очевидна. Цитометрия дает максимум характеристик и быстрый анализ десятков тысяч клеток с возможностью обнаружения даже самых редких популяций, а конфокальная и флуоресцентная микроскопия обеспечивают высокое пространственное разрешение.
Проточные цитометры с визуализацией позволяют проводить быстрый, чувствительный и мультиспектральный анализ больших популяций клеток, а также получать в прямом смысле фотографию каждой из проанализированных клеток.
Технология имеет множество применений; на рисунке 7 представлено одно из них — разделение единичных и сдвоенных (так называемых дублетов) клеток при помощи окрашивания ядер DAPI — этот краситель интеркалирует в двухцепочечную ДНК, взаимодействуя с AT-кластерами в малой бороздке молекулы. В обычной цитометрии без визуализации отличить дублеты от единичных клеток почти невозможно, тогда как целевой сигнал, например, количество поверхностных маркеров, будет вдвое выше (за счет того, что дублет считается прибором как одна клетка). Это может сказаться на достоверности получаемых данных, если дублетов и триплетов в анализируемой пробе много. На рисунке ниже приведен пример, как для клеток, ядра которых ярко окрашены DAPI, при помощи проточного цитометра с визуализацией посмотреть морфологию и отсечь сдвоенные клетки от ярких одинарных.
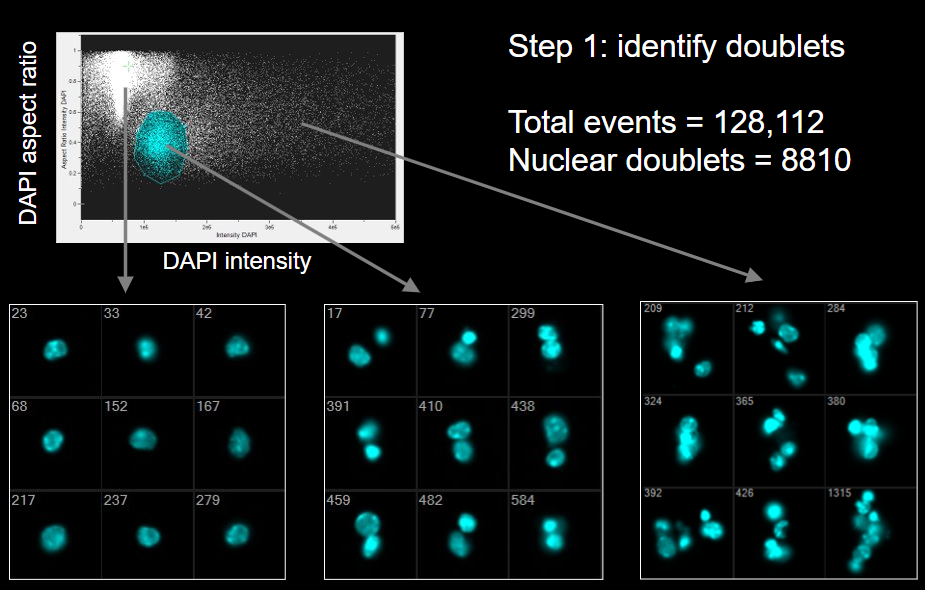
Рисунок 7. Анализ клеток на проточном цитометре с визуализацией. Клетки разделяют по интенсивности флуоресценции красителя DAPI (цитометрия), а далее анализируют их изображения, чтобы отделить сдвоенные и строенные клетки от ярких одинарных: это позволяет избежать ситуации, когда увеличение флуоресценции связано не с увеличением экспрессии того или иного исследуемого маркера, а с появлением подобных «слепленных» клеток-артефактов.
Комбинация микроскопии и прочной цитометрии позволяет изучать клеточный сигналинг, фагоцитоз, ко-локализацию белков, изменение формы клеток и их взаимодействия друг с другом (например, образование дуплетов), клеточный цикл и апоптоз, и даже оценивать заражение клеток паразитами.
Любопытно, что с точки зрения обработки результатов метод сильно отличается от классической цитометрии. В частности, почти все параметры получаются из анализа изображения с камеры, а не за счет прямого сигнала с флуоресцентного детектора. С одной стороны, это дает больше возможностей по применению искусственного интеллекта — можно обучить программу находить нужные клетки среди всего пула изображений, выбрав 10–20 модельных. С другой стороны, это замедляет скорость измерения пробы, а также выделяет работу с результатами в отдельный трудоемкий процесс. Тем не менее, сильнее всего распространение этой технологии сдерживает ее высокая цена, а не что-то другое.
Проточная цитометрия с визуализацией имеет потенциал и в клиническом использовании: например, можно отслеживать изменение морфологии клеток при воздействии теми или иными реагентами, влияющими на их функциональность. В данном случае используется индекс циркулярности, который показывает, насколько «кругла» клетка: по сути, статистически определяется средний «обычный» радиус клетки в популяции, а затем оценивается, насколько каждая конкретная клетка отличается по этому параметру.
Любой «классический» цитометрист заметит, что упомянутый выше индекс сферичности — это новый для цитометрии показатель. И это не единичный пример. Подобное объединение двух крупных методов в одном приборе логично приводит к возникновению новых параметров, общее число которых исчисляется десятками.
Масс-спектрометрия
Масс-цитометрия сочетает проточную цитометрию с масс-спектрометрией с индуктивно связанной плазмой (ICP-MS). В этом методе регистрируется молекулярная масса метки, а не сигнал флуоресценции. В качестве меток вместо флуорохромов используются конъюгаты с редкоземельными металлами (в основном изотопами лантаноидов), а также изотопы тяжелых металлов. Технология особенно актуальна там, где требуется анализ клеток по большому количеству маркеров одновременно — проблема перекрывания сигналов в этом случае практически отсутствует, а потому снимается и задача компенсации.
Принципы масс-спектрометрии мы разбирали в статье «Протеомика» из цикла «12 биологических методов в картинках» [7].
Есть и другие плюсы — сигналы от разных меток на основе редкоземельных металлов однородны, поэтому можно делать выводы о количестве меток на клетке. Кроме того, масс-цитометрии (в отличие от флуориметрии) не мешает аутофлуоресценция клеток.
Недостатки у метода тоже есть. К ним относится низкая скорость анализа — не более 500 клеток в секунду — а также ограниченное количество меток и деструкция клеток: объединить масс-цитометрию с сортингом не представляется возможным.
Иммуноферментный анализ
Сам принцип проточной цитометрии подразумевает, что объект нашего исследования — это клетки. Тем не менее, исследовать внеклеточные аналиты (например, белки) тоже можно. Для этого используют флуоресцентные сферы, конъюгированные с антителами (рис. 8).
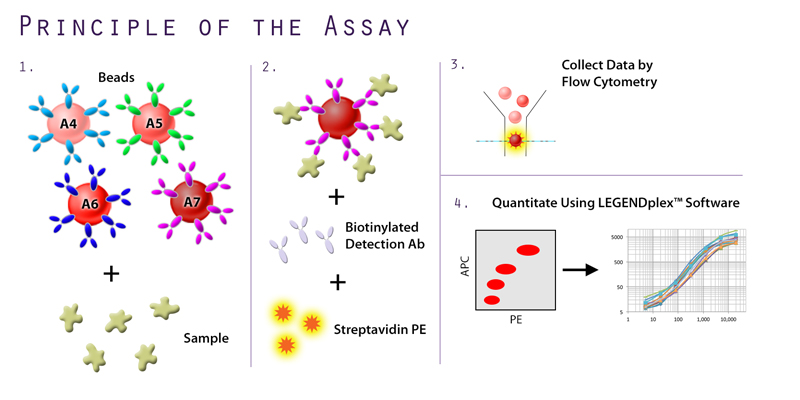
Рисунок 8. Принцип работы ИФА на сферах для последующего анализа на проточном цитометре. 1 — Взаимодействие флуоресцентных сфер, конъюгированных со специфичными антителами, с образцом. 2 — Конъюгация с вторичными антителами и флуоресцентной меткой. 3 — Анализ на проточном цитометре. 4 — Обработка результатов.
Производителей таких наборов достаточно много, и в целом метод нельзя назвать революционно новым. Обычно продаются наборы сфер для анализа 5—10—15 аналитов. Хороший пример — панель для анализа интерлейкинов в пробе. Сферы могут быть разных размеров, а также иметь разную интенсивность флуоресценции в выбранном канале (например, APC). Каждая сфера несет на себе антитела, специфичные к определенному аналиту. Всё, что происходит дальше, похоже на любой другой иммуноанализ. Соответствующий аналит связывается с антителами на «своей» сфере, затем происходит связывание со вторичными антителами и флуоресцентной меткой.
Как и в «традиционном» ИФА-анализе, требуется трудоемкая пробоподготовка: «отмывка» от избытка антител или метки после каждого этапа, продолжительные (от 30 минут) инкубации. На данный момент метод используется только в лабораторных анализах. Современные тенденции таковы, что сферы делают магнитными, и это позволяет использовать их в более привычном для ИФА формате плашек. Это облегчает автоматизацию пробоподготовки и позволяет проводить ее параллельно для 96 проб. Считывание уже связавшихся с аналитом проб может происходить в разных приборах: как на базе цитометрии, так и на базе микроскопии, как например это реализовано в решениях Luminex xMap.
Заключение
Внимательный читатель мог заметить, что некоторые технологии за прошедшие годы существенно продвинулись вперед, но, в общем-то, их не назвать принципиально новыми: визуализирующая цитометрия, решения для клиники, ELISA на микросферах, добавление новых лазеров и детекторов уже было и раньше. Речь скорее идет о совершенствовании инженерных решений, увеличении удобства работы, уменьшении цены устройства. Но вот микрофлюидные решения — это настоящий прорыв последних пяти лет. Мы писали о том, что микрофлюидика применяется и в технологии моделирования органов, и в single cell решениях в геномике... и вот теперь, в сортинге. Микрофлюидные решения позволяют экономить и точнее дозировать реагенты, автоматизировать пробоподготовку, стандартизировать условия. Возможно, спустя пять лет микрофлюидика еще больше интегрируется в проточную цитометрию и сортинг.
Литература
- 12 методов в картинках: проточная цитофлуориметрия;
- Callen D., Schulze M. (2021). Trends in flow cytometry lasers call for more new wavelengths. Laser Focus World. 57, 31–34;
- Работа с клетками: автоматизируй и властвуй;
- Dawn M. Betters, PhD, RN. (2015). Use of Flow Cytometry in Clinical Practice. JADPRO. 6;
- Henry Y. Dong, Jia Xue Kung, Vatsala Bhardwaj, John McGill. (2011). Flow Cytometry Rapidly Identifies All Acute Promyelocytic Leukemias With High Specificity Independent of Underlying Cytogenetic Abnormalities. Am J Clin Pathol. 135, 76-84;
- Автоматизация омиксных технологий;
- 12 методов в картинках: протеомика.