Свет в конце туннеля: генная терапия болезней зрения
17 ноября 2023
Свет в конце туннеля: генная терапия болезней зрения
- 3107
- 1
- 8
С появлением Luxturna — первого генно-терапевтического продукта, одобренного в США, — а также благодаря запуску ряда обнадеживающих клинических испытаний, генная терапия начинает открывать новые горизонты в лечении болезней глаз, особенно затрагивающих сетчатку. Рисунок в полном размере.
иллюстрация Елены Беловой
-
Автор
-
Редакторы
-
Иллюстратор
Это 10-я статья спецпроекта о генной и клеточной терапиях, в которой мы поговорим о борьбе с глазными заболеваниями, многие из которых долгие годы считались неизлечимыми. Во всем мире более двух миллионов человек страдают заболеваниями сетчатки, причем как приобретенными, так и наследственными, — и ученые уже нашли более 270 ответственных за это генов. В этом обзоре мы затронем патогенез таких болезней; представим данные последних клинических испытаний — как успешных, так и потерпевших фиаско; рассмотрим рыночный потенциал нескольких генных продуктов; а также сравним эффективность и безопасность различных лечебных подходов.
Генная и клеточная терапии

Третий сезон спецпроекта о генной и клеточной терапиях рассказывает о конкретных применениях этих новейших методов для лечения нейромоторных, онкологических, офтальмологических и других заболеваний.
Партнер спецпроекта — Департамент разработки генотерапевтических препаратов одной из крупнейших российских биотехнологических компаний — BIOCAD. BIOCAD заслужил серьезные позиции на мировом фармацевтическом рынке благодаря выпуску лекарственных препаратов на основе антител.

Рисунок 1. Вечернее небо Санкт-Петербурга
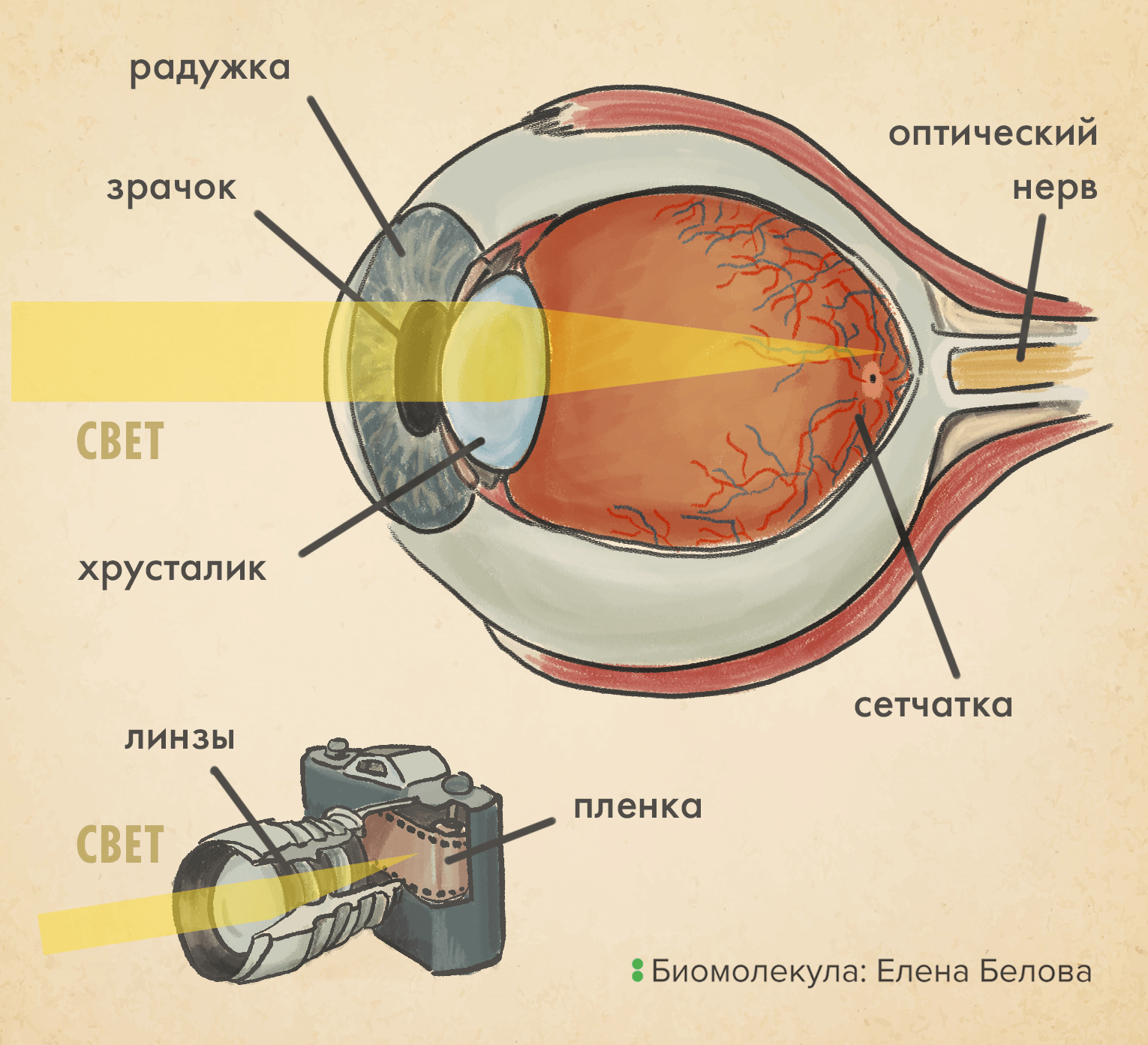
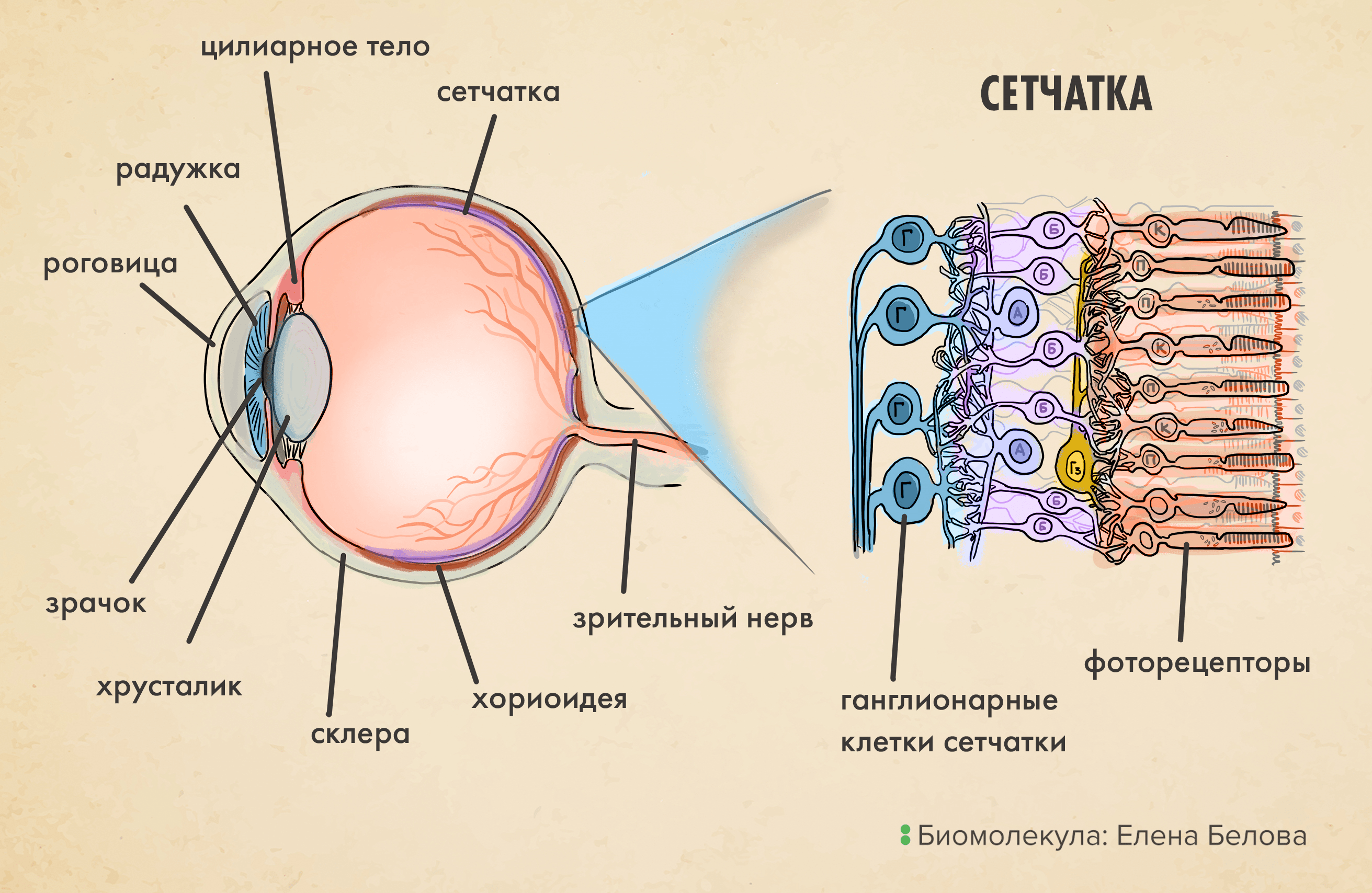
Когда мы смотрим на волнующий воображение полыхающий закат (рис. 1), в наших глазах разворачиваются не менее удивительные явления. Свет, преломляясь на хрусталике и проходя через прозрачное глазное яблоко, падает на сетчатку — тонкую светочувствительную ткань на самом донышке глаза. В этот момент на ней, как на пленке фотоаппарата (рис. 2а), запечатлевается образ видимого мира, после чего ее возбуждаемые светом фоторецепторные клетки передают по зрительному нерву в мозг электрохимические сигналы (рис. 2б).
Яркая метафора фотопленки подчеркивает ключевую роль сетчатки для зрения, а потому неудивительно, что именно тут «гнездится» множество болезней, нарушающих зрение — ведь, по сути, какой из молекулярных механизмов здесь не тронь, это скажется на остроте, а может, и на самóм наличии этого важнейшего чувства. И если такие недостатки как близорукость и дальнозоркость давно научились исправлять очками и контактными линзами (а позже — лазерной коррекцией), то к болезням сетчатки подступиться оказалось гораздо сложнее — и тем не менее пытливые ученые уже несколько десятилетий назад открыли природу многих из них и сделали первые попытки применить «молекулярное» лечение.
Еще в 1990-х годах эксперименты на мышах показали возможность коррекции заболеваний зрения «лечебными генами», доставляемыми в клетки сетчатки аденовирусными векторами [1], что уже тогда воплощало современную концепцию геннозаместительной терапии [2]. Суть ее — в замещении дефектных генов их здоровыми (то есть функциональными) копиями, доставленными в клетку с помощью специальных носителей — и чаще всего на их роль выбирают вирусные векторы.
Погодите, ведь вектор — это что-то из геометрии?.. А вирус — он несет смертельную опасность, разве не так? Если у вас в голове мелькнули эти мысли — приглашаем для начала ознакомиться с более ранними публикациями спецпроекта о генной и клеточной терапиях, начиная например со статьи «Генная терапия: познакомьтесь с лекарствами будущего» [3].
Однако не только большое число болезней сетчатки привлекло к глазам — одним из первых! — внимание разработчиков генной терапии. Здесь сыграла роль уникальная анатомия сетчатки и даже некоторая иммунологическая... привилегированность этого органа. Дело в том, что наряду с центральной нервной системой, плацентой, плодом и яичками человеческий глаз — относительно закрытый от иммунитета орган. Причем сетчатка — его и самая изолированная, и иммунологически наиболее «привилегированная» часть. В целом это означает, что помещаемые в глаз (и особенно в сетчатку) трансплантаты тканей или чужеродные агенты (например, вирусные векторы для генной терапии) не будут отторгаться иммунной системой — из-за ее сниженной активности. Связано это с тем, что такие «привилегированные» участки изолированы от прямого контакта с системным кровообращением (рис. 3) и защищены от циркулирующих в крови иммунных клеток и их «белковых помощников» — антител и цитокинов . Исследователи полагают, что иммунологические привилегии — эволюционная защита определенных органов от воспалительных повреждений и, как следствие — потери функции. Для глаза такое воспаление привело бы к ухудшению или даже полной потере зрения.
Цитокины — небольшие белковые молекулы, помогающие иммунным клеткам «общаться» и координировать борьбу с инфекцией. Антитела же не только позволяют таким клеткам узнавать «чужаков» в организме, но и сами способны их нейтрализовывать: «Иммунитет: борьба с чужими и... своими» [5].
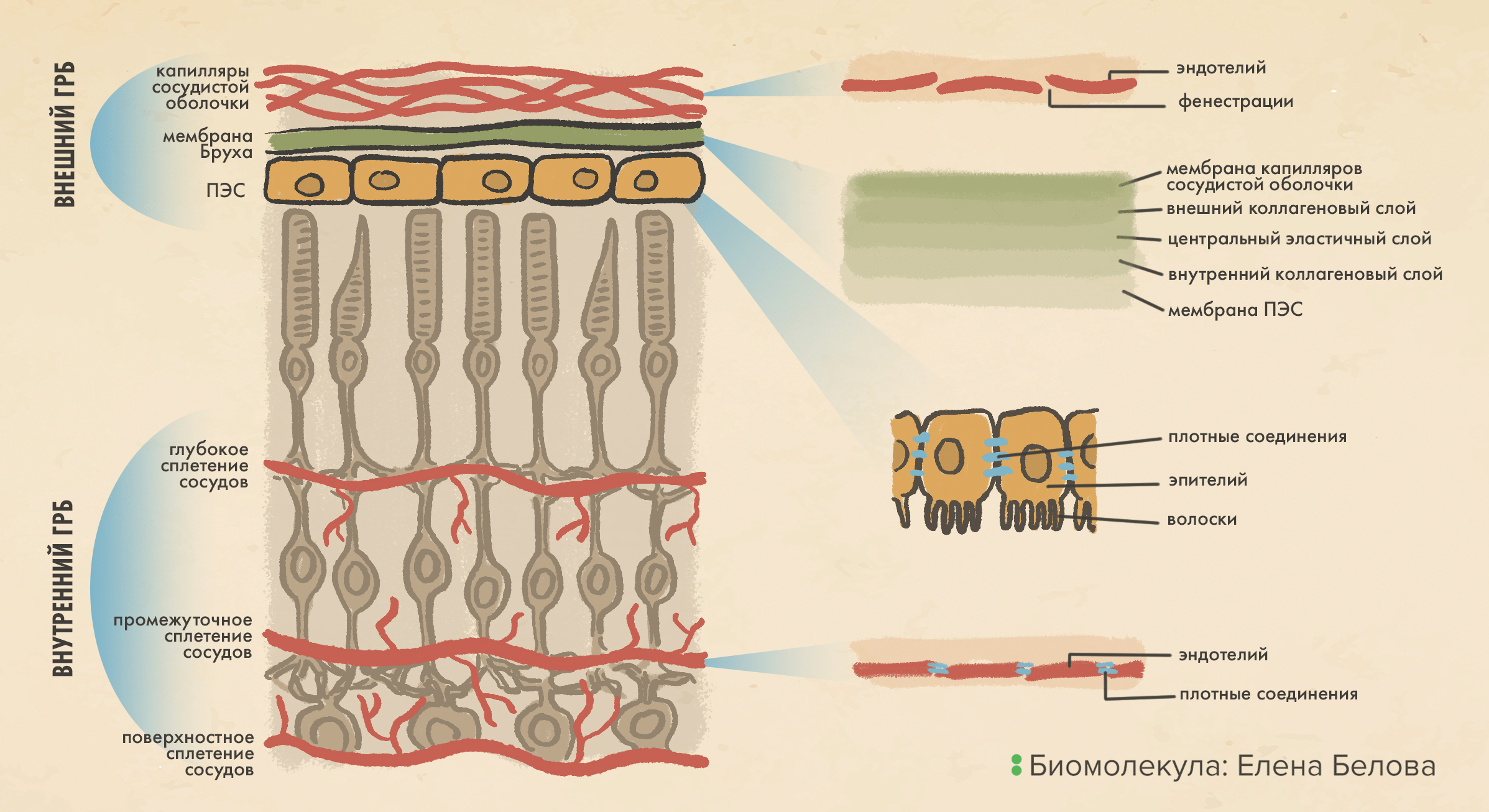
Рисунок 3. Гемато-ретинальный барьер (ГРБ) отделяет сосудистую сеть глаза от сетчатки. Внешний ГРБ (сверху) изолирует сетчатку от капилляров сосудистой оболочки, в эндотелии которых много отверстий (фенестраций), однако малые молекулы могут выборочно проходить через пятислойную мембрану Бруха и через плотно «сшитый» пигментный эпителий сетчатки (ПЭС), достигая непосредственно сетчатки. Внутренний ГРБ (снизу) изолирует сетчатку от ее собственной трехслойной сосудистой сети; здесь уже работает сам эндотелий сосудов сетчатки, плотные контакты между клетками которого образуют селективный барьер.
иллюстрация Елены Беловой по [38]
К счастью, иммунные привилегии «прикрывают» наш орган зрения от тяжелого воспаления (в ответ на введение чужеродных антигенов), давая разработчикам генного лечения важное преимущество. Однако это далеко не единственное, что делает сетчатку привлекательной мишенью генной терапии (наиболее важные факторы кратко изложены ниже):
- Воздействие терапевтических генов здесь более точечное и безопасное, так как гематогематические барьеры (рис. 3) предотвращают «утечку» введенных векторов в системный кровоток, снижая вероятность нежелательных явлений.
- Векторы почти не выводятся из глаза и не нейтрализуются антителами в сетчатке, что вместе с их длительной «работоспособностью» обусловливает долгосрочность лечения. Длительная служба векторов определяется их свойствами (в основном используют аденоассоциированные векторы, экспрессирующиеся до 10 лет), а также особенностями клеток сетчатки, — после рождения человека они уже не делятся, а потому не теряют и экспрессию векторов [6], [7].
- В небольшой по размеру глаз векторов нужно доставить немного, что упрощает и удешевляет их производство.
- Оценку эффективности лечения можно провести неинвазивно — визуальной диагностикой, ведь, по сути, это единственная область мозга, в которую можно «заглянуть» напрямую (см. врезку).
- Парность нашего зрительного органа обусловливает еще одно преимущество — при лечении одного глаза другой можно использовать как контроль, проверяя эффективность лечения первого.
- И, наконец, последнее, но, быть может, главное: клетки сетчатки подвержены самым разным дегенеративным изменениям из-за моногенных мутаций (наследственные заболевания сетчатки связаны с мутациями более чем в 270 генах [8]).
Не в бровь, а в глаз: о доставке генетических векторов
Как мы уже начинали говорить выше, главное средство доставки «лечебных генов» на сегодняшний день — вирусные векторы. Самыми безопасными и удобными сейчас считаются аденоассоциированные вирусы [9], почти полностью вытеснившие аденовирусные носители (которые ввиду высокой иммуногенности используют сейчас в основном в вакцинах — там это оказывается кстати [1]) .
Речь здесь о терапии in vivo — то есть прямом введении пациенту раствора с вирусными векторами, трансдуцирующими (заражающими) его клетки прямо в организме. Если же в ход идет подход ex vivo — когда извлеченные у пациента клетки трансдуцируют векторами вне организма, а потом возвращают обратно ему же, — выгоднее использовать лентивирусные векторы. О них читайте в статье: «Лентивирусные векторы: как они стали лучшими векторами для терапии ex vivo» [10].
Однако вектор мало сконструировать и произвести — его еще нужно доставить в точку назначения, причем в оптимальном количестве для стабильной терапевтической экспрессии трансгена. В глаз вектор доставляют в основном инъекциями, и выделяют три их вида: субретинальную, интравитреальную и супрахориоидальную (рис. 4) [11]. Что выбрать — зависит от эффективности доставки, инвазивности (тяжести таких инъекций для пациента), побочных эффектов, а также технической сложности операции, — а для разных способов введения эти параметры различны.
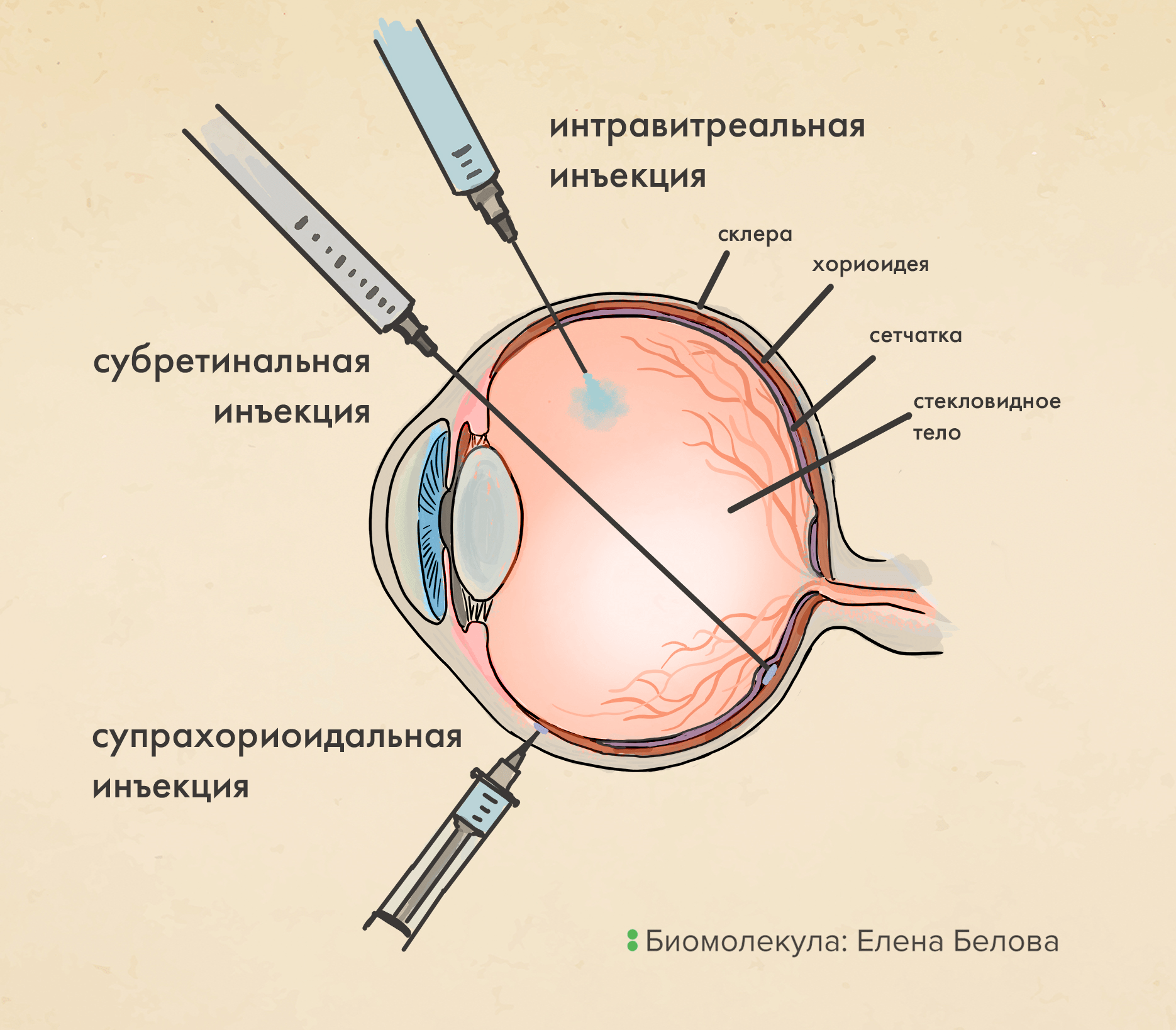
Рисунок 4. Пути доставки вирусных векторов в сетчатку. Субретинальная инъекция делается непосредственно под фотосенсорный слой сетчатки, в так называемое субретинальное пространство (область между клетками пигментного эпителия сетчатки и ее фоторецепторами) — хирургически это очень сложно. При интравитреальной инъекции суспензией с лекарством заполняют стекловидное тело, и потому воздействию векторов подвергаются все внутриглазные поверхности. Супрахориоидальная инъекция нацелена в область между сосудистой оболочкой глаза и склерой, по которой лекарство может «растечься» по обширной области.
иллюстрация Елены Беловой по [12]
Субретинальная инъекция —
самый популярный и наиболее изученный метод введения векторов в глаз благодаря эффективности трансдукции нужных клеток — чаще всего это клетки пигментного эпителия и фоторецепторы. Субретинальное пространство же такими клетками непосредственно окружено (рис. 5), что и направляет вектор точно в цель.
Однако субретинальная операция сложна, чревата осложнениями, да и просто инвазивна — еще до инъекции нужно сделать так называемую витрэктомию pars plana (а дальше — еще и ретинотомию ) для облегчения доступа к задней части глаза [12]; да и сама инъекция вирусных частиц — крайне сложная задача, требующая от хирургов высочайших навыков и опыта [11]. Введение векторов необходимо производить точно в субретинальное пространство, контролируя глубину инъекции для сохранности нижележащих слоев (мембраны Бруха и лежащей под ней сосудистой оболочки — хориоидеи). Сделать это очень сложно, ведь участок инъекции совсем крошечный: размером около 200 микрон, а хирургическая игла должна не только туда попасть, но и оставаться на месте во время введения лекарства. Однако при ручном введении кончик инструмента даже лучшего хирурга может «дергаться» в пределах 100 микрон, а потому успешное выполнение такой инъекции бросает настоящий вызов возможностям хирурга и находится буквально на пределе физиологических возможностей человека [13], [14].
Витрэктомия — удаление стекловидного тела: vitreum (лат. «стекло») + эктомия (др.-греч. ἐκτομή — «вырезание, усечение»); облегчает субретинальное введение, но повышает риск развития катаракты и отслойки сетчатки [12].
То есть рассечение сетчатки.
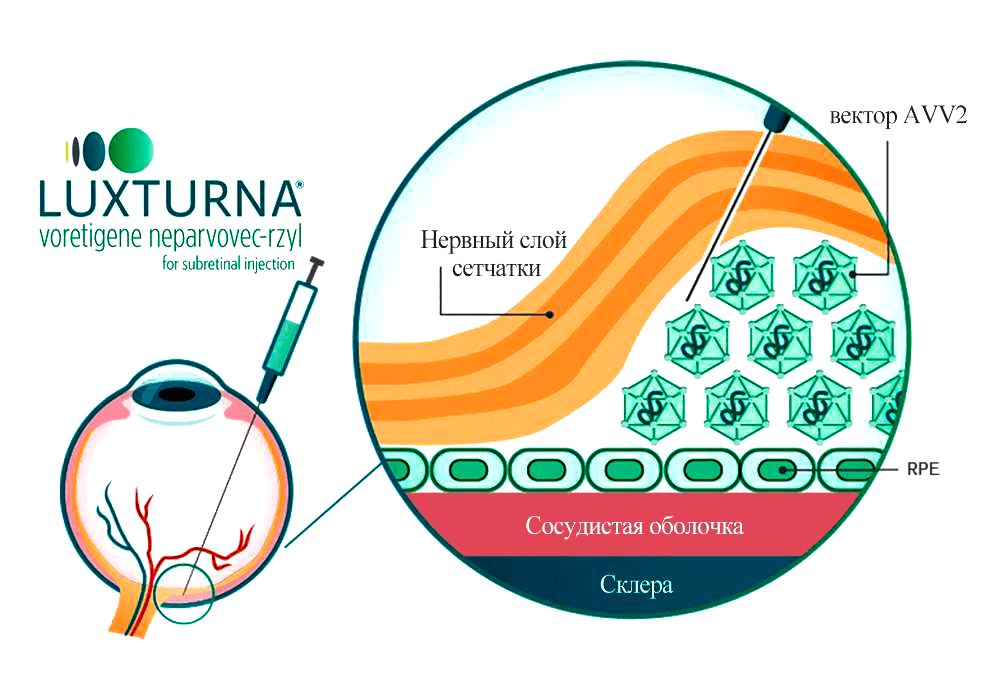
Рисунок 5. Субретинальное введение препарата «Люкстурна». Чтобы ввести суспензию лечебных векторов типа AAV2, специалистам необходимо попасть иглой между слоями сетчатки: пигментным эпителием (RPE) и фоторецепторными клетками (обозначены желтым). Излишне говорить, что чисто хирургически это очень сложно.
Вероятно, из-за высокой сложности и инвазивности субретинальных инъекций описана масса осложнений: макулопатии, макулярные разрывы, разрывы сетчатки и/или ее пигментного эпителия, хориоидальная неоваскуляризация, повышенное внутриглазное давление, необратимая потеря зрения, катаракта, субконъюнктивальные и/или ретинальные кровоизлияния, эндофтальмит, рефлюкс (излияние) суспензии векторов из субретинального пространства в стекловидное тело (с возможными иммунными реакциями, направленными на вирусные капсиды) и др.
Еще одно ограничение — концентрация всей дозы векторов буквально в одной точке (рис. 5), из-за чего они трансдуцируют лишь небольшую часть клеток сетчатки (самые близкие от места инъекции), что снизит эффективность лечения там, где важно как раз широкое воздействие (например, при пигментном ретините) [12], [15].
Интравитреальная инъекция
гораздо проще по сравнению с субретинальной, менее инвазивна, имеет меньше осложнений и обеспечивает более равномерное распределение вирусных векторов по сетчатке [11]. По этой причине она может гораздо лучше подойти для генной терапии пигментного ретинита: при этом заболевании дегенерация фоторецепторов обычно начинается с периферии сетчатки, постепенно продвигаясь к центру (при этом первыми поражаются палочки). Теоретически, если «починить гены» в палочках на ранней стадии этой болезни, можно предотвратить и даже частично обратить вспять дегенерацию сетчатки [11]. Однако на практике все совсем не так просто, ведь при интравитреальном введении достичь нужных клеток (клеток пигментного эпителия и фоторецепторов) довольно нелегко.
Дело в том, что при инъекции в стекловидное тело вектор в нем же и «растворяется», и доставка становится менее адресной [15]. К тому же, чтобы потом добраться до светочувствительной части сетчатки, векторам потребуется пересечь восемь–девять ее слоев [11], в то время как есть справедливые сомнения, что они смогут пересечь хотя бы первый (и все это явно будет снижать эффективность трансдукции целевых клеток) ...
Ведь со стороны стекловидного тела сетчатку выстилает внутренняя пограничная мембрана, прорваться через которую сложно — она, хотя и тонкая (шириной 2–3 мкм), но очень плотная и препятствует проникновению векторов в нижележащие слои [12].
Все это вместе может не только снизить эффективность лечения, но и усилить побочные эффекты. Казалось бы, можно просто увеличить концентрацию вектора для лучшей трансдукции, но и это нехорошо — в отличие от субретинального пространства, антитела все же могут проникать в стекловидное тело, что, очевидно, снизит лечебный эффект и вызовет нежелательные явления [12]. В такой ситуации большие титры векторов лишь «подольют масла в огонь» и разожгут совсем ненужный здесь иммунный ответ.
Очевидно, что интравитреальное введение векторов имеет множество ограничений и годится далеко не для всех случаев генной терапии, хотя в офтальмологии в целом это наиболее частый подход среди инвазивных — благодаря безопасности и эффективности [15].
В генном же лечении введение векторов в стекловидное тело хорошо подходит для внешних слоев сетчатки, тогда как субретинальная доставка лучше годится для внутренних слоев [15]. Поэтому интравитреальное введение можно выбрать, например, при оптической невропатии Лебера и глаукоме (здесь терапевтический эффект последует за трансдукцией ганглионарных клеток, непосредственно контактирующих со стекловидным телом) [12].
Супрахориоидальная инъекция
делается в область между склерой и сосудистой оболочкой (хориоидеей) шириной примерно 35 микрон (рис. 6). До недавнего времени операцию делали при помощи катетеров и подкожных игл — и она была технически сложной и небезопасной [12]. Все изменилось с развитием технологии микроигл (например, SCS Microinjector™), сделавших этот укол, выполняемый под местной анестезией, минимально инвазивным [12].
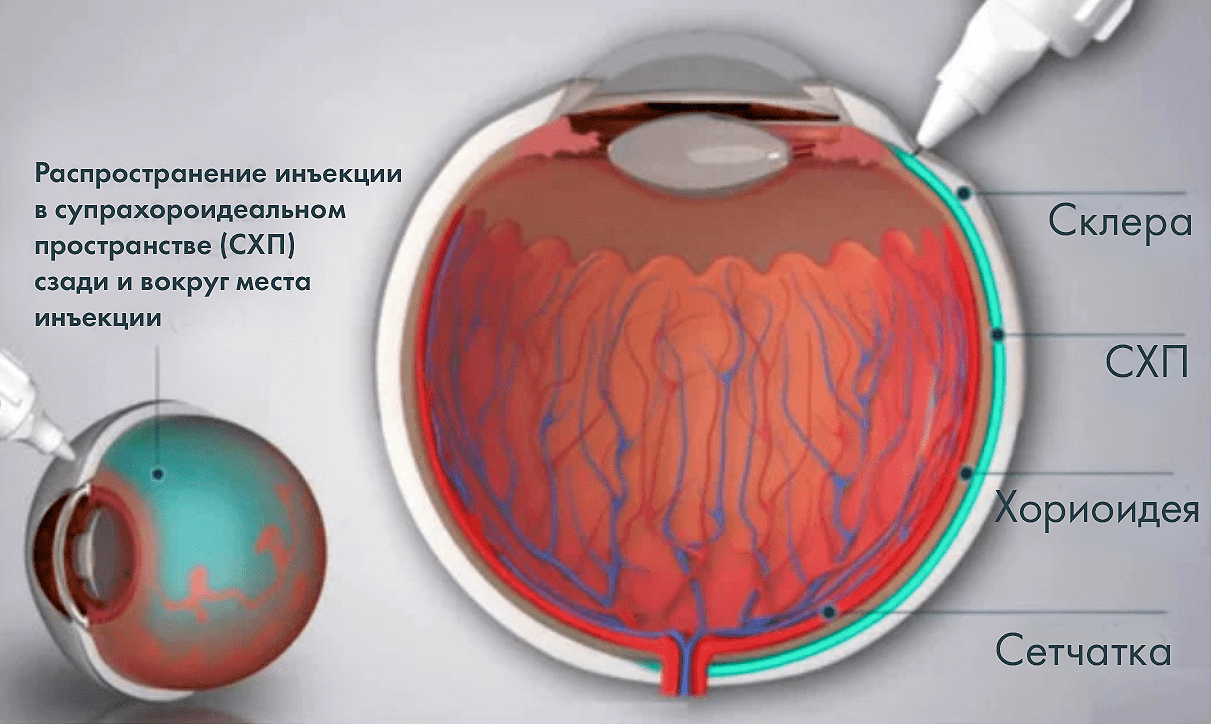
Рисунок 6. Распределение введенного препарата после супрахориоидальной инъекции. Голубая область показывает, как далеко может распространиться лекарство при таком введении.
Главное преимущество супрахориоидальной доставки — более высокая адресность и биодоступность на большей площади сетчатки и сосудистой оболочки в сравнении с интравитреальным введением. Суспензия векторов здесь уже не растворяется по всему объему стекловидного тела, а распространяется назад по тонкому сферическому слою, что позволяет векторам достигать задней части глаза, включая хориоидею и сетчатку, в бо́льших концентрациях (рис. 6). Помимо этого очевидного преимущества, при таком уколе удается избежать плавающих помутнений в глазу, и это не говоря уже о рисках инвазивной витрэктомии при субретинальной доставке [16].
Однако есть тут и минусы:
- После введения в супрахориоидальное пространство может возникнуть клиренс векторов — «утекание» от целевых клеток-мишеней через отверстия капилляров в сосуды хориоидеи, а оттуда и в системный кровоток (хотя это и «неточно» — размер пор может оказаться недостаточным). Кстати, это же может ограничить и проникновение векторов в сетчатку, снижая эффективность трансдукции.
- Хотя такая доставка считается адресной, полностью исключить системное действие нельзя — а, стало быть, требуется скрупулезная оценка возможности трансдукции нецелевых тканей.
- Супрахориоидальное пространство не ограничено гемато-ретинальным барьером, а потому лишено иммунологических «привилегий». Так что тут потребуется учитывать возможную нейтрализацию векторов антителами [12].
Сегодня супрахориоидальная генная терапия испытывается в исследовании RGX-314 компании RegenxBio и показывает благоприятный профиль безопасности и некоторые признаки дозозависимого ответа у пациентов с влажной возрастной макулярной дегенерацией (влажной ВМД), проходивших лечение в рамках исследования AAVIATE фазы 2 [17].
Данные об эффективности пока поверхностные: показано только, что препарат хорошо переносится и может снижать бремя анти-VEGF терапии; кстати, по тем же показаниям это же лекарство исследуется при введении субретинально; и его также вводят супрахороидально при диабетической ретинопатии (обо всем этом расскажем ниже).
Резюмируя: метод супрахориоидального введения пока не получил широкого распространения в клинической практике, и потому безопасность, эффективность и долгосрочность действия целевого лекарственного вещества при его применении еще предстоит доказать. В случае же успеха такая генная терапия может проложить путь к менее инвазивной (и потому более безопасной) трансдукции клеток сетчатки.
Генная терапия болезней зрения
Далее переключимся со способов введения на конкретные исследования генной терапии глаз, некоторые из которых оказались успешными, другие многообещающими, а часть — потерпели неудачу. Однако даже отрицательный результат на этой стадии полезен, потому что обозначает точки роста для будущих вариантов лечения различных заболеваний и раскрывает механизмы патогенеза этих заболеваний у человека.
Генно-заместительная терапия
Зрительный цикл, ген RPE65 и «Люкстурна»
Voretigene neparvovec-rzyl (Luxturna, Spark Therapeutics) — первый (и пока единственный) одобренный FDA еще в конце 2017 года генный препарат для лечения заболеваний, связанных с мутациями в гене RPE65. Ген этот кодирует фермент, превращающий 11-транс-ретинол (известный также как витамин А) в 11-цис-ретинол — ключевой метаболит ретиноидов в зрительном цикле (рис. 7).
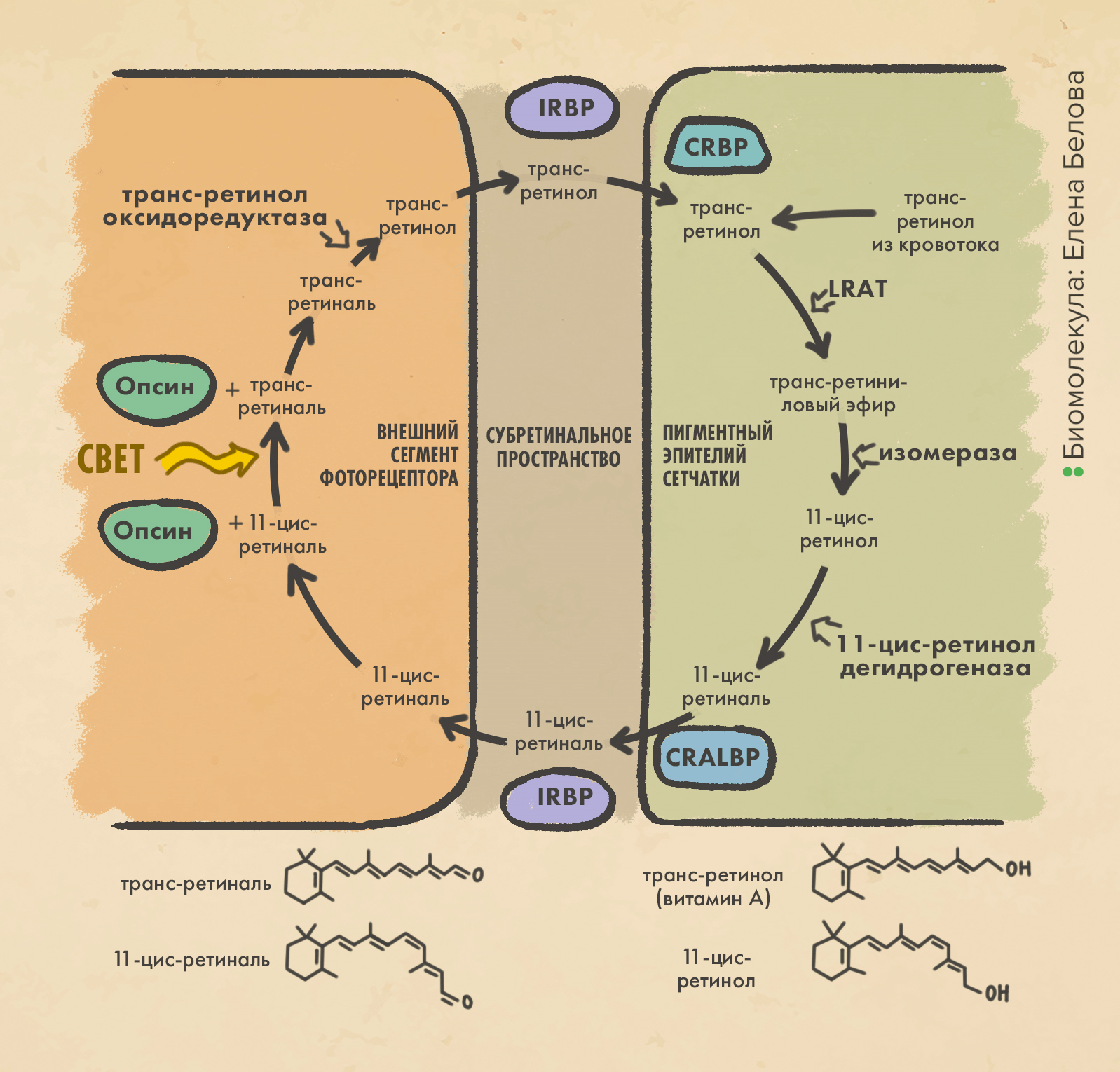
Рисунок 7. Метаболизм ретиноидов в зрительном цикле. Транс-ретинол поступает в пигментный эпителий сетчатки из кровотока или из фоторецепторных клеток (палочек и колбочек), где он образуется из цис-метаболита путем фотоизомеризации ⚡ при поглощении света — это ключевой этап световой чувствительности зрительных пигментов (родопсинов). И если цис-ретиналь связан с родописином ковалентно, транс-метаболит диссоциирует в свободной форме и тем самым обесцвечивает белок-пигмент. В пигментном эпителии сетчатки транс-ретинол связывается ретинолсвязывающим белком (CRBP), но также этерифицируется до полностью транс-ретиниловых эфиров — субстратов ретиноид-изомерогидролазы (продукта гена RPE65). Эта изомераза превращает их в 11-цис-ретинол, окисляемый до 11-цис-ретиналя 11-цис-ретинолдегидрогеназой. Этот метаболит в клетке образует комплекс с ретинальдегидсвязывающим белком (CRALBP), а в субретинальном пространстве — с ретиноидсвязывающим белком (IRBP). Отсюда молекула переносится в колбочки и палочки, где связывается с белком опсином, образуя фотоактивный фермент родопсин — это ключевая стадия цикла. Под воздействием света ⚡ ретиналь претерпевает цис→транс фотоизомеризацию, активируя родопсин и запуская молекулярный зрительный каскад в клетке-фоторецепторе; родопсин при этом диссоциирует на опсин и транс-ретиналь. Опсин, активировав свою палочку или колбочку, будет ждать новой молекулы цис-ретиналя, а транс-ретиналь, восстановившись сперва до транс-ретинола (под действием транс-ретинолоксидоредуктазы), покинет фоторецепторную клетку и выйдет в субретинальное пространство, дав начало новому обороту этого цикла.
На этом рисунке не показана стимуляция активированным родопсином сотен гетеротримерных G-белков, называемых трансдуцинами — их активация запускает молекулярный сигнальный каскад зрения, в результате которого первичный зрительный стимул (поглощение фотона цис-ретиналем) передастся по зрительным нервам прямиком в зрительную кору мозга. Желающих подробнее разобраться в структуре и молекулярных превращениях родопсина отправляем к статье «Зрительный родопсин — рецептор, реагирующий на свет» [4].
иллюстрация Елены Беловой по oculist.net
Поскольку весь этот сложнейший цикл приводит к зрительному возбуждению, а значит, и к самому феномену зрения, — «выбивание» одного из его ключевых компонентов из-за мутации может привести сначала к дисфункции, а затем и к гибели фоторецепторов. Это так серьезно, что без лечения тяжелая и прогрессирующая слепота наступает почти неминуемо.
Заболевания, вызываемые мутацией гена RPE65, включают амавроз Лебера (АЛ), пигментный ретинит (ПР) 20-го типа, а также некоторые формы ранней дистрофии сетчатки [3]. При врожденном АЛ мутации в RPE65 встречаются в 6–16% всех известных случаев [20]; при аутосомно-рецессивном ПР — только в 2–5% случаев (при этом аутосомно-рецессивным путем наследуются 5–20% всех форм ПР) [21].
Так или иначе, если генетическим тестом определено, что у пациента мутации в двух копиях гена RPE65, и у него осталось достаточное количество функционирующих клеток сетчатки, — лечиться надо препаратом Luxturna (рис. 5).
В ходе клинического исследования фазы III однократная доза данного препарата улучшала зрение через год — это измерялось тестом, в котором пациенты ориентировались при различной интенсивности света (у участников исследования происходило усиление светочувствительности и расширение полей зрения [22]); причем первые улучшения наблюдались через 30 дней после начала лечения. Здесь также фиксировали некоторое усиление остроты зрения — правда, оно не было статистически значимым. На данный момент известно, что улучшения зрения сохраняются в течение минимум пяти лет после инъекции «Люкстурны», однако наблюдения еще продолжаются.
И хотя у «Люкстурны» есть целый ряд побочных эффектов (в частности, отмечаемых при субретинальных инъекциях — см. выше), это лекарство — самый настоящий прорыв: ведь оно дарит пациентам с практически гарантированной слепотой шанс на полноценную жизнь (рис. 8).

Рисунок 8. Звездное небо, которое смогла увидеть Мисти — одна из участниц исследования «Люкстурны». Вот что она сказала после операции: «Одной из лучших вещей, которые я когда-либо смогла увидеть, были звезды. Раньше я не знала, что это такие маленькие мерцающие точки».
Х-сцепленный пигментный ретинит (XLRP)
Составляет 5–15% всех случаев пигментного ретинита и обусловлен нарушениями в нескольких генах, в том числе гене регулятора ГТФазы пигментного ретинита (RPGR), на который приходится 70% случаев XLRP и около 11% всех случаев пигментного ретинита. RPGR кодирует белок, расположенный во внешних сегментах палочек; его функция до конца еще не изучена, однако для нормальной работы фоторецепторов он точно необходим, чем и объясняется его роль в патогенезе XLRP [23].
Из всех форм пигментного ретинита XLRP считается самой тяжелой: у страдающих ей сужаются поля зрения, развивается ночная слепота и нистагм (непроизвольные маятниковые движения глаз), появляются вспышки света в глазах, ухудшается различение цветов и снижается острота зрения. Все это растет как снежный ком, и пациенты часто становятся инвалидами по зрению еще до окончания средней школы (и в конечном счете слепнут). Одобренного лечения XLRP пока не существует, но есть исследования, дающие надежду на скорое появление генной терапии.
Laruparetigene zosaparvovec (AGTC-501)
Еще в 2018 году компания Applied Genetic Technologies Corp (AGTC) запустила SKYLINE — клиническое исследование фаз I/II с участием 29 пациентов с XLRP, с использованием усовершенствованного AAV2-вектора с особым промотором человеческой родопсинкиназы (rAAV2tYF–GRK1–RPGR). Такой промотор активируется именно в фоторецепторах, обеспечивая селективную экспрессию целевого трансгена, что явно необходимо для лечения заболеваний этих нейронов.
Первые результаты представили в 2021 году: AGTC-501 хорошо переносился в широком диапазоне доз с легкими или умеренными нежелательными эффектами (связанными с субретинальным вмешательством). Самое главное — лечение привело к статистически значимому улучшению остроты зрения [24].
Этот предварительный положительный результат в том же 2021 году побудил запустить VISTA — новое клиническое исследование фаз II/III для оценки эффективности, безопасности и переносимости AGTC-501 с участием уже 60 пациентов [25]. Компания AGTC была куплена британским холдингом Syncona, и сейчас AGTC-501 разрабатывает компания Beacon Therapeutics.
Botaretigene sparoparvovec (bota-vec)
MeiraGTx (совместно с Janssen) провела исследование, в ходе которого пациентам субретинально вводили векторы с инвертированным терминальным повтором (ITR) серотипа 2 и капсида серотипа 5 (AAV2/5 ). Эти векторы содержали укороченную (на 126 аминокислот), но функциональную версию RPGR .
Данная модификация повышает эффективность трансдукции и изменяет тропизм вектора в направлении нейронов, которыми и являются клетки-фоторецепторы. Благодарить за это нужно именно AAV5 — ну а AAV2 трансдуцируют нейроны недостаточно эффективно.
Под контролем уже известного нам промотора человеческой родопсинкиназы.
Общий профиль безопасности в этом исследовании был благоприятным — пациенты, получавшие низкие и средние дозы, демонстрировали повышение чувствительности сетчатки, а также статистически значимое устойчивое улучшение зрения через год после начала лечения. Хуже было с высокой дозой — при ней чувствительность, напротив, снижалась, а у двух из трех пациентов зафиксировали воспаление, которое скорректировали стероидными противовоспалительными средствами.
В настоящее время продолжается клиническое исследование фазы 3 LUMEOS, в котором участвуют 97 пациентов.
4D-125 (4D Molecular Therapeutics — 4DMT)
В этой генной терапии для доставки функциональной копии гена RPGR к фоторецепторам используется разработанный компанией 4DMT и запатентованный вариант капсида AAV (на основе вектора R100, рис. 9). Такая терапия крайне интересна тем, что, в отличие от всех описанных выше, доставляет целевой трансген не субретинально, а интравитреально, в чем как раз помогает созданный компанией вектор. Он получен методом направленной эволюции, и, как заявляют представители 4DMT, обладает способностью проникать через внутреннюю пограничную мембрану, эффективно трансдуцируя все клетки сетчатки и стабильно экспрессируя целевой трансген.
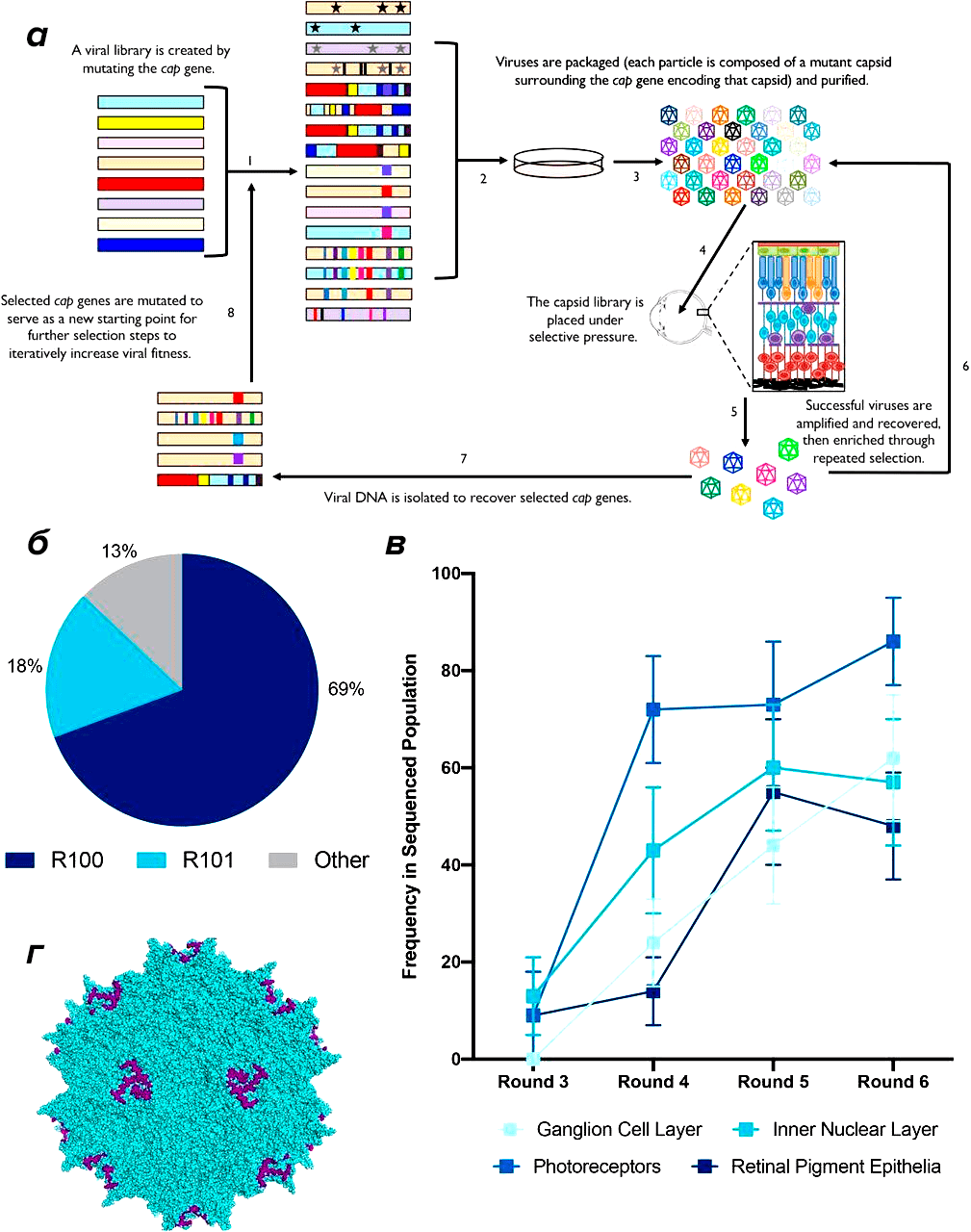
Рисунок 9. Направленный эволюционный редизайн капсида AAV позволяет распределять вектор во все слои сетчатки при интравитреальной доставке. а — Схема направленной эволюции: 1) создание плазмидной библиотеки из более чем 20 мутированных cap-генов капсида; 2) сборка вирусных частиц так, чтобы конкретный вариант капсида содержал свой же cap-ген; 3) очистка; 4) «in vitro-эволюция»; 5) размножение «выживших» в результате искусственного отбора частиц; 6) повторные раунды селекции; 7) выделение и секвенирование ДНК для установления последовательности мутантных cap-генов; 8) отобранные cap-гены вновь подвергают мутационному воздействию, а затем включают в новую плазмидную библиотеку; после этого весь цикл повторяют несколько раз (до тех пор, пока не будут получены капсиды с нужными исследователям свойствами). б — Частота вариантов мотивов в рамках анализа секвенирования 6-го раунда направленной эволюции. в — Частота варианта мотива R100, обнаруженного в отдельных слоях клеток сетчатки (слой ганглиозных клеток, внутренний ядерный слой, слой фоторецепторов, слой пигментного эпителия сетчатки) в раундах направленной эволюции 3-6. г — 3D-модель R100.
В октябре 2021 года компания опубликовала предварительные результаты клинического исследования фазы I/II с использованием R100 у пациентов с поздними стадиями XLRP и сниженной (или отсутствующей) чувствительностью сетчатки. Никакой дозоограничивающей токсичности или серьезных нежелательных явлений в этом исследовании не наблюдалось. Интересно, что у двух пациентов при контрольном обследовании (через 6 и 9 месяцев) чувствительность сетчатки повысилась [23].
Эта терапия имеет множество преимуществ: интравитреальное введение значительно безопасней субретинальных инъекций, а проникновение R100 во все слои и клетки сетчатки (если это и правда так) может помочь сохранить фоторецепторы более молодым пациентам, остановив или сильно замедлив их деградацию в результате прогрессирования болезни (с соответствующим улучшением зрительной функции и общего самочувствия больных).
Возможно, именно исходя из этого FDA присвоило данной терапии статус Fast Track, подразумевающий ускоренное рассмотрение заявки на одобрение терапии. Кстати аналогичный вариант вектора (4D-R100) компания 4DMT уже использует в клиническом исследовании лечения хороидеремии (см. ниже).
Cotoretigene toliparvovec (BIIB112, Biogen)
Стоит отметить, что далеко не все перспективные подходы генной терапии показывают достоверную эффективность в клинических испытаниях — иногда они и вовсе оказываются провальными. Нечто подобное недавно произошло с кандидатом на генную терапию XLRP от компании Biogen (ранее данная разработка была выкуплена у Nightstar).
Исследуемая генная терапия на основе вектора AAV8 предназначена для субретинального введения и обеспечения наличия функционального белка-регулятора ГТФазы пигментного ретинита у пациентов с Х-сцепленным пигментным ретинитом (XLRP), вызванным мутациями в гене RPGR. Заменяя этот ген, которетиген толипарвовек увеличивает уровень RPGR-белка, что может замедлять, останавливать или предотвращать дальнейшую дегенерацию фоторецепторов у пациентов с XLRP, aссоциированным с RPGR,
Несмотря на многообещающие первичные данные (6-месячные результаты исследования этого препарата фазы I/II демонстрировали, что у 7 из 18 участников несколько улучшались зрительные функции), Biogen здесь, к сожалению, не достигли основной цели исследования — значительного и устойчивого функционального улучшения зрения и состояния сетчатки.
И хотя для компании все это обернулось провалом (убытки оценивают в $250+ млн), представители Biogen по-прежнему считают, что такая терапия может быть полезна. Эта идея подтверждается более поздними (12-месячными) данными, показавшими улучшение чувствительности сетчатки у 12 из 18 пациентов, получавших самые высокие дозы препарата. Исследователи считают, что этого может быть достаточно, чтобы продолжить испытания.
Хороидеремия
(или хориоретинальная дистрофия — то есть дистрофия сосудистой оболочки) — хориоидеи) — заболевание, приводящее к прогрессирующей потере зрения. Как и XLRP, эта болезнь Х-сцеплена и вызывается мутациями в небольшом гене CHM, кодирующем белок клеточного транспорта REP1. Точный патогенез пока неясен, но считается, что сначала поражаются клетки пигментного эпителия, а затем постепенно разрушаются фоторецепторы и атрофируется сетчатка. Все это развивается далеко не разом, а в течение всей жизни человека — и, как правило, потеря зрения наступает только после дегенерации нескольких слоев сетчатки. Большинство затрагивающих CHM мутаций (а их найдено более 200) приводят к потере функции REP1 — а значит, есть основания выбрать заместительную генную терапию. На руку играет и небольшой размера гена CHM, который легко упаковать в ограниченный по емкости AAV.
В 2011 году Оксфордский университет провел первое испытание генной терапии против хороидеремии фазы I/II с использованием вектора AAV2, модифицированного промотором β-актина курицы, а также посттранскрипционным регуляторным элементом вируса гепатита североамериканского лесного сурка (WPRE). Такой интересный промотор установили с целью долгосрочной трансдукции пигментного эпителия сетчатки (в предыдущих испытаниях было показано: он помогает трансдуцировать эти клетки); не менее «экзотичный» регуляторный элемент WPRE применили, поскольку он усиливает экспрессию целевого трансгена [26].
Субретинальные инъекции таких векторов получили шесть пациентов, у двоих из которых с наиболее поздними стадиями заболевания наблюдалось раннее улучшение, а у большинства остальных также наблюдалось улучшение в последующем исследовании через 3,5 года — в сравнении с «нелеченным» глазом (на котором наблюдалась прогрессирующая дегенерация сетчатки) [23].
После этого и еще нескольких аналогичных академических исследований (также имевших относительный успех) за лечение хороидеремии взялись фармацевтические компании; правда, несмотря на внушительные денежные вливания, их исследования пока сложно назвать успешными. Запущенные Biogen (ранее Nightstar Therapeutics) и Spark Therapeutics исследования пока еще не выявили существенного улучшения остроты зрения — ни при низких, ни при высоких дозах векторов. Однако тут стоит оговориться, что тестируемые этими компаниями методы лечения, вероятно, требуют более длительного наблюдения, чтобы сделать окончательный вывод.
Между тем, в 2020 году 4DMT начала клиническое исследование фазы I по лечению хороидеремии интравитреальной инъекцией нового варианта капсида 4D-R100 для доставки в сетчатку целевого трансгена. Как и в случае 4D-125, предполагается, что это приведет к его экспрессии во всех слоях и регионах сетчатки после однократной дозы. Если это получится, данный подход снизит риск осложнений на сетчатке в результате терапии, поскольку позволит избежать более рискованных субретинальных инъекций [23]. На данный момент в это исследование включено 13 пациентов, а первые результаты ожидаются в июне 2024 года.
Наследственная оптическая нейропатия Лебера (LHON)
Более трех десятилетий назад наследственная оптическая невропатия Лебера стала первой болезнью, связанной с мутацией в митохондриальной ДНК; также это первое митохондриальное заболевание, которое подверглось коррекции генной терапией; а, кроме того, считается, что это еще и самое распространенное митохондриальное заболевание [27]. LHON поражает ганглиозные клетки сетчатки, аксоны которых образуют зрительный нерв и, проходя через зрительный перекрест в зрительные тракты, несут информацию непосредственно в мозг (рис. 10). Дегенерация ганглиозных клеток и их аксонов приводит к быстро прогрессирующей двусторонней потере центрального зрения [28].
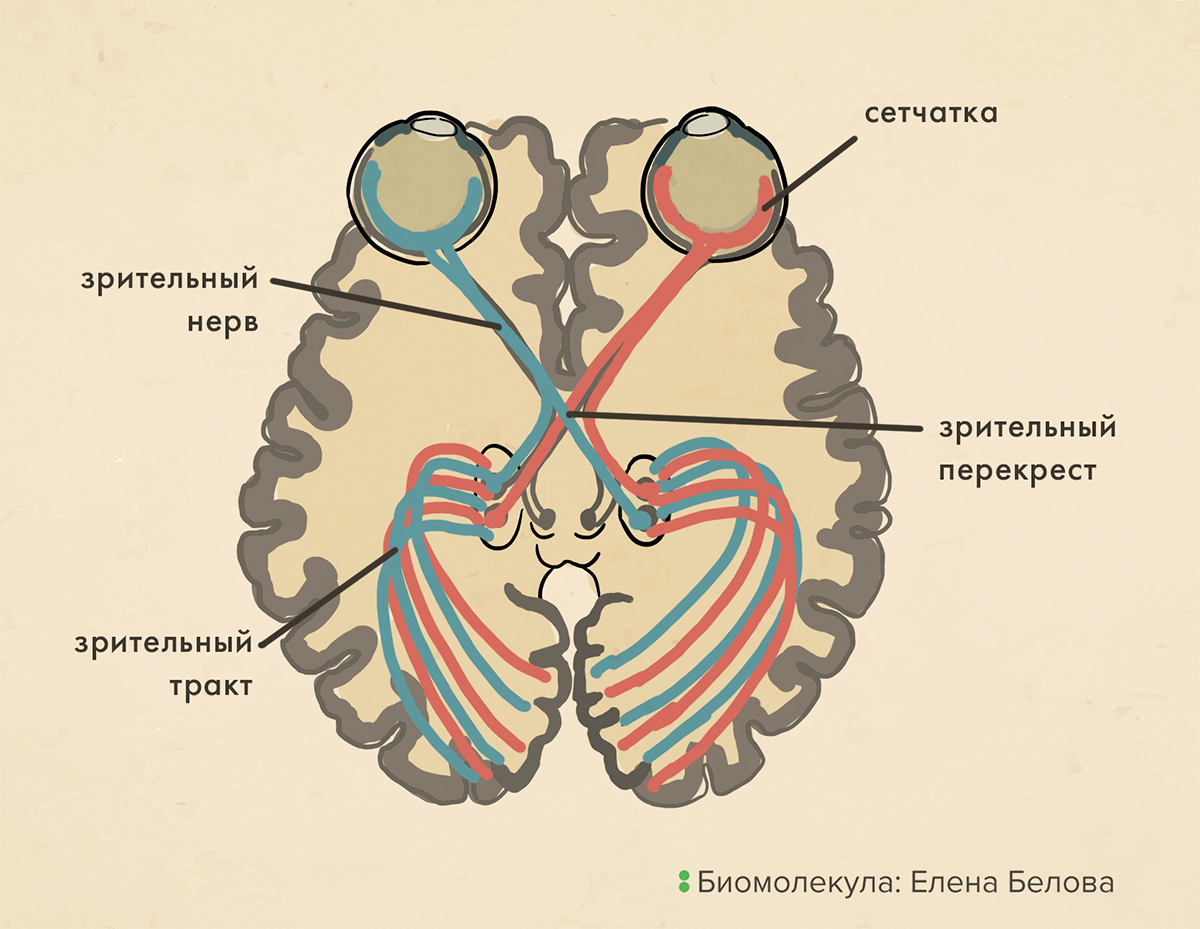
Рисунок 10. Аксоны ганглиозных клеток образуют зрительный нерв, который далее через зрительный перекрест и зрительный тракт передает информацию непосредственно в мозг.
иллюстрация Елены Беловой по изображению Первой медицинской клиники
Патогенез LHON в основном (≈90% случаев) определяется точечными мутациями в трех митохондриальных генах: MT-ND1, MT-ND4 и MT-ND6. Эти гены кодируют три структурные субъединицы НАДН-дегидрогеназного комплекса, играющего ключевую роль в производстве АТФ (при окислительном фосфорилировании в митохондриях).
Мутации в субъединицах комплекса НАДН в конечном итоге нарушают синтез АТФ и повышают выработку активных форм кислорода (АФК), в результате чего достаточно уязвимые ганглиозные клетки уйдут в апоптоз, «не справившись» с цитотоксическим воздействием АФК. Вероятно, эти клетки избирательно уязвимы к дисфункции митохондрий — возможно, из-за их своеобразной нейронной архитектуры (поскольку их аксоны остаются немиелинизированными, а значит, менее защищенными). Такая уязвимость может спровоцировать катастрофическую волну дегенерации этих клеток, которая и проявится клинически [28].
Существующая (но еще не одобренная к применению) генная терапия данной болезни направлена на восстановление функции митохондриального гена ND4, но ген при этом крайне трудно доставить: транслируемый белок должен достичь митохондриального матрикса, а для этого пересечь внешнюю и внутреннюю мембраны митохондрии. Решением этой проблемы стала экспрессия в ядрах клеток гена, несущего особую нацеливающую в митохондрии последовательность. Такая стратегия была успешно апробирована на клеточных моделях, а затем на грызунах, продемонстрировав у последних улучшение зрительной функции [29].
После этого настало время клинических исследований на людях, которые сначала также осуществлялись в рамках узких академических исследований, но затем перешли под контроль фармацевтических компаний. В последнем исследовании препарата Lenadogene nolparvovec компании GenSight участвовало более 60 пациентов, получивших интравитреальные инъекции лекарства. По итогу двухлетнего наблюдения у 73% из них наблюдалось клинически значимое улучшение остроты зрения с лишь небольшим побочным эффектом — внутриглазным воспалением, которое удавалось скорректировать.
В целом данные клинических испытаний генной терапии LHON выглядят многообещающе, позволяя предположить, что вскоре это заболевание можно будет лечить с помощью уже одобренного препарата [23].
Ахроматопсия (цветовая слепота) —
заболевание, поражающее все три типа фоторецепторов-колбочек и потому приводящее к потере различения цветов. Оно отличается от обычного дальтонизма, при котором зачастую цветовосприятие всего лишь снижено, так как поражается лишь один из трех типов колбочек (из-за мутации в одном из генов, кодирующих специфичный для данных клеток опсин).
Множественные генетические нарушения при ахроматопсии приводят к более серьезным последствиям — такие пациенты практически не различают цвета, видя мир словно в черно-белом кино. Начинается это заболевание довольно рано — уже в возрасте 6 месяцев. Проявляется оно прежде всего отсутствием цветового зрения, а за ним следуют такие симптомы как светобоязнь, непроизвольные маятниковые движения глаз (нистагм) и низкая острота зрения.
Но есть хорошие новости: большинство патологических изменений из-за мутаций при ахроматопсии развиваются медленно, оставляя достаточно времени для лечения, что дает некоторую надежду, ведь несколько генов-«виновников» уже идентифицировано. Чаще всего встречается мутация в CNGB3, кодирующем β3-субъединицу сигнального G-белка трансдуцина; чуть реже попадается мутация CNGA3, кодирующего ɑ3-субъединицу того же белка.
На данный момент несколько компаний запустили клинические исследования генной терапии у пациентов с мутациями в CNGB3 и CNGA3 путем доставки в фоторецепторы функциональных копий этих целевых генов векторами AAV. В частности, в 2015 году в Германии исследовательские группы Университетской клиники Тюбингена и Мюнхенского университета Людвига-Максимилиана начали клиническое исследование, в котором доставляли в глаз копии гена CNGA3 векторами AAV8. Их вводили девяти взрослым пациентам в разных дозах с исходным периодом наблюдения в течение 12 месяцев. По результатам не сообщалось о каких-либо нежелательных явлениях, за исключением двух пациентов, у которых развилась легкая иммунная реакция на препарат (ее скорректировали с помощью кортикостероидов).
Оценка этого исследования показала, что у пациентов улучшалась общая функция колбочек: это проявилось в некотором усилении остроты зрения и лучшем распознавании контрастов. Правда, статистически значимые функциональные результаты удалось получить лишь по нескольким второстепенным показателям (но не ключевым конечным точкам). При этом отмеченные в пролеченном глазу в первый год функциональные преимущества сохранялись на протяжении следующих наблюдений: через два и три года (но пока еще исследование продолжается) [30].
Главный пока полученный результат — расширение информации о наиболее подходящем дизайне и конечных точках аналогичных будущих испытаний. Такие исследования должны пролить свет на перспективы применения данной терапии в более молодом возрасте, ведь именно так в теории можно предотвратить развитие у маленьких пациентов связанной с нарушением работы колбочек дисфункции зрительной коры (амблиопии — как потенциально ограничивающего фактора в лечении взрослых пациентов) [23], [30].
Вдогонку к этому две компании — MeiraGTx и Applied Genetic Technologies Corp (AGTC) — запустили похожие клинические испытания фаз I/II для изучения своей терапии AAV как у детей, так и у взрослых с ахроматопсией и нарушениями в генах CNGB3 и CNGA3. AGTC исследовала два препарата генной терапии AAV2, нацеленных на гены CNGA3 (AGTC-402) и CNGB3 (AGTC-401). Однако основные результаты этих исследований касаются пока лишь безопасности, переносимости и токсичности (для высоких доз) вводимых векторов: доказательств статистически значимой эффективности, увы, пока мало. Хотя были отмечены и некоторые положительные тенденции — например, лечение AGTC-401 позволило улучшить у некоторых пациентов светочувствительность [23].
MeiraGTx: NCT03001310 и NCT03758404; AGTC — NCT02935517 и NCT02599922.
Таким образом, все эти испытания скорее наращивают «критическую массу» клинического опыта, на основе которой однажды будет разработано по-настоящему эффективное лечение. Нечто подобное можно сказать и о существующих клинических исследованиях терапии при болезни Штаргардта и Х-сцепленном ретиношизисе: полученные данные пока неоднозначны — говорить о создании эффективной генной терапии в ближайшее время не приходится. Однако продолжающиеся исследования могут подвести исследователей к потенциальным решениям существующих проблем, что может помочь разработать эффективные методы лечения этих заболеваний в будущем.
Генетическое лечение ненаследуемых заболеваний
Успехи генной терапии пока особенно скромны на фронте лечения приобретенных многофакторных заболеваний зрения (от которых страдают миллионы людей во всем мире) — таких как возрастная макулярная дегенерация (ВМД), глаукома и диабетическая ретинопатия. В отличие от редких моногенных заболеваний (парадоксальным образом), эти состояния имеют более сложную и зачастую малоизученную этиологию [31]. Учитывая крайне широкий спектр возможных мишеней и вариации патогенеза даже у двух отдельно взятых пациентов, не удивительно, что «чистую» генную терапию нацелить на такие заболевания пока невозможно. Поэтому здесь исследователям нужно попытаться нащупать некие «универсальные» решения, реализовав которые станет возможным обратить (или хотя бы приостановить) развитие болезни.
Это крайне непростая задача, и, вероятно, потому действия в этом направлении пока не привели к существенным прорывам (хотя некоторые подвижки имеются). В подобных исследованиях генная терапия зачастую используется для адресной доставки тех белковых веществ, синтез которых имеет потенциал многогранного воздействия на пораженные болезнью клетки.
Глаукома
В частности, на этапе доклиники пытались оценить эффективность нейропротективного лечения такой нейродегенеративной патологии, как глаукома — путем доставки и экспрессии генов различных факторов: транскрипции, нейротрофических, антиапоптотических и других. Существует также стратегия регенерации аксонов (прорегенеративный путь преодоления их нейронной дегенерации), которая включает доставку генов факторов транскрипции, а также генов некоторых ключевых компонентов хорошо известных молекулярных сигнальных путей (PI3K/Akt, Rho/ROCK, Jak/STAT).
Потенциал таких исследований немал, ведь несмотря на многообразие глаукомы (открытоугольная, закрытоугольная, глаукома нормального (низкого) давления), общий исход этих патологий сводится к гибели ганглиозных клеток. Следовательно, стратегии, способные «защитить» эти клетки, теоретически смогут проявить широкий лечебный спектр.
Однако одно дело лечить мышей (или других модельных животных) и совсем другое — людей. Подходы, показавшие эффективность на модельных животных, часто бесполезны для реальных пациентов из-за слишком больших физиологических отличий, а потому поиск успешной стратегии в лечении этого заболевания пока еще остается большой проблемой [32].
Влажная и сухая ВМД
Трудности в поиске эффективного лечения многофакторных приобретенных заболеваний зрения лишь подчеркивают сложность скрытых патогенетических механизмов. В связи с этим даже по-настоящему прорывное лечение может не дать желаемого эффекта в конкретном случае. Влажная ВМД (также называемая неоваскулярной, или экссудативной ВМД) ярко иллюстрирует этот тезис.
Хотя факторы роста эндотелия сосудов (VEGF) и являются признанной лекарственной мишенью в лечении влажной ВМД, а появление анти-VEGF-терапии когда-то произвело революцию в терапии данной формы этого заболевания, неудовлетворенная потребность лечения невосприимчивых к такой терапии пациентов остается весьма острой. Также это касается страдающих сухой (неэкссудативной, или атрофической) формой ВМД (которая шире всего распространена: >90% всех случаев).
Считается, что нарушение регуляции системы комплемента играет важную роль в патологии сухой ВМД, а поэтому доставка векторами AAV фактора комплемента I может помочь лечению. Осуществить такую стратегию стремилась компания Gyroscope Therapeutics (позже разработку выкупил Novartis), однако ничем хорошим эта затея на данный момент, к сожалению, не увенчалась: соотношение пользы/рисков признали «соответствующими критериям бесполезности» (оцените эвфемизм!), и исследование приостановили.
Параллельно компания RegenxBio пытается реализовать более традиционный подход для лечения влажной ВМД: RGX-314 разрабатывается как препарат на основе вектора AAV8 с геном, кодирующим фрагмент моноклонального антитела против VEGF. Это своего рода генетическая анти-VEGF терапия, преимуществом которой должно стать однократное и единовременное введение (так как регулярные инъекции серьезно снижают приверженность к лечению). По данным компании, препарат хорошо переносился, и после субретинального введения RGX-314 наблюдалось стабильное повышение остроты зрения.
Этот же препарат исследовался в лечении диабетической ретинопатии с применением супрахориоидальной инъекции в исследовании ALTITUDE.
Диабетическая ретинопатия (ДР) —
одна из основных причин потери зрения у населения трудоспособного возраста. Она поражает примерно каждого десятого больного сахарным диабетом [33], что приводит к значительному снижению зрения, вплоть до его потери и инвалидности [34]. Тяжесть ДР варьирует от легкой (непролиферативной) до более выраженной пролиферативной формы (ПДР). Потеря зрения при ПДР происходит из-за разрастания кровеносных сосудов на поверхности сетчатки и в стекловидном теле, что вызывает диабетический макулярный отек (ДМО), деформирующий ткани и ухудшающий зрение [34].
По данным пресс-релиза ALTITUDE, более чем у 50% пациентов, получивших RGX-314, наблюдается клинически значимое снижение тяжести заболевания, однако исследование еще не окончено, а потому стоит подождать окончательных результатов.
Оптогенетическая терапия
Оптогенетика — метод, использующий свет для активации нужных исследователям процессов в клетках. Клетки можно так генетически модифицировать, чтобы они обрели чувствительность к свету, даже если исходно и следов ее у них не было. Можно оптогенетику приспособить и для лечения заболеваний зрения — например, трансдуцировать ганглиозные клетки вектором, кодирующим светочувствительный белок — каналородопсин. Даже если собственные клетки-фоторецепторы пациентов уже не работают, такой трансген можно поместить в ганглиозные клетки, которые подхватят (как умеют) функцию колбочек и палочек. Подробнее об этом можно прочесть в статье «Оптогенетика + голография = прозрение?» [35].
GS030 от GenSight: первая ласточка?
Интересный пример использования оптогенетики в лечении заболеваний зрения — препарат GS030 от GenSight для лечения пигментного ретинита. Это лекарство посредством вводимого интравитреально вектора AAV2 доставляет в ганглиозные клетки ген каналородопсина [36], известный также как ChrimsonR-tdT. Под действием желтого света ChrimsonR активируется сам и активирует ганглиозные клетки, передающие в мозг визуальную информацию. Чтобы все это надежно работало, помимо самой генной терапии пациенты получают также специальные очки, сужающие весь световой спектр до желтой гаммы (примерно 590 нм).
Предварительные результаты клинических исследований фаз I/II этого препарата показали хорошую переносимость и некоторое улучшение зрения, но для достоверной оценки эффективности GS030 явно потребуются дальнейшие исследования (это можно отнести и к другим лекарствам, созданным на основе этой технологии — например, MCO-010, BS01). Если в будущем такие испытания будут проведены и дадут положительные результаты, это может проложить путь к появлению в клинике препаратов, основанных на оптогенетической технологии.
Заключение и перспективы
Генная терапия уже демонстрирует впечатляющий терапевтический потенциал в лечении глазных болезней, но для его реализации, несомненно, потребуется провести еще множество исследований. Пока нерешенными остаются проблемы обеспечения достаточной безопасности и эффективности, выбора подходящих (и технологического усовершенствования существующих) путей введения векторов в глаз, а также трудностей подбора терапевтических мишеней для лечения распространенных многофакторных заболеваний зрения (в патогенезе своем не имеющих моногенетической «основы»)
В то же время ежегодно ученые открывают все новые мутации, вызывающие такие заболевания, и на основе этого активно разрабатываются новейшие подходы генной коррекции широкого спектра неизлечимых пока что глазных болезней. Все это внушает надежду, что вскоре на горизонте появятся терапии, способные вылечить и их.
Хочется верить, что по мере развития научного прогресса подобное лечение будет становиться более доступным и эффективным.
Литература
- «Спутник V» и не только: сказ об аденовирусных вакцинах;
- Selina Drag, Farokh Dotiwala, Arun K. Upadhyay. (2023). Gene Therapy for Retinal Degenerative Diseases: Progress, Challenges, and Future Directions. Invest. Ophthalmol. Vis. Sci.. 64, 39;
- Генная терапия: познакомьтесь с лекарствами будущего;
- Зрительный родопсин — рецептор, реагирующий на свет;
- Иммунитет: борьба с чужими и… своими;
- Wei Chiu, Ting-Yi Lin, Yun-Chia Chang, Henkie Isahwan-Ahmad Mulyadi Lai, Shen-Che Lin, et. al.. (2021). An Update on Gene Therapy for Inherited Retinal Dystrophy: Experience in Leber Congenital Amaurosis Clinical Trials. IJMS. 22, 4534;
- Три поколения лекарств;
- Raja Narayanan, Deven Dhurandhar, NirojKumar Sahoo, Indumathi Mariappan. (2021). Gene therapy in retinal diseases: A review. Indian J Ophthalmol. 69, 2257;
- Время первых: как аденоассоциированные вирусы стали лучшими в доставке генов in vivo;
- Лентивирусные векторы: как они стали лучшими векторами для терапии ex vivo;
- Bellingrath J.-S.E. Optimising Gene Therapy for X-linked Retinitis Pigmentosa: Inaugural-Dissertation zur Erlangung des Doktorgrades der Medizin. — Tübingen, 2019. — 142 p.;
- Viral Kansara, Leroy Muya, Chen-rei Wan, Thomas A. Ciulla. (2020). Suprachoroidal Delivery of Viral and Nonviral Gene Therapy for Retinal Diseases. Journal of Ocular Pharmacology and Therapeutics. 36, 384-392;
- K. Xue, T. L. Edwards, H. C. M. Meenink, M. J. Beelen, G. J. L. Naus, et. al.. (2019). Robot-Assisted Retinal Surgery: Overcoming Human Limitations. Surgical Retina. 109-114;
- Reza Ladha, Laure E. Caspers, François Willermain, Marc D. de Smet. (2022). Subretinal Therapy: Technological Solutions to Surgical and Immunological Challenges. Front. Med.. 9;
- Cristina Irigoyen, Asier Amenabar Alonso, Jorge Sanchez-Molina, María Rodríguez-Hidalgo, Araceli Lara-López, Javier Ruiz-Ederra. (2022). Subretinal Injection Techniques for Retinal Disease: A Review. JCM. 11, 4717;
- Kasetty V.M., Qin L.G., Espinosa-Heidmann D., Marcus D.M. (2022). Flow Mechanics of Suprachoroidal Injection. Retinal Physician. 19, 19–23;
- Boyer D. (2023). David Boyer, MD, on Potential Advantages of Suprachoroidal Gene Therapy for Neovascular AMD. CGTlive;
- Генная терапия нейромоторных болезней;
- Как болезни крови генной терапией лечили;
- Oscar Francisco Chacon-Camacho. (2015). Review and update on the molecular basis of Leber congenital amaurosis. WJCC. 3, 112;
- Barnett J. and Landa G. (2018). A New Gene Therapy For Early-onset RP. Review of Ophthalmology;
- Scott Johnson, Marric Buessing, Thomas O’Connell, Sarah Pitluck, Thomas A. Ciulla. (2019). Cost-effectiveness of Voretigene Neparvovec-rzyl vs Standard Care for RPE65-Mediated Inherited Retinal Disease. JAMA Ophthalmol. 137, 1115;
- Shun-Yun Cheng, Claudio Punzo. (2022). Update on Viral Gene Therapy Clinical Trials for Retinal Diseases. Human Gene Therapy. 33, 865-878;
- Jimenez-Davila H.J., Procopio R.A., Klufas M.A. (2022). A Review of Retinitis Pigmentosa. Review of Ophthalmology;
- Greig L.C. and Ameri H. (2023). The Latest in Gene Therapy Clinical Trials for IRD. Retina Today;
- Robert E MacLaren, Markus Groppe, Alun R Barnard, Charles L Cottriall, Tanya Tolmachova, et. al.. (2014). Retinal gene therapy in patients with choroideremia: initial findings from a phase 1/2 clinical trial. The Lancet. 383, 1129-1137;
- John J. Chen, M. Tariq Bhatti. (2021). Gene Therapy for Leber Hereditary Optic Neuropathy: Is Vision Truly RESCUED?. Ophthalmology. 128, 661-662;
- José-Alain Sahel, Nancy J. Newman, Patrick Yu-Wai-Man, Catherine Vignal-Clermont, Valerio Carelli, et. al.. (2021). Gene Therapies for the Treatment of Leber Hereditary Optic Neuropathy. International Ophthalmology Clinics. 61, 195-208;
- Patrick Yu-Wai-Man, Nancy J. Newman, Valerio Carelli, Mark L. Moster, Valerie Biousse, et. al.. (2020). Bilateral visual improvement with unilateral gene therapy injection for Leber hereditary optic neuropathy. Sci. Transl. Med.. 12;
- Felix Friedrich Reichel, Stylianos Michalakis, Barbara Wilhelm, Ditta Zobor, Regine Muehlfriedel, et. al.. (2022). Three-year results of phase I retinal gene therapy trial for CNGA3-mutated achromatopsia: results of a non randomised controlled trial. Br J Ophthalmol. 106, 1567-1572;
- Anne Louise Askou, Thomas Stax Jakobsen, Thomas J. Corydon. (2021). Retinal gene therapy: an eye-opener of the 21st century. Gene Ther. 28, 209-216;
- Mariana Santana Dias, Victor Guedes de Araujo, Rafael Lani-Louzada, Rafael Linden, Vinicius Toledo Ribas, Hilda Petrs-Silva. (2023). Perspective on Gene Therapy for Glaucoma. Glaucoma - Recent Advances and New Perspectives;
- Мартусевич Я.А., Кобякова О.С., Люцко В.В. (2023). Диабетическая ретинопатия и ее социальная значимость (обзор литературы). «Современные проблемы здравоохранения и медицинской статистики». 3, 877–902;
- ABBV-RGX-314 is being developed as a potential one-time treatment for wet AMD, diabetic retinopathy and other additional chronic retinal conditions treated with anti-VEGF. REGENXBIO;
- Оптогенетика + голография = прозрение?;
- Martel J., Esposti S.D., Boulanger-Scemama E., Galluppi F., Vernadal E., Gray D. et al. (2020). Optogenetics in the Clinic: PIONEER, a Phase 1/2a Gene Therapy Program for Non-Syndromic Retinitis Pigmentosa. Invest. Ophthalmol. Vis. Sci. 61(7), 4491;
- Xin Fu, Viet Anh Nguyen Huu, Yaou Duan, Daniel S Kermany, Carolina C S Valentim, et. al.. (2018). Clinical applications of retinal gene therapies. Precision Clinical Medicine. 1, 5-20;
- Annamaria Tisi, Marco Feligioni, Maurizio Passacantando, Marco Ciancaglini, Rita Maccarone. (2021). The Impact of Oxidative Stress on Blood-Retinal Barrier Physiology in Age-Related Macular Degeneration. Cells. 10, 64;
- Chen-rei Wan, Leroy Muya, Viral Kansara, Thomas A. Ciulla. (2021). Suprachoroidal Delivery of Small Molecules, Nanoparticles, Gene and Cell Therapies for Ocular Diseases. Pharmaceutics. 13, 288;
- Kotterman M., Beliakoff G., Croze R., Vazin T., Schmitt C., Szymanski P. et al. (2021). Directed Evolution of AAV Targeting Primate Retina by Intravitreal Injection Identifies R100, a Variant Demonstrating Robust Gene Delivery and Therapeutic Efficacy in Non-Human Primates. bioRxiv.