Tecelra: явный прорыв в лечении синовиальной саркомы?
06 сентября 2024
Tecelra: явный прорыв в лечении синовиальной саркомы?
- 1058
- 0
- 6
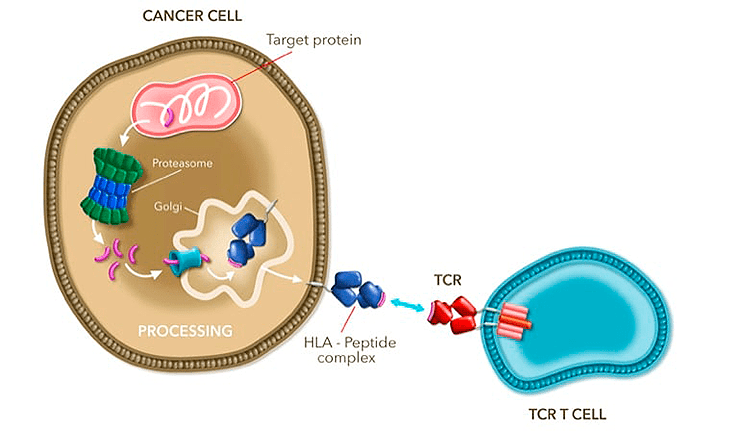
Генетически измененные TCR в терапии Tecelra узнают опухолевые антигены на поверхности клетки в составе главного комплекса гистосовместимости. Почти каждая клетка организма умеет нарезать собственные белки с помощью специального «измельчителя» — протеасомы, а затем и выставлять их пептидные фрагменты наружу. Такая презентация нужна, чтобы иммунные Т-клетки смогли обнаружить, а затем уничтожить клетки-носители чужеродных антигенов (инфицированные микроорганизмами или измененные опухолевым перерождением). Данный природный механизм как раз и используется в качестве инструмента нацеливания на раковых «недругов» в новой клеточной терапии от Adaptimmune (а его специфичность здесь лишь совсем немного улучшена генной модификацией).
-
Автор
-
Редакторы
Темы
Август 2024-го ознаменовался ускоренным одобрением FDA препарата Tecelra (от Adaptimmune), ставшего на рынке инновацией сразу по трем направлениям. Во-первых, это первая генно-инженерная клеточная терапия, направленная на уничтожение со́лидной опухоли; во-вторых — первое новое лечение по данному показанию (неоперабельная/метастатическая синовиальная саркома) более чем за десятилетие; наконец, в-третьих — это совсем новый тип терапии (ранее исследовавшийся лишь в клинических испытаниях). Очевидно, что американский регулятор подарил этому препарату путевку в жизнь совсем не случайно, но насколько он на самом деле прорывной и эффективный? Разбираемся в нашей статье.
Генная и клеточная терапии
Третий сезон спецпроекта о генной и клеточной терапиях рассказывает о конкретных применениях этих новейших методов для лечения нейромоторных, онкологических, офтальмологических и других заболеваний.
В предыдущей статье мы уже писали [1] о текущих (и на тот момент весьма успешных) результатах клинических испытаний рассматриваемой здесь клеточной терапии Adaptimmune и о том, что компания планирует добиваться её одобрения регулятором FDA в 2024 году... и вот это, наконец, произошло! Препарат получил, правда, пока только ускоренное одобрение (подробности и нюансы — далее). Для более же полного погружения в тему генной терапии (не только в лечении рака!) рекомендуем прочитать как предыдущую [1], так и другие статьи нашего одноименного цикла: там много всего любопытного.
Узкие показания, но острая проблема
Синовиальная саркома — очень редкая форма рака, когда злокачественные клетки образуют опухоль в мягких тканях тела. Чаще всего ей поражаются суставы конечностей (до 40% случаев); и хотя и реже, но данная патология обнаруживалась также и в большинстве основных органов и тканей человека (включая мозг, простату и сердце [2]). Ежегодно это заболевание диагностируется только лишь у 1–3 человек из миллиона и, по-видимому, чаще поражает сильный пол: из пациентов с таким диагнозом на 12 мужчин приходится примерно 10 женщин.
Встречается синовиальная саркома у взрослых с частотой приблизительно 1% от всех злокачественных новообразований; у детей, впрочем, этот показатель уже выше: 4–8% раковых опухолей, [3].
Краеугольным камнем терапии синовиальной саркомы сегодня является радикальное хирургическое удаление всей опухоли вместе с окружающими её здоровыми тканями , что в случаях обширных поражений нередко оборачивается вынужденной ампутацией и экзартикуляцией (отсечением конечности на уровне сустава).
Дело в том, что при хирургическом вмешательстве (а это первая линия терапии данного заболевания) захват и удаление здоровых тканей вокруг новообразования должен осуществляться на протяжении как минимум 2–4 см (чтобы повысить вероятность полного удаления раковых клеток и уменьшить риск рецидива).
Комплексное лечение этой болезни может включать как лучевую, так и химиотерапию, что нацелено на улучшение безрецидивной выживаемости после удаления опухоли. При неоперабельных новообразованиях эти процедуры также могут помочь, но их эффективность здесь невелика, и прогноз лечения уже совсем неблагоприятный.
Надежда на новый прорыв?
При известном сегодня пятилетнем уровне выживаемости пациентов с синовиальной саркомой в 36% (а у кого первично диагностированы метастазы — уже всего лишь в 20%), необходимость улучшать терапию напрашивалась уже давно. Ну а поскольку треть пациентов получают такой крайне неприятный диагноз в возрасте до 30 лет, эффект от нового действенного лечения может быть очень велик .
Дело в том, что согласно современным данным выживаемость при синовиальной саркоме непосредственно коррелирует с возрастом: она намного выше, если пациент моложе 25 лет; при этом уже после 50 лет заболевание практически не встречается.
Очевидно, что именно для этих случаев поиск по-настоящему действенного лечения более чем актуален, поэтому появление на рынке нового работающего препарата представляется как минимум весьма обнадеживающим. Вот почему умы исследователей обратились в поисках лучшего лечения к генно-клеточной терапии, с которой уже долгое время связывают надежды на полную победу над раком.
Как работают современные генно-клеточные терапии и в чем новшество Tecelra?
Надежды на излечение рака генетически модифицированными клетками пока что оправдались лишь для онкогематологических заболеваний (и то далеко не всех — подробнее об этом здесь [4]), но зато как!..
Еще в 2010-х терапия CAR-T показала настолько ошеломительные возможности обращения вспять гематологических новообразований (в прежде безнадежных случаях), что это практически мгновенно привлекло к ней внимание академического сообщества и крупных игроков фармрынка, дав почву для её бурного роста и развития в последующие годы. Всё это привело к тому, что в череде передовых терапевтических методик она сегодня одна из наиболее разрабатываемых (рис. 1) [5].
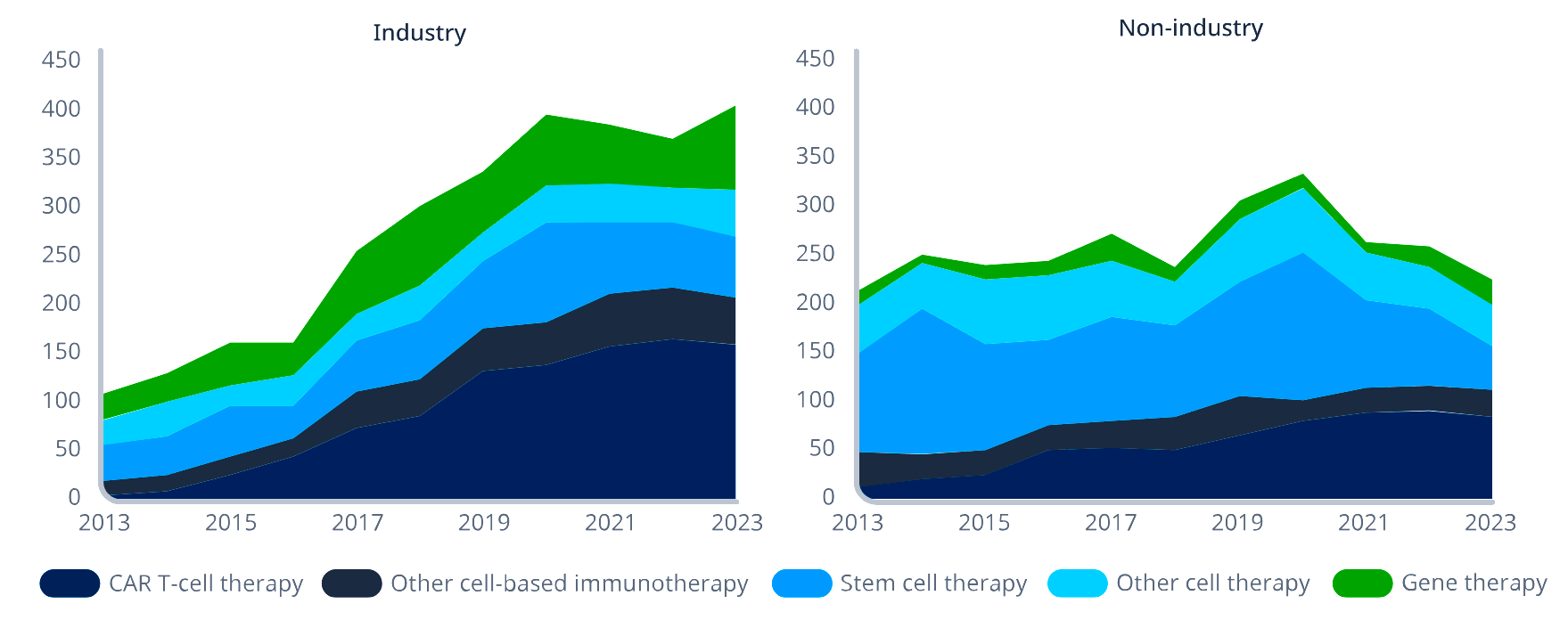
Рисунок 1. Число клинических исследований генных и клеточных терапий за период 2013–2023 гг. в фармкомпаниях (слева; industry) и в академических / исследовательских институтах (справа; non-industry). Ясно видно, что в фарминдустрии клеточные CAR-T терапии преобладают над прочими, тогда как в научно-исследовательском сегменте «не всё так однозначно». Скорее всего, технология CAR-T представляется фармгигантам более перспективной.
Суть данного лечения вот какая: из организма выделяют иммунные клетки; генетически их модифицируют; затем размножают «в неволе» (в лабораторных условиях); и вводят обратно пациенту, где они и начинают борьбу с опухолевыми клетками (это так называемая ex vivo терапия). Главное здесь — генная модификация, в ходе которой в лимфоцит вводят ген химерного антигенного рецептора (CAR), экспонирующегося затем на его поверхности (рис. 2) [4]. Такой рецептор способен распознавать свойственные новообразованиям антигены, «нацеливая» лимфоциты на опухолевые клетки и помогая уничтожать их, тем самым направляя организм на путь выздоровления .
Об этом подходе, технологических особенностях его реализации, также одобренных на его основе лекарствах «Биомолекула» уже неоднократно писала: см. «Клеточная терапия CAR-T»: «Можно ли вылечить рак генной терапией?» [1], «Как первые российские CAR-T-клетки с опухолью боролись» [6] и т.д.
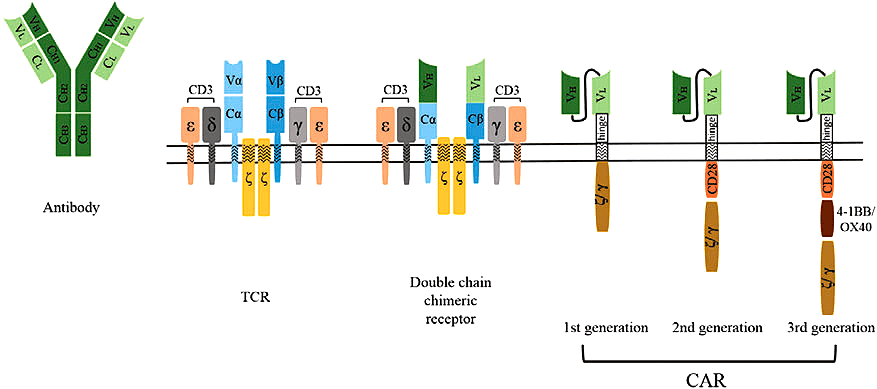
Рисунок 2. Эволюция CAR: мы можем видеть, как со временем они существенно менялись. Если у самых первых чисто экспериментальных рецепторов (double chain chimeric receptor) модификация фрагментами антител затрагивала только часть внеклеточного домена (в остальном же это были точно такие же TCR, какие имеются и у опухоль-инфильтрирующих лимфоцитов (TILs)), то в дальнейшем их реконструкция стала настолько радикальной, что от нативных TCR уже практически ничего не осталось... В частности, у всех последующих поколений CAR наружная часть рецептора представлена антительным scFv-фрагментом, что и придает им соответствующую специфичность. Дополнительно разницу TCR и CAR-T можно поизучать на рисунке 1 из статьи «Клетки, которые лечат людей» [4].
Впрочем, иммунные клетки пробовали использовать против рака и без генных манипуляций (в академических исследованиях еще в 1970–1980-е гг.), когда выделенные прямо из опухолевого очага опухоль-инфильтрирующие лимфоциты (tumor-infiltrating lymphocytes, TILs) точно так же размножали ex vivo, а затем внедряли пациенту, что в некоторых случаях помогало обратить вспять метастатическую меланому [1], [5], [7].
Такой подход (TIL-терапию) исследовать в клинике не прекращали, апофеозом чего стала коммерциализация данной технологии в недавнем одобрении (февраль 2024 г.) препарата Amtagvi (Iovance Biotherapeutics). Он также нацелен на лечение запущенной меланомы (при которой другие методы уже не сработали) и стал первой одобренной клеточной терапией, направленной на уничтожение со́лидной опухоли.
Чем от всего перечисленного отличается Tecelra?
Рациональный дизайн и базовые свойства технологии Tecelra в чем-то схожи с TILs и CAR-T терапиями, но есть и принципиальные различия. Как и обе они, Tecelra — подход ex vivo, осуществляемый по вышеописанному алгоритму: извлечение клеток пациента; размножение их в лаборатории; инфузия ему же обратно. Как и в случае с CAR-T, тут отбирают и генетически модифицируют Т-лимфоциты, причем «редизайну» подвергается всё тот же эндогенный (т.е. природный) TCR , но только вот масштабы «тюнинга» здесь гораздо скромнее...
Он исходно присутствует на поверхности TILs (на то он и природный!), естественным образом помогая им распознавать опухолевые антигены, что как раз и является основой их терапевтической эффективности [8].
Дело в том, что даже для первого поколения CAR модификации, которым подвергся исходный TCR, были настолько радикальными, что впору тут уже говорить о дизайне de novo (рис. 2). В то же время у Tecelra базовая структура TCR принципиально не отличается от природного аналога; основное отличие — модификация антигенсвязывающего участка для увеличения аффинности к опухолевым пептидам, связанным с MHC (рис. 3).
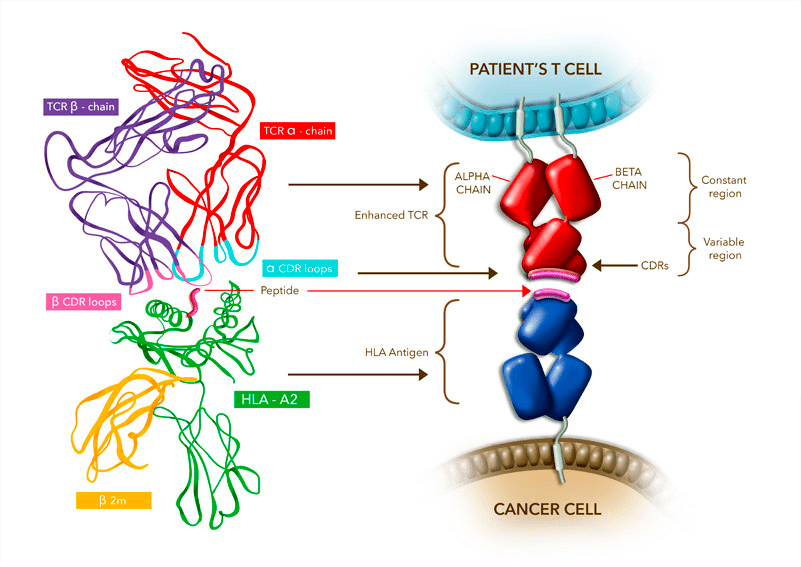
Рисунок 3. Механизм действия: связывание TCR (модифицированного в области антигенсвязывающего участка) с опухолевым пептидом, презентируемым комплексом гистосовместимости (HLA/MHC I) на поверхности раковой клетки. Этот комплекс играет роль «молекулярного паспорта», демонстрируя иммунному надзору короткие пептиды, получаемые внутри клетки нарезанием целых белков (см. заглавную картинку). Цель этой операции в том, что если организм поразит нечто чужеродное, иммунный надзор сможет вычислить и уничтожить вражеские элементы по молекулярной структуре таких пептидов (фрагментов вирусов, бактерий, специфичных для опухолевого перерождения белков и др.). Однако опухолевые клетки очень схожи с обычными и далеко не всегда так уж отличаются от нормальных белками своей поверхности.
Решить эту проблему призвана терапия Adaptimmune, ведь компания модифицирует рецептор Т-клеток таким образом, чтобы его «блок наведения» (complementarity-defining regions, CDRs) как можно лучше распознавал пептиды из опухоли в контексте MHC (ведь это и есть главный путь борьбы с новообразованием). Для Tecelra такие пептиды — это фрагменты белка MAGE-A4, характерного для многих опухолей, но в особенности — для синовиальной саркомы.
Эти пептиды компания Adaptimmune тщательно отбирает на основе специфического синтеза антигенов именно в опухоли, а не в нормальной ткани, что включает ряд этапов:
- Анализ презентации антигенных пептидов в опухолевых клетках.
- Скрининг их отсутствия в здоровой ткани (для минимизации риска перекрестной реактивности).
- Валидацию (т.е. подтверждение) презентации данных пептидов на поверхности опухолевых клеток.
После отбора опухолевых пептидов (в данном случае это фрагменты внутриклеточного белка MAGE-A4 , но технологию можно применить и к другим белкам), TCR в клетках так генномодифицируют, чтобы его три участка CDRs (см. рис. 3) максимально эффективно распознавали именно эти пептиды.
Меланома-ассоциированные антигены 4 типа, синтезируемые в опухолях примерно у 80% пациентов с синовиальной саркомой (что и сделало их чрезвычайно привлекательной мишенью для лечения этого заболевания).
Насколько всё это оказалось эффективным, или почему FDA одобрили Tecelra?
Итак, в отличие от CAR-T технологии, эксплуатирующей для поиска опухолевых «недругов» антительную специфичность (позволяющую распознавать целые белки на поверхности клетки), Tecelra в качестве «орудия наводки» использует природную способность TCR узнавать пептидные фрагменты опухолевых антигенов (лишь совсем немного её улучшая)... и, судя по успешности клинических испытаний, Т-лимфоциты в Tecelra действительно чувствительны к таким пептидам и могут узнавать клетки опухолей синовиальной саркомы, борясь тем самым с раком у этих пациентов.
Судите сами: одобрение Tecelra было основано на результатах исследования SPEARHEAD-1, в котором приняли участие 44 пациента с синовиальной саркомой. Основным результатом в этом испытании стала общая частота ответов участников на терапию в 43%, из которых полного ответа достигли 4,5%. Медианная же длительность ответов на лечение составила 6 месяцев, при этом у 39% пациентов продолжительность ответа составила 12 месяцев (или дольше). Учитывая, что сегодня при метастатической синовиальной саркоме шансов излечиться практически нет, такая эффективность выглядит как минимум многообещающей.
Выводы и прогнозы
И всё-таки пока что текущие результаты Tecelra можно считать лишь промежуточным успехом: эта терапия еще не доказала, что сможет продлевать жизнь и именно потому получила статус лишь ускоренного одобрения. Чтобы сохранить возможность присутствия на рынке в будущем, это лечение еще должно будет подтвердить обсуждаемые здесь преимущества, но уже по данным общей выживаемости.
Компания Adaptimmune рассчитывает получить такие данные уже в следующем году (надеясь на позитивный исход): их разведочный анализ показал, что вероятность двухлетней выживаемости пациентов, которые отреагировали на лечение, составляет около 70% [10].
Что же дальше для Adaptimmune?
Препарат Tecelra имеет, как мы уже выяснили, крайне узкие показания (для такой большой страны как США это всего лишь около 400 пациентов в год) , при том, что продаваться он будет по цене 727 000 долларов, — а это самая высокая стоимость одной дозы в Штатах среди всех клеточных лекарств от рака [10].
Как мы помним, синовиальная саркома — очень редкий рак, но особенность терапии сужает применимость еще больше: ведь для неё пригодны лишь некоторые пациенты с определенным гаплотипом: HLA-A*02, а также должно быть подтверждение, что опухоль действительно синтезирует антиген MAGE-A4 (что, к сожалению, происходит не всегда). В целом, такая специфичность имеет как плюсы, так и минусы: в отличие от CAR-T здесь можно нацеливаться не только на поверхностные, но и на внутриклеточные белки, что безусловно открывает новые возможности. Минусы же с плюсами взаимосвязаны: клетки синовиальной саркомы хотя в большинстве случаев и имеют MAGE-A4, но не всегда, а здесь у пациентов должен быть еще и гаплотип HLA-A*02, который встречается только в популяции белых европейского происхождения... Получается, такая терапия будет работать главным образом для «белого человека», да и то не всегда.
Некоторыми аналитиками пиковые годовые рыночные прогнозы выручки препарата сейчас оцениваются в 174 миллионов долларов [10]; сама же компания ожидает, что первые коммерческие продажи будут еще более скромными, рассматривая Tecelra как первый шаг в развитии более крупного бизнеса в будущем (в области лечения рака мягких тканей). Дело в том, что Adaptimmune планируют расширять свою линию терапий TCR T-клетками на новые показания и группы пациентов. Второе их лечение — Lete-cel (оно похоже на Tecelra, но нацелено на другой антиген — NY-ESO-1) — сейчас оценивается у пациентов с синовиальной саркомой и миксоидной/круглоклеточной липосаркомой в исследовании фазы II, и уже в следующем году может быть представлено для одобрения регулирующим органам.
Однако следует тут отметить, что хотя нацеливание TCR на NY-ESO-1 недавно стало одним из самых многообещающих направлений (многие исследования показывают, что оно может вызывать регрессию опухоли у пациентов), оно всё еще далеко от прорыва. Ведь противораковый эффект здесь, как правило, временный, и у большинства пациентов болезнь быстро возвращается и прогрессирует в течение всего лишь нескольких месяцев после начала лечения (а всё оттого, что по мере опухолевой прогрессии раковые клетки постепенно теряют способность синтезировать целевой антиген) [11]. Нельзя также исключать, что аналогичные (или какие-либо иные) механизмы резистентности могут быть характерны и для других TCR-терапий, что, очевидно, является причиной многочисленных неудач в испытаниях этих препаратов.
Тем не менее компания ожидает, что две её терапии совокупно смогут приносить около 400 миллионов долларов пиковых годовых продаж в США (и подняться выше, если будут одобрены в других регионах и для более ранних линий лечения).
Заключение
На данном этапе пока сложно однозначно судить о долгоиграющей эффективности Tecelra, но очевидно, что её одобрение уже само по себе стало важным прецедентом: ведь это первая генно-инженерная клеточная терапия, направленная против со́лидной опухоли (и имеющая притом определенную эффективность); да и по прежде безнадежным показаниям (запущенная синовиальная саркома) наконец-то появилось лечение, способное, по всей видимости, продлевать жизнь пациентов (пусть, даже если и окажется в итоге, что это только совсем ненадолго)...
Литература
- Можно ли вылечить рак генной терапией?;
- Devleena, Bansal V., Chaudhuri T., Roy S. (2014). Primary synovial sarcoma of lung. Lung India: official organ of Indian Chest Society. 31, 277–279;
- Хестанов Д.Б., Сенжапова Э.Р., Романцова О.М., Кочиева В.В., Дзампаев А.З., Алиев М.Д. (2016). Лечение синовиальной саркомы у пациентов детского возраста. «Саркомы костей, мягких тканей и опухоли кожи». 3, 60–66;
- Клетки, которые лечат людей;
- Три поколения лекарств;
- Как первые российские CAR-T-клетки с опухолью боролись;
- Таргетная терапия — прицельный удар по болезни;
- Устюгова Е.А., Савкина М.В., Горяев А.А., Бондарев В.П., Меркулов В.А., Мельникова Е.В. (2019). Применение биомедицинских клеточных продуктов для лечения онкологических заболеваний. «БИОпрепараты. Профилактика, диагностика, лечение». 19, 206–214;
- Биспецифические антитела, их мишени и перспективы применения в современной медицине;
- Fidler B. (2024). First-of-its-kind cell therapy approved by FDA for rare soft tissue cancer. BiopharmaDive;
- Luke Frankiw, Arun Singh, Cole Peters, Begoña Comin-Anduix, Beata Berent-Maoz, et. al.. (2023). Immunotherapy resistance driven by loss of NY-ESO-1 expression in response to transgenic adoptive cellular therapy with PD-1 blockade. J Immunother Cancer. 11, e006930;
- Zelig Eshhar. (2014). From the Mouse Cage to Human Therapy: A Personal Perspective of the Emergence of T-bodies/Chimeric Antigen Receptor T Cells. Human Gene Therapy. 25, 773-778.