Можно ли вылечить рак генной терапией?
12 апреля 2024
Можно ли вылечить рак генной терапией?
- 2970
- 0
- 16
Рак не только умеет активно распространяться в человеческом организме, но и ужасающим маршем шагает по всей планете. В своем отчете за 2022 год ВОЗ назвала его одной из основных причин смертности: по оценкам, каждый пятый заболевает раком, а каждый восьмой мужчина и каждая одиннадцатая женщина умирает от него. Надежду на появление более эффективного лечения связывают с новейшими генными и клеточными терапиями.
Рисунок в оригинальном разрешении.
-
Авторы
-
Редакторы
-
Иллюстратор
Термин «рак» обозначает группу болезней, вызванных аномально перерождающимися клетками, способными также распространяться по организму. Казалось бы: «понял проблему, так реши ее»! Но правда в том, что этиология рака невероятно сложна (притом до конца не изучена), а лечить его до сих пор непросто. В раковый патогенез часто вовлечены самые разные мутации, а потому логично использовать против него генную терапию, уже помогающую от ряда неизлечимых ранее болезней. Однако каждая опухоль индивидуальна (гены в опухолевых клетках могут иметь тысячи различных нарушений), и потому подобрать по-настоящему эффективное лечение получается далеко не всегда. В этой статье спецпроекта о генных и клеточных терапиях мы рассмотрим подводные камни применения генной терапии при раке, обсудим текущее состояние дел и поразмышляем о перспективах.
Генная и клеточная терапии

Третий сезон спецпроекта о генной и клеточной терапиях рассказывает о конкретных применениях этих новейших методов для лечения нейромоторных, онкологических, офтальмологических и других заболеваний.
Партнер спецпроекта — Департамент разработки генотерапевтических препаратов одной из крупнейших российских биотехнологических компаний — BIOCAD. BIOCAD заслужил серьезные позиции на мировом фармацевтическом рынке благодаря выпуску лекарственных препаратов на основе антител.
Злокачественные опухоли: разнообразие и распространенность
Американское онкологическое общество пишет так:
Это довольно простое и интуитивно понятное (в каком-то смысле даже обывательское) определение, а потому в дальнейшем, говоря «рак», мы будем подразумевать именно его . В соответствии с этим выделяют пять основных типов рака, основанных на гистологических характеристиках ─ то есть типах тканей, из которых они происходят: карциномы; саркомы; миеломы; лейкемии; лимфомы (но в целом типов раков, конечно, много больше ─ существуют еще и смешанные типы).
Уточним: в России, а также в некоторых других странах (Германия, страны Балтии) термином «рак» (в строго медицинском смысле) принято обозначать более узкий круг объектов — злокачественные опухоли только эпителиального происхождения (карциномы).
По оценкам Международного агентства по исследованию рака (IARC), в мире существует 36 типов рака [7].
Уже из этого становится ясно, что рак невероятно сложен и многообразен: имея в своем патогенезе множество генетических и эпигенетических мутаций (в том числе клинически значимых), он является одной из основных причин смертности (особенно среди взрослых, причем количество заболевших растет: рис. 1). На это есть свои причины, и больше того: несмотря на усилия по созданию эффективных лекарств, не исключено, что число онкобольных продолжит повышаться.
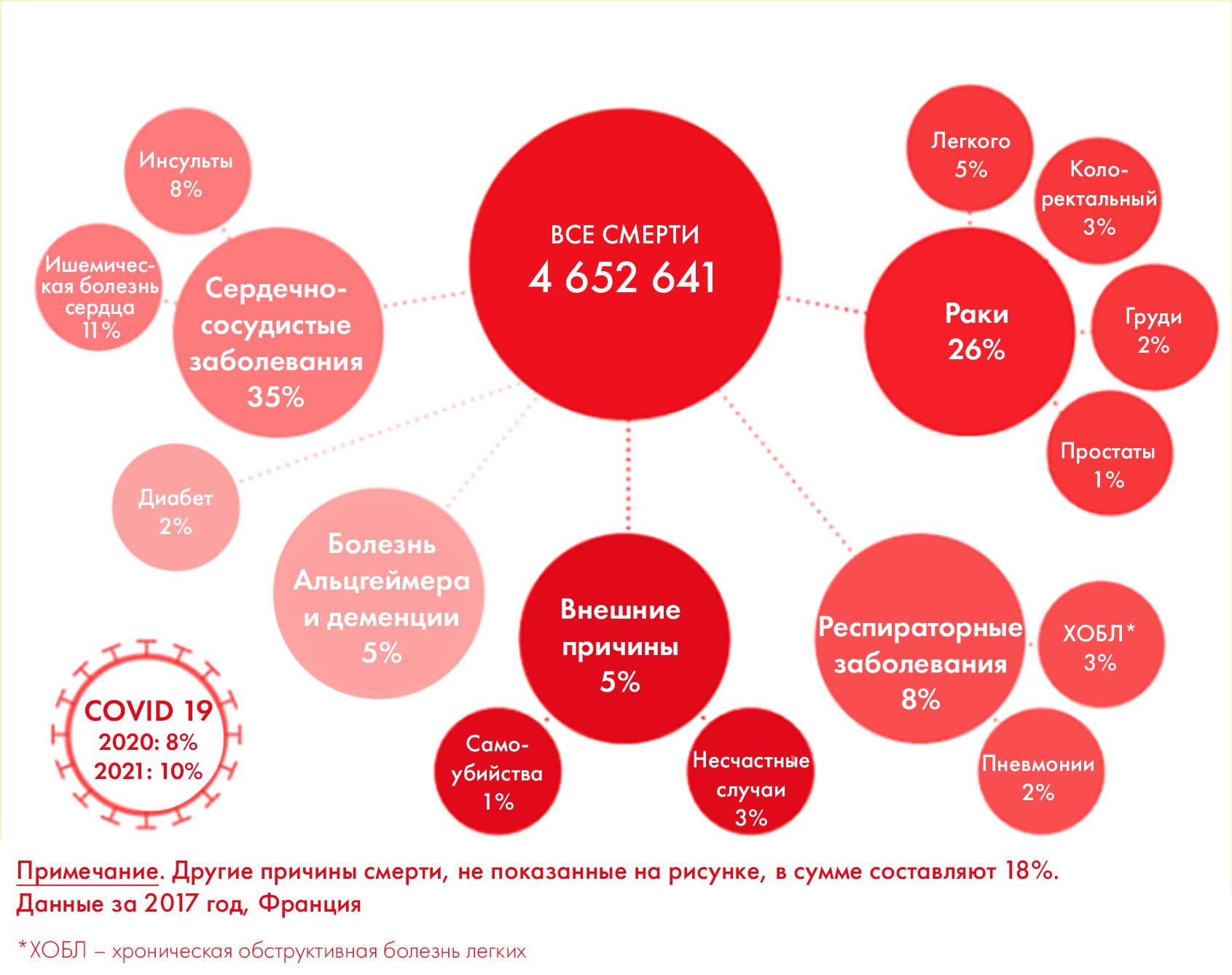
Рисунок 1. Структура смертности в европейских странах.
Этот грустный прогноз исходит из того, что население планеты непрерывно растет и одновременно стареет, а долгая жизнь «вознаграждает» весьма специфическими заболеваниями, что связано с механизмами клеточного старения. Ведь хорошо известно: из-за ошибок при делениях клетки накапливают мутации , а это медленно, но верно подводит к возрастной дегенерации (собственно старости и всему, что с ней связано). Другими словами: старея, люди с неизбежностью накапливают много генетически дефектных клеток, и возникает так называемая геномная нестабильность. Ну а такая нестабильность ─ центральный фактор канцерогенеза, то есть прямой путь к развитию рака.
Здесь, конечно, виновны не только ошибки деления: гены могут повреждаться разными мутагенами: свободными радикалами, вирусами, радиацией, химическими веществами и пр.; причем с возрастом количество таких повреждений также будет возрастать (по очевидным причинам) [8], [9]. Кроме того, есть и наследуемые мутации, существенно повышающие вероятность возникновения рака (см., например: «Рак молочной железы с семейной историей» [10]). За подробным и вдумчивым анализом природы раковых опухолей отправляем читателя к статье «От медицинской онкологии к молекулярной биологии рака» [11].
Таким образом, рак, наряду с сердечно-сосудистыми и нейродегенеративными заболеваниями ─ другими главными «убийцами» современности ─ возраст-ассоциированное заболевание (чем старше человек, тем выше вероятность заболеть). Ну а так как благодаря неумолимому научному прогрессу продолжительность жизни растет, получается (как это ни прискорбно), что и люди всё чаще банально «доживают до своего рака» .
Стоит уточнить, что отмеченный рост числа онкобольных связан не только с фактической заболеваемостью, но и с развитием и совершенствованием (а также с большей доступностью) продвинутых методов диагностики: рак банально всё чаще выявляют (из-за чего показатели растут среди не только пожилых, но и молодых пациентов).
Вместе с тем, ряд онкологических заболеваний поражает маленьких детей — как правило, это не карциномы, а лейкемии, лимфомы и опухоли мозга. Вероятно, это связано с тем, что в бурно растущем организме много клеток с повышенном стволовым потенциалом, то есть менее дифференцированных — а это как раз один из характерных признаков раковой клетки [11].
Однако нет худа без добра: учитывая большое разнообразие опухолевых болезней (и их проявлений), онкология имеет, возможно, наибольшую неудовлетворенную потребность [7], что стало важнейшим драйвером развития фармацевтической отрасли. Так что неудивительно, что это направление в последнее время — одно из самых быстрорастущих, что отражается как в количестве разрабатываемых, так и выпускаемых продуктов (рис. 2А и 2Б). Впрочем, поскольку вывод на рынок новых лекарств (сам по себе) не всегда приводит к существенному увеличению эффективности лечения, особые надежды в борьбе с раком ученые возлагают на новые терапевтические модальности [12]: тут вероятность появления лучшего лечения гораздо выше (об этом говорит вся история лекарственной индустрии). Вот почему многие фармкомпании нацелены на разработку новых генных и клеточных терапий, которые, в противовес многим консервативным методам (таким, например, как химиотерапия), имеют потенциал вылечить ныне неизлечимые виды рака.
Как возникает рак и при чем тут гены?
Оглядываясь на десятилетия исследований рака, понимаешь, что основной вклад тут внесло открытие и изучение генетических механизмов опухолевого перерождения, последовавшее за описанием принципов кодирования и передачи генетической информации. Это еще тогда новое знание позволило охарактеризовать кое-какие участвующие в канцерогенезе гены, попутно оценив и их вклад в развитие онкопатологий [8], [13]. Далее мощный поток исследований в области молекулярной и клеточной биологии не только раскрыл многие тайны происхождения опухолей, но показал возможность их направленного лечения на четкой научной базе. Это стало глотком свежего воздуха, приоткрыв путь к разработке лекарств, воздействующих на первопричину болезни [14] (см. врезку).
Роль генов в развитии рака
Итак, с развитием науки выяснилось: в процессах онкогенеза как-то замешаны гены, а точнее, определенные нарушения в них. Стало ясно, что раковые клетки, хотя и очень похожи на здоровые, отличаются от них наличием генетических поломок (мутаций). Впрочем, само наличие специфических соматических мутаций еще не означает, что у человека разовьется рак: во-первых, в клетках есть механизмы защиты от опухолевого перерождения (зачастую при раке нарушены именно они [13]); а во-вторых, ступившие «на темную сторону» клетки чаще всего просто уничтожаются иммунной системой (но некоторые опухоли способны эффективно ускользать от иммунного надзора) .
Собственно «успех» опухоли во многом и зависит от ее способности «одурачить иммунитет» (рис. 3) и даже поставить иммунные клетки себе на службу: «Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет» [26].
Клональная экспансия (размножение опухолевых клеток из единой клетки-предшественницы) обычно является следствием мутаций в каких-либо из четырех классов генов: протоонкогенов, генов-супрессоров [8], а также генов, регулирующих апоптоз и репарацию ДНК. Нарушения в них дестабилизируют клеточное деление, что, в конечном итоге, и приводит к злокачественной трансформации (рис. 4).
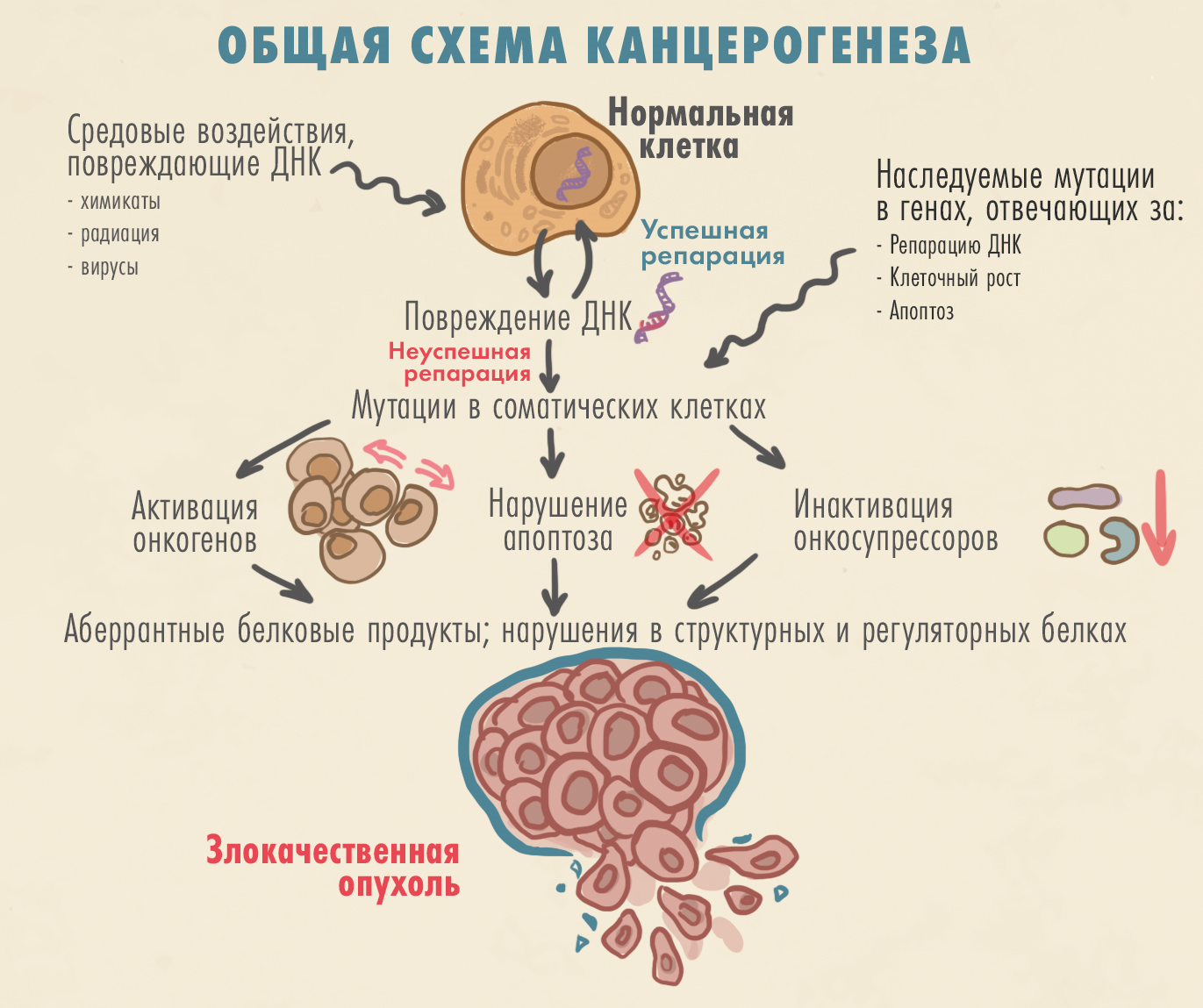
Рисунок 4. Этапы опухолевого перерождения ─ чем больше мутаций, тем выше риск. Эти мутации могут наследоваться или приобретаться вследствие ошибок копирования ДНК или под действием мутагенов. Возрастающая нестабильность генома в какой-то момент просто обрушивает защитные системы клетки (такие как репарация, или восстановление, повреждений ДНК или управляемая гибель клетки за счет апоптоза). Мутации в некоторых генах — протоонкогенах — запускают канцерогенез фактически напрямую, инициируя неконтролируемое деление; практически тот же эффект могут дать мутации в генах — супрессорах опухолей (в норме подавляющих чрезмерный рост клеток). В итоге в клетках появляются мутантные белки, запускающие аномально активированные молекулярные каскады, которые дают старт взрывному росту клеток. Если совсем просто — клетки «теряют тормоза»: делятся бесконтрольно, продолжая злокачественно перерождаться и образуя тем самым опухоль.
иллюстрация Елены Беловой по The Biology of Cancer [9]
Однако онкогенез появлением новообразований не заканчивается ─ есть еще и опухолевая прогрессия. Это нарастание злокачественности: увеличение числа мутаций (повышение молекулярно-генетической гетерогенности клеток) и естественный отбор опухолевых субклонов. Делящиеся и приобретающие самые разные мутации опухолевые клетки подвергаются давлению отбора; в результате выживают наиболее приспособленные из них . Эволюция [27] :-(
Благодаря всему этому активно растущая опухоль обогащается различными клеточными субклонами, выжившими между жерновами иммунной системы и потому научившимися обходить ее защитные механизмы (а их, кстати, довольно много). Такие опухоли постепенно прорастают в окружающие ткани (это называется инвазией) и могут мигрировать по кровотоку (или лимфатической системе) в другие части тела, где затем закрепляются — это называется метастазированием [28]. Доброкачественные и злокачественные опухоли различаются как раз способностью к завоеваниям и разрушениям: первые почти не распространяются по телу человека (и потому относительно безобидны), а вот вторые метастазируют ─ и в силу этого гораздо опаснее. Это, собственно, и есть рак (просим не любить и не жаловать!), причем на молекулярном уровне известно более 500 генов, ассоциированных с различными его формами [7]. Интересно, что в злокачественном патогенезе есть особо «популярные» генные поломки: например, около 50% новообразований обнаруживают нарушения в гене-супрессоре опухолей p53 (рис. 5) [29], крайне важном для запуска апоптоза.
Далее сильно углубляться в тонкости онкогенеза мы тут не будем: тема эта необъятная; но желающих просветиться с удовольствием направляем к статьям «От медицинской онкологии к молекулярной биологии рака» [11], «Путь клетки „из греков в варяги“. Малигнизация: причины и следствия» [13] и прочим нашим онко-публикациям.
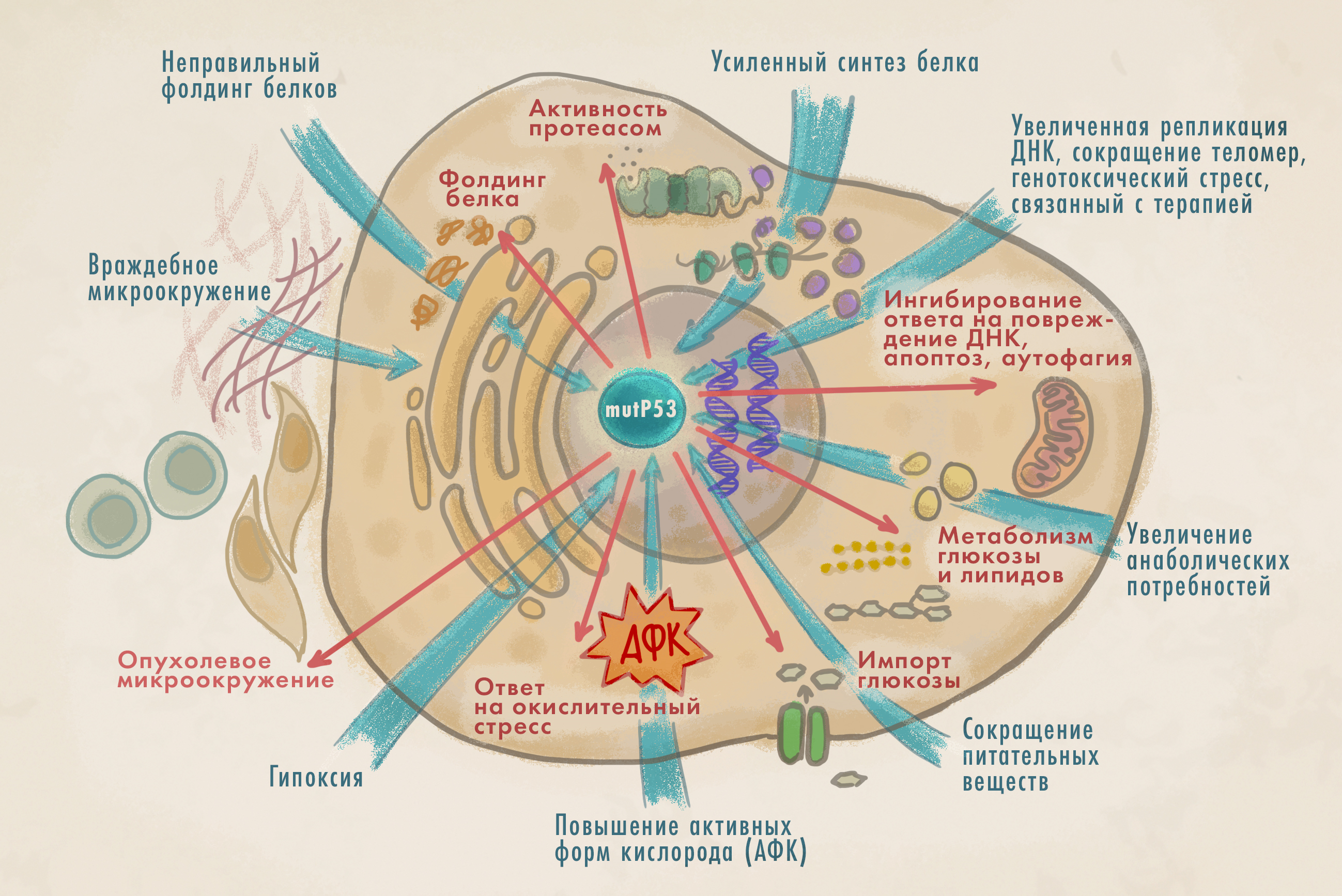
Рисунок 5. Как мутантные формы p53 помогают развиваться раку. Нормальная версия этого гена выполняет в регуляции клеточного цикла столь важную роль, что его прозвали «стражем генома». Он стоит в центре ответа на стрессовые факторы (повреждение ДНК, оксидативный стресс, вирусные инфекции) и отвечает за запуск апоптоза, если нормализовать клетку (например, починить ДНК) не удалось. Мутантный p53, впрочем, играет роль не менее важную — но уже в канцерогенезе, за что остроумные ученые даже окрестили его «стражем раковой клетки». Синим цветом показаны стрессовые факторы, на которые реагирует мутантный р53, красным — адаптивный ответ, который обеспечивает р53 в ответ на стресс.
иллюстрация Елены Беловой по [29]
Генная терапия: на рубежах эффективности
В широком смысле слова генная терапия рака — это манипуляция генами с целью лечения онкологических заболеваний. Гены при этом могут быть как организма пациента, так и введенные извне. Тут можно выделить пять вариантов (рис. 7) [38]:
- введение генов, экспрессия которых приведет к гибели раковой клетки (например, тимидинкиназа вируса герпеса + ганцикловир, см. ниже);
- активация генов-онкосупрессоров (например, р53);
- подавление генов-онкогенов (например, MYCN);
- иммунотерапия, то есть воздействие на гены клеток иммунной системы (CAR-T, TCR-T);
- воздействие на ангиогенез (рост сосудов) в опухоли, опухолевую строму и микроокружение (например, анти-VEGF терапия, уже валидированная антителом бевацизумаб).
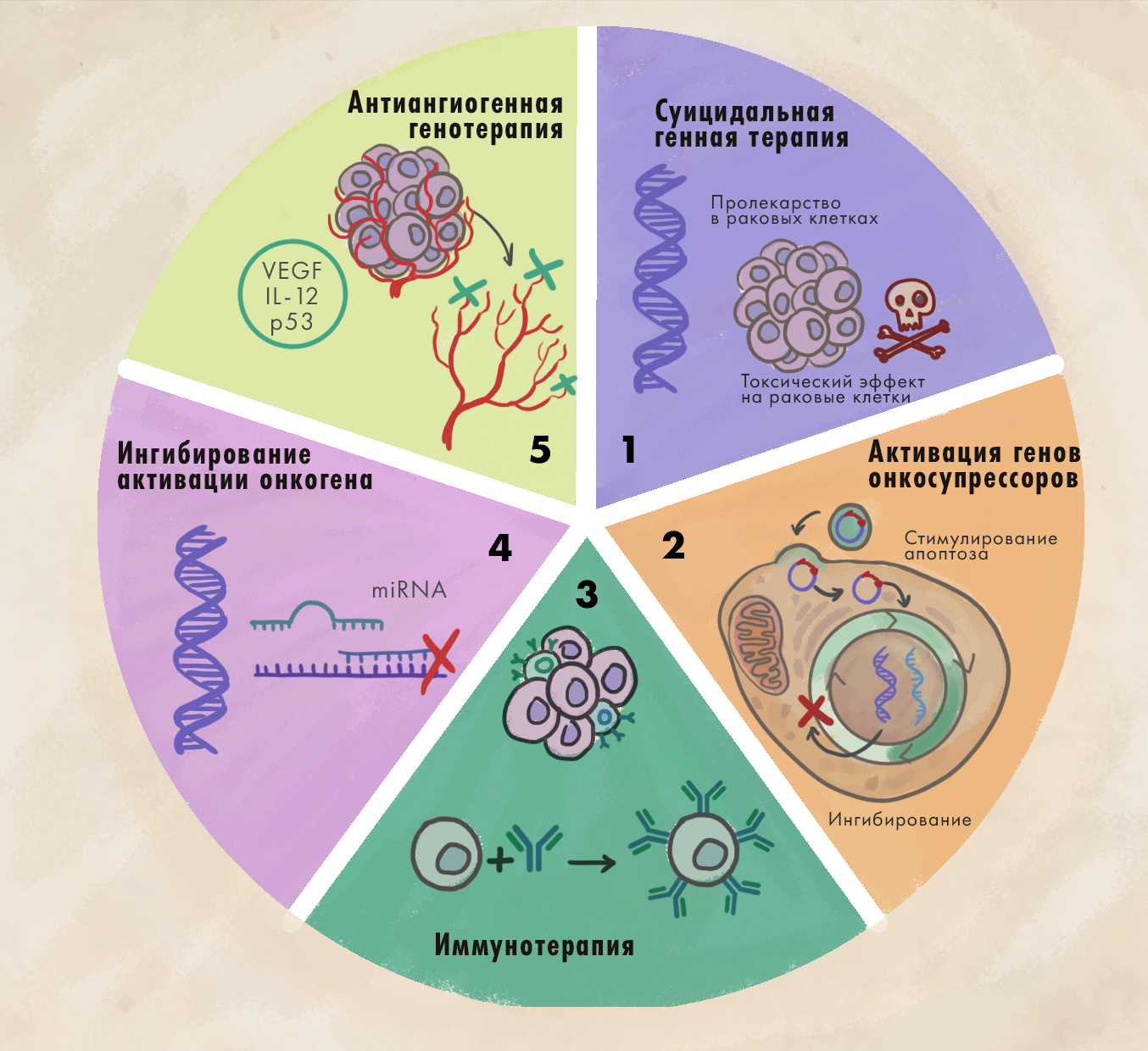
Рисунок 7. Подходы к генной терапии рака. 1. Суицидальная терапия. В раковую клетку доставляется ген фермента, который превращает пролекарство в токсичное лекарство. 2. Активация генов онкусупрессоров. Ингибирование клеточного цикла или стимуляция апоптоза с помощью доставки гена опухолевого супрессора в раковую клетку. 3. Иммунотерапия. Генетические манипуляции с клетками иммунной системы с целью заставить их эффективно уничтожать раковые клетки. 4. Ингибирование активации онкогена. Ингибирование экспрессии онкогенов путем воздействия на них miRNA [39], антисенсами (ASO) [40] или другими способами. 5. Антиангиогенная генотерапия. Ингибируя синтез раковыми клетками факторов роста сосудов, можно попытаться лишить опухоль питательных веществ и вызвать ее регрессию.
иллюстрация Елены Беловой по [38]
Как мы сейчас увидим, пока успеха удалось добиться только с помощью иммунотерапии, но, возможно, в будущем и другие подходы покажут хорошую эффективность.
«Неуспешный успех»: Гендицин и Имлигик
Китай выступил пионером в области генной терапии рака: в 2003 году китайский регулятор SFDA одобрил Гендицин для лечения рака головы и шеи. А уже значительно позже (в 2015 г.), американский FDA одобрил Имлигик — это стало вообще первым одобрением генной терапии в регионе со зрелой регуляторной системой. Но вот только смогли ли эти лекарства оправдать оказанное им «высокое доверие» ─ вопрос как минимум дискуссионный.
Гендицин: «гладко было на бумаге»
В борьбе с раком можно (и нужно) использовать защитные силы самого организма, и ученым это давно известно: это основа иммунотерапии. Чтобы всё это делать правильно, нужно замечать, как сам организм справляется с внешними и внутренними угрозами. И здесь на первый план выходит ген-супрессор опухолей, который явно не стоит игнорировать, — вышеупомянутый «страж генома» p53 (рис. 5). Его роль в защите от опухолевого перерождения так велика, что он стал одним из самых изучаемых. Функциональный белок p53 способен прервать клеточный цикл и индуцировать апоптоз (при накоплении повреждений в ДНК), а в опухолевых клетках, как мы уже говорили, часто выявляют повреждения гена p53 — это как неисправность ручника в машине. Как же можно использовать эти знания с пользой?
Принцип действия китайского противоракового препарата Гендицина ─ доставка в клетку функциональной копии p53 при помощи аденовирусного вектора [42]. По идее, если такой носитель попадет в нормальную клетку, это ей не повредит: активность p53 там особо ни к чему (у нее нет триггерных генетических повреждений). А вот если p53 окажется в раковой клетке, она должна бы совершить «харакири», чтобы не опозорить свое честное имя противоправными действиями. Теоретически это должно ликвидировать опухоль, направив организм на путь выздоровления, — идея шикарная, но, как быстро выяснилось, «гладко было лишь на бумаге»...
Что же здесь не так?
По Гендицину существует целый ряд публикаций, описывающих его эффективность в сочетании с химио- и лучевой терапией, говорящих, что в исследованиях он показал эталонную безопасность [43], [44]; и даже содержащих экспертный консенсус применимости в клинической практике (данное утверждение отражено в публикации журнала Nature — не абы что!) [45].
Данный препарат применяют при лечении плоскоклеточного рака головы и шеи, а также при некоторых других.
Что же не так со всеми этими данными? Или этот препарат действительно по-настоящему эффективен и безопасен? Если внимательно присмотреться к «нахваливающим» Гендицин статьям, то оказывается, что это в основном статьи китайских авторов, и здесь возникает серьезный вопрос: а насколько им можно верить? Дело в том, что в системе лекарственного регулирования в Поднебесной существуют определенные проблемы с прозрачностью. Это означает, что далеко не самые эффективные и безопасные препараты вполне могут проскальзывать сквозь барьеры регулято́рного одобрения. Больше того, поскольку политическая система Китая по сути своей является элитарной диктатурой, нельзя исключать и фактор политического давления на местных регуляторов в случаях, когда госструктурам выгодно выведение на рынок каких-либо лекарственных средств.
К сожалению, для Гендицина всё это вполне может оказаться правдой [46], так как в этот препарат сделаны значительные вливания государственных средств , а его одобрение (основанное на сомнительных данных клинических испытаний, см. ниже) имело некоторую политическую подоплеку. Дело в том, что это была вообще самая первая генная терапия, одобренная к применению у людей, и в случае ее всеобщего признания это вполне могло бы стать более чем убедительным доказательством зрелости китайской биотехнологической промышленности и медико-научной сферы (а значит, и ее конкурентоспособности на международной арене).
Общий объем инвестиций в данный препарат составил около 9,66 миллиона долларов США, четверть из которых пришлась на различные источники китайского правительства, включая Министерство науки и технологий, государственный фонд высоких технологий и муниципальное правительство города Шэньчжэня.
Противоречивость клинических данных
По имеющимся клиническим данным, проблема Гендицина в следующем: на момент его одобрения все эти испытания просто-напросто не соответствовали международным стандартам, и это почти сразу вызвало сомнения в их достоверности. Свою роль здесь сыграли и некоторые расхождения между декларируемой разработчиками Sibiono GenTech эффективностью и безопасностью с опубликованными ими же данными исследований. В частности, доктор Чжаохуэй Пэн (гендиректор и основатель Sibiono GenTech, рис. 8) упоминал о более чем 2500 пациентов, пролеченных Гендицином без серьезных побочных эффектов, однако препарат был одобрен [46] на основе данных лишь о 135 людях (что составляет около 5% от озвученных Пэном цифр). Всё бы ничего, но 135 ─ это ведь даже меньше обычно требуемого для коммерческого одобрения (во всяком случае, если оглядываться на международные практики). Обычно клинические исследования проводятся в три фазы [47], причем на третьей включают порядка тысячи человек.

Рисунок 8. Чжаохуэй Пэн — китайский ученый, основавший компанию-производитель Гендицина (Sibiono GenTech), — утверждал, что в Китае не менее строгие критерии оценки лекарств, чем в США. Вот что он говорил про свое детище: «Хотя одно из значений Гендицина заключается в его способности спасать тысячи жизней, другое состоит в том, что он доказывает: мы не отстаем от остального мира и можем стать мировым лидером, если будем работать достаточно усердно».
На этом странности в дизайне испытания не заканчиваются: в нем пациенты были случайным образом разделены на группы: (1) контроль (лучевая терапия) и (2) экспериментальная (лучевая + Гендицин), причем разделили их не поровну (что уже само по себе не очень хорошо): в первой группе было 72 человека, а во второй ─ 63 (рис. 9). Дальнейшие выводы по наблюдаемой эффективности делались с учетом не всех пациентов: описывали эффект для 63 человек из контрольной группы и 56 — из экспериментальной .
Это вызывает вопросы, так как с одной стороны не совсем ясно, что стало с пациентами, не вошедшими в «расчетный пул» (учитывая, что есть подозрения о сокрытии в Китае статистики смертельных случаев — это приобретает особую остроту), а с другой ─ тут налицо проблемы с рандомизацией. Считается, что для достоверного анализа необходимо включать всех пациентов из исходных групп (даже если по каким-то причинам они и вовсе не получали лечения). Такой статистический метод называется анализом «по намеченному лечению» (intention-to-treat population) и больше соответствует реальной жизни.
| Группа | Полная регрессия | Частичная регрессия | Стабилизация | Прогрессия |
|---|---|---|---|---|
| Генная терапия + радиотерапия (63 в начале, 56 через 12 недель) | 36 (64%) |
16 (29%) |
4 (7%) |
0 (0%) |
| Только радиотерапия (72 в начале, 63 после 12 недель) | 12 (19%) |
38 (60%) |
13 (21%) |
0 (0%) |
По результату: полная регрессия опухолей (по данным компьютерной томографии или магнитно-резонансной томографии) была в три раза выше, когда лечение включало лучевую терапию и Гендицин (что и объявляется разработчиками «несомненным успехом»), по сравнению с только лучевой терапией (36 случаев против 12). Однако частичная регрессия опухоли, напротив, происходила чаще при использовании только лучевой терапии (38 случаев против 16) [46]. Выглядит всё это как будто немного обнадеживающе, но скажем прямо: учитывая непрозрачный (и, по всей видимости, некорректный — как минимум с точки зрения статистической мощности) дизайн исследования, делать на основании этих данных далеко идущие выводы вряд ли правильно. Добавим к этому и то, что относительно данного исследования ничего не известно об «ослеплении», так что тут нельзя исключать свойственных «неслепым» исследованиям погрешностей (связанных с эффектом плацебо и предвзятостью оценки). Кроме того, регрессия опухолей, как говорилось выше, — это лишь суррогатный показатель эффективности терапии, а реальную эффективность показывают лишь данные по выживаемости.
Особенно же удивительно, что всего этого оказалось вполне достаточно для коммерциализации препарата; ну а, учитывая, что есть большие вопросы и к другим опубликованным доктором Пэном и его командой исследованиям, его громкие заявления о «тысячах спасенных Гендицином жизнях» (рис. 8) выглядят в высшей степени спекулятивно.
Что было бы, если бы Гендицин попытались одобрить в странах с более жестким регулированием?
Мы можем предположить это, рассмотрев Адвексин (производства Introgen Therapeutics и Gendux) ─ препарат с аналогичным механизмом действия. Его планировали одобрить для лечения рака по орфанным показаниям, связанным с синдромом Ли-Фраумени в Европе и США; дополнительная заявка была подана на одобрение этого лекарства для лечения плоскоклеточного рака головы и шеи. В итоге рассмотрения были выявлены многочисленные проблемы в производстве, клинических и доклинических исследованиях, при этом убедительных доказательств пользы в отношении выживаемости и отсутствия прогрессирования заболевания (у ограниченного числа пациентов, лечившихся препаратом) выявлено не было. Также не было обнаружено и достоверной корреляции между выраженностью мутаций гена p53 в опухолях и клиническим ответом на Адвексин. В результате заявки на одобрение Адвексина в конечном итоге были отозваны компанией [49].
К сожалению, с учетом всего сказанного, похоже, что доставка p53 в опухолевую клетку, хотя и кажется перспективной технологией, на практике в лечении рака просто-напросто не работает. :-(
Имлигик — скромная эффективность
Имлигик (talimogene laherparepvec; T-VEC) был первым основанным на вирусной онколитической технологии препаратом, одобренным FDA (в 2015 году, для лечения неоперабельной меланомы). Это лекарство представляет собой генетически модифицированный вирус простого герпеса типа 1, который после введения непосредственно в опухоль начинает в ней размножаться, продуцируя иммуностимулирующий белок GM-CSF. В нормальных клетках вирус не реплицируется, потому что у него отсутствует ген, отвечающий за подавление стрессового ответа. В опухолевых клетках система стрессового ответа сломана, что позволяет вирусу размножаться и вызывает лизис опухолей. Предполагается, что высвобождение затем опухолевых антигенов вместе с GM-CSF вирусного происхождения привлекает T-клетки иммунной системы, которые теперь уже могут «расправляться» и с другими новообразованиями [14].
Ситуация с этим препаратом в какой-то мере схожа с Гендицином: он инновационный и с виду интересный, но серьезным прорывом его не назвать. Дело в том, что, хотя Имлигик и показал способность уменьшать размеры некоторых опухолей, улучшение выживаемости пациентов оказалось совсем скромным. А точнее, на момент одобрения даже не было доказано, что он может существенно улучшить общую выживаемость или каким-либо образом повлиять на метастазы, имеющиеся на поздних стадиях меланом (по данным исследования OPTiM ─ на основании которого FDA и одобрили препарат).
В сравнении с контролем (введением GM-CSF), где медиана общей выживаемости составила 19 месяцев, этот же показатель при экспериментальном лечении (T-VEC) в 22,9 месяца не был статистически значимым (p = 0,116).
Узкие показания, внутриопухолевое введение, немалая стоимость (порядка $65 000 на пациента) и наличие альтернативных средств лечения сильно уменьшают смысл применения этого иммунотерапевтического препарата.
Множество других онколитических вирусов побывали в клинических исследованиях [50], но больше ни один не показал эффективности и безопасности, достаточной для одобрения в странах со зрелой регуляторной системой. В этом рассказе нельзя не упомянуть о так называемой суицидальной терапии с помощью тимидинкиназы (TK) вируса простого герпеса HSV. C помощью какого-либо вирусного вектора ген HSV-TK доставляется в клетки (в идеале — только в опухолевые), затем пациент получает относительно нетоксичный ганцикловир, который под воздействием HSV-TK превращается в ганцикловир-фосфат, а внутриклеточные ферменты фосфорилируют его до ганцикловир-трифосфата, который токсичен благодаря связыванию с ДНК, и при этом не выходит из клетки [38]. Замысел элегантный, но так и не сработал — то ли из-за недостаточно специфичного нацеливания векторов на раковые клетки, то ли по каким-то другим причинам.
Однако, несмотря на многочисленные провалы, до сих пор остается надежда, что какой-то из подходов всё же сработает. Вирусы предоставляют широкие возможности для гибкой настройки того, какие ткани заражать, что в них экспрессировать, и по мере накопления знаний и клинических данных успех вполне вероятен.
Но на сегодняшний день самый громкий успех — в области иммунной клеточной генотерапии.
Иммунная генотерапия: рабочие препараты
Как мы уже говорили, нашу собственную иммунную систему можно нацелить на борьбу с раком. Например, взять у ракового больного его же собственные лимфоциты; изолировать их в лабораторных условиях; модифицировать генетически, снабдив особым рецептором, позволяющим распознавать те раковые клетки, что нашли у пациента; и вернуть их пациенту обратно, в организме которого вот эти «генные мутанты» будут искать уже собственно опухолевые бласты, прицельно их уничтожая.
Это самая общая схема достаточно эффективной современной терапии, известной как CAR-T. Причем надо сказать, что у этой терапии имеются различные варианты реализации.
Генно-клеточная CAR-терапия: настоящая эффективность
CAR-T находятся на пересечении нескольких идей и технологий, которые только к 2017 году объединились в одном продукте и созрели для коммерциализации. В идее CAR-T соединились иммунотерапия рака, трансплантация стволовых клеток, представление об инфильтрующих опухоль лимфоцитах, технология моноклональных антител и генная модификация клеток [51].
Идея иммунотерапии рака восходит еще к 19 веку, когда хирург и исследователь рака Уильям Коли вводил больным живые бактерии, вызывая в некоторых случаях регрессию опухоли [52]. Трансплантация стволовых клеток костного мозга для лечения лейкемий и лимфом практикуется с конца 1970-х годов — донорские Т-клетки в составе трансплантата узнают и атакуют опухолевые клетки. Еще более специфичный подход был опробован в 1980-х годах доктором Стивеном Розенбергом. Из материала опухолевой биопсии выделяли Т-клетки (tumor-infiltrating lymphocytes, TILs), инкубировали их с активирующей молекулой интерлейкином-2 и потом вводили обратно. Так удалось добиться успеха у некоторых пациентов с меланомой, но до одобрения этот метод добрался только в 2024 году. Дальше мы его рассматривать не будем, потому что он не предполагает генной модификации клеток, хотя в разработке есть и продукты, где TILs модифицируют для повышения эффективности и безопасности.
В последний раз, когда мы делали обзор клеточных продуктов [53] — в конце 2020 года, — было одобрено три CAR-T против CD19 (маркер предшественников В-клеток, из которых развиваются В-клеточные лейкемии и лимфомы), а на горизонте было одобрение BCMA CAR-T по множественной миеломе. Сейчас их уже шесть — четыре против CD19 и два — против BCMA. За это время у клиницистов накопился опыт применения CAR-T, который позволил вовремя предотвращать большинство осложнений. Произошло важное событие: Yescarta вышла во вторую линию терапии диффузной В-крупноклеточной лимфомы DLCBL. Лечение этого онкогематологического заболевания уже более 30 лет выглядело так: на первой линии химиотерапия (позже к ней присоединилось антитело против маркера В-клеточной линии CD20 ритуксимаб), на второй линии — трансплантация стволовых клеток костного мозга от донора. CAR-T вышли сначала на третью линию, где не было стандартных опций терапии. И вот, в прямом сравнительном исследовании было показано, что Yescarta превосходит трансплантацию костного мозга по выживаемости — через 2,5 года в группе препарата были живы 40,5% пациентов по сравнению с 16,3% в контрольной группе. Похожий процесс сейчас идет с CAR-T против BCMA по множественной миеломе (Carvykti, Abecma).
Приятно отметить, что и Россия, несмотря на международные санкции и уход из страны производителей решения для клеточной терапии рака, тоже не остается в стороне: «Как первые российские CAR-T-клетки с опухолью боролись» [54].
В предыдущей статье [53] мы уже упоминали об улучшениях CAR-T, которые призваны повысить их эффективность, безопасность, расширить область применения. Важный аспект, требующий разработок — снижение стоимости и повышение доступности CAR-T для пациентов. Новые разработки идут по разным направлениям:
- введение новых модификаций в клетки (например, создание переключаемых CAR-T, которые можно быстро выключить введением низкомолекулярного лекарства, или удаление иммуносупрессорных рецепторов),
- использование аллогенных клеток,
- применение новых способов модификации CAR-T (CRISPR/Cas9),
- использование CAR с клетками других типов (например, γδT-клеток или ИПСК),
- создание CAR-T с двойной специфичностью и логическим управлением [55],
- оптимизация фенотипического состава,
- а также всевозможные сочетания этих подходов.
С CAR-T идут сотни клинических исследований по всему миру, но пока что явных фаворитов в этой гонке нет (впрочем, компания Autolus со своими улучшенными CAR-T, о которых мы уже писали [53], ожидает одобрения в ноябре 2024). Большие надежды возлагали на аллогенные CAR-T, но пока что они разочаровывают: из-за их чужеродной природы они вызывают иммунный ответ в организме пациента, что ограничивает их эффективность и может приводить к нежелательным явлениям [56].
Перспективный подход, который, правда, пока показал эффективность только в исследованиях на животных, — получение CAR-T прямо в организме пациента [57]. Для этого надо с помощью вирусного вектора доставить ген, кодирующий CAR, в Т-лимфоциты. Этот подход позволил бы снять ограничение аутологичных CAR-T, связанное с длинным и сложным производством [58], и, возможно, повысил бы безопасность применения CAR-T. Однако на этом пути нужно решить еще много проблем — в частности, выбрать наилучший способ доставки и модификации клеток [56].
А вот чего CAR-T пока не смогли добиться, так это регрессии сóлидных опухолей. Здесь их обгоняют другие подходы, хотя, честно говоря, и их успехи пока довольно скромные и очень нишевые.
Есть и помимо CAR-T достойные кандидаты
Кроме уже упомянутых TILs, которые недавно были одобрены по меланоме, единственная технология, показавшая хоть какие-то результаты при солидных опухолях — это TCR-T (TCR — Т-клеточный рецептор, обеспечивающий распознавание Т-клеткой своего антигена). В отличие от CAR-T, несущих на поверхности фрагмент антитела для связи с антигеном (например, CD19 или BCMA), у TCR-T на поверхности такой же TCR, как у «природного» Т-лимфоцита, только его специфичность изменена так, чтобы он узнавал пептидные фрагменты опухолевых антигенов в контексте MHC I [60] на поверхности раковой клетки. Раковая клетка, как и другие клетки организма, обязана выставлять на поверхности фрагменты внутриклеточных белков, иначе она будет уничтожена иммунологическим надзором — NK-клетками. У раковой клетки может быть довольно много мутаций, и мутантные пептиды воспринимаются иммунной системой как чужеродные (их называют неоантигенами, как и фрагменты необычных для здоровых клеток эмбриональных или тестикулярных белков, см. ниже). В здоровом организме иммунная система справляется с такими мутантами, вовремя уничтожая их (рис. 9a). По мере накопления мутаций и ослабления иммунной системы сначала устанавливается равновесие (рис. 9б) между опухолью и иммунной системой, а затем опухоль побеждает и разрастается (рис. 9в).
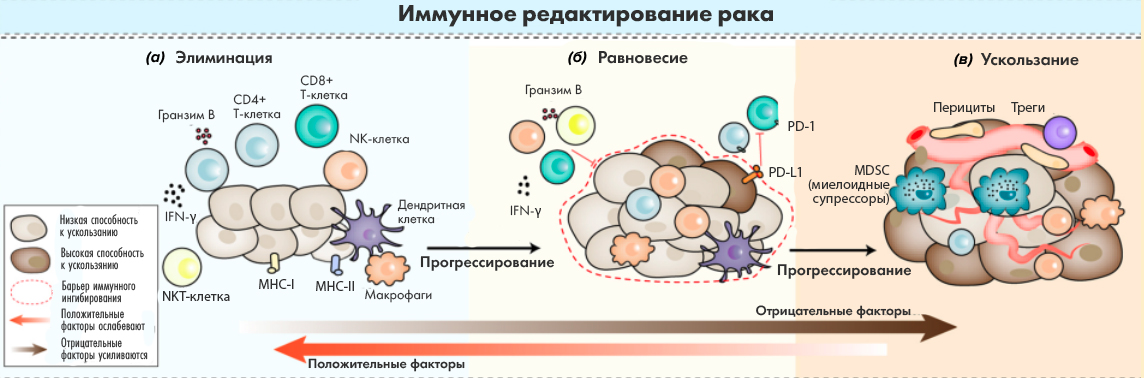
Рисунок 9. Концепция иммунного редактирования. (а) — иммунная система справляется с задачей удаления опухолевых клеток. (б) — устанавливается равновесие между опухолью и иммунной системой — иммунная система не способна уничтожить опухоль, но и опухоль не может избежать надзора со стороны иммунной системы. (в) — опухоль больше не контролируется иммунной системой — наоборот, она теперь контролирует свое микроокружение [61], создавая благоприятные условия для пролиферации.
Эта схема называется концепцией иммунного редактирования и объясняет, почему иммунная система вместо подавления опухоли, наоборот, способствует ее выживанию. Опухоль формирует микроокружение [61], где макрофаги, регуляторные Т-клетки, миелоидные стромальные клетки (myeloid-derived stromal cells, MDSC) и другие нетрансформированные клетки организма защищают опухоль от Т-лимфоцитов и NK-клеток. Именно поэтому, несмотря на наличие неоантигенов и специфический противоопухолевый иммунный ответ, иммунной системе не удается с ней справиться. Однако, как показывают успехи иммунотерапии, ей можно помочь.
В частности, опухоль часто несет так называемые раковые эмбриональные антигены и раковые тестикулярные антигены — белки, которые экспрессируются только у эмбрионов или только в сперматозоидах и поэтому могут быть надежным способом отличить раковую клетку от нормальной. Однако, по-видимому, их фрагменты недостаточно иммуногенны, поэтому иммунная система не вырабатывает против них достаточно активных цитотоксических Т-лимфоцитов. Но их можно сделать генно-инженерным путем! Для этого, как и в случае CAR-T, у пациента забирают лимфоциты и заставляют их экспрессировать T-клеточный рецептор, специфичный к нужному антигену. Попыток было очень много, но пока хорошие результаты показало только применение T-клеток, настроенных против MAGE-A3, при синовиальной саркоме. Среди 25 пациентов, ранее получивших в среднем три линии терапии, у двух наступила полная регрессия опухоли, у восьми — частичная [63]. Анализ долговременной выживаемости показал, что среди всех пациентов медианная выживаемость составила 15,4 месяцев, а среди тех, кто ответил на лечение, двухлетняя вероятность выжить составляет уже 60% [64]. Это очень хороший результат для пациентов с такой тяжелой болезнью — именно такого исследователи и ожидают от средств передовой терапии. Разработчик терапии, компания Adaptimmune собирается добиваться одобрения со стороны FDA в 2024 году.
Особый случай применения TCR-T — их настройка против вирусных антигенов. К сожалению, не так много бывает раков, при которых на поверхности клеток экспрессируются фрагменты вирусов. Один из самых распространенных — вирус папилломы человека [65], вызывающий, в частности, рак шейки матки. Против него пытались создать TCR-T, однако в клинических исследованиях особого успеха не было. Причина, видимо, в том, что под действием терапии опухоль начинает эволюционировать, и выживают те опухолевые клетки, у которых на поверхности нет антигена. Таким образом, экспрессия антигена в опухоли снижается, и терапия становится неэффективной. Тут, наоборот, скорее вопрос, почему в предыдущем случае, при синовиальной саркоме, у части пациентов этого не происходит. На него пока нет ответа — как вы могли убедиться, взаимоотношения опухоли с иммунной системой очень сложны, и ученые только-только начинают в них разбираться.
Однако один вирус всё-таки удалось «поймать», хотя и при очень редком заболевании. Это вирус Эпштейна—Барр (EBV), который присутствует в неактивном виде у многих людей, и иногда активируется, вызывая ряд заболеваний, среди которых как неонкологические (мононуклеоз), так и онкологические (различные виды лейкемий и лимфом [66]). Компания Atara провела исследование аллогенных TCR против редкого осложнения трансплантации — когда EBV, спящий в В-клетках, просыпается из-за иммуносупрессорной терапии. В этом случае возникает PTLD — посттрансплантационное лимфопролиферативное заболевание, трехлетняя выживаемость при котором — менее 50%, а если первая линия терапии не помогла — то выживаемость не больше 4 месяцев. И вот у таких безнадежных пациентов после лечения клеточной терапией двухлетняя выживаемость превзошла 50% [67]! В итоге компания получила одобрение ЕМА (и планирует получить его в FDA), и эта терапия стала первым зарегистрированным аллогенным клеточным продуктом.
Интересный вариант применения генного редактирования клеток для терапии рака — модификация лимфоцитов, чтобы они не несли определенного маркера. Так, до сих пор по острому миелоидному лейкозу не одобрена ни одна клеточная терапия из-за отсутствия достаточно специфических маркеров. На лейкозных бластах эксперссируется маркер CD33, но он также присутствует на нормальных миелоидных клетках. Компания Vor Bio разрабатывает клеточный продукт, представляющий из себя донорские стволовые клетки костного мозга для трансплантации, только с удаленным геном, кодирующим CD33. Таким образом, пациент получает новые клетки костного мозга, неуязвимые против агентов, уничтожающих CD33+ клетки, например, антитела или CAR-T против CD33. Их планируется применять вместе с генно-модифицированным трансплантатом. Сейчас терапия тестируется в фазе I, и время покажет, есть ли у нее преимущество перед стандартной трансплантацией.
Вирусы на службе онкологов
Вернемся к вирусам, однако на сей раз не с точки зрения прямого онколитического действия, а как к средству доставки (вектору). В 2022 году одобрение получила генная терапия рака мочевого пузыря Adstiladrin компании Ferring. Продукт представляет собой аденовирусный вектор, несущий ген интерферона-α2b. Вирус не способен к размножению, то есть он заражает клетки один раз, доставляет туда копию гена, и клетки начинают вырабатывать интерферон-α2b, который стимулирует их апоптоз [68]. Терапия вводится в мочевой пузырь через катетер раз в три месяца и предназначена для пациентов, которые прогрессировали после стандартной терапии — введения БЦЖ.
Наилучшие результаты были получены у пациентов с карциномой in situ — то есть с таким раком, который пока не распространился дальше наружного слоя эпителиальных клеток. Среди этих пациентов более чем у половины (51%) наблюдалась полная регрессия опухоли, и у 46% из них в течение года не было рецидива. Неинвазивный рак мочевого пузыря составляет 75% всех случаев рака мочевого пузыря, и даже после терапии БЦЖ у многих наступает прогрессия к инвазивной и метастатической форме рака. Новая терапия позволит помочь пациентам, не ответившим на БЦЖ, вылечиться совсем или хотя бы отдалить прогрессию.
РНК в борьбе с раком
Еще один способ воздействия на генетический аппарат клетки — РНК-терапия. В области редких заболеваний за последние годы здесь достигнуты определенные успехи: почти каждый год регистрируются новые препараты, действующие по принципу РНК-интерференции или антисмысловых РНК . Эти подходы пытались применять и для противораковой терапии, но успехов добиться не удалось.
В статье на «Биомолекуле» «Есть ли смысл в антисенсах?» [40] рассказывается о препарате custirsen, антисмысловом олигонуклеотиде против кластерина, который провалился в исследованиях фазы 3 по ракам легкого и простаты.
Огромным успехом для РНК-области стали вакцины против COVID-19, разработанные компаниями Moderna и BioNTech/Pfizer. На волне этого успеха Moderna продолжает десятки разработок, и одна из самых многообещающих — РНК-препарат для лечения меланомы. Как и в случае ковидной вакцины, препарат представляет собой РНК, упакованную в липидные наночастицы. В отличие от вакцины, в которой РНК кодирует спайк-белок коронавируса, в состав противоракового препарата входят РНК, кодирующие индивидуальные неоантигены пациента. То есть для того, чтобы получить такой препарат, надо сначала взять у пациента биопсию, отсеквенировать опухолевые клетки, чтобы определить их неоантигенный состав, выбрать до 34 лучших неоантигенов и синтезировать их мРНК (рис. 10) [71]. Препарат изучался в клиническом исследовании у пациентов с резектабельной меланомой после полного удаления опухоли и вводился вместо со стандартной терапией — антителом пембролизумаб против рецептора PD-1. В контрольной группе пациенты получали пембролизумаб. По данным трехлетнего наблюдения в экспериментальной группе риск рецидива или смерти снизился на 49% по сравнению с контрольной, а риск развития метастазирования или смерти — на 62%! Сейчас идет набор в исследование фазы 3 по меланоме и раку легкого.
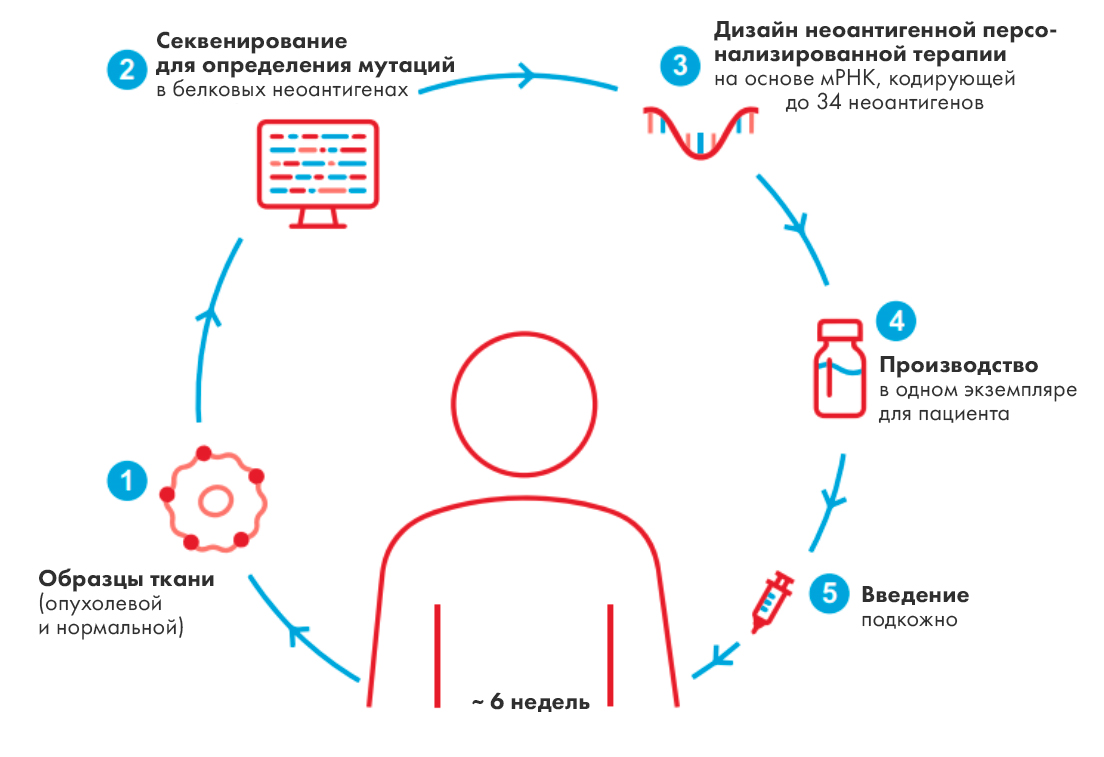
Рисунок 10. Схема изготовления персонализированной неоантигенной вакцины.
Это прекрасный результат, но, к сожалению, пока непонятно, можно ли его будет обобщить на другие виды рака. Меланома и рак легкого вообще хорошо отвечают на иммунотерапию, в отличие от, например, рака поджелудочной или молочной железы. Кроме того, далеко не всегда можно сделать полную резекцию опухоли, чтобы определить ее неоантигенный состав. А при игольчатой биопсии велик шанс пропустить важные неоантигены и получить недостаточно эффективный препарат. Впрочем, сейчас пытаются определять неоантигенный состав опухоли неинвазивно, по циркулирующей ДНК или по составу опухолевых экзосом, так что будущее противораковой терапии всё равно, вероятно, за персонализированным неоантигенным подходом.
Заключение
Как читатель мог убедиться из этого обзора, область генной терапии рака развивается бурно, новости появляются чуть ли не каждый месяц. В то же время, много проблем еще предстоит решить: клеточная и генная терапия — пока очень дорогой, сложный в производстве и поэтому штучный товар. Такие подходы, как аллогенные клетки и редактирование in vivo, возможно, помогут решить эту проблему. В ближайшие годы мы наверняка увидим много нового в этой интересной передовой области.
Литература
- Генная терапия нейромоторных болезней;
- Как болезни крови генной терапией лечили;
- Свет в конце туннеля: генная терапия болезней зрения;
- Генная терапия: познакомьтесь с лекарствами будущего;
- Время первых: как аденоассоциированные вирусы стали лучшими в доставке генов in vivo;
- Лентивирусные векторы: как они стали лучшими векторами для терапии ex vivo;
- Anu Maria Sebastian, David Peter. (2022). Artificial Intelligence in Cancer Research: Trends, Challenges and Future Directions. Life. 12, 1991;
- Генная терапия против рака;
- Weinberg R. The Biology of Cancer. Garland Science, 2006. — 850 p.;
- Рак молочной железы с семейной историей;
- От медицинской онкологии к молекулярной биологии рака;
- Три поколения лекарств;
- Путь клетки «из греков в варяги». Малигнизация: причины и следствия;
- Таргетная терапия — прицельный удар по болезни;
- Hye-Young Min, Ho-Young Lee. (2022). Molecular targeted therapy for anticancer treatment. Exp Mol Med. 54, 1670-1694;
- Josef Rüschoff, Wedad Hanna, Michael Bilous, Manfred Hofmann, Robert Y Osamura, et. al.. (2012). HER2 testing in gastric cancer: a practical approach. Modern Pathology. 25, 637-650;
- Ruofei Du, Xin Wang, Lixia Ma, Leon M. Larcher, Han Tang, et. al.. (2021). Adverse reactions of targeted therapy in cancer patients: a retrospective study of hospital medical data in China. BMC Cancer. 21;
- Douglas Hanahan, Robert A Weinberg. (2000). The Hallmarks of Cancer. Cell. 100, 57-70;
- Терапевтические моноклональные антитела;
- Иммунитет без тормозов: Нобелевская премия за антитела против рака (2018);
- В борьбе с раком: как люди корпускулы приручили;
- Что будет, если человек попадет в ускоритель частиц, и при чем тут лечение опухолей?;
- На пути к безопасной химиотерапии;
- Порочный цикл: от рака молочной железы до костных метастазов;
- Фотодинамическая терапия: подсвети проблему рака;
- Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет;
- Roberto Vendramin, Kevin Litchfield, Charles Swanton. (2021). Cancer evolution: Darwin and beyond. The EMBO Journal. 40;
- Метастазирование опухолей;
- Fiamma Mantovani, Licio Collavin, Giannino Del Sal. (2019). Mutant p53 as a guardian of the cancer cell. Cell Death Differ. 26, 199-212;
- Delou, Souza, Souza, Borges. (2019). Highlights in Resistance Mechanism Pathways for Combination Therapy. Cells. 8, 1013;
- Deborah Plana, Adam C. Palmer, Peter K. Sorger. (2022). Independent Drug Action in Combination Therapy: Implications for Precision Oncology. Cancer Discovery. 12, 606-624;
- Patrizia Cammareri, Kevin B. Myant. (2023). Be like water, my cells: cell plasticity and the art of transformation. Front. Cell Dev. Biol.. 11;
- Rachel F Dear, Kevin McGeechan, Marisa C Jenkins, Alexandra Barratt, Martin HN Tattersall, Nicholas Wilcken. (2013). Combination versus sequential single agent chemotherapy for metastatic breast cancer. Cochrane Database of Systematic Reviews. 2021;
- Fatima Cardoso, Philippe L. Bedard, Eric P. Winer, Olivia Pagani, Elzbieta Senkus-Konefka, et. al.. (2009). International Guidelines for Management of Metastatic Breast Cancer: Combination vs Sequential Single-Agent Chemotherapy. JNCI: Journal of the National Cancer Institute. 101, 1174-1181;
- Kiichiro Ninomiya, Katsuyuki Hotta. (2018). Pembrolizumab for the first-line treatment of non-small cell lung cancer. Expert Opinion on Biological Therapy. 18, 1015-1021;
- Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль;
- Sarah Goring, Nebibe Varol, Nathalie Waser, Evan Popoff, Greta Lozano-Ortega, et. al.. (2022). Correlations between objective response rate and survival-based endpoints in first-line advanced non-small cell lung Cancer: A systematic review and meta-analysis. Lung Cancer. 170, 122-132;
- Büşra Cesur‐Ergün, Devrim Demir‐Dora. (2023). Gene therapy in cancer. The Journal of Gene Medicine. 25;
- МикроРНК в канцерогенезе: тонкая грань между спасением и разрушением;
- Есть ли смысл в антисенсах?;
- S.N. Naryzhny, O.K. Legina. (2019). Structural-functional diversity of p53 proteoforms. BIOMED KHIM. 65, 263-276;
- «Спутник V» и не только: сказ об аденовирусных вакцинах;
- Wei-Wei Zhang, Longjiang Li, Dinggang Li, Jiliang Liu, Xiuqin Li, et. al.. (2018). The First Approved Gene Therapy Product for Cancer Ad-p53(Gendicine): 12 Years in the Clinic. Human Gene Therapy. 29, 160-179;
- Reena Goswami, Gayatri Subramanian, Liliya Silayeva, Isabelle Newkirk, Deborah Doctor, et. al.. (2019). Gene Therapy Leaves a Vicious Cycle. Front. Oncol.. 9;
- Yi Li, Wei Guo, Xiuqin Li, Jianguo Zhang, Moyi Sun, et. al.. (2021). Expert consensus on the clinical application of recombinant adenovirus human p53 for head and neck cancers. Int J Oral Sci. 13;
- Krimsky S. (2005). China's gene therapy drug: do Shenzen SiBiono Gen-Tech's claims hold up?. Genewatch. 18, 10–13;
- С миру по нитке: как соединились компоненты клинического исследования;
- Hepeng Jia. (2006). Gene therapy finds welcoming environment in China. Nat Med. 12, 263-264;
- Alex Kudrin. (2012). Overview of cancer vaccines. Human Vaccines & Immunotherapeutics. 8, 1335-1353;
- Xianwang Wang, Yihua Shen, Xingxia Wan, Xiaoqing Hu, Wen-Qi Cai, et. al.. (2023). Oncolytic virotherapy evolved into the fourth generation as tumor immunotherapy. J Transl Med. 21;
- Aroshi Mitra, Amrita Barua, Luping Huang, Siddhartha Ganguly, Qin Feng, Bin He. (2023). From bench to bedside: the history and progress of CAR T cell therapy. Front. Immunol.. 14;
- Обыкновенное чудо, или Как рак исчезает сам собой;
- Клетки, которые лечат людей;
- Как первые российские CAR-T-клетки с опухолью боролись;
- Многофакторная аутентификация помогает бороться с раком;
- Tianqing Xin, Li Cheng, Chuchao Zhou, Yimeng Zhao, Zhenhua Hu, Xiaoyan Wu. (2022). In-Vivo Induced CAR-T Cell for the Potential Breakthrough to Overcome the Barriers of Current CAR-T Cell Therapy. Front. Oncol.. 12;
- CAR-T-клетки, получаемые in situ (in vivo), — путь к удешевлению и широкодоступности технологии?;
- Генные и клеточные лекарства: сложное регулирование для сложных продуктов;
- Wenkang Wang, Yang Liu, Zhen He, Lifeng Li, Senbo Liu, et. al.. (2024). Breakthrough of solid tumor treatment: CAR-NK immunotherapy. Cell Death Discov.. 10;
- Системная иммунология: секреты Т-клеточного репертуара;
- Опухолевые разговоры, или Роль микроокружения в развитии рака;
- Shaochuan Liu, Qian Sun, Xiubao Ren. (2023). Novel strategies for cancer immunotherapy: counter-immunoediting therapy. J Hematol Oncol. 16;
- Sandra P. D'Angelo, Brian Andrew Van Tine, Steven Attia, Jean-Yves Blay, Sandra J. Strauss, et. al.. (2021). SPEARHEAD-1: A phase 2 trial of afamitresgene autoleucel (Formerly ADP-A2M4) in patients with advanced synovial sarcoma or myxoid/round cell liposarcoma.. JCO. 39, 11504-11504;
- Brian Andrew Van Tine, Kristen N. Ganjoo, Jean-Yves Blay, Claudia Valverde, Dejka M. Araujo, et. al.. (2023). The SPEARHEAD-1 trial of afamitresgene autoleucel (afami-cel [formerly ADP-A2M4]): Analysis of overall survival in advanced synovial sarcoma.. JCO. 41, 11563-11563;
- ВПЧ: вирус, вызывающий рак;
- От поцелуя до лимфомы один вирус;
- Susan J. Keam. (2023). Tabelecleucel: First Approval. Mol Diagn Ther. 27, 425-431;
- Arnold Lee. (2023). Nadofaragene Firadenovec: First Approval. Drugs. 83, 353-357;
- Harry W. Herr, Alvaro Morales. (2008). History of Bacillus Calmette-Guerin and Bladder Cancer: An Immunotherapy Success Story. Journal of Urology. 179, 53-56;
- Jeffrey S Weber, Matteo S Carlino, Adnan Khattak, Tarek Meniawy, George Ansstas, et. al.. (2024). Individualised neoantigen therapy mRNA-4157 (V940) plus pembrolizumab versus pembrolizumab monotherapy in resected melanoma (KEYNOTE-942): a randomised, phase 2b study. The Lancet. 403, 632-644;
- Justin F Gainor, Manish R Patel, Jeffrey Weber, Martin Gutierrez, Julie E Bauman, et. al.. (2023). 1530 T-cell responses to individualized neoantigen therapy (INT) mRNA-4157 (V940) as monotherapy or in combination with pembrolizumab. Late-Breaking Abstracts.