Как первые российские CAR-T-клетки с опухолью боролись
08 марта 2024
Как первые российские CAR-T-клетки с опухолью боролись
- 3836
- 0
- 3
Героиня нашего интервью — Аполлинария Боголюбова-Кузнецова — рассказывает об инновационном лечении опухолей крови.
Рисунок в полном размере.
-
Автор
-
Редакторы
В феврале 2024 года в Москве прошел Форум будущих технологий (читайте наш пост-релиз), на котором среди биотехнологических и биомедицинских достижений российских ученых была представлена работа по созданию первого российского CAR-T-клеточного препарата для лечения онкологических заболеваний, направленного против CD19+ В-лимфоцитов. Мы поговорили с руководителем проекта, заведующей лабораторией трансплантационной иммунологии ФГБУ «НМИЦ гематологии» Минздрава России Аполлинарией Боголюбовой-Кузнецовой о том, как вообще возникла эта идея, что позволило команде с по сути космической скоростью создать работающий препарат в условиях постоянных ограничений и ухода с рынка многих компаний, а также о мечтах и реальных планах на ближайшее будущее.
Т-клетки, экспрессирующие химерный антигенный рецептор (Chimeric Antigen Receptor — CAR), за последние годы показали впечатляющую эффективность в борьбе с В-клеточными злокачественными новообразованиями и множественной миеломой. Идея технологии CAR-T-клеток состоит в том, чтобы взять собственные T-клетки пациента, генетически модифицировать их так, чтобы они научились распознавать при помощи CAR антиген на поверхности опухолевых клеток и прицельно убивать их после повторного введения в организм (рис. 1). Самая распространенная технология модификация Т-клеток — это трансфекция ленти- или ретровирусом [1], который несет последовательность химерного антигенного рецептора. Его внешняя часть, как правило, представляет собой фрагмент антитела, которое, собственно, и будет распознавать антиген на поверхности опухолевой клетки — например, CD19 на В-клетках.
Подробнее об этой технологии можно прочесть в наших предыдущих публикациях: «CAR-T-клетки, получаемые in situ (in vivo), — путь к удешевлению и широкодоступности технологии?» [2], «Способны ли CAR-Т-клетки уничтожить опухоль?» [3] и «Клетки, которые лечат людей» [4].
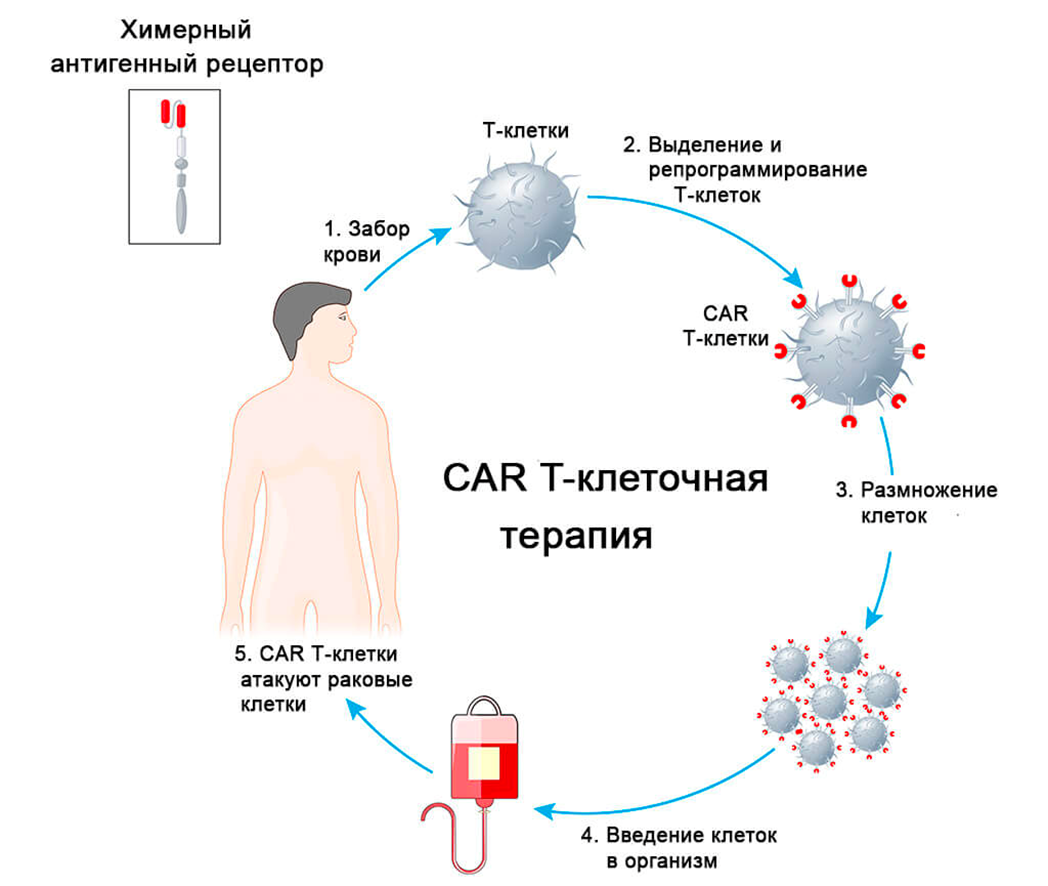
Рисунок 1. Этапы CAR-Т-терапии. Для создания аутологичного CAR-T препарата сначала у пациента берут кровь, из которой выделяют его собственные Т-лимфоциты. Затем полученные клетки активируют (например, антителами против корецепторов CD3 и CD28), после чего трансфицируют вирусом, несущим закодированную последовательность CAR — с этого момент клетки-убийцы получают возможность выслеживать онкологию. Вслед за этим нужно нарастить необходимое количество CAR-Т-клеток и протестировать их безопасность и работоспособность. Наконец, готовый CAR-T препарат можно вводить обратно пациенту: уже прямо в его крови это «живое лекарство» будет само размножаться и уничтожать злокачественные клетки.
Одним из важнейших условий применения этого «умного лекарства» является, конечно, безопасность для человека — потенциальная польза всегда должна сопоставляться с возможным вредом. Идеальный антиген — мишень для атаки CAR-T-клеток — должен экспрессироваться в достаточном количестве на опухолевых клетках и желательно — только на них. Правда, такое требование едва ли выполнимо — дело в том, что опухолевые клетки очень похожи на нормальные по составу антигенов, поскольку именно от нормальных и происходят. Так что если высокая специфичность недостижима — можно ограничиться требованием, чтобы удаление всех клеток, несущих выбранный антиген, не было для пациента фатальным: ведь если целевые антигены обнаружатся и на здоровых клетках, то атака будет нацелена и на них. Например, антиген CD19 маркирует все зрелые В-клетки человека: и здоровые, и опухолевые; однако если речь идет о спасении жизни — B-клеточным звеном на время можно и пожертвовать.
Трансмембранный и внутриклеточный домены CAR важны для запуска активирующего сигнального каскада в Т-лимфоците. Также, помимо костимуляторного и сигнального доменов могут быть использованы домены, обеспечивающие выживаемость самой CAR-T-клетки, например, запускающие экспрессию цитокинов, необходимых для ее функционирования.
От взаимодействия CAR-T-клетки и антигена зависят эффективность убийства опухолевой клетки и пролиферация самой CAR-T-клетки. К сожалению, опухолевые клетки пытаются избежать гибели, ускользая от CAR-Т — например, снижая экспрессию антигенов или видоизменяя их вследствие мутаций. В результате такого ускользания часть опухолевой популяции выживет, и возникнет рецидив. Чтобы избежать таких проблем, врачи комбинируют разные варианты терапии в расчете на то, чтобы «прихлопнуть» максимум онкологических бунтовщиков. Вообще, поиск эффективных опухолевых антигенов-мишеней — непростая задача. Но современные технологии, в том числе секвенирование отдельных клеток [5], приходят на помощь.
Есть и другие проблемы, с которыми сталкивается медицинская наука в этой области: например, прямая зависимость «предлеченности» клеток пациента и дальнейшей эффективности полученного из них CAR-T-клеточного продукта, не говоря уже о дороговизне такого лечения.
В 2017 году агентство FDA одобрило несколько CAR-T препаратов, после чего они постепенно вошли в практику, и сейчас в США и Европе применяются практически уже рутинно. Индустрия производства и рынок CAR-T активно развиваются в этих странах всё это время. Настало время и для нас! Отрадно, что творческие умы российских ученых талантливо преодолевают различные возникающие препятствия, что приводит к созданию новых технологий — а именно, первого российского CAR-T-клеточного препарата.
Мне посчастливилось сначала побывать на Форуме будущих технологий (читайте впечатления здесь [6]), а затем и лично пообщаться с руководителем проекта по созданию российских CAR-T-клеток, заведующей лабораторией трансплантационной иммунологии ФГБУ «НМИЦ гематологии» Минздрава России — Аполлинарией Боголюбовой-Кузнецовой, с которой мы в разное время закончили кафедру иммунологии биофака МГУ им. М.В. Ломоносова. Интерес и любовь к биологии и иммунологии когда-то привели нас в «Биомолекулу», в которой Полина выступает автором и редактором уже многие годы. Мы поговорили о том, как возникла эта идея, что позволило команде с практически космической скоростью создать работающий препарат в условиях постоянных ограничений и ухода с рынка многих компаний, и о мечтах и реальных планах на ближайшее будущее.
— Полина, как и когда вообще возникла идея создания собственного российского клеточного препарата CAR-T?
Вообще эта идея появилась уже давно. Еще в 2021 году директор нашего Центра академик В.Г. Савченко (российский гематолог, профессор, академик РАН) с предыдущим руководителем лаборатории Григорием Ефимовым обсуждали, что пора бы начать работу по созданию CAR-Т здесь, в России. Какое-то время эта мысль просто бродила, но проект не был в приоритете, в том числе поскольку основная деятельность была направлена на исследование новой коронавирусной инфекции SARS-CoV-2. Кроме того, в центре имени Дмитрия Рогачева были последовательно запущены два клинических исследования анти-CD19 CAR-T-клеточного лекарственного препарата от компании Miltenyi Biotec (Германия) — производство клеточного продукта проводилось автоматически в закрытом контуре прибора CliniMACS Prodigy, что называется «под ключ». Однако после февраля 2022 года компания Miltenyi Biotec ушла с российского рынка, и стало понятно, что наша страна теперь оторвана от этой технологии и от возможностей производства этого CAR-T-клеточного препарата. Собственно, с этого момента руководство центра поставило задачу создания российского анти-CD19 CAR-T как приоритетную, и мы стали думать, как можно его разработать и производить в отсутствие, пожалуй, самой удобной технологической платформы и расходников к ней.
— Можешь немного рассказать о том, как вы перестроились, с какими сложностями столкнулись?
Наша технологическая линейка собрана из доступных вариантов приборов разных стран (Китай, США, Европа), которые позволяют выполнять стадии производства клеточного препарата в закрытом корпусе. Довольно много времени ушло на подбор приборов, расходников, реактивов и условий для производства. Но сейчас всё налажено и работает, как надо. Наш опытно-производственный отдел клеточной терапии работает по стандартам GMP.
— Если бы появилась возможность, вы бы вернулись на технологию Miltenyi Biotec?
Сейчас, после того как мы прошли этот путь, я сомневаюсь, что мы бы на это пошли. В наших руках наша технологическая линейка отлично работает, мы получаем клеточный препарат достойного качества и по меньшей себестоимости по сравнению с решением от Miltenyi Biotec.
— Что сейчас есть на российском рынке для вашей технологии? Есть какие-то подвижки?
По части приборов пока, к сожалению, ничего нет. А вот часть расходных материалов и реактивов мы используем от российских производителей. Мы очень плотно общаемся с поставщиками и находимся в постоянном поиске оптимальных решений.
— Можешь примерно оценить изменение стоимости, скорости, сложности производства в связи с переорганизацией процесса?
Так сразу в совокупности сложно оценить. С одной стороны, собственно система Miltenyi Biotec и все расходники для нее очень дорогие. Но это очень хорошо продуманная технология, как я уже сказала, «под ключ», с минимальным влиянием человеческого фактора и связанных с этим ошибок производства. Наша система точно дешевле по использующимся материалам, но требует вовлечения большего числа людей, что несколько усложняет процесс. Однако мы его уже отладили, поэтому надеемся, что и с увеличением объемов производства неприятных сюрпризов не станет больше. То, что я могу сказать точно — стоимость препарата для пациентов будет намного ниже, чем у зарегистрированных в Европе и США.
— Ты понимаешь, как может оплачиваться такое лечение?
Это большой вопрос на будущее. Всё равно CAR-T-клеточная терапия является очень дорогой опцией лечения, но уже говорят о возможном включении ее в перечень высокотехнологической медицинской помощи. Также возможна оплата этой терапии благотворительными фондами. Мы уже сейчас обсуждаем такую опцию с Фондом борьбы с лейкемией.
— На какой стадии сейчас находится разработка?
Мы провели все доклинические исследования как in vitro, так и in vivo с использованием супериммунодефицитных мышей. Исследования in vivo для нашего препарата были проведены в центре Раисы Горбачевой и виварии центра Алмазова в Санкт-Петербурге. Сейчас в Минздрав подана заявка на разрешение официального клинического исследования эффективности, переносимости и безопасности нашего анти-CD19 CAR-T. Мы планируем начать его в этом году и хотим, чтобы препарат далее прошел так называемую условную регистрацию по результатам 1/2 фазы клинического исследования.
— Против каких вообще опухолей можно будет использовать данный препарат? На каких стадиях?
Мы создаем CAR-T препарат с рецептором против клеток, несущих CD19, т.е. практически всех В-лимфоцитов. Он направлен против В-клеточного острого лимфобластного лейкоза и различных неходжкинских лимфом. Если говорить о стадиях, то вообще сейчас CAR-T применяют для тех, у кого нет других вариантов, т.е. это третья и следующие линии терапии. Но нужно понимать, что эффективность зависит от степени предлечения, поэтому мы сейчас уже понимаем, что эффективнее будет начинать такую терапию с более раннего этапа лечения.
— От чего вообще зависит эффективность лечения?
Вообще на это влияет довольно много факторов. Поскольку это клеточный препарат, очень многое зависит от его качества, которое, в свою очередь, зависит не только от факторов производства, но и от изначальных показателей клеток пациента, которые должны «превратиться» в CAR-T. Трендом последнего времени в клеточной терапии является попытка вписать лечение CAR-T-клеточным лекарственным препаратом в общую стратегию лечения каждого конкретного пациента. Какую терапию он получал до CAR-T? Что с ним будет дальше? Скажем, мы хотим просто достичь полной ремиссии и провести трансплантацию аллогенных гемопоэтических стволовых клеток, полностью «перезагрузив» иммунную систему, или же опции трансплантации нет, и пациент надеется выйти в долговременную ремиссию именно благодаря CAR-T. Также мы должны понимать и генетические особенности пациента. Скажем, в случае наличия мутаций в гене опухолевого супрессора р53 пациентам CAR-T-клеточную терапию следует выполнять на более ранних этапах лечения.
Поскольку моя лаборатория (рис. 2) находится в медицинском исследовательском центре, мы неразрывно связаны с врачами и стремимся создать действительно персонифицированную клеточную терапию, вовлекая в диалог и клинические, и научные, и производственные отделения.
— Можешь объяснить, в чем отличие вашего препарата и вообще CAR-T-препаратов от, например, моноклонального антитела ритуксимаба , тоже направленного на уничтожение В-клеток? Корректно ли вообще говорить о том, что эффективнее?
Это, конечно, совсем разные препараты. В то же время, прямых исследований по сравнению эффективности клеточной терапии и терапий с использованием моноклональных антител (как моноспецифичных — скажем, ритуксимаба, — так и биспецификов ) нет. Стоит помнить, что CAR-T — это клеточный препарат, он более комплексно влияет на опухоль, чем антитело. На данный момент в мировой медицине главенствующее мнение, что биспецифические моноклональные антитела должны применяться в случае рецидива после CAR-T-клеточной терапии, а не а не перед ней .
Ритуксимаб, в отличие от цельной клетки, которую представляет собой CAR-T, это отдельная молекула — антитело. Как лечат антителами и что именно делает ритуксимаб, можно прочесть в статьях «Биомолекулы»: «Таргетная терапия — прицельный удар по болезни» [7], «Краткая история открытия и применения антител» [8] и «Терапевтические моноклональные антитела» [9].
Нюансы строения и применения таких антител разобраны в публикациях: «Разработка биспецифических антител для применения в клинике» [10] и «Биспецифические антитела, их мишени и перспективы применения в современной медицине» [11].
— Вы сделали препарат в довольно короткие сроки. Как вообще организована работа в лаборатории, что позволяет повышать эффективность и скорость?
У нас очень молодой, активный и мотивированный коллектив, средний возраст около 25 лет. Я считаю очень важным, чтобы каждый сотрудник понимал важность результата своей работы и мог оценить свой вклад в достижение цели. Тогда он чувствует ответственность за свою работу, видит, как это продвигает наш проект, и это вдохновляет. Плюс, для меня важно, чтобы наш успех был отмечен, причем не мой успех как руководителя, а именно наш общий успех как коллектива. Например, в сентябре 2023 года была конференция памяти В. Г. Савченко, на которой всему коллективу лаборатории вручили диплом за нашу разработку. Кроме того, я искренне считаю, что хорошие сотрудники (а у меня в коллективе других и нет) обязаны получать достойную оплату своего труда — и слежу за этим.
В плане собственно организации проектов у нас всё системно. Введена удобная система подсчета расходников и реактивов, их заказа, не нужно тратить на это лишнее время. Мы проводим еженедельные семинары по каждому из направлений, обсуждаем, что сделано и что делаем дальше. Роли в команде четко распределены, каждый занимается своей частью проекта, поэтому мы можем позволить себе локально проверить несколько гипотез и выбрать наиболее успешную, а что не пошло — оставить в стороне и вернуться к задаче позже. Если времени мало, а внутри коллектива нет каких-то ключевых компетенций для решения задачи, то мы ищем узкого специалиста (кстати, нередко среди сообщества «Биомолекулы»!) и берем его на работу в коллектив. В Центре создана атмосфера творческой работы, это настоящая команда. Здесь живут и работают единомышленники: врачи, гематологи, реаниматологи, ученые, биологи при полной поддержке, помощи и сопровождении администрации. Мы всегда доносим ценность нашей работы до всех сотрудников, приглашаем на экскурсию к нам в лабораторию, показываем, как всё устроено и что, собственно, делаем, чтобы сотрудники, которые занимаются сопровождением и обеспечением ненаучной части проекта (например, из бухгалтерии или отделов снабжения) понимали, для чего всё это делается. Что за этим стоят реальные пациенты, их история борьбы с болезнью и надежда на выздоровление.
— Какое финансирование вы используете для обеспечения проекта?
Проект по созданию анти-CD19 CAR-T был инициирован внутри центра без внешнего финансирования. Проведение клинических исследований стало возможным благодаря НИОКР, а работы по оптимизации технологического процесса производства клеточного препарата помог обеспечить расходными материалами и оборудованием Центр перспективных междисциплинарных исследований «Идея».
— В интервью на «Дзене» ты сказала, что сейчас строится научно-производственный корпус по клеточной терапии, рассчитанный на производство примерно 500 препаратов в год. А какая вообще потребность в России?
Существует подсчет онкогематологических заболеваний в онкологическом регистре под редакцией А.Д. Каприна, но там многие нозологии не разделены между собой. Если мы говорим о В-клеточных злокачественных новообразованиях, резистентных к второй и последующим линиям терапии, то это около 500–700 человек в год. При переходе к терапии на более ранние этапы количество пациентов, которым может быть проведена CAR-T-клеточная терапия, сильно увеличивается.
— В таком случае, есть ли возможность масштабировать производство, и как обстоят дела с пациентами из остальных регионов, ведь центр находится в Москве?
Сейчас у нас открыт лишь пилотный производственный участок, возможность масштабирования заложена в новом корпусе. Когда препарат пройдет условную регистрацию, НМИЦ гематологии сможет производить его для пациентов со всей страны, при этом введение препарата в организм пациента будет осуществляться в месте его лечения. Для того, чтобы лечение проходило штатно, необходима серьезная подготовка врачей на местах. Поэтому Центр планирует организацию программ по обучению врачей, как правильно вводить препарат, как вести пациентов, как отслеживать побочные эффекты и т.д.
— Как ты вообще оцениваешь, насколько принципиально применение таких препаратов меняет степень излечения и выживаемость пациентов?
Когда я была маленькой, фраза «рак крови» звучала как приговор. С того времени ландшафт оказания онкогематологической помощи совершенно изменился. При грамотной и последовательной терапии для некоторых нозологий 5-летняя выживаемость за 10 последних лет увеличилась с 30% до 80%! Вообще, моя голубая мечта — сделать так, чтобы клеточная терапия воспринималась не как что-то уникальное и сверхъестественное, а как рутина, как одна из эффективных опций для лечения онкогематологических пациентов.
— И, наконец, последний вопрос: какие планы на будущее, есть ли что-то похожее в разработке?
Да, сейчас мы разрабатываем CAR-T-клеточные препараты для терапии других типов злокачественных новообразований крови, но называть их пока рано.
Литература
- Лентивирусные векторы: как они стали лучшими векторами для терапии ex vivo;
- CAR-T-клетки, получаемые in situ (in vivo), — путь к удешевлению и широкодоступности технологии?;
- Способны ли CAR-Т-клетки уничтожить опухоль?;
- Клетки, которые лечат людей;
- Одноклеточное секвенирование: разделяй, изучай и властвуй;
- Итоги работы Форума будущих технологий-2024;
- Таргетная терапия — прицельный удар по болезни;
- Краткая история открытия и применения антител;
- Терапевтические моноклональные антитела;
- Разработка биспецифических антител для применения в клинике;
- Биспецифические антитела, их мишени и перспективы применения в современной медицине.