Технологии изучения клеточных механизмов памяти
18 апреля 2016
Технологии изучения клеточных механизмов памяти
- 5041
- 1
- 8
Использование генно-инженерных инструментов получило распространение в нейробиологии в последние два десятилетия и ознаменовало выход этой науки на качественно новый уровень. Генно-инженерные инструменты позволяют исследовать практически все аспекты развития и функционирования нервной системы, включая обработку информации в нейронных сетях, ведь не иначе как через гены запускаются те молекулярные и клеточные механизмы, которые осуществляют постройку нейронных сетей и управление ими. Научившись операциям с генами, мы получаем возможность следить за внутренней работой клеток и внутрисетевыми межклеточными взаимодействиями.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Фундамент учения дуализма серьезно пошатнулся еще во второй половине XIX века наблюдением за отклонениями психической деятельности у людей с повреждениями специфических областей коры головного мозга, а окончательно превратился в руины к середине XX века с первыми успешными опытами нейрохирургии. Однако по-настоящему прикоснуться к материальному субстрату высших психических функций позволил XXI век, принесший небывалый прогресс в разработке технологий для исследования клеточных механизмов высшей нервной деятельности. В статье предлагается краткий обзор технологий исследования долговременной памяти, основанных на современных достижениях генной инженерии. Речь пойдет о методиках визуализации нейронных сетей памяти и манипулирования ими с использованием явления активностно-зависимой генной экспрессии.
«Био/мол/текст»-2016
Эта работа опубликована в номинации «Своя работа» конкурса «био/мол/текст»-2016.

Спонсор номинации — Future Biotech, проект, объединяющий профессионалов и энтузиастов в области биологии и биотехнологий.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
Спонсор публикации этой статьи — Илья Флямер.
В исполнение многих психических функций вовлекаются нейроны, занимающие вполне конкретное место в коре больших полушарий (см., например, поля Бродмана). По-другому обстоят дела с организацией функции памяти. Вероятно, запоминаемая информация сохраняется там же, где происходит ее первичная обработка . Например, лицо Моны Лизы у вас «покоится» где-то в зрительной коре, шерсть вашей собаки на ощупь — в соматосенсорной, и так далее. Соответственно, память на события, которые всегда подразумевают разнородность поступающей информации, будет сохраняться в нейронах, диффузно разбросанных по всей коре.
Не все клетки, задействованные в обработке информации, впоследствии участвуют в хранении памяти [1].
Генетическая память — фундамент памяти нервной
Если возбуждение нейронов, активировавшихся при восприятии нами информации из внешней среды, поддерживается длительно, то сигнал доходит до их ядер и запускает экспрессию определенных генов. Ранее связанные друг с другом не более, чем с соседними нейронами, теперь они начинают менять свой рост и метаболизм в направлении усиления связи друг с другом. В результате мы получаем стойкое повышение проводимости между этими нейронами, что делает возможным вспоминание — узор распространения возбуждения, повторяющий исходный. Таков в общих чертах процесс формирования нейронной сети памяти .
Здесь и далее речь идет о долговременной памяти. В случае кратковременной памяти нейронная сеть держится на обратимых изменениях проводимости и существует лишь пока по ней циркулирует возбуждение: активность клеток поддерживается не так долго, чтобы сигнал дошел до ядра и вызвал экспрессию ранее молчавших генов, а с ней — соответствующие необратимые структурные и химические изменения проводимости [2].
Немедленные ранние гены
Выходит, что ключевым для формирования памяти является запуск экспрессии ранее «молчавших» генов. Первой в клетке активируется группа генов, экспрессия которых не нуждается в синтезе новых белков, как это обыкновенно бывает, а основана на механизмах, заранее готовых для восприятия сигналов [3]. Это группа так называемых немедленных ранних генов (c-fos, Zif268, Arc и другие [4]). Уникальное свойство этих генов заключается в том, что их активация вызывает резкий и кратковременный скачок концентрации их продуктов (мРНК и белков, многие из которых стимулируют транскрипцию других генов) [3]. Таким образом, по их мРНК и белкам можно идентифицировать популяцию нейронов, вовлекшихся в запоминание, — нужно лишь успеть это сделать.
Интересно, что немедленные ранние гены активируются не только при первичном формировании памяти, но и при ее воспроизведении. То есть для идентификации с помощью их продуктов память не обязательно должна быть новоприобретенной. То обстоятельство, что ранние гены активируются при воспроизведении памяти, означает, что последнее по своей природе активно: во время него структура нейронной сети обновляется и модифицируется [5]. Подобные процессы клеточного уровня легко сопоставить с их коррелятами на поведенческом уровне — например, процессом перехода неприятного воспоминания в психическую травму, когда при каждом воспроизведении оно обрастает вымышленными «ужасами», а также обратного процесса, когда на сеансах психотерапии добиваются извлечения и «обезвреживания» травмирующего воспоминания.
Как увидеть память
Итак, экспрессия многих генов зависит от нейронной активности, соответственно, этот феномен получил название активностно-зависимой генной экспрессии. А само его существование означает, что в исследовании памяти можно достичь клеточного разрешения. Нейроны, хранящие память, можно «проявить», то есть провести нейроимиджинг. Для этого сначала нужно создать у экспериментального объекта воспоминание, с которым, собственно, мы будем работать. Классическим объектом является лабораторная мышь. Животное «по просьбе» исследователей приобретает какой-либо опыт: воспринимает, например, незнакомую обстановку, звук или запах. В это время в его мозге активируется некая популяция нейронов. Однако, чтобы этот опыт отложился в памяти, он должен быть достаточно значимым для мыши (ведь и мы запоминаем далеко не всё, что с нами происходит). Надежней всего придать ему значение опасности, и классический способ это сделать — в ходе эпизода опыта ударить мышь слабым электрическим током. И вуаля — активировавшаяся популяция нейронов гарантированно сохраняет информацию о новых обстановке, звуке или запахе. Эта популяция будет субстратом для имиджинга.
Используем то, что есть
Иммуногистохимический метод имиджинга основан на заповедной иммунореакции антиген—антитело. Срезы мозга животного, убитого вскоре после приобретения памяти, обрабатываем сывороткой, содержащей антитела. В качестве антигена, который они свяжут, выступает белок — продукт экспрессии немедленного раннего гена. Антитело конъюгировано (соединено) с меткой (флуоресцентной либо с ферментом, после пары манипуляций тоже дающим цветную реакцию), которую будем регистрировать с помощью микроскопа (рис. 1). Между белком-антигеном и меченым антителом обычно «встраивают» несколько видов промежуточных антител — для усиления чувствительности [13], — впрочем, сущности метода это не меняет.
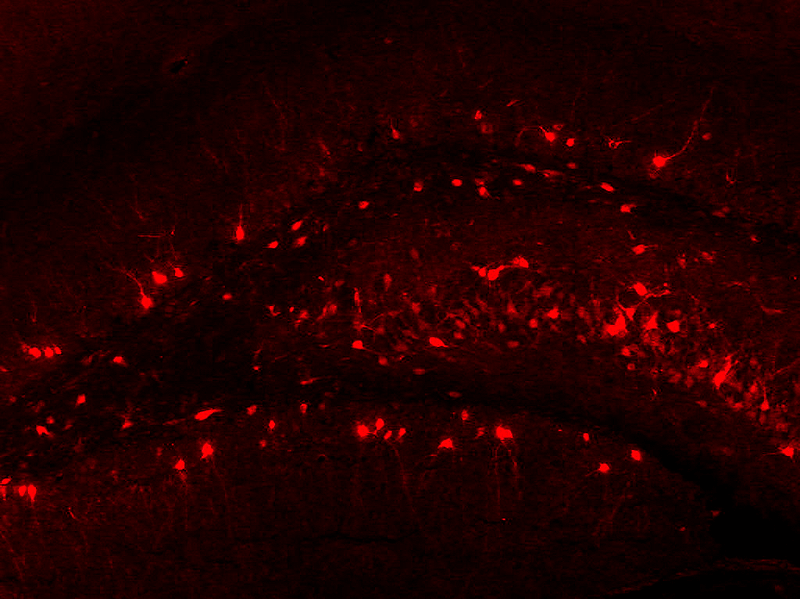
Рисунок 1. Иммуногистохимическое выявление белка Arc в зубчатой извилине крысы.
Другой метод основан на выявлении мРНК немедленных ранних генов. Конструируются специальные молекулярные зонды, которые при нанесении на исследуемый образец мозга соединяются с мРНК по принципу комплементарности, но кроме того несут собственно метку, по которой мы мРНК обнаружим. Метка может быть флуоресцентной или требовать дополнительной процедуры окрашивания. Описанный метод называется FISH (fluorescence in situ hybridization). Он, однако, был доработан специально для целей нейробиологии и приспособлен под выявление в одном образце мозга двух популяций нейронов, активированных двумя различными эпизодами опыта, произошедшими с разницей в небольшой промежуток времени (около 30 минут). Такую модификацию метода назвали cellular compartment analysis of temporal activity by FISH, или просто catFISH [14]. Сигнал от двух популяций реально идентифицировать благодаря тому, что немедленные ранние гены характеризуются очень мощной экспрессией в момент активации при почти полном фоновом (вне эпизодов нового опыта) «молчании» [3].
Такие метки представляют собой флуоресцентные белки. Об их многообразии и применении в биологических исследованиях рассказывают статьи: «Флуоресцирующая Нобелевская премия по химии» [15], «Флуоресцентные белки: разнообразнее, чем вы думали!» [16], «Флуоресцентные репортеры и их молекулярные репортажи» [17]. — Ред.
Собственно имиджинг сводится к выявлению в образце двух форм мРНК: ядерной (незрелой), начинающей накапливаться в нейронах через две минуты после активации, и цитоплазматической (зрелой), образующейся из ядерной через 30 минут после активации. Таким образом, по цитоплазматической мРНК мы определяем популяцию клеток, активированную первым эпизодом опыта, а по ядерной — вторым. Поскольку бо́льшая часть ядерной мРНК исчезает, переходя в зрелую цитоплазматическую форму в течение 20 минут после активации клетки, ее сохранение со времен первого эпизода незначительно; ядерная мРНК от второго эпизода и вовсе не успевает перейти в цитоплазматическую форму [14].
В классической методике форму мРНК (ядерная она или цитоплазматическая?) определяют с помощью прямой оценки пространственной локализации (рис. 2), но уже практикуется использование двух зондов, каждый из которых специфичен к одной из форм мРНК и конъюгирован с уникальной меткой. После окрашивания метки дают разный цвет, по которому становится понятна локализация [18], [19].
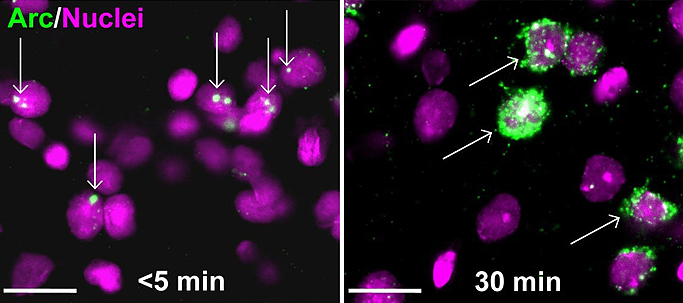
Рисунок 2. Прямая оценка пространственной локализации Arc-мРНК в методе catFISH. Слева — После активации нейронов Arc-мРНК локализуется в ядре. Справа — Через 30 минут мРНК перемещается за пределы ядра.
Доделываем то, что нужно
Вот и пришло время поговорить о ГМО. Речь пойдет о бутербродах из макдо трансгенных мышах.
Стόит пояснить, что кроме кодирующего участка (экзона) ген имеет и регуляторные, среди которых особенно важен промотор — участок, ответственный за запуск считывания гена (транскрипции). В случае отсутствия промотора транскрипция не запустится, а вот без «родного» экзона (например, если мы его вырежем и вставим другой) транскрипция будет возможна, причем синтезироваться будет, понятно, продукт, кодируемый вставленным нами экзоном. Эту возможность и используют биологи, подставляя под промоторы немедленных ранних генов то, что им выгодно.
Они получают мышь, несущую в ДНК трансген, в котором под промотором немедленного раннего гена находится экзон тетрациклинового активатора транскрипции, tTA (рис. 3). Продукт экспрессии этого трансгена — белок tTA — связывается с тетрациклин-откликающимся элементом (tetO) в составе второго трансгена, имеющегося у мыши, тем самым активируя его транскрипцию [20]. Продукты экспрессии второго трансгена — это специально разработанная для целей нейробиологии форма фермента β-галактозидазы (tau-LacZ), выступающая в качестве метки [21], а также автономная форма тетрациклинового активатора транскрипции (tTA*). Антибиотик доксициклин (производное тетрациклина) связывает белок tTA и блокирует его активирующее действие на второй трансген. Устранение же доксициклина приводит к активации трансгена и к синтезу tau-LacZ и tTA*, причем tTA* имеет положительную обратную связь, порождающую перманентное производство tau-LacZ и tTA* даже после возвращения доксициклина в систему. Такие трансгенные мыши всю жизнь держатся на доксициклиновой диете, а во время эксперимента антибиотик отменяется, что позволяет нарабатываться метке [20].
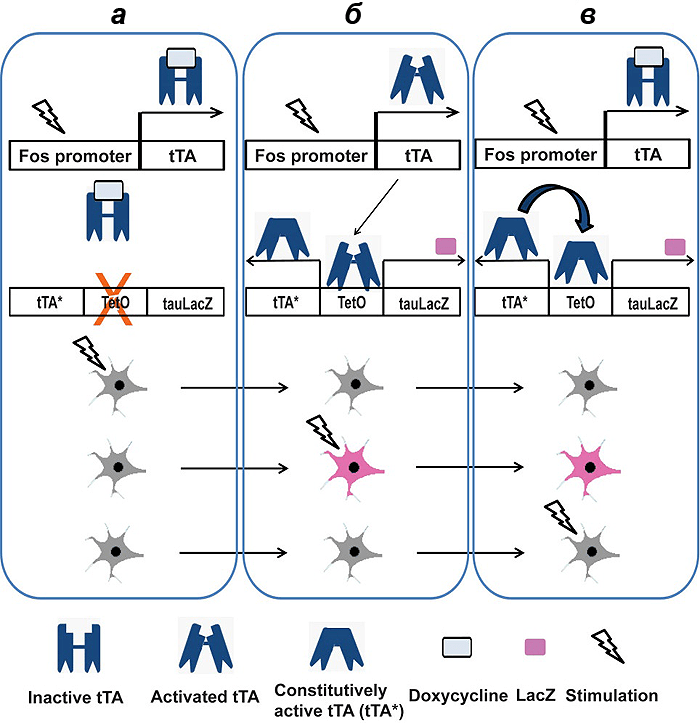
Рисунок 3. Использование трансактивационной системы tTA-tetO для активностно-зависимого мечения нейронов. а — tTA синтезируется избирательно в нейронах, в которых активировался промотор c-fos. Однако доксициклин связывает tTA и предотвращает его взаимодействие с tetO. б — После отмены доксициклина tTA от него освобождается и связывается с tetO, индуцируя синтез tau-LacZ и tTA*. в — После возвращения доксициклина tTA снова инактивируется, но так как tTA* всё еще присутствует, он по принципу положительной обратной связи поддерживает активность tetO.
Получается, что именно метка в конечном счете находится под контролем промотора немедленного раннего гена, а вспомогательная система tTA-tetO делает возможным мечение не всех клеток, в которых на протяжении жизни животного сработали немедленные ранние гены, а только тех, в которых они сработали во время нашего эксперимента (то есть сохранивших память о конкретном эпизоде опыта). Проявляется метка посредством цветной ферментативной реакции со своим специфическим субстратом, которым мы обрабатываем образцы мозга. Подобно catFISH, мы можем использовать методику и для выявления двух популяций нейронов, активированных различными эпизодами опыта. Но поскольку метка сохраняется в клетках длительно (из-за автономной активности tTA*), велика верхняя граница времени, на которое могут быть разнесены эпизоды, тогда как в случае catFISH это время может лишь немного отличаться от 30 минут [22]. Важно здесь другое: второй эпизод должен произойти непосредственно перед убоем, так как относящуюся к нему популяцию нейронов мы будем выявлять по иммунологическим реакциям с белком немедленных ранних генов , который, как мы помним, сохраняется кратковременно. Описанная методика двойного выявления носит название TetTag (рис. 4).
У зрящего в самую суть читателя мог возникнуть вопрос, как мы собираемся обнаружить белок немедленного гена, если его смысловой участок мы заменили последовательностью, кодирующей tTA, сохранив только промотор. Вспомним, что животные имеют двойной набор хромосом. Так вот, трансгенез производится только в одной хромосоме, а со второй синтезируется нормальный (нативный) белок.
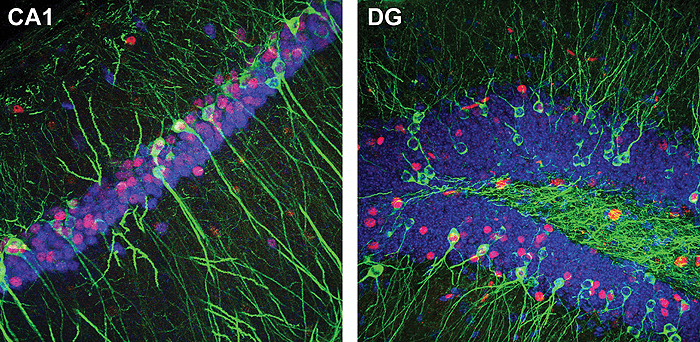
Рисунок 4. Выявление двух популяций нейронов в гиппокампе мыши с помощью методики TetTag. Зеленым окрашен tau-LacZ, красным — белок немедленных ранних генов (слева — c-fos, справа — Zif268).
Давайте теперь посмотрим на другую мышь. У нее есть трансген, в котором под промотором немедленного раннего гена находится экзон тамоксифен-зависимой рекомбиназы Cre (CreERT2), и есть другой трансген, состоящий из синтетического промотора (CAG), экзона красного флуоресцентного белка (tdTomato) и разделяющей их стоп-последовательности, ограниченной с обеих сторон короткими loxP-участками. Активация первого трансгена приводит к синтезу Cre-рекомбиназы. В отсутствие лекарственного вещества тамоксифена этот фермент плавает в цитоплазме, в то время как взаимодействие с тамоксифеном позволяет ему проникать в ядро и производить рекомбинацию. Под рекомбинацией здесь понимается процесс, в ходе которого этот фермент распознает loxP-сайты и вырезает (удаляет) ограниченный ими участок (стоп-последовательность), «разрешая» экспрессию стоящего далее экзона (tdTomato) [22], [23]. Таким образом, если во время эксперимента сделать мыши инъекцию тамоксифена, можно запустить наработку красного флуоресцентного белка, опосредованную активацией немедленного раннего гена. Нейроны, вовлекшиеся в сохранение воспоминания, будут флуоресцировать под действием посылаемого в них микроскопом лазерного луча (рис. 5).
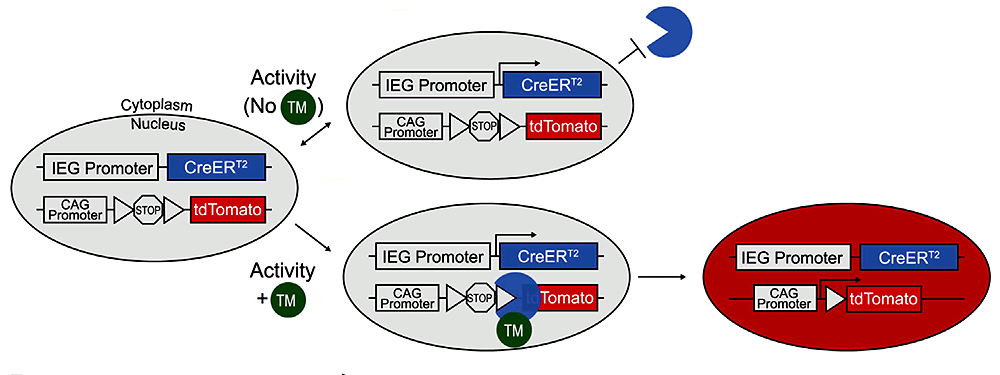
Рисунок 5. Использование рекомбинационной системы Cre/loxP для активностно-зависимого мечения нейронов. Вверху — Рекомбиназа Cre, произведенная в нейронах с активировавшимся промотором IEG (immediate early gene), без тамоксифена не может попасть в ядро клетки, так что рекомбинации не происходит. Внизу — Введение тамоксифена вызывает рекомбинацию в активных клетках (тогда как неактивные остаются нетронутыми, потому что и вовсе не экспрессируют ген Cre-рекомбиназы). Запускается наработка красного флуоресцентного белка.
Между прочим, посмотреть выявленную нейронную сеть можно прямо на живом животном! Для этого можно зафиксировать его голову под объективом, а можно использовать специальные регистрирующие модули, закрепляемые на голове свободноподвижных животных и соединяющиеся с массивными элементами микроскопа через оптоволокно (рис. 6). Такие технологии позволяют проводить достаточно длительный мониторинг интенсивности флуоресценции клеток (то есть накопления белка, участвующего в формировании памяти). Флуоресцентная метка сохраняется в клетке если не навсегда, то по крайней мере неопределенно долго, а значит, мы снова можем выявлять популяции нейронов, активированные двумя значительно разнесенными эпизодами опыта. При этом верхняя граница времени их разнесения неопределенно велика, нижняя же зависит от времени наработки метки (для красного флуоресцентного белка примерно три дня) [22].
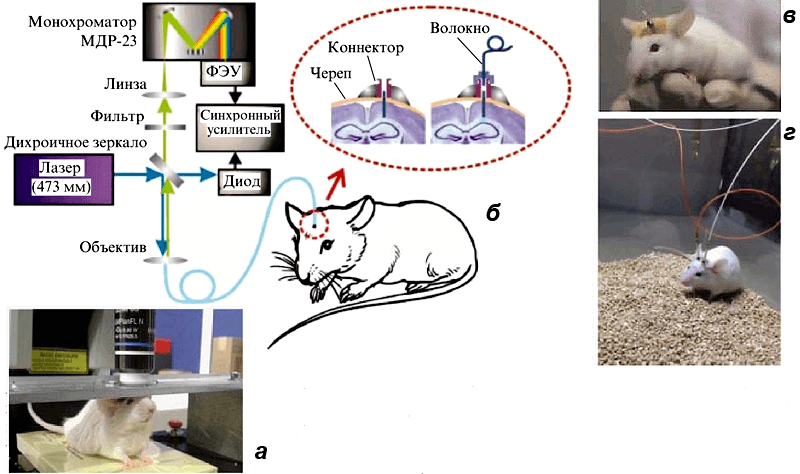
Рисунок 6. Технологии для нейробиологических исследований на живых животных. а — Стационарный микроскоп. б — Волоконно-оптический нейроинтерфейс. в — Мышь со вживленным модулем нейроинтерфейса. г — Мышь с присоединенной световодной частью.
Описанная методика двойного выявления с использованием флуоресцентного белка называется TRAP (targeted recombination in active population). У TRAP есть преимущества перед TetTag, появляющиеся из-за различного характера зависимости систем tTA-tetO и Cre/loxP от фармпрепаратов. Прекращением подачи доксициклина или введением тамоксифена мы активируем систему на определенный отрезок времени. Все нейроны, проявившие активность в пределах этого времени, будут перманентно помечены. Для системы TetTag чувствительное временнόе окно велико: максимальная экспрессия метки развивается лишь через две недели после прекращения введения доксициклина [22]. Это неудобно и требует дополнительных усилий, чтобы по возможности предотвратить мечение нейронов, активность которых попала в чувствительное временное окно, но не относилась к самому эксперименту. Для системы TRAP «махинации» с фармпрепаратом позволяют делать окна шириной приблизительно 10 либо 40 часов [22]. В обоих случаях это значительно меньше, чем для системы TetTag, но в то же время достаточно для экспериментов, в которых может требоваться интеграция активности нейронов на протяжении какого-то промежутка времени (рис. 7).
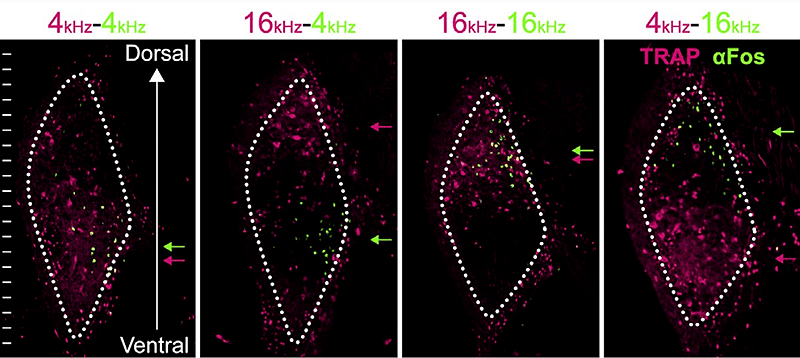
Рисунок 7. Выявление двух популяций нейронов, отвечающих на различные звуковые частоты, в таламусе мыши с помощью методики TRAP. По горизонтали — различные комбинации звуковых частот. Лиловый цвет представляет собой флуоресценцию трансгенного маркерного белка (tdTomato), зеленым окрашен белок немедленного раннего гена с-fos.
Зачем вообще нужно выявлять две популяции нейронов в одном образце мозга? Для конкурса художественной микрофотографии. Например, мы можем изучать, что происходит с памятью при воспроизведении . Если в эксперименте в качестве второго эпизода опыта провести напоминание, имиджинг как раз покажет, как изменился вид активирующейся нейронной сети. Знания о том, что происходит с памятью при воспроизведении, предоставляет возможности эффективного вмешательства в нее на этой стадии [26]. Например, возможность ослабления травмирующих воспоминаний. У животных эти воспоминания получается стереть напрочь, вводя на стадии воспроизведения ингибиторы синтеза белка [5], хотя подвергнуть такому человека было бы как-то дико (рис. 8).
Вспомните: воспроизведение — это активный процесс, что подтверждается как на клеточном, так и на поведенческом уровнях.

Рисунок 8. Кадр из фильма «Вечное сияние чистого разума».
сайт pinterest.com
Не менее важные результаты приносит выявление в одном образце мозга популяций нейронов, хранящих различные воспоминания. Их перекрытие на поведенческим уровне проявляется формированием у животного ассоциативной связи, то есть мы можем изучать молекулярные механизмы обучения.
Как управлять памятью
Что, если создать трансгенных мышей, у которых, как и у уже рассмотренных, промотор немедленных ранних генов находится под контролем системы tTA-tetO или Cre/loxP, но под промотором помимо гена флуоресцентного маркера находится последовательность, кодирующая опсин — светочувствительный белок [27]? А то, что мы сможем не просто видеть модифицированные нейроны, но и управлять их активностью — стимулируя светом (рис. 9) [28]. Здесь нужно вспомнить, что срабатывание нейрона основано на прохождении ионного тока через каналы в его цитоплазматической мембране. В покоящемся состоянии цитоплазма нейрона заряжена отрицательно относительно внеклеточной среды, то есть его мембрана поляризована [29]. Возбуждение проявляется тем, что каналы открываются, и катионы устремляются внутрь клетки, деполяризуя мембрану. Опсины, которые мы будем использовать (впервые добытые из клеток бактерий и водорослей), встраиваются в цитоплазматическую мембрану и при освещении определенной длины волны меняют свою конформацию, начиная пассивно пропускать катионы по градиенту концентрации (каналродопсин, СhR2) либо даже работать в качестве насоса и активно перекачивать анионы внутрь клетки (галородопсин, NpHR) [30]. В первом случае происходит деполяризация мембраны, и нейрон срабатывает. Во втором случае мембрана гиперполяризуется , и клетка становится нечувствительной к раздражению. Таким образом, мы получаем возможность искусственно активировать или подавлять конкретные воспоминания. Название подобных технологий — оптогенетика .
Такой же результат, но с эффективностью, в несколько тысяч раз превышающей помповую, дают недавно открытые анионные каналы из водоросли Guillardia thetа: «Обнаружены управляемые светом анионные каналы» [31]. — Ред.
Все подробности об оптогенетике можно найти в статье «Светлая голова» [32].
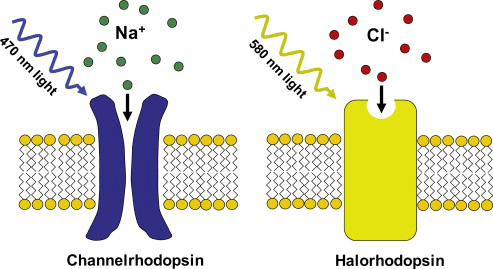
Рисунок 9. Принцип действия канал- и галородопсинов.
сайт lookfordiagnosis.com
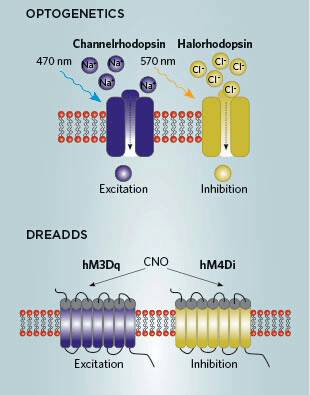
Рисунок 10. Оптогенетические (вверху) и хемогенетические (внизу) технологии для манипулирования сетями памяти.
Особенно любопытен опыт, ставший возможным благодаря оптогенетике, в котором у мышей удалось произвести искусственное обучение. Авторы использовали систему tTA-tetO с доксициклином, а также каналродопсин для искусственного манипулирования нейронами. Вначале они предлагали мышам исследовать обстановку «А» и оптогенетически захватывали активирующуюся при этом популяцию нейронов. Затем они помещали мышей в другую обстановку — «B» — и наносили им удары током, одновременно активируя светом захваченную популяцию нейронов, сохранившую воспоминание об обстановке «А». Последующая проверка показывала, что эта популяция связывалась у мышей с болевым стимулом: у животных возникала боязнь как при помещении их в обстановку «А», так и при прямой активации светом захваченных нейронов в совершенно посторонней обстановке [33].
Страх легко проверить у мышей по поведению: он хорошо детектируется у всех грызунов по характерной реакции замирания.
Ограничение оптогенетики, однако, в том, что область досягаемости светового луча позволяет стимулировать лишь небольшую часть клеток захваченной популяции (стимуляция проводится с помощью всё тех же технологий, что и прижизненный имиджинг, см. рис. 6). Этой проблемы не возникало бы, если бы можно было стимулировать сеть химически, а не оптически. Такие технологии называются хемогенетика.
Возьмем хотя бы уже знакомых нам трансгенных мышей TetTag, обладающих c-fos-опосредованной экспрессией фермента LacZ. После того как мы пометили этим ферментом некоторое воспоминание, можно использовать тот факт, что пролекарственное вещество daun02 под действием LacZ превращается в антибиотик даунорубицин, вызывающий апоптоз клеток и блокировку ионных каналов [34]. То есть, вводя daun02, мы необратимо подавляем это воспоминание.
Вообще, большинство методов хемогенетики основано на внедрении в нервную систему встраивающихся в мембраны нейронов трансгенных рецепторов. С помощью известных нам подходов их экспрессию можно сделать зависимой от немедленных ранних генов и разрешенной только в промежуток времени эксперимента — чтобы захватывать сеть воспоминания для последующего влияния на нее через эти рецепторы. Очень успешен метод с внедрением искусственно созданных рецепторов под названием DREADDs (designer receptors exclusively activated by designer drugs). Они реагируют с синтетическим веществом, производным клозапина (CNO, сlozapine N-oxide). При этом с эндогенными химическими веществами организма ни CNO, ни сами рецепторы не реагируют. Созданы две разновидности этих рецепторов: hM3Dq при введении CNO вызывают деполяризацию нейронов, а hM4Di — гиперполяризацию. Соответственно, возможны активация либо подавление воспоминаний, причем, в отличие от предыдущего метода, обратимые (рис. 10) [35].
Стόит отметить, что химическое вещество воздействует на рецепторы более продолжительно (минуты или часы), чем свет на опсины (миллисекунды), и, соответственно, от применяемой технологии зависит более или менее длительный активирующий или подавляющий эффект на память [36]. В связи с этим интересно упомянуть опыт, аналогичный уже описанному, но использующий вместо каналродопсина CNO и рецепторы hM3Dq. Пройдя ту же схему эксперимента, мыши не выказывали страха ни к обстановке «А», ни к обстановке «В». Зато они пугались при предъявлении обстановки «В» одновременно с химической стимуляцией сети памяти об обстановке «А». По-видимому, за счет продолжительности воздействия химического препарата, а также его циркуляции по всей коре (в опыте с использованием оптогенетики проводилась прицельная стимуляция лишь конкретного, небольшого участка сети памяти), у животных создавалось гибридное воспоминание, отражающее нечто среднее между обстановками «А» и «В», с которым и ассоциировался болевой стимул [37].
Как управлять экспрессией
Понимание того, каким же образом сигнал, поступающий к клетке, передается на немедленные ранние гены и приводит к их активации, позволяет влиять на их экспрессию. Итак, поступающий сигнал сперва активирует транскрипционные факторы немедленных ранних генов , терпеливо дожидающиеся как раз для такого случая. После активации транскрипционные факторы приобретают способность связываться с промоторами немедленных ранних генов, что они и делают, запуская экспрессию последних.
Работа немедленных ранних генов, многие из которых служат транскрипционными факторами для более поздних генов, тоже зависит от транскрипционных факторов — это может показаться немного замороченным, если не знать, как обычно устроены в клетке системы передачи сигнала. Взирая на все эти раскрытые биологами навороты с молекулами-посредниками, понимаешь, что без учебников по внутриклеточной сигнализации Шерлок Холмс бы попал впросак.
Один из таких транскрипционных факторов — белок СREB (сAMP response element-binding protein), который связывается с регуляторной последовательностью CRE (cAMP response element) в составе промоторов таких ранних генов, как c-fos и Arc [38]. CREB влияет на то, какие из нейронов, участвовавших в обработке поступившей информации, вовлекаются в ее запоминание. Оказывается, что вовлекаются преимущественно клетки с более высокой концентрацией CREB [38]. Такое обстоятельство позволяет не только улучшить качество имиджинга сети памяти, но и пополнить запас методик по манипулированию ею. Речь идет о том, что клетки можно принудительно вовлекать в запоминание, нарабатывая в них большие количества CREB, и одновременно хемогенетически захватывать их, синтезируя в сопряжении с ним «орудие» манипулирования (рис. 11).
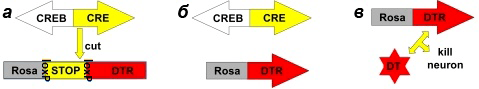
Рисунок 11. Принудительное вовлечение клеток в запоминание с их одновременным хемогенетическим захватом. а — В клетках трансгенной мыши экспрессия рецепторов к дифтерийному токсину (DTR) может быть вызвана активностью Cre-рекомбиназы (внизу). Вектор, несущий гены CREB и Cre-рекомбиназы, вводится локально в желаемые области мозга, где он встраивается в ДНК и начинает экспрессироваться. Cre-рекомбиназа вырезает stop-последовательность и запускает экспрессию рецепторов к дифтерийному токсину, которые сразу же встраиваются в цитоплазматическую мембрану (вверху). б — Мышь приобретает новый опыт, в ходе чего в запоминание вовлекаются клетки, синтезировавшие дополнительные количества CREB (они же чувствительны к дифтерийному токсину). в — Введение дифтерийного токсина (DT) вызывает гибель клеток и, как следствие, потерю памяти [38].
[44], рисунок с изменениями
Преимущественное вовлечение в запоминание нейронов с повышенной концентрацией CREB обусловлено изменением под его влиянием экспрессии целого ряда генов: CREB является транскрипционным фактором для всех генов, содержащих CRE в составе промотора, в том числе кодирующих мембранные ионные каналы, что приводит к повышению возбудимости этих нейронов [39]. Увеличивая долю активного CREB в головном мозге, можно было бы усилить формирование памяти (новое направление для разработки ноотропов?).
Более детальное исследование промоторов немедленных ранних генов позволяет обнаруживать в них последовательности, наиболее сильно реагирующие на активность нейронов. Существует синтетический промотор E-SARE (enhanced synaptic activity-responsive element), полученный путем повторов одной из таких последовательностей, найденной в гене Arc. С ней связываются аж три различных активностно-зависимых транскрипционных фактора. E-SARE обеспечивает, например, в 20 раз более сильную экспрессию по сравнению с промотором c-fos (рис. 12). Используя E-SARE вместо «родных» промоторов немедленных ранних генов, можно получать и соответствующее повышение качества визуализации и манипулирования сетями памяти [40].
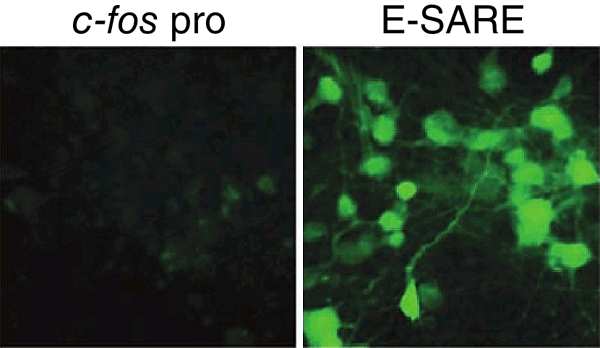
Рисунок 12. Сравнение индукции экспрессии зеленого флуоресцентного белка промотором с-fos (слева) и E-SARE (справа).
Вместо заключения
Мы видим, что сегодня объединение методов рекомбинантной ДНК с методами селекции мышей [41], а также развитие оптических технологий, разрешающих работу на клеточном и молекулярном уровнях (флуоресцентной микроскопии, оптоволоконных технологий и пр.) предоставляют инструменты, которые, вероятно, и не снились пионерам нейробиологии. В общем-то, еще никогда человечество не было так близко к разгадке того, как элементарные процессы в нейронах порождают когнитивные функции и сложные формы памяти, как целое становится чем-то большим, чем сумма частей. Как, в конце концов, порождается сознание — потому что моменты воспроизведения эпизодической памяти и есть моменты возникновения сознания [2]. Остается надеяться, что правы футурологи, которые ожидают в качестве одного из фундаментальных открытий XXI века понимание принципов работы головного мозга.
Литература
- Han J.H., Kushner S.A., Yiu A.P., Cole C.J., Matynia A., Brown R.A. et al. (2007). Neuronal competition and selection during memory formation. Science. 316, 457–460;
- Анохин К.А. (2014). Клеточные следы сознания в мозге. Видео на сайте «ПостНаука»;
- Flavell S.W. and Greenberg M.E. (2008). Signaling mechanisms linking neuronal activity to gene expression and plasticity of the nervous system. Annu. Rev. Neurosci. 31, 563–590;
- Okuno H. (2011). Regulation and function of immediate-early genes in the brain: beyond neuronal activity markers. Neurosci. Res. 69, 175–186;
- Григорьян Г.А. и Маркевич В.А. (2014). Консолидация, реактивация и реконсолидация памяти. Ж. высш. нервн. деят-cти. 2, 123–136;
- Kawashima T., Okuno H., Bito H. (2014). A new era for functional labeling of neurons: activity-dependent promoters have come of age. Front. Neural Circuits. 8, 37;
- Агеенко А.И. Онкогены и канцерогенез. М.: Медицина, 1986. — 255 с.;
- Сейц И.Ф. и Князев П.Г. Молекулярная онкология. Л.: Медицина, 1986. — 352 с.;
- Википедия: «Цинковые пальцы»;
- Википедия: «Arc (protein)» (англ.);
- Stricker J., Falzone T., Gardel M.L. (2010). Mechanics of the F-actin cytoskeleton. J. Biomech. 43, 9–14;
- Bramham C.R., Worley P.F., Moore M.J., Guzowski J.F. (2008). The immediate early gene arc/arg3.1: regulation, mechanisms, and function. J. Neurosci. 28, 11760–11767;
- Matos L.L., Trufelli D.C., Matos L.M.G., Pinhal A.S. (2010). Immunohistochemistry as an important tool in biomarkers detection and clinical practice. Biomark. Insights. 5, 9–20;
- Guzowski J.F. and Worley P.F. (2001). Cellular compartment analysis of temporal activity by fluorescence in situ hybridization (catFISH). Curr. Protoc. Neurosci. Chapter 1, Unit 1.8;
- Флуоресцирующая Нобелевская премия по химии;
- Флуоресцентные белки: разнообразнее, чем вы думали!;
- Флуоресцентные репортеры и их молекулярные репортажи;
- Lin D., Boyle M.P., Dollar P., Lee H., Lein E.S., Perona P., Anderson D.J. (2011). Functional identification of an aggression locus in the mouse hypothalamus. Nature. 470, 221–226;
- Gore F., Schwartz E.C., Brangers B.C., Aladi S., Stujenske J.M., Likhtik E. et al. (2015). Neural representations of unconditioned stimuli in basolateral amygdala mediate innate and learned responses. Cell. 162, 134–145;
- Reijmers L.G., Perkins B.L., Matsuo N., Mayford M. (2007). Localization of a stable neural correlate of associative memory. Science. 317, 1230–1233;
- Callahan C.A. and Thomas J.B. (1994). Tau-beta-galactosidase, an axon-targeted fusion protein. Proc. Natl. Acad. Sci. USA. 91, 5972–5976;
- Guenthner C.J., Miyamichi K., Yang H.H., Heller H.C., Luo L. (2013). Permanent genetic access to transiently active neurons via TRAP: targeted recombination in active populations. Neuron. 78, 773–784;
- Huang Z.J. and Zeng H. (2013). Genetic approaches to neural circuits in the mouse. Annu. Rev. Neurosci. 36, 183–215;
- Доронина-Амитонова Л.В., Федотов И.В., Федотов А.Б., Анохин К.В., Жёлтиков А.М. (2015). Нейрофотоника: оптические методы исследования и управления мозгом. УФН. 185, 371–392;
- Doronina-Amitonova L.V., Fedotov I.V., Ivashkina O.I., Zots M.A., Fedotov A.B., Anokhin K.V., Zheltikov A.M. (2013). Implantable fiber-optic interface for parallel multisite long-term optical dynamic brain interrogation in freely moving mice. Sci. Rep. 3, 3265;
- Амнезия: воспоминания не стираются, просто их трудно пробудить — без оптогенетики;
- Зрительный родопсин — рецептор, реагирующий на свет;
- Liu X., Ramirez S., Pang P.T., Puryear C.B., Govindarajan A., Deisseroth K., Tonegawa S. (2012). Optogenetic stimulation of a hippocampal engram activates fear memory recall. Nature. 484, 381–385;
- Формирование мембранного потенциала покоя;
- Yizhar O., Fenno L.E., Davidson T.J., Mogri M., Deisseroth K. (2011). Optogenetics in neural systems. Neuron. 71, 9–34;
- Обнаружены управляемые светом анионные каналы;
- Светлая голова;
- Ramirez S., Liu X., Lin P.A., Suh J., Pignatelli M., Redondo R.L. et al. (2013). Creating a false memory in the hippocampus. Science. 341, 387–391;
- Koya E., Golden S.A., Harvey B.K., Guez-Barber D.H., Berkow A., Simmons D.E. et al. (2009). Targeted disruption of cocaine-activated nucleus accumbens neurons prevents context-specific sensitization. Nat. Neurosci. 12, 1069–1073;
- Murray A.J. and Wulff P. Remote control of neural activity using chemical genetics. In: Neural Tracing Methods: Tracing Neurons and Their Connections / ed. by Arenkiel B.R. Houston: Baylor College of Medicine, 2015. P. 161–175;
- Chi K.R. (2015). Remote mind control. The Scientist;
- Garner A.R., Rowland D.C., Hwang S.Y., Baumgaertel K., Roth B.L., Kentros C., Mayford M. (2012). Generation of a synthetic memory trace. Science. 335, 1513–1516;
- Sakaguchi M. and Hayashi Y. (2012). Catching the engram: strategies to examine the memory trace. Mol. Brain. 5, 32;
- Lonze B.E. and Ginty D.D. (2002). Function and regulation of CREB family transcription factors in the nervous system. Neuron. 35, 605–623;
- Kawashima T., Kitamura K., Suzuki K., Nonaka M., Kamijo S., Takemoto-Kimura S. et al. (2013). Functional labeling of neurons and their projections using the synthetic activity-dependent promoter E-SARE. Nat. Methods. 10, 889–895;
- Грызун особого назначения;
- Sakaguchi M. and Hayashi Y. (2012). Catching the engram: strategies to examine the memory trace. Mol. Brain. 5, 32;
- Deng W., Mayford M., Gage F.H. (2013). Selection of distinct populations of dentate granule cells in response to inputs as a mechanism for pattern separation in mice. Elife. 2, e00312;
- Reijmers L. and Mayford M. (2009). Genetic control of active neural circuits. Front. Mol. Neurosci. 2, 27.