Тумороиды — микроопухоли в пробирке
27 ноября 2019
Тумороиды — микроопухоли в пробирке
- 2274
- 2
- 6
фотография автора статьи
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: 2D-система, а иначе говоря, монослойная клеточная культура, на протяжении столетия представляла собой успешную платформу для скрининга противоопухолевых препаратов и изучения межклеточных взаимодействий, но такая модельная система ограничена в плане воспроизводимости результатов в клинической практике. Животные модели лучше отражают клиническую картину, однако постановка экспериментов на них требует затрат большого количества времени и денег. Поэтому встает вопрос о создании модели, которая будет максимально приближенна по структуре и свойствам к естественной опухолевой системе, будет отражать закономерности опухолевого роста, а также будет пригодна для тестирования потенциальных противоопухолевых препаратов. Такой моделью могут служить трехмерные клеточные структуры — тумороиды.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Тумороиды (сокращение от англ. tumor spheroids) — это микроразмерные клеточные агрегаты, использующиеся для тканевого моделирования злокачественных новообразований in vitro с целью имитации их свойств. В своем обзоре я буду называть их опухолевыми сфероидами, 3D-системами и 3D-моделями.
Первые шаги в получении тканей вне живого организма
Впервые 3D-культивирование клеток и тканей прослеживается в работах Алексиса Карреля (рис. 1) в 1912 году. Каррель вырастил эксплантат, полученный из клеток сердца эмбриона цыпленка (рис. 2), и поддерживал его жизнеспособность на протяжении трех месяцев [1].
Метод получения сфероидов был описан при изучении эмбрионов амфибий Иоганесом Холтфретером в 1944 году [2]. Он исследовал самоорганизацию эктодермальных, мезодермальных и энтодермальных [3] зародышевых листков с образованием сферических структур и отметил, что происходит не просто объединение клеток, а их закономерное распределение в пространстве.
В начале 1950-х годов Джозеф Лейтон улучшил систему, предложенную Каррелем, путем культивирования тканей на специальной подложке (губчатой матрице). Он использовал губчатую матрицу как субстрат для культуры тканей. Эксперименты Лейтона были выполнены в стеклянных пробирках, где находились целлюлозные губки, окруженные плазменными сгустками. В такие пробирки помещались фрагменты тканей от 1 до 5 мм вместе с каплей куриной плазмы и каплей разбавленного экстракта куриного эмбриона. После того, как плазма сворачивалась, фрагменты тканей плотно прикреплялись к целлюлозной губке. Затем Лейтон добавлял питательную смесь и помещал губку с тканью в аппарат для поддержания нужных условий (инкубатор — в наше время). Таким образом поддерживалась жизнеспособность и обеспечивался частичный рост фрагментов тканей для дальнейших исследований. Лейтон также использовал натуральные и желатиновые губки, но обработанные коллагеном целлюлозные губки оказались оптимальными для поддержания роста и архитектуры ткани. Различные типы тканей были выращены Лейтоном на культурах губчатого матрикса [4]. Тогда же были предприняты первые попытки создания тумороидов (опухолевых сфероидов).
Лейтон брал клетки аденокарциномы C3HBA (опухоли мышиной молочной железы) и выращивал их в губчатой матрице. Он приметил ряд важных особенностей роста опухолевых клеток. Во-первых, клетки агрегировали примерно так, как это происходит в самой опухоли, во-вторых, агрегированные клетки образовывали структуры, похожие на опухолевые, а именно просветы и железистые элементы.
Таким образом, Лейтон обнаружил удивительное сходство между оригинальными опухолями живых организмов и искусственно выращенными трехмерными губчато-гелевыми гистокультурами, которые он назвал гистофизиологически градиентной культурой [5], [6].
Итак, сфероиды можно получить из нормальных клеток. Их можно использовать для тестирования потенциальных препаратов, но самое распространенное применение — биопринтинг. Об этом подробнее можно почитать в статье про искусственные органы и тканевую инженерию [7]. Но мы остановимся более детально на опухолевых сфероидах.
Так что же представляет себой опухолевый сфероид?
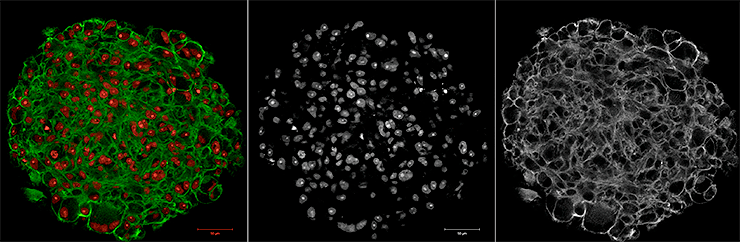
Можно считать, что сфероиды — это микромодель опухоли, в которой составляющие ее клетки похожи по морфологии, профилю продуцируемых биологических веществ и составу рецепторов на клетки злокачественных новообразований, развивающихся в организме (рис. 3) [8].
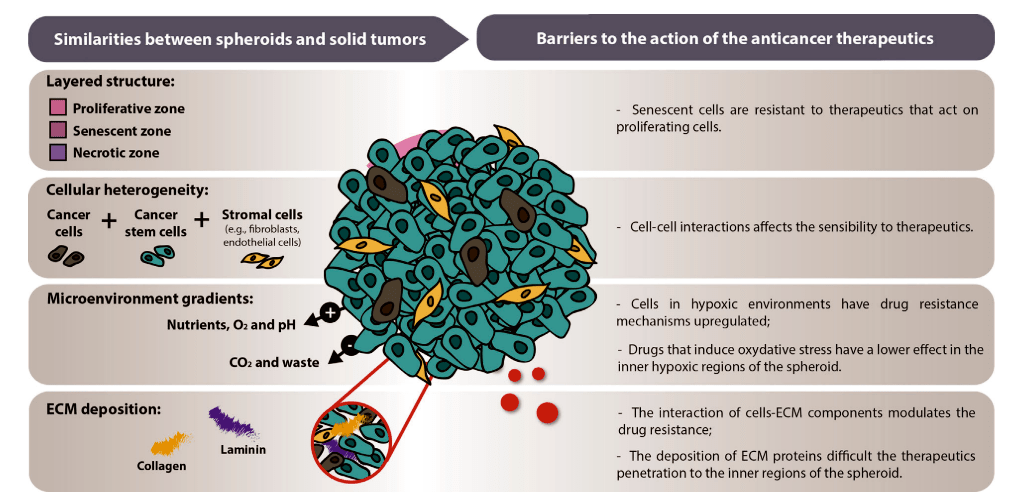
Рисунок 3. Схема, отражающая сходство трехмерных сфероидов с сóлидными опухолями in vivo и соответствующими барьерами для действия противоопухолевой терапии
Было обнаружено, что подобно сóлидным опухолям, в тумороидах существует определенная клеточная зональность, присутствие которой становится более выраженной с увеличением размера сфероида. Обычно можно выявить внешний слой, представленный быстро пролиферирующими клетками, средний слой со стареющими, или покоящимися клетками, и внутренний слой, содержащий некротические клетки [9]. Диаметр тумороидов варьирует от 100 до 1000 мкм, причем пролиферирующая и покоящаяся зоны будут присутствовать в сфероидах от 200 микрометров, тогда как значительно бóльшие по радиусу сфероиды могут также содержать некротическую зону из-за недостатка питательных веществ и ограничения транспорта кислорода (рис. 4) [10].
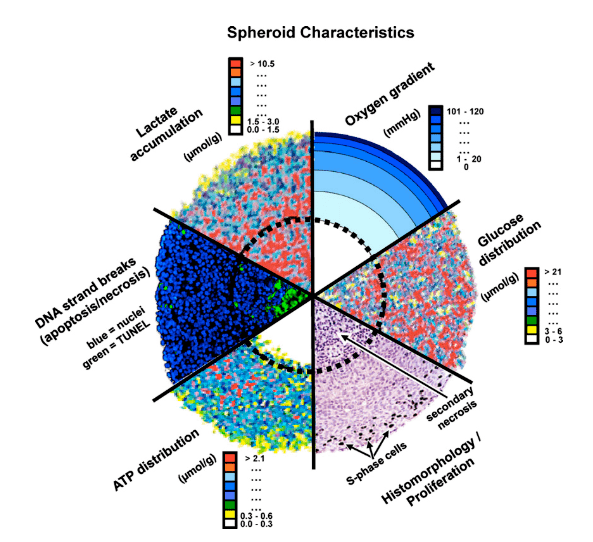
Рисунок 4. Основные молекулярно-биологические характеристики сфероидов. Комбинация аналитических изображений сфероидальных срезов, изучаемых с использованием различных технологий: авторадиографии, tunel-анализа, биолюминесцентной визуализации и зондирования с помощью кислородных микроэлектродов. Эти измерения позволяют понять концентрическое распределение веществ (АТФ, глюкозы, кислорода), пролиферативных процессов и некроза, жизнеспособности.
Интересно, что во внутренней части сфероида микросреда подкисляется (диапазон рН 6,5–7,2) за счет того, что в состоянии гипоксии опухолевые клетки активно преобразуют пируват в молочную кислоту (лактат) [11], и этот явление аналогично эффекту Варбурга [12], связанному с накоплением лактата в солидных опухолях [13]. В ответ на низкий уровень pH окружающей среды клетки стареющей и некротической зон начинают активно продуцировать факторы, способствующие усилению пролиферации злокачественных клеток и их выживанию. Пример такого фактора — индуцируемый гипоксией фактор-1 (HIF-1) [14], [15]. При достижении определенной концентрации в клетке активный димер HIF-1α перемещается в ядро, где активирует экспрессию более чем 200 генов, ответственных за формирование устойчивости к ишемии и гипоксии [16]. За детальное изучение этого процесса в 2019 году была вручена Нобелевская премия по физиологии и медицине.
Процесс формирования сфероида состоит как минимум из трех фаз (рис. 5): первоначальная агрегация изолированных клеток, уплотнение сфероида и его рост [17]. Клетки в сфероидах, как и в опухолях, производят и запасают компоненты внеклеточного матрикса: коллаген IV, ламинин, фибронектин, протеогликаны, тенасцин и др. [18], [19]. Тесное физическое взаимодействие между опухолевыми клетками и внеклеточным матриксом за счет α5- и β1-интегринов [20] и контакты между опухолевыми клетками за счет E-кадгеринов [21] увеличивают плотность сфероида и создают определенный барьер для проникновения и распределения веществ, поступающих извне [19]. Помимо этого, вклад в образование трехмерных структур также вносят внутриклеточные компоненты, такие как актин и микротрубочки [22].
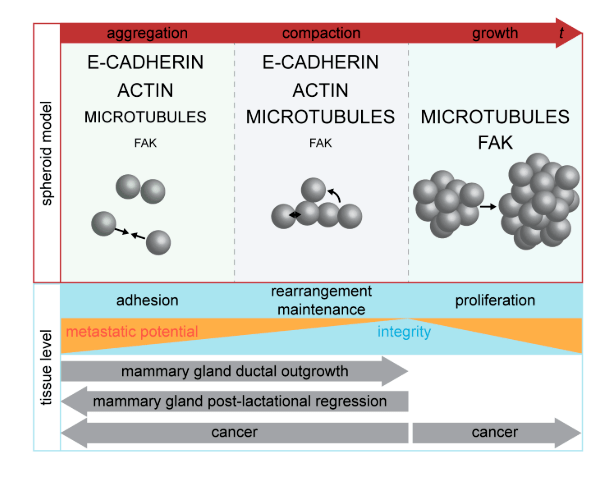
Рисунок 5. Модель, отражающая фазы агрегации компонентов в сфероиде. Образование сфероида на неадгезивной поверхности делится на три фазы: агрегация, уплотнение и рост. Участие внутриклеточных компонентов E-кадгерина, актина, микротрубочек и FAK-белков показано для каждой фазы.
Кинетика роста тумороидов in vitro сходна с кинетикой роста солидных опухолей. Начальный период роста солидных опухолей называют фазой бессосудистого роста, в этот период объем опухоли увеличивается в геометрической прогрессии. Затем наступает состояние покоя, после которого следует фаза образования новых сосудов, вызванная действием ангиогенных факторов — например, ангиогенина и сосудистого эндотелиального фактора роста [23]. Под действием матриксных металлопротеиназ (MMP-2, MMP-9) происходит изменение внеклеточного матрикса, и опухолевые клетки приобретают способность к инвазии и метастазированию [24]. В процессе роста тумороидов их объем экспоненциально увеличивается, далее по достижении размера 200–500 мкм в диаметре скорость роста уменьшается и выходит на плато. Таким образом, рост сфероидов соответствует начальной фазе роста опухолевого узла (рис. 6) [25].
Рисунок 6. Сфероид меланомы, 100-й пассаж, седьмой день культивирования
фотография автора статьи
Как получить опухолевый сфероид?
Основная задача при получении трехмерных клеточных культур — предотвращение прикрепления клеток к поверхности культуральной посуды. Выбор сред, посуды и условий инкубации в случае тумороидов ничем не отличается от выбора в случае монослойных культур. Все эти важные моменты подробнее раскрыты в статье про методы клеточных технологий [26].
Итак, способы получения сфероидов можно разделить на две группы — создание сфероидов с использованием специальных матриц-носителей (скаффолдов) и без их использования. Эффективность получения тумороидов зависит от таких критериев, как длительность их формирования, однородность размеров, пригодность для последующих применений, качество использованных материалов и оборудования.
Как мы уже знаем, первые попытки Лейтона культивировать ткани и клетки вне организма с использованием губчатых матриц завершились успехом. Что представляют собой современные скаффолды? Скаффолды — твердые каркасы (губки или пены), гидрогели, волокна или шарики, которые могут быть получены с различными химическими и механическими характеристиками, для того чтобы имитировать внеклеточный матрикс опухоли in vivo [25]. Скаффолды создают в основном с использованием неадгезивных полимеров (например, агарозы, коллагена, альгината, гиалуроновой кислоты и др.) или смеси неадгезивных полимеров с другими биоматериалами [27]. Именно неадгезивные свойства скаффолда играют решающую роль в сфероидообразовании. Когда клетки помещают на поверхность или в сам скаффолд, они оседают на нем, силы адгезии между клетками начинают преобладать, клетки мигрируют внутрь, образуя «микроткань» в ячейках скаффолда (рис. 7 и 8).
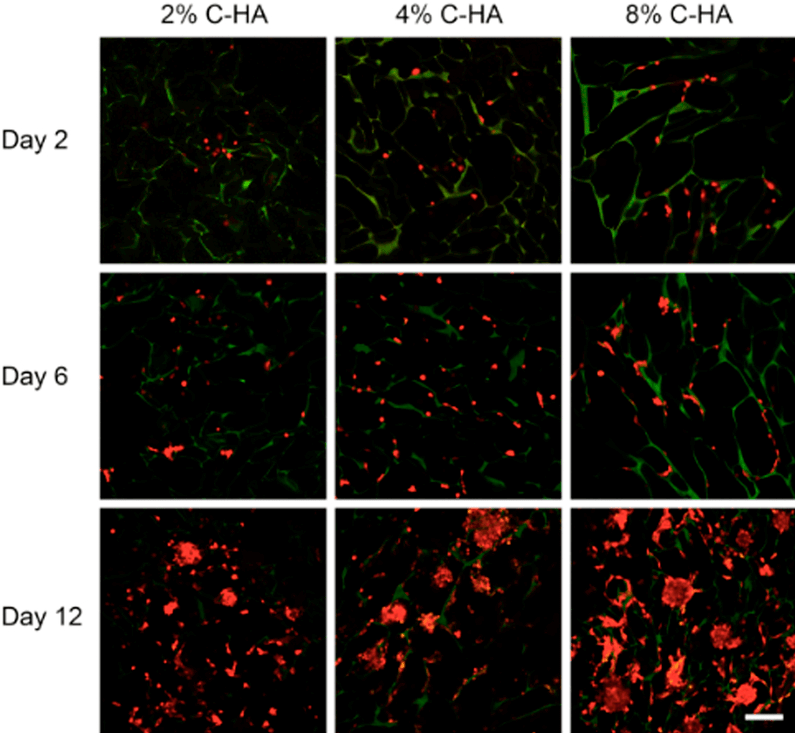
Рисунок 7. Флуоресцентная визуализация клеток RFP U87-MG (красного цвета), прогрессирующих от отдельных клеток до сфероидов через 12 дней при культивировании на 2%, 4% и 8% chitosan — hyaluronic acid scaffolds (вид скаффолда). Скаффолды видны (зеленые) благодаря автофлуоресценции. Масштабная линейка — 300 мкм.
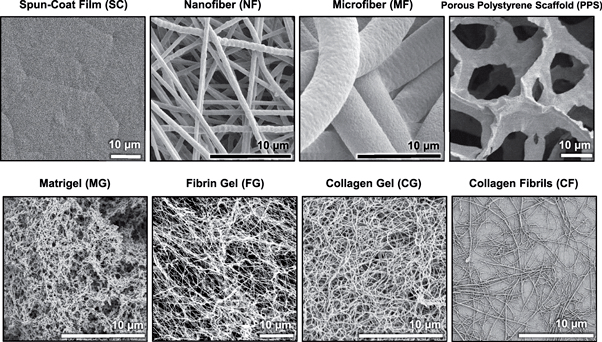
Рисунок 8. Микрофотографии различных по морфологии скаффолдов, полученные методом сканирующей электронной микроскопии
Наиболее известный гель для получения 3D-сфероидов и поддержания жизнеспособности опухолевых эксплантатов в современной практике — матригель [28]. Он представляет собой растворимый экстракт белков базальной мембраны, полученный из саркомы мыши, который формирует 3D-гель при 37 °С. Саркомы — это соединительнотканные опухоли. Соединительная ткань производит большое количество межклеточного вещества, поэтому используют именно этот тип опухоли для приготовления матригеля. С помощью этого геля можно получать сфероиды, поддерживать клеточный морфогенез, дифференцировку, рост опухоли, а также изучать действие клеточных и внеклеточных факторов.
Методы без использования скаффолдов основаны на получении сфероидов в неадгезивных условиях (рис. 9).
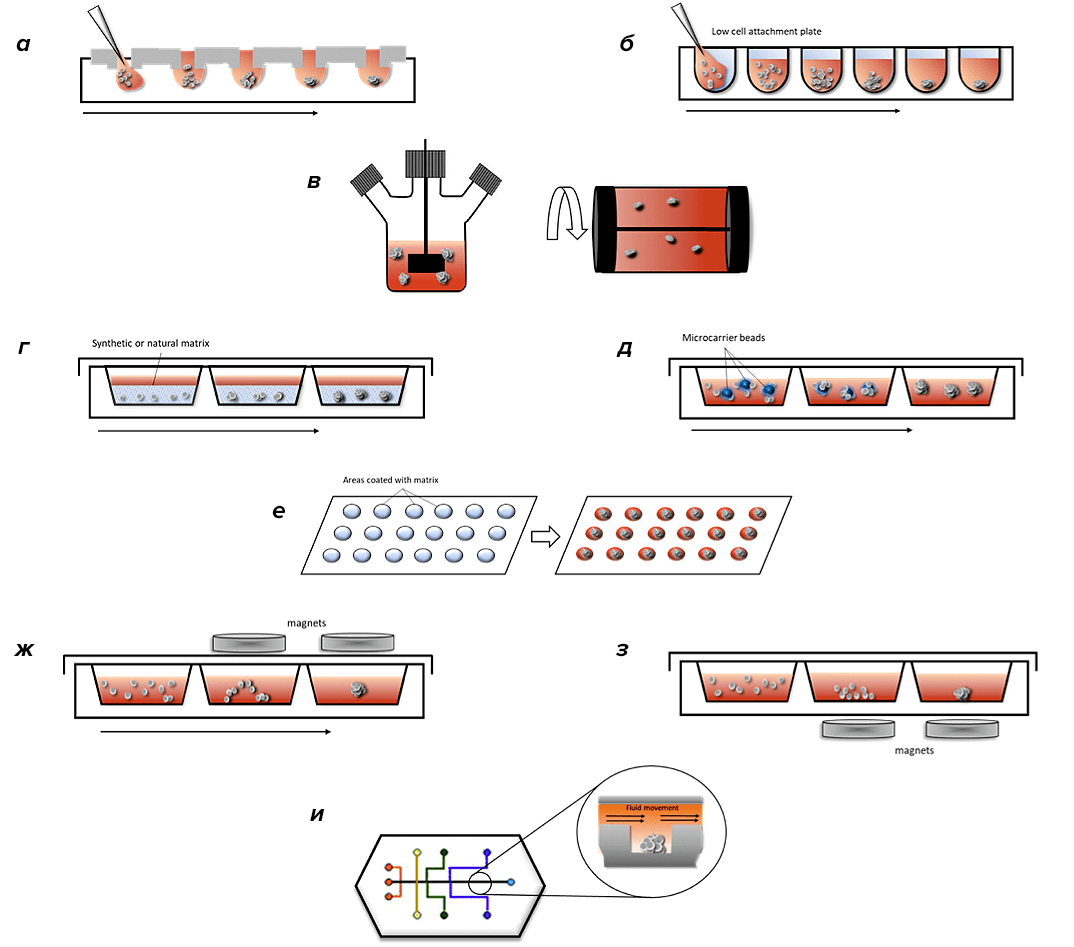
Рисунок 9. Методы получения сфероидов. а — Метод висячей капли: клетки высеваются в маленькие капли среды и под действием силы тяжести образуют клеточные агрегаты. б — Низкоадгезивные планшеты: поверхность планшета модифицируют, чтобы стимулировать агрегацию клеток в сфероиды. в — Спиннерные колбы: мешалки или вращающиеся колбы, которые предотвращают прилипание клеток к колбам благодаря постоянному перемешиванию, способствуя образованию сфероидов в суспензии. г — Матрицы (скаффолды): естественные или синтетические матрицы и каркасы, позволяющие отдельным клеткам в суспензии формировать сфероиды на этих каркасах. д — Бусины на микроносителях: натуральные или синтетические твердые бусины, покрытые матрицами, которые позволяют прилипшим на их поверхность клеткам размножаться и образовывать сфероиды. е — Пластины с микропаттернами: пластины c матрицами, способствующими образованию сфероидов. ж — Магнитная левитация: клетки намагничиваются с использованием наночастиц и инкубируются под действием магнитных сил, что приводит к образованию сфероидов. з — Магнитная биопечать: с помощью магнитных сил намагниченные участки с клетками «печатаются» на дно культурального планшета. и — Микрофлюидный метод: основан на принципах сосудистой сети, обнаруженной в системах органов. Клеточные сфероиды располагаются в микроканалах перфузионной системы, которая позволяет моделировать поток питательных веществ и кислорода, а также удалять отходы.
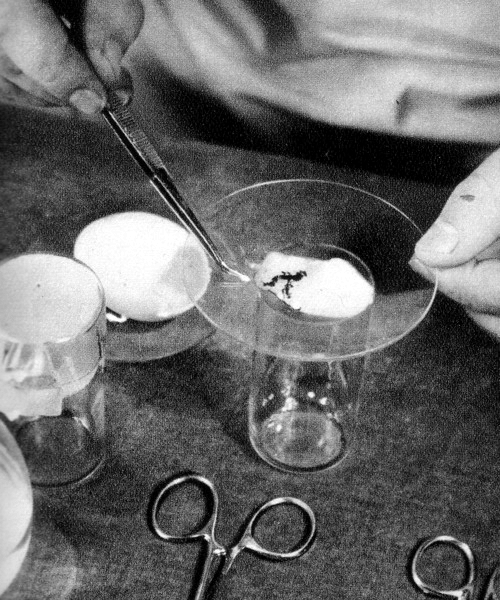
Самый распространенный, дешевый и простой метод — метод «висячей капли» (hanging drop method), при котором клеточную суспензию помещают на крышку чашки Петри (рис. 10), а затем клетки спонтанно агрегируют на дне капли культуральной среды с образованием сфероидов [29].

Рисунок 10. Метод «висячей капли»
фотография автора статьи
Еще один довольно распространенный метод — использование поверхностей, сформированных неадгезивными полимерами, например, агарозой или гиалуроновой кислотой (liquid overlay technique) [30].
Также разработаны методы получения сфероидов при помощи биореакторов — замкнутых систем со строго контролируемыми физико-химическими условиями (температурой, pH, скоростью потока среды, кислорода, подачи питательных веществ и удалением метаболитов). Биореакторы позволяют создавать непрерывное перемешивание среды за счет постоянных вращательных движений колбы, что предотвращает прилипание клеток [31]. Эти методы позволяют осуществлять массовое производство сфероидов, поэтому представляют собой метод выбора для выращивания большого количества однородных сфероидов для последующих применений. Более подробно о биореакторах можно прочесть в [32].
Клеточные культуры можно предварительно обрабатывать циклическими пептидами (cyclo-RGDfK(TPP)) [33]. Эти пептиды индуцируют синтез E-кадгеринов на поверхности путем связывания с интегрином α5β1. Взаимодействие E-кадгеринов раковых клеткок приводит к уплотнению клеток и образованию сфероидов (рис. 11).
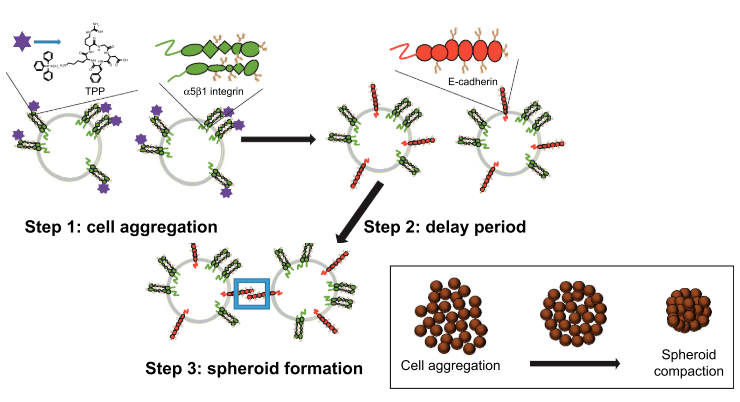
Рисунок 11. Стадии образования 3D-сфероидов биохимическим методом на основе cyclo-rgDfK(TPP) peptide. Стадия 1: образование рыхлых клеточных агрегатов посредством связывания пептида и α5β1-интегрина. Стадия 2: период задержки для экспрессии и накопления E-кадгеринов. Стадия 3: формирование компактных 3D-сфероидов через взаимодействия E-кадгерин—E-кадгерин.
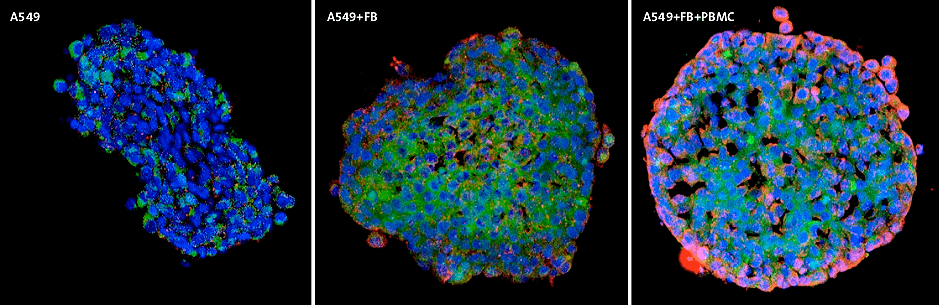
Тумороиды можно получать не из одного типа клеток: в систему можно вводить стромальные клетки, такие как фибробласты, мезенхимальные стволовые клетки и др. [34]. Такую систему можно усложнять различными элементами на свое усмотрение, приближая ее состав к естественной опухоли.
Мы разобрались, что такое тумороиды, что в них особенного и как их получают. Но для чего это всё?
Применение опухолевых сфероидов
Приступим к самой важной части обзора, касающейся применения тумороидов. Область их применения ограничивается лишь фантазией экспериментатора. В настоящее время опухолевые клеточные трехмерные модели in vitro активно применяют для прогностической оценки противоопухолевых методов лечения, таких как химиотерапия, радиотерапия, фотодинамическая терапия, генная терапия и иммунотерапия. Помимо широчайшего списка терапевтических подходов, воздействующих на сами опухолевые клетки, большой интерес представляет микроокружение. Тумороиды могут быть использованы для изучения процессов инвазии, метастазирования и ангиогенеза, изучения процессов клеточной адгезии и взаимодействий опухолевых клеток со стромальными и иммунными клетками (рис. 12) [35]. Изучение геометрии и архитектуры может быть полезным для количественной оценки проникновения лекарственных препаратов.
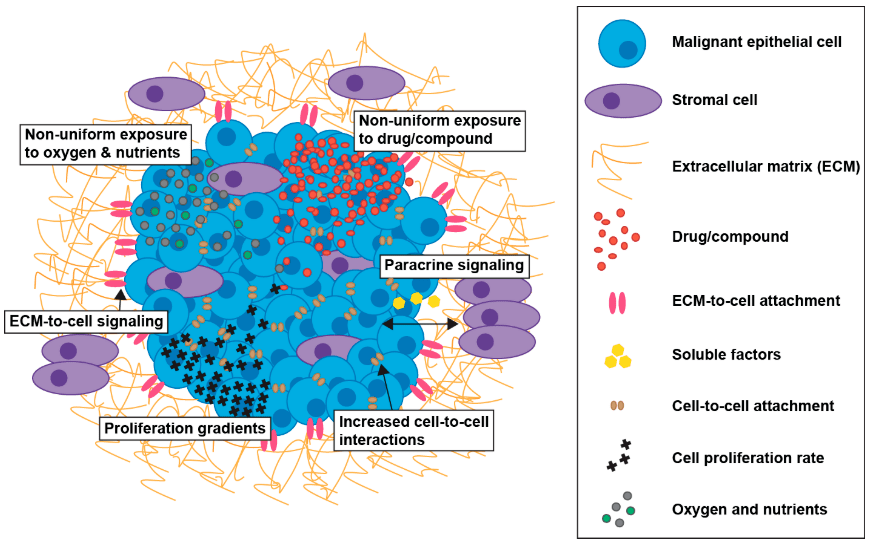
Рисунок 12. Преимущества использования клеток, выращенных в условиях 3D-культуры, по сравнению с 2D-моделями культуры для оценки лекарственных кандидатов и изучения механистических свойств противораковых агентов.
Опухолевые сфероиды — подходящие модели для тестирования систем доставки лекарств in vitro. Как известно, в реальной клинической ситуации концентрация лекарств, кислорода и питательных веществ уменьшается к центру опухоли. Эффективность лекарственного препарата in vivo во многом зависит от его дозы, фармакокинетических свойств, молекулярной массы, заряда, растворимости в воде и липидах, диффузии, барьеров в микроокружении, связывания с мишенью, метаболизма и секвестрации.
Физиологические параметры внутри сфероидов (сложная многоклеточная архитектура, барьеры для переноса массы веществ, внутренний градиент питательных веществ, кислорода и метаболитов) похожи на параметры внутри опухоли пациента. Именно поэтому такое сходство можно использовать для исследований in vitro цитотоксичности противоопухолевых препаратов, патофизиологических градиентов и процессов их диффузии. Сильвен Л’Эсперанс с соавторами исследовал химиорезистентность с помощью сфероидов, полученных из шести клеточных линий рака яичника, обработанных одним из трех различных химиотерапевтических агентов. Они изучили экспрессию ряда генов, связанных с ростом и пролиферацией клеток, со сборкой и организацией цитоскелета, с гибелью клеток, с контролем клеточного цикла и передачей сигналов в клетках, и отметили, что опухолевые клетки в сфероидах быстро приобретают химиорезистентность к препаратам за счет сверхэкспрессии генов, ответственных за остановку клеточного цикла, а также за репарацию и репликацию ДНК [36]. При этом подобная сверхэкспрессия генов не наблюдалась в монослойных культурах.
Также обнаружили, что из-за рН-градиентов, существующих внутри сфероидов, клетки некротической зоны могут быть защищены от цитотоксического действия слабокислых препаратов, таких как митоксантроны и антрациклины, тогда как действие слабощелочных, таких как хлорамбуцил и митомицин С, усиливается [37]. Оба приведенных эксперимента свидетельствуют о том, что использование сфероидов позволяет лучше предсказать взаимодействие лекарства с опухолью, чем эксперименты на обычных монослойных культурах, и при этом дешевле и проще, чем эксперименты in vivo.
За последние десятилетия одним из подходов к улучшению эффективности химиотерапевтических агентов стала разработка нанотехнологий в сфере доставки лекарственных препаратов. Разнообразные наночастицы выступают в роли носителей лекарств за счет инкапсуляции гидрофобных химиопрепаратов. Они эффективнее проникают в опухоль и накапливаются в ней за счет связи со специфическими молекулами-мишенями [38]. Два основных фактора препятствуют накоплению наночастиц в опухоли: высокое внутриопухолевое давление, формирующееся в результате особенностей сосудистой сети и нарушений функций лимфатической системы, и затруднение диффузии, вызванное агрессивным характером роста клеток, наличием фиброза и уплотнением внеклеточного матрикса [39]. Шенг Лу и его коллеги использовали сфероиды, полученные из линии карциномы легкого человека A549, для оценки проникновения в опухоль доксорубицина в составе нанокомплекса [40]. При попадании в опухоль доксорубицин высвобождался из нанокомплекса в среде, обогащенной АТФ. Было обнаружено, что нанокомплекс с доксорубицином приводит к дезинтеграции опухолевых сфероидов, в то время как обработанные чистым доксорубицином сфероиды сохраняют свою форму. Таким образом, эта работа продемонстрировала эффективность трехмерного клеточного моделирования для разработки новых наностратегий противоопухолевого лечения.
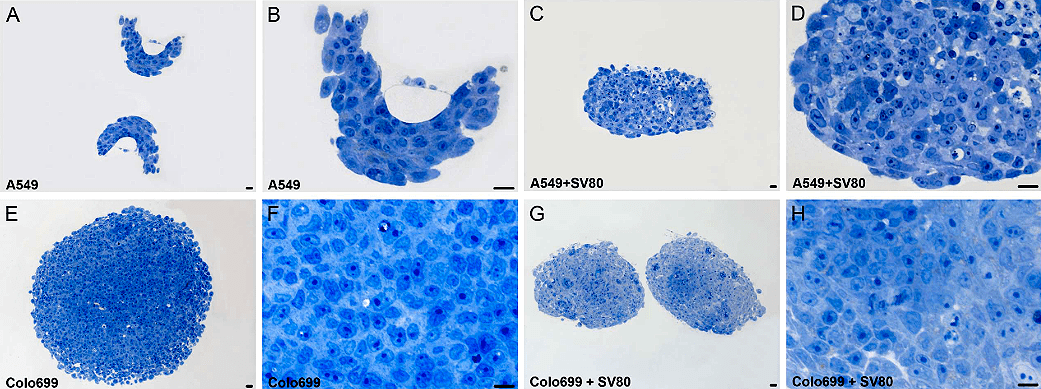
Интересно, что стромальные клетки, которые сокультивируются вместе с опухолевыми, способствуют развитию химиорезистентности последних. Это явление называется adhesion-mediated apoptosis resistance (AMAR), или «опосредованная адгезией устойчивость к апоптозу». Есть данные о том, что сокультивирование клеточной линии немелкоклеточного рака легкого с фибробластами легкого эмбриона человека в сфероидах способствовало росту последних и предотвращало гибель опухолевых клеток под воздействием химиотерапии через паракринную передачу сигналов [41]. Намхук Бик с соавторами использовал 3D-систему культивирования клеточной линии остеосаркомы мониторинга воздействия химиотерапии [42], [43]. Анализируя морфологические (рост и форма) и энергетические (АТФ) параметры изменения сфероидов в режиме реального времени, авторы пришли к выводу, что барьером для проникновения цитотоксических агентов является внеклеточный матрикс (рис. 13 и 14). Именно поэтому одной из наиважнейших мишеней в терапии рака является микроокружение [34], которое способствует росту опухоли за счет увеличения пролиферации, инвазии, метастазирования и устойчивости к апоптозу.
Один из значимых компонентов опухолевого микроокружения — иммунные клетки. Сегодня уже ни для кого не секрет, что иммунные клетки ведут себя по-разному с опухолевыми клетками в различных модельных системах. Например, цитотоксические Т-лимфоциты, которые специфичны к ассоциированным с опухолью антигенам (tumor-associated antigens (TAAs)), успешно распознают опухолевые клетки в монослойной культуре, но «проваливают тест» на распознавание тех же клеток в 3D-системе [44]. Возможным объяснением является повышенная концентрация молочной кислоты, которую активно нарабатывают тумороиды (рис. 15). Именно из-за повышенного содержания лактата в среде цитотоксические лимфоциты перестают выполнять свои функции по распознаванию и секреции IFN-γ [45]. Было также показано, что повышенное содержание лактата влияет на дифференцировку моноцитов в дендритные клетки [46].
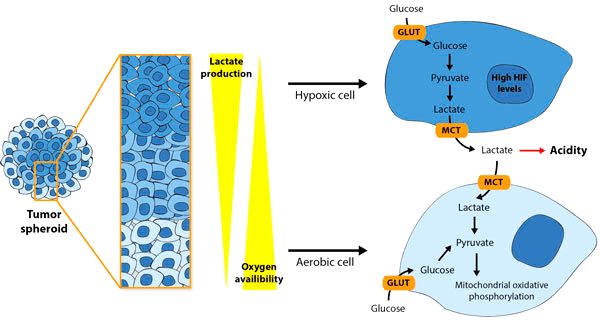
Рисунок 15. Распределение кислорода в опухолевых сфероидах, порождающих градиент гипоксии, который влияет на метаболизм клеток
Тристан Куро и его коллеги проанализировали гетеротипические сфероиды, полученные из клеточных линий колоректального рака человека, после сокультивирования с мононуклеарными клетками, выделенными из периферической крови, для оценки инфильтрации, активации и функций T-лимфоцитов и NK-клеток в модельной системе in vitro [47]. В этом исследовании удалось показать, что аллогенные Т- и NK-клетки быстро инфильтрируют в сфероиды, вызывая иммуноопосредованный апоптоз опухолевых клеток и разрушение сфероида. Данная система позволила оценить терапевтический потенциал антитела, нацеленного на иммуносупрессорные лиганды на поверхности опухолевых клеток. Эти наблюдения были подтверждены уже в клинически значимой модели дикультуры сфероидов из клеток колоректального рака, выделенных из опухолей пациентов, и аутологичных (из организма пациента) опухоль-инфильтрирующих лимфоцитов [48]. Таким образом, трехмерные клеточные модели для всех типов опухолей человека позволяют динамически изучать противоопухолевый иммунный ответ, возникающий у пациентов, и в конечном итоге, обладают предикторными возможностями в отношении определения эффективности противоопухолевой иммунотерапии. Изучение этих взаимодействий может быть использовано для разработки иммунотерапии с помощью цитокинов [49] (для усиления естественного иммунитета), с помощью антител [50], [51] (для подавления защиты от апоптоза), и наконец, иммунные клетки можно использовать в качестве носителей для генной терапии [52].
Всё только начинается
Четкое понимание сложных механизмов, влияющих на эффективность противоопухолевой терапии, имеет большое значение для современной онкологии (рис. 16). По сравнению с 2D-культурой сфероиды более точно имитируют нативные ткани, повторяя их архитектуру, спектр растворимых веществ, экспрессию ряда рецепторов, сложные взаимодействия клеток между собой, а также клеток с внеклеточным матриксом. Сейчас публикуется всё больше исследований, в которых подчеркиваются преимущества трехмерных моделей различных тканей in vitro.
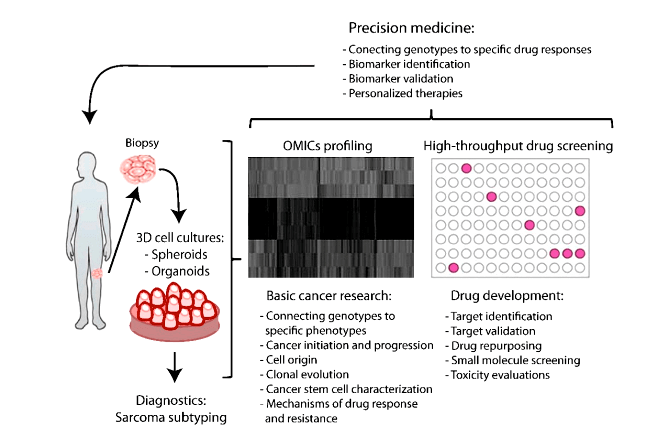
Рисунок 16. От биопсии до персонализированной медицины. Из биопсии можно получить модели органоидов и сфероидов, которые являются источниками специфичных ДНК, РНК и белков для пациента. Можно выбрать конкретные мутации, гены и белки и идентифицировать цели для терапии. Сфероиды могут быть непосредственно использованы для скрининга чувствительности пациента к лекарственным препаратам и нахождения молекулярной цели. Интеграция данных омических исследований и высокопроизводительный скрининг лекарственных препаратов могут предоставить конкретные молекулярные и клинические исходы для более персонализированной терапии.
Последние достижения показывают, что сфероиды помогут преодолеть разрыв между доклиническими и клиническими исследованиями, предоставляя релевантную модель злокачественных новообразований человека in vitro, полезную для тестирования различных терапевтических методов воздействия на опухоль, изучения механизмов инвазии и метастазирования, процессов функционирования иммунной системы в условиях опухолевого роста. А главное, такие модели можно сделать персонализированными и доступными.
Автор статьи выражает благодарность заведующей научным отделом, д.м.н., Балдуевой Ирине Александровне, научному руководителю, к.б.н., старшему научному сотруднику Даниловой Анне Борисовне, а также всем сотрудникам научного отдела онкоиммунологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России за помощь в написании и редактировании статьи, бесценные советы и безграничную поддержку во всех творческих начинаниях автора.
Литература
- A. Carrel. (1912). ON THE PERMANENT LIFE OF TISSUES OUTSIDE OF THE ORGANISM. Journal of Experimental Medicine. 15, 516-528;
- Johannes Holtfreter. (1944). A study of the mechanics of gastrulation. J. Exp. Zool.. 95, 171-212;
- Энтодерма возникла в ходе эволюции раньше эктодермы;
- Leighton J. (1951). A Sponge Matrix Method for Tissue Culture. Formation of Organized Aggregates of Cells
in Vitro 2 . JNCI: Journal of the National Cancer Institute; - J. LEIGHTON. (1959). Aggregate Replication, a Factor in the Growth of Cancer. Science. 129, 466-467;
- Leighton J. (1960). The propagation of aggregates of cancer cells: implications for therapy and a simple method of study. Cancer Chemother Rep. 9, 71–72;
- Искусственные органы и тканевая инженерия;
- Deakin A. (1975). Model for the growth of a solid in vitro tumor. Growth. 1, 159–165;
- Geeta Mehta, Amy Y. Hsiao, Marylou Ingram, Gary D. Luker, Shuichi Takayama. (2012). Opportunities and challenges for use of tumor spheroids as models to test drug delivery and efficacy. Journal of Controlled Release. 164, 192-204;
- Delyan P. Ivanov, Terry L. Parker, David A. Walker, Cameron Alexander, Marianne B. Ashford, et. al.. (2014). Multiplexing Spheroid Volume, Resazurin and Acid Phosphatase Viability Assays for High-Throughput Screening of Tumour Spheroids and Stem Cell Neurospheres. PLoS ONE. 9, e103817;
- Khalid O. Alfarouk, Daniel Verduzco, Cyril Rauch, Abdel Khalig Muddathir, Adil H. H. Bashir, et. al.. (2014). Glycolysis, tumor metabolism, cancer growth and dissemination. A new pH-based etiopathogenic perspective and therapeutic approach to an old cancer question. Oncoscience. 1, 777;
- Вослед Варбургу — последние достижения в изучении биоэнергетики рака;
- Jung-whan Kim, Chi V. Dang. (2006). Cancer's Molecular Sweet Tooth and the Warburg Effect: Figure 1.. Cancer Res. 66, 8927-8930;
- Во власти опухоли: почему метастазы так сложно остановить?;
- Гипоксия, негипоксическая гипоксия и иммунитет;
- Anthony R. Martin, Cyril Ronco, Luc Demange, Rachid Benhida. (2017). Hypoxia inducible factor down-regulation, cancer and cancer stem cells (CSCs): ongoing success stories. Med. Chem. Commun.. 8, 21-52;
- Ruei-Zeng Lin, Li-Fang Chou, Chi-Chen Michael Chien, Hwan-You Chang. (2006). Dynamic analysis of hepatoma spheroid formation: roles of E-cadherin and β1-integrin. Cell Tissue Res. 324, 411-422;
- Hon Fai Chan, Ying Zhang, Yi-Ping Ho, Ya-Ling Chiu, Youngmee Jung, Kam W. Leong. (2013). Rapid formation of multicellular spheroids in double-emulsion droplets with controllable microenvironment. Sci Rep. 3;
- Что такое внеклеточный матрикс и почему его все изучают;
- Cindy K. Miranti, Joan S. Brugge. (2002). Sensing the environment: a historical perspective on integrin signal transduction. Nat Cell Biol. 4, E83-E90;
- I. Smyrek, B. Mathew, S. C. Fischer, S. M. Lissek, S. Becker, E. H. K. Stelzer. (2019). E-cadherin, actin, microtubules and FAK dominate different spheroid formation phases and important elements of tissue integrity. Biology Open. 8, bio037051;
- Emmanouhl S. Tzanakakis, Linda K. Hansen, Wei-Shou Hu. (2001). The role of actin filaments and microtubules in hepatocyte spheroid self-assembly. Cell Motil. Cytoskeleton. 48, 175-189;
- Marius Raica, Anca Maria Cimpean, Domenico Ribatti. (2009). Angiogenesis in pre-malignant conditions. European Journal of Cancer. 45, 1924-1934;
- Marianne van Dijk, Sara A. Göransson, Staffan Strömblad. (2013). Cell to extracellular matrix interactions and their reciprocal nature in cancer. Experimental Cell Research. 319, 1663-1670;
- Elisabete C. Costa, Vítor M. Gaspar, Paula Coutinho, Ilídio J. Correia. (2014). Optimization of liquid overlay technique to formulate heterogenic 3D co-cultures models. Biotechnol. Bioeng.. 111, 1672-1685;
- 12 методов в картинках: клеточные технологии;
- Yukie Yoshii, Atsuo Waki, Kaori Yoshida, Anna Kakezuka, Maki Kobayashi, et. al.. (2011). The use of nanoimprinted scaffolds as 3D culture models to facilitate spontaneous tumor cell migration and well-regulated spheroid formation. Biomaterials. 32, 6052-6058;
- Corning matrigel matrix. Corning Life Sciences;
- Susan Breslin, Lorraine O’Driscoll. (2013). Three-dimensional cell culture: the missing link in drug discovery. Drug Discovery Today. 18, 240-249;
- Elisabete C. Costa, Duarte de Melo-Diogo, André F. Moreira, Marco P. Carvalho, Ilídio J. Correia. (2018). Spheroids Formation on Non-Adhesive Surfaces by Liquid Overlay Technique: Considerations and Practical Approaches. Biotechnol. J.. 13, 1700417;
- Clare Selden, Barry Fuller. (2018). Role of Bioreactor Technology in Tissue Engineering for Clinical Use and Therapeutic Target Design. Bioengineering. 5, 32;
- Тканевая инженерия — окно в современную медицину;
- Sabah Haq, Vanessa Samuel, Fiona Haxho, Roman Akasov, Maria Leko, et. al.. (2017). Sialylation facilitates self-assembly of 3D multicellular prostaspheres by using cyclo-RGDfK(TPP) peptide. OTT. Volume 10, 2427-2447;
- Опухолевые разговоры, или Роль микроокружения в развитии рака;
- Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет;
- Sylvain L'Espérance, Magdalena Bachvarova, Bernard Tetu, Anne-Marie Mes-Masson, Dimcho Bachvarov. (2008). Global gene expression analysis of early response to chemotherapy treatment in ovarian cancer spheroids. BMC Genomics. 9, 99;
- SV Kozin, LE Gerweck. (1998). Cytotoxicity of weak electrolytes after the adaptation of cells to low pH: role of the transmembrane pH gradient. Br J Cancer. 77, 1580-1585;
- Theresa M. Allen. (2002). Ligand-targeted therapeutics in anticancer therapy. Nat Rev Cancer. 2, 750-763;
- Elvin Blanco, Haifa Shen, Mauro Ferrari. (2015). Principles of nanoparticle design for overcoming biological barriers to drug delivery. Nat Biotechnol. 33, 941-951;
- Sheng Lu, Feng Zhao, Qiuxin Zhang, P. Chen. (2018). Therapeutic Peptide Amphiphile as a Drug Carrier with ATP-Triggered Release for Synergistic Effect, Improved Therapeutic Index, and Penetration of 3D Cancer Cell Spheroids. IJMS. 19, 2773;
- Babett Bartling, Hans-Stefan Hofmann, Rolf-Edgar Silber, Andreas Simm. (2008). Differential impact of fibroblasts on the efficient cell death of lung cancer cells induced by paclitaxel and cisplatin. Cancer Biology & Therapy. 7, 1250-1261;
- NamHuk Baek, Ok Won Seo, MinSung Kim, John Hulme, Seong Soo A An. (2016). Monitoring the effects of doxorubicin on 3D-spheroid tumor cells in real-time. OTT. Volume 9, 7207-7218;
- Seong Soo A. An, Ok Won Seo, Jaehwa Lee, John Hulme, NamHyuk Baek. (2016). Real-time monitoring of cisplatin cytotoxicity on three-dimensional spheroid tumor cells. DDDT. Volume 10, 2155-2165;
- Chantal Feder-Mengus, Sourabh Ghosh, Anca Reschner, Ivan Martin, Giulio C. Spagnoli. (2008). New dimensions in tumor immunology: what does 3D culture reveal?. Trends in Molecular Medicine. 14, 333-340;
- Candace M. Cham, Thomas F. Gajewski. (2005). Glucose Availability Regulates IFN-γ Production and p70S6 Kinase Activation in CD8+ Effector T Cells. J Immunol. 174, 4670-4677;
- Eva Gottfried, Leoni A. Kunz-Schughart, Stephanie Ebner, Wolfgang Mueller-Klieser, Sabine Hoves, et. al.. (2006). Tumor-derived lactic acid modulates dendritic cell activation and antigen expression. Blood. 107, 2013-2021;
- Tristan Courau, Julie Bonnereau, Justine Chicoteau, Hugo Bottois, Romain Remark, et. al.. (2019). Cocultures of human colorectal tumor spheroids with immune cells reveal the therapeutic potential of MICA/B and NKG2A targeting for cancer treatment. j. immunotherapy cancer. 7;
- Т-клетки — марионетки, или как перепрограммировать Т-лимфоциты, чтобы вылечить рак;
- Иммуностимулирующие вакцины;
- Биотехнология антител;
- Иммунитет без тормозов: Нобелевская премия за антитела против рака (2018);
- Генная терапия против рака;
- Franziska Hirschhaeuser, Heike Menne, Claudia Dittfeld, Jonathan West, Wolfgang Mueller-Klieser, Leoni A. Kunz-Schughart. (2010). Multicellular tumor spheroids: An underestimated tool is catching up again. Journal of Biotechnology. 148, 3-15;
- Ariane E. Erickson, Sheeny K. Lan Levengood, Jialu Sun, Fei-Chien Chang, Miqin Zhang. (2018). Fabrication and Characterization of Chitosan-Hyaluronic Acid Scaffolds with Varying Stiffness for Glioblastoma Cell Culture. Adv. Healthcare Mater.. 7, 1800295;
- Beatriz A Pazmino Betancourt, Stephen J Florczyk, Mylene Simon, Derek Juba, Jack F Douglas, et. al.. (2018). Effect of the scaffold microenvironment on cell polarizability and capacitance determined by probabilistic computations. Biomed. Mater.. 13, 025012;
- Carrie Lovitt, Todd Shelper, Vicky Avery. (2014). Advanced Cell Culture Techniques for Cancer Drug Discovery. Biology. 3, 345-367;
- Arno Amann, Marit Zwierzina, Gabriele Gamerith, Mario Bitsche, Julia M. Huber, et. al.. (2014). Development of an Innovative 3D Cell Culture System to Study Tumour - Stroma Interactions in Non-Small Cell Lung Cancer Cells. PLoS ONE. 9, e92511;
- Ana S. Nunes, Andreia S. Barros, Elisabete C. Costa, André F. Moreira, Ilídio J. Correia. (2019). 3D tumor spheroids as in vitro models to mimic in vivo human solid tumors resistance to therapeutic drugs. Biotechnology and Bioengineering. 116, 206-226;
- Gianluca Colella, Flavio Fazioli, Michele Gallo, Annarosaria De Chiara, Gaetano Apice, et. al.. (2018). Sarcoma Spheroids and Organoids—Promising Tools in the Era of Personalized Medicine. IJMS. 19, 615.