У бактерий тоже есть прионы
06 февраля 2017
У бактерий тоже есть прионы
- 2169
- 0
- 5
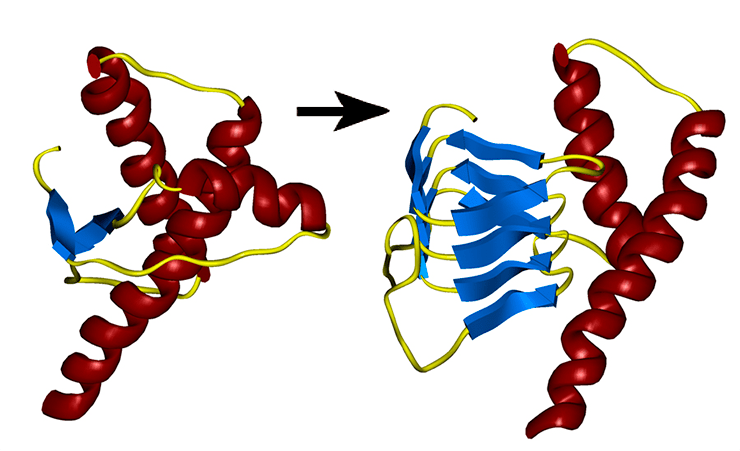
Как изменяется нормальный белок при превращении в прион.
сайт ucsf.edu
-
Автор
-
Редакторы
Темы
До 2017 года прионы находили только у эукариот и считали, что они появились уже после того, как бактерии и эукариоты разошлись по разным ветвям эволюционного древа. Но, как выяснилось, бактериальные прионы тоже существуют и могут регулировать экспрессию генов своих микрохозяев. Однако нельзя исключить, что их влияние распространяется и на макроорганизмы.
Прионы — это инфекционные агенты белковой природы, вызывающие такие заболевания, как например коровье бешенство, куру и болезнь Крейтцфельдта-Якоба. Прионы способны изменять конформацию гомологичного им нормального клеточного белка, превращая его в такой же прион. Они — единственные известные инфекционные агенты, которые размножаются без участия нуклеиновых кислот. Большинство известных прионов содержит в своей структуре амилоидные фибриллы, которые, по сути, и определяют прионный фенотип [1], [2].
Амилоид — особая форма белка, в которой отдельные, называемые амилоидогенными, участки образуют фибриллярные полимеры с кросс-β-структурой (то есть состоящие из β-слоев, направленных перпендикулярно оси фибриллы). В процессе преобразования нормального белка в прион его α-спирали превращаются в β-слои (см. заглавный рисунок) [2].
Более детально прионная проблема уже неоднократно освещалась на страницах «биомолекулы»: «Разоблачитель белков-убийц» [3], «Прионы: исследования таинственных молекул продолжаются» [4], «Прионные и неприонные амилоиды: определяет ли конформация разницу в инфекционности?» [2] и «Мутация, защищающая от всех известных прионных болезней» [5].
До сих пор мы ничего не слышали о бактериальных прионах, хотя было известно, что дрожжевые прионы прекрасно размножаются в клетках бактерий [6]. Однако в середине 2000-х прионоподобные свойства обнаружил испанский ученый Рафаэль Хиральдо у одного из белков, инициирующих репликацию бактериальных плазмид. Специфический домен белка RepA (особенно в случае точечной мутации) менял конформацию на прионоподобную при контакте с плазмидной ДНК в месте начала репликации. Этот домен вызывал у бактерии Escherichia coli амилоидную протеинопатию, передающуюся от родительской клетки дочерним (вертикально), и уже безо всякой ДНК инициировал агрегацию молекул гомологичного белка in vitro. Наблюдавшие это ученые предположили, что такие конформационные перестройки лежат в основе регуляции копийности некоторых плазмид [3]. Авторы исследования относили к прионам амилоиды, способные придавать соответствующие свойства другим белкам и передаваться как вертикально, так и горизонтально (от клетки к клетке) — то есть обладать инфекционностью [7]. Возможно, из-за того что RepA не был инфекционным белком, исследователи решили называть его и подобные молекулы прионоидами. Но этот термин так и не стал «вирусным», и другие биологи продолжают называть все прионоподобные белки прионами.
Энди Юань и Энн Хохшильд из Гарвардской медицинской школы (США) изучили почти 60 000 бактериальных геномов в поисках детерминант белков, содержащих потенциальный прион-формирующий домен (cPrD). И их усилия не были тщетными: такой домен — размером 68 аминокислотных остатков — обнаружили внутри N-концевого домена фактора терминации транскрипции Clostridium botulinum (Cb-Rho). Rho, или ρ-фактор — крайне консервативная гексамерная хеликаза. Присоединяясь к образующемуся транскрипту примерно за 100 нуклеотидов до сайта терминации, она передвигается по РНК и, добравшись до притормозившей на сайте терминации РНК-полимеразы, ослабляет связь между ДНК и РНК (рис. 1). Это приводит к окончанию работы полимеразы [6].
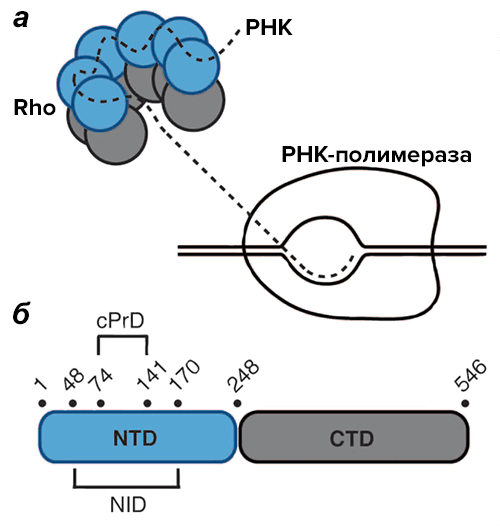
Рисунок 1. Rho-фактор. а — Модель погони ρ-фактора за РНК-полимеразой. б — Схема строения Cb-Rho. NTD — N-концевой домен, CTD — C-концевой домен, NID — N-концевой внутренний домен, cPrD — потенциальный прион-формирующий домен.
Исследователи протестировали Cb-Rho на амилоидогенность. Эксперимент проводили, как обычно, на модельной бактерии E. coli — в данном случае это удобно потому, что она может секретировать амилоиды во внешнюю среду (рис. 2). В результате ρ-факторы клостридий — и с 68-нуклеотидным cPrD, и с полным 248-нуклеотидным NTD — оказались способными к формированию амилоидов. А если N-концевой домен «родного» ρ-фактора E. coli заменяли на NTD от Cb-Rho, то клостридиальный cPrD придавал способность такому химерному Rho принимать в клетках две разные формы: растворимую, которая эффективно останавливала транскрипцию, и агрегированную, прионную, самовоспроизводящуюся у более чем 120 бактериальных поколений. Белок в прионной конформации вызывал обширные изменения транскриптома бактерий, поскольку РНК-полимераза во время транскрипции не останавливалась на Rho-зависимых терминаторах [6].

Рисунок 2. Выделение амилоида бактериями Escherichia coli. Клетки высевали на твердую среду, содержащую амилоид-связывающую краску Congo Red (CR). Дрожжевой белок Sup35 (Sup35NM) с прион-формирующим доменом и его вариант без PrD (Sup35M) использовали как положительный и отрицательный контроли соответственно. Материал из среды визуализировали с помощью светлопольной микроскопии (Bright-field) и между скрещенными поляризаторами (Cross-polarized). Последний метод показывает CR-связанные амилоиды окрашенными в зеленый цвет. Cb-Rho NTD — клостридиальный ρ-фактор с полным N-концевым доменом, Cb-Rho cPrD — только с cPrD.
Но если прокариотический cPrD клостридий так похож на эукариотический PrD дрожжей, может ли он его заменить? Ученые решили это проверить. У дрожжей PrD входит в состав N-концевого домена прион-формирующего белка Sup35 — основного фактора терминации трансляции. Создав химерный cPrD из Cb-Rho и Sup35С (С-концевого домена Sup35) и внеся генетическую конструкцию в клетки дрожжей, Юань и Хохшильд наблюдали обычный, неприонный, дрожжевой фенотип, который мог переходить в устойчивый прионный. Так удалось узнать, что бактериальный прион-формирующий домен беспрепятственно функционирует в клетках эукариот [6].
Открытие бактериального приона, способного «работать» в эукариотических клетках, подтверждает существование белковой наследственности у бактерий и позволяет предположить, что прионы появились еще до эволюционного расхождения эукариот и бактерий. Конечно, RepA-прионоид был обнаружен намного раньше, но кодируется он не бактериальной хромосомой, а плазмидой, и, вероятно, поэтому безапелляционно бактериальным прионом биологи посчитали именно Cb-Rho.
Домен cPrD обнаружили в составе ρ-факторов шести бактериальных типов, включающих основных представителей человеческой кишечной микробиоты. А это значит, что прионы бактерий могут каким-то образом влиять и на жизнедеятельность клеток человека.
Поскольку Rho-факторы, «прионизируясь», изменяют транскриптом, они могут быть источниками эпигенетического разнообразия бактерий и адаптировать их к изменяющимся условиям среды. Например, помогать патогенам уходить от иммунного надзора во время инфекции или способствовать приобретению персистирующими клетками толерантности к антибиотикам.
Литература
- Википедия: «Прионы»;
- Прионные и неприонные амилоиды: определяет ли конформация разницу в инфекционности?;
- Разоблачитель белков-убийц;
- Прионы: исследования таинственных молекул продолжаются;
- Мутация, защищающая от всех известных прионных болезней;
- Yuan A.H. and Hochschild A. (2017). A bacterial global regulator forms a prion. Science. 355, 198–201;
- Giraldo R., Moreno-Díaz de la Espina S., Fernández-Tresguerres M.E., Gasset-Rosa F. (2011). RepA-WH1 prionoid: a synthetic amyloid proteinopathy in a minimalist host. Prion. 5, 60–64.