
Вселенная слёз
16 октября 2025
Вселенная слёз
- 356
- 1
- 3
Кристаллизованная человеческая слеза. Микрофотография в поляризованном свете.
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: В слезах каждого человека заключена целая вселенная, наполненная тысячами уникальных молекул. Благодаря своей доступности и неинвазивности, они обладают огромным потенциалом и способны рассказать о здоровье больше, чем можно вообразить.
Конкурс «Био/Мол/Текст»-2025/2026
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2025/2026.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Глаза — одни из самых уникальных органов человеческого тела. Они состоят из множества специфических тканей, необходимых для поддержания прозрачности, и позволяют видеть окружающий мир. Защитный внешний слой наших глаз, называемый слезной пленкой, содержит тысячи молекул, включая белки, липиды, электролиты, муцины, метаболиты и гормоны. И, оказывается, всего несколько микролитров этой жидкости может стать важным инструментом для раннего выявления самых разных заболеваний (не только глазных, но и системных), причем совершенно неинвазивным. Согласитесь, наряду с другими биожидкостями, такими как кровь, слюна и моча, слёзы выглядят гораздо более привлекательно и даже несколько романтично. Мы отправимся в небольшое путешествие во вселенную слёзи посмотрим, из чего они состоят, как можно получить слёзные образцы для исследований и о каких заболеваниях они могут нам рассказать.
Слёзы разные нужны, слёзы разные важны
Слёзы — это прозрачная жидкость, которая увлажняет и защищает поверхность глаза, помогает бороться с инфекциями, способствует заживлению различных повреждений, вымывает пыль или другие раздражающие частицы и поддерживает высокое качество зрения. Слёзы выделяются не только для поддержания комфорта и чистоты глаз, но и в ответ на сильные эмоции — грусть, боль, радость, а также при раздражении пылью, дымом и другими внешними факторами.

Рисунок 1. Датский ученый-анатом Нильс Стенсен (1638–1686 гг.)
В 1662 году датский ученый Нильс Стенсен (рис. 1) (также известный как Николас Стено), проведя анатомические исследования, обнаружил, что источник слёз — слёзная железа [1], [2].
Стенсен изучал строение глаза и обнаружил железу, расположенную в верхней части глазницы, которая вырабатывает слезную жидкость. Он описал, как слёзы попадают в глаз через специальные каналы и стекают в носовую полость (что, кстати, объясняет, почему при плаче люди часто «шмыгают» носом). «Я полагаю, что эта жидкость, способствующая движению ресниц, образуется в слезной железе и транспортируется по ее протокам. Образование слёз зависит от внешних и внутренних условий», — утверждал Стенсен [2].
Именно тогда ученые начали выяснять, какую возможную эволюционную пользу может приносить эта жидкость. Теория Стенсена утверждала, что слёзы — это просто способ увлажнить глаза. За этой теорией последовали и другие, например, выдвинутая биохимиком Уильямом Фреем в 1985 году, которая заключалась в том, что плач удаляет из организма токсичные вещества, которые накапливаются во время эпизодов стресса.
Слезы всегда вызывали интерес, и не только у ученых. Во время личных потрясений фотограф Роуз-Линн Фишер задалась вопросом, как выглядят слезы вблизи. Она собрала 100 образцов слёз — свои собственные и слезы мужчин, женщин и детей, выпущенные в разные моменты жизни и при разных обстоятельствах: при чувстве горя, боли, благодарности и радости, а также при нарезке лука, и проанализировала их под микроскопом (рис. 2). Она обнаружила, что каждая слеза изображала драматический миниатюрный пейзаж. Проект «Топография слез» запечатлел все уникальные моменты человеческого опыта.
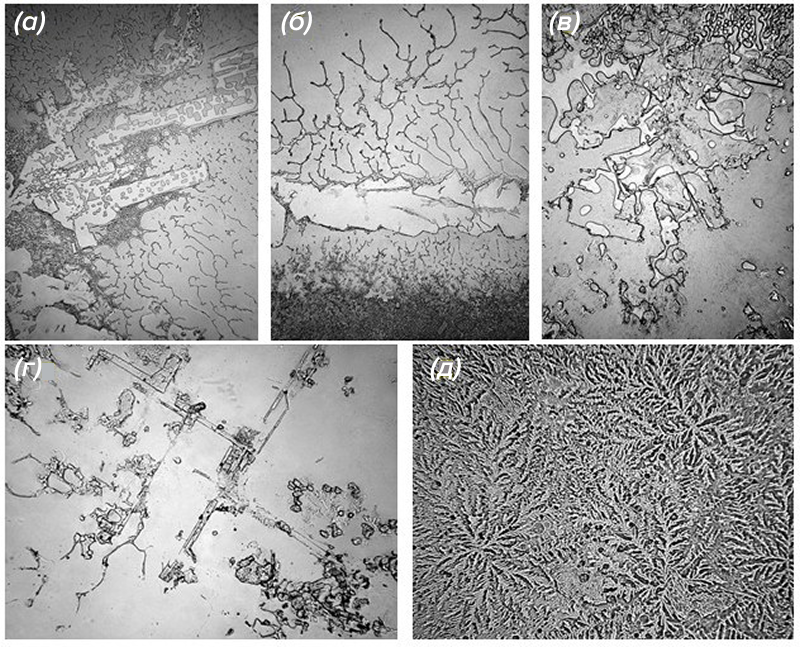
Рисунок 2. Изображения разных видов слез под микроскопом: (а) — слезы воспоминаний; (б) — базальные слезы; (в) — слезы от смеха; (г) — слезы горя; (д) — слезы от лука.
Рисунок слезы, который можно увидеть под микроскопом, называют папоротником [3]. По сути, это отчетливый рисунок, образованный кристаллизацией, который появляется, когда слезы высыхают на воздухе на предметном стекле. Однако, поскольку структуры, наблюдаемые под микроскопом, кристаллизуются по-разному, в зависимости от внешних условий и скорости испарения, даже две слезы с одинаковым химическим составом могут выглядеть совершенно по-разному. Именно поэтому сами по себе эти узоры не позволяют точно определить химический состав слёз. Но папоротники могут служить косвенным показателем стабильности слёзной пленки и используются, например, в диагностике синдрома сухого глаза. Дело в том, что папоротниковые кристаллы в основном состоят из хлорида натрия, хлорида калия и следовых ионов, а поверхность кристаллов покрыта муцинами и высокомолекулярными белками, которые косвенно контролируют образование кристаллов [4]. Поэтому четкий густой папоротник указывает на то, что слёзная пленка стабильна и слеза имеет нормальный состав электролитов и муцинов. А разреженный фрагментированный папоротник чаще говорит о дефиците муцинового слоя слезной пленки, а это одна из главных причин развития синдрома сухого глаза.
Итак, слеза, как мы видим — это сложная физиологическая жидкость, причем непостоянная, так как ее состав зависит от того, с каким типом слез мы имеем дело.
Известны три разных типа слез: базальные, рефлекторные и эмоциональные [5]. Базальные слёзы (или слёзы открытых глаз) увлажняют наши глаза и поддерживают их здоровое состояние. Они производятся и обновляются постоянно, когда глаза открыты. С другой стороны, рефлекторные и эмоциональные слезы выделяются как при открытых, так и при закрытых глазах, ведь, когда мы плачем, мы зажмуриваемся. В случае рефлекторных слез — из-за раздражителей, например, паров лука, а в случае эмоциональных — из-за нахлынувших на нас чувств. Есть также слезы, которые образуются во время сна и в основном отвечают за очистку глаз от клеточного мусора и поддержание гомеостаза [5], [6]. Они выделяются, когда глаза полностью закрыты, но в это время мы не плачем.
Интересно, что ученые нашли некоторые доказательства того, что эмоциональные слезы по химическому строению отличаются от тех, которые люди проливают, нарезая лук. Основная причина этому – участие различных функциональных единиц слезных желез. Например, для базальных слез стимуляция не требуется. Эмоциональные слезы секретируются при стимуляции слезной железы и контролируются нейронными сигналами из мозга, а потому включают в себя гормоны стресса [7]. В свою очередь, рефлекторные слезы вызываются в ответ на любое раздражение глаз, вызванное рефлекторным механизмом. Их стимуляция вызывается чувствительными нервами на поверхности глаза, которые связаны с ганглиями тройничного нерва мозга. Рефлекторные слёзы секретируются из-за любой инородной частицы, которая попадает в глаз, а также из-за яркого света и присутствия раздражителей, таких как пары нарезанного лука, духи или ароматизаторы.
Известно, что белковый компонент этих типов слёз различается. Например, уровни секреторного иммуноглобулина-А выше в слезах закрытых глаз и ниже — в базальных и рефлекторных. Хотя другие белки, такие как лактоферрин, липокалин-1 и лизоцим, существенно не изменяют свою концентрацию в этих типах слез. Эмоциональные слезы могут отличаться от рефлекторных содержанием феромонов, которые влияют на поведение и имеют немного более высокую общую концентрацию белка — 6 мг/мл по сравнению с 4 мг/мл [5].
Слёзный интерфейс
Слёзы — это не только вода. Вода сама по себе не могла бы защищать нежный эпителий роговицы и конъюнктивы и обеспечивать четкое и стабильное зрение. Каждый раз, когда вы моргаете, по поверхности роговицы распространяется тонкий слой слёз, который называется «слёзной пленкой». Объем слёзной пленки составляет приблизительно от 3 до 10 мкл, ее толщина — 3 мкм, и секретируется она со скоростью от 1 до 2 мкл/мин [8].
Слёзная пленка — это своеобразный интерфейс между эпителием поверхности глаза и окружающей средой, и имеет, как вы уже поняли, очень сложный состав, включающий воду, электролиты, муцины, белки и липиды [9], [10]. Все слёзные компоненты работают согласованно, непрерывно смазывая, увлажняя, разглаживая, насыщая кислородом, выводя продукты жизнедеятельности и защищая поверхность глаза во время и между циклами моргания.
Согласно классической модели, слезную пленку можно рассматривать как «сэндвич», состоящий из трех слоев [11], [12]:
- Внутренний слизистый (муциновый) слой, который удерживает слезу прикрепленной к глазу. Он состоит из геля с преобладанием муцина, образованного двумя слоями: гликокаликсом и слизистым слоем. Сзади слой гликокаликса располагается на микроворсинках поверхностного эпителия роговицы и вырабатывается эпителиальными клетками роговицы и конъюнктивы.
- Водный средний слой (самый толстый), который служит для поддержания увлажненности глаза, отталкивания бактерий и защиты роговицы. Этот слой секретируется слёзными железами и на 98% состоит из воды, а оставшиеся 2% состоят из натрия, калия (в 6 раз больше, чем в плазме), хлорида, кальция, аминокислот и т.д.
- Внешний маслянистый (липидный) слой, необходимый для поддержания гладкости поверхности слезы, чтобы глаз мог видеть, и для предотвращения испарения других слоев. Липиды внутри этого слоя секретируются в основном мейбомиевыми железами (крошечные сальные железы, расположенные на краю век, которые касаются друг друга, когда глаза закрыты), с небольшим вкладом желез Молля и Цейсса, расположенных в веках.
Однако в реальности эти слои перекрываются и смешиваются. А благодаря технологическим достижениям, а также в связи с улучшением понимания сложной природы слезной жидкости вышепредставленная модель постепенно превратилась в двухслойную структуру (что-то вроде коктейля) — с помощью сканера слезной пленки ученые смогли визуализировать только слизисто-водный и липидный слои (рис. 3) [13], [14].
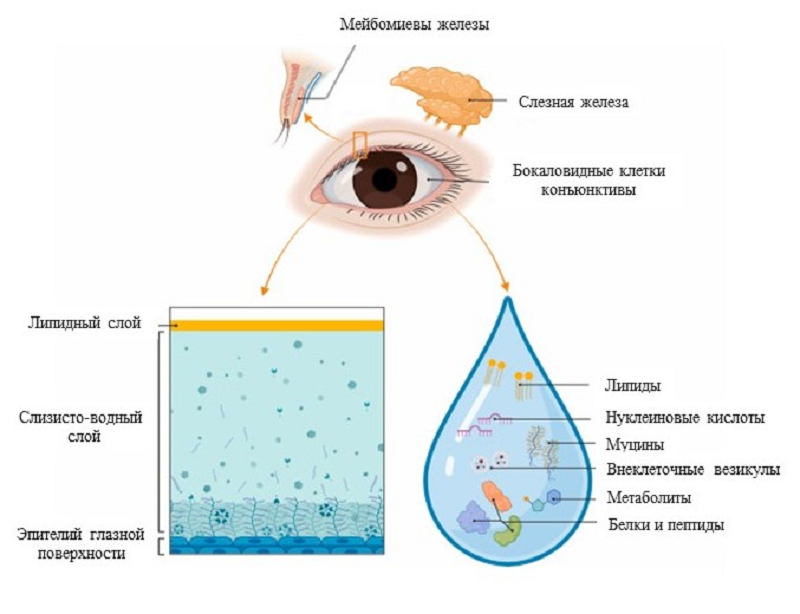
Рисунок 3. Структура и компоненты слёзной жидкости. Слёзная жидкость вырабатывается и секретируется слёзными железами, мейбомиевыми железами и бокаловидными клетками конъюнктивы. Она состоит из двух слоев: липидного и слизисто-водного. В состав слёзной жидкости входят липиды, нуклеиновые кислоты, муцины, внеклеточные везикулы, метаболиты, белки и пептиды.
Первый из них представляет собой гелеобразный композит водной жидкости и муцина, а внешний липидный слой состоит из полярных липидов, прилегающих к слизисто-водному слою, и неполярных липидов. Муцины способствуют стабилизации и распространению слезной жидкости, связываясь с водой благодаря высокому уровню гликозилирования. Поверхностный липидный слой слезной пленки секретируется в основном мейбомиевыми железами и действует как интерфейс между слизисто-водным слоем и воздухом, уменьшая испарение и снижая поверхностное натяжение [11].
Человеческие слёзы содержат более 1500 белков [10], [15], а их общая концентрация колеблется от 6 до 11 мг/мл, причем наиболее распространенным является лизоцим [16]. Среди других распространенных белков — лактоферрин, липокалин, секреторный иммуноглобулин А, супероксиддисмутаза, цистатины и ингибитор α1-протеазы, которые вместе с лизоцимом составляют более 90% всех белков слезы [17]. В слезах можно также обнаружить факторы роста и нейротрофические факторы, цитокины, гормоны, матриксные металлопротеиназы, протеазы и ингибиторы протеаз, гликопротеины и, что особенно интересно, циркулирующие микроРНК [16–18].
Но сначала разберемся, как собрать слёзы и сколько их нужно, чтобы что-нибудь в них увидеть.
Полезай, слеза, в пробирку
Кажется, что может быть проще, чем собрать слёзы? В нашем безумном мире, полном стресса, очень легко заставить кого-нибудь заплакать — и вуаля! Готова целая пробирка! (рис. 4)

Рисунок 4. Ученый, собирающий слезы своего коллеги в пробирку.
изображение сгенерировано нейросетью
Однако всё не так просто. Во-первых, слёзы в том виде, в котором мы привыкли их видеть, слишком разбавлены и не подойдут для исследований. А во-вторых, для того, чтобы последующие анализы были качественными и точными, сбор слёз должен проходить согласно установленным методам. Такие методы гарантируют, что образцы будут репрезентативными и надежными для изучения биомаркеров слёзной жидкости. Итак, наиболее часто для сбора слез используют капиллярные трубки и полоски Ширмера.
Капиллярные трубки
Слёзную жидкость можно собирать с помощью капилляров (рис. 5). Для этого слеза втягивается в трубку посредством капиллярного действия (объем примерно 5–10 мкл). Такая техника имеет минимальный контакт с поверхностью глаза, что позволяет избегать раздражения конъюнктивы и сбора эпителиальных клеток. Однако этот процесс может быть медленным, или его может быть трудно выполнить у определенных групп пациентов, например, у маленьких детей. После сбора полученная слёзная жидкость извлекается из капилляров путем центрифугирования.
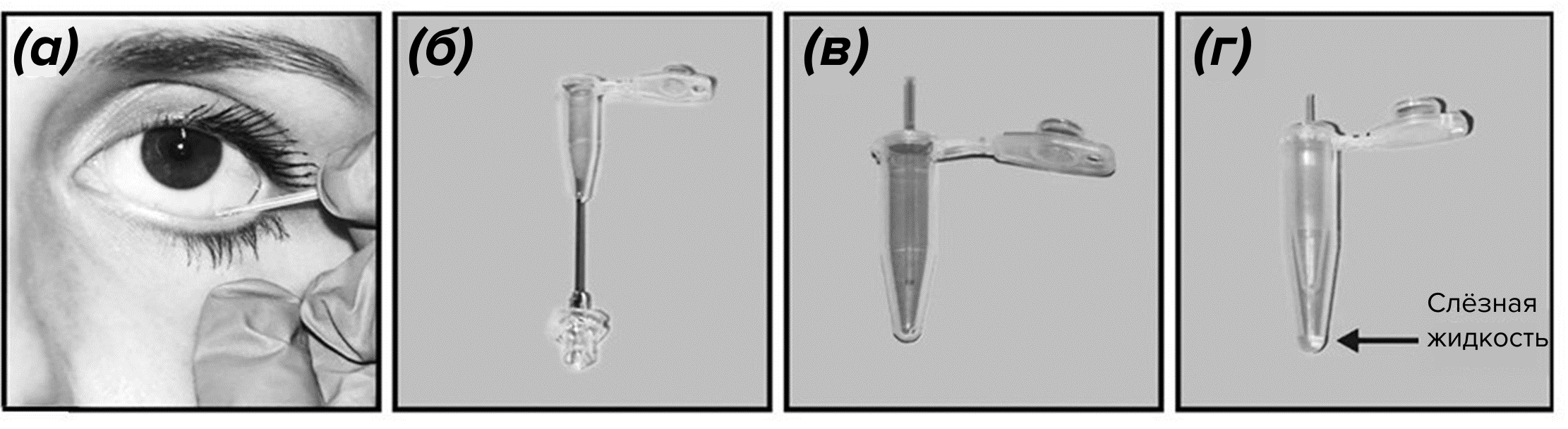
Рисунок 5. Сбор слёзной жидкости с помощью капиллярных трубок. (а) — капиллярная трубка помещается в нижнюю часть глаза до тех пор, пока не будет собран желаемый объем слёзной жидкости с использованием капиллярного эффекта. (б) — далее капилляр переносится в проколотую пробирку объемом 0,5 мл и (в), (г) — центрифугируется в пробирке объемом 1,5 мл для получения слезной жидкости.
Полоски Ширмера
Полоски Ширмера, по сути, представляющие собой фильтровальную бумагу, обычно используются в клинической практике для оценки объема слезной жидкости. Эти полоски недорогие, а метод сбора довольно прост. Полоска помещается на дальний угол глаза, подальше от слезных протоков, примерно на пять минут, пока она не станет влажной от слезной жидкости, которая покрывает и защищает глаз. К этому моменту бумага соберет около 10–15 микролитров слёз (рис. 6). Затем пропитанная часть полоски Ширмера отрезается и помещается в пробирку с NaCl, инкубируется некоторое время и затем центрифугируется [19], [20].
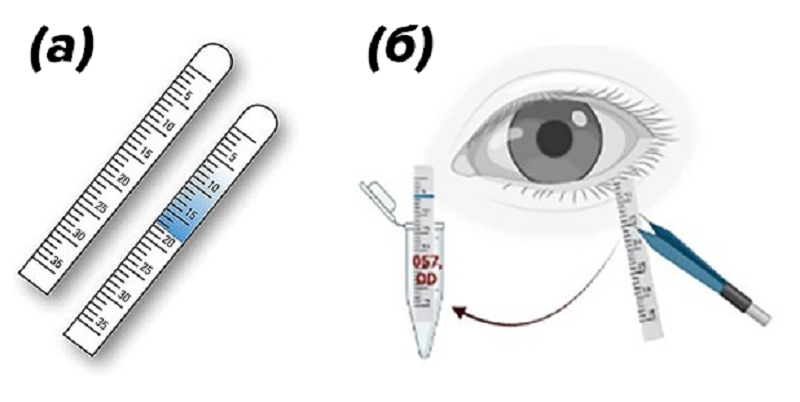
Рисунок 6. Полоски Ширмера (а) и сбор слезной жидкости с помощью полоски Ширмера (б).
коллаж автора с использованием источников [20] и amazon.com
Несмотря не преимущества, полоски Ширмера имеют ограничения, которые включают в себя раздражение поверхности глаза после удаления полоски, особенно у пациентов с синдромом сухого глаза, а также сбор эпителиальных клеток конъюнктивы. Кроме того, продолжительность смачивания полосок Ширмера может варьироваться в зависимости от производителя из-за различий в размере пор и самих полосок, а также плотности целлюлозных волокон [19].
Другие методы
Помимо представленных выше методов сбора, существуют и другие [14], [19], [21]. Например, можно использовать:
- Мини-губки из целлюлозы или полиуретана, которые помещают в нижний слёзный мениск и удерживают в таком положении в течение определенного времени для сбора слезной жидкости.
- Промывание глазной поверхности, которое является наиболее щадящим методом сбора. Для этого специальный раствор наносят с помощью микропипетки на поверхность глаза пациента, просят его закрыть глаз и несколько раз вращать глазным яблоком во всех направлениях, а затем собрать слезу с помощью стеклянных капилляров или микропипетки.
- Тампоны, с помощью которых можно собирать слёзную жидкость вместе с клетками конъюнктивы, что делает его выгодным для исследований, анализирующих как клеточные, так и жидкостные компоненты. В клинической практике глазные мазки уже используются для исследования поверхностных бактериальных инфекций глаз, таких как конъюнктивит.
- Контактные линзы — самый удобный способ для пациентов, которые привыкли к их ношению.
В таблицу 1 для удобства включены все существующие методы сбора слезной жидкости, их преимущества и недостатки.
| Метод | Преимущества | Недостатки |
|---|---|---|
| Капиллярные трубки | Простота применения, минимальный контакт с поверхностью глаза | Длительный сбор |
| Полоски Ширмера | Простота применения | Раздражение поверхности глаза после удаления полоски, сбор эпителиальных клеток конъюнктивы |
| Мини-губки | Простота применения и скорость забора | Удержание части жидкости внутри абсорбирующего материала. Возможность рефлекторного слезотечения, которое может изменить естественный состав слёзной жидкости |
| Промывание глазной поверхности | Щадящий способ | Разбавляет собранную слёзную жидкость, что не позволяет точно измерить ее исходный объем и затрудняет обнаружение биомаркеров с низким содержанием |
| Тампоны | Простота применения | Собирают неопределенный объем слёзной жидкости и могут удерживать аналиты в своем абсорбирующем материале. Механическое действие тампона может также стимулировать рефлекторное слезотечение |
| Контактные линзы | Удобство для пациентов, носящих контактные линзы, низкое раздражение | Может привести к отложению белка на линзе и уменьшению определенных компонентов слёзной жидкости из-за абсорбции |
Однако, вне зависимости от метода забора слёзной жидкости, следует соблюдать осторожность, чтобы не спровоцировать рефлекторные слёзные выделения, поскольку белковый профиль слёзной жидкости существенно различается: рефлекторные слёзные выделения, как правило, более разбавлены, чем базальные [22].
Покажи свои слёзы, и я скажу, чем ты болеешь
Мы приблизились к самому интересному и теперь посмотрим, о каких заболеваниях в настоящее время могут нам рассказать слёзы. И могут ли вообще?
Синдром сухого глаза
Слёзные биомаркеры, пожалуй, наиболее изучены при синдроме сухого глаза. Это многофакторное заболевание, которое обусловлено, прежде всего, нарушением гомеостаза слёзной пленки.
Исследования последних лет с использованием протеомного [23] и иммуноферментного анализа [24] показали, что среди слёзных биомаркеров синдрома сухого глаза — воспалительные цитокины и хемокины (IL-1β, IL-6, TNF-α, IL-17A, IL-8), белки и другие молекулы, отражающие патологические процессы на глазной поверхности — лактоферрин, эпидермальный фактор роста, липокалин-1, матриксная металлопротеиназа 9 [25]. Все эти факторы тесно связаны с тяжестью заболевания.
В 2013 году компания Quidel разработала тест InflammaDry, позволяющий в домашних условиях определять уровень матриксной металлопротеиназы-9 выше 40 нг/мл и таким образом выявлять синдром сухого глаза. Однако позже, на выборке из 1515 пациентов, было показано, что не у всех из них результат теста положительный, а только у пациентов с определенным клиническим фенотипом синдрома сухого глаза. Это, безусловно, ограничивает использование данного теста и указывает на необходимость дальнейших исследований [26].
Аллергический коньюнктивит
Слёзные биомаркеры также становятся важным инструментом в диагностике и мониторинге аллергического конъюнктивита. Один из таких показателей – общий иммуноглобулин E (IgE), уровень которого значительно повышается при сезонных и круглогодичных формах болезни [27].
Кроме IgE, важным диагностическим показателем считается периостин — белок, участвующий в ремоделировании тканей и воспалении. Его уровень в слезе значительно возрастает у пациентов с аллергическими заболеваниями конъюнктивы, особенно при более тяжелых формах. Также при аллергическом конъюнктивите в слезах увеличивается концентрация цитокинов Th2-типа (IL-4, IL-5, IL-13), хемокинов (эотаксин-1,-2,-3) и эозинофильного катионного белка, что отражает активное участие эозинофилов и Т-лимфоцитов в воспалительном процессе [28].
Изучение этих биомаркеров открывает новые возможности для ранней диагностики, оценки тяжести течения и индивидуального подбора терапии, что в перспективе может существенно повысить эффективность лечения и качество жизни пациентов.
Болезнь Альцгеймера
Выявлены также потенциальные биомаркеры слёзной жидкости для ранней диагностики и мониторинга деменции и болезни Альцгеймера [29], [30]. Голландские офтальмологи показали, что в слезах пациентов с нейродегенерацией регулярно детектируются амилоид-β (особенно Аβ40 и Аβ42) и тау-протеины (t-tau и p-tau) [31].
А в 2016 году венгерские ученые исследовали образцы слёз 14 пациентов с болезнью Альцгеймера и обнаружили, что скорость слезотечения, которая у контрольной группы составляла 6 мкл/мин, у пациентов с болезнью Альцгеймера увеличилась до 12 мкл/мин. Кроме того, концентрация белка в слезах также стала выше, при этом в них было значительно меньше лизоцима, липокалина 1 и лакритнина, а также больше дермцидина. И комбинация из этих четырех белков при диагностике болезни Альцгеймера имела 81% чувствительности и 77% специфичности [32].
Также было обнаружено, что в слезах больных пациентов увеличивается общее количество микроРНК, а микроРНК-200b-5p признана возможным биомаркером болезни Альцгеймера [33]. Однако до практического применения анализа слёзной жидкости для диагностики болезни Альцгеймера еще далеко. Необходимо провести дальнейшие крупномасштабные исследования, чтобы выработать единообразную интерпретацию биомаркеров и надежные протоколы тестирования.
Сахарный диабет и его глазные осложнения
Известно, что сахарный диабет характеризуется гипергликемией, возникающей вследствие гибели или дисфункции бета-клеток поджелудочной железы, вырабатывающих инсулин, либо из-за инсулинорезистентности [34]. Слёзы, также как кровь и моча, содержат глюкозу (пусть и в меньших количествах). И у пациентов с сахарным диабетом глюкозы в слезах больше, чем у здоровых людей [35], [36]. Но в отличие от крови и мочи, слёзная жидкость может быть получена и быстро, и неинвазивно. Кроме того, слёзы могут стать перспективной матрицей для разработки носимых систем непрерывного мониторинга, например, смарт-линз. Такие разработки уже ведутся, но пока все еще остаются на экспериментальной стадии.
Предполагается, что присутствие глюкозы в слёзной жидкости может быть обусловлено «утечкой плазмы», то есть частичной утечкой компонентов крови в слёзную жидкость через гематоэнцефалический барьер (рис. 7) [37].
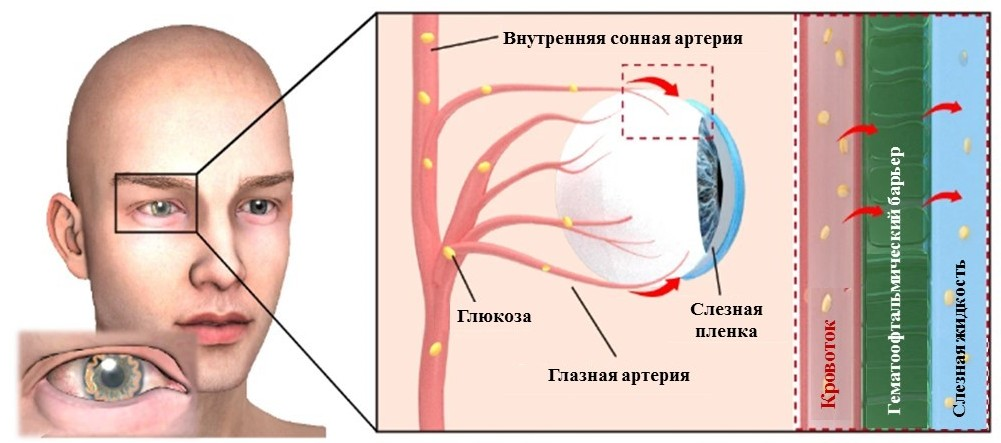
Рисунок 7. Схематическое изображение утечки плазмы в человеческом глазу. Красные стрелки указывают на утечку глюкозы из крови в слёзную пленку.
Хроническое повышение концентрации глюкозы в крови, как известно, часто приводит к микрососудистым осложнениям и повреждениям различных органов, включая глаза — вплоть до слепоты. К таким осложнениям относятся диабетические ретинопатия, нейропатия роговицы, макулярный отек и др. Все их в перспективе можно выявлять, оценив состав слёз. Недавно проведенный метаанализ показал, что фактор некроза опухоли (TNF-α) и фактор роста эндотелия сосудов (VEGF) независимо или в сочетании с другими биомаркерами — это неплохой инструмент, чтобы различать пациентов с глазными осложнениями диабета, пациентов без каких-либо глазных осложнений (только диабет) и людей без диабета (контроль) [38].
Рак
Удивительно, но слёзная жидкость может стать отличным сырьем для поиска биомаркеров, связанных с раком: белков слёзной жидкости, пептидов и микроРНК (все это претенденты на на роль индикаторов рака молочной железы [39–41] и рака толстой кишки [42]).
В одном исследовании было показано, что слёзная жидкость пациентов с раком молочной железы содержала лакриглобин в относительно более высокой концентрации, чем у здоровых людей [43]. А в других исследованиях в слезах пациентов с раком молочной железы рос уровень внеклеточной сульфатазы Sulf-1, цистатина SA, трифосфатизомеразы и снижалась концентрация GTP-связывающего белка Di-Ras2, белка S100-A9, альдегиддегидрогеназы [6].
В 2020 году японские ученые разработали новую технологию диагностики рака молочной железы — TearExo. В качестве биомаркеров они использовали экзосомы, содержащиеся в слёзной жидкости. Это первая в мире технология химической нанообработки для обнаружения экзосом в очень небольшом количестве биожидкости, которая демонстрирует довольно высокую чувствительность [44]. Исследователями было обнаружено четкое различие между образцами, которые были получены от здоровых доноров и от пациентов с раком молочной железы. Это указывает на возможность использования слёзной жидкости для диагностики данного заболевания.
Мигрень
Мигрень — сложное неврологическое заболевание, которое затрагивает миллионы людей по всему миру [45]. Одним из перспективных биомаркеров мигрени считается CGRP — пептид, связанный с геном кальцитонина (calcitonin gene-related peptide). Во время приступа его уровень значительно повышается не только в крови, но и в слёзной жидкости [46]. Это открытие легло в основу разработки экспресс-теста Tongo-test, созданного врачами-исследователями из Сеченовского университета. Тест-полоска, похожая на тест для диагностики COVID-19, всего за 10 минут позволяет определить уровень CGRP в слезе и определить, будет ли эффективна для пациента дорогостоящая таргетная терапия моноклональными антителами, блокирующими CGRP.
Слёзные биосенсоры
Уже совсем близко то будущее, в котором диагностические тест-полоски, аналогичные тесту на беременность, можно будет использовать для анализа слёзной жидкости для диагностики самых разных заболеваний. Кроме того, сегодня уже разрабатываются биосенсоры для измерения слёзных биомаркеров, в том числе с целью прогнозирования развития того или иного заболевания (рис. 8) [47]. К их числу относятся датчики, встроенные в контактные линзы, позволяющие непрерывно контролировать слёзные биомаркеры [48]. Также это колориметрические микрофлюидные патчи, которые выглядят как гибкие пластыри, меняющие цвет при сборе слёз и указывающие на уровни тех или иных биомаркеров [49].
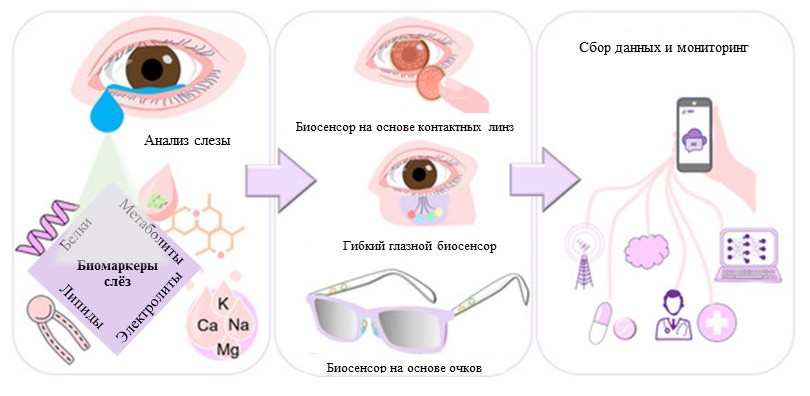
Рисунок 8. Слёзные биосенсоры.
И не менее значительный интерес представляют носимые датчики, интегрированные в очки, созданные на основе электрохимического детектора на переносице [47]. Например, такое устройство было представлено международной группой ученых в 2019 году и были получены предварительные результаты по обнаружению в слезах уровня алкоголя, витаминов и глюкозы [50].
Подобные разработки демонстрируют потенциал непрерывного и неинвазивного мониторинга слёзных биомаркеров, что может быть полезно не только для диагностики заболеваний, но и для контроля состояния организма в реальном времени.
Заключение
В 2022 году было создано международное сообщество, объединяющее врачей и исследователей, увлеченных изучением слёзной жидкости — Tear Researsh Network (TRN). Участники этой организации встречаются несколько раз в год для обсуждения проблем в исследованиях слёз, а также для реализации совместных проектов. В настоящее время в рамках сообщества создана рабочая группа Databae, которая работает над созданием открытой базы данных слёзных биомаркеров.
Несмотря на то, что сегодня уже выявлено огромное количество потенциальных слёзных биомаркеров, перевод этих открытий в клинические инструменты для диагностики и прогноза все еще остается сложной задачей. Главное препятствие к этому — отсутствие стандартизированных методов сбора проб, анализа и интерпретации результатов, что приводит к расхождениям между опубликованными исследованиями. Этот недостаток в сочетании с малыми размерами выборки в клинических испытаниях приводит к снижению надежности и воспроизводимости результатов, усложняет интерпретацию данных и препятствует переносу анализов слёзной жидкости с лабораторного стола в клинические условия.
Тем не менее, сегодня нет сомнений в том, что слёзы — это не только прозрачная соленая жидкость, омывающая наши лица в самые сложные и самые радостные моменты жизни, но также они — бесценный ресурс для развития персонализированной и прецизионной медицины. Учитывая огромное клиническое преимущество, их анализ, возможно, уже в ближайшем будущем станет рутинным тестом для мониторинга здоровья как в клиниках, так и за их пределами.
Литература
- Malik Aydin, Jana Dietrich, Joana Witt, Maximiliane S. C. Finkbeiner, Jonas J.-H. Park, et. al.. (2021). The Communication between Ocular Surface and Nasal Epithelia in 3D Cell Culture Technology for Translational Research: A Narrative Review. IJMS. 22, 12994;
- Swati Singh, Sayan Basu. (2020). The Human Lacrimal Gland: Historical Perspectives, Current Understanding, and Recent Advances. Current Eye Research. 45, 1188-1198;
- Timothy R. Golding, Anthony T. Baker, Joanne Rechberger, Noel A. Brennan. (1994). X-Ray and Scanning Electron Microscopic Analysis of the Structural Composition of Tear Ferns. Cornea. 13, 58-66;
- Yaying Wu, Chunyang Wang, Xin Wang, Yujie Mou, Kelan Yuan, et. al.. (2022). Advances in Dry Eye Disease Examination Techniques. Front. Med.. 8;
- Jennifer P. Craig, Mark D. P. Willcox, Pablo Argüeso, Cecile Maissa, Ulrike Stahl, et. al.. (2013). The TFOS International Workshop on Contact Lens Discomfort: Report of the Contact Lens Interactions With the Tear Film Subcommittee. Invest. Ophthalmol. Vis. Sci.. 54, TFOS123;
- Sandip K. Nandi, Deepanmol Singh, Jyoti Upadhay, Neeti Gupta, Nayan Dhiman, et. al.. (2021). Identification of tear-based protein and non-protein biomarkers: Its application in diagnosis of human diseases using biosensors. International Journal of Biological Macromolecules. 193, 838-846;
- Почему же ты плачешь, Homo sapiens?;
- Chang A. Y., Purt B. Biochemistry, Tear Film. StatPearls Publishing, 2023;
- Lei Zhou, Shao Zhen Zhao, Siew Kwan Koh, Liyan Chen, Candida Vaz, et. al.. (2012). In-depth analysis of the human tear proteome. Journal of Proteomics. 75, 3877-3885;
- Navid Fotovat-Ahmadi, Omer Siddiqui, Joshua Ong, Chanon Thanitcul, Christian Reinhardt, et. al.. (2025). The ocular surface tear film as a biomarker for systemic health. The Ocular Surface. 37, 283-300;
- Stephen C. Pflugfelder, Michael E. Stern. (2020). Biological functions of tear film. Experimental Eye Research. 197, 108115;
- Abraham Kayal. (2022). The Physiology of Tear Film. Dry Eye Syndrome - Modern Diagnostic Techniques and Advanced Treatments;
- Fani Segev, Noa Geffen, Anat Galor, Yoel Cohen, Raanan Gefen, et. al.. (2020). Dynamic assessment of the tear film muco-aqueous and lipid layers using a novel tear film imager (TFI). Br J Ophthalmol. 104, 136-141;
- Marlies Gijs, Nienke van de Sande, Clémence Bonnet, Jente Schmeetz, Rosa Fernandes, et. al.. (2025). A comprehensive scoping review of methodological approaches and clinical applications of tear fluid biomarkers. Progress in Retinal and Eye Research. 106, 101338;
- Suzanne Hagan, Eilidh Martin, Amalia Enríquez-de-Salamanca. (2016). Tear fluid biomarkers in ocular and systemic disease: potential use for predictive, preventive and personalised medicine. EPMA Journal. 7;
- Marianne Dor, Simone Eperon, Patrice H. Lalive, Yan Guex-Crosier, Mehrad Hamedani, et. al.. (2019). Investigation of the global protein content from healthy human tears. Experimental Eye Research. 179, 64-74;
- Aniko Rentka, Krisztina Koroskenyi, Jolan Harsfalvi, Zoltan Szekanecz, Gabriella Szucs, et. al.. (2017). Evaluation of commonly used tear sampling methods and their relevance in subsequent biochemical analysis. Ann Clin Biochem. 54, 521-529;
- Кодирующие некодирующие РНК;
- Franziska Bachhuber, André Huss, Makbule Senel, Hayrettin Tumani. (2021). Diagnostic biomarkers in tear fluid: from sampling to preanalytical processing. Sci Rep. 11;
- Marlies Gijs, Sinthuja Arumugam, Nienke van de Sande, Carroll A. B. Webers, Swaminathan Sethu, et. al.. (2023). Pre-analytical sample handling effects on tear fluid protein levels. Sci Rep. 13;
- Mirko Resan, Ivan Stanojevic, Aleksandra Petkovic-Curcin, Bojan Pajic, Danilo Vojvodic. (2015). Levels of interleukin-6 in tears before and after excimer laser treatment. VSP. 72, 350-355;
- Lei Zhou, Roger W. Beuerman. (2012). Tear analysis in ocular surface diseases. Progress in Retinal and Eye Research. 31, 527-550;
- 12 методов в картинках: протеомика;
- 12 методов в картинках: иммунологические технологии;
- Nimisha R Kumar, Machiraju Praveen, Raghav Narasimhan, Pooja Khamar, Sharon D’Souza, et. al.. (2023). Tear biomarkers in dry eye disease: Progress in the last decade. Indian Journal of Ophthalmology. 71, 1190-1202;
- Germán Mejía-Salgado, William Rojas-Carabali, Carlos Cifuentes-González, Laura Zárate-Pinzón, Camilo Andrés Rodríguez-Rodríguez, et. al.. (2025). Real-world performance of the inflammadry test in dry eye diagnosis: an analysis of 1,515 patients. Graefes Arch Clin Exp Ophthalmol. 263, 1623-1631;
- Xumin Shang, Yiqiu Zhang, Shunrong Luo, Miaomiao Liu, Hanqiao Li, et. al.. (2025). Tear IgE point-of-care testing for differentiating type I and type IV allergic conjunctivitis. Front. Med.. 12;
- Neeta Roy, Shir Levanon, Penny A. Asbell. (2020). Potential Biomarkers for Allergic Conjunctival Diseases. Eye & Contact Lens: Science & Clinical Practice. 46, S109-S121;
- Ayesha Majeed, Ben Marwick, Haoqing Yu, Hassan Fadavi, Mitra Tavakoli. (2021). Ophthalmic Biomarkers for Alzheimer’s Disease: A Review. Front. Aging Neurosci.. 13;
- Альбумин VS Альцгеймер;
- Marlies Gijs, Inez H. G. B. Ramakers, Pieter Jelle Visser, Frans R. J. Verhey, Marjo P. H. van de Waarenburg, et. al.. (2021). Association of tear fluid amyloid and tau levels with disease severity and neurodegeneration. Sci Rep. 11;
- Gergő Kalló, Miklós Emri, Zsófia Varga, Bernadett Ujhelyi, József Tőzsér, et. al.. (2016). Changes in the Chemical Barrier Composition of Tears in Alzheimer’s Disease Reveal Potential Tear Diagnostic Biomarkers. PLoS ONE. 11, e0158000;
- Aidan Kenny, Eva M. Jiménez-Mateos, María Ascensión Zea-Sevilla, Alberto Rábano, Pablo Gili-Manzanaro, et. al.. (2019). Proteins and microRNAs are differentially expressed in tear fluid from patients with Alzheimer’s disease. Sci Rep. 9;
- Сахарный диабет I типа, или Охота на поджелудочную железу;
- Wonjung Park, Hunkyu Seo, Jeongho Kim, Yeon-Mi Hong, Hayoung Song, et. al.. (2024). In-depth correlation analysis between tear glucose and blood glucose using a wireless smart contact lens. Nat Commun. 15;
- Masakazu Aihara, Naoto Kubota, Takahiro Minami, Rika Shirakawa, Yoshitaka Sakurai, et. al.. (2021). Association between tear and blood glucose concentrations: Random intercept model adjusted with confounders in tear samples negative for occult blood. J of Diabetes Invest. 12, 266-276;
- Wonjung Park, Hunkyu Seo, Jeongho Kim, Yeon-Mi Hong, Hayoung Song, et. al.. (2024). In-depth correlation analysis between tear glucose and blood glucose using a wireless smart contact lens. Nat Commun. 15;
- Mya Polkamp, Nhan H. T. Pham, Wilson K. M. Wong, Hrishikesh P. Hardikar, Pooja S. Kunte, et. al.. (2025). Tear-fluid-derived biomarkers of ocular complications in diabetes: a systematic review and meta-analysis. BMC Med. 23;
- SACHIKO INUBUSHI, HIROKI KAWAGUCHI, SACHIKO MIZUMOTO, TOMONARI KUNIHISA, MOTOI BABA, et. al.. (2020). Oncogenic miRNAs Identified in Tear Exosomes From Metastatic Breast Cancer Patients. Anticancer Res. 40, 3091-3096;
- Anna Daily, Prashanth Ravishankar, Steve Harms, V. Suzanne Klimberg. (2022). Using tears as a non-invasive source for early detection of breast cancer. PLoS ONE. 17, e0267676;
- Рак молочной железы с семейной историей;
- Yihong Kaufmann, Stephanie D. Byrum, Alison A. Acott, Eric R. Siegel, Charity L. Washam, et. al.. (2022). Proteomic profiling of tear fluid as a promising non-invasive screening test for colon cancer. The American Journal of Surgery. 224, 19-24;
- Victoria Evans, Cassandra Vockler, Michael Friedlander, Bradley Walsh, Mark DP Willcox. (2001). Lacryglobin in human tears, a potential marker for cancer. Clinical Exper Ophthalmology. 29, 161-163;
- Toshifumi Takeuchi, Kisho Mori, Hirobumi Sunayama, Eri Takano, Yukiya Kitayama, et. al.. (2020). Antibody-Conjugated Signaling Nanocavities Fabricated by Dynamic Molding for Detecting Cancers Using Small Extracellular Vesicle Markers from Tears. J. Am. Chem. Soc.. 142, 6617-6624;
- «Аймовиг» — спасение от мигрени?;
- Katharina Kamm, Andreas Straube, Ruth Ruscheweyh. (2019). Calcitonin gene-related peptide levels in tear fluid are elevated in migraine patients compared to healthy controls. Cephalalgia. 39, 1535-1543;
- Arunima Rajan, Jithin Vishnu, Balakrishnan Shankar. (2024). Tear-Based Ocular Wearable Biosensors for Human Health Monitoring. Biosensors. 14, 483;
- Weiyi Bai, Xingzhi Yu, Qing Li, Huiling Tan, Ke Ma, et. al.. (2024). Recent advances in the study of tear biomarkers and contact lens-based biosensors. Chemical Engineering Journal. 499, 156540;
- Zihu Wang, Yan Dong, Xiaoxiao Sui, Xingyan Shao, Kangshuai Li, et. al.. (2024). An artificial intelligence-assisted microfluidic colorimetric wearable sensor system for monitoring of key tear biomarkers. npj Flex Electron. 8;
- Juliane R. Sempionatto, Laís Canniatti Brazaca, Laura García-Carmona, Gulcin Bolat, Alan S. Campbell, et. al.. (2019). Eyeglasses-based tear biosensing system: Non-invasive detection of alcohol, vitamins and glucose. Biosensors and Bioelectronics. 137, 161-170.







