
Земную жизнь пройдя до половины: 40 лет борьбы с ВИЧ
29 января 2026
Земную жизнь пройдя до половины: 40 лет борьбы с ВИЧ
- 1069
- 0
- 1
1985–2025: 40 лет борьбы с ВИЧ.
Рисунок в полном размере.
авторский коллаж, адаптировано из genengnews.com
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Провожая 2025 год, мы предлагаем вам сверить часы: где сегодня ВИЧ, и где — объединенное человечество. Обсудим, куда привело нас противостояние смертельной болезни и чем можно приструнить вирус ВИЧ. Можно ли ВИЧ-инфицированным пациентам обойтись без стандартной антиретровирусной терапии на пути к полному исцелению, или же необходимо принимать лекарства всю жизнь?
Конкурс «Био/Мол/Текст»-2025/2026
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2025/2026.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
В 1981 году люди впервые услышали о пяти необычных случаях пневмоцистной пневмонии у молодых мужчин. Позже эти случаи объяснили синдромом приобретенного иммунодефицита (СПИД), который вызывается вирусом иммунодефицита человека (ВИЧ). А в 2008 году исследователям Франсуазе Барре-Синусси и Люку Монтанье, впервые выделившим и описавшим вирус-возбудитель СПИДа, вручили Нобелевскую премию по физиологии и медицине.
Сегодня мы знаем: без лечения медленно, но верно ВИЧ приводит к развитию тяжелого иммунодефицита. В итоге организм больного не может противостоять даже самым безобидным инфекциям, так как вирус атакует иммунные клетки, — это и есть СПИД. Подробнее о нем можно почитать здесь [1], мы же коснемся механизмов развития этой болезни лишь немного, в контексте лечения, и позже — в разделе «Биология вируса». А сперва обсудим, как люди в современном мире противостоят ВИЧ, и можно ли назвать это противостояние успешным.
По данным Роспотребнадзора, к концу 2024 года в России жили 1,2 млн человек с лабораторно подтвержденным диагнозом ВИЧ. В среднем в год умирают около 30 тысяч ВИЧ-инфицированных пациентов, 17–18 тысяч из них — от причин, напрямую связанных с ВИЧ. Чаще всего это микобактериальная инфекция (28% в 2023 году), множественные инфекции (23%), бактериальные инфекции (9%). У 14% — синдром истощения, ВИЧ-энцефалит и другие тяжелые осложнения.
Благодаря многим исследователям уже с конца прошлого века мы знаем «в лицо» своего страшного противника, но насколько далеко нам удалось продвинуться в предотвращении пандемии ВИЧ? Каковы успехи терапии опасного заболевания? В 1985 году были опубликованы первые успешные исследования терапии этого вируса противоопухолевым препаратом зидовудином. Это событие возвестило начало эры антиретровирусной терапии (АРТ). Изменилось ли что-то после ее изобретения, и как лечат СПИД сейчас? И создана ли вакцина, чтобы можно было предотвратить заражение и распространение вируса ВИЧ? Обсудим все это. И, конечно, поговорим о том, как уже помогает в гонке против ВИЧ пресловутый искусственный интеллект, культ которого сегодня в самом разгаре, хотя некоторые и пытаются это отрицать.
Между надеждой и реальностью
Десятилетия борьбы. Годы открытий. Миллионы спасенных жизней. Казалось бы, мы должны быть уже у цели. Но эпидемия ВИЧ-инфекции остается одной из серьезнейших проблем мирового здравоохранения. Человечество ставит себе серьезные задачи, но порой оглушительно проваливает их выполнение. Хотя глобальные усилия и привели к значительному прогрессу в лечении и профилактике СПИДа, последние данные демонстрируют, что мир все еще весьма далек от победы над ним к 2030 году: именно такая цель формулировалась на встречах ООН в 2015–2016 годах. Чтобы этого добиться, в качестве промежуточного шага на пути к этой цели к 2025 году необходимо было достичь показателей 95–95–95 (рис. 1) [2]. Эти цифры значат:
- 95% процентов людей, живущих с ВИЧ, должны знать о своем ВИЧ-статусе;
- 95% всех пациентов с диагнозом ВИЧ должны получать антиретровирусную терапию (АРТ);
- 95% всех пациентов, получающих АРТ, должны иметь неопределяемую вирусную нагрузку, то есть после лечения в их крови будет слишком мало или вовсе не окажется вируса, а оставшийся в организме ВИЧ станет неактивным, то есть не сможет заражать новые клетки и копировать свой геном.
Некоторые страны к 2025 году смогли достичь заветных показателей 95–95–95, среди них: Ботсвана, Эсватини, Лесото, Намибия, Руанда, Замбия, Зимбабве, Дания, Швеция.
Почему это важно? Именно стабильно неопределяемая вирусная нагрузка у «третьих 95%» означает, что дальше ВИЧ не будет распространяться. Но как этого добиться?
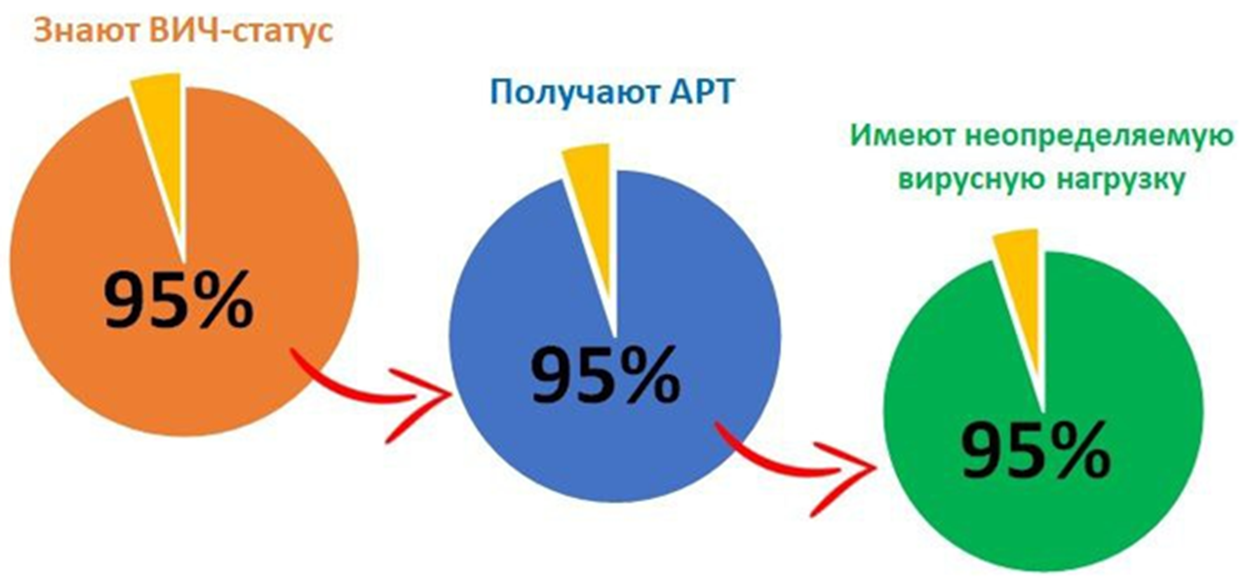
Рисунок 1. Стратегия «95–95–95», предложенная ЮНЭЙДС (Объединенная программа ООН по ВИЧ/СПИДу; русскоязычное название «ЮНЭЙДС» — это «калька» от английской аббревиатуры UNAIDS, The Joint United Nations Programme on HIV/AIDS).
рисунок авторов
Согласно последним данным Объединенной программы ООН по ВИЧ/СПИДу (ЮНЭЙДС), к концу 2023 года в мире проживало около 39,9 миллиона человек с ВИЧ, а уже через год, этот показатель достиг 40,8 миллионов. Однако есть и хорошие новости: в 2024 году прирост новых случаев заражения оказался наименьшим с конца 1980-х годов. Это стало возможным благодаря доступному тестированию на ВИЧ (часто оно проводится бесплатно, например, в центрах профилактики и борьбы со СПИДом) и антиретровирусной терапии (АРТ) — лекарствам, направленным на борьбу с возбудителем.
Выбрать величайшее достижение медицины — задача не из легких, ведь многие открытия взаимосвязаны и образуют единую цепь научного прогресса. Тем не менее, современная антиретровирусная терапия по праву занимает место среди самых революционных прорывов в истории фармакологии наряду с антибиотиками, рекомбинантным инсулином или моноклональными антителами.
Сегодня благодаря АРТ люди с ВИЧ-положительным статусом живут намного дольше и, вопреки своей болезни, могут вести практически полноценную жизнь: учиться, работать, путешествовать, заводить семьи, лишь изредка посещая стационары. Более того, длительный прием лекарств этой группы подавляет вирус до неопределяемого уровня, что, по заявлению ВОЗ (Всемирная организация здравоохранения), практически исключает его горизонтальную и вертикальную передачу и приравнивается к функциональному излечению. Это значит, что вирус все еще не полностью уничтожен, но находится в латентном состоянии, не нанося вреда организму. То есть функциональное излечение ВИЧ — это настолько устойчивая ремиссия, что в итоге она позволяет полностью отказаться от приема АРТ.
Какой путь привел к этому успеху, и есть ли недостатки у АРТ? Чтобы разобраться, рассмотрим подробнее вирус ВИЧ и вспомним недавнюю историю фармацевтических поисков.
Биология вируса
ВИЧ — вирус из семейства Retroviridae, рода Lentivirus. Ретровирусы, в отличие от обычных вирусов, не синтезируют РНК на своей ДНК, а наоборот — создают ДНК на основе своей РНК, то есть буквально делают обратную операцию (обратную транскрипцию), отсюда и приставка «ретро-», что означает «обратный». Дальше мы расскажем о судьбе этой ДНК, а пока подчеркнем, что именно поэтому лекарства против ВИЧ называются антиретровирусной терапией, подчеркивая, на какие биологические (и, в частности, генетические) механизмы они нацелены.
Зрелая частица (вирион) ВИЧ размером всего около 100 нм — это образец эволюционной компактификации и эффективности (рис. 2).
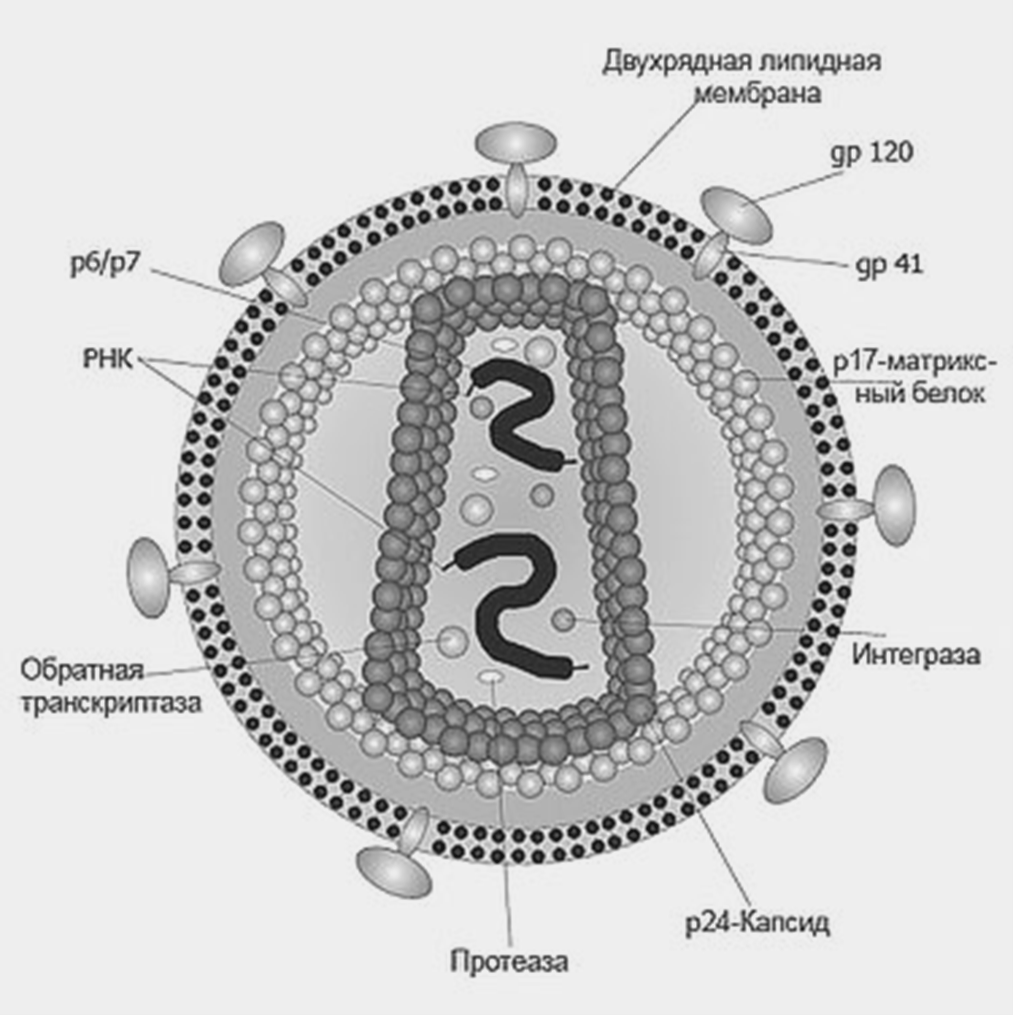
Рисунок 2. Строение вируса иммунодефицита человека.
Вирион покрыт липидной мембраной, в нее встроены сложные белковые комплексы — «шипы». Каждый шип образован тремя молекулами поверхностного белка gp120 и трансмембранного белка gp41. Именно gp120 является тем «ключом», который отпирает клеточные «двери» — рецептор CD4, находящийся в основном на поверхности Т-хелперов, макрофагов и дендритных клеток. Внутри вириона находится сердцевина в форме усеченного конуса из белка p24 (капсидный), защищающая самое ценное: две копии вирусного генома (одноцепочечная РНК) и набор жизненно важных ферментов — обратную транскриптазу, интегразу и протеазу. Вирусная РНК размером около 9700 нуклеотидов содержит всего 9 генов, но использует их с максимальной эффективностью, делая вирус исключительно адаптированным к жизни внутри человека [3].
Репликация ВИЧ напоминает четко отлаженную диверсионную операцию, однако современная медицина научилась блокировать каждый «шаг» вируса. Всё начинается с проникновения: вирусный «ключ» — белок gp120 — последовательно отпирает два «замка» на поверхности иммунной клетки. Сначала он связывается с рецептором CD4, а затем с корецептором (CCR5 или CXCR4). Это двойное рукопожатие запускает изменение другого вирусного белка, gp41, который, подобно гарпуну, пронзает и сливает оболочки вируса и клетки (рис. 3) [4].
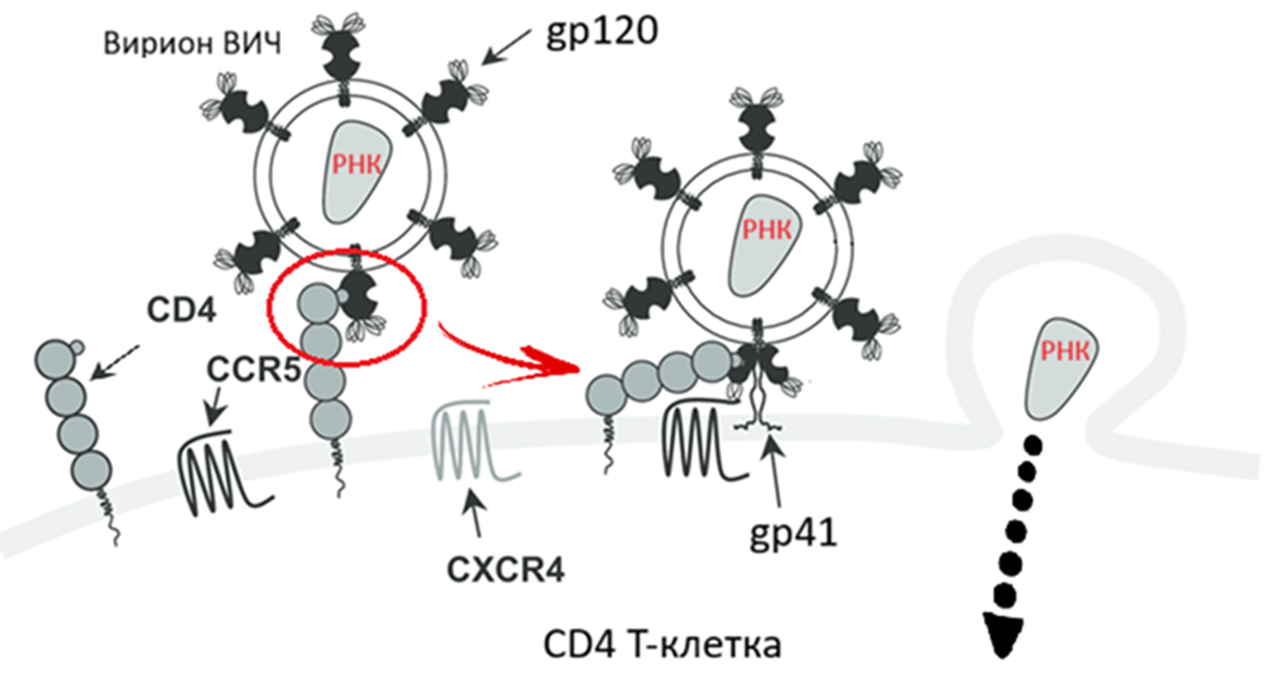
Рисунок 3. Проникновение ВИЧ в клетку.
адаптировано из [4]
Оказавшись внутри, вирус приступает к своей самой рискованной и одновременно критической операции — обратной транскрипции. Его фермент, обратная транскриптаза, на ходу переписывает вирусную РНК в ДНК. Этот процесс настолько небрежен, что порождает тысячи мутаций, создавая внутри человека целое облако генетических вариантов вируса (квазивиды или подтипы). Эта изменчивость — кошмар для иммунной системы.
Далее свежесинтезированная вирусная ДНК в виде особого комплекса пробирается в самый центр — ядро клетки. Здесь в дело вступает вирусная интеграза. Она встраивает чужеродный генетический код прямо в хромосому хозяина, делая провирус его пожизненной частью. Отныне эта молекулярная «закладка» будет передаваться всем потомкам зараженной клетки. Когда же клетка получает сигнал к активации, она, сама того не ведая, запускает конвейер по производству врага. Собираются новые вирусные частицы, которые отпочковываются от клетки, закутавшись в кусочек ее же мембраны для маскировки. Но чтобы стать опасными, им нужно созреть. Этим занимается вирусная протеаза — молекулярные ножницы, которые нарезают длинные бесформенные белковые цепи на готовые функциональные элементы [5].
Иногда жизненный цикл вируса происходит не по стандартной схеме, формируя так называемые клеточные резервуары — скрытые хранилища вируса.
Клеточные «резервуары»
Резервуар ВИЧ — это скрытое убежище вируса внутри организма, и именно из-за них инфекция возвращается после отмены терапии. По своей сути, резервуар — это популяция наших собственных иммунных клеток, в ДНК которых навсегда встроен генетический код вируса (провирус), но он находится в «спящем» режиме и не производит новые вирусные частицы.
Обычно ВИЧ заражает активированные иммунные клетки (CD4+ лимфоциты), что приводит к их гибели. Но иногда он попадает в особый тип клеток — так называемые покоящиеся Т-клетки памяти. Это долгоживущие «ветераны» иммунитета, которые находятся в состоянии глубокого сна, готовые активироваться при повторной встрече с инфекцией. Если вирус успевает проникнуть в такую «спящую» клетку и встроить свою ДНК в ее геном до ее активации, то он сам оказывается в ловушке. Внутри неактивной клетки молекулярные машины, необходимые для считывания вирусных генов, выключены. Иммунная система не видит угрозы, клетка не погибает и может десятилетиями циркулировать в организме, являясь тикающей бомбой.
Коварство этой ситуации усиливают несколько факторов. Вирусная ДНК часто встраивается в «глухие» участки нашего генома, где гены по умолчанию не транскрибируются. Кроме того, молекулярные «блокировки» — метильные метки на ДНК и модификации белков-гистонов — физически мешают клетке реплицировать вирусные белки. Главная опасность резервуара в том, что покоящаяся клетка, несущая спящий вирус, может начать делиться — например, в ответ на встречу с привычным патогеном, не имеющим отношения к ВИЧ. При делении встроенная вирусная ДНК копируется и передается всем дочерним клеткам. Так возникает клональная экспансия — целая армия генетически идентичных клеток, каждая со своей копией провируса. Этот процесс может поддерживать и даже расширять резервуар без единого акта новой инфекции. Усугубляет проблему и то, что убежища вируса разбросаны по разным уголкам организма. Хотя основная база — это Т-клетки памяти, провирус также находят в клетках-предшественниках в тимусе, тканевых макрофагах в кишечнике и даже в особых клетках мозга — астроцитах. Каждый из этих резервуаров может жить по своим правилам [6], [7].
Как же бороться с активно делящимся вирусом и ВИЧ, скрытым в резервуарах?
АРТ: послать вирус на три буквы

Рисунок 4. Дэвид Хо — «Человек года»: обложка журнала Time.
Первый препарат против ВИЧ — это зидовудин, также известный как азидотимидин (AZT), который изначально синтезировали как противоопухолевый препарат. Однако на животных моделях его противоонкологическая активность не подтвердилась, зато в 1985 году появились первые отчеты об успешном применении AZT для лечения ВИЧ-инфекции, и уже в 1987 году зидовудин был одобрен для применения по новым показаниям. Зидовудин — это нуклеозидный ингибитор обратной транскриптазы, который обрывает цепь ДНК, синтезируемую по матрице РНК, «подсовывая» вирусу неправильный нуклеотид. Как вы помните, вирионы ВИЧ содержат именно РНК, и транскрипция ее в ДНК необходима для встраивания генетического материала вируса в геном хозяина. О ключевом для ВИЧ ферменте — обратной транскриптазе — читайте подробнее в статье «„Швейцарский нож“ вирусной армии: разгадан секрет обратной транскриптазы» [8].
К сожалению, несмотря на большие надежды, эффективность монотерапии оказалась скромной. Та же участь постигла и другие нуклеозидные ингибиторы обратной транскриптазы, созданные в начале 90-х. Однако ученые не сдавались. Переломный момент наступил в 1995–1996 годах, когда были опубликованы результаты масштабных клинических исследований, которые доказали, что комбинация двух нуклеозидных ингибиторов — зидовудина в сочетании с диданозином (ddI) или залцитабином (ddC) — работает значительно эффективнее монотерапии [9].
Параллельно велись испытания принципиально нового класса лекарств — ингибиторов протеазы. Протеаза необходима для формирования зрелых, инфекционных вирусных частиц. Ингибиторы протеазы блокируют ферментную активность белка и тем самым нарушают расщепление вирусных полипептидов, что делает вирусные частицы неспособными инфицировать другие клетки. Примерами таких препаратов являются ритонавир, саквинавир, индинавир, атазанавир и дарунавир. Три фармакологических гиганта вступили в напряженную гонку, и в период с декабря 1995 по март 1996 года их препараты один за другим получили официальное одобрение [10].
Настоящей сенсацией стала публикация группы авторов о том, что добавление ритонавира, ингибирующего протеазы, к стандартной АРТ значительно повышало выживаемость у пациентов с тяжелыми формами ВИЧ-инфекций и низким иммунным статусом [16]. Один из авторов этой статьи — американский вирусолог азиатского происхождения Дэвид Хо — провел много дополнительных исследований по кинетике заражения клеток ВИЧ и обнаружил чрезвычайно высокую скорость репликации ВИЧ, что сформировало его концепцию раннего лечения набором агрессивных препаратов (hit hard, hit early). Дэвид Хо предложил отказаться от монотерапии. Он создал «коктейль против СПИДа», включающий в себя три препарата не менее двух различных классов: нуклеозидные ингибиторы обратной транскриптазы и ингибитор протеазы. Эти разработки привели к созданию высокоактивной антиретровирусной терапии (ВААРТ), и в 1996 году журнал Time назвал Дэвида Хо «Человеком года» (рис. 4) за научный прорыв, который коренным образом изменил подход к лечению ВИЧ.

Рисунок 5. Эволюция терапии против ВИЧ.
ВААРТ (со временем название упростили до антиретровирусной терапии – АРТ) действует одновременно на разные мишени в цикле репликации вируса, подавляя размножение ВИЧ до уровня, не определяемого методом ПЦР, и устойчиво поддерживает этот эффект на протяжении многих лет у большинства пациентов.
За четверть века развития АРТ ученые сменили парадигму разработки препаратов. Изначально главным приоритетом была максимальная эффективность, даже в ущерб переносимости и удобству для пациента (некоторым пациентам, согласно этой терапии, приходилось принимать до сорока таблеток в день!!!! — рис. 5).
Однако с 1987 по 2013 год требования к препаратам последовательно расширялись, и акцент смещался в сторону снижения стоимости лечения, хорошей переносимости, удобства применения, долгосрочной безопасности и отсутствия резистентности к терапии.
Тем не менее, для большинства пациентов АРТ означает прием лекарств всю жизнь, так как вирус не уходит из организма полностью, то есть болезнь может возобновиться при отмене терапии. А для некоторых пациентов, к сожалению, АРТ — не просто пожизненное бремя, а необходимость уже с рождения.
Цветы жизни
В 2011 году в США было зарегистрировано 127 ВИЧ-положительных новорожденных, но по всему миру около 330 тысяч новорожденных ежегодно заражаются ВИЧ при рождении.
Один из таких случаев — «младенец из Миссисипи» (англ. Mississippi baby). Девочка родилась в 2010 году, и, поскольку ее мать не обследовалась во время беременности, врачи провели ряд анализов, включая тест на ВИЧ, во время родов. Получив заключение о положительном статусе матери, врачи приняли решение начать АРТ для ребенка, то есть уже со второго дня жизни ребенок был в терапии, и уже через месяц вирусная нагрузка снизилась, а после года и вовсе не обнаруживалась. Лечение прекратили незапланированно, мама просто пропала с медицинских радаров на некоторое время, однако, когда она вновь обратилась к врачам, у ребенка не обнаруживался вирус в крови, и ее даже называли вторым излеченным после «берлинского пациента», о котором мы поговорим позже [12]. Была даже выдвинута гипотеза о том, что младенец получал антиретровирусную терапию до того, как начал производить клетки памяти T-клеток — иммунные клетки, которые могут служить вирусным резервуаром для ВИЧ. Долгое время этот случай был еще одним зачетом в копилочку полного излечения ВИЧ, однако, к сожалению, спустя несколько лет ребенка снова вернули на АРТ из-за возросшей вирусной нагрузки.
Аналогичный случай был описан в 2015 году для девочки из Франции [12]. Ее семья также в какой-то момент отказалась от АРТ, но ремиссия была гораздо более длительной — около шести лет.
В результате масштабных исследований по терапии младенцев были сформированы подробные тактики ведения детей, у которых ВИЧ диагностирован в первые часы жизни. Подробные рекомендации представлены на портале Clinicalinfo.HIV.gov. На данный момент обновление датируется декабрем 2024 года.
Не привыкай к хорошему
Несмотря на то, что с помощью АРТ инфекцию ВИЧ получается неплохо контролировать, у нее есть и серьезные недостатки. Так, резистентность к назначаемым лекарствам, вырабатывающаяся в том числе из-за длительности терапии, может свести на нет все усилия врачей. Это значит, что мы снова возвращаемся к тому, с чего начали, когда под рукой была только надежда, но не действующее вещество.
Выделяют несколько типов резистентности к АРТ:
- Трансмиссивная (первичная) резистентность: передача уже резистентных вариантов ВИЧ от другого человека. Чаще встречается к ненуклеозидным ингибиторам обратной транскриптазы (НИОТ, или NNRTI — от англ. Non‑Nucleoside Reverse Transcriptase Inhibitors). NNRTI до сих пор являются краеугольным камнем АРТ из-за их относительно мощной активности, умеренной токсичности и высокой специфичности [13]. На сегодняшний день существует шесть NNRTI, утвержденных FDA, однако препараты первого поколения наиболее часто становятся неэффективными из-за возникающей резистентности вследствие одиночных мутаций типа K103N, Y181C, G190A, что легко проверить генотипированием пациентов до старта лечения.
- Предлечебная резистентность: обнаруживается у людей, которые ранее могли получать доконтактную профилактику (ДкП, или PrEP — от англ. Pre-exposure prophylaxis), профилактику при беременности/родах или нерегулярно принимали АРТ [14].
- Приобретенная резистентность: возникает на фоне терапии при недостаточной экспозиции (пропуски, лекарственные взаимодействия, непереносимость, субоптимальные схемы) [15].
- Новые исследования, представленные на 20-й Европейской конференции по СПИДу (EACS 2025) в Париже, выявили потенциальные риски, связанные с вирусологической неудачей и развитием резистентности при приеме длительно действующих инъекционных препаратов каботегравир/рилпивирин CAB/RPV.
Обратная сторона Луны
Длительность приема АРТ может вызывать резистентность к препаратам как из-за постоянного приема одних и тех же лекарств, так и вследствие несоблюдения назначенной схемы. Возникает порочный круг: каждый из компонентов коктейля АРТ сам по себе может вызывать побочные эффекты от кожной сыпи и расстройств пищеварения до головокружений и потери памяти [16], из-за чего некоторые пациенты, возможно, даже бессознательно стремятся «упростить» схему приема лекарств, что неизбежно снижает эффективность лечения из-за развивающейся резистентности к препаратам.
В то же самое время, далеко не все ВИЧ-инфицированные пациенты получают необходимое лечение (вспомните «вторые 95%», к которому призывает ЮНЭЙДС, чтобы остановить пандемию ВИЧ). Примерно четверть (!) ВИЧ-инфицированных в мире остается без лечения. Особенно тревожна ситуация с детьми, практически половина которых не получают необходимой помощи.
Кроме экономических причин, некоторые пациенты не получают терапию, так как АРТ не позволяет полностью побороть вирус, а значит, люди продолжают сохранять ВИЧ-статус и остаются стигматизированными. Это значит, что некоторые пациенты не получают лечение, так как не хотят афишировать свой диагноз из-за боязни осуждения (ранее ВИЧ-инфекция ассоциировалась только с неблагополучными и маргинальными личностями) и возникающего отчуждения близких. Люди элементарно боятся заразиться ВИЧ, не зная, что инфекция не передается бытовыми путями, например, через объятия, рукопожатия, общую посуду, туалет, одежду, через укусы комаров или в бассейне, поскольку вирус быстро погибает вне организма человека.
Стигма, то есть негативное отношение — от внутреннего осуждения до открытого навешивания ярлыков и дискриминации ВИЧ-инфицированных людей — остается одним из главных барьеров на пути к эффективной помощи. Ни для кого не секрет, что успех в борьбе с эпидемией зависит не только от медицинских инноваций и разработок, но и от преодоления социальных и экономических барьеров.
Теперь давайте разберемся, есть ли альтернативы АРТ? И какими перспективами может нас обнадежить новое лечение СПИДа?
— Больной, вы больше не больной!
На сегодняшний день (конец 2025 года) известно о десятке пациентов, полностью излечившихся от ВИЧ. Помимо редких случаев раскрытых имен, фигурируют они под условными обозначениями, связанными с географическими топонимами. В первой пятерке: «Берлинский пациент» (Тимоти Рэй Браун), «Лондонский» (Адам Кастильехо), «Нью‑Йоркский», «Дюссельдорфский» (Марк Франке) [17] и пациент «Города надежды» (Пол Эдмондс), названный так в честь калифорнийского медицинского центра City of Hope.
Войти в историю под этими звучными именами удалось лишь тем пациентам, к которым ВИЧ-инфекция не вернулась спустя длительное время после отказа от АРТ. При этом о каждом новом случае успешного излечения от ВИЧ всегда рапортуется со сдержанным оптимизмом, чтобы не давать ложные надежды больным или их родственникам. Так, например, произошло с пациентом из бразильского города Сан-Паулу, который сохранял неопределяемую вирусную нагрузку на протяжении 72 недель после прекращения приема АРТ, однако спустя полтора года ремиссии состояние пациента ухудшилось, и он вынужден был возобновить лечение. В его крови снова нашли вирус, причем на этот раз это был другой штамм ВИЧ.
CCR5delta32/delta32: двух зайцев одним выстрелом
Тимоти Рэй Браун (рис. 6) открывает наш триумфальный парад счастливчиков, которые смогли побороть ВИЧ [17]. И мы говорим «побороть» не просто так. После диагностирования заболевания в 1995 году Тимоти успешно проходил АРТ уже больше 10 лет, когда его ждал новый удар.

Рисунок 6. Тимоти Рэй Браун, «Берлинский пациент» — первый в мире человек, вылеченный от ВИЧ.
В 2006 году у Брауна выявили онкологию — острый миелоидный лейкоз. Последовали три безрезультатных курса химиотерапии. После второго из них у Тимоти развилась грибковая пневмония, и ее тоже пришлось лечить. А после третьего раунда «химии» больного ввели в искусственную кому из-за другой, еще более опасной инфекции [18]. Наступила недолгая ремиссия, однако вскоре онкология снова дала о себе знать.
У Тимоти осталась последняя соломинка. Взамен курсов химиотерапии лечащий врач предложил искать донора для трансплантации костного мозга (в котором рождаются иммунные клетки — главная мишень для ВИЧ), но «не простого, а золотого»: с редкой мутацией CCR5delta32 в гене рецептора CCR5, ответственного за проникновение вируса ВИЧ в клетки, чтобы вылечить сразу и лейкоз, и ВИЧ-инфекцию (рис. 7). При сломанном гене рецептор CCR5 не работает, и Т-лимфоциты становятся устойчивы к вирусу — он просто не может в них пролезть. Сам Тимоти Браун по этому гену оказался гетерозиготен — в его клетках была сломана лишь одна из двух копий CCR5, а потому он не мог в полной мере противостоять вирусной инфекции. Нужен был донор с мутацией в обеих аллелях гена (CCR5delta32/delta32). Был шанс, что пересадка клеток от этого донора «запрет» для вируса дверь в организм Тимоти навсегда.
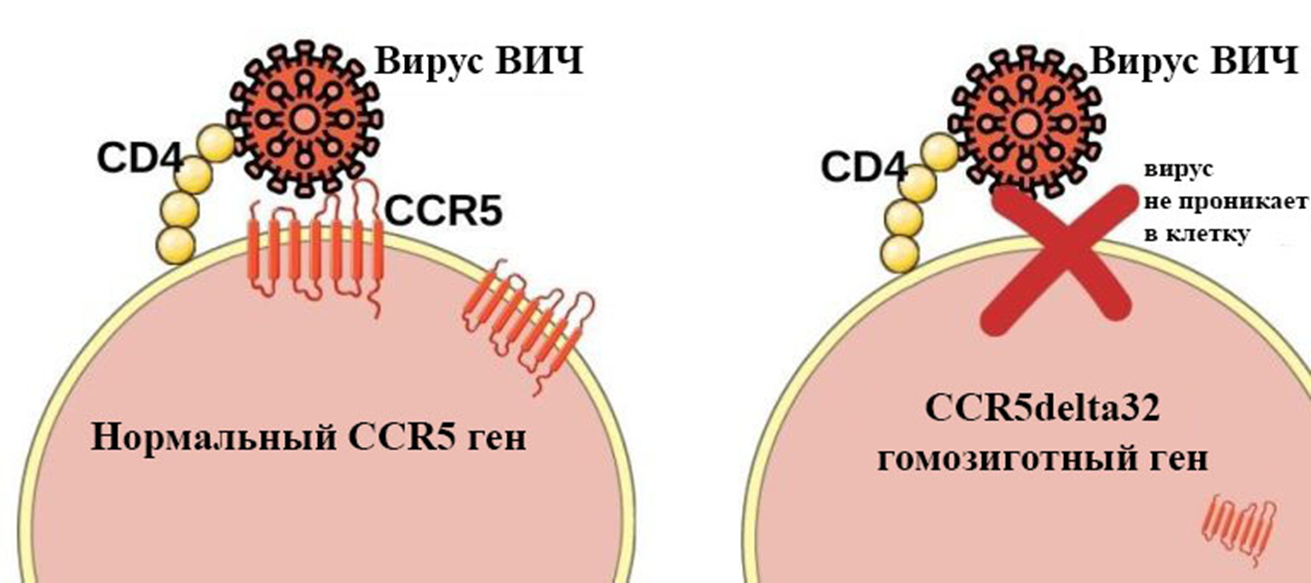
Рисунок 7. Гомозиготная мутация CCR5delta32 препятствует проникновению ВИЧ в CD4+ клетки.
адаптировано из civilsdaily.com
Не сразу, но такой донор нашелся [18]. И после курса радиационной терапии, необходимой для убийства собственных иммунных клеток, в феврале 2007 года гематолог Геро Хюттер и его команда провели трансплантацию. В результате в 2008 году Хюттер был назван одним из «берлинцев года» по версии газеты Berliner Morgenpost, а Тимоти Рэй Браун получил тот самый статус «Берлинского пациента» на конференции Conference on Retroviruses and Opportunistic Infections-2008. Это имя было предложено общественности, чтобы сохранить анонимность пациента, на что сам пациент отреагировал довольно бурно.
Итак, трансплантация позади. Теперь представьте только: после 10 лет непрерывного приема таблеток наступил момент, когда Тимоти Рэю Брауну можно было перестать их пить. И радостно, и волнительно: что, если операция не сработала? Но нет, лечение, как оказалось, отлично помогло. После 600 дней, это практически два года, без АРТ, уровень ВИЧ в крови, костном мозге и кишечнике пациента был ниже предела обнаружения. Тимоти подвергся биопсии практически всех тканей и частей тела, для которых эта процедура возможна, чтобы подтвердить отсутствие вируса.
Однако спустя год из-за рецидива лейкемии трансплантацию провели повторно. На этот раз Тимоти пришлось тяжело: он был прикован к инвалидному креслу и практически ослеп, восстановление затянулось на шесть долгих лет из-за реакции «трансплантат против хозяина» [18].
«Берлинский пациент» снял маску в 2010 году. Тимоти часто рассказывал о своей истории на конференциях и активно пропагандировал ДкП, так как никогда не хотел быть «единственным излечившимся». ДкП подразумевает использование антиретровирусных препаратов ВИЧ-отрицательными людьми для предотвращения заражения ВИЧ. Это особенно важно, если люди входят в группы риска, для которых вероятность инфицирования выше, чем для обычного населения.
В июле 2012 года Тимоти Рэй Браун объявил о создании Фонда своего имени, посвященного борьбе с ВИЧ/СПИДом. Другой важной, пусть и менее известной, инициативой Тимоти стало создание проекта IciStem: исследовательского консорциума, который регистрирует доноров стволовых клеток с редкой мутацией CCR5delta32 и является крупнейшей программой по изучению лечения ВИЧ после трансплантации стволовых клеток. Программа уже выявила более 22 000 доноров с дефектом гена CCR5, и к 2020 году 39 человек с ВИЧ, которые зарегистрированы в ней, получили трансплантацию.
К сожалению, спустя 13 лет после излечения от ВИЧ, в сентябре 2020 года знаменитый «Берлинский пациент» скончался от рецидива лейкоза в своем родном городе Палм-Спрингс (США) в возрасте 54 лет.
Его пример — другим наука
Второй излечившийся от ВИЧ человек — Адам Кастильехо (рис. 8), известный как «Лондонский пациент» — с размахом праздновал десятую годовщину своего выздоровления, и его донор был почетным гостем на этом празднике жизни. После излечения Адам Кастильехо оставил профессию шеф-повара и посвятил себя общественной деятельности, чтобы чудесные истории исцеления продолжали обретать гласность. Теперь он мотивационный спикер, сумевший побороть самые темные свои дни, когда обращение к европейским компаниям, проводящим эвтаназию, казалось ему единственно верным решением. Историю Адама врачи встретили с таким же воодушевлением, как и успех Тимоти, ведь это подтверждало, что «Берлинский пациент» — не ошибка, не уникальный случай, а закономерность. Да и сам Тимоти Браун с восторгом узнал о выздоровлении Адама.

Рисунок 8. Адам Костильехо — «Лондонский пациент».
Успех стратегии CCR5delta32/delta32 оказался столь вдохновляющим, что последовали и другие практики такой трансплантации. Однако, когда новым пациентам довелось самим пережить ее, розовые очки «успешного успеха» с общественности снова слетели. Аллогенная трансплантация гемопоэтических стволовых клеток костного мозга — это высокорисковая процедура, которую проводят по гематологическим показаниям (лейкоз, лимфома), а антивирусный эффект ей всего лишь сопутствует. Подробно об этом подходе рассказывает статья «Клетки, которые лечат людей» [19] в рамках спецпроекта «Генная и клеточная терапия».
Марк Франке, «Дюссельдорфский пациент» (рис. 9), подчеркивает, как тяжело проходило восстановление после трансплантации: «Путь, который я выбрал, я бы не рекомендовал никому». Ему, как и Тимоти Брауну, пришлось долгое время провести в инвалидном кресле.

Рисунок 9. Марк Франке, «Дюссельдорфский пациент», и его лечащий врач.
Документальный фильм о своем предшественнике стал для Марка важным подспорьем во время переживания терапии. Пересматривая его, он видел не только историю успеха, в конце которой Тимоти излечился от ВИЧ, но и множество подводных камней, связанных с осложнениями после процедуры лечения.
Впоследствии Марк Франке познакомился со своим донором, и вслед за «Берлинским пациентом» активно рассказывает о своем лечении на всевозможных конференциях, встречах и форумах, правда, на принятие позиции гласности ему потребовалось около десяти лет.
Невероятно, но пациенты с ВИЧ смотрят на онкологию как на добрый знак. Об этом говорил и Адам Кастильехо (диагностирована лимфома Ходжкина), и Марк Франке (диагностирована лейкемия). HIV; hate. Cancer; love — из их уст звучит как гимн движения хиппи. Новый ужасный диагноз дает им, с одной стороны, совершенно другой статус в глазах общественности, откликающейся именно на онкологию с полной эмпатией, дружеским участием и сочувствием, а с другой стороны, дарит возможность изменить ВИЧ-статус, ведь многие врачи и исследователи считают, что трансплантацию не стоит проводить для не больных онкологией ВИЧ-инфицированных, даже если будет найден подходящий донор, так как ставки в этой игре слишком высоки.
Отдельно стоит сказать и о такой проблеме, как поиск донора. Тимоти не зря занимался этим вопросом, ведь он часто становится настоящим камнем преткновения. Взять хотя бы историю третьего вылеченного от ВИЧ человека — «Нью-Йоркской пациентки», которой трансплантировали клетки пуповинной крови, перебрав для этого около 18 тысяч образцов [20]!
Для лечения женщины из города Нью-Йорка, у которой была обнаружена лейкемия через пять лет после диагностирования ВИЧ, была использована процедура под названием «гаплоидентичная трансплантация костного мозга» (гаплотрансплантация). Гаплотрансплантация — вид трансплантации костного мозга, который позволяет трансплантировать наполовину HLA-совместимые стволовые клетки. Часть стволовых клеток с мутацией CCR5delta32 была взята из пуповинной крови ребенка, а часть — от взрослого донора, родственника пациентки, без этой мутации. По сравнению со взрослыми стволовыми клетками, пуповинная кровь обычно требует меньшей совместимости HLA и вызывает меньше осложнений. Однако она не дает достаточного количества клеток, чтобы эффективно лечить рак у взрослых.
Операция с клетками пуповинной крови переносится гораздо легче. «Нью-Йоркская пациентка» покинула больницу 17 дней спустя после пересадки, поскольку реакция «трансплантат против хозяина» обошла ее стороной, в то время как Адам и Тимоти годами восстанавливались: один потерял слух, другой — зрение.
Впрочем, едва ли не каждый случай CCR5delta32-излечения становится уникальным по комбинации анамнеза и истории лечения. Так, 68-летний Пол Эдмондс (пациент «Города надежды») на сегодняшний день является самым возрастным пациентом, перенесшим трансплантацию. Прожив на АРТ более тридцати лет, Эдмондс, как и другие герои нашей статьи, при очередном обследовании узнал о своем онкологическом заболевании. Успешная медицинская практика Пола Эдмондса дает врачам новые козыри, главный из который — это время: «По мере того, как люди с ВИЧ продолжают жить дольше, появится больше возможностей для персонализированного лечения их рака крови».
Палка о двух концах
Необходимо понимать, что такой подход к лечению ВИЧ — штучная не масштабируемая терапия, если здесь вообще применим этот термин. Барьеров для массового применения такой терапии много:
- Высокий риск смертности в результате операции, увеличивающийся с возрастом пациента, уже сам по себе может поставить крест на всей затее. Но есть немало и других опасностей.
- Это и дефицит подходящих доноров, ведь нужен не только донор с редкой мутацией, неравномерно распределенной среди отдельных рас (из-за этого были сложности у пациентов-первопроходцев смешанного происхождения), но и одновременно совместимый с реципиентом по портрету молекул главного комплекса гистосовместимости человека (HLA, от англ. Human Leucocyte Antigen). Именно совпадение молекул HLA на клетках двух разных людей позволяет организму больного принимать донорские клетки как «свои» и не атаковать их.
- Донор найден? Отлично! Но теперь вас ждут неизбежно возникающие сложности в логистике донорского материала.
- После трансплантации донорских клеток вирус по-прежнему представляет серьезную угрозу для пациента, если в его теле остались скрытые резервуары или CCR5+ клетки, лишенные гомозиготной мутации.
- Отсутствие CCR5+ клеток не повлияет на заражение ВИЧ с другим тропизмом, то есть использующим другой корецептор для проникновения в клетки (рис. 10).
- И, в конце концов, вернемся с небес на землю: высокая стоимость процедуры является просто непреодолимым бременем для многих и многих пациентов.
Иными словами, если пациент стабилен на той же АРТ (от которой, заметим, приходится отказываться, чтобы подтвердить успешность лечения), то любой врач, давший клятву Гиппократа, будет стоять на том, что риски трансплантации несоизмеримо выше потенциальной пользы.
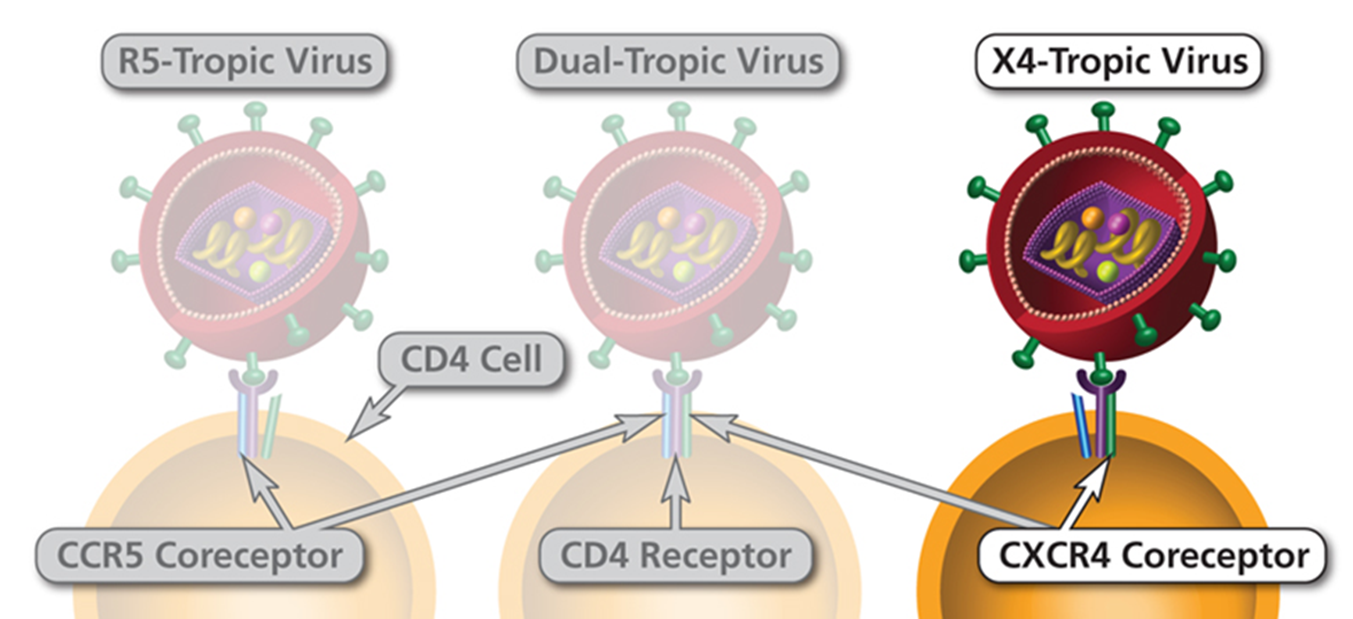
Рисунок 10. Три типа тропизма вируса ВИЧ. Слева: R5-тропный вирус использует корецептор CCR5 для входа в клетки-мишени, в основном CD4+ T-лимфоциты и макрофаги, это доминирующий тип вируса на ранних стадиях инфекции. В центре: R5X4-тропный, или вирус с двойным тропизмом, может проникать в клетки как через CCR5, так и CXCR4 корецепторы. Справа: X4-тропный вирус, использует CXCR4. Выделен как пример инфицирования, не зависящего от наличия в клетке рецептора ССR5.
Своими силами: элитный контроль
Если ВИЧ не лечить АРТ, развивается тяжелый иммунодефицит, и сопутствующие заболевания могут оказаться смертельными в подавляющем большинстве случаев. Но нет правил без исключений.
На крупнейшей международной конференции по СПИДу AIDS (от англ. Acquired Immunodeficiency Syndrome, что на русский переводится как «синдром приобретенного иммунодефицита», или СПИД) в 2022 году доктор Хавьер Мартинес-Пикадо обсудил необычный феномен. Некоторые ВИЧ-положительные пациенты не испытывают иммунной дисфункции при отмене АРТ, и вирус детектируется у них на чрезвычайно низком уровне. Да-да, бывает и такое! Менее 1% из тех, кто приобретает вирус, могут эффективно контролировать его без развития болезни. Их называют элитными контроллерами. А если пациенты сдерживают вирус более 20 лет без лечения — исключительными элитными контроллерами [18]. Что еще интересно, женщины-контроллеры при беременности и родах не передают ВИЧ плоду, а значит, могут не бояться за здоровье своих будущих детей. Некоторые элитные контроллеры раскрыли свои имена, в частности, Лорин Уилленберг, другие пока известны только под шифрами, публикуемыми в научных статьях.
Чем же отличаются элитные контроллеры от обычных ВИЧ-инфицированных людей?
Как правило, у них незначительные вирусные резервуары (то есть у них мало спящих иммунных клеток), и они заражены вирусом с более низкой репликативной активностью. Кроме того, у элитных контроллеров часто встречается особый тип молекул HLA, например, HLA-B57 или HLA-B58, который лучше защищает организм за счет более сильных Т-клеточных ответов [21]. Вдобавок к этому, моноциты элитных контроллеров активнее презентируют антигены, то есть быстрее и эффективнее направляют иммунный ответ на вторжение чего-то чужеродного [22]. Другие важные защитники элитных контроллеров — В-клетки — производят необычные антитела к самым консервативным участкам вируса [23]. Такие антитела называются широко нейтрализующими (bnAbs), потому что у них более широкий спектр связывания с белками: им «не страшны» мутации вируса.
Конечно, статус элитного контроллера — не панацея от всех бед. Более активная иммунная система, которая позволяет им эффективно противостоять ВИЧ, одновременно является и их проклятием. Эти пациенты чаще подвержены различным сопутствующим заболеваниям по сравнению с неинфицированным населением и ВИЧ-пациентами, у которых вирус подавлен с помощью АРТ [21]. Исключительный элитный контроллер Лорин Уилленберг более 30 лет успешно сдерживала ВИЧ без приема АРТ, но теперь ей придется бороться с онкологией: летом 2025 года у нее обнаружили рак легких.
Сейчас также определяют отдельную группу контроллеров, ранее получавших АРТ, — это посттерапевтические контроллеры (post-treatment controllers, PTCs). У обычных пациентов отказ от АРТ приводит к ухудшению буквально через несколько недель, а у посттерапевтических контроллеров организм способен противостоять вирусу длительное время после отмены терапии. Таких пациентов примерно в 10–20 раз больше, чем элитных контроллеров, и показано, что они похожи на элитных контроллеров по характеру клеточных резервуаров ВИЧ [23].
Будь спок: block-lock
АРТ и трансплантация клеток с двойной мутацией в гене CCR5 направлены на борьбу с активно делящимся вирусом. Как вы помните, ВИЧ может укрываться от иммунной системы в резервуарах, и необходимы другие подходы, чтобы извлечь его из хранилища, уничтожить, и тем самым добиться, наконец, полного излечения.
Экспериментальная стратегия «шок и убийство» (от англ. Shock and kill) направлена на полное удаление ВИЧ из организма пациента. На первом этапе происходит «пробуждение», или «шокирование» неактивного, скрытого в резервуарах вируса с помощью агентов обратной латентности (АОЛ, от англ. Latency Reversing Agents, LRA). АОЛ воздействуют на клеточные пути, снимая блокировки, которые удерживают ВИЧ в латентном состоянии, заставляя вирус начать экспрессировать свои гены, то есть нарабатывать вирусные белки. Активация вируса должна обязательно проходить на фоне приема АРТ, чтобы не допустить повторного заражения вновь собранными вирионами ВИЧ.
Далее инфицированные клетки, теперь уже видимые для иммунной системы за счет чужеродных белков, уничтожают, чтобы клеточный резервуар не разрастался (рис. 11). ВИЧ-инфицированные клетки погибают или за счет цитотоксичности, опосредованной вирусом (апоптоз [24], пироптоз, некроз), или за счет иммуноопосредованной цитотоксичности, например, цитотоксических моноклональных антител [25].
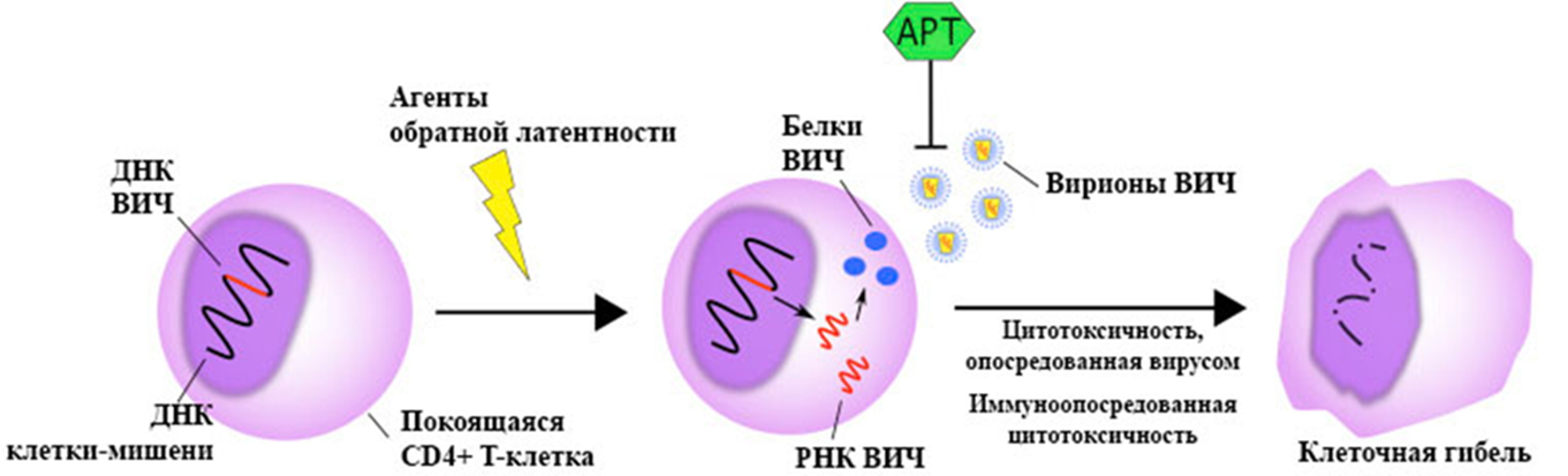
Рисунок 11. Стратегия «шок и убийство», направленная на уничтожение резервуаров ВИЧ.
адаптировано из [25]
К сожалению, эта стратегия во многом остается экспериментальной, так как ее невозможно применить для вируса, скрытого в других типах клеток, например, клетках микроглии. В таком случае вирус, наоборот, лучше надежно «запереть» в клетке, чтобы даже при отмене АРТ не ухудшалось самочувствие пациента. Такой подход называется «блок и замок» (от англ. block and lock). ВИЧ блокируется в клетке за счет эпигенетических модификаций ДНК провируса, например, метилирования промотора, и снижения транскрипционной активности, не затрагивая при этом ДНК пациента. Таким образом, вирусный резервуар «выключается», и наступает глубокая ремиссия, даже при отмене АРТ.
Конечно, идеальный сценарий — это вовсе избавиться от генетический вирусной нагрузки, например, за счет «молекулярных ножниц» CRISPR-Cas9 — читайте об этом подробнее в статье «Битва века: CRISPR vs ВИЧ» [26].
Вакцины против ВИЧ: кто не падал, тот не поднимался
Нужно понимать, что в конечном счете без вакцины остановить глобальную эпидемию ВИЧ будет довольно сложно. Ко многим заболеваниям создать вакцины удается, об этом читайте подробнее в статье «Разработка вакцин: чем и как имитировать болезнь?» [27], однако с ВИЧ ситуация выглядит иначе.
Помимо тех проблем, которые мы обсуждали в начале нашей статьи, а именно — высокая скорость мутаций вируса и наличие скрытых от иммунной системы резервуаров, — есть и другие причины, усложняющие создание вакцины против ВИЧ. Среди них:
- К ВИЧ-инфекции редко формируется естественный иммунитет, в отличие от многих других вирусных инфекций, то есть у ученых до сих нет выверенной модели для воспроизведения.
- Поверхность ВИЧ наполовину покрыта сахарной оболочкой (гликанами), которая маскирует уязвимые участки вируса от антител иммунной системы [28], [29].
Несмотря на все сложности, научное сообщество продолжает поиск эффективной вакцины против ВИЧ. На сегодняшний день известны следующие подходы:
- Вакцины, основанные на индукции гуморального иммунитета (антительный ответ). Их цель — стимулировать выработку тех самых bnAbs, которые были обнаружены у элитных контроллеров [29].
- Платформа мРНК-вакцин [30], доказавшая высокую эффективность против COVID-19, теперь перспективна и для создания вакцин против ВИЧ. Ее преимущества: мощный иммунный ответ, безопасность и масштабируемость производства. Исследования на животных показывают обнадеживающие результаты. мРНК-вакцины вызывают стойкий гуморальный и клеточный иммунитет. Они способствуют выработке нейтрализующих антител и экспансии специфических Т-клеток, которые сохраняются долгое время после вакцинации [31].
История клинических испытаний вакцин против ВИЧ — это череда тщательно продуманных, но зачастую неудачных попыток. Вот только некоторые из них.
- RV144 («Тайское исследование») — луч надежды (2009 г). Это был первый и долгое время единственный пример, доказавший, что вакцина против ВИЧ в принципе возможна. Комбинированная схема «прайм-буст» (вакцина ALVAC и белковый бустер AIDSVAX) показала скромную, но статистически значимую эффективность в 31,2%. Хотя этого недостаточно для широкого применения, успех RV144 стал прорывом. Он предоставил бесценные данные о специфических маркерах иммунного ответа, которые ассоциируются с устойчивостью к заражению [32].
- HVTN 702 (Uhambo) — разочарование (2020 г). Это масштабное исследование в Южной Африке, основанное на усовершенствованной схеме RV144, было досрочно остановлено. Независимый комитет по мониторингу данных установил, что вакцина не обеспечивает статистически значимой защиты от заражения ВИЧ.
- HVTN 705 (Imbokodo) и HVTN 706 (Mosaico) — тупик для одной стратегии (2021–2023 гг.). Эти исследования использовали передовую технологию «мозаичных» вакцин, содержащих генетические последовательности из разных штаммов ВИЧ со всего мира, чтобы обеспечить широкий иммунный ответ. Несмотря на безопасность и способность вызывать иммунный ответ, ни Imbokodo (среди женщин в Африке), ни Mosaico (среди мужчин, имеющих половые контакты с мужчинами, и трансгендерных лиц в Северной и Южной Америке и Европе) не показали эффективности в предотвращении заражения [33].
- Последнее поколение исследований, такое как PrEPVacc, проводимое в Южной Африке, Уганде и Танзании, сочетает тестирование двух экспериментальных вакцин с одновременным применением ДкП. Такой подход позволял этически обоснованно проводить испытания, обеспечивая участникам защиту от заражения ВИЧ на время исследования. Все исследования были прекращены в ноябре 2023 года из-за низкой или вовсе отсутствующей эффективности вакцины в профилактике заражения ВИЧ.
Помимо профилактических вакцин, предназначенных для предотвращения заражения, существуют еще и терапевтические. Они разрабатываются для людей, уже живущих с ВИЧ. Их цель — помочь иммунной системе контролировать вирус без постоянного приема АРТ. Одно из наиболее перспективных исследований — терапевтическая вакцина HTI, представленная на Конференции по ретровирусам и оппортунистическим инфекциям (КРОИ) в 2021 году. Эта вакцина была разработана на основе наблюдений за элитными контролерами и достоверно позволила отменить ежедневный прием АРТ практически на полгода. При более длительной отмене АРТ болезнь возвращалась.
Пока ученые бьются над созданием вакцины, значительный прогресс достигнут в области ДкП. Ленакапавир — новый инновационный препарат для лечения ВИЧ — блокирует репликацию вируса, воздействуя на его капсид. В 2024 году журнал Science признал разработку и применение этого препарата «прорывом года» [34], а в июле 2025 года ВОЗ сделала исторический шаг, рекомендовав инъекционный ленакапавир в качестве средства для профилактики ВИЧ. Этот препарат длительного действия вводится всего (!) два раза в год и обеспечивает практически полную защиту от заражения, что особенно важно для людей, которые имеют ограниченный доступ к медицинской помощи.
Итак, мы видим, что путь к созданию вакцины против ВИЧ оказался долгим и тернистым. Каждая неудача приносила не только разочарование, но и бесценные знания о вирусе и иммунитете. Сегодня научное сообщество, вооруженное новейшими технологиями — от мРНК до целенаправленного дизайна иммуногенов — продолжает движение к цели cо сдержанным оптимизмом, поскольку на сегодняшний день такая вакцина все еще остается недостижимым «Священным Граалем».
Цифровой свет в конце тоннеля

Рисунок 11. Альянс разума.
На горизонте традиционной медицины загорелась новая заря — заря искусственного интеллекта (ИИ). ИИ совершает невозможное: просеивает бескрайние океаны биологических данных, выуживая из них крупицы знания, выводя раннюю диагностику на новый уровень и способствуя введению персонализированного лечения и ускорению разработки вакцин.
Феномен машинного обучения заключается в его умении находить невидимые глазу человека связи. Оно строит сложные, нелинейные модели, которые сплетают в единую картину тысячи признаков и факторов риска, демонстрируя поразительные эффективность и точность.
Какую помощь ИИ способен оказать уже сегодня?
- ВИЧ — это не статичный объект; скорость и количество его мутаций создают две проблемы: поиск консервативных мишеней для будущей вакцины и предсказание мутаций, чтобы бороться с резистентностью ВИЧ к терапии. Алгоритмы машинного обучения анализируют тысячи генетических последовательностей ВИЧ со всего мира и находят уязвимые мишени ВИЧ [35], [36].
- При создании терапевтических молекул-кандидатов приходится перебирать в лаборатории тысячи потенциальных соединений. Это может растянуться на годы. ИИ ускоряет этот процесс в сотни раз, действуя как сверхбыстрый и креативный молекулярный дизайнер, используя различные языковые модели [37]. Он может не только проанализировать природные молекулы, но и сгенерировать совершенно новые, не существующие в природе белковые конструкции. Эти молекулы-кандидаты генерируются так, чтобы идеально подходить к ключевым участкам ВИЧ и вызывать мощный и широкий иммунный ответ [37].
- Как мы и упоминали ранее, у небольшого процента людей, живущих с ВИЧ, со временем вырабатываются особые антитела, способные нейтрализовать множество штаммов вируса. Эти bnAbs — ключевой элемент для создания вакцины. ИИ помогает проанализировать сложный и многоступенчатый путь, который проходит В-клетка, чтобы произвести такие антитела. Понимая эту дорожную карту, ученые могут разработать вакцину, которая будет целенаправленно вести иммунную систему обычного человека по этому же пути, стимулируя выработку bnAbs [38–40].
- Клинические испытания — это долгий и дорогой этап. Успех во многом зависит от множества факторов, включая правильный подбор добровольцев. Алгоритмы анализируют данные предыдущих испытаний, медицинские карты и генетическую информацию, чтобы предсказать, у каких групп населения с наибольшей вероятностью проявится защитный иммунный ответ. Это позволяет проводить более целенаправленные и эффективные исследования, экономя время и ресурсы [36].
Конечно, ограниченный доступ к данным из-за проблем с конфиденциальностью, этические соображения, высокая изменчивость ВИЧ и его разнообразные механизмы уклонения от иммунного контроля усложняют обучение ИИ.
Тем не менее, реальные примеры использования ИИ вдохновляют будущих исследователей уже сегодня.
Например, ученые исследовательского центра Scripps Research занимаются проектом «Вакцина против ВИЧ». Они уже сейчас используют машинное обучение для анализа огромных наборов данных от людей с ВИЧ, чтобы определять корреляцию между иммунными реакциями и контролем над вирусом.
Ученые Медицинского центра Университета Вандербильта работают над проектом по созданию сотен тысяч смоделированных (синтетических) пациентов с ВИЧ с использованием генеративного ИИ. Цель проекта — ускорить долгосрочные обсервационные исследования и решить проблемы, связанные с конфиденциальностью данных в глобальных исследованиях ВИЧ.
Самотестирование на ВИЧ — это простой и анонимный способ узнать свой статус, однако его потенциал до сих пор раскрыт не полностью, и его вполне можно расширить с помощью ИИ. Парадокс заключается в том, что, несмотря на высокую точность тестов, сохраняется серьезная проблема: риск ложноотрицательных результатов. Человек, получивший такой результат, может отложить начало жизненно важной терапии или неправильно использовать средства профилактики (например, ДкП), что в долгосрочной перспективе повышает риск развития устойчивости вируса к лекарствам. В 2024 году компания Roche показала, что ее алгоритм обнаружил четыре случая ВИЧ, пропущенных людьми, благодаря способности анализировать сверхслабые линии на тестах. А в 2021 году алгоритм Валериана Турбе, обученный на десятках тысяч изображений из Южной Африки, достиг рекордной чувствительности (97,8%) и в полевых условиях превзошел человеческое зрение [36].
Модель, разработанная Реда Рави (2019 г.), с помощью машинного обучения предсказывает устойчивость ВИЧ-1 к 33-м bNAbs. Алгоритм определяет критически важные участки вируса, ответственные за резистентность, что позволяет оптимизировать выбор терапии. Другое исследование, проведенное Штайнером и др. (2020 г.), систематически сравнило три различные архитектуры нейронных сетей для прогнозирования устойчивости к 18 антиретровирусным препаратам. Ученые пришли к выводу, что наибольшая точность достигается при объединении данных геномного секвенирования с клинической информацией. Такой комплексный подход не только повышает точность прогноза, но и делает его более интерпретируемым для врачей [36].
Наконец, многие компании и исследовательские группы разрабатывают системы на основе ИИ для помощи врачам в подборе оптимальной схемы АРТ. Алгоритмы анализируют исторические данные тысяч пациентов: генетическую последовательность их вируса, историю приема лекарств, вирусную нагрузку и иммунный статус. На основе этих данных ИИ учится прогнозировать, к каким препаратам у конкретного штамма ВИЧ у данного пациента может развиться устойчивость. Врач, получая на руки генетический отчет о вирусе пациента, может с помощью такой ИИ-системы получить рекомендацию по наиболее эффективной схеме лечения, избежав неработающих вариантов [37].
Эти примеры наглядно показывают, что ИИ — это не абстрактная технология будущего, а уже работающий сейчас инструмент. Он участвует на всех этапах борьбы человека с вирусом: от фундаментального дизайна молекул и понимания структуры вируса до поиска путей его уничтожения и подбора индивидуального лечения.
Show must go on
23 ноября 1991 года лидер группы Queen Фредди Меркьюри (рис. 13) сделал официальное заявление о том, что у него ВИЧ и СПИД. На следующий день легендарный певец умер.

Рисунок 13. Фредди Меркьюри: Show must go on!
Долгие годы из-за стигматизации и боязни беспокоить близких подобное признание пациенты могли сделать только в терминальной стадии болезни: более ранние каминг-ауты не смогли бы им помочь из-за отсутствующего лечения. Сегодня ситуация стабилизировалась, о чем мы и попытались рассказать в своей статье. И, конечно, чем раньше ВИЧ-инфицированный человек узнает о своем статусе, тем больше у него шансов взять вирус под контроль и, возможно, приблизиться к функциональному или даже полному излечению, сдержав распространение эпидемии. Борьба с ВИЧ продолжается. Сегодня мы празднуем ее успехи и уже с большей надеждой смотрим в наше будущее, за которое борются не только люди, но и нейросети.
Одним из последних распоряжений Фредди Меркьюри стала передача всех прав на песню Bohemian Rhapsody фонду имени Тереса Хиггинса, созданному для противостояния ВИЧ и СПИД. Этот фонд учрежден в память об одном из первых людей в Великобритании, скончавшихся от сопутствующих СПИДу заболеваний.
А в какие российские фонды за бесплатным тестированием, консультацией и помощью в лечении можно обратиться, читайте ниже.
Литература
- СПИД: как ВИЧ разрушает нашу иммунную систему;
- Peter Godfrey-Faussett, Luisa Frescura, Quarraisha Abdool Karim, Michaela Clayton, Peter D. Ghys, (on behalf of the 2025 prevention targets working group). (2022). HIV prevention for the next decade: Appropriate, person-centred, prioritised, effective, combination prevention. PLoS Med. 19, e1004102;
- German Advisory Committee Blood (Arbeitskreis Blut), Subgroup ‘Assessment of Pathogens Transmissible by Blood'. (2016). Human Immunodeficiency Virus (HIV). Transfus Med Hemother. 43, 203-222;
- Paul R. Gorry, Jasminka Sterjovski, Melissa Churchill, Kristie Witlox, Lachlan Gray, et. al.. (2004). The role of viral coreceptors and enhanced macrophage tropism in human immunodeficiency virus type 1 disease progression. Sexual Health. 1, 23-34;
- Yuntao Wu, Jon W Marsh. (2003). Gene transcription in HIV infection. Microbes and Infection. 5, 1023-1027;
- Deanna A. Kulpa, Mirko Paiardini, Guido Silvestri. (2025). Immune-mediated strategies to solving the HIV reservoir problem. Nat Rev Immunol. 25, 542-553;
- Andrey I. Murzin, Kirill A. Elfimov, Natalia M. Gashnikova. (2024). The Proviral Reservoirs of Human Immunodeficiency Virus (HIV) Infection. Pathogens. 14, 15;
- «Швейцарский нож» вирусной армии: разгадан секрет обратной транскриптазы;
- Torres, G. (1995). ACTG 175 and delta. GMHC Treat Issues. 9, 2–3;
- Yong Wang, Zhengtong Lv, Yuan Chu. (2015). HIV protease inhibitors: a review of molecular selectivity and toxicity. HIV. 95;
- William Cameron, Anthony J. Japour, Yi Xu, Ann Hsu, John Mellors, et. al.. (1999). Ritonavir and saquinavir combination therapy for the treatment of HIV infection. AIDS. 13, 213-224;
- Jon Cohen. (2015). How a young child fought off the AIDS virus. Science;
- Zhao Wang, Shawn Rumrill, Dongwei Kang, Samuel Desta Guma, Da Feng, et. al.. (2025). Development of enhanced HIV-1 non-nucleoside reverse transcriptase inhibitors with improved resistance and pharmacokinetic profiles. Sci. Adv.. 11;
- Qiuqian Su, Yanjun Li, Ting Huang, Liangjia Wei, Jinfeng He, et. al.. (2025). The Prevalence of Pretreatment Drug Resistance and Transmission Networks Among Newly Diagnosed HIV-1-Infected Individuals in Nanning, Guangxi, China. Pathogens. 14, 336;
- Joseph Fokam, Tekoh Tatiana Anim-Keng, Benjamin Thumamo Pokam, Collins Ambe Chenwi, Aude Christelle Ka’e, et. al.. (2025). Acquired HIV-1 drug resistance to reverse transcriptase and protease inhibitors among people failing antiretroviral therapy in Cameroon and implications for future treatment options. AIDS Res Ther. 22;
- Wei-Ti Chen. (2013). Antiretroviral Therapy (ART) Side Effect Impacted on Quality of Life, and Depressive Symptomatology: A Mixed-Method Study. J AIDS Clin Res. 04;
- Победа над ВИЧ: смертельная лотерея со счастливым концом;
- Timothy Ray Brown. (2015). I Am the Berlin Patient: A Personal Reflection. AIDS Research and Human Retroviruses. 31, 2-3;
- Клетки, которые лечат людей;
- N+1: «Пуповинная кровь вылечила „нью-йоркскую пациентку“ от ВИЧ и не вызвала осложнений»;
- María Salgado, Stephen A. Migueles, Xu G. Yu, Javier Martinez-Picado. (2024). Exceptional, naturally occurring HIV-1 control: Insight into a functional cure. Med. 5, 1071-1082;
- José M. Benito, Daniel Jiménez-Carretero, Jaime Valentín-Quiroga, Ignacio Mahillo, José M. Ligos, et. al.. (2025). Long-Term Elite Controllers of HIV-1 Infection Exhibit a Deep Perturbation of Monocyte Homeostasis. IJMS. 26, 3926;
- Zhuoya Deng, Hongxia Yan, Olivier Lambotte, Christiane Moog, Bin Su. (2025). HIV controllers: hope for a functional cure. Front. Immunol.. 16;
- Апоптоз, или Путь самурая;
- Youry Kim, Jenny L. Anderson, Sharon R. Lewin. (2018). Getting the “Kill” into “Shock and Kill”: Strategies to Eliminate Latent HIV. Cell Host & Microbe. 23, 14-26;
- Битва века: CRISPR vs ВИЧ;
- Разработка вакцин: чем и как имитировать болезнь?;
- Dan H. Barouch. (2008). Challenges in the development of an HIV-1 vaccine. Nature. 455, 613-619;
- Jiae Kim, Sandhya Vasan, Jerome H. Kim, Julie A. Ake. (2021). Current approaches to HIV vaccine development: a narrative review. J Int AIDS Soc.. 24;
- мРНК-вакцина на страже коллективного иммунитета: за что вручили Нобелевскую премию в 2023 году;
- Zekun Mu, Barton F. Haynes, Derek W. Cain. (2021). HIV mRNA Vaccines—Progress and Future Paths. Vaccines. 9, 134;
- Nicos Karasavvas, Erik Billings, Mangala Rao, Constance Williams, Susan Zolla-Pazner, et. al.. (2012). The Thai Phase III HIV Type 1 Vaccine Trial (RV144) Regimen Induces Antibodies That Target Conserved Regions Within the V2 Loop of gp120. AIDS Research and Human Retroviruses. 28, 1444-1457;
- PCR News: «Вакцина против ВИЧ компании J&J признана неэффективной по результатам КИ»;
- Phelan M. (2025). The road to lenacapavir, a breakthrough HIV treatment. Science. 388, 989-991;
- Brian Hie, Ellen D. Zhong, Bonnie Berger, Bryan Bryson. (2021). Learning the language of viral evolution and escape. Science. 371, 284-288;
- Ruyi Jin, Li Zhang. (2025). AI applications in HIV research: advances and future directions. Front. Microbiol.. 16;
- Как языковые модели покорили мир белков;
- Laurent Perez, Mathilde Foglierini RAIN: a Machine Learning-based identification for HIV-1 bNAbs — Research Square Platform LLC;
- Jisun Kim, Matthew McFee, Qiao Fang, Osama Abdin, Philip M. Kim. (2023). Computational and artificial intelligence-based methods for antibody development. Trends in Pharmacological Sciences. 44, 175-189;
- Claire Marks, Charlotte M. Deane. (2020). How repertoire data are changing antibody science. Journal of Biological Chemistry. 295, 9823-9837.






