
Знакомые незнакомцы: внехромосомные кольцевые ДНК
09 декабря 2019
Знакомые незнакомцы: внехромосомные кольцевые ДНК
- 2909
- 1
- 14
3D-модель внехромосомной кольцевой ДНК
-
Автор
-
Редактор
В истории молекулярной биологии многие открытия сначала опережают время, а потом долгие годы остаются незаслуженно забытыми, пока накопившиеся в области геномики и других «-омик» данные не приведут к их повторному «переоткрытию». Так случилось и с внехромосомной кольцевой ДНК, которая описана у большинства эукариот, а у человека известна с 60-х годов прошлого века. В последнее время этот ранее неизученный пул нуклеиновых кислот привлек внимание ученых, поскольку выяснилось, насколько весомым является их вклад в патогенез онкологических заболеваний. Позволит ли внехромосомная кольцевая ДНК собрать опухолевый пазл в единую картину? Только ли для опухолей характерно ее присутствие? О некоторых аспектах биологии внехромосомных кольцевых ДНК мы и поговорим в этом обзоре.

Рисунок 1. Цитогенетический препарат клетки нейробластомы с присутствующими на нем 16-ю двойными минихромосомами. Опубликовано в журнале Lancet, 1965 год.
Кольцевые ДНК описаны у вирусов, прокариот, низших эукариот (дрожжей, простейших и грибов), а также у некоторых высших растений. У млекопитающих, в том числе у человека, кольцевые ДНК присутствуют в составе митохондриального генома. Весь остальной геном, как считалось, в норме представлен линейными хромосомами и только в опухолях были описаны крупные внехромосомные кольцевые ДНК, которые удавалось наблюдать, изучая образцы новообразований в световом микроскопе (рис. 1).
Эти структуры получили название double minutes (от лат. minutus — маленький, мелкий) — двойные минихромосомы [1]. От обычных хромосом они отличаются не только кольцевой формой и размером, но и тем, что не имеют центромеры.
Впоследствии предложили методы, позволяющие отделить пул кольцевых ДНК от основной массы ДНК с помощью центрифугирования в градиенте плотности хлорида цезия или специфических экзонуклеаз и двумерного гель-электрофореза. Но, как и в случае с кольцевыми РНК (о которых «Биомолекула» писала в [2]), только в последнее время, с развитием технологии секвенирования нового поколения и разработкой биоинформатических подходов для поиска кольцевых молекул, удалось изучить всё их многообразие, ограничивающееся далеко не только двойными минихромосомами.
Четкой номенклатуры внехромосомных кольцевых ДНК, или вкДНК (extrachromosomal circular DNA, eccDNA), пока нет, но сегодня известно о существовании их вариантов размерами от сотен пар нуклеотидов (например, микроДНК, состоящей из 200–400 п.н.) до нескольких миллионов. Внехромосомная кольцевая ДНК может содержать повторяющиеся участки (как, скажем, теломерная или рибосомная ДНК) или состоять из уникальных, неповторяющихся последовательностей. Кольцевая ДНК упакована не столь плотно, как в хромосомах, что играет важную регуляторную роль, так как облегчает доступ к хроматину и способствует транскрипции определенных генов [3].
Точное число всех внехромосомных кольцевых ДНК, присутствующих в клетках, подсчитать достаточно сложно: методы секвенирования для количественного учета не годятся, а флуоресцентная гибридизация in situ (FISH), позволяющая локализовать в клетках любые последовательности ДНК, характеризуется высоким уровнем «шума». Малый размер и отсутствие четких морфологических «опознавательных знаков» вкДНК еще более затрудняют их идентификацию при FISH.
Совсем недавно на базе нейронной сети U-Net, широко применяющейся при анализе и обработке биомедицинских изображений, была создана программа ecSeg, позволяющая подсчитывать количество внехромосомных кольцевых ДНК в образцах различных клеточных линий [4]. Программа работает с изображениями, получаемыми камерой флуоресцентного микроскопа с метафазных пластинок, окрашенных DAPI (ДНК-связывающимся флуорофором). Проанализировав сорок различных опухолевых клеточных линий человека, создатели программы обнаружили, что некоторые из них (например, клеточная линия рака молочной железы HCC1569) содержат более 100 различных внехромосомных кольцевых ДНК в каждой клетке. Причем вариабельность вкДНК внутри одной и той же клеточной линии обеспечивается уже при их содержании в каждой клетке в количестве всего 10 единиц (и более). Это говорит о той важной роли, которую играет количество вкДНК в повышении неоднородности клеточной популяции.
Умножай и властвуй
Но вернемся к самым известным представителям внехромосомных кольцевых ДНК — двойным минихромосомам. Предполагается, что их появлению в клетке предшествует амплификация (многократное увеличение числа копий) определенных генов. В дальнейшем амплифицированные участки «вырезаются» из хромосомы и закольцовываются. Так, двойные минихромосомы клеток нейробластом (злокачественных опухолей симпатической нервной системы) содержат амплифицированный ген MYCN. Экстрахромосомная амплификация KRAS наблюдается в аденокарциномах пищевода, пищеводно-желудочного перехода и желудка, а также в некоторых случаях колоректального рака. Внехромосомная амплификация гена циклина D1 описана при раке мочевого пузыря [5]. Как правило, каждая кольцевая минихромосома состоит из амплифицированных копий только одного онкогена, хотя есть и исключения: так, описаны внехромосомные кольцевые ДНК с одновременной амплификацией генов EGFR и CDK4 [6]. Средний размер ампликона (участка ДНК, являющегося результатом амплификации) составляет 1,26 миллиона пар нуклеотидов [3], поэтому неудивительно, что двойные минихромосомы достаточно крупны (хоть это и звучит как каламбур).
В дальнейшем кольцевые структуры, несущие амплифицированный онкоген, могут встраиваться в хромосому, причем в произвольно выбранной позиции. В этом случае они формируют на хромосоме гомогенно окрашенные участки (ГОУ; в англоязычной литературе — homogenous staining regions, HSR), представляющие собой цитогенетическое проявление амплификации (рис. 2).
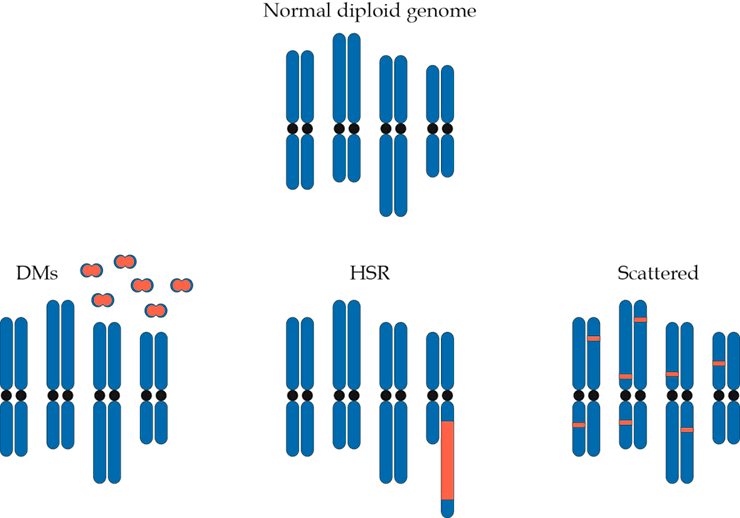
Рисунок 2. Двойные минихромосомы могут приводить к появлению ГОУ при встраивании в один и тот же участок на хромосоме или распределяться случайным образом, встраиваясь в разные участки разных хромосом
Отсутствие центромер приводит к тому, что в процессе митоза двойные минихромосомы, в отличие от обычной хромосомной ДНК, распределяются между дочерними клетками случайным образом. Поскольку амплификация онкогенов придает опухолевой клетке преимущество в скорости роста по сравнению с соседями, те из них, что содержат большее количество внехромосомных кольцевых ДНК, приобретают пролиферативное преимущество и проходят, таким образом, положительный отбор в ходе эволюции опухоли [7].
Рассматривая прогрессию опухоли через призму дарвиновской эволюции, можно объяснить и альтернативный вариант — полное исчезновение двойных минихромосом из клетки. Например, при таргетном лечении трастузумабом рака молочной железы (РМЖ) с амплификацией гена Her2/neu примерно у одной трети больных возникает рецидив [8]. Механизмов развития резистентности к таргетной терапии существует много, но один из вариантов заключается в активации работы сигнальных каскадов, перекрывающихся с сигнальным путем Her2/neu, с помощью компенсирующей амплификации генов PIK3CA и c-Met [8], [9]. Так, при лечении трастузумабом метастатического РМЖ с амплификацией Her2/neu в 27,7% случаев обнаруживается и амплификация гена рецептора тирозинкиназы c-Met [10]. Амплификация с-Met берет на себя функцию драйверной, а кольцевые минихромосомы, несущие амплифицированный ген Her2/neu, становятся балластом: они элиминируются из клетки.
На примере появления резистентных к трастузумабу клеток и прогрессии РМЖ, несмотря на лечение, хорошо видно, почему ингибирование только одной молекулярной мишени может оказаться терапевтически неэффективным. Стратегическим направлением клинических исследований сейчас становится воздействие сразу на несколько мишеней (double-hit-лечение). Так, по сравнению с обычной таргетной терапией при немелкоклеточном раке легкого с мутациями гена EGFR, использование комбинированной терапии бевацузимабом и эрлотинибом увеличивает время до прогрессирования заболевания и общую выживаемость больных [11]. Комбинация различных препаратов используется и при лечении меланомы c мутацией в гене BRAF [12]. К сожалению, ни в одном из исследований не описана какая-либо комбинация препаратов, которая бы привела к полному излечению пациентов. Во всех случаях неизбежно развивается резистентность, правда, в более поздние сроки по сравнению с монотерапией.
Пассажир садится за руль
Гены, которые подвергаются амплификации, находятся, как правило, в начале сигнальных каскадов, регулирующих важнейшие клеточные процессы, такие как рост клеток и поддержание целостности и функциональной дееспособности генома. Эти гены являются драйверами процесса канцерогенеза, то есть играют решающую роль в развитии опухоли. Учитывая, что процесс образования кольцевых структур может быть опосредован репарацией двухцепочечных разрывов с помощью негомологичного соединения концов линейной ДНК (non-homologous end joining, NHEJ) — процесса неточного и потенциально ведущего к накоплению мутаций, — можно ожидать, что мутационная нагрузка на вкДНК окажется выше, чем на остальные части опухолевого генома. И действительно, оказалось, что амплификация с образованием внехромосомной кольцевой ДНК может сопровождаться вторичными мутациями, которые изначально не влияют на рост опухоли (за что и получили название «мутации-“пассажиры”»), но способны выступать как потенциальные драйверы опухолевой прогрессии при изменении условий внешней среды, например, если опухоль подвергнется лечению.
Ярким примером того, как мутации-«пассажиры» на внехромосомных кольцевых ДНК, накапливаемые «про запас», обеспечивают дополнительный механизм адаптации опухоли в новых условиях существования, является возникновение резистентности к лечению ингибиторами тирозинкиназы в глиобластомах (злокачественных опухолях головного мозга) с делецией 16 экзона в РНК-транскрипте гена EGFR (EGFRxE16) (рис. 3) [13].
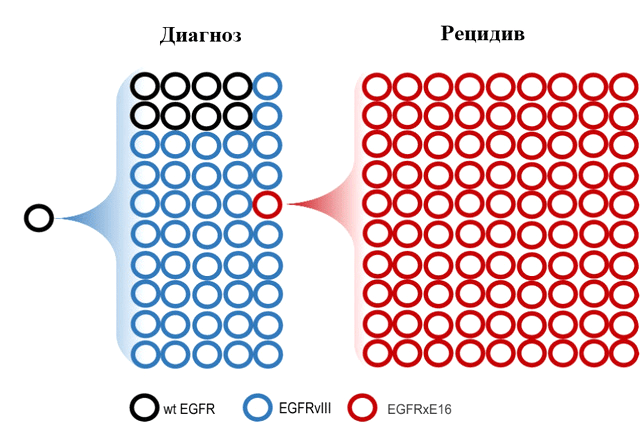
Рисунок 3. Молекулярный профиль внехромосомных кольцевых ДНК опухоли в момент постановки диагноза и после обнаружения рецидива. В каждой из кольцевых минихромосом возможно возникновение дополнительных мутаций (обозначены кружками различных оттенков). вкДНК, несущие ген EGFR дикого типа (wtEGFR), отмечены черными кружками. Кольцевые минихромосомы с мутацией EGFRvIII — синего цвета, с мутацией EGFRxE16 — красного. Объяснения см. в тексте.
В клетках глиобластом возможны несколько различных мутаций гена EGFR. В случае мутации EGFRvIII, которая возникает в результате делеции экзонов 2–7 гена EGFR, опухоль, как и при наличии EGFR «дикого типа», остается чувствительной к терапии ингибиторами тирозинкиназы EGFR, такими как эрлотиниб и др. Напротив, опухоли, содержащие кольцевые минихромосомы с мутацией EGFRxE16, приобретают резистентность к проводимой терапии. Находясь в небольшом количестве клеток опухоли в момент постановки диагноза, с каждым поколением клеток кольцевые минихромосомы с мутацией EGFRxE16 накапливаются и дают начало новому опухолевому клону, преуспевшему в изменившихся условиях окружающей среды больше остальных. Отбор наиболее приспособленных — движущая сила эволюции, и здесь эволюция внутри опухоли поразительно напоминает классическую дарвиновскую эволюцию, предопределяя то обстоятельство, что возникающий через некоторое время рецидив будет представлен именно клоном с мутацией EGFRxE16 на внехромосомной кольцевой ДНК. Другой путь эволюции глиобластом — потеря двойных микрохромосом с мутантным EGFR, что тоже повышает устойчивость к лекарственным препаратам, усиливает злокачественный потенциал опухолевой популяции и объясняет плохой прогноз при данном заболевании [14].
Под окружающей средой в данном случае мы понимаем спектр экспрессии генов и белков, мутации и эпигенетические изменения, уже имеющиеся в этой клетке, опухолевое микроокружение и внешние факторы, такие как препараты, используемые для лечения. В этом конкретном случае изменение окружающей среды — это воздействие на опухоль лекарственным препаратом эрлотиниб.
Когда замкнутость дает преимущества
Возникновение амплификаций и вторичных по отношению к ним точечных мутаций за пределами хромосом имеет глубокий биологический смысл. Так опухоли получают возможность «экспериментировать» с новыми функциями, не нарушая свою жизнедеятельность. К тому же, с помощью амплификаций и других мутаций кольцевой внехромосомной ДНК формируется генетическая гетерогенность (разнородность) опухоли, а процесс ее эволюции идет гораздо быстрее, чем если бы эти процессы происходили исключительно в хромосомах. Это было показано Кристен Тёрнер и ее соавторами с помощью методов математического моделирования [15]. Они обнаружили, что внехромосомная амплификация позволяет достичь более высокого уровня экспрессии онкогена благодаря неравному распределению кольцевой ДНК между дочерними клетками во время митоза. Как и было предсказано моделью, в опухолях, где отмечалось присутствие вкДНК, содержание онкогенов EGFR (включая EGFRvIII) и MYC было значительно более высоким по сравнению с теми, которые не задействовали механизм внехромосомной амплификации. Авторы исследования также пришли к выводу, что если онкоген амплифицируется интрахромосомно, гетерогенность опухоли остается на сравнительно низком уровне.
Существование гетерогенности в опухоли может иметь большое клиническое значение, так как оказывает влияние на развитие заболевания и во многом определяет ответ на лечение [15], [16]. Представим себе опухолевые клетки с полностью идентичным геномом за исключением качественного и количественного спектра внехромосомных кольцевых ДНК. Уже только за их счет опухоль обеспечивает себе огромное разнообразие генотипических и фенотипических вариантов, и высока вероятность, что хотя бы один из них преуспеет больше остальных при изменении условий окружающей среды. Если учесть, что в реальных условиях in vivo опухоль является внутренне гетерогенной за счет генных мутаций и эпигенетических изменений, а также за счет влияния внешних факторов (таких как микроокружение опухоли), то вкДНК делает процесс опухолевой эволюции еще более сложным, приводя к прогрессии заболевания и неудачам в лечении.
На что способна кольцевая ДНК?
Важное открытие последних лет состоит в том, что в неопухолевых клетках также присутствуют внехромосомные кольцевые ДНК. Так, в 2018 году сразу две исследовательские группы продемонстрировали существование вкДНК в здоровых тканях человека [17], [18].
Молекулы кольцевой ДНК, обнаруженные в нормальных клетках, сильно различаются по размеру и генному составу. Часть из этих внехромосомных структур очень мала (менее 25 т.п.н.), другие же достигают 1 миллиона пар нуклеотидов, что сравнимо с двойными минихромосомами опухолей. Надо особо подчеркнуть, что сравнимы внехромосомные кольцевые ДНК опухолевой и нормальной тканей могут быть только по размеру, но не по структуре — в норме амплификации генов на внехромосомной ДНК не происходит.
В составе «нормальной» вкДНК обнаруживаются целые гены и их отдельные участки, межгенные промежутки, повторяющиеся последовательности, ретровирусы, ретротранспозоны, длинные терминальные повторы (LTR) и т.д. Ученые предполагают, что это продукты удаленной из хромосом поврежденной ДНК, которая не сразу элиминируется из клетки, а продолжает существовать в нестабильной кольцевой форме. Был даже предложен новый термин «циркулóм», обозначающий совокупность дополнительных внехромосомных кольцевых молекул ДНК [17]. Интересно, что хромосомы, содержащие наибольшее количество генов, являются и источником самого большого количества внехромосомных кольцевых ДНК [18].
Какую роль может играть эта ДНК в нормальной, неопухолевой клетке? Для ответа на этот вопрос ученым может пригодиться CRISPR/Cas — самая нашумевшая технология последних лет, о которой «Биомолекула» неоднократно писала [19–22].
Технология CRISPR сделала возможным эндогенный биогенез внехромосомной кольцевой ДНК в культуре клеток. Эксперименты были проведены на человеческих клетках почки эмбриона (HEK293T) и фибробластах молочной железы человека (HMF). Но принцип метода универсален и подходит для любых клеточных культур: нужны лишь два различных рибопротеиновых комплекса CRISPR/Cas9, вносящие в ДНК одной и той же хромосомы два двухцепочечных разрыва, а далее дело за клеточной системой репарации NHEJ, превращающей вырезанный кусок в кольцо. С помощью этой технологии была продемонстрирована гипотетическая ранее транскрипционная активность внехромосомной кольцевой ДНК [23]. Показано, что с вкДНК транскрибируются не только мРНК, но и малые некодирующие РНК — микроРНК и короткие интерферирующие РНК, которые могут подавлять экспрессию генов в клетках на уровне трансляции посредством РНК-интерференции [24]. Интересно, что эти линейные молекулы РНК содержат соединительные последовательности, характерные в то же время и для кольцевой РНК, что может привести к потенциальным ошибкам при биоинформатическом анализе данных секвенирования [25]. Поэтому при работе с кольцевой РНК необходимо подтверждать данные РНК-секвенирования (полученные методами «сухой» биологии) с помощью РНК-азы R, нозерн-блоттинга или электрофоретически. Сами же химерные линейные РНК, содержащие соединительные последовательности, характерные для бэксплайсинга (от англ. backsplicing — процесс сплайсинга с последующим соединением концов вырезанного транскрипта «голова к хвосту»), следует рассматривать как еще один тип молекул РНК, которые, возможно, выполняют в организме те же функции, что и кольцевые РНК, и потому заслуживают прицельного изучения.
Транскрипционной регуляцией экспрессии генов функции внехромосомной кольцевой ДНК не ограничиваются. Подобно экзосомам, она может выполнять роль переносчиков генетической информации от клетки к клетке. Межклеточные взаимодействия — это универсальный по своей природе биологический механизм, который лежит в основе существования всех многоклеточных. Процессы межклеточной коммуникации с особым вниманием изучают онкологи, так как, к сожалению, опухоли используют те же самые механизмы коммуникации, что и здоровые клетки. Уже накоплены данные о том, что вкДНК может репрограммировать микроокружение опухоли, участвовать в формировании преметастатических ниш, супрессивно модулировать иммунные клетки, тем самым определяя развитие опухолевого процесса и прогноз заболевания [3], [15–17].
Не менее интересно возможное участие внехромосомных кольцевых ДНК в регуляции иммунных процессов в клетке. Известно, что в ответ на появление молекул ДНК в цитоплазме клетка активирует cGAS — синтазу 2′-3′-циклического ГМФ-АМФ, — что запускает сигнальный каскад, кульминацией которого является продукция интерферона и других медиаторов воспаления . Таков иммунный ответ на внешние патогены.
О cGAS-пути иммунного ответа «Биомолекула» писала в статье «Почему прячут ДНК от Стинга?» [26].
При попадании в цитоплазму внехромосомная кольцевая ДНК, если она не подвергается деградации ферментами, такими как TREX1 , тоже способна запускать cGAS-каскад, действуя, таким образом, как эндогенный антиген, активирующий аутоиммунные пути в клетке.
Перспективы использования внехромосомной кольцевой ДНК в медицине
Внехромосомная кольцевая ДНК, подобно линейным «осколкам» хромосом, может попадать не только в цитоплазму, но и в кровяное русло. Опухоли участвуют в этом процессе не менее активно, чем здоровые ткани (рис. 4).
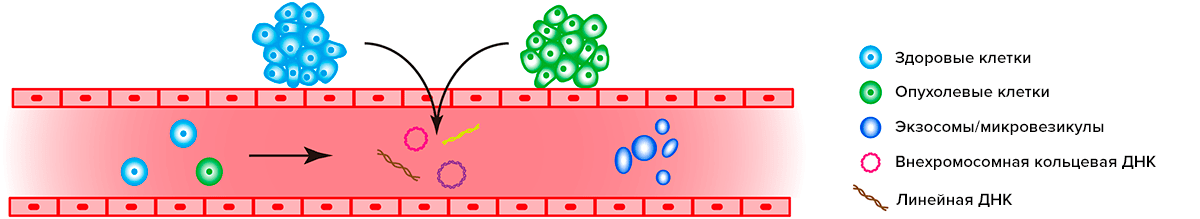
Рисунок 4. Источником ДНК для жидкостной биопсии могут быть линейные «осколки» хромосом и внехромосомная кольцевая ДНК, а также экзосомы, циркулирующие опухолевые клетки и клетки нормальных тканей, попадающие в кровяное русло
Количество внехромосомной кольцевой ДНК в крови не всегда коррелирует с размерами опухоли, но также зависит и от ее пролиферативной активности, васкуляризации, скорости деградации и других факторов. К тому же, необходимо помнить, что источником внехромосомной кольцевой ДНК в крови служат не только опухолевые, но и нормальные клетки. Но поскольку вкДНК опухолей обычно больше по размеру, это создает потенциальную возможность использования жидкостной биопсии для определения их динамики при хирургическом и лекарственном лечении злокачественных новообразований различной локализации [27]. Перспективным подходом является и оценка риска рецидива заболевания на основе выявляемых методом жидкостной биопсии закономерностей изменения численности внехромосомных кольцевых ДНК. Однако техническая сложность анализа минимальных различий размера вкДНК из здоровых и опухолевых клеток, необходимость минимизации ложно-положительных результатов и создания крайне чувствительного теста делают клиническое применение внехромосомной кольцевой ДНК опухолей как биомаркера для жидкостной биопсии делом отдаленного будущего. По крайней мере, эксперты американского общества клинической онкологии (ASCO) и коллегии американских патологов (CAP) по этому вопросу настроены скептически [28].
Более реальным выглядит создание лекарственного препарата, прицельно разрушающего внехромосомные кольцевые ДНК в опухолевых клетках и таким образом оказывающего терапевтическое воздействие. Так, уже появилось сообщение о том, что двуцепочечные разрывы, вносимые в структуру вкДНК с помощью CRISPR/Cas9, приводят к их агрегации, включению в состав микроядра и элиминации из клетки [29].
Заключение
Становится очевидным, что внехромосомные кольцевые ДНК играют важную роль в нормальных клетках и клетках опухолей. Будучи широко распространенными практически у всех эукариот, кольцевые ДНК участвуют в транскрипционной регуляции уровня экспрессии различных генов, процессах иммунного ответа, межклеточном взаимодействии и выполняют другие важные функции.
В опухолях же двойные минихромосомы можно рассматривать как резервуар для накопления различных амплификаций и точечных мутаций, причем все эти изменения, что немаловажно, являются обратимыми. Кольцевая ДНК обеспечивает высокую скорость накопления мутаций, которой не удается достичь в линейных хромосомах. И при этом клетка в любой момент может повернуть процесс вспять — если выяснится, что мутация несет потенциальный вред опухоли, вкДНК, ее содержащая, элиминируется из клетки. В конечном итоге именно внехромосомная кольцевая ДНК придает злокачественным новообразованиям пластичность, что делает лечение опухолей такой сложной задачей.
Литература
- David Cox, Catherine Yuncken, ArthurI. Spriggs. (1965). MINUTE CHROMATIN BODIES IN MALIGNANT TUMOURS OF CHILDHOOD. The Lancet. 286, 55-58;
- Власть колец: всемогущие кольцевые РНК;
- Sihan Wu, Kristen M. Turner, Nam Nguyen, Ramya Raviram, Marcella Erb, et. al.. (2019). Circular ecDNA promotes accessible chromatin and high oncogene expression. Nature. 575, 699-703;
- Utkrisht Rajkumar, Kristen Turner, Jens Luebeck, Viraj Deshpande, Manmohan Chandraker, et. al.. (2019). EcSeg: Semantic Segmentation of Metaphase Images Containing Extrachromosomal DNA. iScience. 21, 428-435;
- Ozkan Bagci, Serkan Kurtgöz. (2015). Amplification of cellular oncogenes in solid tumors. North Am J Med Sci. 7, 341;
- Ana C. deCarvalho, Hoon Kim, Laila M. Poisson, Mary E. Winn, Claudius Mueller, et. al.. (2018). Discordant inheritance of chromosomal and extrachromosomal DNA elements contributes to dynamic disease evolution in glioblastoma. Nat Genet. 50, 708-717;
- LUKÁŠ LACINA, MATÚŠ ČOMA, BARBORA DVOŘÁNKOVÁ, ONDŘEJ KODET, NIKOLA MELEGOVÁ, et. al.. (2019). Evolution of Cancer Progression in the Context of Darwinism. Anticancer Res. 39, 1-16;
- Debora de Melo Gagliato, Denis Leonardo Fontes Jardim, Mario Sergio Pereira Marchesi, Gabriel N. Hortobagyi. (2016). Mechanisms of resistance and sensitivity to anti-HER2 therapies in HER2+ breast cancer. Oncotarget. 7;
- Maria Luque-Cabal, Paula García-Teijido, Yolanda Fernández-Pérez, Luisa Sánchez-Lorenzo, Isabel Palacio-Vázquez. (2016). Mechanisms behind the Resistance to Trastuzumab in HER2-Amplified Breast Cancer and Strategies to Overcome It. Clin Med Insights Oncol. 10s1, CMO.S34537;
- Colan M Ho-Yen, J Louise Jones, Stephanie Kermorgant. (2015). The clinical and functional significance of c-Met in breast cancer: a review. Breast Cancer Res. 17;
- Takashi Seto, Terufumi Kato, Makoto Nishio, Koichi Goto, Shinji Atagi, et. al.. (2014). Erlotinib alone or with bevacizumab as first-line therapy in patients with advanced non-squamous non-small-cell lung cancer harbouring EGFR mutations (JO25567): an open-label, randomised, multicentre, phase 2 study. The Lancet Oncology. 15, 1236-1244;
- Ester Simeone, Antonio M. Grimaldi, Lucia Festino, Vito Vanella, Marco Palla, Paolo A. Ascierto. (2017). Combination Treatment of Patients with BRAF-Mutant Melanoma: A New Standard of Care. BioDrugs. 31, 51-61;
- Ke Xu, Liang Ding, Ti-Cheng Chang, Ying Shao, Jason Chiang, et. al.. (2019). Structure and evolution of double minutes in diagnosis and relapse brain tumors. Acta Neuropathol. 137, 123-137;
- David A. Nathanson, Beatrice Gini, Jack Mottahedeh, Koppany Visnyei, Tomoyuki Koga, et. al.. (2014). Targeted Therapy Resistance Mediated by Dynamic Regulation of Extrachromosomal Mutant EGFR DNA. Science. 343, 72-76;
- Kristen M. Turner, Viraj Deshpande, Doruk Beyter, Tomoyuki Koga, Jessica Rusert, et. al.. (2017). Extrachromosomal oncogene amplification drives tumour evolution and genetic heterogeneity. Nature. 543, 122-125;
- Roel G. W. Verhaak, Vineet Bafna, Paul S. Mischel. (2019). Extrachromosomal oncogene amplification in tumour pathogenesis and evolution. Nat Rev Cancer. 19, 283-288;
- Teressa Paulsen, Pankaj Kumar, M. Murat Koseoglu, Anindya Dutta. (2018). Discoveries of Extrachromosomal Circles of DNA in Normal and Tumor Cells. Trends in Genetics. 34, 270-278;
- Henrik Devitt Møller, Marghoob Mohiyuddin, Iñigo Prada-Luengo, M. Reza Sailani, Jens Frey Halling, et. al.. (2018). Circular DNA elements of chromosomal origin are common in healthy human somatic tissue. Nat Commun. 9;
- CRISPR-системы: иммунизация прокариот;
- CRISPR-эпопея и ее герои;
- От слов к делу: технологию CRISPR-Cas впервые применили для лечения онкозаболеваний;
- Разнообразие и эволюция систем CRISPR/Cas;
- Henrik Devitt Møller, Lin Lin, Xi Xiang, Trine Skov Petersen, Jinrong Huang, et. al.. (2018). CRISPR-C: circularization of genes and chromosome by CRISPR in human cells. Nucleic Acids Research;
- Teressa Paulsen, Yoshiyuki Shibata, Pankaj Kumar, Laura Dillon, Anindya Dutta. (2019). Small extrachromosomal circular DNAs, microDNA, produce short regulatory RNAs that suppress gene expression independent of canonical promoters. Nucleic Acids Research. 47, 4586-4596;
- Leire Iparraguirre, Iñigo Prada-Luengo, Birgitte Regenberg, David Otaegui. (2019). To Be or Not to Be: Circular RNAs or mRNAs From Circular DNAs?. Front. Genet.. 10;
- Почему прячут ДНК от Стинга?;
- Jing Zhu, Siyu Chen, Fan Zhang, Liang Wang. (2018). Cell-Free eccDNAs: A New Type of Nucleic Acid Component for Liquid Biopsy?. Mol Diagn Ther. 22, 515-522;
- Jason D. Merker, Geoffrey R. Oxnard, Carolyn Compton, Maximilian Diehn, Patricia Hurley, et. al.. (2018). Circulating Tumor DNA Analysis in Patients With Cancer: American Society of Clinical Oncology and College of American Pathologists Joint Review. JCO. 36, 1631-1641;
- Yoshihiro Oobatake, Noriaki Shimizu. (2019). Double‐strand breakage in the extrachromosomal double minutes triggers their aggregation in the nucleus, micronucleation, and morphological transformation. Genes Chromosomes Cancer;
- Takaaki Watanabe. (2013). Model Systems Facilitating an Understanding of Mechanisms for Oncogene Amplification. Oncogene and Cancer - From Bench to Clinic.





