Экзосома — механизм координации и взаимопомощи клеток организма
22 октября 2013
Экзосома — механизм координации и взаимопомощи клеток организма
- 15867
- 8
- 11
Вам посылка издалека!
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Необходимым условием жизнедеятельности многоклеточного организма являются межклеточные взаимосвязи, позволяющие скоординировать общие биохимические процессы. Для осуществления такой координации, дающей возможность сообществу клеток контролировать поведение ее частей, требуются механизмы, которые позволяют обмениваться комплексной информацией на расстоянии. Шесть лет тому назад такой механизм был открыт при изучении микроскопических пузырьков, выделяемых клетками во внеклеточную среду. Эти пузырьки, до последнего времени считавшиеся чем-то вроде мусорного бачка для удаления из клетки отходов жизнедеятельности, оказались бесценным кладом для будущей медицины!
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Необходимым условием жизнедеятельности многоклеточного организма являются межклеточные взаимосвязи, позволяющие скоординировать биохимические процессы, протекающие в его клетках. Такая коммуникация даёт возможность контролировать и направлять развитие и работу организма. Например, развитие эмбриона требует сложнейшей регуляции: необходимо, чтобы все клетки правильно посылали сигналы о себе и правильно реагировали на сигналы, полученные извне. Неадекватная реакция на такой сигнал может привести к аномалиям развития или к таким заболеваниям как рак. Сигналы передаются с помощью гормонов, цитокинов и хемокинов, факторов роста, нейромедиаторов, метаболитов, ионов и проч. Передача сигналов может осуществляться как путем секреции во внеклеточное пространство, так и через щелевые контакты напрямую между клетками [1]. Однако эти способы передачи сигнала предполагают либо тесный контакт между клетками, либо слишком просты для того, чтобы обмениваться комплексной информацией на расстоянии.
Как недавно выяснилось, есть еще один способ передачи информации между клетками — крошечные внеклеточные пузырьки, выделяемые клетками в окружающую среду и разносимые кровотоком по всему организму [2]. С момента открытия и до начала XXI века никто ими особенно не интересовался. Потом выяснилось, что они обладают способностью регулировать иммунные реакции организма. Когда же в 2007 году в них были обнаружены нуклеиновые кислоты, стало ясно, что это пока недостаточно изученный механизм координации и «взаимопомощи» клеток организма [3].
Благодаря тому, что эти пузырьки несут белки, липиды и нуклеиновые кислоты, они способны воздействовать на клетку-адресата гораздо более сложным способом, чем отдельные растворенные вещества. Дополнительное удобство здесь в том, что содержимое пузырька окружено мембраной, которая предохраняет его от воздействия среды. Рецепторы на поверхности мембраны обеспечивают доставку точно по адресу. Путешествуют такие «посылки» наиболее экономичным «водным транспортом» — с жидкостью, циркулирующей по кровеносным и лимфатическим сосудам. Таким образом обеспечивается обмен информацией между удаленными клетками в самых разных органах и частях тела.
Помимо переноса информации внеклеточные везикулы могут участвовать и в механизмах «взаимопомощи» — доставлять готовые белки, необходимые «адресату». Например, внеклеточные пузырьки, называемые экзосомами, переправляют от нейронов к мышечным клеткам мембранный белок синаптотагмин-4. Он нужен для формирования нервно-мышечного соединения (синапса), через которое передаются электрические сигналы от нейронов к мышечным клеткам. Производится этот белок в нервных клетках, а используется в мышечных, так что без пересылки тут не обойтись [4].
В 2013 году работы по изучению везикулярного транспорта были удостоены Нобелевской премии: «Нобелевская премия по физиологии и медицине (2013): везикулярный транспорт» [5].
Классификация и механизмы образования внеклеточных везикул
В зависимости от того, как образуются внеклеточные пузырьки и какой они величины, их называют апоптозными тельцами, эктосомами или экзосомами.
Апоптозные тельца, они же апотельца, — это ограниченные плазматической мембраной фрагменты клетки, образующиеся в результате апоптоза — регулируемой организмом самоликвидации клетки. Они имеют размер около 50–5000 нм в диаметре и могут содержать органеллы или даже фрагменты ядра погибшей клетки.
Эктосомы, или почкующиеся микровезикулы, образуются путем выпячивания плазматической мембраны из клетки наружу; выпуклость отшнуровывается от мембраны клетки и превращается в пузырек. Это довольно крупные пузырьки — обычно от 50 до 200 нм, но иногда достигают и 1000 нм в диаметре.
Экзосомы — небольшие пузырьки (обычно от 40 до 100 нм). Первоначально они образуются внутри клетки — почкуются в полость, называемую эндосомой. Когда в этой полости накапливается достаточно много экзосом, дальнейшая ее судьба зависит от того, какими липидами промаркирована ее мембрана. Если эндосома помечена лизобисфосфатидиловой кислотой (фосфатидилинозитол-3-фосфат) и содержит убиквитинированные белки, то ее содержимое будет уничтожено: она сольется с лизосомой — мембранным пузырьком, наполненным ферментами, которые расщепляют белки, углеводы, липиды и нуклеиновые кислоты. Если же мембрана эндосомы содержит церамиды — это сигнал «отправить почту»: эндосома сливается с поверхностной мембраной клетки, и множество экзосом выталкивается наружу, во внеклеточную среду (рис. 1).
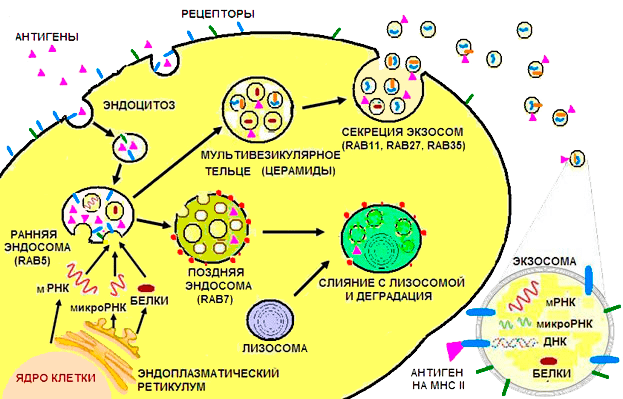
Рисунок 1. Образование экзосом. Мембрана экзосомы образуется в результате впячивания внутрь мембраны ранней эндосомы. Белки, РНК, ДНК попадают внутрь экзосомы из цитоплазмы клетки, тогда как антигены сперва попадают в результате эндоцитоза в эндосому и уже там связываются на наружней поверхности экзосомы с белками главного комплекса гистосовместимости. Рецепторы экзосомы, очевидно, достаются ей «по наследству» от плазматической мембраны клетки. Судьба эндосомы зависит от маркировки её мембраны определёнными липидами: если она помечена лизобисфосфатидиловой кислотой (красные точки), то её содержимое будет уничтожено, а если церамидами — вытолкнуто из клетки наружу. Руководят этими процессами ГТФазы семейства Rab, различные члены которого выполняют разные функции: Rab5 руководит образованием эндосомы, Rab7 организует деградацию содержимого мультивезикулярной эндосомы в лизосоме, а Rab11, Rab27 и Rab35 необходимы для секреции экзосом во внеклеточное пространство. Показано, что экзосомы содержат порядка 4000 различных белков, более 1500 разных микроРНК и мРНК, а также ДНК. Внизу справа — «обобщенная» экзосома в увеличенном виде.
Механизм поглощения клетками млекопитающих экзосом пока изучен слабо. Этот механизм включает эндоцитоз, активируемый экзосомой путем фосфорилирования внеклеточной регулируемой киназы-1/2 (ERK1/2), передающей этот сигнал на белок теплового шока 27 (HSP27). Процесс эндоцитоза негативно регулируется белком кавеолином-1 [6].
Экзосомы и эктосомы были обнаружены в самых разных полостных жидкостях организма: их можно найти в моче, в сперме, в сыворотке крови, в лимфе, в слюне, в слезах, в выделениях из носа, в желчи, в околоплодных водах и даже в грудном молоке. Производить экзосомы, как теперь известно, способна почти любая наша клетка — от желудочно-кишечного тракта и желез внутренней секреции до кожи и мозга.
| Экзосомы | Эктосомы | Апотельца | |
|---|---|---|---|
| Размер | 40–100 нм | 50–1000 нм | До 5000 нм |
| Механизм образования | Внутри клетки, почкованием в эндосому | Почкованием — выпячиванием плазматической мембраны клетки наружу | Распад клеток на части, каждая из которых окружена мембраной |
| Биомаркеры | Белки Alix, ESCRT, трансмембранные белки-тетраспанины CD63, CD81 и CD9 | Интегрины, селектины, маркеры родительских клеток, маркер внешней мембраны клетки — фосфатидилсерин | Геномная ДНК и цельные органеллы, фосфатидилсерин на внешней мембране |
| Содержание РНК | Главным образом микроРНК и мРНК; нет рРНК | Очень мало РНК | Главным образом рРНК |
Как следует из таблицы, РНК, имеющие регуляторные функции, содержатся в основном в экзосомах, что доказывает их первоочередное значение в координационной деятельности клеточного сообщества организма.
Способностью к секреции экзосом обладают все многоклеточные и даже некоторые одноклеточные организмы, организованные в сообщества. Очевидно, этот механизм коммуникации с целью взаиморегуляции столь важен, что не подвергся существенным изменениям в процессе эволюции [8].
Поэтому далее мы сосредоточимся на описании именно этих везикул.
Состав экзосом
За последние годы собрана обширная информация о компонентах внеклеточных пузырьков из различных типов клеток и жидкостей. Оказалось, что состав их белков, липидов, микроРНК и матричных РНК сильно зависит от происхождения пузырьков, а также от физиологического состояния породившей их клетки (здорова она или больна) [9]. Как правило, все экзосомы содержат аннексины, которые регулируют процессы слияния ее мембраны с мембраной клетки; ГТФазы Rab; молекулы адгезии и рецепторы, помогающие экзосоме «причалить» к клетке-мишени; а также белки ESCRT (эндосомный комплекс сортировки, предназначенный для внутриклеточной транспортировки белков и РНК — что-то вроде аналога портовой службы маркировки-сортировки). Главный маркер экзосом — трансмембранные белки CD63, CD81 и (иногда) CD9 из семейства тетраспанинов. Кроме того, экзосомы, как и клетки, несут на своей мембране белки главного комплекса гистосовместимости (МНС), которые отвечают за распознавание «своих» и «чужих» клеток и тканей; а также белки теплового шока, они же белки стресса (HSP60, HSP70, HSP90). Те и другие принимают участие в связывании антигенов и презентировании этих антигенов иммунной системе.
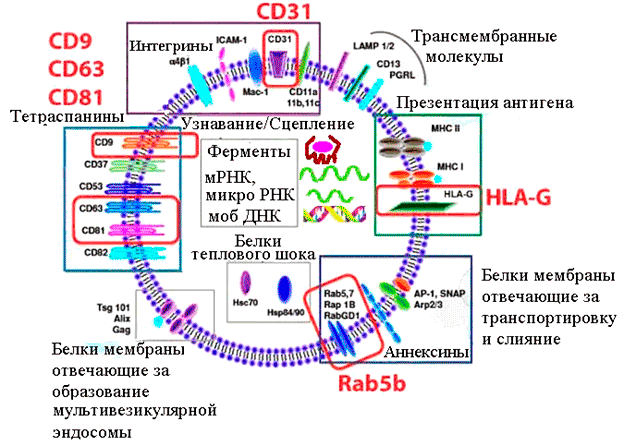
Рисунок 2. Состав и функции характерных компонентов экзосомы (в реальности экзосомы содержат порядка 4000 различных белков, более 1500 разных микроРНК и мРНК, а также фрагменты ДНК). Красными рамками выделены молекулы, используемые для аффинного выделения и идентификации; зеленой рамкой — белки гистосовместимости: MHC I и II — антигены I и II класса главного комплекса гистосовместимости; HLA-G — человеческий лейкоцитарный антиген G (отвечает за иммунотолерантность плаценты); фиолетовой рамкой — белки, отвечающие за узнавание и сцепление с принимающей клеткой; серыми рамками — внутреннее содержимое, переносимое экзосомой: ферменты и мышечные белки, белки теплового шока, матричные РНК, микро РНК и т.д.
Экзосомы как иммуномодуляторы
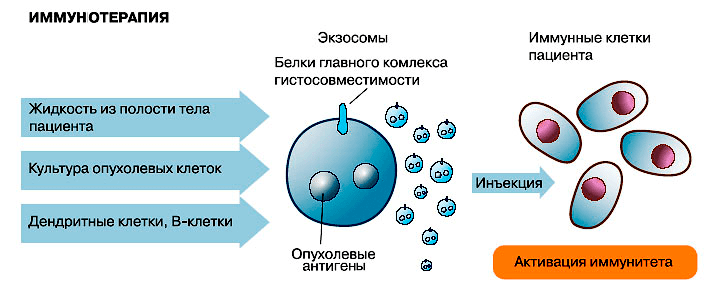
Способность мембранных пузырьков транспортировать информацию впервые была показана в исследованиях экзосом из В-лимфоцитов. Оказалось, что они несут на себе белки главного комплекса гистосовместимости — МНС класса II, связанные с антигенным пептидом (конструкция, необходимая для иммунного ответа). И несут они ее не куда-нибудь, а в специализированные Т-клетки. Аналогичным образом экзосомы переносят комплексы MHC класса I c пептидным антигеном из дендритных клеток в так называемые «наивные» Т-лимфоциты. Получив такое «письмо», Т-лимфоциты перестают быть наивными и готовы опознать антиген. Подобным же образом экзосомы распространяют антигены и их комплексы с MHC между дендритными клетками.
Дендритная клетка также может продуцировать экзосомы, содержащие иммунно-супрессорные молекулы. Это способствует развитию иммунной толерантности и противодействует воспалительным процессам [10].
Другой тип экзосом выделяется клетками плаценты в кровь матери. Они несут на себе фактор FasL, ингибирующий Т-клетки и NK-клетки (от англ. natural killers), чем предотвращают иммунную атаку матери против плода. Подобные экзосомы найдены также в молозиве и молоке кормящей матери.
Кстати, сами NK-клетки тоже выделяют экзосомы, образно названные «нанопулями против опухолей». Они содержат две «молекулы-убийцы»: перфорин, который проделывает дырки в плазматической мембране клетки-мишени, и тот же самый лиганд FasL, который взаимодействует с трансмембранным белком FasR — рецептором, запускающим апоптоз.
К сожалению, опухоли распространяются по организму и спасаются от иммунного наздора также с помощью экзосом. Появляется все больше доказательств того, что экзосомы из опухолей ингибируют иммунный ответ и содействуют ангиогенезу (образованию новых кровеносных сосудов), тем самым способствуя росту новообразования. Кроме того, опухолевые экзосомы могут провоцировать образование метастазов, активируя миграцию опухолевых клеток и подготавливая им на новом месте так называемую метастазную нишу — микроокружение, способствующее укоренению и росту.
Компания «Aethlon» разработала очистительную колонку «Hemopurifier», которая, по данным доклинических исследований in vitro, позволяет очистить кровь пациента от экзосом рака молочной железы, рака яичников, метастатической меланомы, колоректального рака и лимфомы. Предполагается, что удаление секретируемых раковыми клетками экзосом поможет улучшить результаты медикаментозного лечения [13], [14], поскольку именно они считаются причиной устойчивости опухолей к терапии [15], [16].
Перенос генетического материала
В 2007 году было обнаружено, что экзосомы, продуцируемые тучными клетками, содержат не только белки, но и РНК [17]. Это были как матричные РНК, содержащие информацию об аминокислотной последовательности белков, так и функционально активные малые РНК — некодирующие молекулы длиной около 22 нуклеотидов, которые принимают участие в регуляции экспрессии генов [18].
Функции молекул РНК многочисленны, и чем дальше, тем больше их открывают: «Обо всех РНК на свете, больших и малых» [19], «РНК у истоков жизни?» [20], «Большие дела небольших молекул: как малые РНК дирижируют генами бактерий» [21]. — Ред.
Молекулы РНК попадают в экзосомы не случайным образом. Об этом свидетельствует тот факт, что в экзосомы почти не попадает самая распространенная в клетке рибосомальная РНК. Кроме того, набор микроРНК и мРНК в экзосоме не вполне отражает содержание этих РНК в родительских клетках. Например, в клетках аденокарциномы крысы обнаружено более 8000 различных мРНК, а в экзосомах из этих клеток их не более 1500. РНК, курсирующие с помощью экзосом от одной клетки к другой, были названы челночными, или шаттл-РНК (от англ. exosomal shuttle RNA — esRNA).
Основным механизмом информационной деятельности экзосом до последнего времени считался перенос матричной РНК, которая кодирует необходимые клетке-реципиенту белки. Однако исследования последних лет показывают, что клетки общаются между собой, используя в качестве «языка» нетранслируемые последовательности как микроРНК [22], так и матричных (!) РНК. Переносчиком этих посланий и являются экзосомы.
По данным Батагова и Курочкина, экзосомы, секретируемые клетками человека, главным образом транспортируют фрагменты мРНК, которые обогащены 3′-нетранслируемыми участками [23]. На основании этого авторы выдвинули смелое предположение, что экзосомальные фрагменты мРНК могут выступать в качестве конкурирующих РНК, цель которых — регулировать стабильность, локализацию и активность трансляции мРНК в клетках-реципиентах, поскольку 3′-нетранслируемые участки богаты элементами, которые определяют место локализации мРНК [24] и богаты микроРНК-связывающими участками. Этим предположением они развивают гипотезу, по которой РНК-транскрипты могут «разговаривать» друг с другом с помощью микроРНК-опосредованного языка (путем конкуренции связывания за ограниченный пул микроРНК) по схеме: РНК → микроРНК → РНК [25].
Передача микроРНК — один из ключевых путей взаимодействия между стволовыми клетками и их микроокружением. Так, например, экзосомы, секретируемые эндотелиальными клетками, стимулировали миграцию и ангиогенез клеток-реципиентов, перенося микроРНК miR-214 [30]. Этим путем пользуются и раковые клетки. Как было отмечено выше, передача микроРНК miR21 и miR29a экзосомой из раковой клетки влияет на экспрессию генов в клетке-мишени, способствуя распространению метастазов.
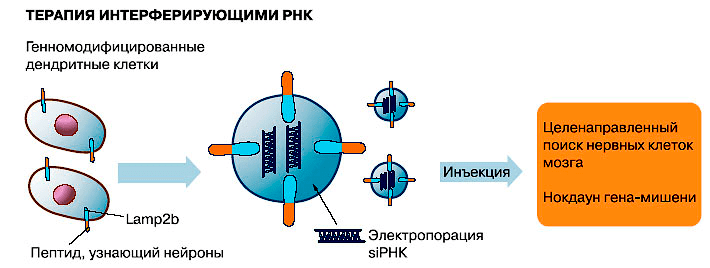
Естественно возникает вопрос: можно ли заблокировать пересылку микроРНК из больных клеток? Подсказкой может оказаться тот факт, что для образования экзосом требуются церамиды — липиды, которые входят в состав мембран и играют роль сигнальных молекул ; мы их уже упоминали в начале, когда рассказывали о секреции экзосом. Подавить секрецию экзосом и таким образом заблокировать пересылку микроРНК из больных клеток удалось в опытах in vitro, подавив ингибитором активность сфингомиелиназы — фермента, который продуцирует церамиды, расщепляя сфинголипиды мембран.
О многообразии ролей, которые играют липиды в образовании мембран и в сигнальных процессах, можно прочесть в статье «Липидный фундамент жизни» [31]. — Ред.
Помимо РНК экзосомы могут содержать еще и мобильную ДНК, — например, митохондриальную. Во внеклеточной жидкости, в том числе в плазме крови, присутствуют ферменты, разрушающие ДНК и РНК, поэтому носители генетической информации должны путешествовать от одной клетки к другой внутри мембранных микропузырьков защищающих их от этих ферментов. По сравнению с РНК клетки, РНК экзосом более стабильны и устойчивы к деградации при длительном хранении и повторных циклах замораживания и оттаивания. Полезное качество для потенциальных диагностических и лечебных препаратов!
Регенерация
Экзосомы, по всей видимости, играют важную роль в восстановлении поврежденных органов. Все больше данных свидетельствует о том, что внеклеточные везикулы, секретируемые из гемопоэтических стволовых клеток, мультипотентных клеток стромы или сердечных стволовых клеток, обладают уникальными свойствами. Они защищают клетки, оставшиеся в поврежденных тканях, от апоптоза, стимулируют деление выживших клеток и рост сосудов.
За счет чего это происходит? Во-первых, мембраны этих везикул обогащены биологически активными липидами, такими, как близкий родственник церамидов сфингозин-1-фосфат. Во-вторых, на их поверхности синтезируются антиапоптозные и стимуляторные ростовые факторы и цитокины. В-третьих, они целенаправленно доставляют в поврежденные ткани мРНК, регуляторные микроРНК и ферменты, и вся эта «гуманитарная помощь» повышает способность клеток к регенерации.
Например, мезенхимальные стволовые клетки посылают с помощью экзосом в поврежденные клетки канальцев почек матричную РНК рецептора инсулиноподобного ростового фактора-1. В клетках начинается синтез этого рецептора, и регенерация идет активнее. Аналогичным образом транспортировка экзосомами мРНК TGF-β1 при повреждении дает начало активации процессов регенерации и восстановлению тканей [32].
Подобные механизмы перепрограммирования поврежденных клеток стволовыми могут быть задействованы и при инфаркте миокарда. В экспериментах на животных даже однократное введение экзосом мезенхимальных стволовых клеток уменьшает размер инфаркта и улучшает состояние подопытных. Очевидно, экзосомы восполняют дефицит ферментов, важных для снабжения клетки энергией, а значит, и для скорейшей реабилитации сердечной мышцы [33], [34].
Развитие организмов и старение
Недавно было обнаружено, что длительность жизни нейронов мозга зависит от среды, в которой они находятся. Если пересадить нейроны мыши в мозг крыс, живущих намного дольше мышей, продолжительность жизни этих нервных клеток может более чем вдвое превысить средний срок, отмеренный природой мышам. Исследования методом гетерохронного парабиоза, при котором кровеносные системы двух животных разного возраста объединяют хирургическим путем, показали, что при этой операции старое животное молодеет, а молодое, наоборот, стареет. Очевидно, возрастное снижение активности клеток может быть результатом воздействия циркулирующих в крови факторов, состав которых меняется с возрастом. Очистка крови с помощью сепаратора показала, что действующее начало сосредоточено в зоне частиц, совпадающих по размерам с экзосомами.
В недавно опубликованном обзоре Ден Сюй из Китая и Хидетоши Тахара из Японии [35] обосновали гипотезу о том, что важнейшую роль в координации процессов клеточного старения выполняют экзосомы, а точнее, переносимые ими микроРНК. Некоторые из них могут способствовать старению, запуская сигнальные пути, ведущие к одряхлению организма, другие защищают от этих процессов. Экзосомы из состарившихся клеток с помощью своей микроРНК так изменяют микроокружение, что оно начинает благоприятствовать возрастным заболеваниям, понижению иммунитета, воспалению и нарушению функций различных органов.
В связи с вышеизложенным интересно отметить, что, как правило, биологическая и терапевтическая активность, а также способность к секреции экзосом мезенхимальных стволовых клеток обратно коррелируют со стадией развития донора [36].
Диагностика
Исследования экзосом имеют огромную практическую значимость. Например, они могут сказать многое о состоянии организма. Из экзосом, содержащихся в плазме крови, моче и других биожидкостях, можно получить микроРНК для диагностики. Как уже говорилось, липидная оболочка защищает РНК от агрессивных ферментов, поэтому возможность их деградации при транспортировке и хранении образцов невелика. Результаты такого анализа помогут не только поставить диагноз, но и определить стадию заболевания, выяснить, прогрессирует ли оно или вошло в стадию ремиссии, проверить эффективность лечения.
Экзосомы содержат белки, микроРНК и матричную РНК той клетки, из которой они произошли. Это позволяет использовать их для фенотипирования и идентификации клеток. Они многое могут рассказать и о состоянии клетки:
- повышенный уровень микроРНК-155 говорит о присутствии провоспалительных макрофагов и атеросклеротических поражений;
- микроРНК семейства Let-7 в экзосомах может свидетельствовать об активном размножении клеток, а значит, — о растущей опухоли;
- появление в плазме крови типичной для сердечной мышцы микроРНК-208а и изменение уровня некоторых других микроРНК могут быть использованы для ранней диагностики повреждения миокарда;
- характерный состав микроРНК имеют также экзосомы из нейронов, зараженных прионами [37] — инфекционными белками, вызывающими тяжелые заболевания центральной нервной системы, такие, как куру или «коровье бешенство».
И подобных примеров, демонстрирующих возможности диагностики по экзосомам, с каждым днем становится все больше. Еще один плюс диагностики по экзосомам — вместо весьма болезненной и порой небезопасной хирургической биопсии тканей можно исследовать жидкости организма и получить ту же информацию. Это особенно важно при диагностике рака головного мозга, например глиомы, когда проведение множества биопсий может быть опасным для жизни пациента.
От клеточной терапии к терапии экзосомами
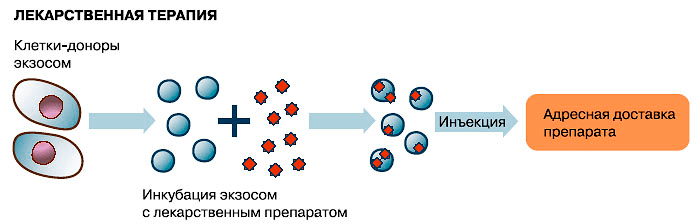
Исследованиями последних лет показано, что экзосомы могут использоваться не только для диагностики, но и для лечения. Далеко не полный список возможного терапевтического применения уже включает иммунотерапию, изготовление вакцин, модуляторы ангиогенеза, целевую доставку в ткани-мишени различных лекарственных препаратов (в том числе «скоропортящихся» — ферментов и препаратов на основе РНК: микроРНК, матричных РНК, малых интерферирующих РНК [40]).
Действительно, экзосомы по многим параметрам являются идеальным средством доставки лекарств [41], [42]. Они способны нести достаточно большие порции лекарственных препаратов, и при этом благодаря липидной оболочке предохраняют свое содержимое от разбавления и разрушения (что особенно важно, если лекарством является фермент или нуклеиновая кислота), а также могут переносить свое содержимое через плазматическую мембрану клетки. Кроме того, эти мембранные пузырьки не токсичны, так как самой природой предназначенны для межклеточного обмена, и хорошо переносятся организмом, о чем свидетельствует их присутствие в биологических жидкостях. Благодаря рецепторам на их поверхности они избирательно находят клетки-мишени, тем самым повышая эффективность переноса лекарственных препаратов, белков и РНК и снижая вероятность побочных эффектов [43]. Например, если препарат экзосом, заключающих в себе противовоспалительное лекарство, просто закапать в нос, лекарство будет доставлено в конкретные клетки мозга, то есть сможет пересечь гематоэнцефалический барьер. Важно отметить, что при необходимости можно изменить состав рецепторов на поверхности экзосомы и направить ее «по новому адресу».
Примеры терапии с помощью экзосом
Экзосомы можно применять для иммунной и лекарственной терапии, а также для терапии с помощью РНК-интерференции (рисунки 3–5). Но это еще не все: на очереди их применение взамен клеточной терапии!
Человеческие мезенхимальные стволовые клетки обладают способностью вызывать иммуносупрессию и активировать процессы регенерации. Поэтому они интенсивно исследуются на предмет их применения для лечения сердца, почек, нервной ткани, суставов и регенерации костей, а также терапии воспалительных заболеваний и подавления реакции отторжения при трансплантации. Клинические исследования на животных показали, что терапевтическая эффективность мезенхимальных стволовых клеток опосредована не их дифференцировкой и включением в ткань-мишень, а секретируемыми ими трофическими факторами терапевтического воздействия, одним из которых являются экзосомы. Исходя из того, что в основе терапевтической эффективности мезенхимальных стволовых клеток может лежать терапевтическое воздействие продуцируемых ими экзосом [25], которые, в отличие от клеток, легко переносят замораживание и оттаивание, было предложено перейти от клеточной терапии на терапию экзосомами. Для массового производства экзосом предполагается использовать культуры человеческих мезенхимальных стволовых клеток, обладающих способностью к пролиферации. Уже удалось создать постоянную «промышленную» линию таких клеток, которая с течением времени не теряет способности к делению, полностью сохраняя и способность секретировать экзосомы [44]. Важно отметить, что, в отличие от клеток, экзосомы не могут сами размножаться и поэтому не могут выйти из-под контроля и начать образовывать опухоли, а значит терапия экзосомами более безопасна, чем клеточная терапия. Перспективное терапевтическое средство представляют собой и экзосомы из культур NK-клеток — как нетрудно догадаться, потенциальное оружие против опухолей.
Конечно, есть и нерешенные проблемы. Коль скоро экзосомы несут на себе белки главного комплекса гистосовместимости, аллогенные (то есть взятые от другого человека) экзосомы теоретически могут вызывать у пациента иммунный ответ, несмотря на иммуносупрессивную активность (хотя по некоторым данным даже межвидовые переносы экзосом из мезенхимальных стволовых клеток, например от мыши крысе, не сопровождаются иммунной реакцией). Ключ к решению — вероятно, тщательный подбор донорских клеток для производства экзосом, а также получение культур аутологичных (собственных) мезенхимальных стволовых клеток пациента из индуцированных стволовых клеток.
Кроме того необходимо достичь некоторой стандартизации методологических подходов (особенно методов выделения микровезикул) чтобы можно было сравнивать результаты, полученные разными исследовательскими лабораториями [45].
В заключение следует отметить, что изучение экзосом и других секретируемых микровезикул является быстро развивающейся новой областью как фундаментальных, так и клинических исследований, цель которых — получить более полное представление о роли экзосом и их функциях в физиологических и патологических условиях. Вышеизложенное свидетельство того, что эта область исследований обещает беспрецедентные возможности для открытия механизмов межклеточного взаимодействия и разработки новых способов диагностики и лечения.
В первоначальной форме статья была опубликована в «Химии и жизни» [46].
Литература
- Sandra Bloemendal, Ulrich Kück. (2013). Cell-to-cell communication in plants, animals, and fungi: a comparative review. Naturwissenschaften. 100, 3-19;
- B. T. Pan. (1985). Electron microscopic evidence for externalization of the transferrin receptor in vesicular form in sheep reticulocytes. The Journal of Cell Biology. 101, 942-948;
- Chiara Corrado, Stefania Raimondo, Antonio Chiesi, Francesco Ciccia, Giacomo De Leo, Riccardo Alessandro. (2013). Exosomes as Intercellular Signaling Organelles Involved in Health and Disease: Basic Science and Clinical Applications. IJMS. 14, 5338-5366;
- Pranav Sharma, Lucio Schiapparelli, Hollis T Cline. (2013). Exosomes function in cell–cell communication during brain circuit development. Current Opinion in Neurobiology. 23, 997-1004;
- Нобелевская премия по физиологии и медицине (2013): везикулярный транспорт;
- Katrin J. Svensson, Helena C. Christianson, Anders Wittrup, Erika Bourseau-Guilmain, Eva Lindqvist, et. al.. (2013). Exosome Uptake Depends on ERK1/2-Heat Shock Protein 27 Signaling and Lipid Raft-mediated Endocytosis Negatively Regulated by Caveolin-1. J. Biol. Chem.. 288, 17713-17724;
- H. C. Christianson, K. J. Svensson, T. H. van Kuppevelt, J.-P. Li, M. Belting. (2013). Cancer cell exosomes depend on cell-surface heparan sulfate proteoglycans for their internalization and functional activity. Proceedings of the National Academy of Sciences. 110, 17380-17385;
- María A Lopez-Verrilli, Felipe A Court. (2013). Exosomes: mediators of communication in eukaryotes. Biol. Res.. 46, 5-11;
- Dong-Sic Choi, Dae-Kyum Kim, Yoon-Keun Kim, Yong Song Gho. (2013). Proteomics, transcriptomics and lipidomics of exosomes and ectosomes. Proteomics. 13, 1554-1571;
- Weifan Yin, Song Ouyang, Yi Li, Bo Xiao, Huan Yang. (2013). Immature Dendritic Cell-Derived Exosomes: a Promise Subcellular Vaccine for Autoimmunity. Inflammation. 36, 232-240;
- Толл-подобные рецепторы: от революционной идеи Чарльза Джейнуэя до Нобелевской премии 2011 года;
- M. Fabbri, A. Paone, F. Calore, R. Galli, E. Gaudio, et. al.. (2012). MicroRNAs bind to Toll-like receptors to induce prometastatic inflammatory response. Proceedings of the National Academy of Sciences. 109, E2110-E2116;
- Extracorporeal removal of microvesicular particles. Патент WO 2007103572 A2;
- Filter for the removal of micro-vesicles from biological fluids, methods and devices using such a filter. Патент EP 2495025 A1;
- A. Raz, R. Goldman, I. Yuli, M. Inbar. (1978). Isolation of plasma membrane fragments and vesicles from ascites fluid of lymphoma-bearing mice and their possible role in the escape mechanism of tumors from host immune rejection. Cancer Immunol Immunother. 4;
- F. Pucci, M. J. Pittet. (2013). Molecular Pathways: Tumor-Derived Microvesicles and Their Interactions with Immune Cells In Vivo. Clinical Cancer Research;
- Hadi Valadi, Karin Ekström, Apostolos Bossios, Margareta Sjöstrand, James J Lee, Jan O Lötvall. (2007). Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nat Cell Biol. 9, 654-659;
- Epaminondas Doxakis. (2013). Principles of miRNA-Target Regulation in Metazoan Models. IJMS. 14, 16280-16302;
- Обо всех РНК на свете, больших и малых;
- РНК у истоков жизни?;
- Большие дела небольших молекул: как малые РНК дирижируют генами бактерий;
- Huili Guo, Nicholas T. Ingolia, Jonathan S. Weissman, David P. Bartel. (2010). Mammalian microRNAs predominantly act to decrease target mRNA levels. Nature. 466, 835-840;
- Arsen O Batagov, Igor V Kurochkin. (2013). Exosomes secreted by human cells transport largely mRNA fragments that are enriched in the 3′-untranslated regions. Biol Direct. 8;
- Catia Andreassi, Antonella Riccio. (2009). To localize or not to localize: mRNA fate is in 3′UTR ends. Trends in Cell Biology. 19, 465-474;
- Leonardo Salmena, Laura Poliseno, Yvonne Tay, Lev Kats, Pier Paolo Pandolfi. (2011). A ceRNA Hypothesis: The Rosetta Stone of a Hidden RNA Language?. Cell. 146, 353-358;
- Tim R. Mercer, Dagmar Wilhelm, Marcel E. Dinger, Giulia Soldà, Darren J. Korbie, et. al.. (2011). Expression of distinct RNAs from 3′ untranslated regions. Nucleic Acids Research. 39, 2393-2403;
- Feng Wang, Zhiwen Xu, Jie Zhou, Wing-Sze Lo, Ching-Fun Lau, et. al.. (2013). Regulated Capture by Exosomes of mRNAs for Cytoplasmic tRNA Synthetases. J. Biol. Chem.. 288, 29223-29228;
- Min Guo, Paul Schimmel. (2013). Essential nontranslational functions of tRNA synthetases. Nat Chem Biol. 9, 145-153;
- Tian Sheng Chen, Sai Kiang Lim. (2013). Measurement of Precursor miRNA in Exosomes from Human ESC-Derived Mesenchymal Stem Cells. Methods in Molecular Biology. 69-86;
- B. W. M. van Balkom, O. G. de Jong, M. Smits, J. Brummelman, K. den Ouden, et. al.. (2013). Endothelial cells require miR-214 to secrete exosomes that suppress senescence and induce angiogenesis in human and mouse endothelial cells. Blood. 121, 3997-4006;
- Липидный фундамент жизни;
- Fernanda T. Borges, Sonia A. Melo, Berna C. Özdemir, Noritoshi Kato, Ignacio Revuelta, et. al.. (2013). TGF-β1–Containing Exosomes from Injured Epithelial Cells Activate Fibroblasts to Initiate Tissue Regenerative Responses and Fibrosis. JASN. 24, 385-392;
- Fatih Arslan, Ruenn Chai Lai, Mirjam B. Smeets, Lars Akeroyd, Andre Choo, et. al.. (2013). Mesenchymal stem cell-derived exosomes increase ATP levels, decrease oxidative stress and activate PI3K/Akt pathway to enhance myocardial viability and prevent adverse remodeling after myocardial ischemia/reperfusion injury. Stem Cell Research. 10, 301-312;
- Ruenn Chai Lai, Ronne Wee Yeh Yeo, Kok Hian Tan, Sai Kiang Lim. (2013). Mesenchymal stem cell exosome ameliorates reperfusion injury through proteomic complementation. Regenerative Medicine. 8, 197-209;
- Dan Xu, Hidetoshi Tahara. (2013). The role of exosomes and microRNAs in senescence and aging. Advanced Drug Delivery Reviews. 65, 368-375;
- Ronne Wee Yeh Yeo. (2013). Efficiency of Exosome Production Correlates Inversely with the Developmental Maturity of MSC Donor. J Stem Cell Res Ther. 3;
- Прионы: исследования таинственных молекул продолжаются;
- Huilin Shao, Jaehoon Chung, Leonora Balaj, Alain Charest, Darell D Bigner, et. al.. (2012). Protein typing of circulating microvesicles allows real-time monitoring of glioblastoma therapy. Nat Med. 18, 1835-1840;
- Emily Zeringer. (2013). Methods for the extraction and RNA profiling of exosomes. WJM. 3, 11;
- Samira Lakhal, Samir El Andaloussi, Aisling J. O’Loughlin, Jinghuan Li, Matthew M. J. Wood. (2013). RNAi Therapeutic Delivery by Exosomes. Advances in Delivery Science and Technology. 185-205;
- Доставка лекарственных препаратов на основе рецептор-опосредованного эндоцитоза;
- Наномедицина будущего: трансдермальная доставка с использованием наночастиц;
- Zacharias E, Milton G., Fatemeh Momen-Heravi, Jie Hu, Xin Zhang, et. al.. (2013). Therapeutic uses of exosomes. Exosomes microvesicles. 1;
- Ronne Wee Yeh Yeo, Ruenn Chai Lai, Bin Zhang, Soon Sim Tan, Yijun Yin, et. al.. (2013). Mesenchymal stem cell: An efficient mass producer of exosomes for drug delivery. Advanced Drug Delivery Reviews. 65, 336-341;
- Kenneth W. Witwer, Edit I. Buzás, Lynne T. Bemis, Adriana Bora, Cecilia Lässer, et. al.. (2013). Standardization of sample collection, isolation and analysis methods in extracellular vesicle research. Journal of Extracellular Vesicles. 2, 20360;
- Джагаров Д.Э. (2013). Экзосомы — бутылочная почта организма. «Химия и жизнь». 6;
- Гусаченко О.Н., Зенкова М.А., Власов В.В. (2013) Нуклеиновые кислоты экзосом: маркеры заболеваний и молекулы межклеточной коммуникации. «Биохимия». 78, 5–13;
- David A. Shifrin, Michelle Demory Beckler, Robert J. Coffey, Matthew J. Tyska. (2013). Extracellular vesicles: communication, coercion, and conditioning. MBoC. 24, 1253-1259;
- Michelle Marcus, Joshua Leonard. (2013). FedExosomes: Engineering Therapeutic Biological Nanoparticles that Truly Deliver. Pharmaceuticals. 6, 659-680;
- María A Lopez-Verrilli, Felipe A Court. (2013). Exosomes: mediators of communication in eukaryotes. Biol. Res.. 46, 5-11.