Как происходит выделение нейромедиатора
19 ноября 2015
Как происходит выделение нейромедиатора
- 27997
- 5
- 54
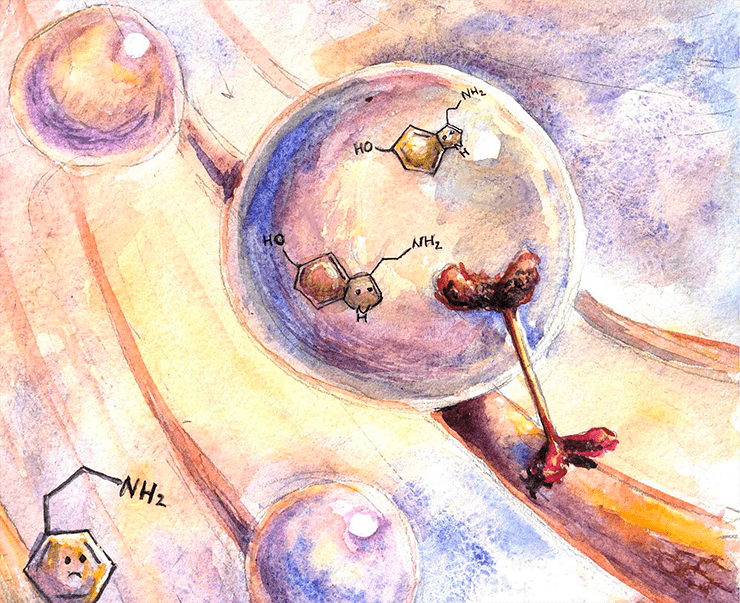
Серотонин в мембранном пузырьке путешествует по аксону.
-
Автор
-
Редакторы
Комикс на конкурс «био/мол/текст»: Что происходит с момента синтеза нейромедиатора до связывания его с рецепторами на постсинаптической мембране? Комикс по мотивам Нобелевской лекции Томаса Зюдофа: молекулярный механизм выделения нейромедиатора в картинках. Конечно, это лишь малый фрагмент полной картины распространения импульсов в нервной системе, но зато посмотрите, как он красив!
Конкурс «био/мол/текст»-2015
 Эта работа заслужила приз зрительских симпатий конкурса «био/мол/текст»-2015.
Эта работа заслужила приз зрительских симпатий конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: лаборатория биотехнологических исследований 3D Bioprinting Solutions и студия научной графики, анимации и моделирования Visual Science.
Синапсы — области контакта между нейронами — бывают химическими и электрическими. Химический синапс представляет собой непрямой контакт двух клеток: между их мембранами остается узкое пространство — синаптическая щель. Эффекторная клетка (та, от которой идет импульс), возбуждаясь, выделяет в синаптическую щель молекулы нейромедиатора , которые связываются с рецепторами на мембране воспринимающей клетки и вызывают ее ответ.
Любознательный читатель приглашается к ознакомлению с эпической сагой о нейромедиаторах, написанной для «биомолекулы» Виктором Лебедевым. В сериал входят: дофамин, серотонин, норадреналин, ацетилхолин, γ-аминомасляная кислота и глутаминовая кислота [1–6]. Не счесть алмазов пламенных в лабазах каменных. — Ред.
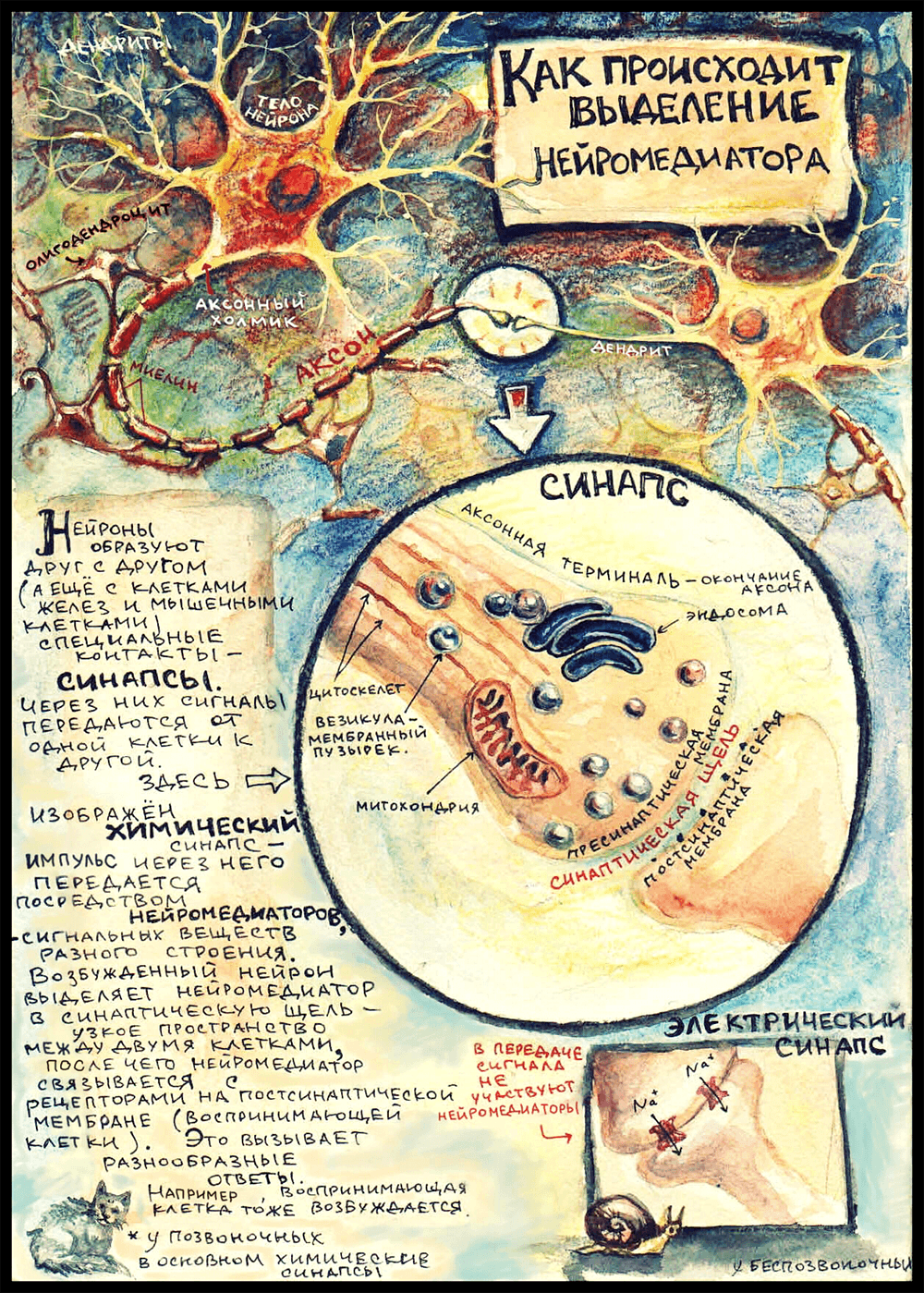
На картинке изображен самый распространенный вид синапса — аксо-дендритический. (А бывают еще аксо-соматические синапсы, когда аксон подходит к телу воспринимающей клетки, аксо-аксональные, и даже дендро-дендритические — их образуют таинственные безаксонные нейроны где-то в глубине обонятельной луковицы, но это совсем редкий и маргинальный случай.) Еще на картинке виднеются олигодендроциты — глиальные клетки, которые в центральной нервной системе обматывают аксоны слоями миелина — изолирующей липидной мембраны, что препятствует рассеиванию импульса и ускоряет его проведение. (Олигодендроциты подрисованы просто для приличия; предполагается, что вся рассказанная ниже история происходит где-то в мозге: выбранный мной нейромедиатор выделяется в центральной нервной системе.) Начало аксона — место, где он отходит от тела клетки — называется «аксонный холмик». Именно там возникает потенциал действия, который потом распространяется дальше по аксону в сторону воспринимающей клетки.
Аксон ближе к концу может разделяться на несколько веточек, идущих к разным клеткам. Каждая такая веточка оканчивается аксонной терминалью — зарубежные ученые ласково называют эту структуру «пуговкой» (button) или «бутончиком» (bouton). В аксонной терминали есть митохондрии, чтобы обеспечивать энергией многочисленные происходящие здесь процессы; почти всегда обнаруживается довольно много везикул — мембранных пузырьков, в которых транспортируются медиаторы и разные другие вещества — например, ферменты. Так же там есть довольно правильным образом организованный цитоскелет: микротрубочки цитоскелета образуют «рельсы», которые протягиваются в цитоплазме аксона от тела нейрона до самого окончания. Везикулы перемещаются по этим самым «рельсам». Еще в аксонной терминали есть эндосома — мембранная структура, похожая на аппарат Гольджи [7]. Надо сказать, что научное сообщество не пришло к единому мнению, постоянное это образование или временное, которое получается в результате слияния пузырьков; но, так или иначе, от эндосомы могут отпочковываться везикулы, которые используются для транспорта нейромедиаторов.
В электрических синапсах не задействованы нейромедиаторы, а синаптическая щель очень узкая. Цитоплазма двух клеток связана напрямую через специальные белковые каналы — коннексоны. Сигнал в таком синапсе передается путем перехода ионов из одной клетки в другую. Такие синапсы почти не встречаются в нашей нервной системе; они характерны главным образом для беспозвоночных.
Дальше речь пойдет о событиях, происходящих в химическом синапсе, а именно о том, как выделяется медиатор в синаптическую щель.
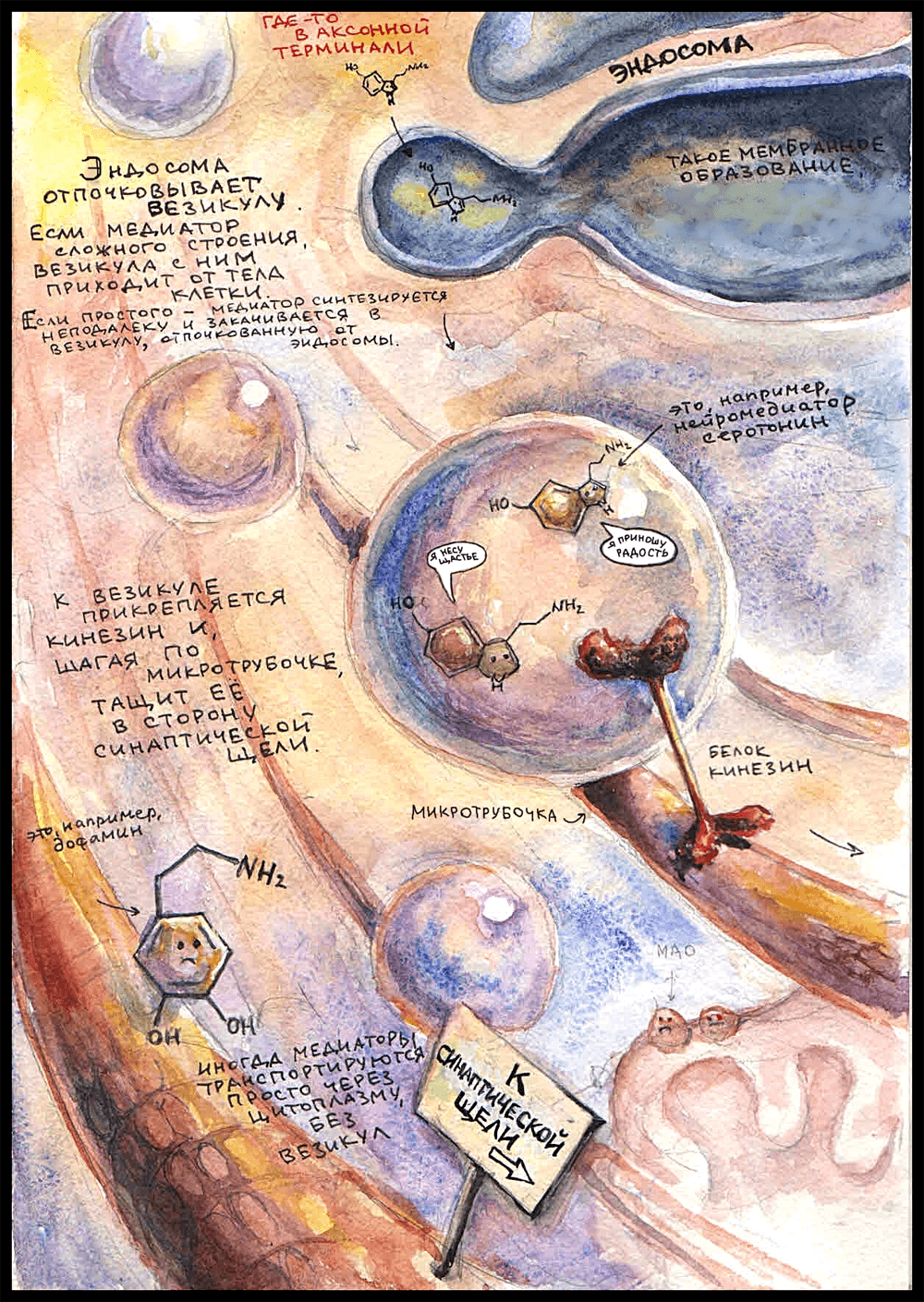
Маленькие и просто устроенные нейромедиаторы — например, ацетилхолин [4] — образуются из молекул-предшественников прямо в цитоплазме аксонной терминали. Там же они упаковываются в везикулы — мембранные пузырьки, которые могут отделяться от эндосомы или приходить от синаптической щели после высвобождения своего прошлого содержимого.
Медиаторы сложного строения — такие как пептиды — синтезируются в теле нейрона и, уже будучи упакованными в везикулы, транспортируются оттуда до аксонной терминали по микротрубочкам. Здесь в качестве медиатора, вместе с которым читателю предлагается пройти путь до синаптической щели, выбран серотонин [2]. Правда, хороший? Он — маленькая молекула, а значит, синтезируется в цитоплазме недалеко от окончания. Вот он попадает в везикулу, отпочкованную от эндосомы, и к мембране везикулы прикрепляется транспортный белок кинезин, который начинает тащить пузырек за собой, «шагая» по микротрубочке в сторону пресинаптической мембраны. (У кинезина есть две субъединицы — «ножки», которые по очереди прикрепляются и открепляются от микротрубочки, с каждым разом немного дальше, продвигая его вперед.) В одной везикуле могут быть тысячи молекул нейромедиатора. Раньше считалось, что один нейрон может выделять только один нейромедиатор (принцип Дейла [8]), но сейчас известно, что это не так. Более того, оказалось, что в везикуле одновременно могут находиться разные нейромедиаторы.
Не вся пресинаптическая мембрана подходит для того, чтобы медиатор выделился, а только области, которые называются «активными зонами». Только там есть специальные белки, нужные для прикрепления везикулы, а также локализованы потенциал-зависимые кальциевые каналы. Активные зоны располагаются ровно напротив рецепторных полей на постсинаптической мембране. Вот туда, к одной из активных зон, и держит путь кинезин.
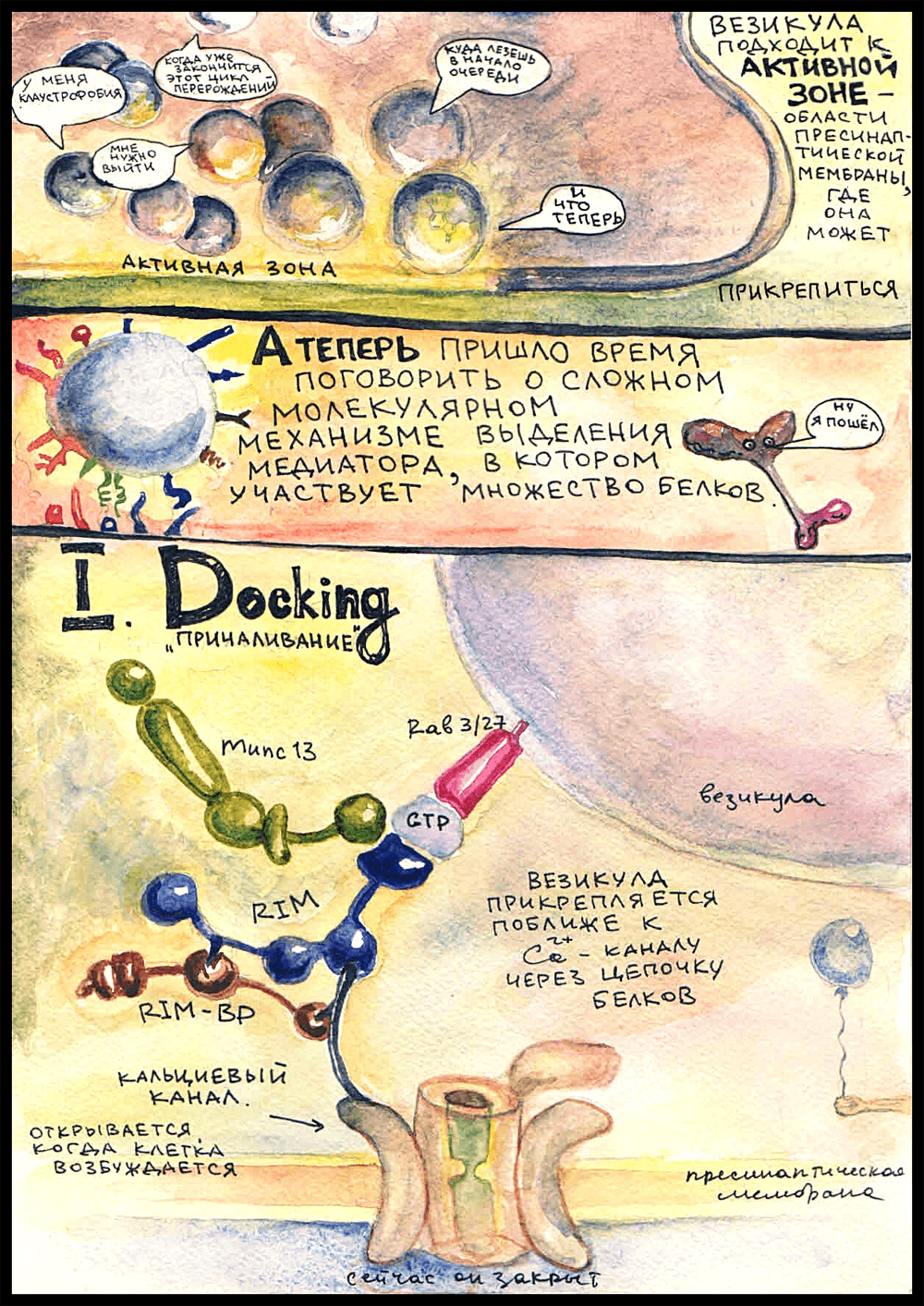
Над активными зонами обычно собирается множество пузырьков, которые ждут своей очереди слиться с пресинаптической мембраной и освободиться от содержимого. У наших героев чудом получается проникнуть к самой активной зоне, и — ...
И дальше начинается вот что.
Докинг
Первый этап прикрепления везикулы к пресинаптической мембране называется «docking», или «tethering» — «заякоривание». В мембране везикулы есть такой белок — Rab 3/27, принадлежащий к семейству Rab-ГТФаз, которые занимаются адресованием везикул в мембраны-реципиенты. (Rab — от «rat brain». В первый раз такие белки были найдены в мозгу крысы.) Rab 3/27 заякорен в липидном бислое мембраны; он включается туда на стадии образования везикулы. Будучи связанным с ГДФ, он неактивен и не может ничего присоединять, а при замене ГДФ на ГТФ активируется и становится способным к формированию связей. Когда везикула образуется, Rab 3/27 прикрепляется к ней уже в активированной форме.
Когда везикула оказывается в достаточной близости от активной зоны, Rab 3/27 связывается с белками RIM (Rab 3-interacting molecules), которые, в свою очередь, через RIM-BP (RIM-binding proteins) прикрепляются к кальциевым каналам в пресинаптической мембране. Это очень важный момент, потому что ключевым сигналом для выделения нейромедиатора служит поступление ионов кальция в цитоплазму. Кальциевые каналы открываются, когда потенциал действия доходит до аксонной терминали.
И вот, чтобы везикула могла как можно более оперативно выбросить медиатор, когда придет ПД, она прикрепляется к кальциевому каналу такой белковой «веревочкой». Формирование этой «веревочки» и называется докингом. Везикула «причаливает» к пресинаптической мембране, бросая «якорь» около кальциевого канала.
К белковой цепочке из RIM присоединяется еще белок Munc-13 — запомните его, он сыграет свою роль на следующей стадии.
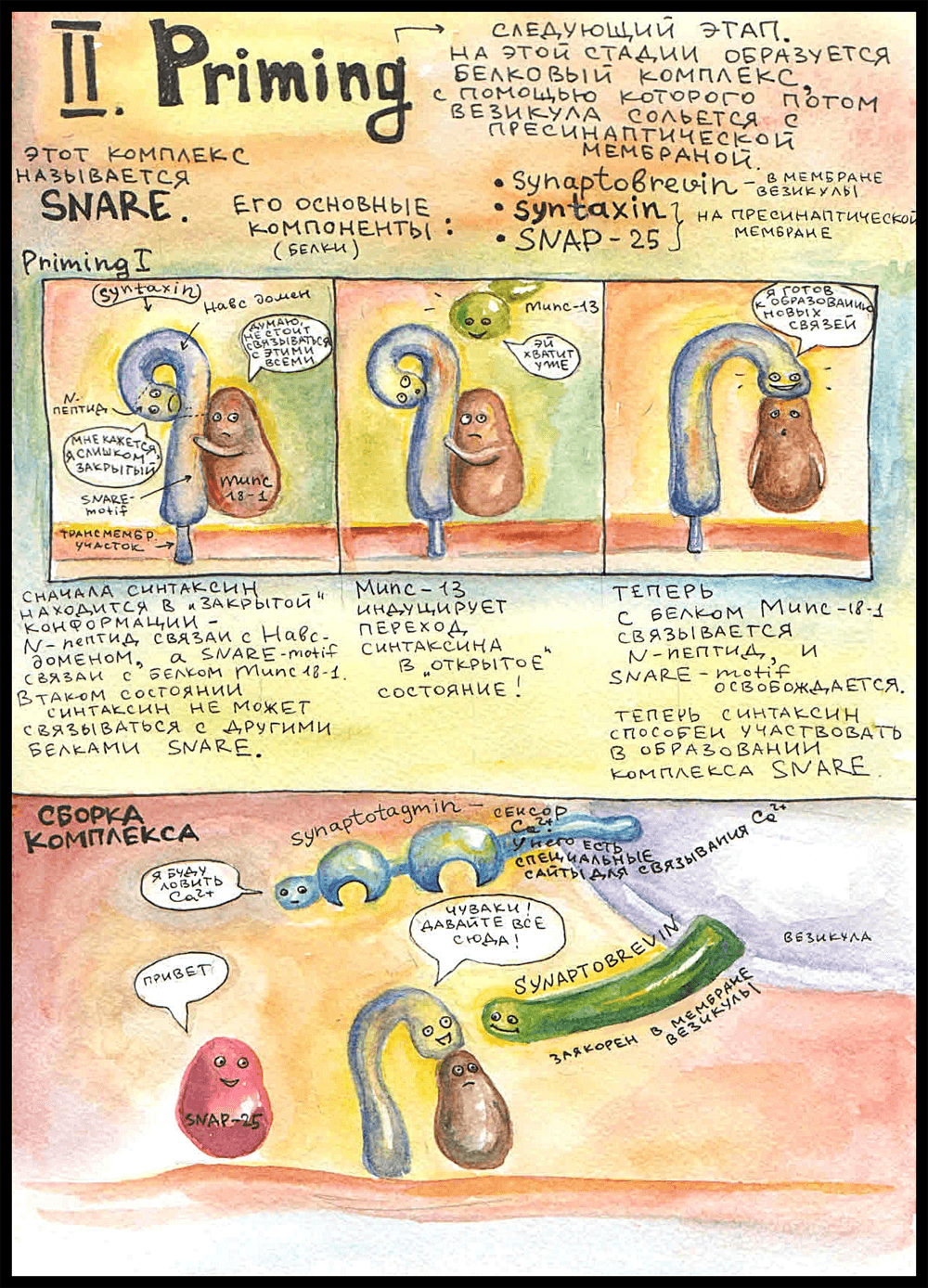
Прайминг
Следующий этап — это прайминг (priming; подготовка везикулы к слиянию). Подготовка заключается в образовании плотного белкового комплекса между мембраной везикулы и пресинаптической мембраной, в результате чего мембранный пузырек крепко прижимается к мембране аксона и становится способным реагировать на увеличение концентрации кальция.
Этот комплекс получил название SNARE — soluble NSF attachment receptor proteins, по названию АТФазы NSF, с которой он может реагировать. Как именно он реагирует и что при этом происходит — парой картинок ниже. Основные три компонента SNARE — синаптобревин, синтаксин и SNAP-25.
Синтаксин заякорен в пресинаптической мембране. В неактивном состоянии его концевой N-пептид связан с другим участком этой же молекулы — H-abc доменом, то есть неактивный синтаксин как бы замкнут сам на себя. Еще он на протяжении всей истории остается связанным с белком Munc 18-1. Сначала думали, что Munc 18-1 препятствует сборке комплекса, а потом оказалось, что он необходим для открытия поры в везикуле.
В неактивном состоянии синтаксин связан с Munc 18-1 через SNARE-мотив — участок, которым он потом связывается с белками SNARE. Поэтому это состояние и неактивное — синтаксин не может войти в состав комплекса, потому что нужный для этого участок занят.
Прайминг 1
Munc-13 — тот самый, который висел в белковой цепочке, — инициирует переход синтаксина в активное состояние: синтаксин отделяет N-пептид от самого себя и связывается им с Munc 18-1, а SNARE-мотив при этом освобождается. После этого он становится способным к образованию комплекса SNARE, что и происходит дальше: он плотно связывается с синаптобревином, который торчит из мембраны везикулы, и с белком SNAP-25. Munc 18-1 тоже входит в состав комплекса, будучи связанным с синтаксином, поэтому целый комплекс называется SNARE/SM.
Белок, который не входит в состав комплекса, но играет ключевую роль в процессе выделения — это синаптотагмин. Он заякорен в мембране везикулы неподалеку от синаптобревина. Синаптотагмин выполняет роль кальциевого сенсора: у него есть специальные сайты связывания Ca2+, то есть именно синаптотагмин делает возможным выделение нейромедиатора, когда приходит потенциал действия.
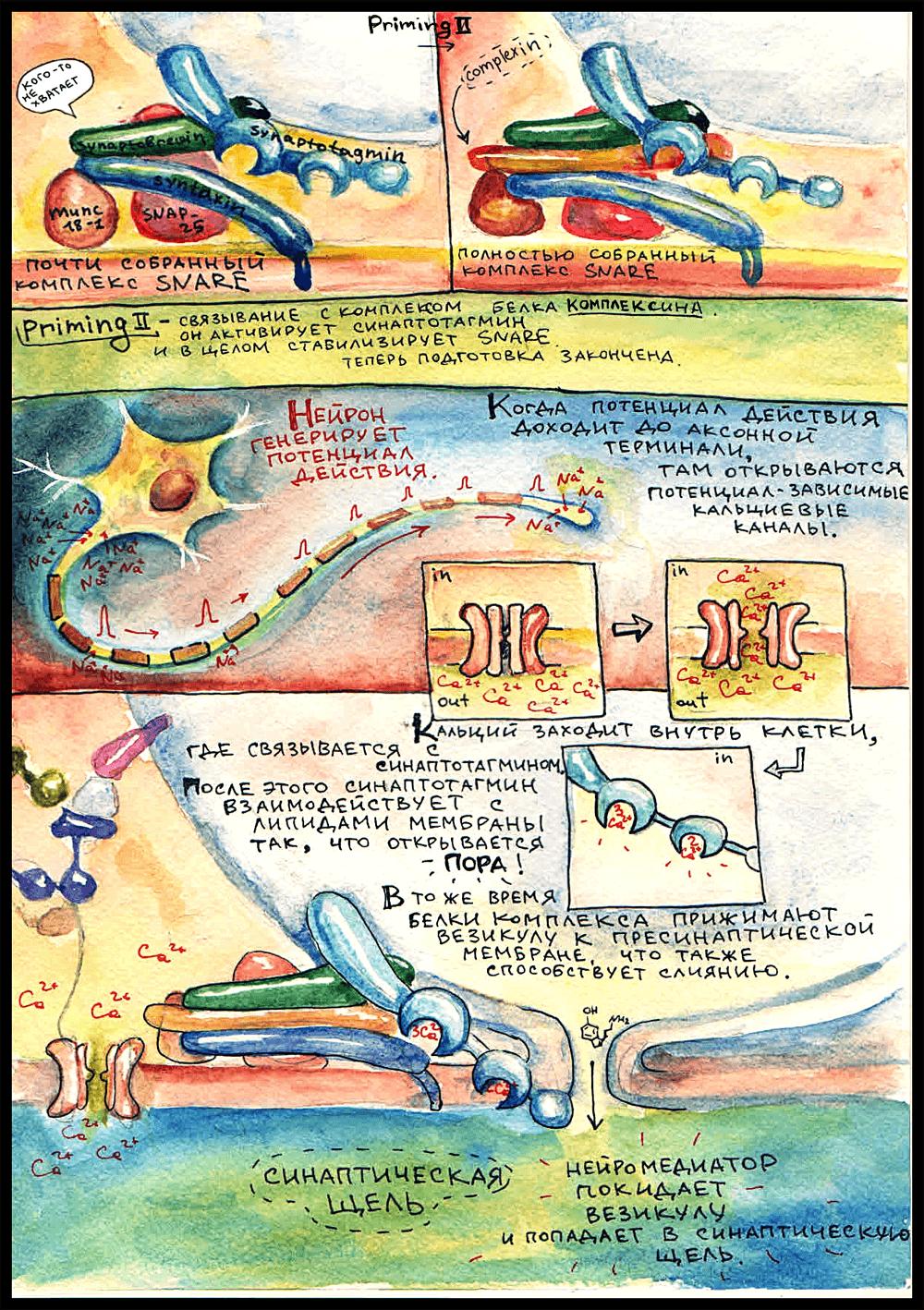
Прайминг 2
Для того, чтобы окончательно собрать комплекс, нужен еще белок комплексин. Он присоединяется в желобок между синаптобревином и синтаксином, а функция его заключается в активации синаптотагмина. Когда комплексин присоединяется к комплексу, синтаптотагмин становится способным связывать кальций. Вот теперь комплекс окончательно собран, все готово, и остается только ждать потенциала действия.
И вот — нейрон возбуждается! В аксонном холмике лавинообразно открываются натриевые каналы, мембрана деполяризуется, ПД бежит по аксону — и в пресинаптической мембране открываются кальциевые каналы. В цитоплазму заходят ионы Ca2+, синаптотагмин связывает пять штук — одним сайтом три, другим два — и взаимодействует с липидами мембраны так, что открывается пора — сквозная дырочка из везикулы в синаптическую щель. Также важным фактором при слиянии является давление, создаваемое белковым комплексом — он прижимает везикулу к пресинаптической мембране.
И — ура, нейромедиатор в синаптической щели!

Но что же происходит с SNARE/SM комплексом потом? Когда пора расширяется, белки меняют расположение, поворачиваясь как бы перпендикулярно плоскости мембраны. А вскоре NSF — такая АТФаза — приходит из цитоплазмы вместе со своим кофактором SNAP, и они вызывают распад SNARE/SM комплекса. После этого везикула может отделиться от пресинаптической мембраны, но тут может происходить по-разному:

Описанный выше механизм выброса медиаторов в синапсах, а также роль ионов кальция в этом процессе были установлены Томасом Зюдофом, который тем самым внес решающий вклад в нейробиологию и клеточную биологию. За данные открытия ему вместе с Джеймсом Ротманом и Рэнди Шекманом присуждена в 2013 году Нобелевская премия по физиологии и медицине — «за открытие системы везикулярного транспорта — основной транспортной системы в наших клетках» [9].
Литература
- Дофаминовые болезни;
- Серотониновые сети;
- Тайны голубого пятна;
- Молекула здравого ума;
- Спокоен как GABA;
- Очень нервное возбуждение;
- Экзосома — механизм координации и взаимопомощи клеток организма;
- Фармаколог, понявший нейроны: Генри Дейл;
- Нобелевская премия по физиологии и медицине (2013): везикулярный транспорт;
- Thomas C. Südhof. (2014). The Molecular Machinery of Neurotransmitter Release (Nobel Lecture). Angew. Chem. Int. Ed.. 53, 12696-12717;
- Thomas C. Südhof. (2013). Neurotransmitter Release: The Last Millisecond in the Life of a Synaptic Vesicle. Neuron. 80, 675-690;
- Sebastian Jähne, Silvio O. Rizzoli, Martin S. Helm. (2015). The structure and function of presynaptic endosomes. Experimental Cell Research. 335, 172-179;
- Ege T Kavalali, Erik M Jorgensen. (2013). Visualizing presynaptic function. Nat Neurosci. 17, 10-16;
- Natalia L. Kononenko, Volker Haucke. (2015). Molecular Mechanisms of Presynaptic Membrane Retrieval and Synaptic Vesicle Reformation. Neuron. 85, 484-496;
- Juan S Bonifacino, Benjamin S Glick. (2004). The Mechanisms of Vesicle Budding and Fusion. Cell. 116, 153-166;
- Jeffrey P Bombardier, Mary Munson. (2015). Three steps forward, two steps back: mechanistic insights into the assembly and disassembly of the SNARE complex. Current Opinion in Chemical Biology. 29, 66-71;
- Purves D., Augustine G.J., Fitzpatrick D., Katz L.C., LaMantia A.-S., McNamara J.O., Williams S.M. Neuroscience (2nd Edition). Sunderland (MA): Sinauer Associates, 2001;
- Plopper G., Sharp D., Sikorski E. Lewin’s Cells (3rd Edition). Burlington: Jones & Bartlett Learning, 2013.