
«ФизтехБиоМед»: виртуальное долгожительство
25 декабря 2017
«ФизтехБиоМед»: виртуальное долгожительство
- 807
- 0
- 2
Ведущий пленарной сессии Сергей Леонов, заведующий лабораторией разработки инновационных лекарственных средств и агробиотехнологий МФТИ.
пресс-служба МФТИ
-
Автор
-
Редакторы
21–22 сентября 2017 г. прошла Международная конференция «ФизтехБиоМед-2017». Эксперты обсудили идеи, связанные с «активным долголетием», неврологией и биотехнологиями. Рассказываем о самых интересных лекциях: чего достигла современная инженерия в кардиологии, почему медицина фокусируется не на том и как сделать виртуального человека своими руками.
Виртуальность (лат. virtualis — возможный) — это объект или состояние, которые реально не существуют, но могут возникнуть при определенных условиях. Cейчас это слово связано с технологиями 21 века, которые предоставляют множество возможностей, в том числе продление жизни или хотя бы принципиальное ее улучшение. И где, как не на Физтехе, провести конференцию, посвященную этим технологиям?
Целью конференции «ФизтехБиоМед», по словам организаторов, стало «объединение лидеров и экспертов в области биоинженерии, нейротехнологий и гериатрии для обсуждения идей, связанных с “активным долголетием”, неврологией, биоинженерией и биотехнологиями, улучшением здоровья и медициной будущего для борьбы с различными заболеваниями».
Ваше виртуальное сердце
Первый лектор, Наталия Траянова, профессор из Университета Джонса Хопкинса (США), занимается вычислительной кардиологией. Ее научная группа строит виртуальную 3D-модель сердца по МРТ-снимкам. Модель учитывает множество факторов и отображает физические, электрические и даже химические свойства конкретного сердца. Изучать работу человеческого сердца экспериментально невозможно, а детальная 3D-модель позволяет подробно рассмотреть геометрию сердца, ориентацию волокон, распространение электрических волн и другие процессы, участвующие в работе этого органа. Модель сердца настолько впечатляюще выглядит, что выиграла конкурс и теперь каждый месяц в течение 2017 года появляется на обложке Nature Rewiews Cardiology.
Предполагается, что методологию построения виртуального сердца можно будет использовать в клинике для диагностики и лечения пациентов. Ученые в лаборатории Траяновой разрабатывают технологию для предсказания возникновения аритмии: VARP (Virtual heart Arrhythmia Risk Prediction) (рис. 1). У людей, переживших инфаркт, в сердечной ткани образуются рубцы, и это может привести к возникновению аритмии. В современной медицине эта проблема решается установкой дефибрилляторов (здесь тоже не всё так просто, подробнее — ниже), однако нужно еще определить, каким пациентам дефибрилляторы нужны. Сейчас для этого используют, например, измерение фракции выброса, то есть сколько крови выбрасывается при каждом сердцебиении. Однако это не очень надежный параметр — многим пациентам дефибриллятор не нужен, но им приходится проходить болезненную операцию по его имплантации. Группа Траяновой показала, что технология VARP надежнее остальных методов, и к тому же безболезненна [1].
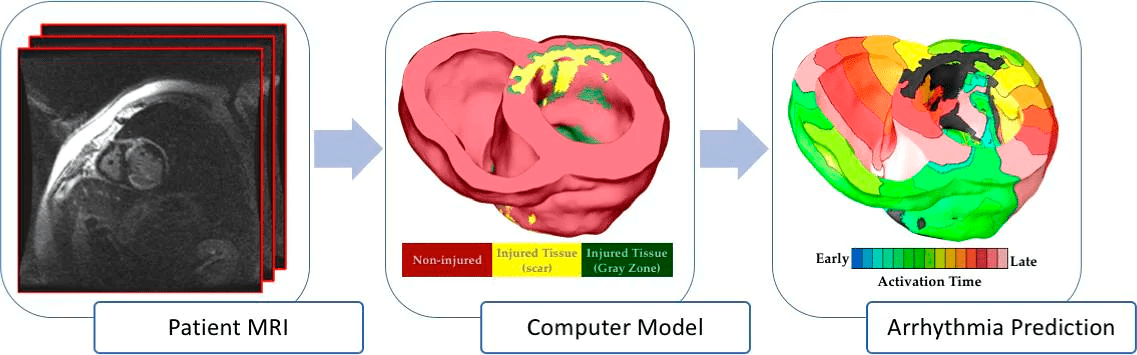
Рисунок 1. Технология VARP — Virtual heart Arrhythmia Risk Prediction. На основе снимков МРТ моделируется сердце пациента с поврежденными областями сердечной ткани, потом моделируется распространение волны возбуждения. Если на виртуальном сердце будет вихревое распространение волн, характерное для аритмии, значит, риск аритмии повышен.
Последние исследования показывают, что сердечный ритм можно выровнять с использованием оптогенетики [2], [3]. Например, в лаборатории МФТИ показали, что активностью крысиных кардиомиоцитов можно управлять с помощью света [4]. Команда из Университета Бонна использовала мышей и показала, что освещение синим светом устраняет аритмию. В лаборатории Траяновой проверили, можно ли использовать такую технологию на людях. Конечно, они это проверяли не экспериментально, а всё на том же виртуальном сердце, которое смоделировали с помощью МРТ-снимков пациента, пережившего инфаркт. Модель показала, что у людей тоже можно исправлять аритмию с помощью оптогенетики. Оказалось, что синий свет выравнивает сердечный ритм, но совсем ненадолго, зато красный свет показал более многообещающие результаты [5].
Хотя лаборатория Траяновой выяснила, что болезненные электрические дефибрилляторы можно заменить на оптические, до внедрения этой технологии в клиническую практику еще далеко. Так что пациентам с риском аритмии пока придется имплантировать электрические дефибрилляторы. Однако технологии их изготовления тоже не стоят на месте, о чем и поведал следующий лектор.
Инженерия для сердца
Игорь Ефимов, профессор в Университете Джорджа Вашингтона (США), выпускник МФТИ, начал свою лекцию с демонстрации графиков смертности от сердечно-сосудистых заболеваний. Смертность от них в США за последние 50–60 лет снизилась на 70%, а от инсультов — на 80%. Если посмотреть, какие открытия снижали смертность, то можно увидеть, что это в основном инженерные и хирургические достижения [6]. Большим прорывом стал кардиостимулятор — прибор, который имплантируется под кожу, и от которого к сердцу — как правило, в правый желудочек — тянется электрод. Похожим на него прибором является имплантируемый дефибриллятор, но он производит больший шок, чем кардиостимулятор. Дефибриллятор вставляется при угрозе фибрилляции желудочков — опасного заболевания, причины многих внезапных смертей. Однако при фибрилляции предсердий, или мерцательной аритмии, такой прибор не может использоваться, так как нужен разряд слишком большой мощности для человека.
Группа Ефимова занимается разработкой приборов для малошоковой терапии мерцательной аритмии и для мониторинга состояния сердца. С помощью КТ и МРТ можно сделать трехмерный образец сердца и по его меркам распечатать всю электронику (рис. 2). Электроды, покрытые слоем тонкого стекла для защиты сердца от побочных электрофизических эффектов, наносят на гибкую матрицу [7]. Группа Ефимова разрабатывает уже третье поколение этих устройств. Сначала электроды были не очень умными и собирали много шума. Затем разработчики поняли, что качество сигнала можно улучшить, снабдив каждый электрод его собственным электронным устройством. Эксперименты показали, что такой прибор живет 70 лет (в отличие от современных имплантируемых аппаратов со сроком годности 10 лет). Но все 400 электродов располагаются на слишком маленькой площади, которая не может покрыть поверхность миокарда полностью. Поэтому разработчики делают следующий шаг и переходят на так называемую chiplet electronics — каждый электрод будет изготавливаться отдельно для нанесения на гибкую матрицу. Такие приборы могут использоваться не только для сердца — ученые постепенно переходят и в другие области.
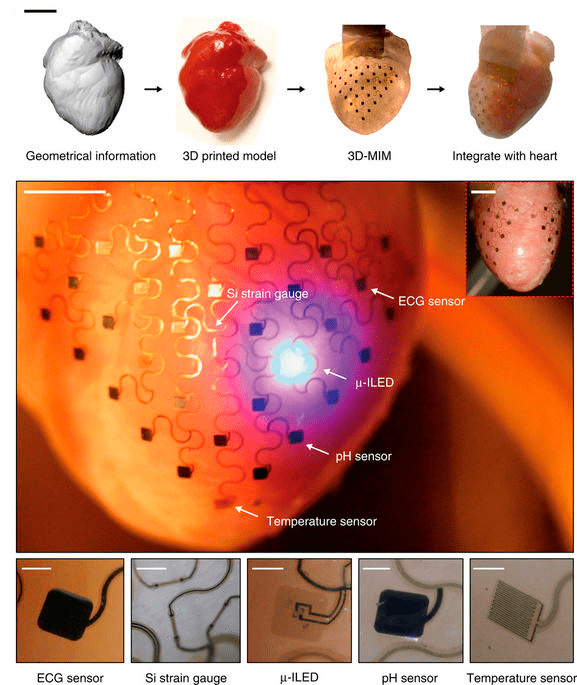
Рисунок 2. Прибор с сенсорами на сердце кролика. Трехмерную модель сердца распечатывают на 3D-принтере и создают гибкую матрицу, повторяющую форму распечатанного сердца. Матрица содержит сенсоры ЭКГ, растяжения, pH, температуры и микроскопический светодиод.
Сердечные заболевания, с которыми борются Траянова и Ефимов, наиболее часто возникают к старости. Следующий лектор использует кардинально другой подход и предлагает пересмотреть наши взгляды на старческие болезни.
Активное долголетие
Брайан Кеннеди, профессор Национального университета Сингапура, президент Института исследований старения Бака, также упоминает про то, что средняя продолжительность жизни во многих странах растет, и это связано с достижениями в медицине. Однако он настроен не так оптимистично и обращает наше внимание на то, что период здоровой жизни увеличивается очень медленно. То есть медицина продлевает не только жизнь, но и продолжительность страданий, которые мы испытываем в старости. Брайан Кеннеди считает, что изучение частных заболеваний, связанных со старением, — это в целом хорошо: если человек заболел — ему нужно лечение. Но упускается важная деталь: основным фактором риска многих болезней является старение, и если решить эту проблему, автоматически получится разобраться со всеми возрастными заболеваниями. На «Биомолекуле» борьбе со старением посвящен отдельный спецпроект.
Первые исследования старения проводили на простейших организмах; сейчас перешли на млекопитающих [8]. Также и Брайан перешел с червяков и мух на мышей. Основным объектом его исследований является сигнальный путь mTOR (Target Of Rapamicin — мишень рапамицина), он считает его потенциально интересным в вопросе долголетия [9]. И не зря — экспериментальные исследования на мышах показывают, что рапамицин, у которого, к сожалению, много побочных эффектов, продлевает жизнь. В процессе исследований выяснилось, что есть способы замедлить старение, которые работают на самцах, но не работают на самках [10]. По всей видимости, механизмы старения немного различаются в зависимости от пола и других характеристик. Это значит, что для каждого из них нужно искать свой способ воздействия.
Существует ли сейчас возможность продлить молодость? Самый надежный способ — это здоровое питание, физическая и умственная активность и упражнения на релаксацию. Есть данные о том, что препарат метформин продлевает активный период жизни и снижает риск многих заболеваний [11], [12]. Также недавно выяснили, что гормон FGF21 (фактор роста фибробластов), синтезирующийся в щитовидной железе, продлевает жизнь на 30–40% (у трансгенных мышей с повышенной экспрессией соответствующего гена [13]). В общем, Брайан уверен: активное долголетие — это возможно.
Большую надежду на обретение долголетия люди возлагают на стволовые клетки. Благодаря тому, что из них можно сделать клетку любой ткани, стволовые клетки используют в регенеративной медицине [14]. Ученые из Университета Люксембурга рассказали о своих работах, связанных со стволовыми клетками.
Программирование клеток
Йенс Швамборн рассказал, как его научная группа бьётся над проблемой моделирования нейродегенеративных заболеваний (например, болезни Паркинсона [15]). Они пытаются создать мини-мозг в пробирке — структуру из нейронов и глиальных клеток, сгруппированных особым образом. Для этого они используют перепрограммирование клеток (см. врезку): сначала получают нейроэпителиальные стволовые клетки, а потом эти клетки дифференцируются и превращаются в нейроны, астроциты и олигодендроциты. Ученым удалось вырастить в пробирке маленький средний мозг — именно там находятся дофаминергические нейроны, которые погибают при болезни Паркинсона. Они показали, что клетки в пробирке самоорганизуются, образуют синапсы и демонстрируют электрофизиологическую активность — в общем, всё как в мозге [16]. Возможно, эта технология поможет понять механизм такой загадочной болезни, как болезнь Паркинсона.
Антонио Дель Соль Меза пытается улучшить эффективность и точность перепрограммирования клеток [19]. Его группа с помощью математических и вычислительных методов объединяет все известные биологические данные, чтобы узнать больше о регуляции дифференциации стволовых клеток. На деятельность клетки влияет множество факторов (рис. 3) [20], а эти факторы в свою очередь регулируются так называемыми генными сетями. Антонио с группой строят математические модели дифференцировки клеток на основе генных сетей и разрабатывают методы, которые могли бы улучшить построение экспериментов со стволовыми клетками [21].
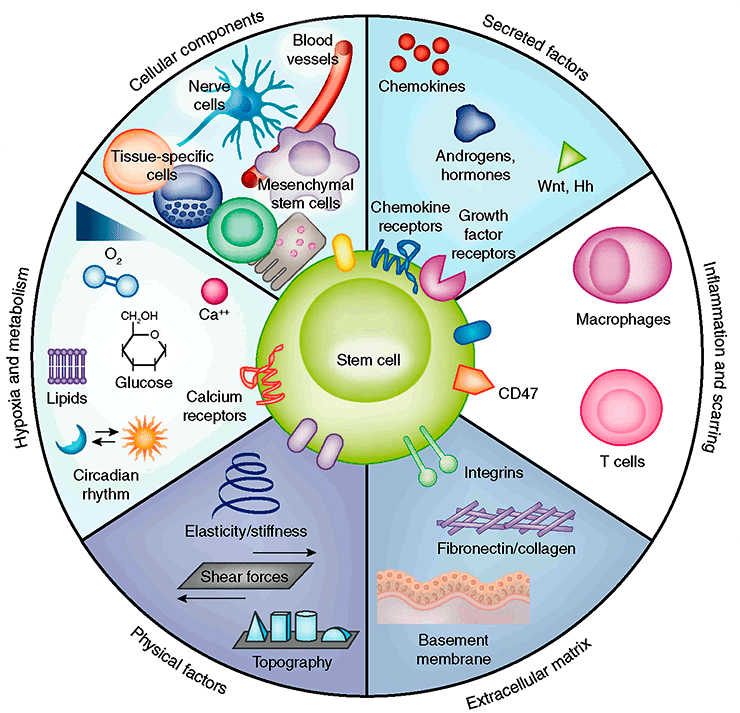
Рисунок 3. Так называемая ниша стволовой клетки — совокупность факторов, обеспечивающих ее жизнедеятельность.
Еще один ученый, занимающийся моделированием, провел лекции и мастер-классы для молодых ученых, где рассказал о концепции «виртуального человека» и о возможностях персонализированной медицины, которые нам открывает системная биология.
Виртуальный человек
Алексей Колодкин, научный сотрудник Университета Амстердама, считает, что с помощью системной биологии можно объединить огромное количество знаний, например, о болезни Паркинсона [22]. Даже об одной клетке данных о молекулярных взаимодействиях так много, что их просто нереально удержать в голове. Зато можно удержать в компьютере.
Алексей показал, как модуль за модулем можно построить схему действия активных форм кислорода (АФК) в клетке [23]. АФК являются катализатором старения митохондрий. В то же время поврежденные митохондрии производят активные формы кислорода — работает положительная обратная связь. Кроме этого, есть антиоксидантный ответ (Antiox), который устраняет АФК, и есть так называемая митофагия — устранение поврежденных митохондрий. Чтобы плохие митохондрии устранялись, нужны белки, например, p62. Каждую реакцию можно описать математически и промоделировать, как система будет себя вести, если что-то сломается. На самом деле система сложнее, и в ней играют роль много разных белков, участие которых тоже можно смоделировать.
Следующий модуль — система Keap1-Nrf2, которая тоже участвует в регуляции содержания АФК (показана розовым цветом на рис. 4). Когда белок Keap1 находится в активном состоянии, он дезактивирует транскрипционный фактор Nrf2. АФК дезактивируют Keap1, следовательно, Nrf2 остается в активном состоянии и участвует в транскрипции гена p62 и антиоксидантного гена. Благодаря этому при увеличении активных форм кислорода увеличивается антиоксидантный ответ, и система приходит в равновесие.
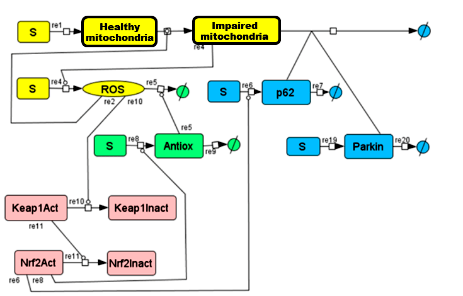
Рисунок 4. Упрощенная схема регуляции АФК в клетке. Здоровая митохондрия → поврежденная митохондрия. Остальные пояснения в тексте.
И так постепенно усложняем схему (рис. 5). Можно промоделировать, как система будет реагировать на оксидативный стресс — увеличение АФК. Оказывается, что при краткосрочном воздействии система восстанавливается, а при длительном — умирает. Похожее происходит при болезни Паркинсона — воздействия оксидативного стресса постепенно накапливаются, и спустя годы нейроны гибнут.
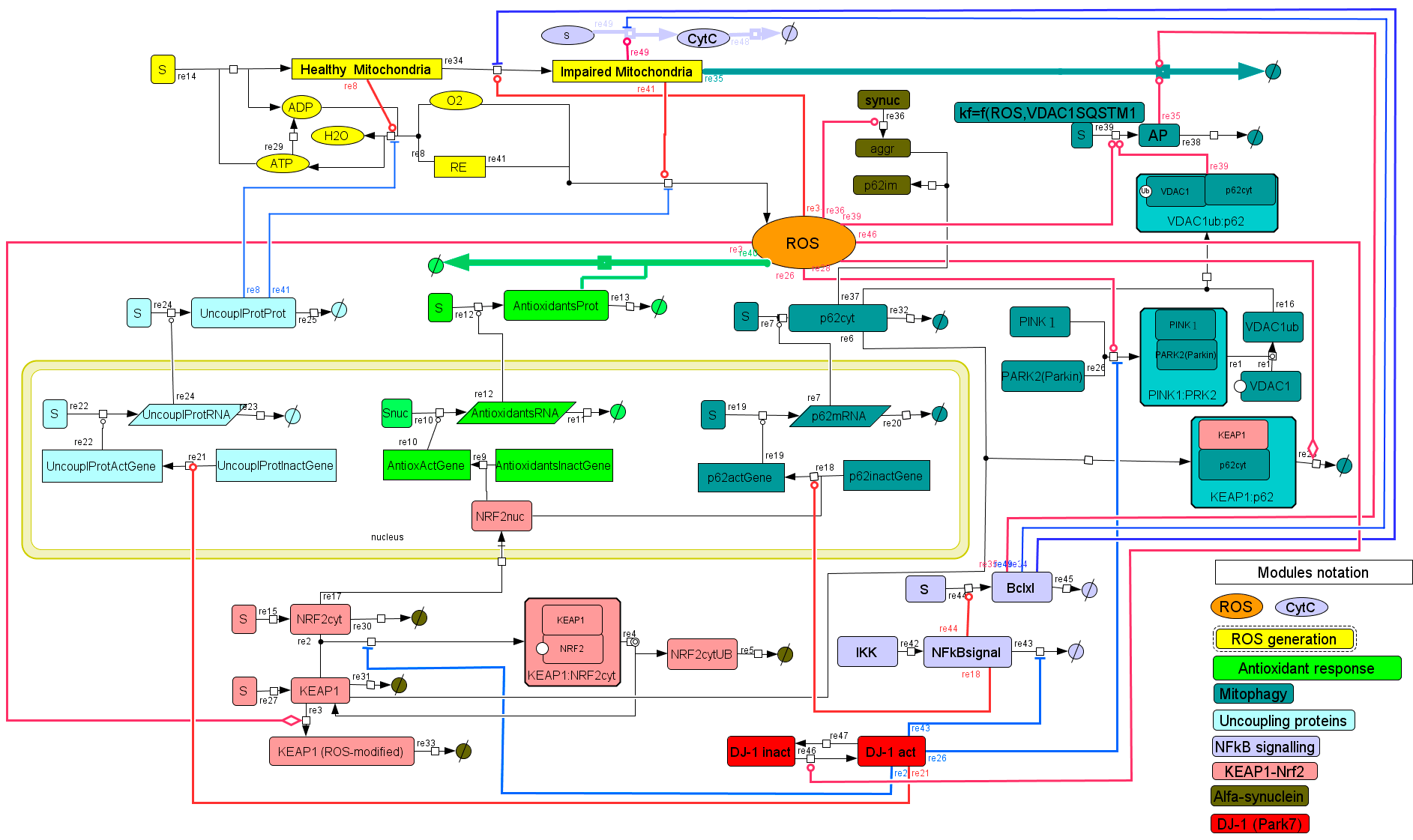
Рисунок 5. Схема регуляции АФК в клетке, включающая АТФ и ядро.
Если увеличить концентрацию Nrf2 (например, с помощью кофеина), то клетка от продолжительного стресса все равно умирает, но позже. И действительно, есть данные о том, что среди любителей кофе меньше людей с болезнью Паркинсона [24]. Однако причины болезней у пациентов могут быть разные. Возьмем пример двух реальных пациентов: одного с увеличенным содержанием альфа-синуклеина (показан коричневым цветом на рис. 5) и второго с мутацией в гене DJ1 (показан красным цветом на рис. 5). Если в специальной программе проделать вычисления на двух таких виртуальных пациентах, то окажется, что первому кофе помогает, а второму — нет. Таким образом, с помощью модели получается гипотеза, которую можно проверить экспериментально.
Алексей подвёл итог: нужна персонализированная медицина [25]. Тем более что частота возникновения болезни Паркинсона и многих других болезней зависит от пола, от этнической группы и т.д. В компьютерной модели можно подстроить параметры под конкретного больного и посмотреть, где нужно воздействовать на систему. В Университете Люксембурга уже создали «виртуальный нейрон» — карту болезни Паркинсона, где собрана вся известная информация о болезни, но пока на ней нельзя моделировать реакции [22]. Для интересующихся Алексей провел практикум и показал, как можно промоделировать вышеописанные процессы с помощью программы COPASI. Также об этом можно узнать из мануала: slideplayer.com/slide/8845213.
«Матрица» — наше будущее?
Нейротехнологии тоже занимаются виртуальными нейронами, но на уровне сетей. Про нейронные сети и машинное обучение не говорит только ленивый. И, конечно, об этом говорили на конференции «ФизтехБиоМед». В секции «Нейротехнологии» свои разработки представили участники союза «НейроНет», а пленарное заседание завершилось лекцией Владимира Конышева, руководителя подгруппы «НейроМедтехника» рабочей группы НТИ «НейроНет» и руководителя лаборатории нейроробототехники МФТИ, про ассистивные нейротехнологии — технологии, которые с помощью интерфейса «мозг—компьютер» могут повысить автономность людей с ограниченными возможностями или даже способствовать их восстановлению [26].
“НейроНет” станет следующим этапом развития современного интернета (Web 4.0), в котором взаимодействие участников (человек—человек, человек—машина) будет осуществляться с помощью новых нейрокомпьютерных интерфейсов, а сами компьютеры станут нейроморфными (похожими на мозг) с помощью гибридных цифроаналоговых архитектур. Прогнозируется появление социальных нейросетей и полноценного гибридного человекомашинного интеллекта.
Заключение
Сергей Леонов, заведующий лабораторией разработки инновационных лекарственных средств и агробиотехнологий МФТИ, прокомментировал: «Чтобы сформулировать адекватное и выполнимое послание властям, нам надо определить основные тренды развития и достижения современной науки в области биомедицинских технологий у нас и в мире. Выяснить, что делается и может быть сделано у нас, что мешает и что нужно изменить — в этом мы видим результат проведения конференции».
Конференцию проводила Физтех-школа биологической и медицинской физики при поддержке Биофармкластера «Северный» и Фармацевтического кластера Московской области «ФармДолина». В мероприятии поучаствовало более 400 специалистов — ученых, представителей ведущих НИИ, университетов и научных центров, предпринимателей и разработчиков в области живых систем, представителей венчурных фондов, студентов и аспирантов.
Литература
- Hermenegild J. Arevalo, Fijoy Vadakkumpadan, Eliseo Guallar, Alexander Jebb, Peter Malamas, et. al.. (2016). Arrhythmia risk stratification of patients after myocardial infarction using personalized heart models. Nat Comms. 7, 11437;
- Светлая голова;
- 12 методов в картинках: нейробиология;
- Лаборатория биофизики возбудимых систем: сердце, его вихри и фотоуправление;
- Tobias Bruegmann, Patrick M. Boyle, Christoph C. Vogt, Thomas V. Karathanos, Hermenegild J. Arevalo, et. al.. (2016). Optogenetic defibrillation terminates ventricular arrhythmia in mouse hearts and human simulations. Journal of Clinical Investigation. 126, 3894-3904;
- Elizabeth G. Nabel, Eugene Braunwald. (2012). A Tale of Coronary Artery Disease and Myocardial Infarction. N Engl J Med. 366, 54-63;
- Lizhi Xu, Sarah R. Gutbrod, Andrew P. Bonifas, Yewang Su, Matthew S. Sulkin, et. al.. (2014). 3D multifunctional integumentary membranes for spatiotemporal cardiac measurements and stimulation across the entire epicardium. Nat Comms. 5;
- Paola Fabrizio, Valter D. Longo. (2008). Chronological aging-induced apoptosis in yeast. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1783, 1280-1285;
- Brian K. Kennedy, Dudley W. Lamming. (2016). The Mechanistic Target of Rapamycin: The Grand ConducTOR of Metabolism and Aging. Cell Metabolism. 23, 990-1003;
- Shih-Yin Tsai, Ariana A. Rodriguez, Somasish G. Dastidar, Elizabeth Del Greco, Kaili Lia Carr, et. al.. (2016). Increased 4E-BP1 Expression Protects against Diet-Induced Obesity and Insulin Resistance in Male Mice. Cell Reports. 16, 1903-1914;
- Nils Ekström, Linus Schiöler, Ann-Marie Svensson, Katarina Eeg-Olofsson, Junmei Miao Jonasson, et. al.. (2012). Effectiveness and safety of metformin in 51 675 patients with type 2 diabetes and different levels of renal function: a cohort study from the Swedish National Diabetes Register. BMJ Open. 2, e001076;
- C. A. Bannister, S. E. Holden, S. Jenkins-Jones, C. Ll. Morgan, J. P. Halcox, et. al.. (2014). Can people with type 2 diabetes live longer than those without? A comparison of mortality in people initiated with metformin or sulphonylurea monotherapy and matched, non-diabetic controls. Diabetes Obes Metab. 16, 1165-1173;
- Yuan Zhang, Yang Xie, Eric D Berglund, Katie Colbert Coate, Tian Teng He, et. al.. (2012). The starvation hormone, fibroblast growth factor-21, extends lifespan in mice. eLife. 1;
- Тканевая инженерия: мы живем в матрице;
- Болезнь Паркинсона: что изучать? как изучать?;
- Anna S. Monzel, Lisa M. Smits, Kathrin Hemmer, Siham Hachi, Edinson Lucumi Moreno, et. al.. (2017). Derivation of Human Midbrain-Specific Organoids from Neuroepithelial Stem Cells. Stem Cell Reports. 8, 1144-1154;
- Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки;
- Кем быть? Как гемопоэтическая стволовая клетка выбирает профессию;
- Vladimir Espinosa Angarica, Antonio del Sol. (2016). Modeling heterogeneity in the pluripotent state: A promising strategy for improving the efficiency and fidelity of stem cell differentiation. BioEssays. 38, 758-768;
- Steven W Lane, David A Williams, Fiona M Watt. (2014). Modulating the stem cell niche for tissue regeneration. Nat Biotechnol. 32, 795-803;
- Satoshi Okawa, Sarah Nicklas, Sascha Zickenrott, Jens C. Schwamborn, Antonio del Sol. (2016). A Generalized Gene-Regulatory Network Model of Stem Cell Differentiation for Predicting Lineage Specifiers. Stem Cell Reports. 7, 307-315;
- Kazuhiro A. Fujita, Marek Ostaszewski, Yukiko Matsuoka, Samik Ghosh, Enrico Glaab, et. al.. (2014). Integrating Pathways of Parkinson's Disease in a Molecular Interaction Map. Mol Neurobiol. 49, 88-102;
- Активный кислород: друг или враг, или О пользе и вреде антиоксидантов;
- João Costa, Nuno Lunet, Catarina Santos, João Santos, António Vaz-Carneiro. (2010). Caffeine Exposure and the Risk of Parkinson's Disease: A Systematic Review and Meta-Analysis of Observational Studiess. JAD. 20, S221-S238;
- От медицины для всех — к медицине для каждого!;
- Ana R. C. Donati, Solaiman Shokur, Edgard Morya, Debora S. F. Campos, Renan C. Moioli, et. al.. (2016). Long-Term Training with a Brain-Machine Interface-Based Gait Protocol Induces Partial Neurological Recovery in Paraplegic Patients. Sci Rep. 6.





