Канцер Меркель
20 февраля 2024
Канцер Меркель
- 626
- 0
- 7
Карцинома Меркеля часто располагается на открытых, подверженных инсоляции участках кожи: голове, шее, конечностях. Помимо этого, болезнь может быть связана с вирусной инфекцией.
Рисунок в полном размере.
коллаж автора статьи на основе stock.adobe.com
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Статья посвящена карциноме Меркеля — редкому и агрессивному типу злокачественного заболевания кожи. Уникальным аспектом являются разные типы этого заболевания: один тип вызывается вирусной инфекцией, а второй — не связан с вирусом, а возникает из-за УФ-излучения. Вследствие этого интересно географическое распределение разных типов карциномы Меркеля. Вместе с тем в статье освещаются подходы к диагностике и лечению болезни.
Конкурс «Био/Мол/Текст»-2023/2024
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Организм человека напоминает общество, где отдельные его члены — это клетки, которые объединяются в ткани. В отличие от одноклеточных организмов, таких как бактерии, которые конкурируют друг с другом за выживание, клетки многоклеточных организмов настроены на сотрудничество. Они обмениваются сигналами для координации поведения. Эти сигналы играют роль социального контроля, указывая клеткам, как вести себя. В результате каждая клетка действует социально ответственно: она растет, делится, дифференцируется или умирает в зависимости от потребностей организма.
Молекулярные нарушения часто вредят многоклеточному сообществу. Человеческий организм состоит из 37 триллионов клеток [1], в миллиардах которых ежедневно происходят мутации. Опасно, если мутации дают одной клетке преимущество и она делится и растет быстрее соседей. Эта мутантная клетка может стать основателем новой агрессивной популяции. Мутации, которые помогают такому эгоистичному поведению, угрожают будущему клеточного общества.
Опухолевые клетки неконтролируемо размножаются и растут, нарушая ограничения, и вторгаются в территории других клеток. Опухоль считается доброкачественной и часто удаляется хирургически, если аномальные клетки не вторгаются в окружающие ткани. Опухоль становится злокачественной, когда ее клетки внедряются в соседние ткани. Эта способность к инвазивности — ключевая для злокачественных клеток. Они могут покидать первоначальную опухоль, попадать в кровеносные или лимфатические сосуды и образовывать вторичные опухоли (метастазы) в других частях организма. Чем дальше распространяется злокачественное новообразование, тем труднее его лечение. Зачастую метастазы приводят к смерти больного [2], [3].
Злокачественные опухоли разделяются по типу ткани и клеток, из которых они происходят. Карциномы возникают из эпителиальных клеток. Это самый распространенный тип неоплазий у человека [4]. Частая встречаемость карцином связана с тем, что большая часть клеточной пролиферации у взрослых происходит в эпителии. Также эти ткани подвержены повреждениям, которые ведут к развитию рака. Саркомы возникают из соединительной или мышечной ткани. Кроме того, встречаются и другие типы опухолей, такие как лейкозы, лимфомы, неоплазии нервной системы (например, глиобластома) и другие [5].
В данной статье мы рассмотрим редкий и агрессивный вид злокачественного заболевания кожи — карциному Меркеля. Обсудим вопросы происхождения, разновидности, факторы риска и методы лечения данного заболевания.
Карцинома Меркеля: что это?
В 1972 году американский патологоанатом Кирил Токер описал трабекулярную карциному кожи. Это заболевание было диагностировано у пяти пациентов, истории болезни которых описываются в его статье [6]. Токер пишет, что трабекулярные карциномы кожи возникают в дерме или подкожной жировой клетчатке. Эти новообразования состоят из сплошных трабекул (перегородок, тяжей) без четких ацинусов (мешочков). Поражение встречается у пожилых пациентов обоих полов, а крупные опухоли активно распространяются по лимфатическим сосудам. Трабекулярные карциномы иногда сложно диагностировать, так как их можно неправильно распознать как кожные метастазы других опухолей.
Токер предполагал, что трабекулярная карцинома кожи происходит из клеток потовых желез. Но позже выяснилось, что происхождение у заболевания другое. По одной из гипотез, начало карциноме дают механорецепторные клетки Меркеля в коже. Поэтому было придумано другое название — карцинома Меркеля.
Карцинома Меркеля — это агрессивная кожная нейроэндокринная опухоль, которая может быть связана с вирусной инфекцией, иммуносупрессией и воздействием солнца. Кроме того, фактором риска является пожилой возраст. У пациентов обычно обнаруживаются увеличивающиеся красные или розовые узелки на участках, подверженных облучению ультрафиолетом (рис. 1) [7].
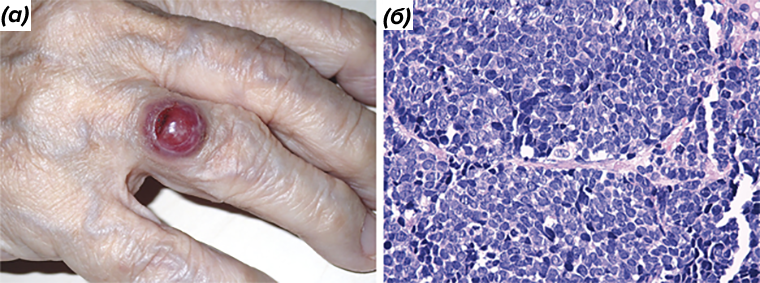
Рисунок 1. Внешний вид карциномы Меркеля на безымянном пальце правой руки (а); гистологический срез карциномы Меркеля, полученный при пункционной биопсии (б).
С изучением карциномы Меркеля связано много вопросов исследовательского характера. Международный конгресс по исследованию карциномы Меркеля [8], проведенный в 2018 году, очертил круг таких вопросов (см. врезку). В этой статье мы постараемся ответить на большую часть из них, несмотря на то, что многое в области изучения карциномы Меркеля пока неизвестно.
Из каких клеток происходит карцинома Меркеля?
Первичная опухоль возникает из одной клетки с начальными генетическими изменениями. Постепенно у потомков этой клетки накапливаются дополнительные изменения, благодаря которым они усиленно растут и размножаются. К моменту обнаружения злокачественного новообразования у человека обычно проходит много лет, и опухоль уже содержит миллиарды и более больных клеток.
Английское название карциномы Меркеля — Merkel-cell carcinoma, что буквально означает «карцинома из клеток Меркеля». Вам может показаться, что оно указывает на малигнизацию (приобретение свойств злокачественной опухоли) нормальных клеток Меркеля, происходящую при образовании карциномы. Однако это не совсем так.
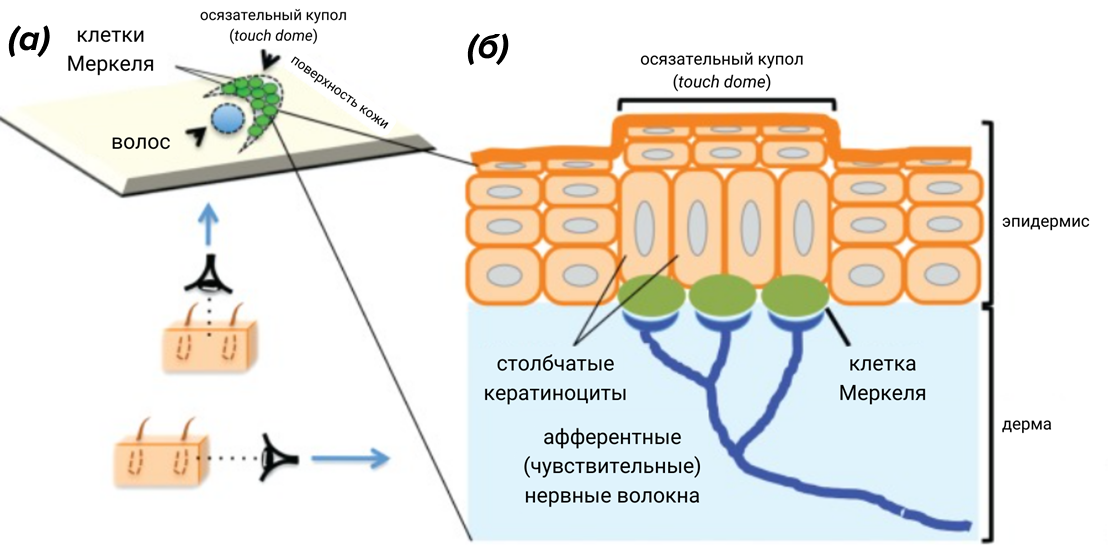
Впервые особые осязательные клетки, выполняющие механорецепторную функцию, были описаны в лапках крысы Фридрихом Меркелем, который назвал их Tastzellen (что по-немецки означает «осязательные клетки») [9]. В 1965 [10] и 1968 [11] годах c помощью трансмиссионной электронной микроскопии была установлена ультраструктура клеток Меркеля. Характерный признак клеток Меркеля при электронномикроскопическом исследовании — лобулярное (лобарное) ядро, состоящее из двух долей (рис. 2). Эта черта стала ключевым моментом при установлении Кирилом Токером происхождения трабекулярной карциномы кожи в 1972 году [6]. Дальнейшие исследования показали, что описанная Токером опухоль имеет сходные с клетками Меркеля признаки [12].
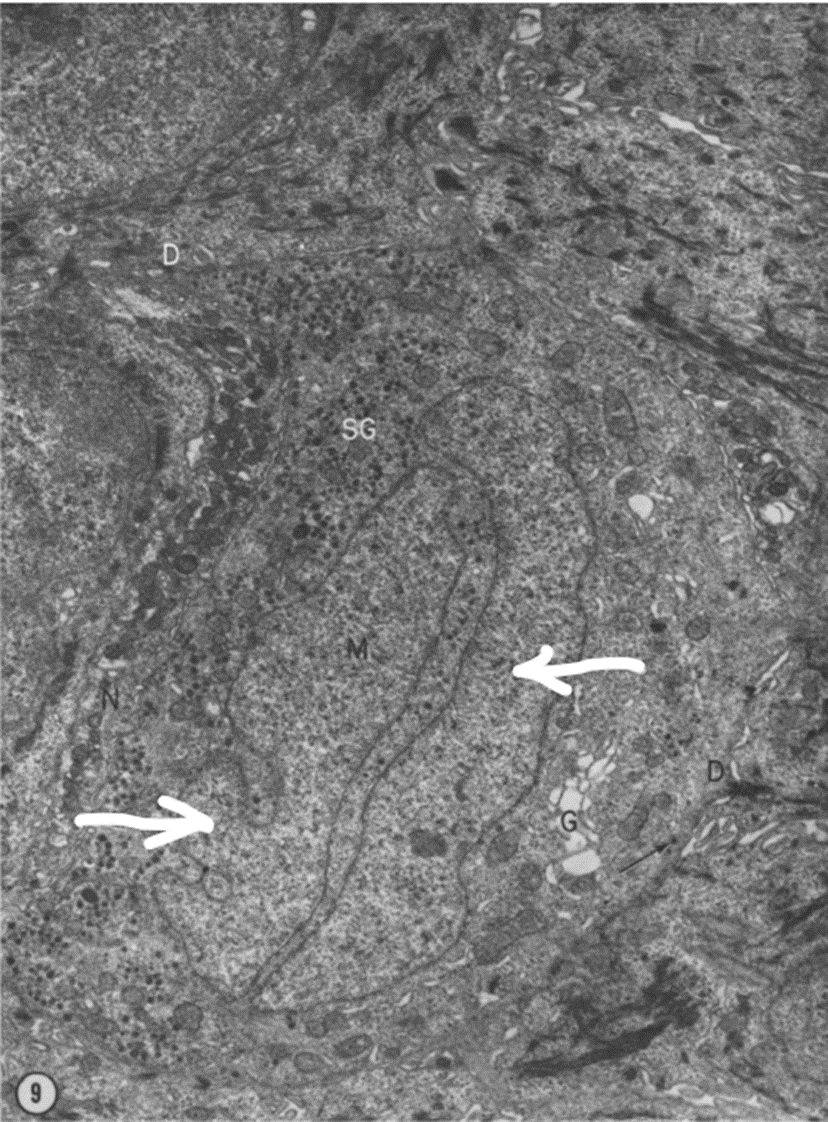
Рисунок 2. Ультраструктура клетки Меркеля. Трансмиссионная электронная микроскопия. Видно характерное для клеток Меркеля лобулярное (лобарное) ядро, состоящее из двух долей (показаны на рисунке белыми стрелками).
Клетки Меркеля (рис. 3) — это механорецепторы, которые генерируют потенциалы действия даже при слабом механическом раздражении кожи [13], [14]. Их много на кончиках пальцев, на коже наружных половых органов, у основания некоторых волосяных фолликулов и других частях тела с очень чувствительной кожей. Клетки Меркеля присоединяются десмосомами к кератиноцитам базального слоя эпидермиса. Оба типа клеток происходят из одной стволовой клетки. Но, в отличие от кератиноцитов, клетки Меркеля содержат очень мало меланосом или не содержат их вообще. Клетки Меркеля имеют синаптические контакты с расширенными терминальными дисками чувствительных волокон. Внутри клеток Меркеля вблизи областей контактов находятся плотные гранулы. Легкое прикосновение к коже вызывает активацию кальциевых каналов, высвобождение нейротрансмиттеров (серотонина и нейропептидов) из гранул и инициацию нервного импульса, вызывающего ощущение прикосновения в этом месте [15].
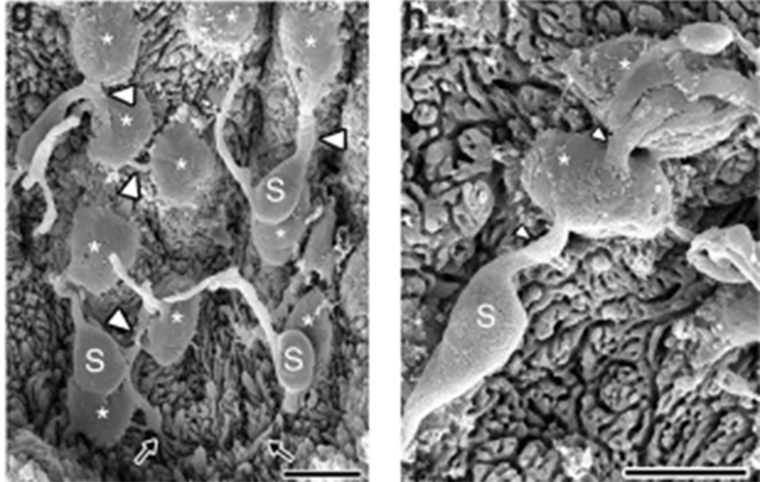
Рисунок 3. Сканирующая электронная микроскопия клеток Меркеля. Клетки Меркеля обозначены белыми звездочками, нервные волокна — белыми стрелками, а буквой S указаны Шванновские клетки.
Клетки Меркеля располагаются наиболее плотно в местах, не типичных для карциномы Меркеля. Нет доказательств прямой эволюции нормальных клеток Меркеля в опухолевые клетки. По-видимому, клетки карциномы Меркеля приобретают фенотип, схожий с таким у клеток Меркеля. Исходной для карциномы Меркеля может быть эпидермальная, дермальная или нейрональная стволовая клетка или клетка B-клеточной линии (рис. 4) [16].
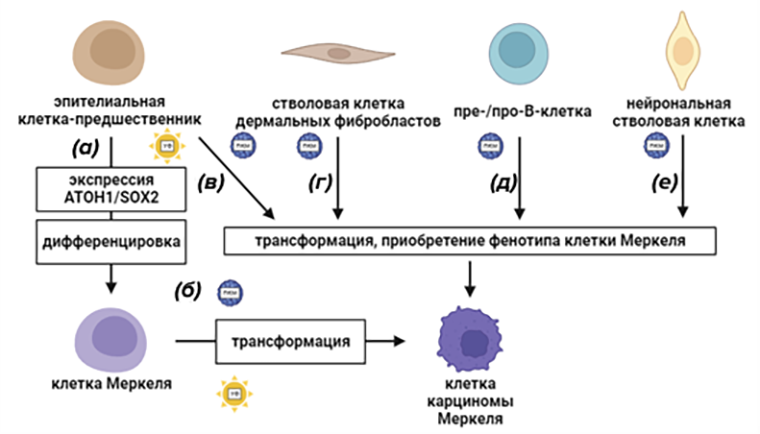
Рисунок 4. Гипотезы клеточного происхождения карциномы Меркеля.
(а) — нормальная физиологическая дифференцировка клеток Меркеля;
(б) — гипотеза 1: исходная для карциномы Меркеля клетка — клетка Меркеля, при трансформации, индуцированной T-антигеном;
(в–е) — гипотеза 2: онкогенные события происходят в клетке, отличной от клетки Меркеля, и вызывают трансформацию и приобретение фенотипа, подобного клетке Меркеля. Потенциальные предшественники клеток карциномы Меркеля: эпителиальные прогениторные клетки (в), стволовые клетки фибробластов (г), пре-/про-B-клетки и (д) нейрональные стволовые клетки (е).
ПКМ — полиомавирус клеток Меркеля.
В нормальных условиях в клетки Меркеля дифференцируются эпителиальные предшественники, которые в основном располагаются в волосяных фолликулах и в межфолликулярном эпидермисе в специализированных структурах, называемых осязательными куполами (touch domes) (рис. 5) [17]. Дифференцировка происходит при экспрессии транскрипционных факторов ATOH1 и SOX2. Эти два фактора транскрипции индуцируются LТ-антигеном (large tumor antigen) полиомавируса клеток Меркеля (ПКМ) и, следовательно, могут быть также вовлечены в приобретение фенотипа клетки Меркеля при развитии карциномы Меркеля [18].
Гипотеза о фибробластическом происхождении объясняет расположение карциномы Меркеля и согласуется с естественным жизненным циклом ПКМ, так как было обнаружено, что фибробласты способны поддерживать полный цикл ПКМ in vitro. При таком сценарии для приобретения фенотипа клетки Меркеля требуется переходная плюрипотентная стадия [16]. Плюрипотентные клетки могут быть получены непосредственно как раз-таки из фибробластов [18], [19].
Другой клеткой-кандидатом, ответственной за происхождение карциномы Меркеля, может быть предшественник нейронных клеток, поскольку было показано, что нокдаун Т-антигена в ПКМ-положительных клеточных линиях карциномы Меркеля индуцирует нейроноподобную дифференцировку [16].
Одновременно с карциномой Меркеля у пациентов встречаются различные неоплазии B-клеток (например, хронический лимфолейкоз). Помимо этого, обнаружилось, что ПКМ интегрируется в клетки B-клеточных злокачественных новообразований. Эти факты, а также коэкспрессия маркеров B-клеток (в частности, иммуноглобулинов) позволили выдвинуть гипотезу о B-клеточном происхождении карциномы Меркеля. Однако нет доказательств способности В-клеток приобретать фенотип, подобный клеткам карциномы Меркеля. И довольно странно, что нейроэндокринная карцинома происходит от клеток иммунной системы [20].
Исходя из сказанного выше, можно дать определение: карцинома Меркеля представляет собой злокачественную пролиферацию недифференцированных клеток, которые имеют общие структурные и иммуногистохимические черты с различными клетками нейро- и эктодермального происхождения, включая клетки Меркеля в дерме кожи. Однако в настоящее время еще не сложилось единого мнения об исходных клетках для карциномы Меркеля. Поиск клеток-предшественников ведется до сих пор.
Как распознать карциному Меркеля?
Заподозрить карциному Меркеля до морфологического подтверждения очень трудно. Часто пациент указывает на появление единичного безболезненного однородного образования на коже розового или красно-фиолетового цвета. Опухоль наиболее часто располагается на открытых, подверженных инсоляции (воздействию солнца) участках кожных покровов: голове, шее, конечностях [21]. Поражение быстро увеличивается в размерах в течение нескольких недель или месяцев [22]. Реже карциному Меркеля обнаруживают на коже туловища и половых органов [23]. Встречаются случаи локализации карциномы на слизистой оболочки влагалища [24].
Безобидный внешний вид карциномы Меркеля периодически приводит к неправильной диагностике кист, липом или других доброкачественных кожных поражений [17]. Иногда карциному Меркеля можно спутать с прыщами. На практике рекомендуют применять биопсию любого узла с неспецифической морфологией, безболезненностью и быстрым ростом, а не просто наблюдать за поражением [22].
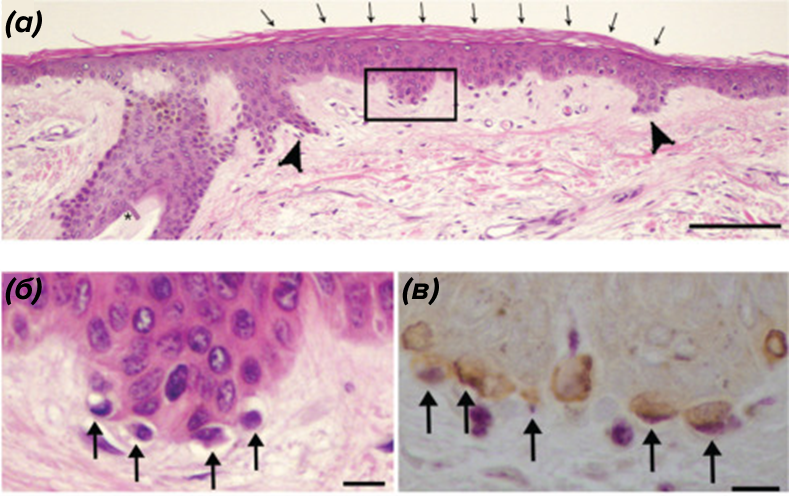
При окраске гематоксилин-эозином клеток карциномы Меркеля под световым микроскопом видны структуры трубчато-железистого строения. Клетки относительно крупные (10–15 мкм). Ядро занимает большую часть клетки, демонстрирует черты нейроэндокринных опухолей (хроматин типа «соль и перец»). Ядрышки крупные, дольчатые. Опухоль располагается в дерме кожи. Она представляет собой узел или имеет инфильтративный тип роста (слово «инфильтрат» означает в этом случае местное уплотнение и увеличение объема тканей из-за скопления в них клеток новообразования) [22].
Необходимо проводить дифференциальную диагностику (рис. 6) [25] карциномы Меркеля с рядом других опухолевых патологий. Гистопатологическими имитаторами карциномы Меркеля могут стать метастазы солидных карцином, таких как мелкоклеточный рак легкого. Для дифференциальной диагностики используются иммуногистохимические биомаркеры: антитела к фактору транскрипции щитовидной железы 1 (TTF1) [26], общий лейкоцитарного антигена CD45 [27], [28], цитокератина 20 (CK20) [22], [29], хромогранина А (CHGA), синаптофизина (SYN) [30], нейрон-специфической енолазы (NSE) [31] и CD56 [32] (рис. 6). Как фактор плохого прогноза используют также и p63 [25], [33].
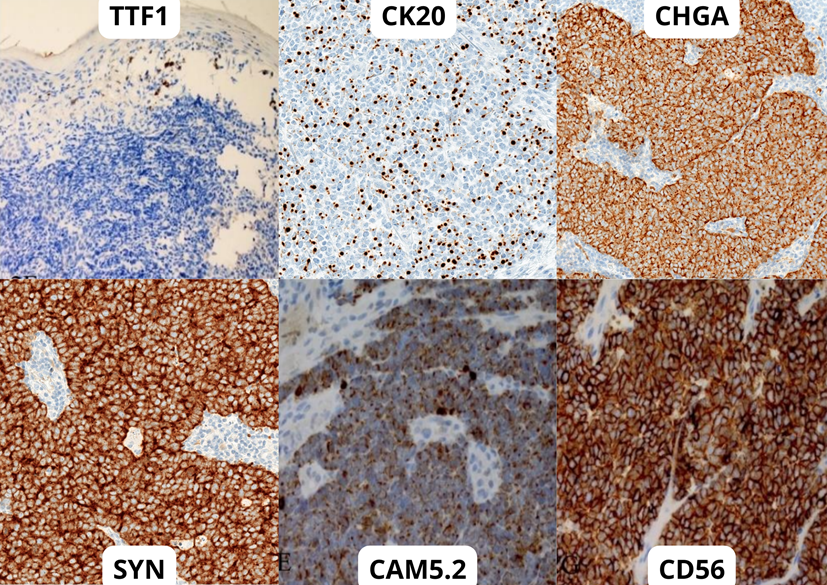
Рисунок 6. Иммуногистохимическое исследование карциномы Меркеля. Примеры использования некоторых маркеров в дифференциальной диагностике карциномы Меркеля.
коллаж автора по pathologyoutlines.com и [25]
Измерение экспрессии T-антигенов ПКМ с помощью иммуногистохимии — распространенный подход в обнаружении карциномы Меркеля [8].
В зависимости от индивидуальных гистоморфологических особенностей и в особых случаях (например, CK20-негативные опухоли) следует проводить дальнейший иммуногистохимический анализ для подтверждения диагноза и дифференциации карциномы Меркеля от потенциальных гистопатологических имитаторов [22].
Кроме иммуногистохимии, в детекции карциномы Меркеля используют также полимеразную цепную реакцию (ПЦР) [34], гибридизацию РНК или ДНК in situ [35] и секвенирование нового поколения (next-generation sequencing — NGS) [36]. Наиболее эффективно совместное использование этих подходов [8].
Какие типы карциномы Меркеля встречаются у пациентов?
Карцинома Меркеля бывает двух типов. Большинство случаев карциномы Меркеля в северном полушарии планеты (80%) исследователи относят к вирус-позитивным. Это означает, что заболевание вызвано вирусной инфекцией. Известно о таком вирусе стало сравнительно недавно, в 2008 году [37]. Полиомавирус клеток Меркеля (ПКМ) — двухцепочечный ДНК-вирус. Он поселяется на коже человека с детства и широко распространен среди здоровых взрослых людей [16]. Заподозрить у себя ПКМ довольно проблематично, потому что инфекция, вызываемая ПКМ, проходит бессимптомно [31].
Сразу напрашивается вопрос: почему безобидный вирус, встречающийся почти у каждого человека, может лишь у единиц вызывать развитие карциномы Меркеля? Вот ответ. Полиомавирусы находятся на поверхности кожи в латентном (скрытом) состоянии. В это время геном вируса реплицируется только в тандеме с клеткой-хозяином, и не образуется инфекционных частиц, которые могли бы стимулировать защитную реакцию организма человека [38]. Потеря иммунного контроля в результате старения, СПИДа или трансплантации и последующее лечение иммуносупрессивными препаратами может привести к активации репликации ПКМ в клетках кожи.
Затем вирус претерпевает как минимум две мутации, первая из которых — негомологичная рекомбинация с хромосомой хозяина. Для выживания зарождающейся клетки карциномы Меркеля необходима вторая мутация. Она приводит к укорочению Т-антигена. Воздействие солнечного света (возможно, ультрафиолета) и других мутагенов может усилить последовательные мутационные события, которые превращают эту бессимптомную вирусную инфекцию в онкогенную (рис. 7) [39].
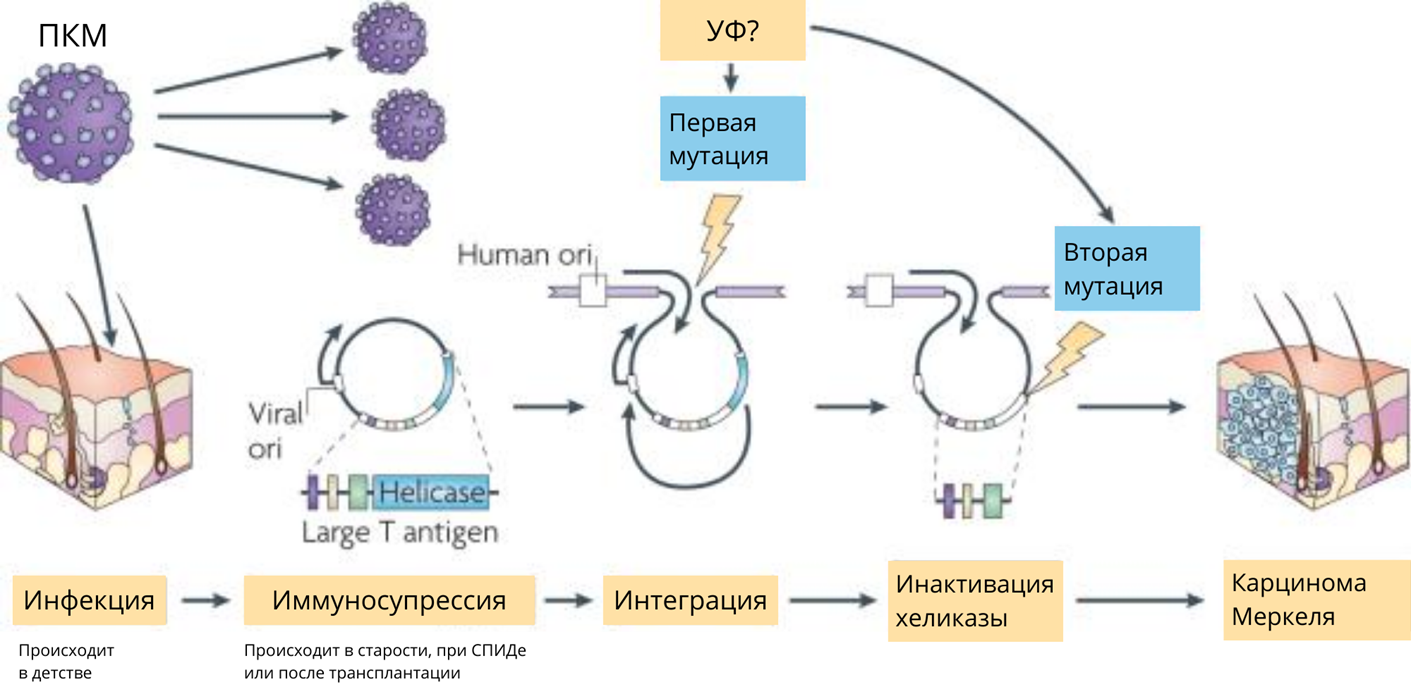
Рисунок 7. Молекулярная эволюция полиомавируса клеток Меркеля.
адаптировано из [39]
С другой стороны, в южном полушарии встречаются преимущественно вирус-негативные опухоли, в развитии которых ПКМ не принимает участия. Клетки вирус-позитивных и вирус-негативных категорий опухолей имеют разные механизмы стимулирования клеточного роста и репликации [21].
Вирус-негативные карциномы Меркеля
Чтобы образовалась опухоль, аномальной клетке необходимо передать свои изменения потомству. Это означает, что эти изменения должны быть унаследованы. Развитие злокачественных клеток зависит от генетических изменений. В опухолевых клетках присутствуют изменения в последовательности ДНК, которые выделяют их среди нормальных клеток, окружающих опухоль. Эти изменения называются соматическими мутациями. Кроме того, развитие злокачественной опухоли может быть вызвано эпигенетическими изменениями — унаследованными изменениями в экспрессии генов, обусловленными модификацией структуры хроматина без изменения последовательности ДНК клетки [41–43]. Однако соматические мутации, изменяющие последовательность ДНК, являются основной и универсальной характеристикой злокачественных новообразований.
Часто факторы, способствующие генетическим изменениям, также могут спровоцировать развитие онкологического заболевания. Поэтому онкогенез может быть связан с возникновением изменений в последовательности ДНК (мутагенезом). Особенно четко это наблюдается при воздействии двух классов внешних агентов: химических канцерогенов, которые обычно вызывают простые локальные изменения в последовательности нуклеотидов, и различных форм излучения, таких как рентгеновское и ультрафиолетовое, которые вызывают специфические изменения в ДНК [5].
Клетки вирус-негативных опухолей накапливают большое количество соматических мутаций под воздействием ультрафиолетового излучения (УФ). Многие мутации включают замены, которые являются характерными для мутаций, возникающих при воздействии УФ-излучения (например, пиримидиновые димеры) [44]. Подобные мутации обнаруживаются и при других злокачественных новообразованиях кожи. Они влияют на пути белков-супрессоров опухолей p53 и RB, а также на эпигенетические факторы, активирующие онкогены [21].
Вирус-позитивные карциномы Меркеля
Карциномы Меркеля, в развитии которых ответственен полиомавирус, вызывают большой интерес. Поэтому мы разберем основные принципы и механизмы вирусной интеграции и ее роль в онкогенезе карциномы Меркеля.
В вирус-позитивных опухолях ПКМ интегрируется в геном человека. Вирусные онкопротеины, называемые Т-антигенами, непрерывно экспрессируются и воздействуют на несколько путей клеточного роста, включая ингибирование белка RB, стабилизацию протоонкогенного белка c-Myc и уклонение от врожденного иммунитета [21].
В ДНК полиомавируса обнаружен регион (рис. 8), который содержит два кодирующих участка: один кодирует большой T-белок (LT-антиген), а второй — малый T-белок (ST-антиген).
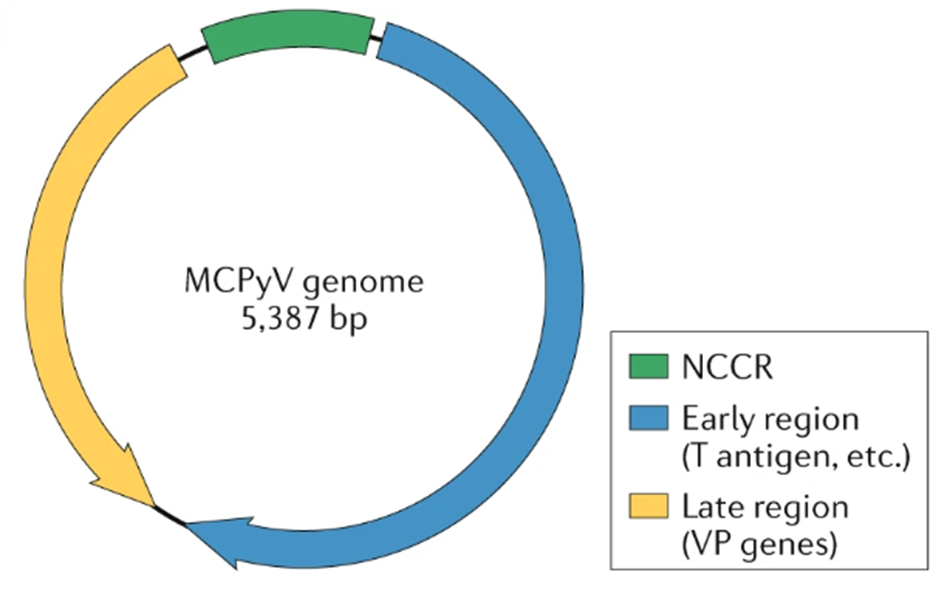
Рисунок 8. Структура генома полиомавируса карциномы Меркеля (ПКМ). Геном ПКМ представлен кольцевой двухцепочечной ДНК с 5387 парами оснований. Он включает:
1 — некодирующий контрольный регион (non-coding control region — NCCR);
2 — early region (дословно «ранний регион»), содержащий гены T-антигенов, которые координируют вирусную репликацию;
3 — late region (дословно «поздний регион») с генами капсидных белков (viral protein genes — VP genes).
Вирусная интеграция приводит к экспрессии укороченного LT-антигена (large tumor antigen). Он связан с подавлением опухолевых супрессоров, в частности, белка ретинобластомы (RB), который является контрольной точкой клеточного цикла (рис. 9). Выключая RB-белок, LT-антиген позволяет клетке быстрее проходить деление [22]. Было показано, что это взаимодействие усиливает экспрессию онкопротеина сурвивина, который может быть важной терапевтической мишенью у пациентов с вирус-позитивной карциномой Меркеля [8]. LT-белок также играет важную роль в поддержании опухоли и росте ее клеток [22].
Клетки вирус-позитивной карциномы Меркеля экспрессируют также ST-антиген (small tumor antigen). В первую очередь, он ингибирует белок MDM2, связанный с клеточным циклом и опосредованно угнетает активность белка p53 (рис. 9). Белок р53 — клеточный сенсор стресса. В ответ на повреждение ДНК, гипоксию, укорочение теломер и другие стрессы уровень р53 в клетке повышается. Это может привести либо к остановке клеточного цикла, позволяющей клетке приспособиться и выжить, либо к ее самоубийству путем апоптоза, либо к необратимой остановке клеточного цикла, при которой поврежденные клетки перестают делиться [5]. Кроме того, ST-антиген связывается с Fbxw7 (Fbxw7 — критический супрессор опухоли, один из часто дерегулируемых белков убиквитин-протеасомной системы при злокачественных заболеваниях человека [45]). Это приводит к накоплению онкогенных белков, таких как циклин-E, c-Jun, mTOR и укороченный LT-антиген [22]. Однако недавнее исследование не смогло доказать прямое взаимодействие между Т-антигенами и Fbxw7, что позволяет предположить: механизм, с помощью которого SТ-белок увеличивает уровень LТ-белка и трансформирует клетки, не включает секвестрацию (ограничение перемещения к рабочим местам) и/или нарушение Fbxw7 [46].
Также ST-антиген блокирует уничтожение белков, способных вызывать пролиферацию клеток. Исследователи считают, что ST-антиген играет важную роль в метастазировании [22]. Он нарушает целостность межклеточных соединений, тем самым усиливая диссоциацию клеток и вовлекая в этот процесс ферменты ADAM-протеазы, которые отщепляют внеклеточные фрагменты мембранных белков [47]. Например, ADAM17 отщепляют внеклеточный участок фактора некроза опухоли, что приводит к его активации. Интересно, что экспрессии только ST-антигена достаточно для трансформации в опухолевые клетки фибробластов крысы в культуре [48], но для мышиных моделей только ST-антигена оказывается недостаточно [49].
Кроме того, было обнаружено, что SТ-белок и укороченный LТ-белок индуцируют экспрессию нескольких микроРНК, которые регулируют гены-супрессоры аутофагии. Аутофагия — защитный клеточный механизм утилизации избыточных или поврежденных белков, белковых комплексов и органелл, осуществляемый лизосомами. Такая утилизация позволяет получать питательные вещества при голодании, поддерживать клеточный гомеостаз и клеточный иммунитет, осуществлять апоптоз (программируемую клеточную гибель) [50]. Уклонение опухолевыми клетками от аутофагии — очень частый случай. Возможно, это дополнительный компонент вирус-опосредованного онкогенеза и выживания клеток карциномы Меркеля, как и при многих других видах злокачественных опухолей. Вероятно, Т-антигены — не единственные регуляторы экспрессии микроРНК в клетках карциномы Меркеля, поскольку было обнаружено, что микроРНК экспрессируются как в вирус-позитивных, так и в вирус-негативных карциномах [16].
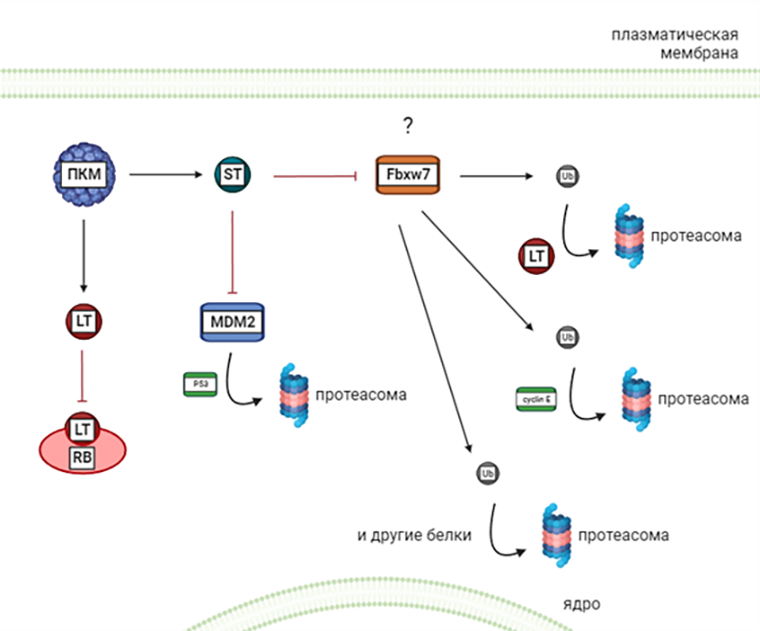
Рисунок 9. Основные моменты функционирования ST- и LT-белков полиомавируса карциномы Меркеля. Пояснения в тексте.
Для развития злокачественной опухоли необходимо постепенное накопление мутаций в различных генах. Это позволяет объяснить широко известный процесс опухолевой прогрессии, при котором начальное незначительное нарушение функций клеток постепенно превращается в полноценное злокачественное новообразование [5].

Рисунок 10. Мутационный ландшафт вирус-негативных и вирус-позитивных типов карциномы Меркеля. Обратите внимание, как мало закрашенных квадратиков (мутаций в различных генах) у вирус-позитивной карциномы Меркеля, и как много — у вирус-негативного варианта этого заболевания.
Ни при вирус-позитивных, ни при вирус-негативных вариантах карциномы Меркеля не наблюдается драйверных (приводящих к опухолевому росту) мутаций. В обоих типах прослеживается хаотичная встречаемость мутаций в разных генах, но отличается количество мутаций [51]. Из графика (рис. 10) видно, что мутаций, связанных с полиомавирусом, насчитывается немного, а количество мутаций, не связанных с ним, достаточно велико.
Было проведено сравнение числа мутаций на одну мегабазу, то есть на миллион пар оснований, между разными солидными опухолями и вирус-позитивной и вирус-негативной карциномами Меркеля. Такая генетическая характеристика, обозначающая количество ненаследуемых мутаций на миллион пар оснований исследуемой геномной последовательности, получила название «опухолевая мутационная нагрузка». Опухолевая мутационная нагрузка клеток вирус-негативной карциномы Меркеля оказалась гораздо выше остальных. Например, она примерно в пять раз выше, чем при немелкоклеточном раке легкого и меланоме [52].
При вирус-негативной карциноме Меркеля в клетках чаще всего встречаются мутации, связанные с генами опухолевых супрессоров, в частности p53 и RB [53]. Вирус-позитивные опухоли имеют минимально измененные геномы по сравнению с вирус-негативными, в которых преобладают мутации, как уже говорилось, опосредованные УФ-излучением [54].
Какая статистика по заболеваемости карциномой Меркеля?
В России эпидемиология карциномы Меркеля прослеживается плохо, потому что это заболевание в нашей стране не выделено в отдельную нозологическую единицу (нозология — раздел медицины, изучающий виды заболеваний и их классификацию). По Международной статистической классификации болезней и проблем, связанных со здоровьем, 10 пересмотра (МКБ10), карцинома Меркеля попадает под кодировку «Другие злокачественные новообразования кожи» (код С44). По МКБ11 карцинома Меркеля кодируется уже как «Кожная нейроэндокринная карцинома». В России переход к этой системе классификации болезней еще только предстоит, поэтому показатели заболеваемости и смертности регистрируются для С44 в целом (рак кожи, кроме меланомы).
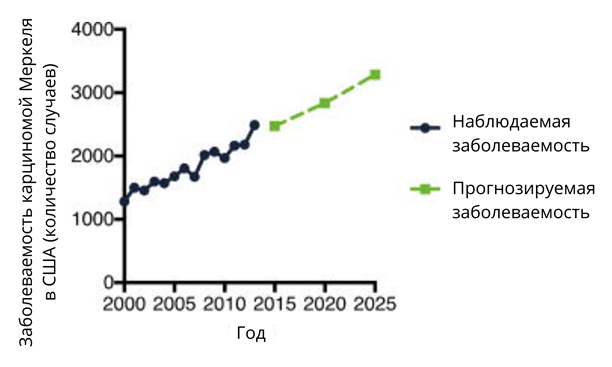
Карцинома Меркеля — редкий тип злокачественных новообразований, но количество случаев, по статистическим данным США, каждый год растет (рис. 11). Увеличение частоты встречаемости карциномы Меркеля исследователи связывают с демографическим старением населения и улучшением диагностики [55]. В некоторых странах, в том числе и в России, карцинома Меркеля отнесена к группе редких (орфанных) заболеваний. Это затрудняет сбор данных и клинические испытания лекарств [56].
Карцинома Меркеля встречается чаще всего у пациентов, которым более 50 лет. Обычно это светлокожие мужчины, так как у людей с темным цветом кожи карцинома Меркеля встречается очень редко [22]. Несколько популяционных исследований показали, что заболевание встречается в 62% случаев у мужчин и в 38% случаев у женщин. Американское онкологическое общество считает, что это связано с тем, что мужчины чаще бывают на солнце (вспомните строителей, работающих под палящим солнцем). 95% всех пораженных пациентов имеют светлую кожу и более 75% — старше 65 лет [21]. В отличие от многих других видов злокачественных заболеваний, при которых заболеваемость достигает пика, а затем снижается с увеличением возраста, частота карциномы Меркеля продолжает расти даже по достижении пациентами 80 или даже 90 лет, что, возможно, связано с иммунным старением [8].
У многих пациентов наблюдаются дефекты иммунной системы (связанные с ВИЧ-инфекцией и развившимся СПИДом), либо они принимают препараты, которые угнетают иммунную систему. Люди с ослабленным иммунитетом, как правило, имеют гораздо более высокий риск развития карциномы Меркеля даже в более молодом возрасте [21]. К факторам риска развития карциномы Меркеля относят также пересадку органов, стволовых клеток и гематологические злокачественные новообразования [8].
Самая высокая заболеваемость карциномой Меркеля зарегистрирована в Австралии, за ней следуют Новая Зеландия и США. Возможно, это связано с тем, что в таких странах солнечная погода присутствует практически круглогодично. Среди европейских стран показатели заболеваемости довольно схожи по всему континенту. Лидерами по заболеваемости среди них являются Франция, Испания, Шотландия и Нидерланды. Однако в Швеции и Финляндии уровень заболеваемости несколько ниже, чем в остальных европейских государствах [22].
Карцинома Меркеля встречается в 40 раз реже, чем злокачественная меланома, но имеет вдвое большую смертность, чем это заболевание. Эпидемиологические данные свидетельствуют о том, что в странах Европейского союза ежегодно регистрируется около 2500 новых случаев карциномы Меркеля, и примерно 1000 из этих пациентов умирают от нее [57].
Американский объединенный комитет по злокачественным опухолям (AJCC) и Международный союз по борьбе с онкологическими заболеваниями (UICC) разработали систему стадирования карциномы Меркеля (табл. 1). Она разделяет клиническую и патологическую стадии. Клиническая стадия основана на результатах физического осмотра, биопсии и визуализирующих тестов [58], а патологическая стадия включает в себя гистологическое исследование ткани [21], [22]. Самая ранняя стадия карциномы Меркеля — стадия 0 (или карцинома in situ — «на месте»), затем идут стадии I, II, III и IV. Чем меньше номер стадии, тем меньше распространилось злокачественное новообразование. Более высокий номер означает, что карцинома распространилась дальше. Внутри ступени более ранняя буква (A или B) означает более низкую ступень. Критерий Т отражает распространенность первичной опухоли. Критерий N указывает на наличие или отсутствие метастазов в регионарных лимфатических узлах. Критерий М характеризует наличие или отсутствие отдаленных метастазов. С прогрессированием заболевания выживаемость снижается. Например, пятилетняя выживаемость составляет 62,8% на патологической стадии I и постепенно убывает, достигая на патологической стадии IV 13,5% [59].
Для процедуры стадирования карциномы Меркеля обязательно выполнение патологоанатомического исследования биопсийного (операционного) материала. Оценку состояния лимфатических узлов для установления стадии выполняют при помощи клинического осмотра, инструментальных исследований и процедуры биопсии сторожевого лимфатического узла.
| Стадия | Характеристика | Описание |
|---|---|---|
| 0 |
|
|
| I |
|
|
| IIA |
|
|
| IIB |
|
|
| IIIA |
|
|
| или | ||
|
|
|
| IIIB |
|
|
| IV |
|
|
Как лечить карциному Меркеля?
Злокачественные клетки могут развиваться в разные подвиды, которые сосуществуют в опухоли или распространяются по разным частям организма. Новые мутации могут привести к тому, что некоторые подвиды становятся доминирующими, а другие отступают. Увеличение генетического разнообразия опухолевых клеток усложняет лечение заболевания.
Большинство злокачественных клеток у человека имеют высокую частоту мутаций и считаются генетически нестабильными. Эта нестабильность возникает из-за проблем с механизмами восстановления поврежденной ДНК или исправления ошибок при копировании генетической информации. Эти проблемы приводят к изменению последовательности ДНК, мутациям. Кроме того, часто возникают ошибки при расхождении хромосом во время митоза, что также приводит к изменениям в генетическом наборе клеток [60].
Лечение онкологического заболевания сравнимо с борьбой с сорняками. Можно удалить опухолевые клетки хирургическим путем или уничтожить их с помощью химикатов или радиации, но полностью искоренить их очень трудно. Хирургия редко способна убрать все метастазы, а химиотерапия, убивающая злокачественные клетки, часто вредит и нормальным. Кроме того, опухолевые клетки могут быстро изменяться и часто становятся устойчивыми к лекарствам и облучению. Несмотря на эти трудности, существуют эффективные методы лечения некоторых ранее смертельных видов злокачественных заболеваний с использованием противоопухолевых препаратов (зачастую в комбинации с другими методами). Даже для видов неоплазий, для которых полное излечение кажется невозможным, существуют методы, которые продлевают жизнь или облегчают страдания пациентам [5].
Пациенты с карциномой Меркеля получают пользу от мультидисциплинарного лечения [61]. Эффективнее атаковать опухоль сразу несколькими видами лечения, чем применять их поочередно до неудачи каждого. Это связано с тем, что опухолевые клетки имеют высокую склонность к генетическим изменениям, и поэтому последовательное применение двух препаратов часто приводит к появлению мутантных клонов, устойчивых к обоим препаратам [62]. В начальной популяции всегда есть клетки с редкими мутациями, делающими их устойчивыми к одному препарату, поэтому не должно быть клеток с полным набором таких редких мутаций, обеспечивающих устойчивость к разным препаратам, применяемым одновременно. В отличие от этого, последовательное лечение дает небольшому количеству клеток, резистентных к первому препарату, возможность размножиться до большого числа. Внутри этой большой популяции клеток, устойчивых к первому препарату, вероятно, появится небольшое количество клеток, устойчивых и к следующему препарату, и так далее (рис. 12).
Эффективное и разумное применение комбинированной медикаментозной терапии требует трех шагов. Во-первых, необходимо выявить множество характеристик злокачественных клеток, которые делают их уязвимыми в большей степени, чем нормальные клетки. Во-вторых, нужно разработать препараты (или другие методы лечения), направленные на каждую из этих уязвимостей. В-третьих, следует подобрать комбинацию препаратов, соответствующую конкретному набору характеристик, присутствующих в опухолевых клетках у конкретного пациента [5].
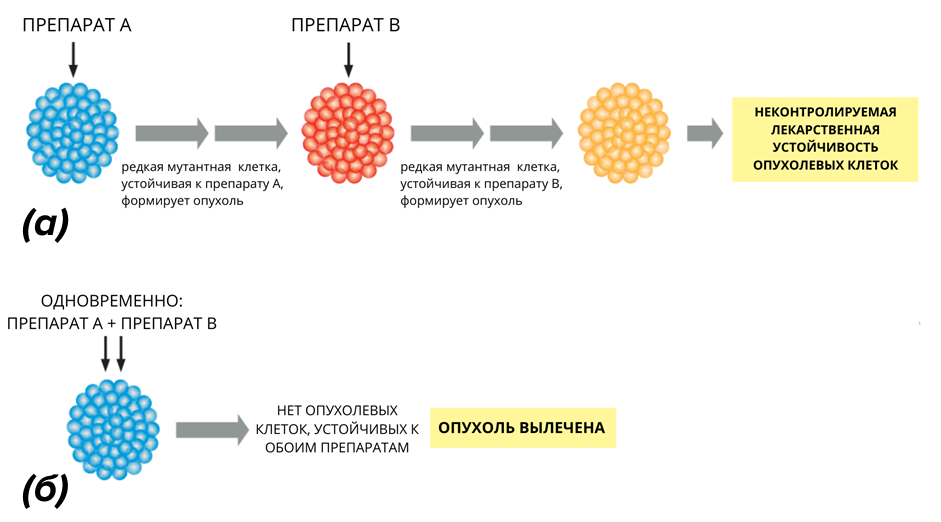
Рисунок 12. Почему лечение несколькими препаратами может быть более эффективным, чем последовательное лечение злокачественной опухоли.
(а) — поскольку опухолевые клетки обладают повышенной мутабельностью, последовательное лечение двумя препаратами часто приводит к отбору мутантных клонов клеток, устойчивых к обоим препаратам;
(б) — одновременное лечение обоими препаратами может быть более эффективным.
адаптировано из [5]
Онкологические заболевания, выявленные на ранних стадиях, часто поддаются лечению с помощью хирургического вмешательства, лучевой терапии или лекарственных препаратов [5]. Первоначальное лечение карциномы Меркеля — обычно хирургическое удаление опухоли. Перед операцией всем пациентам с карциномой Меркеля рекомендуется биопсия сторожевых лимфатических узлов [22]. Сторожевые лимфатические узлы — это лимфоузлы, которые ближе всего расположены к опухоли и в которые наиболее вероятно распространение злокачественных клеток из первичной опухоли. Биопсия означает прижизненное взятие клеток или тканей из организма с диагностической целью. Это обязательный метод подтверждения диагноза при подозрении на наличие онкологических заболеваний.
На ранних стадиях (0—II) карциномы Меркеля исследователи не рекомендуют проводить адъювантное лекарственное лечение (химиотерапию, иммунотерапию и т. д.), так как польза от такой терапии не была показана.
При появлении метастазов в лимфатических узлах прибегают к полной диссекции лимфатических узлов (ПДЛУ). Иммуногистохимия, направленная на цитокератины (например, CK20) улучшает детекцию микрометастазов в сторожевых лимфоузлах [8]. В случае масштабного метастатического поражения лимфоузлов применяют ПДЛУ и послеоперационную лучевую терапию. Препарат авелумаб (антитела к белку PD-(L)1) следует предлагать в качестве системной терапии первой линии при распространенной карциноме Меркеля. Частота последующих посещений поликлиники и обследований зависит от стадии заболевания и проводимого лечения пациента [22], [63].
При метастатической и нерезектабельной (неудаляемой) карциноме Меркеля прибегают уже к системной лекарственной терапии. Такая терапия обычно включает в себя противоопухолевые препараты платины, таксаны, антрациклиновые антибиотики и этопозид. В связи с отсутствием стойких ответов и установленного влияния на выживаемость химиотерапия в настоящее время рассматривается как паллиативная, то есть применяемая только для устранения отдельных симптомов [8]. Для большинства видов злокачественных новообразований, которые прогрессируют и дают обширные метастазы, в том числе и карциномы Меркеля, излечение все еще не представляется возможным.
С точки зрения пациента, развитие онкологических исследований может показаться медленным и даже утомительным. Каждый новый препарат должен пройти серию клинических испытаний: сначала на безопасность, а затем на эффективность, прежде чем он будет доступен для широкого применения. Если препарат планируется использовать в комбинации с другими, то и комбинированная терапия подлежит такому же длительному процессу. Строгие этические нормы ограничивают проведение испытаний, что требует времени, — как правило, несколько лет . Тем не менее, постепенные и осторожные шаги в правильном направлении могут привести к значительным достижениям [5].
На «Биомолекуле» есть спецпроект, посвященный клиническим исследованиям.
Сейчас проводится несколько клинических испытаний новых методов лечения или новых комбинаций методов лечения распространенной карциномы Меркеля, а также в настоящее время врачи присматриваются к иммунотерапии в качестве адъювантной и неоадъювантной терапии [22].
Может ли иммунная система человека справиться с карциномой Меркеля?
Онкологические заболевания взаимодействуют с иммунной системой сложным образом, и различные ее компоненты могут иногда как способствовать, так и препятствовать прогрессированию опухоли.
Иммунитет решает ключевую роль в контроле роста карциномы Меркеля. На это указывают данные об ответах кровяных и внутриопухолевых CD4+ и CD8+ Т-клеток, направленных против вирусных и клеточных антигенов [16].
Клетки карциномы Меркеля экспрессируют либо антигены ПКМ (вирус-позитивная карцинома Меркеля), либо неоантигены, связанные с мутациями из-за УФ-излучения (вирус-негативная карцинома Меркеля). Неоантигены — это чужеродные белки, которые отсутствуют в нормальных тканях, но могут возникать в опухолях в результате различных механизмов, таких как геномные мутации и т. п. [64]. И антигены ПКМ, и неоантигены — потенциальная мишень для противоопухолевого иммунитета [8].
Противоопухолевое воздействие оказывает как врожденный, так и адаптивный иммунитет. Адаптивный противоопухолевый иммунитет опосредуется активацией эффекторных Т-клеток антигенпрезентирующими клетками и модулируется белками, экспрессируемыми на поверхности иммунных и опухолевых клеток [8].
За взаимодействием опухолевых и иммунных клеток иммунологи наблюдают уже много лет. Идея использовать для лечения онкологических заболеваний собственный иммунитет, механизм специфичного, целенаправленного убийства аномальных клеток, увлекает исследователей по всему миру. И иммунотерапия уже несколько десятков лет развивается и спасает жизни пациентам [65].
Самый простой вид иммунотерапии заключается в введении пациенту антител, направленных против опухолевых клеток. В другом подходе антитела используются для доставки препарата к злокачественных клеткам. Антитела против белков, которые в изобилии присутствуют на поверхности определенного типа опухолевых клеток, но редко встречаются на нормальных клетках, могут быть снабжены токсином, убивающим те клетки, которые связывают молекулу антитела.
Как уже обсуждалось, авелумаб (антитела против PD-L1) обеспечивает эффективный ответ у одной трети пациентов с карциномой Меркеля, получающих терапию второй линии после неэффективности химиотерапии, при этом половина пациентов остается жива через один год и одна треть пациентов — через два года [16]. Лечение препаратом петролизумабом (антителом против PD-1) в 56% показало положительный результат [67]. И авелумаб, и петролизумаб были одобрены Управлением по контролю качества пищевых продуктов и лекарственных средств США (FDA) [68].
Чтобы выжить и делиться без ограничений, потенциальная опухолевая клетка должна накапливать мутации, которые отключают нормальные защитные механизмы, побуждающие клетку, подвергшуюся стрессу тем или иным образом, к самоубийству. Фактически, одним из важнейших свойств многих типов опухолевых клеток является то, что они не подвергаются апоптозу, когда нормальная клетка сделала бы это [5]. Было показано, что ABT-263, низкомолекулярный ингибитор регулятора апоптоза белков семейства BCL-2, индуцирует апоптоз в большинстве исследованных клеточных линий карциномы Меркеля. Эффективными могут быть также препараты, направленные на сурвивин или BCL-2. YM155, низкомолекулярный ингибитор антиапоптотического белка сурвивина, — мощный индуктор клеточной гибели в клеточных линиях вирус-позитивной карциномы Меркеля [8].
Клетки карциномы Меркеля экспрессируют рецепторы соматостатина, поэтому аналоги соматостатина исследуются как для молекулярной визуализации, так и для лечения пациентов [8].
Клеточные линии карциномы Меркеля чувствительны к ингибированию фосфоинозитид-3-киназы (PI3K) и протеинкиназы mTOR, а у одного пациента был получен полный ответ на препарат иделалисиб — ингибитор PI3K, хотя ответ мог быть изменен одновременным применением лучевой терапии. Безопасность и эффективность ингибирования mTOR у пациентов изучается в нескольких клинических исследованиях [8].
Сигнальный путь PI3K/Akt/mTOR внутри клетки играет важную роль в контроле ее роста. В норме этот путь активируется разными внешними сигналами, такими как инсулин и инсулиноподобные факторы роста. В опухолевых клетках из-за мутаций этот путь активируется так, что клетка начинает расти даже без этих сигналов. Это приводит к увеличенной активности протеинкиназ Akt и mTOR, что усиливает не только синтез белков, но и поглощение глюкозы, а также образование ацетил-КоА — важного компонента для создания клеточных липидов [5].
В будущих исследованиях следует рассмотреть возможность использования терапевтических вакцин в качестве неоадъювантной терапии пациентов с карциномой Меркеля, например, с помощью вирусов для доставки инактивированных вирусных онкопротеинов [8], [69], [70].
Заключение
Как мы увидели, карцинома Меркеля представляет собой редкий, но агрессивный тип кожного злокачественного заболевания, который требует особого внимания и диагностики. Несмотря на свою редкость, она может иметь серьезные последствия для здоровья пациентов, особенно при отсутствии своевременного обнаружения и лечения. Важно подчеркнуть роль профилактики, регулярного осмотра кожи и своевременного обращения к врачу при выявлении подозрительных симптомов. Современные методы диагностики и лечения предоставляют надежные возможности для борьбы с этой болезнью, а медицинская наука продолжает работу над развитием эффективных терапевтических стратегий. Следует помнить, что поддержка и информирование пациентов, а также поддержка их близких играют важную роль в борьбе с заболеванием.
Литература
- Ananda L. Roy, Richard S. Conroy. (2018). Toward mapping the human body at a cellular resolution. MBoC. 29, 1779-1785;
- Модельные организмы: бонус — раковые клетки;
- Во власти опухоли: почему метастазы так сложно остановить?;
- Rebecca L. Siegel, Kimberly D. Miller, Nikita Sandeep Wagle, Ahmedin Jemal. (2023). Cancer statistics, 2023. CA A Cancer J Clinicians. 73, 17-48;
- Stephen Bustin. (2015). Molecular Biology of the Cell, Sixth Edition; ISBN: 9780815344643; and Molecular Biology of the Cell, Sixth Edition, The Problems Book; ISBN 9780815344537. IJMS. 16, 28123-28125;
- Cyril Toker. (1972). Trabecular Carcinoma of the Skin. Arch Dermatol. 105, 107;
- Pedro J. Gomez-Arias, Rafael Salido-Vallejo. (2019). Merkel-Cell Carcinoma. N Engl J Med. 381, e40;
- Paul W. Harms, on behalf of the International Workshop on Merkel Cell Carcinoma Research (IWMCC) Working Group, Kelly L. Harms, Patrick S. Moore, James A. DeCaprio, et. al.. (2018). The biology and treatment of Merkel cell carcinoma: current understanding and research priorities. Nat Rev Clin Oncol. 15, 763-776;
- Fr. Merkel. (1875). Tastzellen und Tastkörperchen bei den Hausthieren und beim Menschen. Archiv f. mikrosk. Anat.. 11, 636-652;
- Bryce L. Munger. (1965). THE INTRAEPIDERMAL INNERVATION OF THE SNOUT SKIN OF THE OPOSSUM. The Journal of Cell Biology. 26, 79-97;
- A. E. Andersen, P. H. J. Nafstad. (1968). An electron microscopic investigation of the sensory organs in the hard palate region of the hen (Gallus domesticus). Z.Zellforsch. 91, 391-401;
- Richard K. Sibley, Louis P. Dehner, Juan Rosai. (1985). Primary neuroendocrine (Merkel cell?) carcinoma of the skin. The American Journal of Surgical Pathology. 9, 95-108;
- Purves D., Augustine G.J., Fitzpatrick D. Neuroscience. 2nd edition. Sunderland (MA): Sinauer Associates, 2001. — 681 p.;
- Mari Orime, Tatsuo Ushiki, Daisuke Koga, Masaaki Ito. (2013). Three-Dimensional Morphology of Touch Domes in Human Hairy Skin by Correlative Light and Scanning Electron Microscopy. Journal of Investigative Dermatology. 133, 2108-2111;
- Mescher A.L. Junqueira's Basic Histology. McGraw-Hill Education, 2016. — 560 p.;
- Mahtab Samimi, Thibault Kervarrec, Antoine Touze. (2020). Immunobiology of Merkel cell carcinoma. Current Opinion in Oncology. 32, 114-121;
- D. M. Owens, E. A. Lumpkin. (2014). Diversification and Specialization of Touch Receptors in Skin. Cold Spring Harbor Perspectives in Medicine. 4, a013656-a013656;
- Kazutoshi Takahashi, Shinya Yamanaka. (2006). Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors. Cell. 126, 663-676;
- Была клетка простая, стала стволовая;
- Thibault Kervarrec, Mahtab Samimi, Serge Guyétant, Bhavishya Sarma, Jérémy Chéret, et. al.. (2019). Histogenesis of Merkel Cell Carcinoma: A Comprehensive Review. Front. Oncol.. 9;
- Yun Xue, Manisha Thakuria. (2019). Merkel Cell Carcinoma Review. Hematology/Oncology Clinics of North America. 33, 39-52;
- Marie-Léa Gauci, Cynthia Aristei, Jurgen C. Becker, Astrid Blom, Veronique Bataille, et. al.. (2022). Diagnosis and treatment of Merkel cell carcinoma: European consensus-based interdisciplinary guideline – Update 2022. European Journal of Cancer. 171, 203-231;
- Michelle Heath, Natalia Jaimes, Bianca Lemos, Arash Mostaghimi, Linda C. Wang, et. al.. (2008). Clinical characteristics of Merkel cell carcinoma at diagnosis in 195 patients: the AEIOU features. Journal of the American Academy of Dermatology. 58, 375-381;
- Manju Aron, Ming Zhou. (2011). Merkel Cell Carcinoma of the Genitourinary Tract. Archives of Pathology & Laboratory Medicine. 135, 1067-1071;
- Sofia Asioli, Alberto Righi, Marco Volante, Vincenzo Eusebi, Gianni Bussolati. (2007). p63 expression as a new prognostic marker in Merkel cell carcinoma. Cancer. 110, 640-647;
- S N Leech, A J O Kolar, P D Barrett, S A Sinclair, N Leonard. (2001). Merkel cell carcinoma can be distinguished from metastatic small cell carcinoma using antibodies to cytokeratin 20 and thyroid transcription factor 1. Journal of Clinical Pathology. 54, 727-729;
- Melissa Pulitzer. (2017). Merkel Cell Carcinoma. Surgical Pathology Clinics. 10, 399-408;
- Nicholas Mulchan, Alberto Cayton, Armand Asarian, Philip Xiao. (2019). Merkel cell carcinoma: a case report and literature review. Journal of Surgical Case Reports. 2019;
- Mark P. Scott, Klaus F. Helm. (1999). Cytokeratin 20: A Marker For Diagnosing Merkel Cell Carcinoma. The American Journal of Dermatopathology. 21, 16-20;
- Koljonen V., Haglund C., Tukiainen E., Böhling T. (2005). Neuroendocrine differentiation in primary Merkel cell carcinoma--possible prognostic significance. Anticancer Res. 25,853–858;
- Yanis Tolstov. (2011). Asymptomatic Primary Merkel Cell Polyomavirus Infection among Adults. Emerg. Infect. Dis. 1371-1380;
- Motoki Kurokawa, Kazuki Nabeshima, Yutaka Akiyama, Shunichi Maeda, Takaaki Nishida, et. al.. (2003). CD56: a useful marker for diagnosing Merkel cell carcinoma. Journal of Dermatological Science. 31, 219-224;
- Noreen M. Walsh, Andrea Saggini, Sylvia Pasternak, Michael D. Carter, Kirsten Fleming, et. al.. (2020). p63 expression in Merkel cell carcinoma: comparative immunohistochemistry invokes TAp63 as the dominant isoform involved. Human Pathology. 97, 60-67;
- 12 методов в картинках: полимеразная цепная реакция;
- Важнейшие методы молекулярной биологии и генной инженерии;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- Huichen Feng, Masahiro Shuda, Yuan Chang, Patrick S. Moore. (2008). Clonal Integration of a Polyomavirus in Human Merkel Cell Carcinoma. Science. 319, 1096-1100;
- Hyun Jin Kwun, Yuan Chang, Patrick S. Moore. (2017). Protein-mediated viral latency is a novel mechanism for Merkel cell polyomavirus persistence. Proc. Natl. Acad. Sci. U.S.A.. 114;
- Patrick S. Moore, Yuan Chang. (2010). Why do viruses cause cancer? Highlights of the first century of human tumour virology. Nat Rev Cancer. 10, 878-889;
- Эпигенетика: невидимый командир генома;
- Эпигенетика: невидимый командир генома;
- Путь клетки «из греков в варяги». Малигнизация: причины и следствия;
- Эпигеном: параллельная реальность внутри клетки;
- Douglas E. Brash. (2015).
UV Signature Mutations. Photochem & Photobiology. 91, 15-26; - Chien-Hung Yeh, Marcia Bellon, Christophe Nicot. (2018). FBXW7: a critical tumor suppressor of human cancers. Mol Cancer. 17;
- Kristine N. Dye, Markus Welcker, Bruce E. Clurman, Ann Roman, Denise A. Galloway. (2019). Merkel cell polyomavirus Tumor antigens expressed in Merkel cell carcinoma function independently of the ubiquitin ligases Fbw7 and β-TrCP. PLoS Pathog. 15, e1007543;
- Nnenna Nwogu, James R. Boyne, Samuel J. Dobson, Krzysztof Poterlowicz, G. Eric Blair, et. al.. (2018). Cellular sheddases are induced by Merkel cell polyomavirus small tumour antigen to mediate cell dissociation and invasiveness. PLoS Pathog. 14, e1007276;
- Masahiro Shuda, Hyun Jin Kwun, Huichen Feng, Yuan Chang, Patrick S. Moore. (2011). Human Merkel cell polyomavirus small T antigen is an oncoprotein targeting the 4E-BP1 translation regulator. J. Clin. Invest.. 121, 3623-3634;
- Monique E. Verhaegen, Doris Mangelberger, Paul W. Harms, Tracy D. Vozheiko, Jack W. Weick, et. al.. (2015). Merkel Cell Polyomavirus Small T Antigen Is Oncogenic in Transgenic Mice. Journal of Investigative Dermatology. 135, 1415-1424;
- Аутофагия, протофагия и остальные;
- Paul William Harms, Pankaj Vats, Monique Elise Verhaegen, Dan R. Robinson, Yi-Mi Wu, et. al.. (2015). The Distinctive Mutational Spectra of Polyomavirus-Negative Merkel Cell Carcinoma. Cancer Research. 75, 3720-3727;
- Gerald Goh, Trent Walradt, Vladimir Markarov, Astrid Blom, Nadeem Riaz, et. al.. (2016). Mutational landscape of MCPyV-positive and MCPyV-negative Merkel cell carcinomas with implications for immunotherapy. Oncotarget. 7, 3403-3415;
- Derek Erstad, James Cusack. (2014). Mutational Analysis of Merkel Cell Carcinoma. Cancers. 6, 2116-2136;
- Gabriel J. Starrett, Christina Marcelus, Paul G. Cantalupo, Joshua P. Katz, Jingwei Cheng, et. al.. (2017). Merkel Cell Polyomavirus Exhibits Dominant Control of the Tumor Genome and Transcriptome in Virus-Associated Merkel Cell Carcinoma. mBio. 8;
- Kelly G. Paulson, Song Youn Park, Natalie A. Vandeven, Kristina Lachance, Hannah Thomas, et. al.. (2018). Merkel cell carcinoma: Current US incidence and projected increases based on changing demographics. Journal of the American Academy of Dermatology. 78, 457-463.e2;
- Редко, но метко: орфанные заболевания как вызов современной медицине;
- Jürgen C. Becker, Andreas Stang, Axel zur Hausen, Nicole Fischer, James A. DeCaprio, et. al.. (2018). Epidemiology, biology and therapy of Merkel cell carcinoma: conclusions from the EU project IMMOMEC. Cancer Immunol Immunother. 67, 341-351;
- Жизнь и судьба: визуализируем клеточный состав ткани;
- Kelly L. Harms, Mark A. Healy, Paul Nghiem, Arthur J. Sober, Timothy M. Johnson, et. al.. (2016). Analysis of Prognostic Factors from 9387 Merkel Cell Carcinoma Cases Forms the Basis for the New 8th Edition AJCC Staging System. Ann Surg Oncol. 23, 3564-3571;
- Почему прячут ДНК от Стинга?;
- Christopher K. Bichakjian, Lori Lowe, Christopher D. Lao, Howard M. Sandler, Carol R. Bradford, et. al.. (2007). Merkel cell carcinoma: Critical review with guidelines for multidisciplinary management. Cancer. 110, 1-12;
- Отступают, но не сдаются: что помогает опухолевым клеткам противостоять лекарственной терапии;
- Mairead Baker, Lisa Cordes, Isaac Brownell. (2018). Avelumab: a new standard for treating metastatic Merkel cell carcinoma. Expert Review of Anticancer Therapy. 18, 319-326;
- Na Xie, Guobo Shen, Wei Gao, Zhao Huang, Canhua Huang, Li Fu. (2023). Neoantigens: promising targets for cancer therapy. Sig Transduct Target Ther. 8;
- Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль;
- Почему неклеточная иммунотерапия не способна победить все виды злокачественных опухолей?;
- Paul T. Nghiem, Shailender Bhatia, Evan J. Lipson, Ragini R. Kudchadkar, Natalie J. Miller, et. al.. (2016). PD-1 Blockade with Pembrolizumab in Advanced Merkel-Cell Carcinoma. N Engl J Med. 374, 2542-2552;
- Wei Liu, Jianxin You. (2021). Merkel Cell Polyomavirus and Human Merkel Cell Carcinoma. Viruses and Human Cancer. 303-323;
- Dan Xu, Sheng Jiang, Yue He, Xiang Jin, Gan Zhao, Bin Wang. (2021). Development of a therapeutic vaccine targeting Merkel cell polyomavirus capsid protein VP1 against Merkel cell carcinoma. npj Vaccines. 6;
- Qi Zeng, Bianca P. Gomez, Raphael P. Viscidi, Shiwen Peng, Liangmei He, et. al.. (2012). Development of a DNA vaccine targeting Merkel cell polyomavirus. Vaccine. 30, 1322-1329.