Контроль качества биотехнологических продуктов
28 декабря 2018
Контроль качества биотехнологических продуктов
- 6092
- 0
- 8
Качество биотехнологических продуктов, в частности антител, отслеживается на всех этапах производства
иллюстрация Дарьи Боголюбовой-Кузнецовой
-
Автор
-
Редакторы
Заключительная статья спецпроекта о биспецифических антителах посвящена контролю качества этого класса биотехнологических продуктов. В ней рассмотрены особенности обеспечения качества антител по сравнению с молекулами, полученными путем химического синтеза, вопросы определения подлинности и чистоты, рассказано о новых подходах к контролю качества и о методах, которые при этом используются.
Биспецифические антитела

Спецпроект о биспецифических антителах, особенностях их строения, свойств, получения и применения в современной медицине.
Партнер спецпроекта — компания Cytiva, занимающаяся оснащением научно-исследовательских лабораторий, фармацевтических и биотехнологических производств приборами, расходными материалами и реактивами.
Качество лекарственных продуктов вообще и биотехнологических продуктов, которые используют как лекарственные средства, в частности — это их важнейшая характеристика, поскольку речь идет о здоровье и жизни людей. Поэтому неудивительно, что обеспечению и контролю качества уделяется первостепенное внимание в процессе производства антител, о котором мы рассказали в предыдущей статье спецпроекта о биспецифических антителах (биспецификах) [1]. Там уже говорилось, что этот процесс на всех этапах строго регламентирован. В этой статье мы подробнее обсудим методы контроля качества и современные подходы к его обеспечению.
Что такое качество лекарственного препарата?
Обеспечение качества производства биотехнологических продуктов в целом базируется на системе менеджмента качества ISO 9001. В ней качество определяется как степень соответствия совокупности присущих характеристик объекта требованиям. То есть сначала человек субъективно задает какие-то требования к объекту — продукту или процессу. А качество — это то, насколько объективные характеристики этого продукта удовлетворяют сформулированным ранее субъективным требованиям.
Что же такое фармацевтическое качество? Это пригодность действующего вещества и лекарственного препарата для своего целевого назначения. Разберем это определение. Целевое назначение лекарства — это, упрощенно говоря, популяция пациентов и болезнь, которую нужно лечить, то есть субъективная сторона в определении качества. А объективная сторона — это лекарственный продукт со всеми его характеристиками. Подлинность, дозировка и чистота — основные показатели качества лекарственного продукта, от которого, в свою очередь, ключевым образом зависят эффективность и безопасность лекарства.
Качество препарата закладывается и контролируется в ходе всей фармацевтической разработки, то есть при создании процесса производства лекарства. Это понятие неразрывно связано с препаратом уже на этапах доклинической и клинической разработки (подробнее — в статье «Наработка антител для доклинических и клинических испытаний» [1]). Так, данные доклинических и клинических исследований дают информацию о том, насколько стабильно качество продукта, и какие именно его характеристики следует контролировать в процессе производства.
Биспецифики и прочие антитела относятся к биотехнологическим продуктам, то есть веществам, полученным с помощью методов биотехнологии (в том числе и генной инженерии). Биологические продукты включают все биотехнологические плюс другие продукты биологического происхождения — клетки, белки плазмы крови и другие. Мы будем использовать термины «биологический» и «биотехнологический» как эквивалентные, потому что в рамках нашей статьи между ними существенных различий нет. Дальше мы будем говорить в основном об антителах, иногда упоминая биспецифики, но бόльшая часть информации будет относиться ко всем биотехнологическим продуктам.
Обеспечивать и контролировать качество биотехнологических продуктов гораздо сложнее, чем продуктов, полученных химическим синтезом — так называемых малых молекул (таблица). Это связано с их размерами, сложностью химической структуры и способом получения. Так, если малая молекула обладает массой 100–1000 Да , то антитело имеет массу около 150 000 Да и содержит больше тысячи аминокислотных остатков [2]. Из-за таких размеров подобные продукты получают не химическим синтезом, а в клетках — как правило, бактерий или животных. Методами генной инженерии (они описаны в статье «12 методов в картинках: генная инженерия. Часть II: инструменты и техники» [3]) в клетку вводят ген, кодирующий нужный белок, и другие генетические элементы, необходимые для продукции белка в конкретной клеточной системе. Эти манипуляции описаны в статьях «Биотехнология антител» [4] и «Разработка биспецифических антител для применения в клинике» [5]. Поскольку тонко контролировать процессы, происходящие в живых клетках, мы пока не научились, свойства получающихся продуктов варьируют, и для них требуются специальные меры обеспечения качества и свои методы контроля.
Да (дальтон) — обозначение атомной единицы массы, которое чаще применяется к макромолекулам.
По сравнению с малыми молекулами, качество биотехнологических продуктов гораздо сильнее завязано на процесс их получения. Небольшие изменения в процессе культивирования клеток могут привести, например, к изменению профиля гликозилирования белка, а это грозит снижением эффективности или появлением иммуногенности. Кроме того, биотехнологические продукты обычно менее устойчивы к воздействиям среды, чем малые молекулы, и потому требуют специальных усилий по разработке стабильного конечного продукта.
| Требования на серию активного фармацевтического ингредиента* | Низкомолекулярное соединение | Биологический продукт |
|---|---|---|
| Продолжительность производства, дни | 6 | 62 |
| Сырье, кол-во наименований | 2 | 35 |
| Внутрипроизводственные образцы, кол-во | 8 | 350 |
| Критические технологические стадии, число | <100 | >5 000 |
| Число вводимых данных | <4 000 | >60 000 |
| * — Активный фармацевтический ингредиент (лекарственная субстанция) — вещество, которое войдет в состав готового лекарственного продукта и которое оказывает фармакологический эффект. К производству и контролю качества субстанций и готовых продуктов предъявляют разные требования, но мы здесь не будем делать акцент на этих различиях. | ||
Как уже говорилось в статье «Наработка антител для доклинических и клинических испытаний» [1], разработка и производство лекарств строго регулируются законодательством. Международный совет по гармонизации технических требований к регистрации лекарственных средств для медицинского применения (The International Council for Harmonisation, ICH) разработал свод руководств, которые легли в основу европейских и американских регуляторных требований к разработке лекарств. Качеству лекарственных средств посвящена целая серия рекомендаций под буквой Q (от слова quality). Некоторые руководства применимы исключительно к биотехнологическим продуктам — например, серия ICH Q5A-Q5E, посвященная вирусной безопасности, анализу экспрессионных конструкций, проверке стабильности, описанию клеточных линий и проверке сопоставимости. А руководство ICH Q6B посвящено спецификациям биотехнологических продуктов, о которых мы дальше и поговорим.
Спецификации — это перечень испытаний, ссылок на аналитические методики и критерии приемлемости (допустимые нормы) [6]. Соответствие спецификациям — критическая часть стратегии обеспечения качества. Производитель обосновывает перечень спецификаций, опираясь на результаты доклинических и клинических исследований, а также исследований стабильности, о которых мы поговорим ниже (см. главу «Стабильность»). В ходе изучения характеристик продукта выбирают наиболее полезные параметры, критически влияющие на качество.
У биологических препаратов, в отличие от малых молекул, нет полной зависимости между их структурными и функциональными свойствами. Кроме того, аналитическими методами невозможно изучить все параметры биопрепарата, значимые с точки зрения безопасности и эффективности. Поэтому спецификация — менее универсальный инструмент обеспечения качества биопрепаратов по сравнению с малыми молекулами. Для биопрепаратов особенное значение приобретают другие элементы обеспечения качества: контроль исходных материалов, контроль сырья, но особенно — контроль критичных показателей и валидация процесса производства . Весь комплекс мер по обеспечению качества лекарственного продукта называют стратегией контроля качества (см. видео).
Валидация процесса — это документальное доказательство того, что процесс надежно приводит к желаемому результату. Подробнее разобрана в статье «Наработка антител для доклинических и клинических испытаний» [1].
Рассмотрим теперь, как именно реализуются различные стороны стратегии контроля качества и что собой представляют главные параметры биотехнологических продуктов: подлинность, чистота, иммуногенность, биологическая активность и стабильность.
Показатели качества
Подлинность
Подлинность (identity) — это характеристики вещества, отличающие его от других веществ [7]. В случае антител дело осложняется тем, что не существует единственного теста, который бы позволил определить подлинность вещества, поэтому нужно проводить сразу много тестов [8].
При аналитической характеристике белков часто вспоминают древнеиндийскую притчу о слепых мудрецах, которые ощупывали слона и спорили, потому что одному он напоминал змею, другому — сосну, третьему — стену, и так далее (рис. 1). Каждый аналитический метод дает фрагментарную информацию о свойствах продукта, но их совокупность позволяет в достаточной мере контролировать получение лекарства требуемого качества.
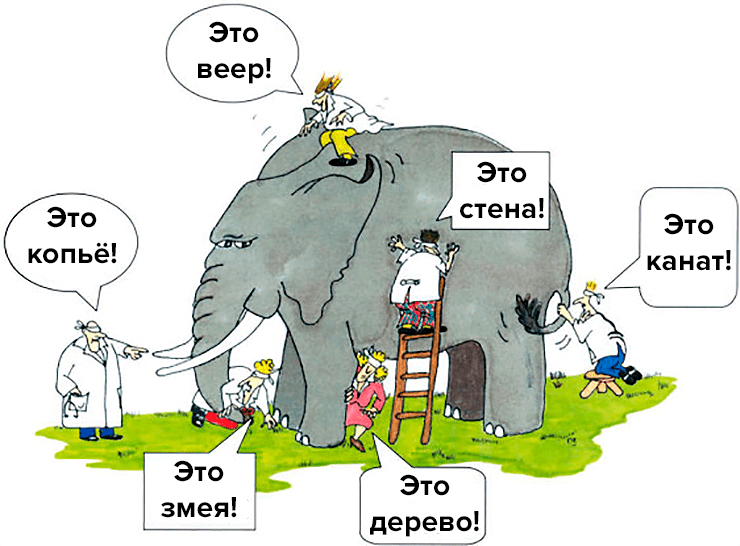
Рисунок 1. Слон и слепые мудрецы
Подлинность доказывают, изучая физико-химические свойства белка и его биологическую активность (см. главу «Биологическая активность»). В случае антител чаще всего используют такие физико-химические методы :
- колориметрические методы определения белка — например, метод Лоури, метод с бицинхониновой кислотой, метод Бредфорда (для определения общей концентрации белка) ;
- поглощение в УФ-области (для определения общей концентрации белка) [9];
- вестерн-блоттинг (для определения массы и иммунохимической подлинности) [10];
- иммуноферментный анализ, ИФА (для определения иммунохимической подлинности) [10];
- различные виды хроматографии (для определения молекулярной массы, профиля заряженных вариантов, профиля посттрансляционных модификаций и других вариантов) [11];
- масс-спектрометрию (для определения молекулярной массы, профиля гликозилирования, правильности образования дисульфидных связей) [12];
- N- и С-терминальное секвенирование [12];
- пептидное картирование (для определения первичной последовательности) [12];
- электрофорез в нативных и денатурирующих условиях (для определения массы, агрегатов, профиля гликозилирования и заряженных вариантов) [11];
- изоэлектрофокусирование (для определения заряженных вариантов) [9];
- динамическое рассеяние света (для определения гидродинамического радиуса молекулы). С использованием титрования этим методом можно определить истинную изоэлектрическую точку белка, что способствует подбору оптимальных условий стабилизации биомолекулы [13].
О большинстве перечисленных здесь методов можно прочесть в статьях спецпроекта «12 биологических методов в картинках»: «Протеомика» [12] и «Очистка молекул и разделение смесей» [11].
Колориметрические методы определения общего белка основаны на цветных реакциях белков с хромоген-образующими реактивами (восстановление меди при взаимодействии с пептидными связями и ее реакция с реактивом Фолина в методе Лоури или с бицинхониновой кислотой) или на неспецифическом связывании красителя (кумасси с аргинином и гидрофобными кислотами в методе Бредфорда).
ИФА (ELISA, enzyme-linked immunosorbent assay) подробно описан в статье того же спецпроекта «Иммунологические технологии» [10].
Подлинность определяют на всех стадиях фармацевтической разработки, а часть методов используют для рутинного контроля серий при коммерческом производстве.
Чистота
При получении биофармацевтического препарата невозможно полностью удалить все примеси, поэтому их нужно тщательно охарактеризовать. Кроме того, важно доказать, что они не влияют на профиль эффективности и безопасности препарата.
Примеси могут быть как вариантами целевого продукта (образовавшимися в ходе его производства или деградации), так и веществами, привнесенными в процессе производства и очистки. Например, в случае антител обязательно контролируют наличие белка А, который используется на первой стадии очистки (см. статью «Биотехнология антител» [4]).
Не менее важно контролировать отсутствие вирусов и других патогенов. Их обнаружение в образце может привести к закрытию производства на 1–2 года, пока не будет проведена полная дезинфекция помещений и оборудования [6].
Клетки млекопитающих, в которых обычно производят антитела, как правило, содержат эндогенные ретровирусы. К тому же, вирусы могут попасть в препарат из внешней среды в процессе производства. Поэтому вирусная безопасность обеспечивается тремя способами [14]:
- проверкой исходных материалов на наличие вирусов;
- валидацией процесса производства на способность снижать количество вирусных частиц;
- тестированием продукта на наличие вирусов на разных стадиях производства.
Как было рассказано в статье «Наработка антител для доклинических и клинических испытаний» [1], очистку от вирусов или их инактивацию производят с помощью хроматографии, химической инактивации (детергентами, кислотами) и фильтрации. Регуляторные требования устанавливают предельное содержание вирусов на уровне не более одной частицы на миллион доз. Как правило, для этого необходимо снижать суммарное содержание вирусных частиц на 12–18 порядков. Контроль качества вирусной очистки проводят так: перед очередным этапом к промежуточному продукту добавляют вирусные частицы в известной концентрации. После очистки определяют остаточную концентрацию вируса и рассчитывают, на сколько порядков она снизилась [15]. Для такого исследования выбирают около десятка вирусов, которые с высокой вероятностью могут оказаться в продукте. Общее снижение подсчитывают, суммируя снижения на каждом этапе [14].
Агрегаты — еще одна примесь, которую обязательно контролируют в ходе производства антител. В одном из исследований было показано, что биспецифики более склонны к агрегации, чем антитела, на основе которых они получены. Однако предотвратить образование агрегатов можно введением в структуру биспецифика дополнительной дисульфидной связи (рис. 4).
Чаще всего для определения чистоты используют следующие методы:
- эксклюзионную хроматографию (для определения агрегатов, продуктов расщепления);
- капиллярный электрофорез (для определения низкомолекулярных продуктов деградации, продуктов химической модификации белка);
- пептидное картирование (для определения химических изменений в аминокислотном составе);
- хроматография высокого разрешения — обращенно-фазовая, гель-фильтрация, ионообменная, аффинная и др. (для определения прочих белковых и низкомолекулярных примесей).
Иммуногенность
Иммуногенность — это способность введенного терапевтического агента вызывать иммунный ответ. Поскольку, как рассказано в статье «Антитело: лучший способ распознать чужого» [16], антительный иммунный ответ чаще всего возникает после введения белков, в том числе других антител, при разработке биотехнологических продуктов иммуногенности уделяется особое внимание.
Иммуногенность может влиять как на безопасность, так и на эффективность терапевтических антител. Введение чужеродного белка может вызвать такие тяжелые побочные эффекты, как анафилактический шок (острая аллергическая реакция) и цитокиновый шторм , которые порой приводили к смерти людей в клинических исследованиях нового лекарства [17], [18]. Эффективность биопрепарата может снижаться вследствие выработки антилекарственных антител (ADA, antidrug antibodies). ADA могут ухудшить фармакокинетические свойства препарата, например, сильно ускоряя его выведение из организма. Также ADA могут препятствовать связыванию препарата с мишенью, например, блокируя вариабельный домен терапевтического антитела (рис. 6). Такие антитела называют нейтрализующими.
Цитокиновый шторм (синдром выброса цитокинов) — системная воспалительная реакция, которая обусловлена массированной активацией клеток иммунной системы, ведущей к повышению уровня провоспалительных цитокинов (сигнальных молекул иммунной системы) и возникновению множества побочных реакций.
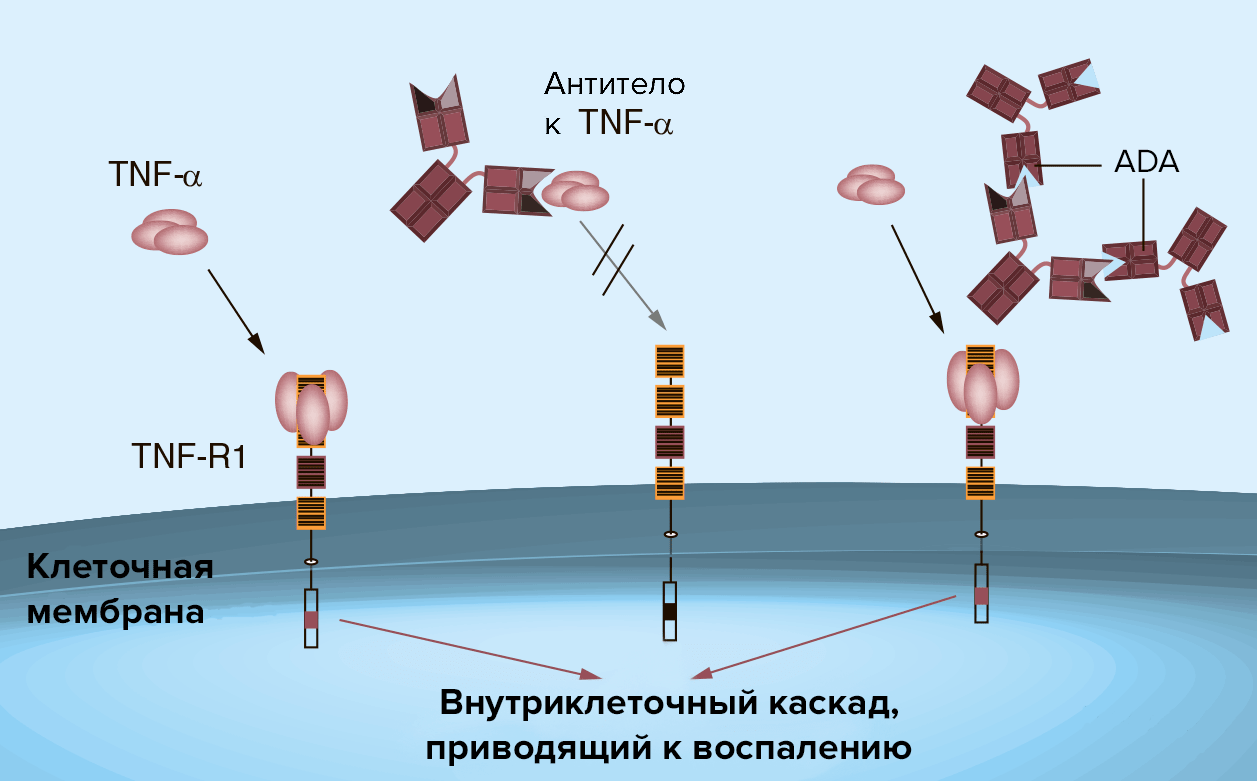
Рисунок 6. Нейтрализация терапевтического антитела антилекарственным антителом (ADA). Слева — провоспалительный цитокин TNF-α связывается со своим рецептором TNF-R1 и стимулирует воспаление. В центре — терапевтическое антитело связывается с TNF-α, препятствует его взаимодействию с рецептором и снижает воспаление. Справа — ADA связывается с антигенраспознающим участком антитела, и TNF-α получает возможность связаться со своим рецептором и индуцировать воспаление.
В статье «Биотехнология антител» [4] уже говорилось о том, что высокая иммуногенность мышиных терапевтических моноклональных антител привела к разработке химерных, гуманизированных и полностью человеческих антител. Хотя последние три варианта в целом менее иммуногенны, ADA вырабатываются и при их применении [19]. Биспецифики в целом более иммуногенны, чем обычные антитела, потому что новые структуры, полученные методами генной инженерии, могут спровоцировать образование иммуногенных эпитопов [19]. Часть проблем можно устранить еще на этапе проектирования первичной структуры нового продукта: сейчас существуют вычислительные методы, позволяющие предсказать иммуногенность определенных пептидов [20]. Однако эти методы не всегда дают правильный результат, поэтому обязательный элемент разработки нового биотехнологического продукта — его тестирование на способность вызывать образование ADA.
Существенный вклад в иммуногенность могут вносить посттрансляционные модификации, особенно гликозилирование белков, химические модификации [21], а также образование агрегатов [17].
Стόит оговориться, что иммуногенность зависит не только от свойств самогό продукта, но и от человека, которому его вводят, и, вообще говоря, заранее невозможно предсказать, будет ли у пациента реакция на конкретный белок.
Наиболее распространенные методы измерения ADA — различные модификации иммуноферментного анализа. Изучаемое терапевтическое антитело иммобилизуют (прикрепляют к неподвижному носителю) в лунках планшета, затем добавляют туда сыворотку крови животного или пациента, которому до этого вводили препарат. Если в сыворотке есть ADA, они свяжутся с иммобилизованным продуктом. Затем лунки отмывают для удаления несвязавшихся ADA и добавляют меченое антитело, которое будет связываться с Fc-фрагментом ADA (рис. 7).
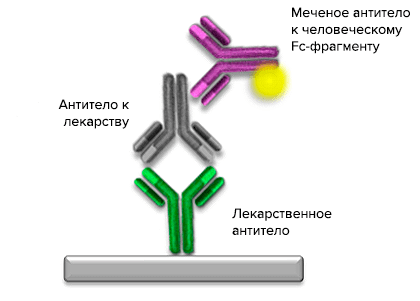
Рисунок 7. Схема ИФА для определения ADA в сыворотке крови
Если ADA были обнаружены, переходят к определению их нейтрализующей способности. Для этого исследуют, насколько они влияют на биологическую активность продукта [22]. Эти эксперименты мы рассмотрим в следующем разделе.
Проявление иммуногенности, особенно не у всех пациентов, не обязательно грозит закрытием проекта. Если ADA не нейтрализующие, не влияют на фармакокинетику и вообще никак не сказываются на эффективности и безопасности лекарства, его вполне можно применять дальше.
Биологическая активность
Биологическая активность (potency) — один из ключевых атрибутов качества, отражающий способность продукта воздействовать на мишень и вызывать нужный эффект. Поэтому для каждого антитела аналитические методики создаются индивидуально.
Хорошая методика определения биоактивности дает результаты, коррелирующие с клиническим действием лекарства, то есть позволяет сразу оценить эффективность, безопасность и качество продукта.
Методик, как правило, применяют несколько, потому что у антитела несколько механизмов действия [23]. Так, связываясь с мишенью на разных клетках, антитело может запускать разные каскады событий, а связывание антитела с молекулами иммунной системы опосредует различные эффекторные механизмы [24].
Для определения биологической активности антител изучают следующие характеристики или процессы:
- ADCC, CDC и другие эффекторные свойства;
- связывание с молекулами-мишенями человека и других видов животных;
- связывание с близкими белками, не являющимися мишенью (для доказательства селективности связывания с мишенью);
- специфические клеточные события, демонстрирующие механизм действия антитела.
Об ADCC (antibody-dependent cellular cytotoxicity, антителозависимой цитотоксичности) и CDC (complement-dependent cytotoxicity, комплементзависимой цитотоксичности) рассказано в предыдущих статьях спецпроекта: «Биспецифические антитела, их мишени и перспективы применения в современной медицине» [24] и «Биотехнология антител» [4]. Вкратце — это механизмы действия антител, позволяющие иммунной системе уничтожать клетки, несущие рецептор-мишень [23].
Для изучения ADCC в лунку планшета помещают клетки, экспрессирующие мишень (как правило, это наиболее чувствительная клеточная линия, на поверхности клеток которой очень много молекул мишени) и измеряют их количество. Добавляют эффекторные клетки, в данном случае NK (естественные киллеры), и изучаемое антитело. Если антитело работает, то через 1–2 часа NK уничтожают часть клеток с мишенью, что и детектируется.
Другой метод используют для антител, основной функцией которых является блокирование взаимодействия мишени с лигандом. К таким антителам относятся, например, ингибиторы молекул иммунологических чекпойнтов (например, PD-1/PD-L1, CTLA-4), которые раковые клетки используют в своих интересах, чтобы защититься от уничтожения лимфоцитами [25]. Т-лимфоциты, несущие PD-1, смешивают с опухолевыми клетками с лигандом PD-L1 на поверхности. Т-клеточный рецептор (TCR) на поверхности Т-лимфоцита распознает чужеродные антигены на поверхности раковой клетки, но взаимодействие между PD-1 и PD-L1 подавляет активацию Т-лимфоцитов. При добавлении антитела, блокирующего взаимодействие PD-1 и PD-L1, ТCR активируется и передает сигнал внутрь Т-лимфоцита, где запускается синтез люциферазы. Ее детектируют с помощью чувствительных люминесцентных методов (рис. 9).
За изучение биологии молекул иммунологических чекпойнтов Джеймсу П. Эллисону и Тасуку Хондзё была вручена Нобелевская премия по физиологии или медицине 2018 года. Об этом можно прочитать в нашей статье «Иммунитет без тормозов: Нобелевская премия за антитела против рака» [26]. — Ред.
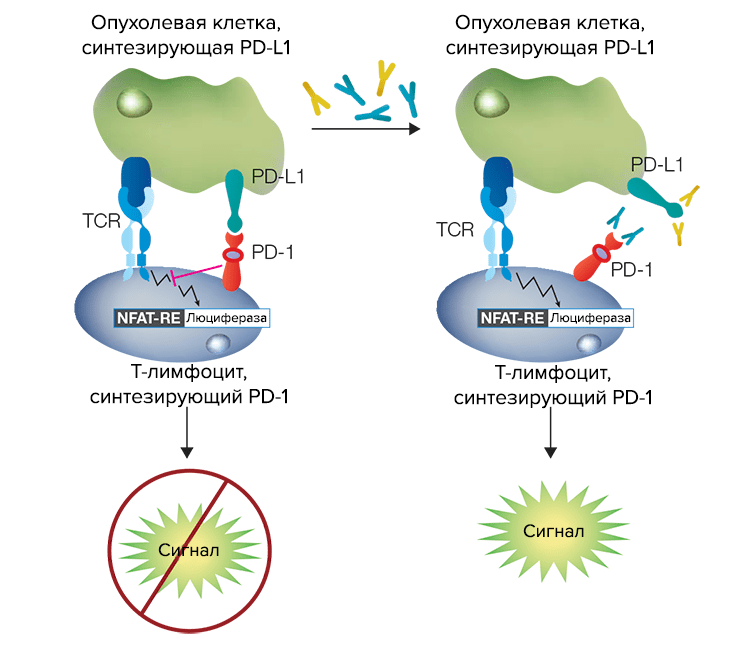
Рисунок 9. Принцип работы клеточного теста на биологическую активность антител против PD-1 и PD-L1. Когда антител нет (слева), взаимодействие между PD-L1 на опухолевой клетке (зеленая) и PD-1 на Т-лимфоците (синий) подавляет сигнал, идущий от TCR внутрь клетки. Люцифераза не производится, и потому люминесценции нет. При добавлении антител против PD-1 (темно-зеленые) или PD-L1 (желтые) взаимодействие между PD-1 и PD-L1 блокируется, и сигнал от TCR вызывает связывание белка NFAT с промотором гена люциферазы. Появление люциферазы детектируется с помощью люминометра.
Поскольку биологическая активность изучается в живых системах — клетках, культурах тканей или организмах животных, — получаемые результаты всегда вариабельны. Тем не менее аналитические методики для определения активности должны быть надежными, воспроизводимыми и точными. Поэтому разработка методик определения активности начинается вместе с разработкой продукта и продолжается до начала фазы III клинических исследований [18], [27]. Активность измеряется в ходе всей разработки продукта, в исследованиях стабильности и сопоставимости, а также после выхода на рынок для контроля серий.
Стабильность
Сохранение качества препарата в течение всего срока хранения, то есть его стабильность, — одна из важнейших задач, решаемых в ходе разработки лекарства. Биологические препараты более «капризны», чем малые молекулы: они могут быть чувствительны к свету, механическому стрессу (поэтому для биопрепаратов обязательна аттестация условий транспортировки [28]), колебаниям температуры и другим воздействиям.
Существует пять основных механизмов деградации антител [9]:
- химическая деградация аминокислот — например, их окисление или дезаминирование ;
- фрагментация — разрыв аминокислотной цепи;
- денатурация третичной структуры — разрыв связей, отвечающих за правильное сворачивание цепи;
- агрегация — формирование димеров, тримеров и так далее;
- адгезия — взаимодействие с поверхностями флаконов, пробирок и т. п.
Дезаминирование — гидролиз боковой цепи остатков аспарагина или глутамина, приводящий к их превращению в остатки аспарагиновой или глутаминовой кислоты.
Результаты исследования стабильности дают информацию о том, как хранение при определенных условиях влияет на критические параметры качества. В ходе исследования определяют пути деградации биологического продукта и условия его хранения [9].
В отличие от малых молекул, для биопрепаратов нельзя экстраполировать результаты ускоренного эксперимента по определению стабильности на более длительный срок хранения. То есть недопустимо на основании исследования стабильности в течение месяца при 40 °С делать вывод о стабильности в течение шести месяцев при комнатной температуре. Для биопрепаратов регистрация возможна только после предоставления результатов экспериментов по изучению стабильности в реальных условиях в течение всего срока хранения. А ускоренные эксперименты можно проводить только в рамках изучения механизмов деградации, при подборе формуляции, то есть для отработки условий долговременного эксперимента [29].
Оценка стабильности препаратов антител обязательно включает в себя изучение подлинности, чистоты (особенно продуктов деградации) и биологической активности в течение минимум шести месяцев. Для оценки подлинности и чистоты применяют методы, описанные выше. Обязательно контролируют внешний вид продукта: цвет, прозрачность растворов, наличие агрегатов, рН; для порошков — цвет, текстуру, влажность, время растворения [28].
Quality by Design
Наиболее современный подход к обеспечению качества фармацевтических продуктов, включая антитела, — Quality by Design (QbD), то есть «качество на этапе разработки», или «проектирование качества» (рис. 11). Как видно из рисунка, ключевые черты QbD — характеристики процесса и продукта и постоянное совершенствование их качества по мере получения новых данных в ходе разработки и после выхода продукта на рынок. В рамках этой парадигмы для продукта создается целевой профиль его качества (quality target product profile, QTPP), который включает в себя описание целевого показания, популяции пациентов, способа введения, методов производства и прочих аспектов, влияющих на качество.
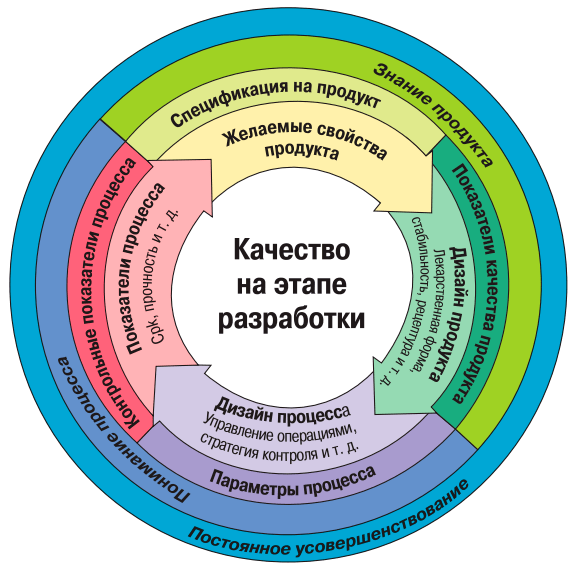
Рисунок 11. Парадигма Quality by Design
Исходя из QTPP, каждому параметру процесса и показателю продукта приписывается уровень риска влияния на качество. Параметры с высоким риском становятся критическими (critical quality attributes, CQA). Многомерная комбинация и взаимосвязь входящих переменных (например, свойств материалов) и параметров процесса, которая должна демонстрировать подтверждение качества, называется проектируемым полем (design space). Пока значения переменных не выходят из проектируемого поля, считается, что продукт не изменился, а значит, не нужно проводить сравнительные исследования для доказательства сопоставимости новой и старой версий продукта (ICH Q8 R2).
На основе проектируемого поля определяют стратегию контроля качества препарата и внедряют систему постоянного совершенствования качества. Стратегия контроля качества служит для того, чтобы минимизировать риски ненадлежащего качества, снизить влияние вариабельности характеристик исходных материалов и параметров производства на качество и в конечном итоге добиться для продукта соответствия своему целевому профилю. Конечно, по мере накопления сведений о продукте в ходе разработки, его QTPP и стратегия контроля качества изменяются [30].
Понятно, что из-за огромного числа параметров биологических продуктов, внедрение принципов QbD в их разработку началось позже, чем для малых молекул. Первым биопродуктом, который получил одобрение FDA в парадигме QbD в 2014 году, стало антитело обинутузумаб (Roche) против мишени CD20, разработанное для лечения ряда хронических лимфоцитарных лейкозов [31]. Внедрение парадигмы QbD в разработку биопрепаратов только начинается, и, скорее всего, за этим подходом будущее.
Заключение
Контроль качества обычных антител, биспецификов и других биологических продуктов — активно развивающаяся область биомедицинской технологии. Сейчас тем, кто приступает к разработке нового продукта, рекомендуется заранее продумывать стратегию контроля его качества. Целевой профиль качества продукта желательно формировать даже до того, как выбран кандидат, который станет этим продуктом. Такое заблаговременное планирование помогает избежать дорогостоящих ошибок в будущем и снизить риски провала при разработке лекарства [20].
Внимание к вопросам качества растет по мере появления в разработке и на рынке биоаналогичных препаратов (biosimilars). Биоаналоги выходят на рынок, когда заканчивается срок действия патентов на оригинальные препараты. Как уже говорилось в статье «Наработка антител для доклинических и клинических испытаний» [1], для биологических препаратов в силу их сложности невозможно создать точную химическую копию, как это делается в случае дженериков малых молекул. При разработке биоаналогов полагаются не на спецификацию, а на описание процесса, продукта и доказательство прямой сопоставимости с оригинальным препаратом в доклинических и клинических исследованиях. Поскольку именно качество препарата критическим образом влияет на его эффективность и безопасность, при разработке биоаналога требуется полное установление характеристик новой молекулы, описанных в нашей статье (см. видео).
Дженерик — воспроизведенный лекарственный препарат. Этот термин относится к препаратам, полученным путем химического синтеза (малым молекулам). Дженерик представляет собой копию оригинального препарата и может продаваться после того, как истек срок патентной защиты на оригинальный препарат.
Литература
- Наработка антител для доклинических и клинических испытаний;
- Ebbers H.C. (2012). Biopharmaceuticals as challenges to the regulatory system. Utrecht University;
- 12 методов в картинках: генная инженерия. Часть II: инструменты и техники;
- Биотехнология антител;
- Разработка биспецифических антител для применения в клинике;
- John Abraham. (). International Conference On Harmonisation Of Technical Requirements For Registration Of Pharmaceuticals For Human Use. Handbook of Transnational Economic Governance Regimes. 1041-1054;
- Васильев А.Н., Реутская Л.А., Байдуллаева Ш.А., Горячев Д.В., Гавришина Е.В., Ниязов Р.Р. (2014). Качество лекарственных препаратов. Суть вопроса и зарубежный опыт. «Ремедиум»;
- C Jane Robinson, Christopher Jones. (2011). Quality control and analytical techniques for biopharmaceuticals. Bioanalysis. 3, 81-95;
- Rios M. (2015). Special report on product stability testing: developing methods for new biologics and emerging markets. BioProcess International;
- 12 методов в картинках: иммунологические технологии;
- 12 методов в картинках: очистка молекул и разделение смесей;
- 12 методов в картинках: протеомика;
- McNeil-Watson F. and Kaszuba M. (2010). A novel method for measuring zeta potential of high-concentration, low-volume protein samples. American Laboratory;
- Guideline on virus safety evaluation of biotechnological investigational medicinal products. (2006). EMA;
- DePalma A. (2017). Viral safety in monoclonal antibody manufacturing. Genetic Engineering and Biotechnology News;
- Антитело: лучший способ распознать чужого;
- Anshu Kuriakose, Narendra Chirmule, Pradip Nair. (2016). Immunogenicity of Biotherapeutics: Causes and Association with Posttranslational Modifications. Journal of Immunology Research. 2016, 1-18;
- С миру по нитке: как соединились компоненты клинического исследования;
- Immunogenicity assessment for therapeutic protein products. (2014). FDA;
- Jesús Zurdo, Andreas Arnell, Olga Obrezanova, Noel Smith, Ramón Gómez de la Cuesta, et. al.. (2015). Early Implementation of QbD in Biopharmaceutical Development: A Practical Example. BioMed Research International. 2015, 1-19;
- Miranda M. C. van Beers, Muriel Bardor. (2012). Minimizing immunogenicity of biopharmaceuticals by controlling critical quality attributes of proteins. Biotechnology Journal. 7, 1473-1484;
- Ivana Knezevic, Hye-Na Kang, Robin Thorpe. (2015). Immunogenicity assessment of monoclonal antibody products: A simulated case study correlating antibody induction with clinical outcomes. Biologicals. 43, 307-317;
- Herbrand U. (2017). Evolving bioassay strategies for therapeutic antibodies: essential information for proving biosimilarity. BioProcess International;
- Биспецифические антитела, их мишени и перспективы применения в современной медицине;
- Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль;
- Иммунитет без тормозов: Нобелевская премия за антитела против рака (2018);
- Shi J. and McKee M. (2015). Building a robuts bioassay for product potency. BioProcess International;
- Quality of biotechnological products: stability testing of biotechnological/biological products. (1996). FDA;
- Oldcorne M. and Weir P. The stability of monoclonal antibodies (MABs). Health in Wales;
- Quality by design: control strategy. (2012). Slideshare.net;
- 1st QbD approval for biologics: Gazyva design space. (2014). QbD Works;
- Jonathan Himmelfarb, Peter Stenvinkel, T. Alp Ikizler, Raymond M. Hakim. (2002). The elephant in uremia: Oxidant stress as a unifying concept of cardiovascular disease in uremia. Kidney International. 62, 1524-1538;
- Jürgen Schanzer, Andreas Jekle, Junichi Nezu, Adriane Lochner, Rebecca Croasdale, et. al.. (2011). Development of Tetravalent, Bispecific CCR5 Antibodies with Antiviral Activity against CCR5 Monoclonal Antibody-Resistant HIV-1 Strains. Antimicrob. Agents Chemother.. 55, 2369-2378;
- Klaus Bendtzen. (2012). Anti-TNF-α biotherapies: perspectives for evidence-based personalized medicine. Immunotherapy. 4, 1167-1179;
- How anti-idiotypic antibodies are essential to drug discovery. (2018). GenScript;
- Гай А. (2012). Качество на этапе разработки Quality by Design (QbD) для вспомогательных веществ. «Фармацевтическая отрасль». 3, 60–64.