
Не телемедициной единой. Как цифровизация повлияла на рынок лекарственных средств
26 марта 2025
Не телемедициной единой. Как цифровизация повлияла на рынок лекарственных средств
- 141
- 0
- 0
Телевизионные сеансы Чумакова с «зарядом» целебной воды через экраны телевизора, которые транслировалась в конце 1980-х и начале 1990-х гг. Шарлатанство с примесью телемедицины, ну а как по-другому в период перестройки?
Рисунок в полном размере.
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: В настоящее время происходит цифровизация всех сфер нашей жизни, это явление не обошло стороной и фармацевтические компании. В рамках гармонизации и создания безбарьерной среды для торговли лекарственными средствами в странах-участниках ЕАЭС (Евразийский экономический союз) в силу вступило изменение в правилах регистрации и экспертизы лекарственных средств. В этом документе говорится о необходимости перехода составления регистрационного досье от национальных программ к общим правилам, установленным ЕАЭС, к концу 2025 года. То есть производителям лекарственного средства не нужно будет изучать национальные программы регистрации отдельных стран и составлять несколько таких досье. Подробности этого перехода мы опустим, так как это тема не для одной статьи, но осветим некоторые пункты, которые касаются цифровизации: какие решения существуют на данный момент, как они регулируются и интегрируются в практику при разработке и регистрации ЛС (лекарственных средств). Мы постарались подробно рассказать о нескольких успешных мировых и отечественных кейсах в рамках данной статьи.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в номинации «Академия & Бизнес» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса и партнер номинации — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Что же такое цифровизация биомедицины и биофармацевтики?
Цифровая биомедицина и биофармацевтика — это относительно новые направления в науке, появившиеся в связи с развитием цифровых инструментов, данных и технологий для модернизации и оптимизации процессов, связанных с разработкой и применением ЛС в практике. В целом, это довольно молодая область, активный толчок развития которой пришелся на времена COVID-19, по известным всем причинам. В настоящее время открываются новые направления подготовки по этим специальностям в зарубежных и отечественных вузах. Но у многих людей отсутствует понимание, что это вообще за сферы, с чем они связаны и как мы сталкиваемся с ними уже сегодня.
Если начать искать в интернете подробнее про эти отрасли, в первую очередь вам расскажут про ключевые направления именно биомедицины, а точнее, про новые переносимые устройства (фитнес-браслеты, смарт-часы и т. д.), телемедицину и платформы для взаимодействия «врач-пациент». Но это будет лишь верхушка айсберга в сфере применения цифровых технологий. Поэтому мы и захотели немного подробнее погрузить вас в мир digital и в то, как он помогает развиваться медицинским и фармацевтическим компаниям, а заодно спасать жизни людей.
Для более точного понимания процесса цифровизации нужно понять, как она вообще происходит и какие этапы существуют в этом процессе [2]. Само по себе внедрение IT-технологий происходит через несколько стадий (табл. 1):
- Информатизация — автоматизация задач и процессов с помощью ЭВМ и перевод всей деятельности или отдельных ее этапов в электронный вид.
- Цифровая трансформация — внедрение современных технологий в бизнес-процессы, которое подразумевает фундаментальные изменения в подходах к управлению процессами на основе данных и, при возможности, их автоматизацию. Сама по себе цифровая трансформация — это перевод информационных взаимодействий между участниками в цифровую среду для повышения эффективности и снижения расходов.
- Цифровизация — внедрение цифровых технологий в бизнес-модели с применением новейших технологий, таких как искусственный интеллект (ИИ), big data, машинное обучение, блокчейн.
На практике цифровая трансформация проходит постепенно, переходя от одного варианта информационного обмена и применяемых технологий к другим, более сложным и автоматизированным технологиям.
| Уровень | 1 уровень | 2 уровень | 3 уровень | 4 уровень |
|---|---|---|---|---|
| Описание | Дублирование бумажных документов их электронными образами | Передача в цифровой форме параллельно с бумажными документами в информационной среде | Данные передаются в виде электронных документов, подписанных электронной цифровой подписью. Исключение бумажных документов | Формирование первичных данных происходит в цифровой форме, и они передаются между участниками согласно уровню их доступа |
| Типы ПО | Текстовые процессоры, электронная почта | Специализированные профильные программы | Системы подписания документов, специализированные профильные системы | Распределительные системы на основе блокчейн-технологий, единые порталы информационного обмена данных |
Современные компании и лаборатории осознают преимущества, которые оцифровка может принести в их работу. Она улучшает процесс управления данными, предоставляя централизованную платформу для хранения, доступа и анализа информации, что обеспечивает эффективный обмен данными между подразделениями и ускоряет процесс исследования. Автоматизация ручных задач и оптимизация рабочих процессов сокращает человеческие ошибки, повышает производительность и освобождает время исследователей. Более того, оцифровка создает возможность мониторинга в реальном времени, что приводит к улучшению контроля качества. Оцифровка повышает соответствие и прослеживаемость за счет ведения всеобъемлющих записей и контроля журналов [2].
Через что проходят биофармацевтические продукты?
Лекарственное средство проходит ряд этапов от начала его разработки до момента снятия с продажи. Этот процесс называется жизненным циклом ЛС (ЖЦЛС) и может охватывать несколько десятков лет. Чтобы завершить весь процесс клинических испытаний и получить одобрение регулятора, разработчик должен планировать потратить в среднем от 100 миллионов долларов за успешный вывод нового лекарственного средства на рынок, а при учете неудач и различных издержек стоимость может сильно увеличиться [3]. Основная задача этапа разработки заключается в обнаружении новых соединений, способных оказать желаемое воздействие на человеческий организм, а также в оценке их качества, безопасности и эффективности для лечения пациентов [4–7].
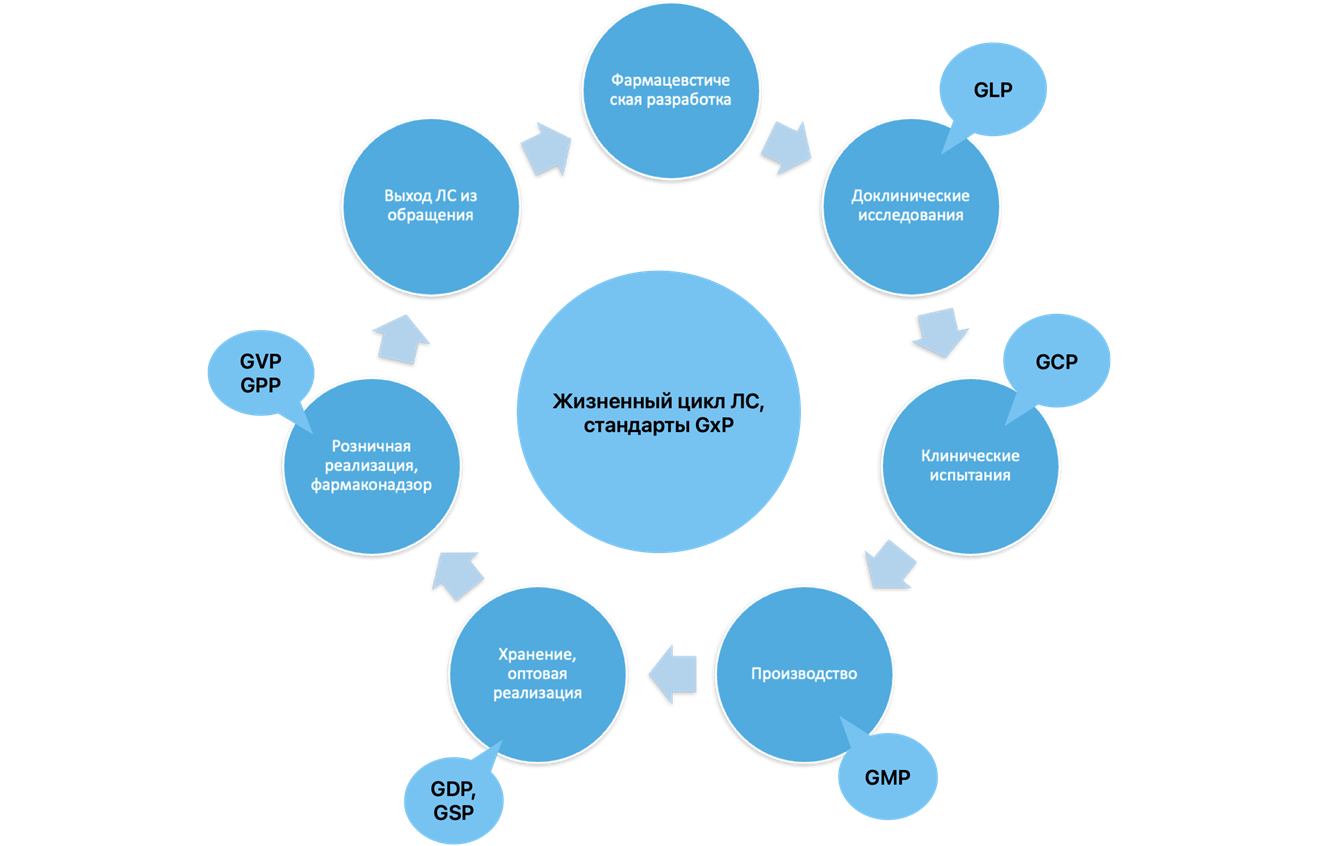
Рисунок 1. Схематическое представление жизненного цикла лекарственных средств. GxP — Good ... Practice (Надлежащая ... Практика); GLP — Good Laboratory Practice (Лабораторная); GCP — Good Clinical Practice (Клиническая); GMP — Good Manufacturing Practice (Производственная); GDP — Good Distribution Practice (Оптовая продажа); GSP — Good Service Practice (Обслуживание); GVP — Good Pharmacovigilance Practice (Фармаконадзорная); GPP — Good Participatory Practice (Розничная продажа).
рисунок авторов
Начинается ЖЦ с одного из самых длительных и затратных этапов — с научно-исследовательской разработки [5], [7]. На этой стадии осуществляется поиск состава ЛП, определение биологической активности и начинается разработка технологии производства. На этом этапе происходят доклинические исследования in vitro и in vivo, которые регулируются правилами Надлежащей лабораторной практики (GLP). Как правило, такие исследования проводятся на животных с целью выявления наиболее перспективных кандидатов, разработки лучших методов масштабирования лекарств, поиска оптимальных формуляций и выполнения регуляторных требований по данным о безопасности и эффективности, прежде чем эти соединения получат разрешение на переход к клиническим испытаниям на людях [8], [9]. Далее подается заявка на проведение клинических испытаний (КИ), которые в свою очередь регламентируются надлежащей клинической практикой (GCP). В случае одобрения заявки препарат должен будет пройти три фазы клинических испытаний (в типичном случае; на практике возможны разные варианты) [10].
В случае успешного завершения клинических испытаний лекарственное средство подлежит рассмотрению и одобрению регулирующими органами. Если оно получает одобрение, его вносят в реестр лекарств и выпускают на рынок. Менее, чем одно из тысячи соединений, обладающее каким-либо потенциалом, проходит все этапы исследований и попадает в продажу [11]. Исследование, опубликованное Массачусетским технологическим институтом, показало, что только 13,8% ЛС, начавших клинические испытания, успешно проходят их [12]. Примерно 7 из 8 препаратов проваливаются на стадиях КИ, особенно на II и III фазах. Причины могут быть разные, например, неэффективность препарата, нежелательные побочные реакции, регуляторные проблемы или необходимость дополнительных исследований. Из-за всего этого компании-разработчики получают большие убытки, так как сами по себе эти исследования очень дорогие (к примеру, средняя стоимость КИ в США составляет 100–200 млн долларов): потеря инвестиций, задержка выхода на рынок, падение акций. В связи с этим идет активное внедрение цифровых технологий в разработку ЛС, так как они помогают снизить стоимость разработки, ускорить процессы и повысить точность исследований. Например, недавнее исследование показало увеличение чистой финансовой выгоды для компаний при использовании цифровых конечных точек эксперимента в рамках КИ [13].
Далее лекарственное средство производится в промышленных масштабах и выпускается на рынок. По оценкам специалистов, задержка выхода ЛП на рынок всего лишь на один день оборачивается для фармацевтической компании потерями порядка 1 млн долларов. Надлежащая производственная практика (GMP) регулирует производство, упаковку, маркировку и логистику поставок [14]. Соблюдение условий хранения и транспортировки установлено Надлежащей практикой хранения (GSP), а оптовую реализацию ЛС регламентирует Надлежащая дистрибьюторская практика (GDP) [15]. Клинические испытания дают важную информацию об эффективности и безопасности препарата, но полную картину безопасности можно увидеть спустя несколько месяцев или даже лет после поступления в продажу (этому посвящен спецпроект «Биомолекулы» «Постклиника»).
На следующей ступени лекарственное средство становится доступным для пациентов и медицинских учреждений для лечения и профилактики заболеваний. Розничная реализация регулируется Надлежащей аптечной практикой (GPP) [16].
На каждом из этих этапов ЖЦЛС допустимо применение информационных технологий, и все чаще многие лаборатории и компании приходят к тому, что автоматизация процессов с помощью ИТ-технологий снижает затраты и повышает эффективность работы. Но проблема состоит в том, что каждый из этих этапов использует свое информационное сопровождение, не связанное с последующими стадиями ЖЦЛС, и отсутствует связь между этими ступенями для более быстрой передачи данных и отслеживания всех этапов [17]. Существует острая необходимость в создании единого информационного пространства между этапами ЖЦЛС, единые информационные системы, которые могли бы использоваться или хотя бы были совместимы для каждого звена разработки ЛС. Все это может упростить передачу данных и их отслеживаемость со стороны компаний-разработчиков и регулятора, ускорить процесс регистрации ЛС и уменьшить количество фальсификаций, как на этапе составления регистрационного досье, так и при реализации ЛС [2], [18], [19].
Самый важный и трудоемкий этап в регистрации ЛС — это составление общего технического документа. Общий технический документ (Common Technical Document, CTD) — это международный формат заявки на регистрацию нового лекарственного средства, предназначенный для подачи в регуляторный орган с целью выпуска ЛС на рынок. CTD разделен на 5 модулей, представленных на рисунке 2:
- Документация административного характера и инструкция по медицинскому применению.
- Обзор и резюме модулей 3–5.
- Фармацевтическая документация (производство, упаковка, хранение и т. д.).
- Результаты доклинических исследований (фармакодинамика, фармакокинетика, токсикология).
- Результаты клинических испытаний (эффективность и безопасность).
Органы регистрации ЛС стран ЕС, США и Японии согласовали единый формат CTD для подготовки заявок в рамках ICH (International Council on Harmonisation, Международный совет по гармонизации). В России общий технический документ введен Федеральным законом №429-Ф3 от 22.12.2014 года п.22.1. Тут важно отметить, что CTD ICH и его российский аналог являются структурно схожими, но не взаимозаменяемыми, так как CTD, составленный по стандартам РФ, не будет принят странами, принимающими CTD по стандартам ICH.
Но почему же этот CTD интересен нам в свете цифровизации биомедицинской и биофармацевтической промышленности? Дело в том, что многие страны, о которых мы говорили чуть выше, еще в 2002 году начали разработку электронного варианта подачи этой самой заявки. Это должно было упростить множество неудобств бумажного варианта заявки. Например, легкость рецензирования документов и использования гиперссылок для удобства работы с информацией, идентификация различных правок, отслеживание жизненного цикла продукта, возможность одновременного доступа к документам. Одно из весомых преимуществ (не только в плане значения, но и в физическом смысле этого слова) — отсутствие необходимости хранения бумажных версий всех документов. Работа над созданием eCTD была очень долгой, выпускались различные версии, и к 2015 году был выпущен проект руководства по внедрению eCTD. Страны ЕС, США и Япония в 2015 начали вводить руководства по использованию этого формата подачи заявок, и к 2017 году во всех этих странах для регистрации новых ЛС необходимо составление электронной версии CTD. В Китае также с 2017 года начался переход на eCTD и разработка своих стандартов по составлению eCTD [20]. В России и странах ЕАЭС только начинают развиваться регулирующие стандарты по составлению eCTD, так, по решению совета ЕЭК от 20 октября 2023 года № 114 «О внесении изменений в Правила регистрации и экспертизы лекарственных средств для медицинского применения», в правила регистрации и экспертизы ЛС от 3 ноября 2016 года № 78 для стран ЕАЭС внесены требования по составлению регистрационного досье в формате общего технического документа, в котором указана возможность подачи электронной версии регистрационного досье в странах, где такая возможность существует.
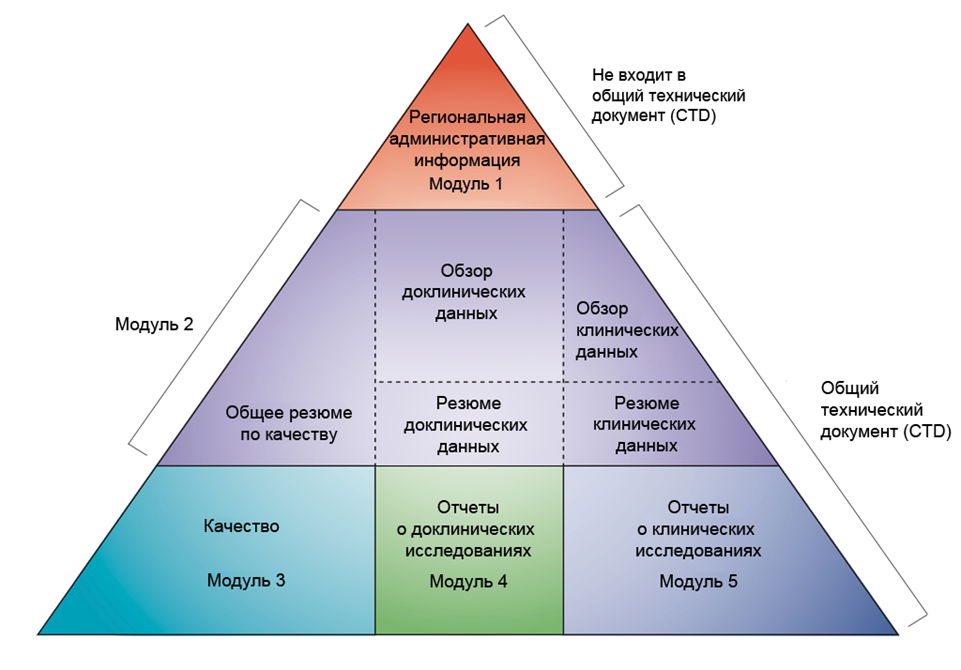
Рисунок 2. Схематическое представление организации общего технического документа.
Регуляторные требования и особенности цифровой трансформации
При переходе между различными стадиями ЖЦЛС один из важнейших процессов — передача информации между участниками сферы обращения ЛС с соблюдением правил надлежащих практик. Эффективность перехода между этапами зависит от информационного взаимодействия участников между собой. В настоящее время для соблюдения стандартов качества отдельных этапов ЖЦЛС применяются цифровые информационные системы, специфичные для этих этапов. Могут быть использованы как коммерческие продукты, так и собственные разработки организаций. Но не все эти программы могут быть использованы в рамках надлежащих практик, так как они должны быть одобрены регулятором и соответствовать единым требованиям работы таких цифровых систем. В настоящее время существует стандарт ISO IDMP (International Organization for Standardization, Identification of Medicinal Products) для описания и кодирования ЛС. С помощью этой идентификации были созданы стандарты для формального описания ЛС и другой медицинской продукции для потребностей сферы обращения ЛС. Также существуют международные требования к информационным системам и применению этих систем в ЖЦЛС. Так, существуют стандарты американского регулятора FDA (Food and Drug Administration), изложенные в 21 CFR Part 11, в которых изложены требования к использованию электронных документов для признания их равноценными бумажным носителям в рамках биотехнологической и фармацевтической промышленности. Ключевое требование — это обязательная валидация всех компьютеризированных систем, которые используются для работы с данными. Сам по себе термин «валидация» применим для всех этапов ЖЦЛС и относится ко всем процессам, которые выполняются в рамках разработки, испытания, производства и обращения ЛС. Валидация помогает подтвердить, что все работает так, как задумано, и неизменно дает высококачественные результаты [21]. Валидации подвергаются оборудование, испытательные площадки, методики выполняемые на этапах ЖЦЛС, обучение персонала и так далее. Различия между традиционной валидацией и валидацией цифровых технологий заключаются в первую очередь в используемых инструментах и процессах. Основные направления в проверке цифровых технологий — это оценка ожидаемой работы ПО в различных сценариях, обеспечение целостности данных, соблюдение безопасности и выполнение регулирующих норм. В рамках этих проверок оценивают: поток данных и их обработку (правильность записи, анализа и передачи данных), кибербезопасность (устойчивость системы к взлому, утечкам и другим угрозам безопасности), совместимость (обеспечение работы ПО на разных платформах и совместимость с другим цифровыми системами), работу алгоритмов (оценка на точность, смещение и производительность) [22]. Для правильной валидации и автоматизации систем в сфере обращения ЛС разработаны стандарты GAMP (Good Automated Manufacturing Practice, надлежащая практика автоматизированного производства). GAMP представляет из себя набор стандартов и рекомендаций для обеспечения безопасности, надежности и повышения качества работы систем в различных отраслях. Помимо этого, FDA вместе с участниками международного форума регуляторов медицинских устройств (IMDRF) согласовали ключевые понятия, системы оценки риска, управления качеством и клинической оценки для программного обеспечения, которое само по себе считается медицинским устройством (SaMD, Software as a Medical Device). Программа предварительной сертификации FDA для SaMD решает некоторые из этих проблем, оценивая процесс управления жизненным циклом программного обеспечения разработчика. В Европейском союзе EMA (European Medicines Agency) и национальные регулирующие органы контролируют цифровые медицинские продукты. Подобно SaMD, EMA контролирует цифровые технологии, связанные с лекарственными средствами, применяя в ЕС регламент по медицинским устройствам (MDR, Medical Device Regulation), в которых проводится анализ цифровых инструментов в ЖЦЛС и их соответствия существующим регулирующим стандартам для обеспечения безопасности ЛС.
Для применения цифровых технологий в лабораторных исследованиях необходимо формирование первичных данных в цифровой форме и минимизация процессов, где данные генерирует и вводит человек. Все это требует внедрения технологий цифровой идентификации для получения результатов из материального мира, либо измерительного оборудования, которое позволяет получать данные в цифровом формате с возможностью обмена этими данными между участниками без дополнительной обработки человеком.
Общей для всего ЖЦЛС может выступать система CRM (Customer Relationship Management, Система управления взаимоотношениями с клиентами). Эта система позволяет улучшать взаимодействия и управлять отношениями с различными участниками ЖЦЛС на всех его этапах. Данная система помогает коммуникации между фармацевтическими компаниями, специалистами здравоохранения, исследовательскими лабораториями, пациентами, дистрибьюторами и регулирующими органами. CRM-системы включают в себя различные функциональные возможности, например, хранения данных о различных этапах ЖЦЛС и быстрого обмена между участниками. К примеру, информация о различных нежелательных реакциях в ходе клинического испытания, либо же во время обращения ЛС на рынке для регистрации этих реакций фармаконадзорной службой и уточнения данных в инструкции к препарату. Также это распределение ресурсов как внутри лаборатории, так и между этапами ЖЦЛС, автоматическая генерация отчетов и инструменты аналитики, которые могут применяться для оценки эффективности маркетинговой кампании, анализа убытков и так далее [23], [24].
Достижения в области цифровых технологий, такие как LIMS (Laboratory Information Management System) и электронные лабораторные журналы (ELN), уже помогают стимулировать оцифровку лабораторий и повышать точность и воспроизводимость научных исследований, в спецпроекте «Автоматизация в биологии» подробнее рассказано, про перспективы «умных» лабораторий, как это возможно и какие трудности нужно решить для достижения этой цели [25], [26].
Лабораторные исследования проводятся на многих этапах ЖЦЛС, при этом возможно использование лабораторных информационных систем. Они нужны для того, чтобы регистрировать данные о тест-объектах, наблюдаемые эффекты от применения биологически активных веществ или сведения об используемых образцах и материалах [27], [28]. LIMS необходима в первую очередь для соблюдения стандартов GLP, для обеспечения информацией сложных бизнес-процессов и помощи в организации управления образцами. К ним относятся запрос, регистрация и хранение образцов и материалов, автоматические расчеты результатов, соблюдение требований нормативных документов, создание и хранение базы испытаний, результатов, а также формирование отчетов и протоколов. Автоматизируя рутинные задачи, такие как регистрация образцов, маркировка и отслеживание, LIMS устраняет необходимость ручного ввода данных и снижает вероятность человеческих ошибок. Также существуют дополнительные возможности, такие как внутренний контроль качества, управление взаимодействия с клиентами, управление складскими запасами, повышение квалификации и обучение персонала [29].
Для планирования и проведения клинических исследований, формирования отчетов используются системы управления клиническими исследованиями (CTMS, англ. Clinical Trial Management System). Они помогают обрабатывать данные о пациентах, ключевые точки исследований. Система электронного сбора информации – один из компонентов данного класса программного обеспечения. В рамках CTMS возможен контроль за ходом клинических испытаний в режиме онлайн 24/7 из любой точки мира. В CTMS есть возможность отслеживания реальных затрат времени на проект, прогресс выполнения задач, соблюдение сроков по проекту и по отдельным этапам [30], [31].
В России также существует цифровая система для повышения качества и доступности медицинской помощи, которая может быть использована для проведения клинических испытаний — это система ЕМИАС (Единая медицинская информационно-аналитическая система). Эта система позволяет собирать и систематизировать данные о пациенте, например, историю болезней, управлять потоками пациентов, выписывать электронные рецепты, а также вести персонифицированный учет. Помимо этого, система содержит информацию о загруженности медицинских учреждений и востребованности врачей и позволяет управлять медицинскими регистрами, что делает возможным планирование клинического испытания.
Также успешным примером цифровизации в биомедицинской практике и гармонизации международных требований можно назвать МДЛП (мониторинг движения лекарственных препаратов). Это отечественная система маркировки ЛС, разработанная для контроля движения ЛС и быстрого реагирования в критических ситуациях, а также для повышения прозрачности и доверия к российской фармацевтической продукции. В рамках этой системы возможно отслеживание работы дистрибьюторов, аптечных сетей и производителей ЛС. Системы, подобные МДЛП, называются Track and Trace, они разработаны во всех передовых странах и используются для обеспечения прозрачности логистических процессов от начала производства до конечного потребителя. В таких системах ЛС присваивается уникальный идентификатор (в России — DataMatrix), который фиксируется в системе мониторинга обращения ЛС, что позволяет отслеживать каждую упаковку в реальном времени. Помимо этого, такие системы в автоматическом порядке могут выявлять нарушения в логистике и мгновенно предупреждать всех участников, например, в случае нарушения температурного режима, влажности. Сама система Track and Trace может интегрироваться с передовыми технологиями, в том числе блокчейн, что позволяет создавать неизменяемые записи о каждом этапе логистики.
В области фармаконадзора также существуют системы мониторинга побочных эффектов на протяжении всего ЖЦЛС. Одно из программных решений в этой сфере — ARISg, которая занимается автоматизацией процессов регистрации и анализа сообщений о побочных эффектах, классифицируя их по степени тяжести и вероятной связи с препаратом. Также существует глобальная база данных Vigibase под управлением ВОЗ, в ней содержится информация о безопасности ЛС. Существует возможность интеграции национальных систем в платформу Vigibase, что способствует глобальному обмену данных о безопасности препаратов [32].
Будущее или настоящее цифровой биомедицины: машинное обучение, ИИ, блокчейн-технологии
Поиск перспективных химических соединений и создание нового ЛС — трудоемкая задача, которая требует много времени и денег. Одна из основных причин интереса к ИИ — это снижение затрат на разработку ЛС.
Машинное обучение значительно ускоряет анализ огромных баз данных химических соединений. Алгоритмы ИИ предсказывают, какие соединения, скорее всего, будут работать. Машинное обучение может виртуально проверять миллиарды соединений. Это называется скринингом in silico. Мощные алгоритмы оценивают химические и биологические данные. Они предсказывают, какие соединения имеют высокие шансы стать лекарствами. Затем эти соединения можно протестировать в первую очередь [33–35]. Машинное обучение все плотнее входит в биомедицинскую практику. Уже сейчас благодаря алгоритмам возможно анализировать и прогнозировать большое число взаимодействий лигандов с различными клеточными структурами, которые необходимы для разработки ЛС. Машинное обучение используют для поиска и валидации лекарственных мишеней, а также проведения оптимизации соединения для выбора кандидата-лидера для дальнейшего доклинического исследования. На данный момент существует не менее 20 перспективных молекул, созданных с помощью применения ИИ, которые проходят этапы КИ [36]. Одним из первых препаратов, созданных с помощью ИИ, можно назвать INS018_055 для лечения идиопатического легочного фиброза, который сейчас проходит 2 фазу клинических испытаний [37].
Существует и возможность использования новых алгоритмов в анализе рынка и продвижении ЛС, а также для повторного применения уже существующих одобренных препаратов по новым показаниям для лечения заболеваний, для которых они изначально не были предназначены [40], [41].
Несколько примеров использования ИИ в различных целях ЖЦЛС:
- Проект Insilico Medicine, создавший один из первых лекарственных препаратов с помощью ИИ-технологий, о котором мы писали чуть ранее, одна из прорывных компаний в области использования ИИ и машинного обучения в разработке ЛС. Эта компания занимается поиском эффективных молекул и новых биологических мишеней для лечения заболеваний, работает над проектами по персонализированной медицине.
- Clara Health — проект, разработанный для улучшения доступа пациентов к КИ, а также улучшения коммуникации между участниками и исследователями. Эта платформа служит площадкой для помощи пациентам в нахождении и регистрации в КИ, которые лучше всего подходят под их состояние здоровья, предпочтения и географическое положение. Таким образом, данный проект помогает ускорить разработку новых методов лечения и терапии, а также повышает вовлеченность и поддержку самих пациентов в ходе исследования, что дает немалые предпосылки для развития базы для персонализированной медицины.
- Exscientia (приобретена Recursion) — компания, специализирующаяся на применении ИИ для разработки новых лекарств. Компания занимается созданием платформы для автоматизации некоторых процессов открытия лекарств, таких как идентификация мишеней, разработка молекул и их оптимизация. Поиск лекарственного кандидата у Exscientia занял менее 12 месяцев, при средних показателях в 4,5 года. На данный момент КИ проходят 4 препарата, созданные с использованием платформы Exscientia [37].
Цифровизации охватывает не менее важные аспекты ЖЦЛС, такие как транспортировка, дистрибуция, контроль и аудит. Эти процессы стали более эффективными и прозрачными благодаря интеграции блокчейн-технологий в фармацевтическую отрасль.
Блокчейн — это технология, основанная на доверии, прозрачности и безопасности. Она становится ключевым инструментом в логистике и в проверке подлинности медикаментов. Каждая партия лекарства отслеживается от момента производства до конечного покупателя и записывается в блокчейне [42], [43]. Важные данные, такие как температура хранения и местоположение груза, становятся легкодоступными, неизменными и защищенными. Это позволяет не только предотвращать нарушения, но и быстро выявлять их. Блокчейн решает одну из главных проблем фармацевтики — фальсификацию лекарств. Уникальные идентификаторы, такие как QR-коды и Data Matrix, вносятся в распределенный реестр, что дает возможность любому заинтересованному лицу — врачу, фармацевту или пациенту — проверить подлинность препарата за считанные секунды [44]. Система МДЛП (мониторинг движения лекарственных препаратов), использует принципы, схожие с блокчейн, например, защиту данных и обеспечение их подлинности, но в ней отсутствует децентрализованный реестр и невозможность изменения данных после их записи. В мировой практике существует несколько успешных кейсов использования технологий на основе блокчейн:
- SAP Information Collaboration Hub for Life Sciences — это облачное хранилище, реализуемое на блокчейне и используемое для многих бизнес-целей в ЖЦЛС. Данная платформа используется фармацевтическими компаниями для сотрудничества с лабораториями, регуляторами и так далее. Помимо этого, с ее помощью возможен мониторинг цепочки поставок с момента производства до розничной реализации для решения таких проблем, как подделка товара или несоблюдение правил хранения и транспортировки. Эта платформа позволяет напрямую взаимодействовать с ведущими регуляторными органами мира FDA и EMA, которые могут напрямую аудировать процессы при разработке и реализации ЛС. В целом, эта платформа многократно повышает эффективность процессов в биомедицинской и биофармацевтической отрасли, предоставляя единую и безопасную среду для обмена данными.
- Modum.io — швейцарский стартап, в начале 2021 года был приобретен компанией Roambee, обе эти компании используют блокчейн-технологии для мониторинга и управления цепочками поставок в реальном времени, особенно для товаров с особыми условиями хранения, с помощью датчиков, подключенных к интернету. В рамках данной платформы возможен мониторинг факторов окружающей среды (температура, влажность) при транспортировке и хранении товара, что позволяет соблюдать требования GDP.
В целом, все эти технологии не просто упрощают поиск ЛС и упрощают управление ЖЦЛС — они меняют сами процессы взаимодействия внутри рынка ЛС, делая их более эффективными, прозрачными и надежными [35], [36], [45]. Ключевыми моментами того, как эти технологии преобразуют рынок, можно назвать: улучшение взаимосвязи между участниками ЖЦЛС; ускорение КИ и взаимодействие с регуляторами; доступность и прозрачность данных; оптимизация цепочек поставок и дистрибуции; автоматизация процессов на всех этапах; анализ рынка для повышения эффективности разработки узкопрофильных препаратов.
Заключение
Цифровизация — это необходимый этап в любой сфере для дальнейшего роста и развития, особенно в такой области, как здравоохранение и фармацевтика. В целом, модернизация в этих областях происходит не без скрежета, но уже многие регуляторы и участники отмечают полезность и удобство возможностей, которые несет в себе цифровизация. Уже разработаны и продолжают модифицироваться законодательные и регуляторные требования к этим системам, порой даже цифровые технологии, ушедшие далеко вперед, диктуют необходимость внедрения тех или иных руководств в отдельные этапы ЖЦЛС. Россия и ЕАЭС не отстают от общемировой тенденции к переходу в электронную среду в сфере обращения ЛС и разрабатывают собственные регуляторные требования к участникам ЖЦЛС. Будущее уже наступило, и все, кто связан с биомедициной и биофармацевтикой, уже сталкиваются с этим.
Литература
- Ahmad Almeman. (2024). The digital transformation in pharmacy: embracing online platforms and the cosmeceutical paradigm shift. J Health Popul Nutr. 43;
- Glenn Hole, Anastasia S. Hole, Ian McFalone-Shaw. (2021). Digitalization in pharmaceutical industry: What to focus on under the digital implementation process?. International Journal of Pharmaceutics: X. 3, 100095;
- Aylin Sertkaya, Trinidad Beleche, Amber Jessup, Benjamin D. Sommers. (2024). Costs of Drug Development and Research and Development Intensity in the US, 2000-2018. JAMA Netw Open. 7, e2415445;
- Олефир Ю.В., Свистунов А.А. Жизненный цикл лекарственных средств. Москва: ООО «Издательство «Медицинское информационное агентство», 2018;
- Smith B.D., Tarricone R., Vella V. (2013). The role of product life cycle in medical technology innovation. J. Med. Mark. Device, Diagnostic Pharm. 13, 3743;
- Глембоцкая Г.Т., Еремин С.Ю. (2019). Научно-практический подход к оптимизации затрат на разработку и продвижение лекарственных препаратов. Вестник Росздравнадзора. 3, 47–53;
- Eelco Kappe. (2014). Pharmaceutical Lifecycle Extension Strategies. International Series in Quantitative Marketing. 225-254;
- E. I. Kalenikova, E. A. Gorodetskaya, O. Y. Kulyak, L. P. Kozaeva, V. G. Makarov, et. al.. (2018). Preclinical Study of the Pharmacokinetics of a New Intravenous Dosage Form of Ubiquinol. Pharm Chem J. 51, 949-953;
- От живого к неживому. Доклинические исследования сегодня и завтра;
- С миру по нитке: как соединились компоненты клинического исследования;
- Michael Hay, David W Thomas, John L Craighead, Celia Economides, Jesse Rosenthal. (2014). Clinical development success rates for investigational drugs. Nat Biotechnol. 32, 40-51;
- Chi Heem Wong, Kien Wei Siah, Andrew W Lo. (2019). Estimation of clinical trial success rates and related parameters. Biostatistics. 20, 273-286;
- Joseph A. DiMasi, Abigail Dirks, Zachary Smith, Sarah Valentine, Jennifer C. Goldsack, et. al.. (2024). Assessing the net financial benefits of employing digital endpoints in clinical trials. Clinical Translational Sci. 17;
- Пятигорская Н.В. (2010). GMP для производства лекарственных препаратов из растительного сырья. Фармация. Общество с ограниченной ответственностью Издательский дом Русский врач. 4, 34–37;
- Bhaskaran J., Venkatesh M. (2019). Good storage and distribution practices for pharmaceuticals in European Union. Journal of Pharmaceutical Sciences and Research. 11, 2992–2997;
- Unhurian L. (2018). Implementation of standards of good pharmacy practice in the world: a review. Asian Journal of Pharmaceutics. 2, 42–46;
- Иванова А.П. (2021). Применение цифровых технологий в управлении здравоохранением. Журнал медицинских технологий. 4, 23–30;
- LÍgia Maria Gaspar Ernesto, Rui Miguel Dias Loureiro. (2020). Pharmaceutical Manufacturing in the EU and the EU–US Mutual Recognition Agreement. PDA Journal of Pharmaceutical Science and Technology. 74, 617-626;
- Pauric Bannigan, Riley J. Hickman, Alán Aspuru‐Guzik, Christine Allen. (2024). The Dawn of a New Pharmaceutical Epoch: Can AI and Robotics Reshape Drug Formulation?. Adv Healthcare Materials. 13;
- 10.5246/jcps.2016.07.061;
- Наработка антител для доклинических и клинических испытаний;
- Lalasa P. (2013). A review on applications of GAMP-5 in pharmaceutical industries. International Journal of Drug Development & Research. 5, 4–16;
- Mehrbakhsh Nilashi, Rabab Ali Abumalloh, Hossein Ahmadi, Sarminah Samad, Mesfer Alrizq, et. al.. (2023). The nexus between quality of customer relationship management systems and customers' satisfaction: Evidence from online customers’ reviews. Heliyon. 9, e21828;
- Yahia Baashar, Hitham Alhussian, Ahmed Patel, Gamal Alkawsi, Ahmed Ibrahim Alzahrani, et. al.. (2020). Customer relationship management systems (CRMS) in the healthcare environment: A systematic literature review. Computer Standards & Interfaces. 71, 103442;
- Меркулов В.А. (2012). Опыт создания системы управления качеством в лабораториях на примере практики внедрения Лабораторной информационной системы. Ведомости НЦЭСМП. 4, 14–18;
- Автоматизация разработки лекарств;
- Jorge L. Sepulveda, Donald S. Young. (2013). The Ideal Laboratory Information System. Archives of Pathology & Laboratory Medicine. 137, 1129-1140;
- Vera Lukić. (2017). Laboratory Information System – Where are we Today?. Journal of Medical Biochemistry. 36, 220-224;
- Maryati M. Yusof, Azila Arifin. (2016). Towards an evaluation framework for Laboratory Information Systems. Journal of Infection and Public Health. 9, 766-773;
- Leroux H., McBride S., Gibson S. (2011). On selecting a clinical trial management system for large scale, multi-centre, multi-modal clinical research study. Studies in Health Technology and Informatics. 168, 89–95;
- Liang Shen, You Zhai, AXiang Pan, Qingwei Zhao, Min Zhou, Jian Liu. (2023). Development of an integrated and comprehensive clinical trial process management system. BMC Med Inform Decis Mak. 23;
- Marie Lindquist. (2008). VigiBase, the WHO Global ICSR Database System: Basic Facts. Drug Information J. 42, 409-419;
- Alexandre Blanco-González, Alfonso Cabezón, Alejandro Seco-González, Daniel Conde-Torres, Paula Antelo-Riveiro, et. al.. (2023). The Role of AI in Drug Discovery: Challenges, Opportunities, and Strategies. Pharmaceuticals. 16, 891;
- Maria Koromina, Maria-Theodora Pandi, George P. Patrinos. (2019). Rethinking Drug Repositioning and Development with Artificial Intelligence, Machine Learning, and Omics. OMICS: A Journal of Integrative Biology. 23, 539-548;
- Junaid Bajwa, Usman Munir, Aditya Nori, Bryan Williams. (2021). Artificial intelligence in healthcare: transforming the practice of medicine. Future Healthcare Journal. 8, e188-e194;
- Pais A. Artificial Intelligence for Drug Product Lifecycle Applications. Academic Press, 2024;
- Frank W. Pun, Ivan V. Ozerov, Alex Zhavoronkov. (2023). AI-powered therapeutic target discovery. Trends in Pharmacological Sciences. 44, 561-572;
- Stefan Harrer, Pratik Shah, Bhavna Antony, Jianying Hu. (2019). Artificial Intelligence for Clinical Trial Design. Trends in Pharmacological Sciences. 40, 577-591;
- Zhaoyi Chen, Xiong Liu, William Hogan, Elizabeth Shenkman, Jiang Bian. (2021). Applications of artificial intelligence in drug development using real-world data. Drug Discovery Today. 26, 1256-1264;
- Clémence Réda, Emilie Kaufmann, Andrée Delahaye-Duriez. (2020). Machine learning applications in drug development. Computational and Structural Biotechnology Journal. 18, 241-252;
- Maciej Staszak, Katarzyna Staszak, Karolina Wieszczycka, Anna Bajek, Krzysztof Roszkowski, Bartosz Tylkowski. (2022). Machine learning in drug design: Use of artificial intelligence to explore the chemical structure–biological activity relationship. WIREs Comput Mol Sci. 12;
- Cornelius C. Agbo, Qusay H. Mahmoud, J. Mikael Eklund. (2019). Blockchain Technology in Healthcare: A Systematic Review. Healthcare. 7, 56;
- Shilpa Srivastava, Millie Pant, Sunil Kumar Jauhar, Atulya K. Nagar. (2022). Analyzing the Prospects of Blockchain in Healthcare Industry. Computational and Mathematical Methods in Medicine. 2022, 1-24;
- Постклиника: что осталось за кадром?;
- Wahiba Oualikene-Gonin, Marie-Christine Jaulent, Jean-Pierre Thierry, Sofia Oliveira-Martins, Laetitia Belgodère, et. al.. (2024). Artificial intelligence integration in the drug lifecycle and in regulatory science: policy implications, challenges and opportunities. Front. Pharmacol.. 15.






