Постклиника: что осталось за кадром?
03 февраля 2023
Постклиника: что осталось за кадром?
- 1097
- 0
- 3
Регулирование лекарств и продуктов, влияющих на здоровье, — дело сложное, иногда запутанное, и состоит из множества разнородных элементов. Все вместе они должны обеспечивать людей качественными, безопасными и эффективными продуктами.
Рисунок в оригинальном разрешении.
иллюстрация Карины Илиопуло
-
Авторы
-
Редакторы
-
Иллюстратор
В этой — завершающей — статье Спецпроекта о постклинических исследованиях мы подробнее расскажем о понятиях, которые встречались ранее: ICH, GLP, GCP, GMP и других GxP: что входит в эти требования; какое отношение правила GxP имеют к руководствам ICH; какова история их появления; как обеспечивается их выполнение; и про специфические вещи, которые обычному человеку кажутся курьезами.
Постклинические исследования
На «Биомолекуле» вышло уже два спецпроекта о судьбах лекарств — в доклинических и в клинических исследованиях. Что же с ними происходит после выпуска на рынок? А также как происходит оформление у регуляторов? С окончанием фазы 3 научные исследования и разработка не заканчиваются. После регистрации и выхода на рынок продолжается сбор данных об эффективности, безопасности, оценка рисков, которые влияют как на судьбу самого лекарства, так и на разработку новых. Этот спецпроект расскажет о четвертой фазе клинических исследований, real-world data, и о том, как регулируются процессы разработки и производства лекарств.
Партнер спецпроекта — аффилированные компании «Филип Моррис Интернэшнл» в России, ФМИ (PMI Affiliates in Russia) — международная компания, занимающаяся разработкой продуктов бездымного табака.
Спецпроект «Постклиника» посвящен тому, что происходит с лекарствами и другими продуктами, влияющими на здоровье, после регистрации. На моменте одобрения жизненный цикл лекарства или продукта не заканчивается: у производителя есть обязательства по сбору информации об эффектах лекарства на рынке, а у здравоохранения — задача обеспечивать людей качественными лекарствами. В первой статье спецпроекта рассказывалось о регистрационном процессе, его истории, видах регистрации [1]. Во второй статье — о пострегистрационных исследованиях, фармаконадзоре, мониторинге нежелательных явлений [2]. Там же приведена классификация клинических исследований. В третьей статье спецпроекта речь шла о новейших технологиях в области сбора данных о продуктах, вышедших на рынок — RWD/RWE [3]. Завершается спецпроект четвертой статьей, в которой речь снова пойдет о регуляторных аспектах регистрации и обращения лекарств и других продуктах, которых мы не касались ранее: как складывались регуляторные системы, как они оцениваются и какие проблемы регулирования есть в России.
В этой статье мы будем много говорить о регулировании лекарств и других продуктов, затрагивающих здоровье, поэтому не лишним будет начать с основ, то есть с общих понятий и определений. Разработка, производство и обращение лекарств, а также других продуктов, которые влияют на безопасность людей (например, медицинские изделия, пищевые и табачные продукты) регулируются строже всего из-за рисков, которые они несут для здоровья и жизни людей, причем чем больше людей подвергается потенциальному риску и чем серьезнее последствия риска, тем сильнее регулирование. Вторая причина — потребители чаще всего сами не способны выяснить, насколько продукт качественный, эффективен и безопасен ли он в долгосрочной перспективе, в отличие от одежды или бытовых инструментов.
Регуляторы исходят из того, что к продуктам, влияющим на здоровье, применяется принцип презумпции виновности: лекарственные препараты и другие продукты считаются неэффективными, небезопасными и некачественными, пока не доказано обратное, причем бремя доказательства возлагается на заявителя (иногда его называют спонсором), который хочет вывести продукт на рынок. Кроме того, ко всем потребительским товарам, к которым относятся и лекарства, применяется принцип предосторожности, подразумевающий необходимость оценки риска, если он существует или его нельзя исключить.
Верхний уровень регуляторной системы — законодательный. Законы принимаются на уровне отдельных стран, как в США, или на наднациональном уровне, как в ЕС или ЕАЭС. В них содержатся максимально общие формулировки, а дальше положения закона раскрываются, уточняются и детализируются в подзаконных актах, технических директивах, регламентах, решениях и так далее. Такая двухуровневая система обеспечивает большую гибкость законодательства, потому что для принятия законов требуется вовлечение парламента и правительства, а для принятия или изменения подзаконных актов обычно достаточно подписи одного министра [5].
Еще более подробная и детальная информация содержится в руководствах (guidelines) и указаниях (guidances). Они не имеют законной силы, но их проще изменять и обновлять, и они носят менее формальный характер, чем законодательные акты. Именно в этих документах обычно содержится конкретное описание того, как может быть выполнено установленное законом требование. Такое описание имеет силу рекомендации и необязательно является единственным способом выполнить требование, поэтому, если разработчик на научной основе предлагает альтернативный подход, это допустимо, если в итоге установленное законом требование выполняется.
Понимание, какой должна быть регуляторная система, наилучшим образом защищающая интересы людей, пришло не сразу: оно формировалось, начиная со второй половины 20 века, и продолжает формироваться до сих пор, становясь все более сложным.
Хорошая система регуляции должна удовлетворять ряду требований, которые отчасти противоречат друг другу. С одной стороны, она должна быть понятной многочисленным участникам процесса и четко определять их роли, с другой — достаточно полной и подробной, чтобы охватывать все аспекты, хоть в какой-то мере влияющие на безопасность. Она должна строго регулировать область, чтобы минимизировать риски для людей, но не настолько строго, что сделать ее неуклюжей и непривлекательной для бизнеса. Нужно немало усилий, чтобы построить стройную, логичную, прозрачную и практичную систему. Она должна предусматривать наличие административных органов, которые будут следить за ее внедрением и выполнением. Такая система должна регулировать:
- разработку и исследования;
- выдачу разрешения на продажу (регистрацию);
- производство и совершенствование производства;
- импорт;
- дистрибуцию;
- продажу и продвижение;
- оформление упаковки,
- а иногда также цены и некоторые другие аспекты лекарств, медицинских изделий и других продуктов.
Такая система должна обеспечивать на рынке наличие качественных, безопасных и эффективных продуктов, не допускать их дефицита, подделки, неверного использования [6].
До 1970-х годов такие системы складывались независимо в каждой стране, но затем, по мере глобализации, возникла необходимость гармонизации. Большую роль тут играет ВОЗ, публикующая руководства, которые, хотя и не имеют силы закона, но позволяют ориентироваться на единый источник.Гармонизация исключительно важна по нескольким причинам:
- более быстрый и равный доступ к лекарствам по всему миру;
- более оптимальное использование ограниченных ресурсов;
- снижение дублирования усилий разработчиков/производителей и регулирующих органов;
- обмен опытом и информацией;
- уменьшение количества клинических исследований и инспекций;
- снижение истребления животных в научных целях;
- более тесное взаимодействие регуляторов и индустрии [7].
Стремление к гармонизации привело к появлению в 1990 г. ICH — International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use (c 2015 года — International Council...). Руководства ICH главным образом касаются этапа разработки и требований к регистрации новых продуктов , однако мы разберем их в этой статье подробнее, потому что ранее они упоминались в статьях и спецпроектах «Биомолекулы», но не все аспекты были освещены достаточно подробно. Другие аспекты (производство, фармаконадзор, дистрибуция) также в разной степени гармонизированы (как ICH, так и другими организациями), и мы коснемся их в соответствующих разделах статьи.
В США регистрацию, то есть выдачу разрешения на продажу продукта, называют approval (одобрением), а в ЕС — marketing authorization (то есть «разрешением на вывод на рынок»). Регистрация — это термин ВОЗ, и мы его будем придерживаться в дальнейшем, хотя он менее удачный, так как не отражает сути процесса.
Рассмотрим подробнее историю и структуру ICH, в рамках которой была создана гармонизированная регуляторная система, построенная на научных принципах, оценке рисков и стратегиях их снижения. Она не высечена в камне — появление новых технологий приводит к постоянному пересмотру и обновлению законов, стандартов и руководств .
Подробнее о регулировании в ЕС и ЕАЭС можно посмотреть на канале Pharmaceutical Education and Development (PhED).
International Council on Harmonisation (ICH)
История
В течение 1980-х годов опыт формирования общего рынка Евросоюза продемонстрировал, что можно создать механизмы межгосударственного регулирования вопросов эффективности, безопасности и качества лекарств.
Начало ICH было положено в 1990 году, когда регуляторы Евросоюза, Японии и США договорились совместно обсуждать научные и технические аспекты регистрации новых лекарств. До учреждения ICH, несмотря на схожесть фундаментальных подходов к разработке, требования на разных территориях отличались. Это приводило к необходимости повторять многие эксперименты при выходе на новые территории. Целью создания системы ICH стала унификация этих требований, чтобы пациенты как можно быстрее и эффективнее получали доступ к современным лекарствам. В ICH входят регуляторы и представители фармацевтических ассоциаций стран-членов, представители международной фармацевтической организации The International Federation of Pharmaceutical Manufacturers & Associations (IFPMA), а также наблюдатели ВОЗ [6].
Главные действующие лица ICH в процессах гармонизации — это рабочие группы. Они отвечают за разработку, внедрение и поддержание руководств ICH. Рабочие группы (числом 10–15) два раза в год собираются вместе с Управляющим комитетом, обсуждают свои достижения и корректируют их по мере необходимости. В них с самого начала вошли признанные лидеры области, что позволило выработать научные и технические рекомендации самого высокого уровня. Управляющий комитет назначает также управляющий совет MedDRA (Medical Dictionary for Regulatory Activities), который отвечает за поддержание словаря медицинской терминологии, используемого для описания медицинских состояний, возникающих на фоне применения лекарств [6] (рис. 1).
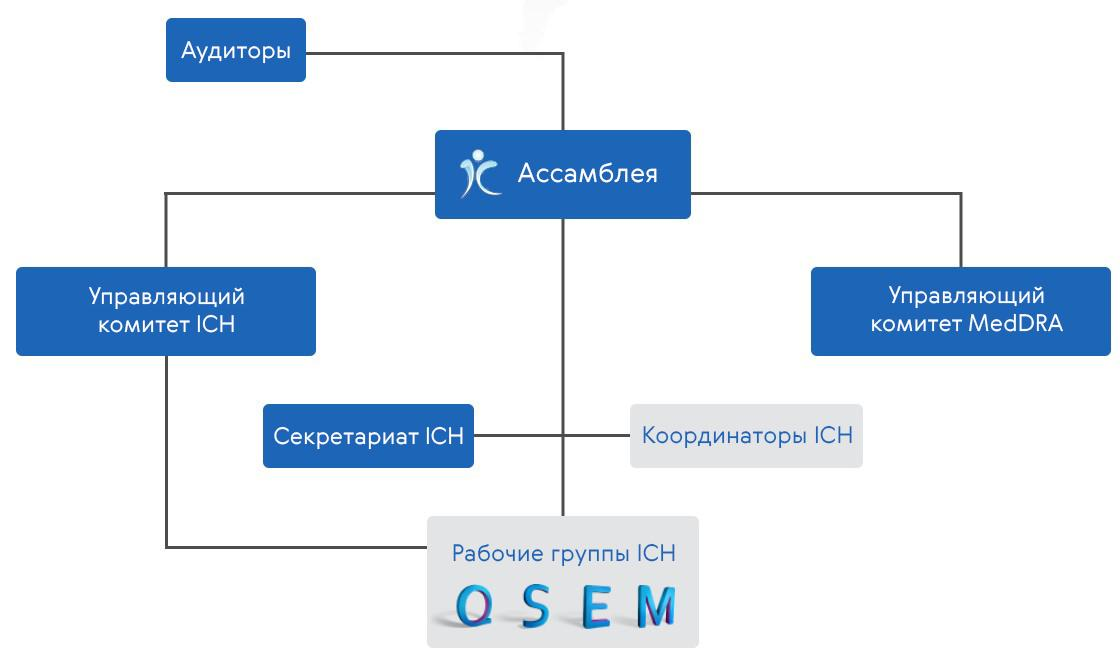
Рисунок 1. Структура управления ICH. QSEM — это качество (Quality), безопасность (Safety), эффективность (Efficacy) и мультидисциплинарные составляющие (Multidisciplinary).
В рамках ICH был создан CTD (Common Technical Document) — унифицированный формат досье на лекарственный препарат, в котором собираются данные в ходе фармакологической и фармацевтической разработки лекарства, а также описываются производство лекарства, всех его компонентов и методы их контроля (см. ниже) [6].
В 1999 году была создана группа глобальной кооперации (The ICH Global Cooperation Group, GCG) для взаимодействия со странами, не являющимися членами ICH. Туда приглашаются представители ряда стран, включая Россию, которая имеет статус наблюдателя ICH. Группа занимается распространением принципов ICH за пределы стран-членов ICH. С тех пор в ICH в качестве стран-членов были приняты Южная Корея, Китай, Бразилия, Турция и некоторые другие. Любопытно, что, несмотря на развитое действующее регулирование и тесное взаимодействие с FDA, Израиль и Австралия не входят в ICH [6].
В 2010 году для повышения эффективности и прозрачности работы ICH и развития роли организации в мире было предложено реформировать ICH, уточнив роли всех членов и критерии принятия новых [8]. В 2015 году реформа была осуществлена, при этом туда были приняты страны с регуляторикой, уровень зрелости которой ниже уровня стран-основателей ICH (они обязуются после вступления в ICH внедрить у себя все руководства в полной мере). Поэтому сейчас неверно говорить о том, что если страна — член ICH, то там имеется передовая регуляторная система. Функцию оценки и улучшения регуляторных систем взяла на себя ВОЗ (подробнее см. ниже в разделе «Проблемы в России»), а ICH сосредоточился на проблемах гармонизации регуляторных систем с точки зрения научных и лишь в незначительной степени административных требований.
Руководства ICH
C самого начала, на первой конференции ICH было решено разделить руководства на три категории: эффективность, безопасность и качество. Позже к ним была добавлена еще одна — мультидисциплинарная категория. Все руководства имеют буквенно-цифровой код, состоящий из обозначения категории (E, S, Q или M) и номера руководства, к которому иногда добавляется номер ревизии [6].
Руководства по качеству описывают такие аспекты, как испытания на стабильность (Q1), валидацию аналитических процедур (Q2), испытания на примеси (Q3), некоторые фармакопейные требования (Q4), качество биотехнологических продуктов (Q5), спецификации (Q6), GMP (Q7) и современные подходы к разработке и контролю процессов производства (Q8—Q13) [6].
Руководства категории S описывают аспекты разработки, касающиеся безопасности, причем они направлены на гармонизацию информации, получаемой в ходе доклинических исследований in vitro и in vivo. Это исследования различных видов токсичности, токсикокинетики и фармакокинетики (S3), фармакологии (S7). Отдельное руководство посвящено доклиническим исследованиям биотехнологических продуктов (S6) [6].
Последнее время есть тенденция вместо термина «доклинические» использовать термин «неклинические» исследования, потому что исследования in vitro и in vivo не обязательно проводятся до исследований на людях.
Руководства категории Е относятся к клиническим исследованиям и фармаконадзору. Только часть из них, несмотря на название раздела, посвящены определению эффективности. Очень важные руководства посвящены структуре и содержанию отчета о клиническом исследовании (Е3), GСP (E6), общим вопросам (E8) и статистическим принципам (Е9). Довольно много руководств в этом разделе (а не в разделе S) посвящается клинической и постклинической оценке безопасности — в частности, управлению данными после регистрации (E2D) и планированию фармаконадзора (E2E) [6].
Мультидисциплинарная категория посвящена медицинскому словарю MedDRA, общему техническому документу и другим темам, не относящимся к предыдущим трем. Важное руководство этой категории — М3, описывающее требования к объему и длительности доклинических экспериментов, достаточных для перехода к клиническим исследованиям (КИ), продолжения клинической разработки и, наконец, регистрации. Оно необходимо для гармонизации требований на различных территориях, а также содержит рекомендации по снижению использования животных в соответствии с принципом 3R (reduce/refine/replace, то есть снижать количество, повышать качество проведения экспериментов и отказываться от животных моделей в пользу других [9]). Это руководство согласовано с остальными частями ICH и способствует более быстрой, экономной и этичной разработке лекарств [6].
В настоящее время ICH занимается как поддержанием и обновлением имеющихся руководств (которых насчитывается более 100 [8]), так и выпуском новых (рис. 2).
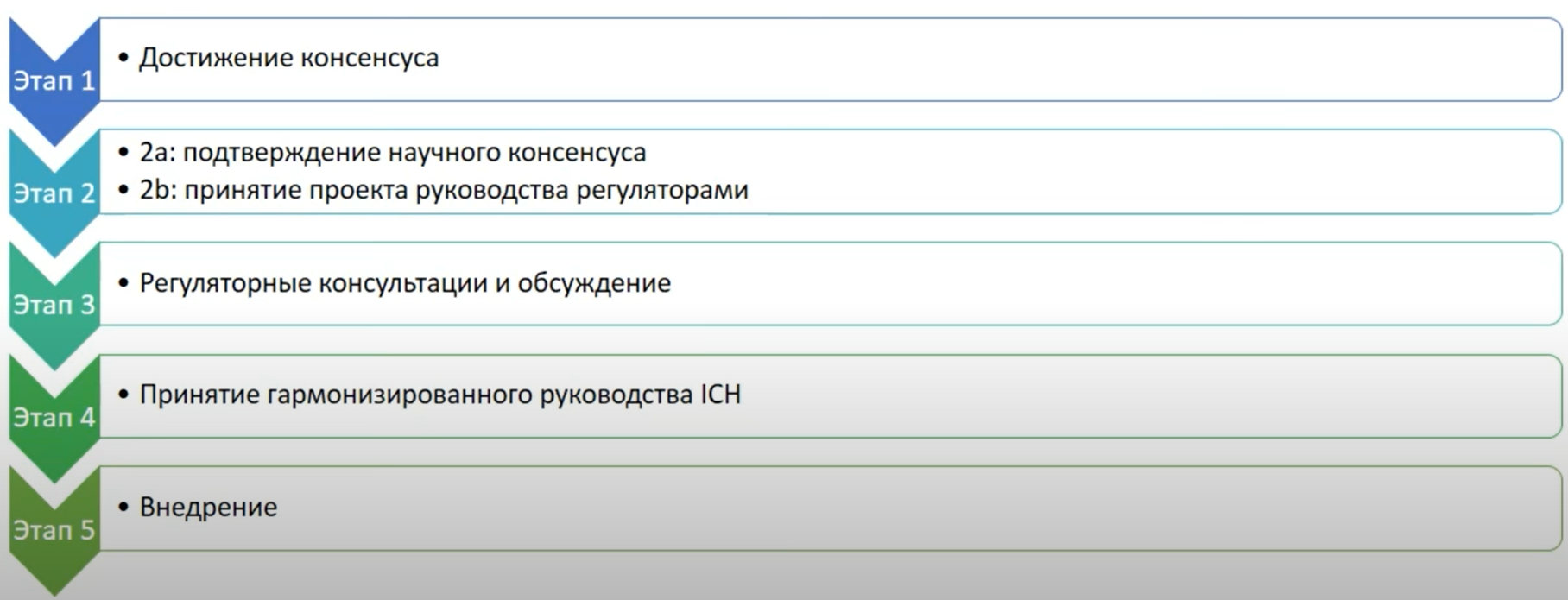
Рисунок 2. Процесс гармонизации нового руководства ICH.
Современные тенденции, в которых развивается система руководств ICH, таковы:
- гармонизация новых технологий и способов воздействия на организм (клеточная и генная терапия, РНК-продукты, другие новые модальности). Кстати, на «Биомолекуле» выходила статья, посвященная регулированию генной и клеточной терапии [10];
- новые инструменты разработки лекарств (моделирование КИ перед их проведением, новые дизайны КИ);
- учет точки зрения пациентов при разработке (включение измерений качества жизни в КИ; клинические исходы, отмечаемые пациентами — patient reported outcomes, PRO);
- использование нетрадиционных типов данных в ходе разработки и жизненного цикла продукта (в том числе, RWD) [7].
Common Technical Document (CTD)
Общий технический документ (ОТД, CTD) — одно из самых известных достижений ICH (описан в семействе руководств ICH M4). Он позволяет подавать регистрационную информацию в различные регуляторные агентства в унифицированном формате, облегчает процедуру рассмотрения заявки и обмен информацией между агентствами. До введения CTD каждое регуляторное агентство пользовалось собственными правилами и формами. В 1996 году было проведено исследование, которое показало, что для адаптации заявки из ЕС в США требуется труд 20–30 человек в течение 3–4 месяцев [7]. С введением CTD надобность в региональных адаптациях в основном отпала.
CTD состоит из пяти модулей: модуль 1 называется административным и содержит заявку и информацию о назначении препарата; модуль 2 содержит резюме модулей 3–5; модуль 3 содержит информацию о качестве; модуль 4 — о неклинических исследованиях; модуль 5 — о клинических исследованиях (рис. 3).
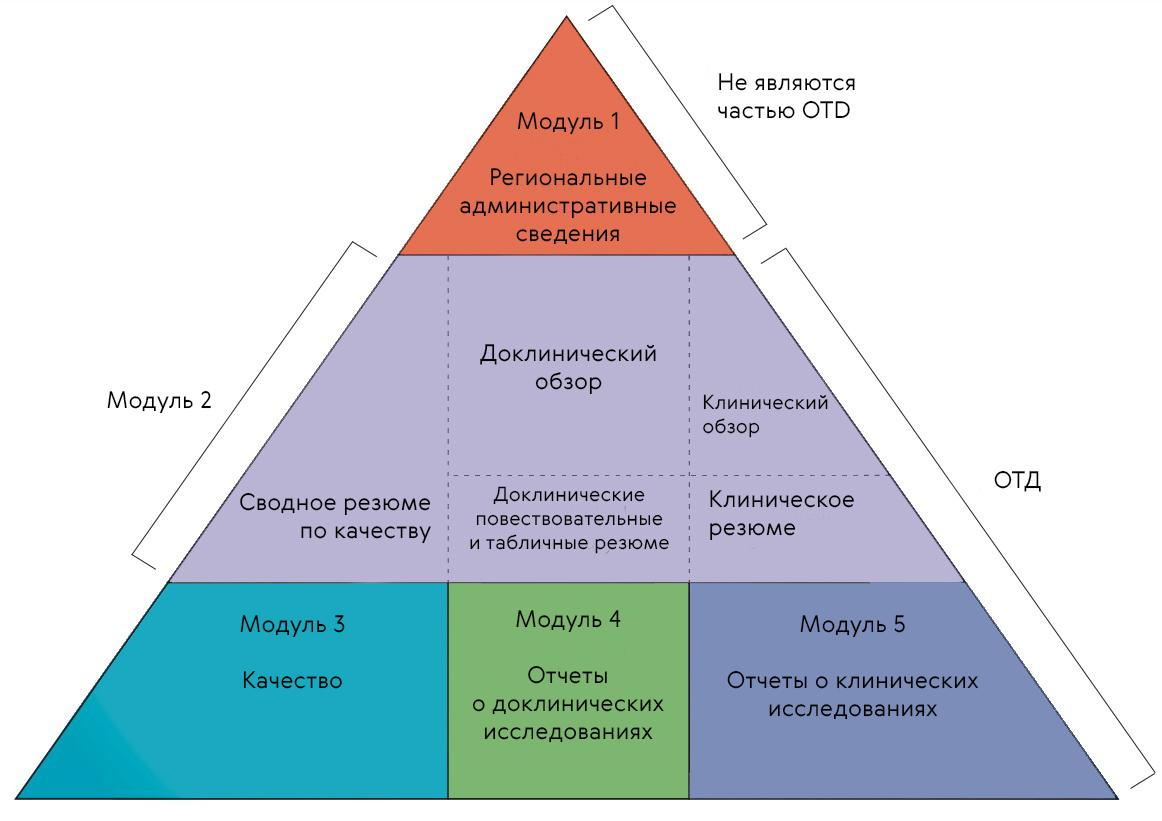
Рисунок 3. Треугольник CTD. Модуль 1 формально не является частью CTD и зависит от региона, в котором подается досье.
CTD предъявляет требования не к содержанию досье, а лишь к формату. Содержание всё же может различаться от региона к региону и регулируется, в конечном итоге, местным законодательством, которое может быть в той или иной степени гармонизировано с другими (что как раз и является целью ICH) [6].
В 2008 году также был разработан формат электронного CTD (eCTD), описанный в руководстве ICH M8. Однако лишь в 2019–20 этот формат стал единственно возможным в развитых юрисдикциях, таких как США и ЕС.
Good Manufacturing Practice (GMP)
GMP, или надлежащая производственная практика — это часть системы обеспечения качества, призванная сделать так, чтобы производство и контроль качества продуктов соответствовали целям использования продуктов и выполнялись так, как описано в регистрационном досье или досье на клиническое исследование. В основном, GMP направлено на снижение рисков фармацевтического производства, которые не снимаются тестированием конечного продукта. GMP регулирует все аспекты производства: начиная от сырьевых и исходных материалов, помещений и оборудования и заканчивая тренингами и личной гигиеной персонала. Иногда к GMP прибавляют букву «c» (cGMP), что означает current («текущая»). В то же время, соответствие производства требованиям GMP не обязательно означает, что продукт качественный, поскольку GMP не устанавливает научные требования к качеству, а только процессуальные.
История
В США стандарты того, что позднее назовут GMP, начали разрабатываться во время Второй мировой войны. Толчок этому процессу дало отравление в 1941 г. почти 300 человек таблетками фенобарбитала, содержащими опасные примеси. В итоге в 1944 г. Конгресс принял The Public Health Services Aсt, описывающий, в том числе, требования к производству. Параллельно FDA стало требовать предоставлять образцы каждой серии лекарств на контроль в агентство. Позднее, в 1983 году, от этой практики в США отказались (а в РФ не отказались до сих пор). Наконец, первые правила собственно GMP были введены в 1963 году после талидомидовой трагедии (см. врезку во второй статье спецпроекта) [2], [11].
Первый вариант GMP на лекарственные продукты появился в США в 1963 году, а ВОЗ опубликовала GMP в 1968 году. Позднее были выпущены специфические руководства по активным фармацевтическим ингредиентам, биологическим продуктам и другим частным вопросам, а также по более общим аспектам, таким как валидация, анализ рисков, трансфер производства и инспекции. На основе документов ВОЗ многие страны составили собственные требования GMP [6].
В США правила GMP продолжали развиваться параллельно ряду трагедий, среди которых важнейшей стал случай с детским питанием в 1979 году и с парацетамолом в 1982 [11].
Две истории с медицинскими устройствами (c некачественными катетерами для ангиопластики и дефектными сердечными клапанами) привели к принятию в 1990 году акта, в соответствии с которым FDA могло инспектировать процесс производства устройств. В течение шести лет после его принятия выяснилось, что в 44% случаев отзыва устройств с рынка проблема была в изначальном дизайне продукта. В случае отзывов, связанных с недостатками программного обеспечения, 90% было вызвано проблемами на уровне разработки, в основном из-за отсутствия валидации программного обеспечения в рутинной практике [11].
Для многих стран ориентиром является законодательство GMP Евросоюза. Оно было заложено в 1991 году директивой 91/356/EEC, которую затем заменила директива 2017/1572 и Регламент 2017/1569 (директивами в ЕС называются законодательные акты, которые регламентируют, каким должно быть законодательство стран-членов. То есть каждая страна должна к определенному сроку привести национальное законодательство в соответствие с директивой. Регламент имеет прямое действие.)
До 1998 года правила GMP были разработаны только для лекарственного продукта и порой некорректно применялись к активным фармацевтическим ингредиентам (active pharmaceutical ingredient, API). Именно ICH сыграл роль в разработке и гармонизации GMP для API [12]. В Евросоюзе ICH Q7 (API GMP) обязателен к выполнению.
С целью координации и гармонизации подходов к GMP в 1998 г. была создана PIC/S (Pharmaceutical Inspection Co-operation Scheme) на основе существовавшей c 1970 г. PIC, которая объединяет национальные регуляторные органы многих стран [6]. PIC/S предоставляет инспекторам тренинги, облегчает сотрудничество между регуляторами, повышая взаимное доверие. Россия подавала заявку на вступление в PIC/S в 2020 году, но в сентябре 2022 года ее рассмотрение было приостановлено.
О содержании GMP уже говорилось в первой статье нашего Спецпроекта [1], поэтому здесь повторяться не будем.
Инспекции, аудит, комплаенс
У слова «комплаенс» два значения: под ним понимается как соответствие организации регуляторным требованиям, так и деятельность по проверке этого соответствия. Поэтому иногда для второго значения используется термин «контроль комплаенса», или проверка на комплаенс.
У каждой организации, имеющей дело с лекарствами и продуктами, влияющими на здоровье, должна быть программа комплаенса, включающая в себя систему управления рисками, принципы которой описаны в руководстве ICH Q9 (она включает идентификацию, оценку, мониторинг и снижение рисков. Кстати, 18 января 2023 года вышла новая версия — ICH Q9(R1)).
Главные компоненты проверки комплаенса — это внутренние и внешние (независимые) аудиты, которые проводятся по инициативе организации, и инспекции, проводимые регуляторными органами.
Сходство аудита и инспекции в том, что проводится проверка документации и фактического положения дел в организации. Отличие в том, что аудит больше сосредоточен на процессах, а не на их результате; охватывает, как правило, сразу много аспектов деятельности; направлен на улучшение деятельности работы компании. Результатом аудита становятся выводы по оптимизации работы, изменению процессов, реорганизация.
Аудиты могут быть внутренними и внешними, а внешние, в свою очередь, добровольными или партнерскими. Внутренние и независимые добровольные аудиты — это часть системы управления качеством. В организации (в соответствии с GMP) должно существовать расписание таких проверок [13].
Если компания выступает заказчиком услуг, она, в соответствии с GMP, сама отвечает за проведение аудитов контрактной организации. Соответственно, если компания является чьим-то поставщиком, то ее заказчики обязаны проводить аудиты на соответствие GMP [13]. Хорошая система качества производителя лекарств, по мнению FDA, — это такая, когда проверки доходят до уровня поставщиков.
Инспекция, в отличие от аудита, как правило, проверяет определенный процесс или продукт на соответствие заранее заданным спецификациям. Инспекции обычно проводятся контролирующими органами государств, и в случае выявленных нарушений могут последовать санкции — приостановка процессов, отзыв продуктов с рынка или даже полное закрытие предприятия.
Инспекции могут быть плановыми или внеплановыми. Типичная частота плановых аудитов на фармацевтическом предприятии, признанным по результатам прошлого инспектирования удовлетворяющим требованиям GMP и на котором за всё время после инспектирования не возникло проблем с качеством, — 3–5 лет [13]. Аудиты могут быть удаленные (камеральные) или с физическим присутствием (выездные). В ходе удаленного аудита проверяется только документация в электронном виде. В ходе личного визита на предприятие регуляторные инспекторы проверяют состояние записей, соответствие помещений персонала и оборудования целям предприятия, изучают систему управления качеством и выносят предупреждения в случае нарушений.
Самые частые и критические инспекции — GLP (Good Laboratory Practice, надлежащая лабораторная практика), GCP, GMP и GVP (особенно в ЕС). Инспекции может подвергаться как организация в целом или отдельный продукт, так и процесс — например, клиническое исследование или производственная линия одного продукта.
В условиях международной торговли здесь крайне важны унификация и согласование действий между регуляторами разных стран. Хорошим примером может служить взаимодействие FDA и EMA. Согласование регуляторных процедур позволяет избежать дублирования инспекций. Очень важно, чтобы результатам инспекций одной стороны могла доверять другая [6]. ЕС и FDA в 2019 году наконец договорились о взаимном признании результатов GMP-инспекций. Также у ЕС есть договоры о взаимном признании с Австралией, Канадой, Израилем, Японией, Швейцарией и Новой Зеландией. С Китаем, Индией и Россией у ЕС есть соглашения о «регуляторном диалоге».
Наказания за нарушения GMP могут быть довольно суровыми. Так, в начале 1990-х годов в США проходило несколько уголовных дел, связанных со взятками чиновникам FDA и с подлогами. Сотрудники дженериковых компаний, в том числе рядовые, подделывали сертификаты анализов, предоставляли образцы оригинальных препаратов вместо воспроизведенных, меняли производственные условия, подделывая записи о них, и так далее. Помимо тюремных сроков и штрафов, с 1992 года виновные вносятся в черный список, и теперь FDA проверяет, не участвовали ли те, кто в нем находится, в работе над поданными заявками [11]. С компаниями, которые не соблюдают GMP, FDA также обходится очень строго: так, в 2002 году Schering-Plough выплатила полмиллиарда долларов в качестве изъятия в пользу государства доходов, которые она получила за три года, пока производила продукты с нарушениями GMP. Это стало следствием череды из 13 инспекций FDA на четырех заводах, где производилось 125 лекарств [11].
Надлежащая дистрибьюторская практика (GDP)
GDP стала важным дополнением к GMP в плане обеспечения населения безопасными лекарствами и другими продуктами. GDP обеспечивает качественную транспортировку, хранение и обращение с продуктами. GDP была принята ЕС в 1994 году, но сначала распространялась главным образом на зарегистрированные препараты. Затем GDP была распространена также и на транспортировку и хранение исходных веществ и сырья.
Основные аспекты, на которые направлена GDP — это лицензирование дистрибьюторов, температурный контроль и квалификация оборудования и помещений. Однако руководства GDP содержат также указания, направленные на борьбу с фальсифицированными продуктами и продуктами с истекшим сроком годности. GDP тесно связана с GMP (рис. 4), и в ЕС, например, существует общая рабочая группа GMP и GDP инспекторов.
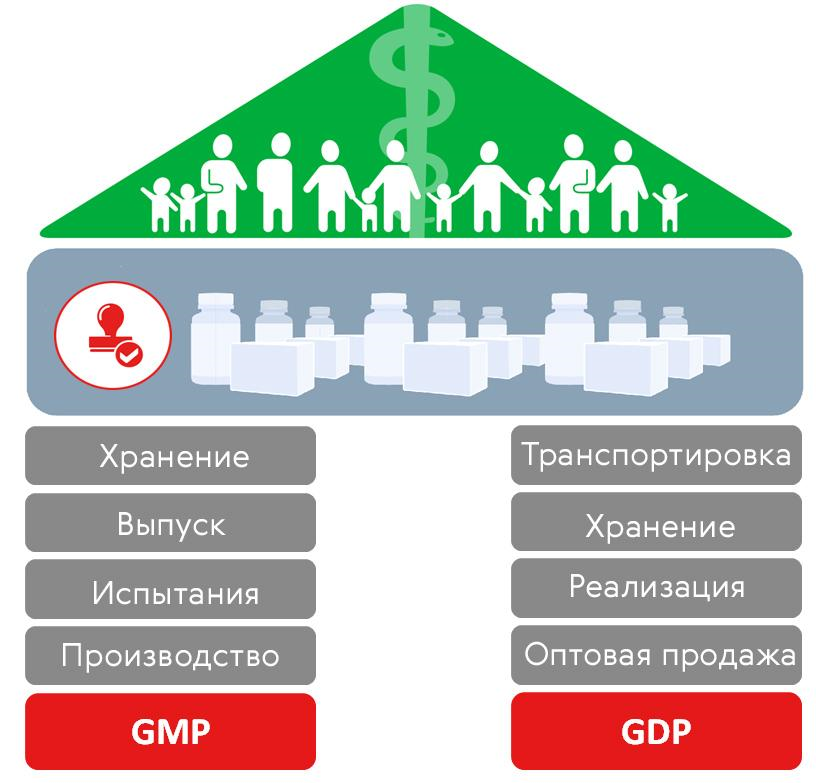
Рисунок 4. GDP и GMP — главные столпы обеспечения населения качественными продуктами.
Дефицит и прослеживаемость
ЕМА много внимания уделяет борьбе с дефицитом. В рамках ЕМА существует специальная рабочая группа по проблемам доступности лекарств. Дефицит лекарств и других продуктов может возникать по нескольким причинам: проблемы с производством (в том числе, вызванные нарушениями GMP), проблемы с цепочками поставки сырьевых и исходных материалов, промежуточных и готовых продуктов (в том числе, из-за нарушений GDP), внезапный рост спроса. Задача рабочей группы — координация усилий всех участников рынка по профилактике дефицитов, своевременному выявлению и снижению их последствий, например, одобрение и дистрибуция лекарств на замену дефицитным.
Тесно связанная с дефицитом проблема, отчасти способствующая решению проблемы дефицита, — это прослеживаемость, то есть маркировка лекарственных препаратов .
По мнению авторов статьи, термин «маркировка», применяемый в РФ, неудачен. В Европе и США используют понятие «средства безопасности», наносимые на упаковку. Они включают QR-код и индикатор первого вскрытия. Без защиты от первого вскрытия QR-код полностью теряет смысл. Именно так обстоят дела в России: QR-код обязателен, а индикатор первого вскрытия не обязателен, поэтому лекарство достаточно легко фальсифицировать. Маркировкой следует называть информацию о лекарстве, наносимую на упаковку, чтобы не возникало путаницы с QR-кодом.
Средства прослеживаемости полезны и при отзыве бракованных или просроченных продуктов. И конечно, они крайне важны в аспекте борьбы с контрафактными и фальсифицированными продуктами, а в США — для предотвращения параллельного импорта (когда лекарства нелегально ввозятся из стран с более низкими ценами в страны с более высокими). Внедрение прослеживаемости — непростой процесс, требующий больших материальных и организационных затрат на каждом задействованном предприятии в цепочке от производителей до аптек и специалистов, назначающих лекарства.
Контрафактные товары — это товары, нарушающие права интеллектуальной собственности или торговой марки. Фальсифицированные товары — это подделки, выдающие себя за другие, качественные товары. Фальсифицированные лекарства сопровождаются ложными сведениями об их подлинности, источнике и (или) истории и, таким образом, несут угрозу здоровью людей.
В России актуальна как проблема фальсификации, так и проблема нелегальной торговли больничными лекарствами в розницу [14]. Прослеживаемость возможна на разных уровнях: на уровне серий, отдельных упаковок или агрегированная, когда прослеживаются индивидуальные и групповые упаковки лекарств. У разных стран разные подходы к внедрению маркировки — в США и ЕС начали с маркировки индивидуальных упаковок, в Китае и Индии — серий [14]. В России система агрегированной маркировки внедрялась очень поспешно, в течение полутора лет, что привело к сбоям в ее работе с момента запуска 1 июня 2020 года, из-за чего процедуру маркировки пришлось временно упрощать. С 10 февраля 2022 года упрощенная процедура маркировки стала постоянной.
Good Clinical Practice (GCP)
GCP, или надлежащая клиническая практика, упоминалась в цикле статей о клинических исследованиях [15], однако там не рассматривались цели создания и содержание этих правил, поэтому остановимся на них здесь.
До 1996 года, то есть до разработки правил ICH GCP, на разных территориях существовали свои стандарты проведения КИ, хотя и основанные на одной Хельсинской декларации (первая редакция 1964 г.), но воплощающие ее по-своему. Целью создания общих правил была гармонизация регуляций и руководств по клинической разработке лекарств, чтобы сделать возможным взаимное признание данных, полученных на различных территориях, и снизить количество дублирующих друг друга действий.
В итоге был разработан международный этический и научный стандарт качества проведения КИ, описывающий требования к дизайну, проведению исследований, ведению записей и отчетности (рис. 5). В его основу были положены права участников исследования, их безопасность и благополучие, а также необходимость получения достоверных и надежных данных.
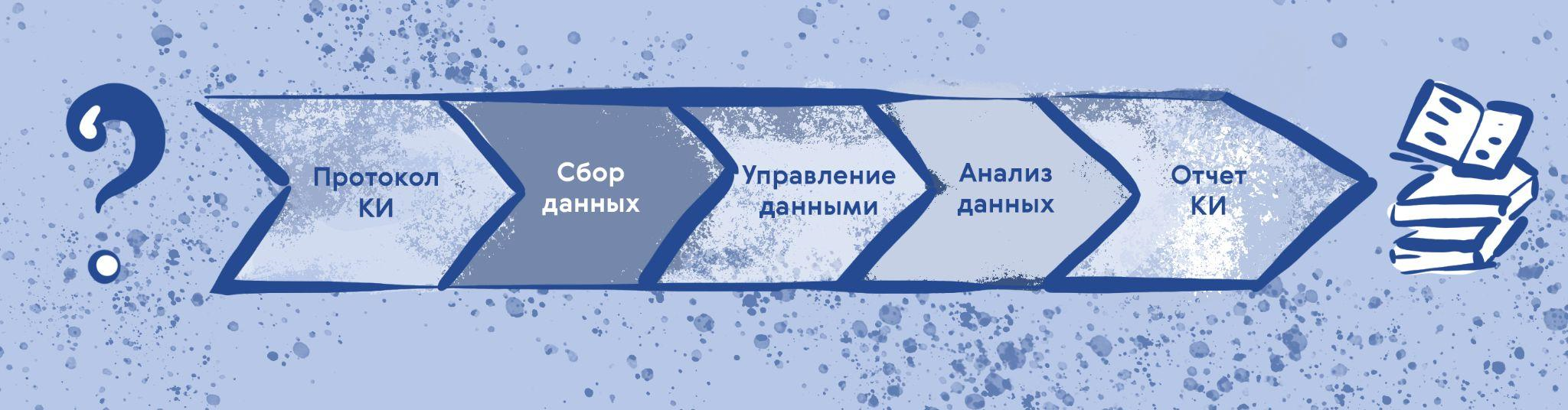
Рисунок 5. Поток данных в ходе КИ. Основные документы на входе — это протокол, брошюра исследователя, информированные согласия. На выходе — отчет об исследовании.
За соблюдение правил GCP отвечают все участвующие стороны (кроме, разумеется, пациентов) — спонсор КИ, исследователи, контрактная исследовательская организация (CRO), вендоры, клинические лаборатории, центры визуализации, этические комитеты, регуляторные органы.
Принципы GCP, сформулированные ВОЗ еще до принятия ICH, изложены ниже:
- Этичность. Исследования, включающие людей, должны не только соблюдать права пациентов, но и быть научно осмысленными. Неэтично подвергать риску пациентов, если в результате получаются данные низкого качества или вообще не получается никакой новой информации.
- Исследование должно быть заранее описано в четком, научно обоснованном протоколе и проводиться в соответствии с ним.
- До проведения исследования необходимо выявить его риски. Для этого нужно максимально использовать имеющуюся неклиническую и клиническую информацию (если есть).
- Необходимо сопоставить риски и пользу (это называется risk-benefit assessment). Польза для науки и общества при этом принимаются во внимание, но на первом месте стоит безопасность и здоровье субъектов исследования.
- Необходимо получить одобрение независимого этического комитета до проведения исследования.
- Все участники исследования должны дать информированное согласие. Если они не в состоянии этого сделать, за них это делают законные представители.
- Оценка соотношения пользы и риска должна проводиться постоянно в ходе исследования, и участники могут продолжать участие в исследовании, только если польза превышает риск.
- Исследования должны проводиться специально обученными и подготовленными людьми, имеющими соответствующий опыт.
- Вся информация о КИ должна собираться и храниться, чтобы в любой момент ее можно было интерпретировать и верифицировать. В частности, КИ в любой момент могут подвергнуться аудиту.
- В отношении записей о пациентах должна соблюдаться конфиденциальность.
- Исследуемые продукты нужно изготавливать, перемещать и хранить в соответствии с GMP.
- Должны быть внедрены процедуры, обеспечивающие качество всех аспектов исследования.
Стандарт GCP вводит очень важный документ — брошюру исследователя. Там излагаются физико-химические и фармакологические свойства продукта, приводится описание неклинических и клинических исследований, делается предположение о возможных рисках, на которые исследователю следует обратить внимание.
Другие GxP
Надлежащие практики обозначают общей аббревиатурой GxP. Их довольно много — помимо описанных выше GCP, GDP и GMP, есть еще GLP (надлежащая лабораторная практика, о которой подробно рассказывалось в статье «Биомолекулы» о доклинических исследованиях [9]), GVP (надлежащая практика фармаконадзора, о которой рассказывалось во второй статье нашего спецпроекта [2]), GCLP (надлежащая клиническая лабораторная практика — устанавливает правила проведения исследований в лабораториях, где анализируются образцы, полученные в ходе клинических исследований), надлежащая аптечная практика, надлежащая фармакоэпидемиологическая практика, надлежащая фармакопейная практика, и много-много других. Они не настолько гармонизированы (или вообще не гармонизированы), как основные GxP, и их разработкой занимаются не такие мощные и заметные международные организации, как ВОЗ или ICH.
На рис. 6 приведена схема того, какие GxP используются на разных этапах жизненного цикла лекарства.
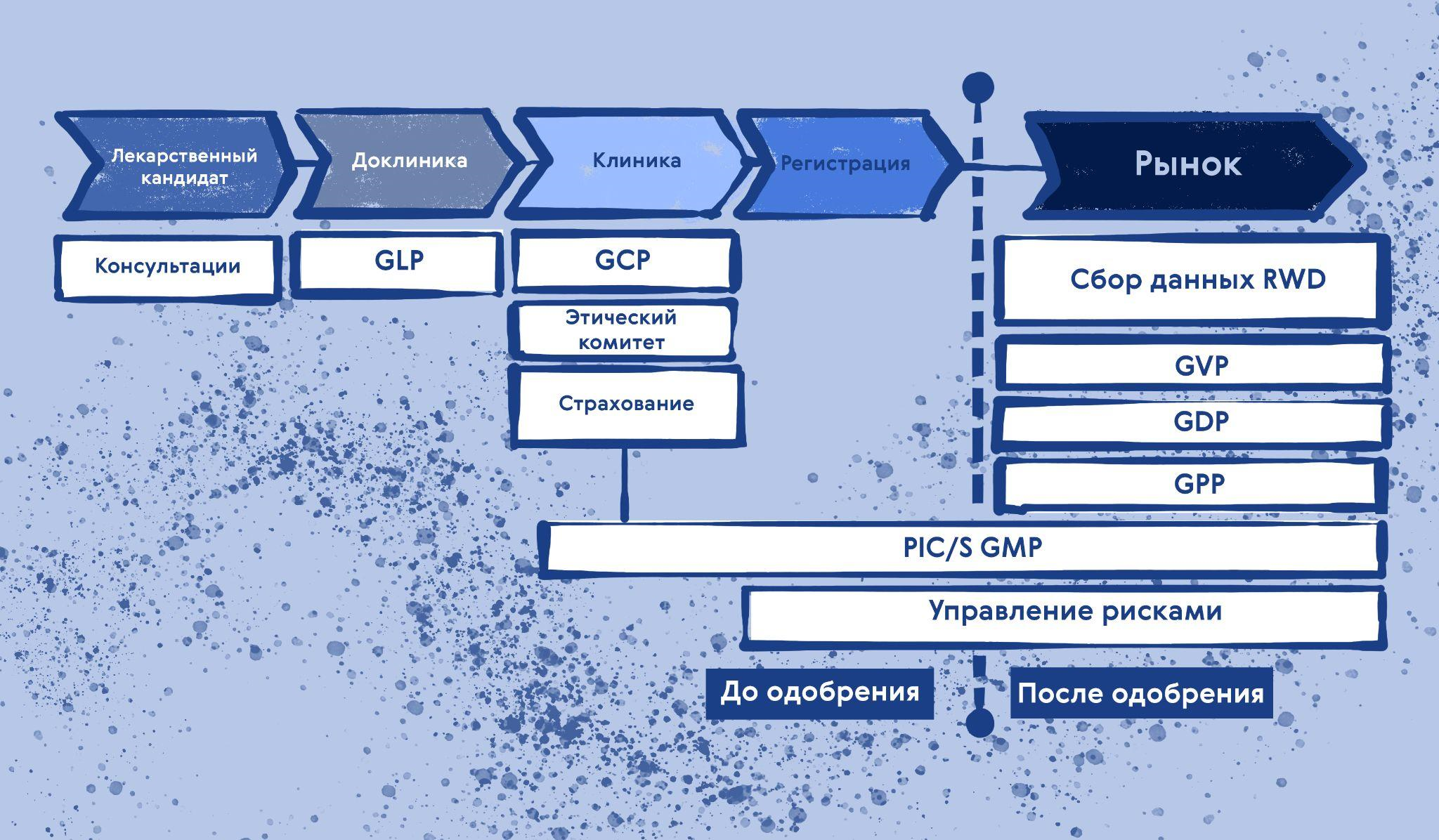
Рисунок 6. Наложение различных регуляций на жизненный цикл лекарств и продуктов.
иллюстрация Карины Илиопуло по FDA Тайваня
Подчеркнем еще раз единство принципов, заложенных во все GxP (см. также рис. 7):
- Четкость и прозрачность: все действия должны регулироваться стандартными операционными процедурами (СОПами). Причем СОПы должны быть буквально на всё. Известен случай, когда одна лаборатория не прошла аудит, потому что процедура предполагала перемещение пробирок между этажами, а в организации не было СОПа, предусматривающего, как именно пробирки попадают с этажа на этаж. Все процессы и оборудование должны быть валидированы. Что такое валидация, «Биомолекула» объясняла в статье о наработке антител [16].
- Проверяемость: организации, работающие по GxP, должны быть готовы к внешним аудитам, в том числе — неожиданным.
- Документируемость и прослеживаемость: есть такой принцип — «если что-то не было документировано, это не было сделано». Записи должны вестись абсолютно обо всем, они должны быть датированы, и у каждого действия должен быть ответственный. Только так в случае проблем можно «отмотать назад» и понять, на каком этапе и что пошло не так. Отдельно оговаривается длительное и надежное хранение архивов. Как говорится, процесс хорош ровно настолько, насколько хорошо он описан.
- Профессионализм сотрудников: обязательный элемент любого GxP — тренинги, касающиеся как выполнения, так и документации процедур.
![Общая суть всех GxP — принцип пяти [латинских] «Р»: Общая суть всех GxP — принцип пяти [латинских] «Р»:](/img/content/3641/3641-07.obschaya-sut-gxp.png)
Рисунок 7. Общая суть всех GxP — принцип пяти [латинских] «Р»: люди (people), помещения и оборудование (premises and equipment), процедуры (procedures), процессы (processes) — всё это обеспечивает пятое «Р» — продукты (products).
Роль человеческого фактора — намеренного или ненамеренного — никогда нельзя исключать, поэтому, повторим, система обеспечения и контроля качества должна быть выстроена так, чтобы минимизировать риски, связанные и с ним, и с другими неблагоприятными воздействиями.
Оценка технологий здравоохранения
Законодательство ЕС в области регулирования лекарств и других продуктов во многих отношениях образцово, поэтому имеет смысл остановиться на других областях, важных для нашей темы. Так, страны и правительство ЕС озабочены равным доступом населения к современным лекарствам, поэтому вопросы цен, страхования и фармакоэкономики не уходят из повестки. Эта область относится к деятельности под названием Health Technology Assessment (HTA, оценка технологий здравоохранения). Тут принимается во внимание не только соотношение пользы и рисков, но и стоимость вмешательства (диагностики, профилактики, терапии) и влияние на параметры здоровья населения в целом. Важным аспектом HTA является тот факт, что различные вмешательства для одного и того же состояния сравниваются друг с другом для определения относительной эффективности и экономичности, в то время как в рамках регуляторной экспертизы такая сравнительная оценка не проводится и даже в какой-то мере запрещена, за что регуляторы нередко подвергаются критике; «Биомолекула» подробнее касалась этой темы в статье о фармакоэкономике [22]. У разных стран свои подходы к этой проблеме, и во многих есть государственные органы, занимающиеся HTA, такие как NICE (The National Institute for Health and Care Excellence) в Великобритании. Здесь также необходима гармонизация, так как различие требований регуляторов и органов НТА замедляют и затрудняют выход на рынок новых лекарств. В России оценкой технологий здравоохранения занимается Центр экспертизы и контроля качества медицинской помощи.
Проблема пока далека от решения, но в ЕС для эффективного сотрудничества между национальными органами НТА была создана EUnetHTA (European Network for Health Technology Assessment). ЕМА также должно сотрудничать с органами НТА стран — членов ЕС.
Впрочем, до сих пор фармакоэкономические решения принимаются на национальном уровне, поэтому фармкомпаниям приходится договариваться о покрытии страховкой с каждой страной по отдельности, причем в подавляющем большинстве случаев в режиме конфиденциальности. В случае новых дорогих препаратов генной терапии это пока что приводит к тому, что препараты выходят на самые привлекательные рынки Германии, Великобритании, Италии, а в остальных странах недоступны. Так, в частности, произошло в отношении одного из самых дорогих в мире лекарств — Libmeldy компании Orchard Therapeutics — для лечения метахроматической лейкодистрофии (цена более 3 млн долларов). А компания bluebird bio, хоть и получила в ЕС регистрацию своей генной терапии для лечения церебральной адренолейкодистрофии, вынуждена была уйти из ЕС, так как не смогла договориться по цене ни с одним из регуляторов. Правда, через некоторое время продукт был зарегистрирован в США, тоже с ценой в 3 млн долларов. Американский Институт изучения фармакоэкономики ICER подсчитал, что такие цены на генные терапии однократного применения оправданы, потому что годовые затраты на пациентов с редкими генетическими болезнями достигают в развитых странах сотен тысяч долларов, то есть через несколько лет лекарство «отобьется». С другой стороны, это не решает проблему недоступности современных терапий в странах с низким и средним уровнем доходов населения.
Проблемы в России
«Биомолекула» уже не раз касалась проблем регулирования лекарств и других продуктов, влияющих на здоровье, в России, поэтому только вкратце резюмируем их тут.
Основных проблем две: это недостаточное внедрение лучших регуляторных практик и недостаток квалифицированных специалистов. В итоге это выливается в такие негативные феномены, как недоверие врачей и пациентов к произведенным в России лекарствам и в присутствие на рынке некачественных лекарств, лекарств с недоказанной эффективностью или даже с доказанной неэффективностью — достаточно зайти в любую аптеку и посмотреть на полки.
Сложившаяся в РФ регуляторная практика не удовлетворяет ряду признаков эффективных регуляторных систем, изложенных в принципах ВОЗ. Важнейшие из них — понятность нормативов и прозрачность механизмов принятия решений. Нередко возникают затруднения в получении доступа к экспертным заключениям после регистрации нового лекарства, что ограничивает публичные обсуждения эффективности и безопасности продуктов, а также добавляет барьеры по своевременному выводу дженериков и биоаналогов на рынок. Нормативно-правовая база в РФ страдает неполнотой, противоречивостью и отсталостью от лучших мировых практик. Фрагментирована и система управления и контроля в этой области (так, регуляция обращения лекарств разделена между пятью ведомствами, взаимодействие между ними налажено слабо). Некоторое улучшение наметилось в связи с переходом на законодательство ЕАЭС, но и этого недостаточно. Уже сейчас можно констатировать, что более высокие требования ЕАЭС не выполняются, а система улучшается только на бумаге. В идеале, необходимо полностью перенять лучшие практики ЕС и ВОЗ, тем более что законодательство ЕАЭС и так уже много из них заимствовало, но и этого недостаточно: чтобы законы и правила соблюдались, должны существовать достаточно квалифицированные исполнители, которые должны быть интегрированы в мировое профессиональное сообщество. Кроме того, правила необходимо постоянно обновлять, и этим должны заниматься не просто чиновники, а высокопрофессиональные объединения из представителей науки, индустрии и государств, как это делается в ЕС и США.
А пока, к сожалению, в России нет ни полностью работающих по GLP лабораторий, которые бы обеспечивали весь объем неклинических исследований, ни признания GMP странами-членами ICH и ВОЗ, ни современной системы фармацевтического инспектората, ни полного внедрения GDP и надлежащей аптечной практики. Что касается клинических исследований, Россия до 2022 года была привлекательной страной для проведения международных многоцентровых клинических исследований (ММКИ) в связи со скоростью набора и большим населением. Многие исследователи и сотрудники клинических центров благодаря этому обучились принципам GCP, однако сейчас практически все ММКИ прекращены. Исследования же, проводимые внутри России, зачастую страдают нарушениями этических и научных стандартов [23].
ВОЗ разработала руководства, направленные на оценку, выявление проблем и улучшение регуляторных систем отдельных стран-членов ВОЗ. Так, еще одним дополнением семейства GxP стала GRP — Good Regulatory Practice, надлежащая регуляторная практика. Это система руководств и методов, направленная на улучшение регуляций в любых областях на основе стандартов ISO 9000, а ВОЗ приспособила ее для здравоохранения. При этом ВОЗ учитывает особенности каждой страны и уровень, на котором находится ее регуляторная система.
В основе ВОЗ GRP лежат 9 принципов: законность, непротиворечивость, независимость, справедливость, соразмерность, гибкость, понятность, эффективность, прозрачность .
Почти все понятия либо самоочевидны, либо мы освещали их ранее, кроме соразмерности. Под ней понимается, что регуляторный контроль должен быть соразмерен риску, которому подвергаются люди. То есть, грубо говоря, продукт, изготовленный штучно в аптеке, должен подвергаться менее строгому регулированию, чем изготовленный серийно на заводе для миллионов людей.
Для оценки регуляторных систем разработана методология The Global Benchmarking Tool (GBT), по которой оценивается уровень «зрелости» регулирования той или иной страны. GBT включает в себя более 250 показателей, в том числе, различные надлежащие практики GxP.
Страны, в которых существуют только отдельные элементы регулирования, находятся на 1 уровне; страны, где есть регуляторные системы, частично выполняющие важнейшие регуляторные функции — на уровне 2. Качество продуктов в странах 1 и 2 уровня можно обеспечить, только если они опираются на более зрелые регуляторные системы. На уровне 3 находятся страны с зрелой регуляторной системой, выполняющей все важнейшие функции, на уровне 4 — страны с постоянно совершенствующейся регуляторной системой, находящиеся в авангарде новых тенденций.
Сейчас продолжается переходный период оценки стран по новой шкале (раньше ВОЗ использовала понятие «строгого регулятора», Stringent Regulatory Authority). На апрель 2022 года на 1 уровне находилось 98 стран, на 2 — 40, на 3 и 4 — 56 стран. В списке переходного периода Россия присутствует с пометкой, что в отношении регулирования вакцин в ней имеется функциональная регуляторная система, которая оценивалась ВОЗ в 2016 году, до введения новой системы оценки. Россия пока не входит в число стран, которые подверглись оценке ВОЗ по новой методологии (рис. 8) [24].
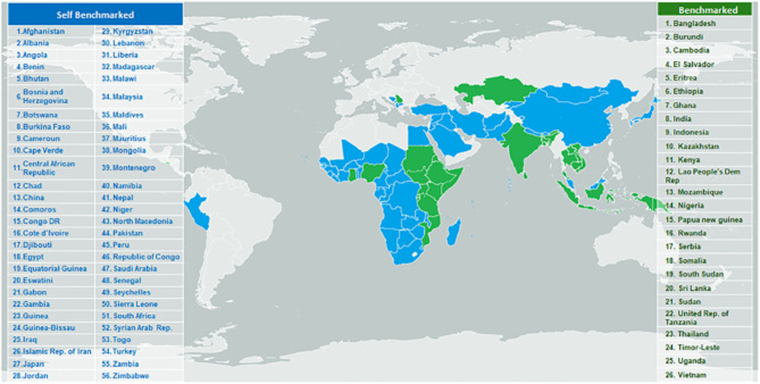
Рисунок 8. Страны, прошедшие оценку ВОЗ по методологии GBT. Синим цветом отмечены страны, оценившие себя сами, зеленым — прошедшие внешнюю оценку.
В декабре 2018 года Танзания стала первой страной Африки, достигшей 3 уровня зрелости по GBT ВОЗ в отношении и лекарств, и вакцин [24] — прекрасная иллюстрация того факта, что прогресс начинается с признания своей отсталости. У Минздрава РФ в начале 2022 также начались переговоры с ВОЗ о начале аккредитации. На момент написания этой статьи (в конце 2022 года) более свежих новостей об этом процессе не найдено.
Выводы
Регуляторные системы в области лекарств и других продуктов, касающихся здоровья, складываются не из стремления к бюрократии и не для того, чтобы усложнить жизнь разработчикам, а наоборот, чтобы упростить разработку эффективных, безопасных и качественных продуктов. К сожалению, бывает (но не всегда), что бизнес старается ровно настолько, насколько от него это требует регулятор. Поэтому неизбежно в странах с более слабой регуляторикой интересы и здоровье людей будет меньше защищены, чем когда регуляторная система сильная и зрелая. Однако тут важно не переборщить и не зарегулировать отрасль настолько, что она станет непривлекательной для бизнеса и инноваций.
Современная регуляторная система не может существовать в отрыве от мировых тенденций, без взаимодействия с ВОЗ и регуляторными агентствами территорий с развитой регуляторикой, таких как США и ЕС. В изоляции невозможно обеспечение людей качественными лекарствами и продуктами, развитие регуляторной системы в соответствии с новыми, постоянно появляющимися научными знаниями.
В частности, успех ICH обусловлен тем, что впервые специалистам, ученым, представителям индустрии и чиновникам была предоставлена площадка для научных обсуждений того, как разрабатывать лекарства в разных регионах и с изначально различающимися подходами, ставя во главу угла интересы пациентов. Участие всех заинтересованных сторон в процессе создания регуляторных систем, опора на научную целесообразность, прозрачность и открытость — залог создания эффективного регулирования и, в конечном итоге, здоровья людей.
Литература
- И царствуют, и правят: как регуляторы следят за допуском лекарств на рынок;
- Доверяй, но проверяй: как контролируют эффективность и безопасность лекарств и других продуктов после регистрации?;
- Весь мир — большая лаборатория: что такое RWD и RWE, и как они помогают контролировать лекарства;
- Контроль качества биотехнологических продуктов;
- Embrey M., Ryan M. Management Sciences for Health. MDS-3: Managing Access to Medicines and Health Technologies. Arlington, VA: Management Sciences for Health, 2012. — 1088 p.;
- Lezotre P.-T. International Cooperation, Convergence and Harmonization of Pharmaceutical Regulations. 1st Edition. Academic Press, 2022. — 376 p.;
- Roache A. International Council for Harmonisation US FDA and Health Canada Regional Public Consultation. Center for Drug Evaluation and Research, 2017;
- Lenita Lindström‐Gommers, Theresa Mullin. (2019). International Conference on Harmonization: Recent Reforms as a Driver of Global Regulatory Harmonization and Innovation in Medical Products. Clin. Pharmacol. Ther.. 105, 926-931;
- От живого к неживому. Доклинические исследования сегодня и завтра;
- Генные и клеточные лекарства: сложное регулирование для сложных продуктов;
- Immel B. (2001). A Brief History of the GMPs for Pharmaceuticals. Pharm. Technol. 7, 44–52;
- Lazar M. (2015). ICH’s Future Reforms — Its Strengths and Weaknesses. Pharmaceutical Outsorcing;
- Frolovs G. (2022). Guide to Quality Audits in the Pharmaceutical Industry. SimplerQMS;
- Булгаков П., Харитонов А. (2021). Маркировка лекарственных препаратов. Мировой опыт и основные выводы по итогам 3500 успешных внедрений. Фармацевтическая отрасль. 1, 26–31;
- С миру по нитке: как соединились компоненты клинического исследования;
- Наработка антител для доклинических и клинических испытаний;
- PMI Science. (2022). Перечень вредных и потенциально вредных компонентов ФМИ-58;
- D M Burns, E Dybing, N Gray, S Hecht, C Anderson, et. al.. (2008). Mandated lowering of toxicants in cigarette smoke: a description of the World Health Organization TobReg proposal. Tobacco Control. 17, 132-141;
- PMI Science. (2022). Что такое сигаретные смолы?;
- PMI Science. (2022). Научное досье ЭСНТ представлено контролирующим органам в соответствии с Директивой ЕС о табачной продукции;
- PMI Science. (2017). PMI Presents to US FDA Advisory Committee;
- Фармакоэкономика: лечить или экономить?;
- Petr Talantov, Ravil Niyazov, Galina Viryasova, Margarita Dranitsyna, Ilya Yasny. (2021). Unapproved clinical trials in Russia: exception or norm?. BMC Med Ethics. 22;
- Cécile Macé, Lembit Rägo, Raffaella Ravinetto. (2022). How the concept of WHO-listed authorities will change international procurement policies for medicines. BMJ Glob Health. 6, e008109.