Автоматизация разработки лекарств
01 октября 2021
Автоматизация разработки лекарств
- 2512
- 1
- 8
Мечта разработчика лекарств: отправил машине информацию о болезни — через неделю получил таблетку
рисунок Анастасии Волчок
-
Автор
-
Редакторы
-
Иллюстратор
При создании и разработке лекарств невозможно в точности заранее теоретически рассчитать, какой должна быть структура действующего вещества. Поэтому наша статья — не про компьютерные методы, а про «мокрые». Из-за невероятной сложности живых систем часто приходится действовать методом проб и ошибок, делая предположения и проверяя их на практике. Что касается проверки: современные методы автоматизации позволяют перебрать гораздо больше вариантов, чем раньше, когда приходилось «капать» вручную. Зачастую именно это позволяет найти такую формулу будущего лекарства, которая приведет к успеху. В этой статье спецпроекта речь пойдет об автоматизации лабораторных методов, с помощью которых создают и разрабатывают современные лекарственные препараты.
Автоматизация в биологии

Работа в современной биологической лаборатории кардинально отличается от той, что велась в ней каких-то 100–150 лет назад. Многие процедуры давно превратились в рутину, которую зачастую выполняет не сам экспериментатор, а автоматизированные приборы. Это позволяет не только упростить процесс, но и высвободить время для новых творческих задач. В спецпроекте «Автоматизация в биологии» мы проследим, какой путь прошли современные приборы, повсеместно использующиеся в экспериментах по геномике и протеомике, цитометрии, генной инженерии и драг-дизайну.
Куратором спецпроекта стал Денис Баев — глава центра коллективного пользования по проточной цитометрии и сортировке клеток Института канцерогенеза Кандиоло, Италия.
Партнер спецпроекта — компания Beckman Coulter Life Sciences, мировой лидер в разработке решений для автоматизации сложных биомедицинских лабораторных процессов.
Современная рациональная разработка лекарств начинается с определения молекулярной мишени, на которую нужно воздействовать, чтобы изменить течение болезни [1]. Но вот когда мишень выбрана — как найти нужное вещество, которое с ней свяжется? Химическое пространство (всё множество молекул, из которых выбирают нужную) огромно. Подсчитано, что органических соединений размером до 30 атомов может быть 1063 [2] — для их синтеза не хватит атомов во Вселенной. Однако все их перебирать и не требуется: химическое пространство можно радикально сузить компьютерными методами . Сейчас без моделирования in silico не обходится ни один проект по разработке лекарств любых типов, будь то малые молекулы, белки или генотерапевтические продукты. Но у компьютерных методов есть свои ограничения: как бы вы ни тренировали компьютерные модели, наступает экспериментальный этап, на котором нужно синтезировать и протестировать тысячи, а иногда сотни тысяч выбранных компьютером кандидатов, и лишь малая часть из них пройдет дальше — на стадию доклинических, а затем и клинических испытаний . О том, как автоматизировать эти экспериментальные процессы, мы и поговорим.
«Биомолекула» много писала о драг-дизайне компьютерными методами: «Драг-дизайн: как в современном мире создаются новые лекарства» [3] и «Виртуальные тропы реальных лекарств» [4]. Не менее подробно мы освещали концепцию in silico в целом: «In vivo — in vitro — in silico» [5] и «12 методов в картинках: “сухая” биология» [6]. Поэтому в данной статье речи про компьютерные исследование не будет, а поговорим мы именно про лабораторные процедуры.
Как устроены клинические исследования, можно прочитать в одноименном спецпроекте (например, в статье «С миру по нитке: как соединились компоненты клинического исследования» [7]).
Автоматизация позволяет, во-первых, получить и изучить такое количество веществ, с каким вручную было бы не справиться, и, во-вторых, сделать это более стандартизованным и аккуратным способом, в одинаковых условиях. Так можно сократить время разработки и повысить вероятность успеха за счет обнаружения таких вариантов молекул, которые были бы пропущены при поиске вручную.
Шесть лет назад «Биомолекула» уже писала об автоматизации в лаборатории [8]. И хотя эта область развивается семимильными шагами, статья все еще актуальна!
После идентификации мишени лекарства [1] разрабатывают аналитический метод, который позволяет измерить параметры взаимодействия веществ с мишенью, и приступают к поиску хитов (hits) — веществ, которые хоть как-то с ней свяжутся. Затем среди лучших хитов определяют лиды (leads), которые дополнительно обладают хорошими селективностью и фармакологическими свойствами (это стадия hit-to-lead, о которой подробнее рассказывается ниже). Лучшие лиды отправляются на оптимизацию (lead optimization), в результате которой получается лекарственный кандидат. Он и становится объектом последующих доклинических и клинических исследований (рис. 1).

Рисунок 1. Упрощенная схема ранней разработки лекарства. доКИ — доклинические исследования.
рисунок Анастасии Волчок по Hit to lead and lead to candidate optimisation using multi-parametric principles и High Throughput Screening Facility
Ход ранней разработки лекарства удобно рассматривать в рамках циклической концепции молекулярного дизайна (рис. 2).
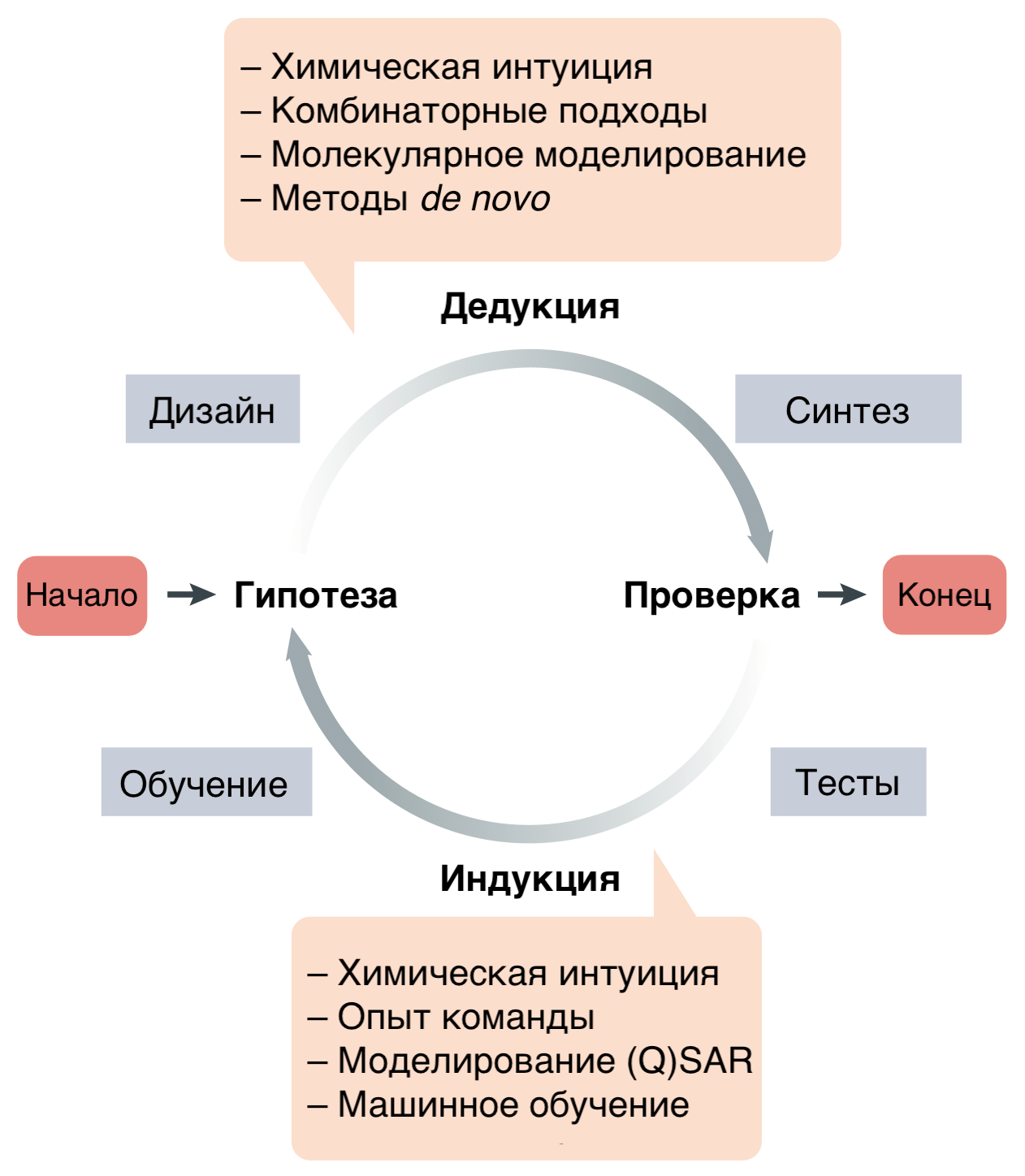
Рисунок 2. Ранняя разработка новых лекарственных препаратов — деятельность с обратной связью и чередующимися этапами дедукции и индукции. В итоге получаются оптимизированные соединения-кандидаты (хиты и лиды). Методы de novo — синтез молекул из простых соединений (в противоположность использованию известных сложных веществ в качестве стартового материала). (Q)SAR — (quantitative) structure activity relationship, см. сноску ниже.
На этом этапе после получения начальных кандидатов (хитов) приходится решать задачу многомерной оптимизации: кандидатные молекулы должны одновременно хорошо связываться с мишенью, не связываться с другими молекулами в организме (обладать селективностью) и иметь приемлемые для лекарств характеристики, такие как растворимость, легкость синтеза и оптимальные показатели ADMET (absorption, distribution, metabolism, excretion, toxicity — то есть адсорбцию, распределение, метаболизм, выведение и токсичность) .
В ходе стадий hit-to-lead и lead optimization устанавливается взаимосвязь между структурой и активностью: structure activity relationship (SAR) — одно из ключевых понятий медицинской химии. SAR (как и количественный SAR — quantitative SAR, QSAR) позволяет определить, как введение тех или иных функциональных групп в молекулу влияет на ее связывание с мишенью и другие свойства. Циклический характер оптимизации молекулы как раз и позволяет использовать результаты экспериментов как входные данные для уточнения моделей SAR.
В настоящее время процесс получения хита после идентификации мишени занимает в среднем 12 месяцев. Еще около 18 месяцев уходит на оптимизацию хита и получение лида. После этого лид требует дополнительной оптимизации, которая, как правило, занимает еще 12 месяцев, и только после этого получается лекарственный кандидат [9]. Очевидно, что пространство для улучшения здесь огромно.
Продуманная автоматизация отдельных частей цикла позволяет снизить элемент случайности и ошибки, повысить продуктивность процесса и снизить затраты на синтез и изучение бесперспективных соединений.
Основной технологией, позволившей автоматизировать многие стадии процесса, стала миниатюризация: микрофлюидные методы синтеза (миниатюрные проточные реакторы, где жидкости смешиваются в малых объемах), применение гранул (beads — микросферы, на которых адсорбированы вещества для анализа), лаборатории- и органы-на-чипе (миниатюрные модели тканей, имитирующие органы в живом организме) и другие инструменты [10]. Общая направленность этих усилий — перейти от циклических процессов (batch) к непрерывным (continuous) . При циклическом процессе в реакторе или аналитической системе создаются начальные условия, далее проходит реакция или анализ, и в конце требуется собрать продукт или получить результат анализа. При непрерывном процессе реагенты или аналиты всё время подаются на вход системы, происходит постоянный выход продукта и постоянный контроль результатов. Непрерывные процессы легче автоматизируются, а значит, требуют меньше человеческих затрат. Они также лучше встраиваются в линию с другими процессами, а значит, подходят для использования в полностью автоматизированных лабораториях.
Мы уже писали об этой тенденции в статьях «Биотехнология антител» [11] и «Наработка антител для доклинических и клинических испытаний» [12].
Естественно, вся автоматизация экспериментов работает в тесной связке с вычислительными методами — сейчас это часто методы машинного обучения (machine learning), — позволяющими обработать результаты экспериментов и «предсказать», что делать дальше.
Давайте рассмотрим автоматизацию отдельных экспериментальных стадий цикла ранней разработки, начиная с синтеза новых соединений, предсказанных на этапе моделирования in silico.
Автоматизация синтеза
После того, как in silico предсказаны молекулы, которые нужно синтезировать [3], перед исследователями встает следующая задача: с какого конца браться за синтез нового сложного органического соединения? Для планирования и обработки результатов синтеза требуется вначале построить сложные математические модели с обратной связью, предсказывающие пути реакций и позволяющие корректировать начальные параметры исходя из свойств получающихся продуктов. Сейчас для этой цели всё шире применяются методы машинного обучения. В качестве обучающих выборок они могут использовать имеющиеся базы данных, которые содержат десятки миллионов химических реакций, организованных в ориентированные графы (рис. 3) [13].
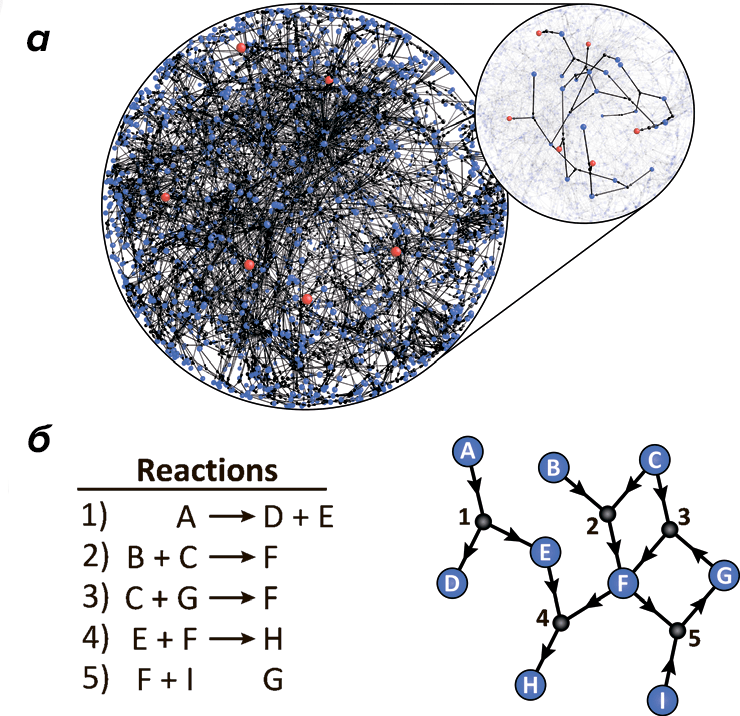
Рисунок 3. «Сеть органической химии» (Network of organic chemistry, NOC) — двухчастный ориентированный граф, содержащий узлы двух видов и ребра, имеющие направление. а — Небольшой фрагмент сети, на котором красными точками отмечены нужные соединения. Современные вычислительные методы позволяют найти близкие к оптимальным планы синтеза, несмотря на размер и сложность сети. б — Иллюстрация того, как из реакций получается двухчастный ориентированный граф.
Первые успехи в автоматизации синтеза были достигнуты в области получения пептидов, олигонуклеотидов и олигосахаридов. Это логично, так как ключевой элемент любого автоматизированного синтеза — наличие простых строительных блоков — кирпичиков, из которых строятся более сложные соединения.
Оказалось, что такой комбинаторный подход годится и для синтеза сложных органических соединений (рис. 4). Конечно, так нельзя получить любые вещества, потому что некоторые реакции требуют экзотических условий (например, высоких температуры и давления, агрессивных растворителей), но обычно из небольшого количества строительных блоков удается получить довольно большое разнообразие новых соединений.
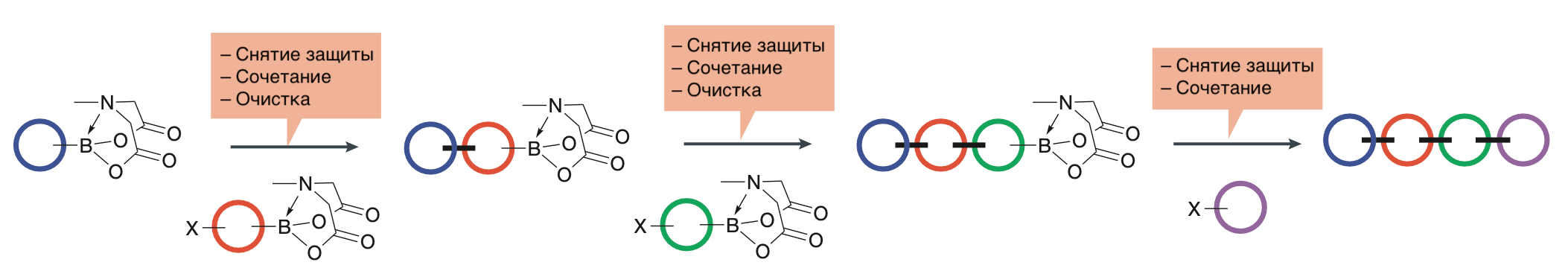
Рисунок 4. Пример схемы синтеза органического соединения, которая хорошо поддается автоматизации
Как уже говорилось, микрофлюидные технологии сыграли центральную роль в автоматизации синтеза лекарств. Микрофлюидные реакторы, объединенные с аналитическими устройствами, детектирующими продукт в реальном времени, позволили параллельно проводить тысячи реакций, что было бы недоступно при использовании макроскопических технологий (рис. 5) [14]. Кроме того, микрофлюидика позволяет снизить затраты реактивов и уменьшить контакт экспериментаторов с потенциально вредными веществами. Малые размеры микрофлюидных каналов и большое отношение площади поверхности реакционных камер к объему обеспечивают нужную скорость переноса тепла и масс, повышая эффективность реакций.
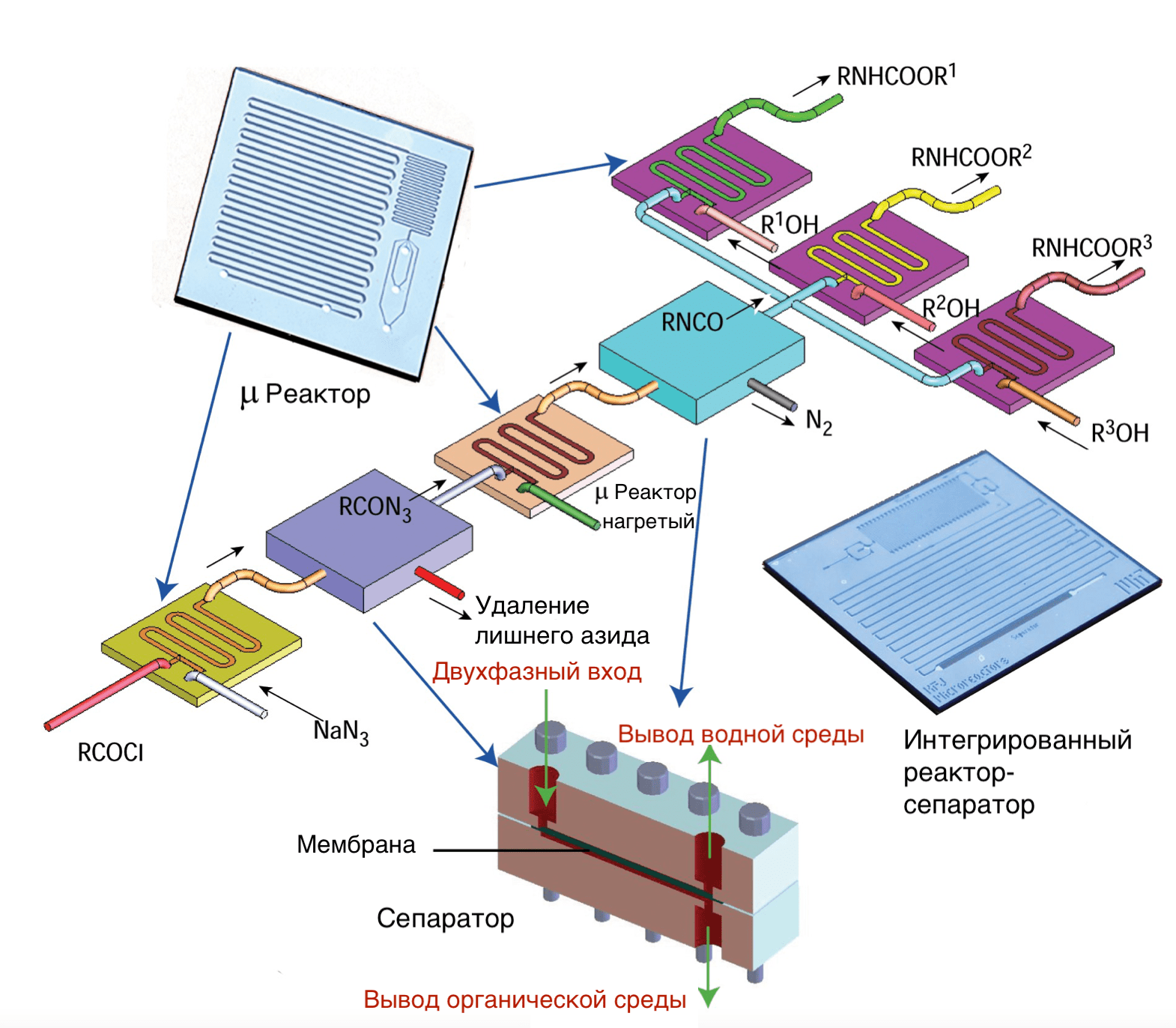
Рисунок 5. Микрофлюидный реактор для поточного синтеза карбаматов из азида и хлоридов органических кислот. Реакция включает три стадии синтеза и две стадии очистки.
Систему с непрерывным потоком (continuous flow) использовали для синтеза тамоксифена — важного лекарства, которое применяют при раке молочной железы, бесплодии и других заболеваниях. Типичный курс тамоксифена — 5 лет по 10 мг каждый день: понятно, что потребность в эффективном способе получения очень высока. Обычный способ — это четыре отдельных стадии синтеза с выделением продуктов и отделением нужного энантиомера. А переход от четырехстадийного синтеза к системе с непрерывным потоком позволил с высоким выходом получить за 80 минут количество тамоксифена, достаточное для полного курса лечения одного человека [15].
Точный контроль реакционного времени, возможный в микрофлюидных проточных реакторах также позволяет синтезировать вещества, которые иначе было бы трудно получить: например, так был получен селективный лиганд ретиноидного рецептора α (RARα) с общим временем нахождения на чипе 13 с и производительностью 100–200 мг/мин. Синтез такого вещества традиционными методами выполняется в пять стадий с очень низким общим выходом (3,4%) [16].
В некоторых случаях на подмогу микрофлюидным технологиям приходят капельные (droplet) (рис. 6). Капельки в каком-то смысле представляют собой миниреакторы с объемом порядка фемтолитров (10⁻¹⁵ л; так что может это фемтореакторы?), что позволяет очень точно настраивать параметры реакций [17]. Забегая вперед, скажем, что капельки идеально подходят и для скрининга получающихся соединений: в них более контролируемым способом протекают ферментативные реакции, а также открываются возможности для тестирования веществ на отдельных клетках (single cell technologies) [18]. Это бывает полезно для того, чтобы исключить межклеточную гетерогенность, очень характерную, в частности, для раковых клеток, и получить лучше интерпретируемые результаты.
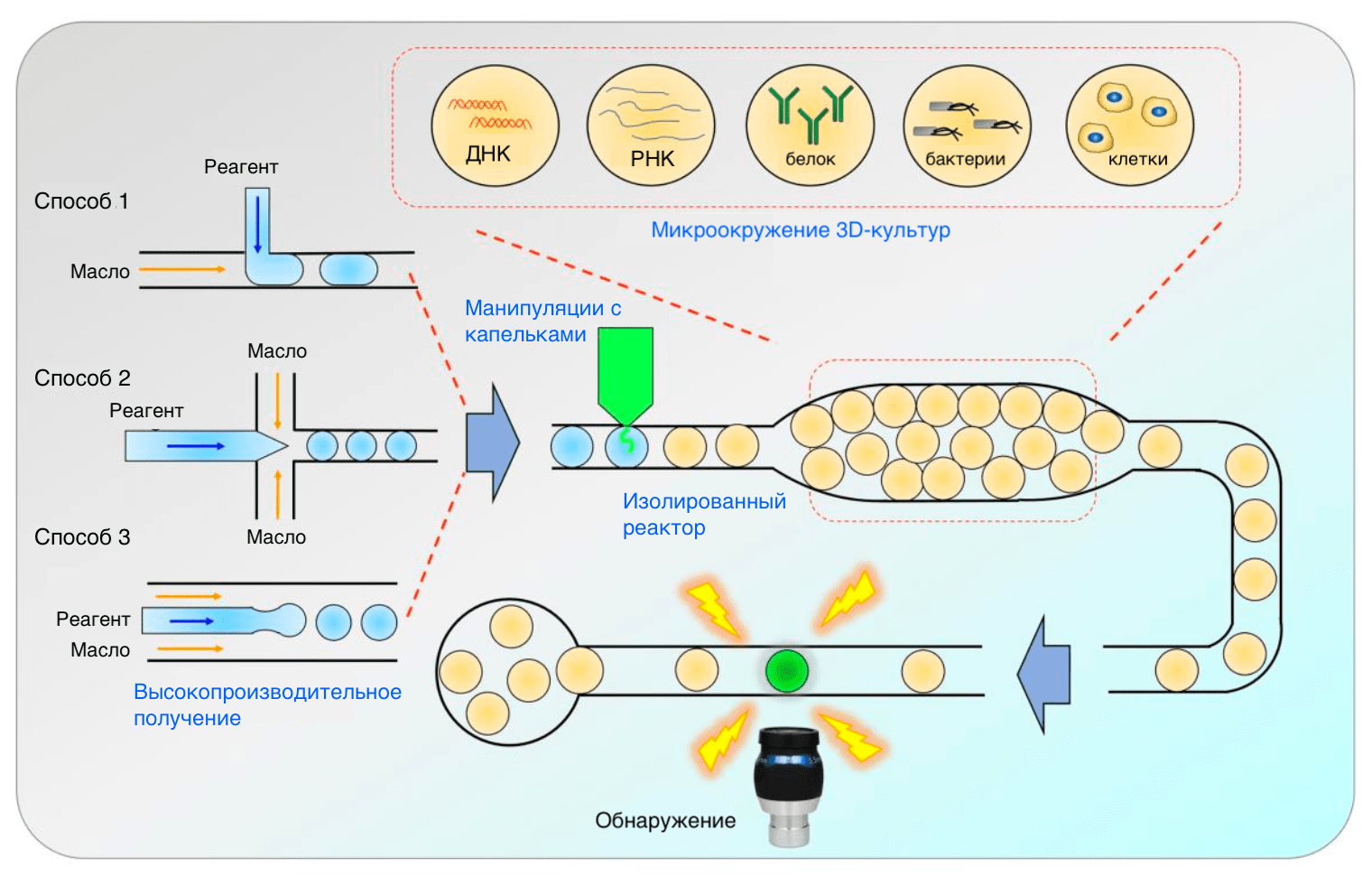
Рисунок 6. Способы получения (слева) и применения (справа) микрофлюидных капель. Капельки получаются с помощью вспомогательного потока масла, направленного параллельно (Способ 1) или перпендикулярно (Способ 2) основному потоку. Масло образует вокруг капелек слой, который превращает их в отдельные реакторы. Третий способ позволяет получать капли в высокопроизводительном режиме благодаря высокой скорости потока и микроразмерам каналов.
С таким прогрессом недалеко и до мечты химика — рисуешь молекулу, а автоматический синтезатор сам ищет путь ее синтеза, заказывает нужные реагенты и выдает продукт с нужной чистотой. Пока это, конечно, еще мечты, но кто знает, сколько осталось до их реализации?
Автоматизация скрининга
До середины 1980-х годов тестирование кандидатов в лекарства на активность в биохимических и фармакологических лабораториях проводилось в индивидуальных пробирках объемом не менее 1 мл и требовало постоянной работы с сухими навесками, которые вручную растворяли в различных буферных растворах. Производительность таких ручных методов ограничивалась 20–50 соединениями в неделю. Таким образом, обычная для тех времен программа скрининга 3000 веществ занимала 1–2 года [19].
Постепенный переход к рациональному дизайну, основанный на знании терапевтической мишени (подробнее это описано в статье «Поиск лекарственных мишеней» [1]), и разработка методов рекомбинантной ДНК [20], позволивших эти мишени получать в очищенном виде в больших количествах, потребовали качественного улучшения ситуации со скринингом.
В публикации [19] подробно рассказано, как в компании Pfizer c 1984 года развивался процесс перехода к высокопроизводительному скринингу (High Throughput Screening, HTS) и каких улучшений он потребовал: использования 96-луночных планшетов вместо пробирок, перехода от сухих веществ к растворам в DMSO, смешивания нескольких соединений в одной лунке. Эти и другие инновации позволили повысить количество тестируемых соединений в неделю сначала до 800 к 1986 году, а потом и до 10 000 к 1990 году.
Высокопроизводительный скрининг можно грубо разделить на два вида. Первый, более простой, — это скрининг на связывание с мишенью, результатом которого является либо качественная реакция (связывается — не связывается), либо измерение константы диссоциации (Kd) или, чаще, концентрации вещества, при которой мишень подавляется наполовину (IC50). Этот скрининг используется для поиска хитов (соединений, отобранных по способности связываться с мишенью — см. выше). Затем, для поиска лидов (соединений, не только связывающихся с мишенью, но и обладающих подходящими фармакологическими свойствами) и их оптимизации используются всё более сложные (и менее производительные) скрининги по изучению биологической активности (например, клеточные тесты) . В последующие годы компания Pfizer перешла и к ним, успев добиться уровня 360 соединений в неделю к 2000 году.
Им посвящена третья статья нашего спецпроекта «Работа с клетками: автоматизируй и властвуй» [21].
Скрининг на связывание с мишенью
Современные системы намного превзошли по производительности первые прототипы и позволяют «прогнать» до 300 000 соединений в день! Делается это с использованием роботов, которые оперируют сотнями планшетов, в каждом из которых 1536 лунок объемом 50 нанолитров .
Для систем, позволяющих сканировать более 100 000 соединений в день, придумано специальное название: ультравысокопроизводительный скрининг (uHTS). При нем нередко используются планшеты с 3456 лунками.
Как правило, в лунках находится мишень, против которой нужно найти вещества. После раскапывания кандидатных веществ в лунки планшеты поступают в систему детекции, работа которой раньше часто была основана на измерении радиоактивности, а сейчас — на детекции флуоресценции или биолюминесценции [22].
Классический высокопроизводительный скрининг — очень быстрый метод, позволяющий просканировать библиотеку из миллиона соединений за неделю. Тем не менее и у него есть недостатки: высокая стоимость и низкая надежность данных, связанная с ошибками дозирования малых количеств веществ и быстрым испарением жидкости [23]. В итоге частота «попаданий» (то есть процент получающихся хитов) невысока: около 1% [24].
В последнее время благодаря методам машинного обучения появилась возможность отойти от метода перебора (то, что по-английски называется bruteforce approach — подход «грубой силы») и применить итеративный подход: сначала скринингу подвергается часть имеющейся химической библиотеки, а затем на основе его результатов модель строит предсказание, какие вещества следует тестировать дальше в первую очередь. В работе [24] проведено сравнение таких подходов с традиционным, и показано, что скрининг всего лишь 35% веществ библиотеки позволил идентифицировать 78% активных соединений.
Альтернативу могут представлять те же самые микрофлюидные подходы, использование микрочипов (microarrays) и гранул (microbeads) с адсорбированными на них мишенями. Однако пока в отношении высокопроизводительного скрининга для поиска хитов эти подходы находятся в зачаточном состоянии [25].
Наиболее распространенные типы мишеней для скрининга — ферменты (киназы, протеазы) и рецепторы (например, GPCRs — рецепторы, сопряженные с G-белком, или ядерные рецепторы). С ферментами работать особенно легко, потому что продукт ферментативной реакции легко детектировать упомянутыми выше методами (прямое измерение флуоресценции, поляризация флуоресценции, FRET — fluorescence resonance energy transfer [26] и другие).
Для скрининга белок-белковых взаимодействий (например при поиске антител) применяются свои подходы. Так, обычный способ отбора антител — высокопроизводительный скрининг с помощью иммуноферментного анализа (ИФА, ELISA) [27] или флуоресцентного сортинга (FACS) [21], которые достаточно легко автоматизировать. Они позволяют отобрать хиты из большого набора антител, однако дают мало информации: как правило, только качественный сигнал «связалось — не связалось». Затем применяют метод поверхностного плазмонного резонанса (SPR) , позволяющий получить информацию об эпитопной специфичности антитела и кинетике связывания. Недавно был предложен метод высокопроизводительного SPR, который позволяет объединить стадии скрининга и характеризации антител с возможностью параллельно анализировать сотни образцов [28].
О нем мы рассказывали в статье «Биотехнология антител» [11].
Функциональный скрининг
В отличие от биохимических тестов, описанных в предыдущем разделе, клеточные функциональные тесты позволяют получить информацию о воздействии вещества на целый сигнальный путь, частью которого является мишень. Конкретный тип используемых клеток, измеряемые параметры и методы измерения очень сильно зависят от терапевтической области, для которой разрабатываются лекарственные кандидаты .
Работе с клетками посвящена предыдущая статья спецпроекта [21].
Сложность скрининговой процедуры может варьировать. Например, достаточно легко наблюдать за гибелью клеток в случае цитотоксических соединений для лечения онкологических заболеваний и чрезвычайно сложно оценивать изменение картины экспонирования рецепторов на поверхности клеток иммунной системы при добавлении киназного ингибитора. Естественно, чем сложнее измеряемый параметр, тем меньше производительность скрининга, поэтому на ранних этапах, когда поиск лидов производится среди тысяч хитов, стараются избегать слишком сложных процедур.
Компания Beckman Coulter Life Sciences разработала автоматизированную систему скрининга на основе индуцированных плюрипотентных стволовых клеток [29] для нейродегенеративных заболеваний, таких как болезнь Паркинсона. На первом этапе они в автоматическом режиме дифференцируются в предшественники нейронов, потом в дофаминергические нейроны, после чего часть из них под воздействием стрессовых факторов превращают в клетки, моделирующие болезнь. Затем библиотека веществ (в данном случае речь идет об ингибиторах LRRK2 — киназы, повышенная активность которой ассоциирована с болезнью Паркинсона) проходит скрининг против этих клеток. В автоматическом режиме определяют выживаемость модельных клеток по содержанию АТФ. Из 150 000 соединений в первоначальной библиотеке 465 проявили активность против LRRK2, для 46 были получены оптимальные параметры «доза—ответ», и они были направлены на фенотипический скрининг в описываемой системе. Было выявлено 16 веществ, то есть итоговая доля хитов составила около 0,01%. Эти типичный результат для подобных процессов.
Как и в случае биохимического скрининга, нередко на помощь приходят микрофлюидные технологии (рис. 7). Такие системы позволяют создавать градиенты концентрации и микрокапли с точным контролем состава. Появившаяся возможность заключать в капельки размером 10–100 мкм отдельные клетки открывает невиданные перспективы высокопроизводительного скрининга на уровне отдельных клеток. Капелька жидкости, в которую помещается клетка, находится внутри другой, несмешивающейся с первой жидкости. Благодаря мельчайшему объему ячейки метаболиты, которые выделяет клетка, быстро достигают детектируемых концентраций [22].
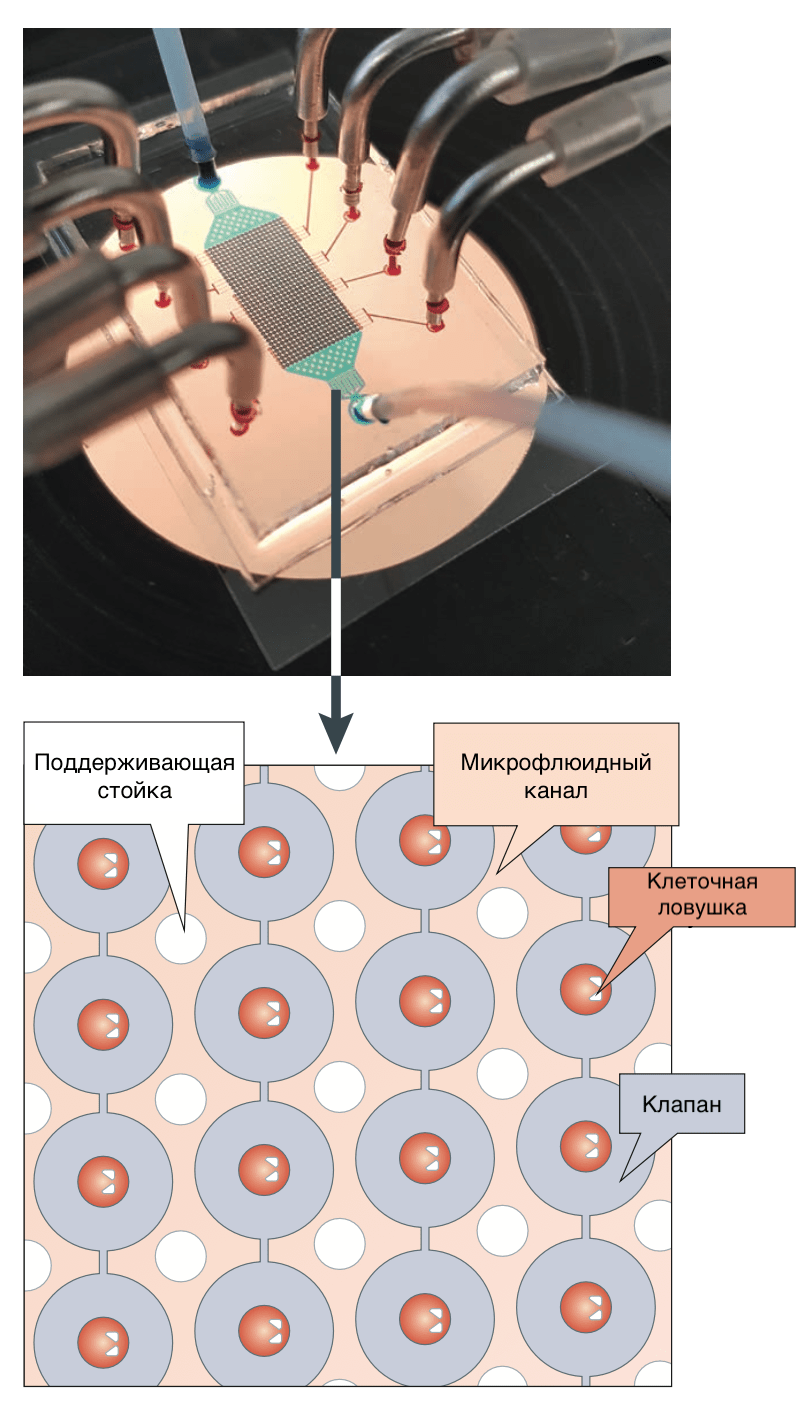
Рисунок 7. Микрофлюидная система для скрининга соединений на отдельных клетках. Объем каждой индивидуальной камеры зависит от дизайна конкретного чипа и обычно составляет 100–500 пиколитров.
Эти технологии позволяют проводить и протеомный, и геномный анализы на уровне отдельной клетки, а также осуществлять так называемый high-content screening, при котором генерируется множество данных, включая результаты визуализации субклеточных компонентов (рис. 8), пространственное распределение белковых маркеров внутри клетки и временную динамику этих параметров .
Об автоматизации омиксных технологий мы говорили в одноименной статье этого спецпроекта [18].
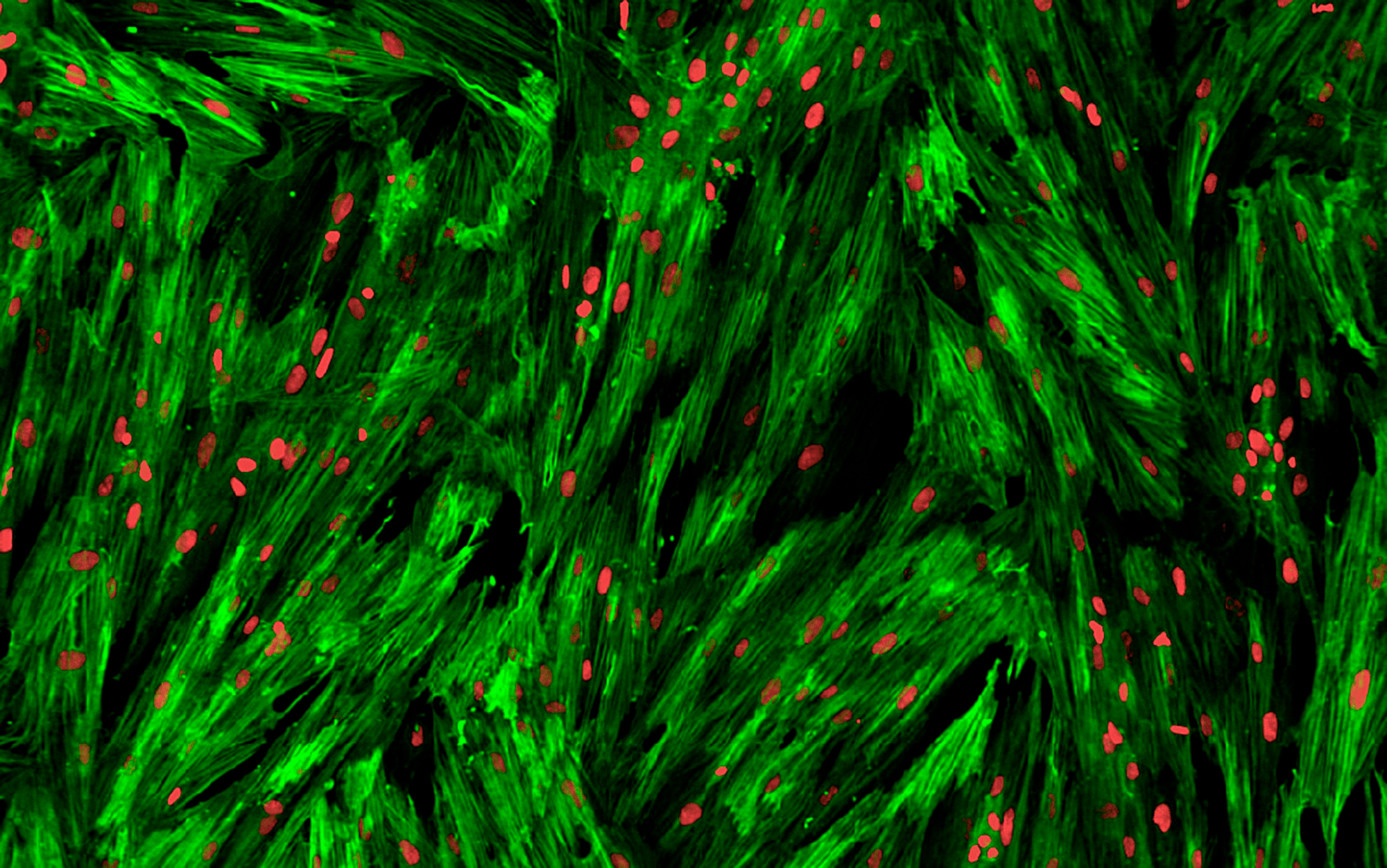
Рисунок 8. Мониторинг образования фиброза в клетках легких, осуществляемый системой high-content screening в рамках программы оптимизации антифибротических веществ
С помощью различных микрофлюидных чипов можно в параллельном автоматизированном режиме проводить такие операции, как выделение ДНК (рис. 9), флуоресцентный клеточный сортинг (FACS) [30], ПЦР в реальном времени, определение маркеров активации клеток, например, Т-лимфоцитов, и множество других [31].
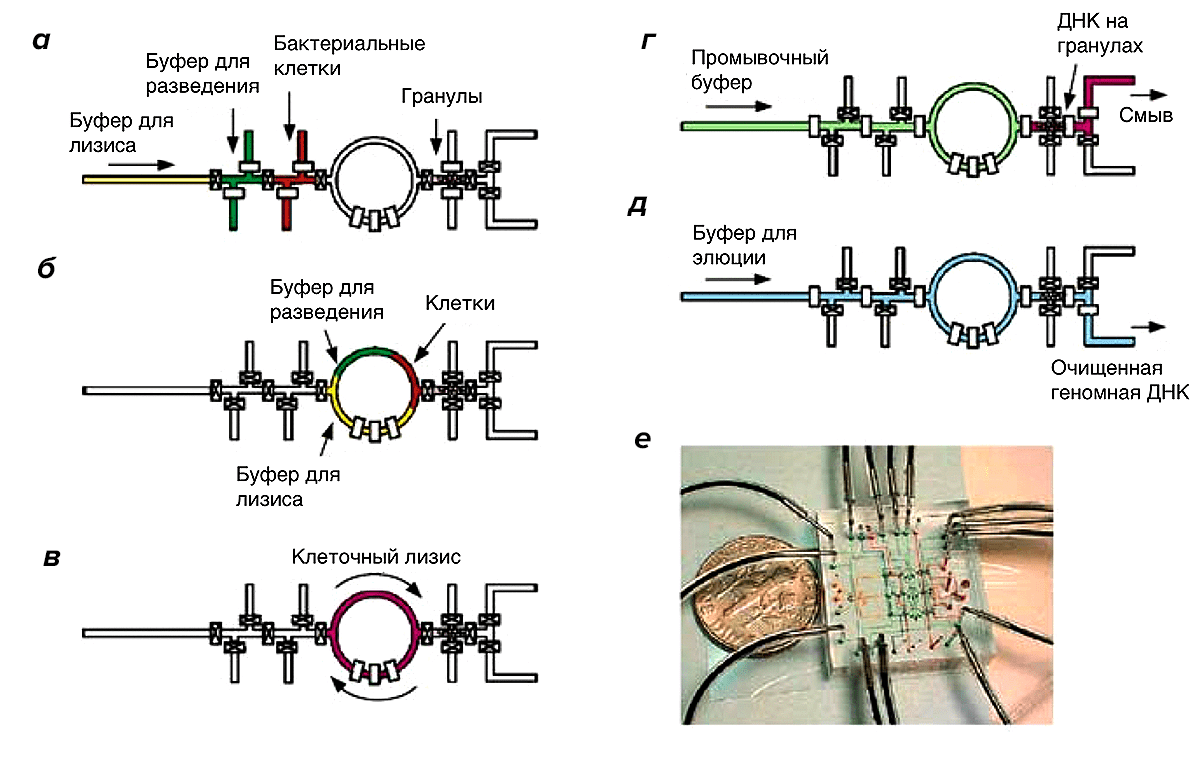
Рисунок 9. Выделение ДНК из бактериальных клеток на микрочипе
Например, автоматизация флуоресцентного клеточного сортинга (FACS) позволила проводить скрининг 50 000 веществ в день и обнаруживать хиты для модуляции ряда клеток иммунной и кроветворной систем, которые могут быть использованы при лечении аутоиммунных заболеваний, рака, тромбоцитопений [32].
Следующий уровень скрининга — массовое тестирование на целых живых организмах. Понятно, что эксперименты на обезьянах и даже мышах таким образом не автоматизируешь, но вот исследования на нематодах или рыбах, в силу их небольших размеров, вполне поддаются автоматизации. Так, с помощью автоматизированного скрининга в 96-луночных планшетах удалось найти новые вещества, снижающие подвижность и выживаемость паразитических червей [33]. Получилось даже привить рыбкам данио рерио [34] человеческие опухоли и провести скрининг цитотоксических веществ в этой in vivo — системе [35].
ADME-скрининг
После получения лидов — веществ с достаточно высокой специфичностью и селективностью по отношению к мишени и показавших хорошие результаты в функциональных тестах — наступает этап их оптимизации (lead optimization), на котором в первую очередь улучшают фармакокинетические свойства будущего лекарственного кандидата (грубо говоря, то, как организм будет воздействовать на лекарство). Основные параметры поведения лекарства в организме — ADME, то есть, как уже говорилось, адсорбция, распределение, метаболизм, выведение, а также токсичность (поэтому иногда используют аббревиатуру ADMET). Хотя на первый взгляд кажется, что поведение веществ в пробирке имеет мало отношения к ситуации в организме, однако двадцатилетний опыт исследования ADMET показал, что тщательное изучение этих параметров in vitro и отсев бесперспективных соединений позволяет значительно снизить риски провала в клинических исследованиях в будущем, а, значит, сэкономить время и деньги.
ADMET-тестов достаточно много, мы приведем лишь несколько наиболее распространенных примеров того, чему подвергают вещества-кандидаты при современной разработке лекарств:
- взаимодействие с цитохромами для определения потенциальных путей метаболизма и лекарственных взаимодействий;
- взаимодействие с многочисленными транспортерами в кишечнике, гематоэнцефалическом барьере, печени и почках для выяснения путей распределения и экскреции, а также для предсказания лекарственных взаимодействий;
- связывание с белками плазмы крови, ЦНС и других тканей;
- клеточные тесты на проникновение через кишечный эпителий, в печень, ЦНС;
- подсчет микроядер для определения потенциала генотоксического действия препарата.
В центре автоматизации ADMET, конечно, стоит робот-диспенсер, раскапывающий кандидатное вещество, а ключевой детектирующий прибор, на котором происходит определение производных веществ, — это тандемный масс-спектрометр с жидкостной хроматографией (LC-MS/MS). Здесь важным шагом вперед в повышении производительности стало применение мультиплексных приборов, когда несколько независимых хроматографов присоединяется к одному входу масс-спектрометра. Это и другие технические ухищрения (нанолитровые дозаторы, акустические генераторы капель) позволили довести среднее время анализа до 5 секунд на образец [36].
Всё большую роль в высокопроизводительном тестировании ADMET играют технологии трехмерных культур тканей и organ-on-a-chip (орган-на-чипе), которые позволяют смоделировать ситуацию в организме с лучшим приближением, нежели культуры клеток. Технологии organ-on-a-chip объединяют микрофлюидику и тканевую инженерию для создания моделей заболеваний, которые проще в обращении и более предсказуемы, чем живые организмы, но ближе к живым организмам, чем клетки в чашке Петри. Органы на чипе позволяют имитировать механические, химические и физические воздействия на ткани в организме и четко контролировать экспериментальные условия. Одним из первых примеров такой технологии стала имитация интерфейса между альвеолой и легочным капилляром (рис. 10). Эпителиальные и эндотелиальные клетки культивировали по разные стороны эластичной полупроницаемой мембраны. По бокам от центрального канала находятся вакуумные камеры. При снижении в них давления мембрана с клетками растягивается, имитируя натяжение поверхности альвеол при дыхании. Это меняет проницаемость слоя с клетками для лекарств, воздуха и других веществ, позволяя исследовать систему в условиях, имитирующих реальные.
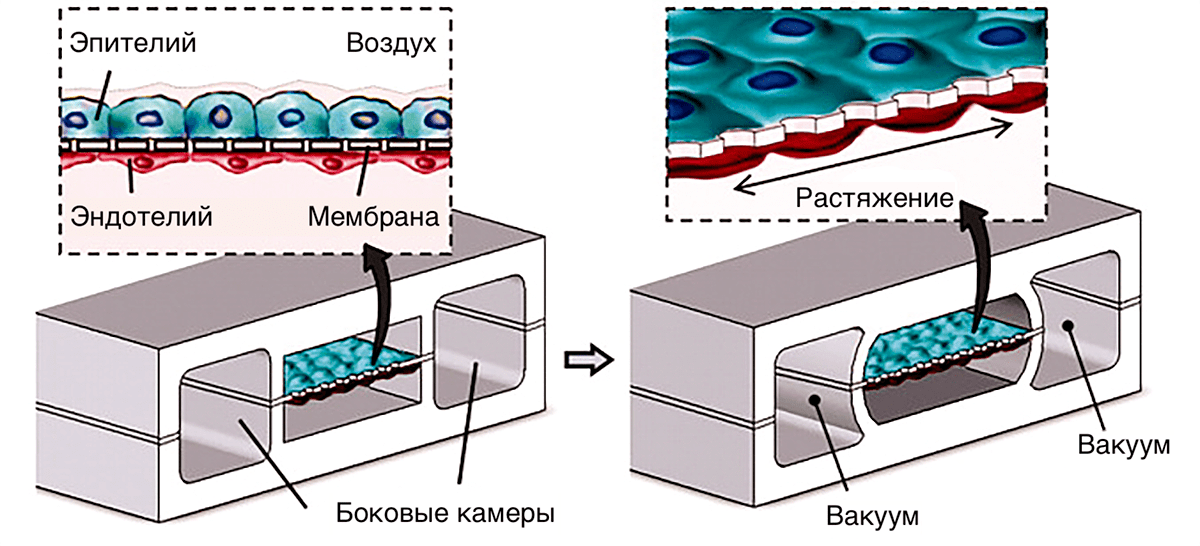
Рисунок 10. Пример органа-на-чипе, имитирующего интерфейс между альвеолой и легочным капилляром, сконструированный с учетом механических воздействий
Пока что органы-на-чипе не стали стандартным этапом разработки лекарств, но, учитывая тенденцию к миниатюризации, снижению истребления животных и, опять же, автоматизации, у этой технологии большое будущее.
Автоматизация фармацевтической разработки
Для создания лекарства недостаточно просто иметь вещество с нужными характеристиками, которые изучаются в ходе этапов получения и оптимизации лида (см. рис. 1). Нужно в итоге обеспечить производство этого вещества и вместе со вспомогательными компонентами объединить его в готовую лекарственную форму (таблетку, раствор для инъекции, крем и др.). Этим занимаются в ходе фармацевтической разработки, которая, конечно, тоже нуждается в автоматизации.
Фармацевтическая разработка, то есть, упрощенно говоря, процесс создания производства качественного препарата, — важнейший этап лекарственной разработки, который начинается на практике, как только утвержден лекарственный кандидат (то есть пройдена стадия оптимизации лида), а планируется еще раньше. Поскольку фармацевтическая разработка очень четко регулируется законами и руководствами и имеет прямое отношение к риску для здоровья и жизни людей, здесь особенно важна стандартизация, повторяемость и документация всех процессов, поэтому автоматизация в этой области вполне естественна.
«Биомолекула» касалась аспектов обеспечения качества лекарственных продуктов в статьях «Контроль качества биотехнологических продуктов» [37] и «Генные и клеточные лекарства: сложное регулирование для сложных продуктов» [38]. В первой статье также вкратце рассказывается о концепции Quality by Design.
Один из тонких моментов фармацевтической разработки — создание формуляции, то есть состава готовой лекарственной формы препарата. Для этого может потребоваться перебор множества вариантов вспомогательных веществ, их концентраций и т.д. На раннем этапе фармацевтической разработки требуется выбрать оптимальный вариант и с точки зрения стабильности, и с точки зрения масштабируемости, и с точки зрения обеспечения наилучших параметров эффективности и безопасности. В дальнейшем формуляцию можно будет изменить, но чем позднее это произойдет, тем больше усилий потребуется.
Другой аспект фармацевтической разработки, требующий аккуратной постановки множества однотипных экспериментов, — валидация процесса производства и аналитических методов контроля качества. Валидация, упрощенно говоря, — доказательство того, что процесс делает то, что от него требуется. То есть, по большому счету, это научный эксперимент, только его методология четко прописана в руководствах, а отчеты о валидации внимательно изучаются регуляторными органами. Процессам и методикам, не прошедшим валидацию, не следует доверять, так как они могут приводить к получению продуктов ненадлежащего качества.
Также хорошо поддаются автоматизации эксперименты по изучению стабильности лекарственных продуктов, которые должны проводиться при различных температурах, освещенности, влажности и т. п. Так, например, для вакцины «Спутник V» сначала была выпущена форма, хранящаяся при −20 °C, потому что эксперименты по хранению и стабильности при более высоких температурах еще не были проведены. Когда они закончились, была выпущена форма, хранящаяся при +2 ... +8 °C. Понятно, что никто не проводит эксперименты два года для обоснования двухлетнего срока хранения. Такой срок получается после экстраполяции результатов экспериментов по ускоренной деградации лекарств при повышенных температурах. То есть, например, информацию о стабильности при −20 °C получают из эксперимента по ускоренному хранению при 0 °C.
Нынешние возможности автоматизации с применением машинного обучения и обратной связи как нельзя лучше вписываются в более современную концепцию фармацевтической разработки в соответствии с принципами Quality by Design. Такая разработка предполагает более глубокое понимание продукта и процесса его производства, знание критических атрибутов качества продукта, мониторинг и постоянную верификацию процесса на протяжении всего жизненного цикла продукта, мониторинг процессов в реальном времени. В полной мере это всё становится возможным только благодаря автоматизации и высокопроизводительным технологиям [39].
«Умные» лаборатории
Следующий шаг в автоматизации разработки лекарств — объединение всех лабораторных устройств в одну систему, контролируемую общим программным обеспечением [8]. В идеале — это объединение всех этапов, описанных выше, от моделирования in silico до доклинических экспериментов. Сейчас на практике такая автоматизация пока нереальна, но в некотором приближении похожие примеры уже есть.
Для этого лабораторные устройства, вплоть до дозаторов, оснащаются датчиками, что позволяет следить за всеми стадиями эксперимента от начала до конца [40]. Такой подход называется Internet of Things (IoT, «интернет вещей») и, по некоторым расчетам, позволит повысить продуктивность лабораторий на 30–40% [41]. Согласно исследованиям, человеческий фактор, ошибки и несоблюдение протоколов — основная причина неэффективности лабораторий в фармкомпаниях. В среднем действия выполняются лаборантами правильно в 92% случаев. Кажется, что это неплохо, но эти 8% ошибок накладываются друг на друга, приводя к заметной потере эффективности.
Объединение баз данных, электронных дневников, данных с датчиков и приборов в одну «умную лабораторию» (smart lab) позволило бы сэкономить на рутинных действиях и отслеживании человеческих ошибок и сосредоточиться на более продуктивных вещах.
Важная предпосылка к интеграции всех систем и обеспечению единого потока автоматических процессов от синтеза веществ до получения лекарственных кандидатов и дальше, к тестированию in vivo — модульность автоматических систем [42]. Многие компании уже сделали шаги в этом направлении, как, например, AstraZeneca со своей платформой NiCoLab [43].
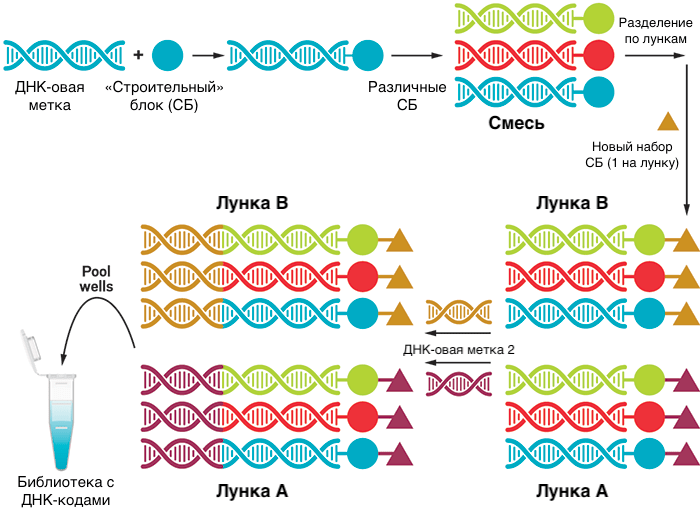
Одним из интересных подходов к объединению разных стадий процесса разработки лекарств может стать использование библиотек с ДНК-кодами — DNA-encoded libraries. Здесь во время синтеза соединений из блоков (как на рис. 2) к растущей структуре основного соединения добавляются ДНК-метки, которые кодируют то, из каких блоков состоит вещество (рис. 11).
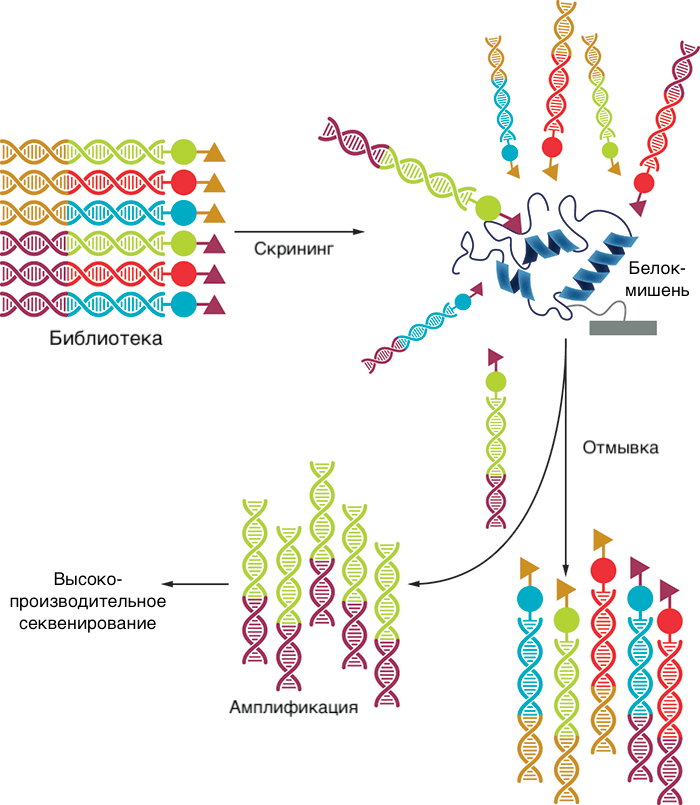
Затем вся библиотека в одной пробирке (а веществ там могут быть миллионы) отправляется на скрининг. Вещества, связавшиеся с мишенью, отделяют и отправляют на секвенирование привязанных к ним меток (иногда проводят два или три раунда связывания с мишенью, чтобы остались только высокоспецифичные лиганды). Это очень сокращает время, реагенты и усилия, затрачиваемые на скрининг. Таким образом удобно, например, находить селективные ингибиторы ферментов, потому что можно провести скрининг большого числа соединений не только против самой мишени, но и против близких к ней белков, с которыми лекарство не должно связываться. Это довольно актуально при поиске киназных ингибиторов, потому что у множества киназ похожие сайты.
Правда, у этого остроумного метода есть и недостатки: во-первых, ДНК-овый «хвост» может влиять на связывание вещества с мишенью вплоть до полного препятствования. Поэтому этот метод может упустить хороших кандидатов, которые могли бы связаться с мишенью, не будь к ним пришита ДНК. Во-вторых, из-за наличия ДНК реакции приходится проводить только в водной среде, что ограничивает круг возможных соединений. В-третьих, после нахождения хитов приходится синтезировать их снова без участия ДНК, что требует отдельного подбора условий.
Тем не менее метод уже показал первые успехи: полученные на его основе соединения находятся на ранних стадиях клинических исследований. А одна из компаний-лидеров в этой области сообщила о создании библиотеки с 40 триллионами (!) соединений [44]. Есть из чего выбрать...
Преграды к внедрению автоматизации
Автоматизация, как мы видим, уже проникла во многие аспекты разработки лекарств — где-то сильнее, где-то еще не настолько глубоко. Всё меньше остается задач, с которыми роботы справляются хуже, чем люди. Однако некоторые области пока остаются крепкими орешками для автоматов.
Так, в принятии решений человек пока незаменим . Самый яркий пример, хоть и не относящийся к области разработки лекарств, — провал IBM Watson for Oncology (системы принятия медицинских решений). Оказалось, что машина ставила диагноз в целом хуже, чем опытные онкологи и, соответственно, выдавала неверные клинические рекомендации. Пока что пришлось отказаться от ее услуг, и сейчас программа свернута.
В Москве идет эксперимент по созданию инновационной поликлиники, в которой львиная доля анализа медицинских данных отводится искусственному интеллекту. Этому посвящена статья «Заглянем в окошко московской кибер-поликлиники» [45].
Одна из причин проблемы — слишком шумные исходные данные. Машинному обучению нужны подготовленные, «вычищенные» данные. Любые ошибки и шум снижают качество предсказаний, сделанных алгоритмом. Другая проблема лабораторной автоматизации: многие автоматизированные системы плохо совместимы между собой. Зачастую всё равно требуется вмешательство человека, чтобы перенести планшеты между разными приборами. Автоматизация химического синтеза нередко наталкивается на то, что для изменения условий реакции нужно переделывать систему, а без этого не получатся новые соединения.
Можно говорить, что роботы пока не заменяют медицинских химиков и фармакологов. Однако робот в сочетании с медицинским химиком сработает лучше, чем и робот, и медицинский химик поодиночке. То же самое относится и к фармакологам, и к гистологам, и даже к врачам. Пожалуй, даже наоборот, наличие такие сложных автоматизированных систем предъявляет повышенные требования и к ученым, и к техникам, и к инженерам, которые их обслуживают.
Заключение
Самая важная задача, которую нужно решать на этапе ранней разработки лекарств, — снижение процентов провалов в последующей разработке. Для этого нужно как можно надежнее предсказать, какие вещества будут токсичны и неэффективны для человека, а какие подойдут в качестве лекарств. К сожалению, сейчас это получается с трудом — лишь 6–10% лекарств, входящих в клинические исследования, доходят до регистрации.
Автоматизация за счет стандартизации, повышения производительности, снижения ошибок и повышения объективности призвана повлиять на эту печальную статистику и увеличить число «хороших» молекул, доходящих до клинических исследований. Пока что прошло слишком мало времени, чтобы уверенно говорить об успехах в этой области. К тому же она быстро развивается, и то, что было невозможным еще вчера (скажем, скрининг миллиона веществ в неделю или мультипараметрическое распознавание картинок с помощью машинного обучения), сегодня доступно во многих лабораториях.
Будем надеяться, что прогресс будет стремительным, и автоматизация в скором времени трансформирует процесс разработки лекарств.
Литература
- Поиск лекарственных мишеней;
- J. Jesús Naveja, José L. Medina-Franco. (2019). Finding Constellations in Chemical Space Through Core Analysis. Front. Chem.. 7;
- Драг-дизайн: как в современном мире создаются новые лекарства;
- Виртуальные тропы реальных лекарств;
- In vivo — in vitro — in silico;
- 12 методов в картинках: «сухая» биология;
- С миру по нитке: как соединились компоненты клинического исследования;
- Автоматические лаборатории и светлое будущее естественнонаучных исследований;
- Plant D., Murray D., Wigglesworth M., Holdgate G., Plant H., Vincent J., Harper P. (2020). Laboratory automation in early drug discovery. Drug targer review. 1, 21–24;
- Haley Fuller, Ting-Yen Wei, Michael Behrens, Warren Ruder. (2020). The Future Application of Organ-on-a-Chip Technologies as Proving Grounds for MicroBioRobots. Micromachines. 11, 947;
- Биотехнология антител;
- Наработка антител для доклинических и клинических испытаний;
- Mikołaj Kowalik, Chris M. Gothard, Aaron M. Drews, Nosheen A. Gothard, Alex Weckiewicz, et. al.. (2012). Parallel Optimization of Synthetic Pathways within the Network of Organic Chemistry. Angew. Chem. Int. Ed.. 51, 7928-7932;
- Jensen K.F. (2018). Microfluidics for Chemical Synthesis: Flow Chemistry. ArXiv: 180205611;
- Gisbert Schneider. (2018). Automating drug discovery. Nat Rev Drug Discov. 17, 97-113;
- Aiichiro Nagaki, Keita Imai, Heejin Kim, Jun-ichi Yoshida. (2011). Flash synthesis of TAC-101 and its analogues from 1,3,5-tribromobenzene using integrated flow microreactor systems. RSC Adv.. 1, 758;
- Yang Bai, Meng Gao, Lingling Wen, Caiyun He, Yuan Chen, et. al.. (2018). Applications of Microfluidics in Quantitative Biology. Biotechnol. J.. 13, 1700170;
- Автоматизация омиксных технологий;
- D A Pereira, J A Williams. (2007). Origin and evolution of high throughput screening. British Journal of Pharmacology. 152, 53-61;
- 12 методов в картинках: генная инженерия. Часть II: инструменты и техники;
- Работа с клетками: автоматизируй и властвуй;
- M.S. Attene-Ramos, C.P. Austin, M. Xia. (2014). High Throughput Screening. Encyclopedia of Toxicology. 916-917;
- Jongin Hong, Jennifer R. Lukes. (2008). Microfluidic Systems for High-Throughput Screening. Encyclopedia of Microfluidics and Nanofluidics. 1230-1243;
- Gabriel H. S. Dreiman, Magda Bictash, Paul V. Fish, Lewis Griffin, Fredrik Svensson. (2021). Changing the HTS Paradigm: AI-Driven Iterative Screening for Hit Finding. SLAS DISCOVERY: Advancing the Science of Drug Discovery. 26, 257-262;
- Yuetong Wang, Zhuoyue Chen, Feika Bian, Luoran Shang, Kaixuan Zhu, Yuanjin Zhao. (2020). Advances of droplet-based microfluidics in drug discovery. Expert Opinion on Drug Discovery. 15, 969-979;
- Рулетка для спектроскописта;
- 12 методов в картинках: иммунологические технологии;
- Abdiche Y.N. (2019). Accelerating biotherapeutic discovery with high throughput SPR. BioTechniques;
- Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки;
- Мáркеры для клеток: как ученые «раскрашивают» клетки, чтобы отличить одну от другой;
- Na Wen, Zhan Zhao, Beiyuan Fan, Deyong Chen, Dong Men, et. al.. (2016). Development of Droplet Microfluidics Enabling High-Throughput Single-Cell Analysis. Molecules. 21, 881;
- John Joslin, James Gilligan, Paul Anderson, Catherine Garcia, Orzala Sharif, et. al.. (2018). A Fully Automated High-Throughput Flow Cytometry Screening System Enabling Phenotypic Drug Discovery. SLAS DISCOVERY: Advancing the Science of Drug Discovery. 23, 697-707;
- Frederick A. Partridge, Anwen E. Brown, Steven D. Buckingham, Nicky J. Willis, Graham M. Wynne, et. al.. (2018). An automated high-throughput system for phenotypic screening of chemical libraries on C. elegans and parasitic nematodes. International Journal for Parasitology: Drugs and Drug Resistance. 8, 8-21;
- Модельные организмы: данио рерио;
- Meghan G. Haney, L. Henry Moore, Jessica S. Blackburn. (2020). Drug Screening of Primary Patient Derived Tumor Xenografts in Zebrafish. JoVE;
- Wilson Z. Shou. (2020). Current status and future directions of high-throughput ADME screening in drug discovery. Journal of Pharmaceutical Analysis. 10, 201-208;
- Контроль качества биотехнологических продуктов;
- Генные и клеточные лекарства: сложное регулирование для сложных продуктов;
- Vladimir Razinkov, Jerry Becker, Cenk Undey, Erwin Freund, Feroz Jameel. (2015). Automation and High-Throughput Technologies in Biopharmaceutical Drug Product Development with QbD Approaches. Quality by Design for Biopharmaceutical Drug Product Development. 475-510;
- Chubb P. (2020). From simple automation to smart labs: the future for drug discovery. Eur. Pharm. Rev.;
- Chubb P. (2020). Productivity in pharma could be drastically improved with IoT implementation. Eur. Pharm. Rev.;
- Suhasa B. Kodandaramaiah, Edward S. Boyden, Craig R. Forest. (2013). In vivo robotics: the automation of neuroscience and other intact‐system biological fields. Ann. N.Y. Acad. Sci.. 1305, 63-71;
- Pearson S. (2020). Biopharma’s Lab of the Future Can’t Wait. GEN;
- Halford B. (2017). How DNA-encoded libraries are revolutionizing drug discovery. Chemical & Engineering News;
- Заглянем в окошко московской кибер-поликлиники.