NETs: почему ДНК помогает болезни и как очистить кровь от опасного мусора
08 апреля 2022
NETs: почему ДНК помогает болезни и как очистить кровь от опасного мусора
- 2487
- 0
- 7
В этой статье аферез будет очищать кровь от ДНК, которая стала опасной, попав наружу клетки.
Рисунок в оригинальном разрешении.
-
Автор
-
Редакторы
-
Рецензент
-
Иллюстратор
Когда ДНК из ядра попадает наружу клетки, это осложняет атеросклероз, рак, COVID-19 и может запускать сепсис. Но нейтрофилы — клетки нашего врожденного иммунитета, — специально выбрасывают сети из ДНК, чтобы опутать опасные крупные частицы и остановить болезнь. Но на деле свойства этих сетей часто оборачиваются вредом здоровью и поддержкой болезни. В этой статье спецпроекта по терапевтическому аферезу мы разберемся, почему происходит нетоз, как он разрушает здоровье и чем можно это вылечить.

Аферез

Партнер спецпроекта — научно-производственная фирма «ПОКАРД», которая занимается разработкой и производством сорбционных колонок, а также внедрением в клиническую практику технологий терапевтического афереза.
В ходе разных болезней опасные молекулы распространяются по организму, заполоняя собой кровь. Избыток транспортных частиц с холестерином, белки-провокаторы иммуной системы, токсины патогенных бактерий... Против одних препараты есть, но подходят не всем, против других — ещё не выведены на рынок. Третьи — важное звено в развитии многих болезней, против которых нет специальных средств борьбы. В любом из этих случаев очищение крови от опасных соединений может сократить ущерб здоровью до минимума: спасти жизнь или значительно ее продлить.
Аферез — именно такой способ извлечь из крови только один тип биомолекул. В медицине с помощью терапевтического афереза из крови пациентов удаляют опасные для здоровья элементы, сохраняя все остальное. Очищают кровь, точнее, плазму крови, очень по-разному: с помощью антител к опасным молекулам, фильтруя через пористые мембраны, разделяя компоненты на центрифуге... Каким он только не бывает!
В спецпроекте мы расскажем, какие сложные проблемы решает терапевтический аферез: простой, но незаменимый во многих ситуациях.
В последовательности ДНК закодирована генетическая информация, и сохранять код в поколениях — ее единственная работа. По инструкции из ДНК синтезируются белки и другие молекулы. Обслуживает ее отдельная машинерия: одни белки удваивают и чинят цепи, другие упаковывают их и регулируют доступность для всех остальных (см. врезку). И в целом, клетка эукариот построена вокруг ДНК: окружает ее ядром и никогда, кроме делений, не выпускает из него, оберегая как зеницу ока.
Ни одна клетка не выпустит свою ДНК наружу по доброй воле; даже чужую нужно уничтожить, а не выбрасывать. Поэтому появление ДНК вне клетки настораживает. Это как с кровью: она работает только внутри организма, и если мы видим ее на коже, то понимаем, что поранились и нужна помощь. И если внеклеточной ДНК становится много, значит, где-то произошла катастрофа.
В этой статье спецпроекта про Терапевтический аферез мы разберемся, когда внеклеточная ДНК вредит здоровью, откуда она появляется и как от нее избавиться. Но начнем с пользы от ДНК снаружи клетки — как выясняется, есть и она.
Ловушки из ДНК
Когда патогенная бактерия попадает в тело человека, иммунитет замечает опасность и начинает делать всё, чтобы ее уничтожить. В том числе, клетки иммунитета пытаются поглотить и переварить бактерию — фагоцитировать. Профессиональнее всего фагоцитируют макрофаги.
Однако в организм могут попасть враги размером и побольше пары бактерий. Нить из клеток болезнетворного гриба фагоцитировать уже не получится. А когда в крови целая армия опасных бактерий, то проглотить их по одной уже невозможно. При таких катастрофах иммунитет включает оружие массового поражения.
Как из ДНК внутри клетки собирается внеклеточная сеть
На страже таких угроз стоят нейтрофилы [2]. Они могут действовать как камикадзе и в сравнительно рядовых ситуациях: заметив угрозу в ткани, они проникают туда, фагоцитируют врагов, активируют иммунитет и через несколько дней сами погибают; их останки убирают макрофаги. А когда опасность действительно велика, нейтрофилы действуют еще более отчаянно. В ответ на масштабную угрозу нейтрофилы выбрасывают сети из своей ДНК и белков — NETs (neutrophil extracellular traps). Эту реакцию открыли в 2004 году и позже назвали нетозом (от англ. NETosis) [3]. ДНК запутывает больших врагов, а связанные с ней белки убивают их. Состав и свойства компонентов NETs мы собрали во врезку и на рисунке 2А, на рисунках 2Б—2Д предлагаем изучить фотографии NETs. Нетоз начинается из-за очень разных причин. После мы расскажем о причинах нетоза и том, когда он спасает здоровье.
Из-за чего начинается нетоз и когда сети из ДНК помогают
Нетоз всегда связан с воспалением, то есть с иммунной системой. Но работает с каждой угрозой он по-разному. В этой части мы разберем несколько особенностей нетоза на конкретных примерах.
Тромбы и выжившие камикадзе
Нетоз всесторонне сотрудничает с системой свертывания крови [15], [16]. Мы уже рассказали, как NETs провоцируют тромбообразование во врезке «Молекулы нейтрофильных ловушек». Но еще тромбоциты помогают нейтрофилам бороться с патогенами.
Когда тромбоцит замечает опасный мусор рядом, то активируется, а чтобы найти его — начинает двигаться активно. Тромбоцит распознает бактерий с помощью рецепторов к их молекулам и белкам иммунитета, которые среагировали на чужаков. Еще помогает, что бактерии в крови обрастают нитями фибрина — тромбоцит чувствителен к активности фибрина и фибриногена, потому что чистит от них сосуды. Тромбоцит склеивает найденных бактерий и доставляет к нейтрофилу. Нейтрофил реагирует на такую опасность нетозом, чтобы задержать сообщников бактерий. Так тромбоцит обезвреживает врагов и привлекает на помощь союзников (рис. 3) [4], [17–20].
Интересно, что на тромбоциты и на бактерий нейтрофилы отвечают прижизненным нетозом. Они отправляют в ядро протеазы, и через несколько минут переносят ДНК вместе и испорченными гистонами наружу клетки внутри мембранных пузырьков. Антимикробные пептиды нейтрофилы выделяют отдельно, и все компоненты объединяются в NETs только снаружи клетки. То есть внутри нее помимо ядра ничто не страдает. Поэтому оставшийся без ядра нейтрофил некоторое время продолжает бой: находит патогенов и фагоцитирует их [8], [21].
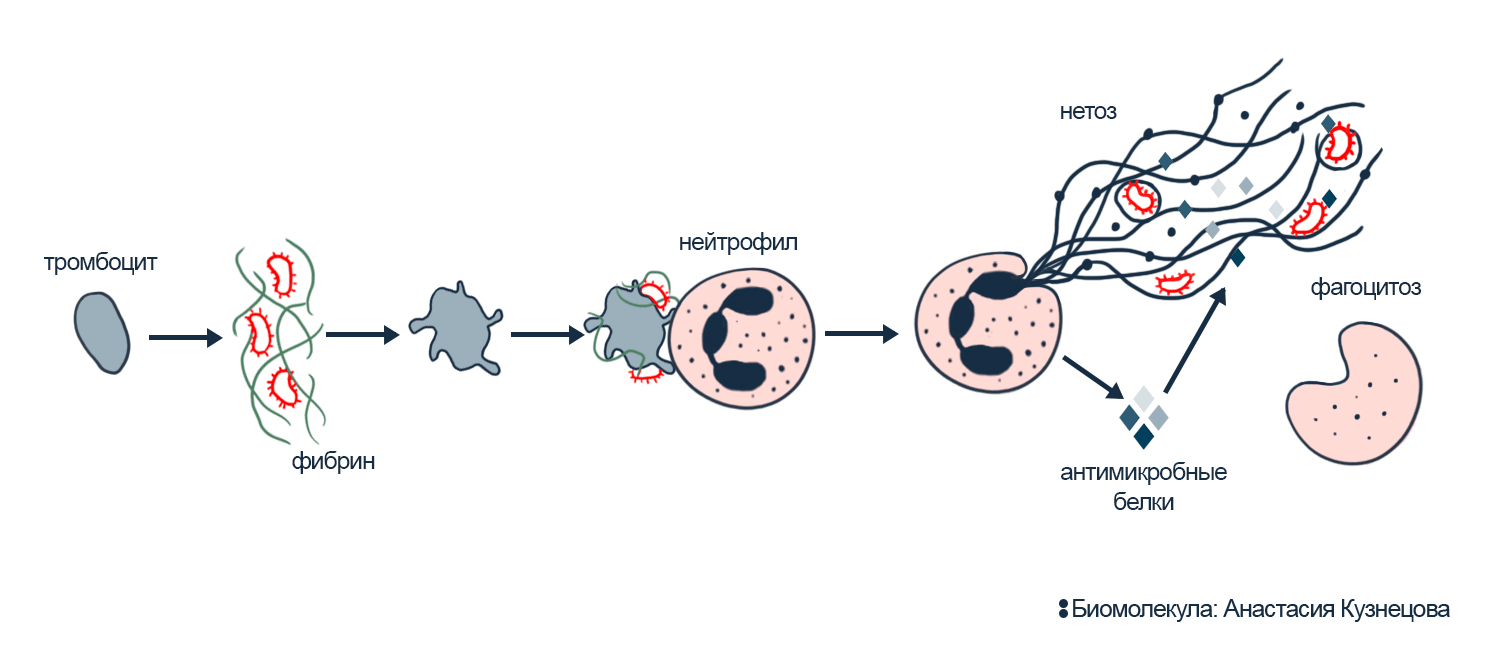
Рисунок 3. Прижизненный нетоз в ответ на встречу с бактериями. Присутствие бактерий запускает свертывание фибрина и активирует тромбоциты. Активировавшись, они начинают резво двигаться и охотиться за бактериями. Тромбоцит собирает бактерий и «на блюдечке» приносит их к нейтрофилу, таким образом запуская себе в помощь нетоз: нейтрофильные ловушки с антимикробными белками противостоят бактериям куда эффективнее. Обычно в ответ на бактерии срабатывает прижизненный нетоз: он быстрый, и после него оставшаяся без ядра клетка еще может работать — фагоцитировать бактерий.
иллюстрация Анастасии Кузнецовой по [4]
Прижизненный нетоз срабатывает на биологические угрозы, которые нужно остановить максимально быстро. Так, бактерии могут заразить другие органы, и кровь нужно остановить, чтобы не потерять литр из-за условного ранения. Чаще всего прижизненный нетоз включают нейтрофилы, которые оказались рядом с катастрофой первыми.
Грибки и оценка размера жертвы
Макрофаги без подмоги нейтрофилов не справляются с грибными нитями, потому что они слишком велики для фагоцитоза. Только NETs достаточно большие для победы над грибковой инфекцией.
Без нетоза люди и мыши постоянно болеют грибковыми инфекциями — как при иммунодефицитных состояниях. В экспериментах у животных выборочно отключали белки нетоза: эластазу или белок-активатор протеаз. Такие мыши теряли иммунитет по отношению к грибкам. То же самое происходит и с пациентами с врожденным недостатком этих белков: их удавалось лечить, но после терапии грибок возвращался, иногда захватывая весь организм. Дополнительно подтверждали роль нейтрофилов, помогая пациентам с дефицитом протеаз нейтрофилов — они страдают от кандидоза и аспергиллеза. Когда врачи восстанавливали работу нейтрофилов, это убивало инфекцию [2], [22], [23].
Интересно, что нейтрофилы сами проверяют, с чем столкнулись. Они оценивают размер гриба и по нему решают, запускать ли нетоз. Помните протеазы? Они разрушают гистоны в ядре в начале нетоза, и без них ничего не выходит. Но протеазы же должны переваривать фагоцитированных врагов. Поэтому нетоз и фагоцитоз конкурируют за протеазы. Когда нейтрофил находит клетку гриба, то начинает ее фагоцитировать: обхватывает выростами, чтобы окружить мембраной и перенести внутрь себя. Если это одиночная клетка, то нейтрофил спокойно переваривает ее с помощью протеаз. То есть когда фагоцитоз работает, то протеаз для нетоза не хватает. Но если нейтрофил столкнулся с нитью из клеток гриба, то фагоцитировать их уже не получается, и тогда протеазы инициируют нетоз (рис. 4) [2].
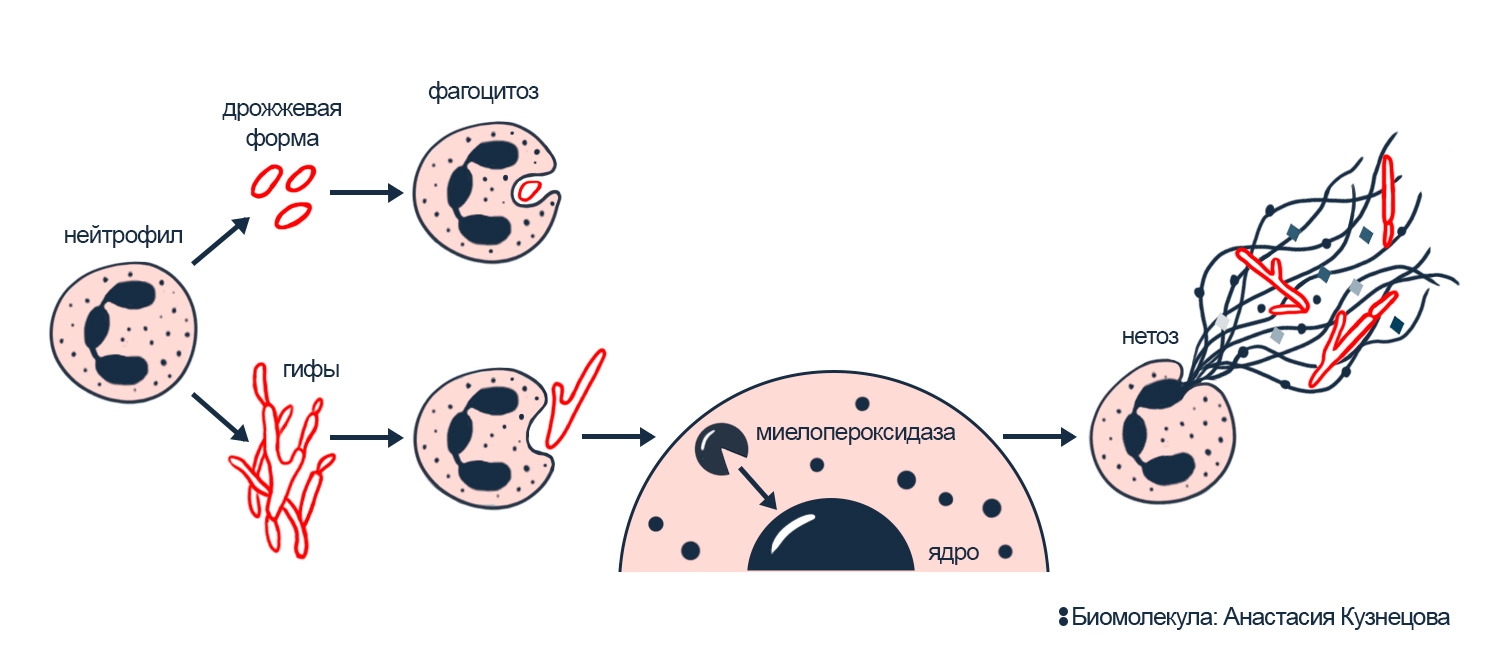
Рисунок 4. Нейтрофил выбирает, запускать ли нетоз, по размеру опасности. Это опосредуется миелопероксидазой. Когда гриб живет в виде отдельных клеток, их легко фагоцитировать, и запасы миелопероксидазы идут на переваривание грибка. Но когда нейтрофилу не удается поглотить длинную грибную нить, то миелопероксидаза не расходуется и уходит в ядро, инициируя нетоз.
иллюстрация Анастасии Кузнецовой по [2]
Подагра и смертельный нетоз
У людей с подагрой почки плохо выводят из организма мочевую кислоту, и кристаллы моноурата натрия накапливаются в суставах. Эти кристаллы повреждают ткани, на что иммунные клетки отвечают воспалением. Но воспаление наносит вред: боль усиливается, а кристаллы не уходят. Оно продолжается, потому что сигнальные молекулы воспаления — цитокины и хемокины — продолжают работать. А нетоз тормозит воспаление в суставе: когда посредники воспаления попадаются в NETs, то начинают разрушаться (рис. 5) [24].
Интересно, что в ответ на опасные кристаллы включается смертельный нетоз. ДНК с гистонами и протеазами выходит в цитоплазму, там соединяется с антимикробными пептидами и выбрасывается наружу. Смертельный (в отличие от прижизненного) нетоз растягивается на несколько часов и заканчивается разрушением нейтрофила. Это масштабная реакция на медленные небиологические угрозы: кристаллы урата, подозрительные вещества. В отличие от прижизненного нетоза, ДНК с протеазами и антимикробными пептидами объединяются в сеть еще в ядре. В общем, смертельный нетоз — способ максимально распространить токсичные белки, уже не заботясь о жизни нейтрофила-камикадзе.
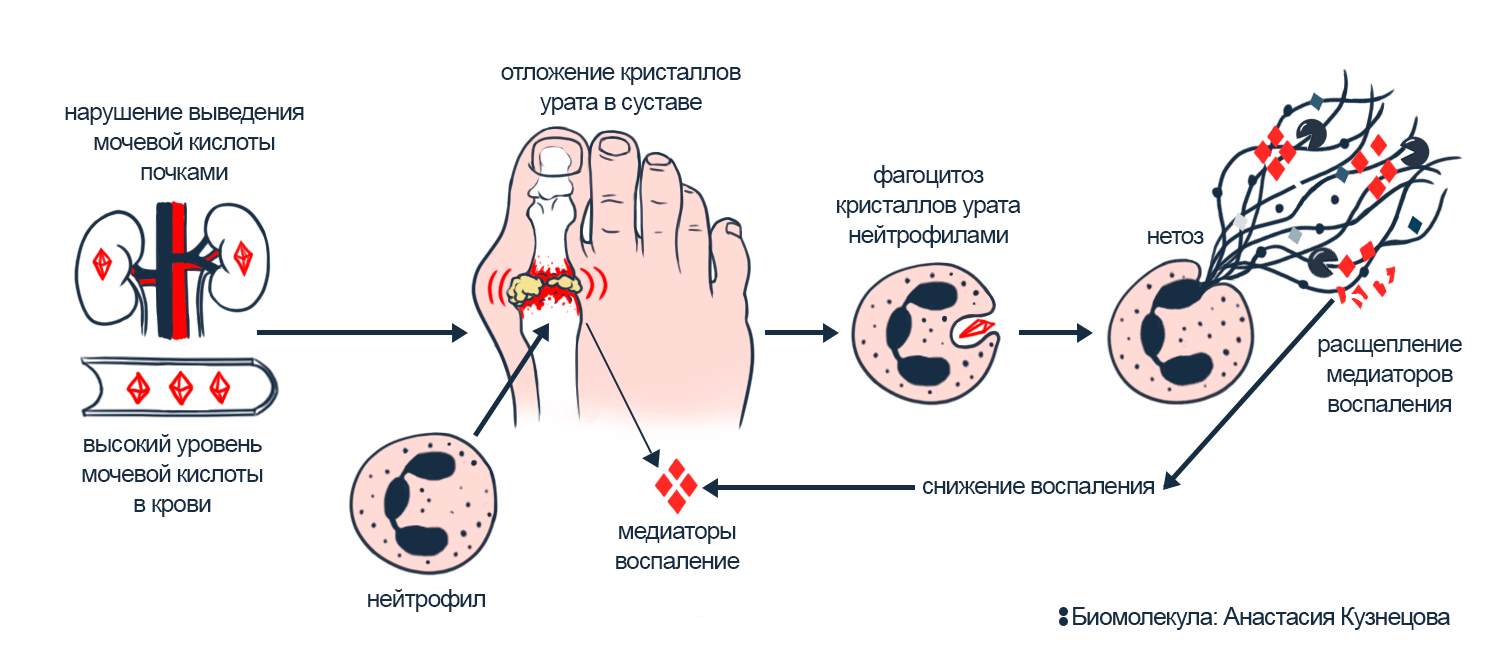
Рисунок 5. Смертельный нетоз в ответ на кристаллы урата. Из-за кристаллов уратов сустав воспаляется и болит. Когда нейтрофилу не удается фагоцитировать кристаллы, запускается смертельный нетоз. Протеазы нейтрофильных ловушек расщепляют посредников воспаления, и боль ослабевает.
иллюстрация Анастасии Кузнецовой по [25]
Нетоз действительно защищает здоровье — вспомним антигрибковый иммунитет. Но это древний и грубый механизм, поэтому он часто засоряет организм и утяжеляет болезни. Дальше мы расскажем, когда нетоз опасен и как это можно вылечить.
Когда ловушки из ДНК вредят здоровью
Нетоз становится опасным, когда NETs слишком много или они появляются там, где не нужны. Так получается, если нейтрофилы слишком активны (что-то избыточно их стимулирует) или организм плохо очищается от внеклеточной ДНК. У нас есть пример того, как полезное действие нетоза становится опасным.
В ходе бактериального менингита [26] — воспаления оболочек мозга — нетоз только защищает бактерий. Когда бактерии Streptococcus pneumoniae попадают в спинной мозг, спинномозговая жидкость может вымыть их оттуда. Но когда нейтрофилы выбрасывают NETs, это задерживает бактерии в мозге. При этом сети не убивают их, потому что S. pneumoniae умеют от них защищаться. В результате нетоз отягощает менингит — это подтверждено на человеке [27].
Нетоз причастен ко многим болезням — сепсису, атеросклерозу, COVID-19, — но есть важный вопрос. Насколько NETs важные игроки? Нетоз обычно связан с воспалением, которое наносит вред, потому что слишком активно. И NETs могут быть просто следствием болезни. Но если нетоз — важное звено развития патологии, то терапевтический удар по нему поможет пациентам.
В исследовании с менингитом важность нетоза проверили ДНКазами — режущими ДНК белками. Когда их добавляли к культурам бактерий и иммунных клеток, они разрушали нейтрофильные ловушки. В результате иммунные клетки фагоцитировали патогены активнее — получается, что разрушение NETs лишает S. pneumoniae защиты (рис. 6). Это с высокой вероятностью подтверждает связь NETs и осложнений менингита. Значит, лечение, которое остановит нетоз, поможет инфицированным людям. Будем размышлять так и дальше.
Клетки печени производят две ДНКазы, чтобы чистить кровь от нейтрофильных ловушек. Если во время воспаления их не убирать, то они будут генерировать тромбы и закупорят сосуды. Еще переизбыток токсичных белков нейтрофилов и антитела против нейтрофильных ловушек разрушат клетки крови. Варианта ДНКаз два для подстраховки: если сломается один, поможет второй [28].
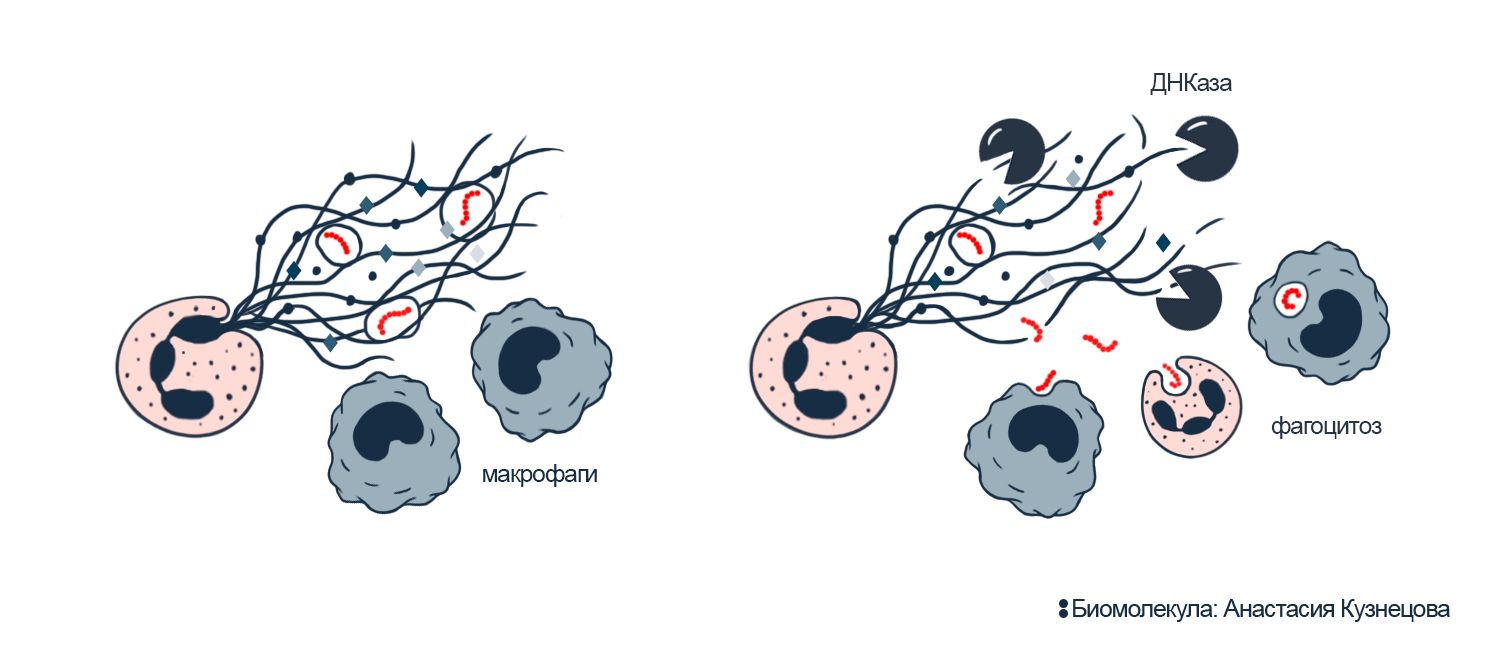
Рисунок 6. Бактериальный менингит: нейтрофильные ловушки защищают бактерий от макрофагов, но ДНКазы разрушают защиту.
Слева: до применения ДНКаз нейтрофильные сети ДНК ограждают стрептококков от уничтожения макрофагами. NETs служат защитой, потому что бактерии устойчивы к белкам нейтрофильных ловушек.
Справа: ДНКазы лишают стрептококков защиты, расщепляя ДНК сетей нейтрофилов. В результате иммунные клетки вновь могут фагоцитировать патогенов.
иллюстрация Анастасии Кузнецовой по [27]
Мы собрали информацию о вредном влиянии нетоза во врезку «Болезни, задействующие нейтрофильные ловушки». Однако давайте перед ней разберем еще несколько примеров, чтобы рассмотреть проблему с разных сторон. Действие нетоза в каждом примере дальше подтверждено с помощью ДНКаз, как в примере выше с менингитом, и других методов.
Cепсис: самое опасное воспаление
В мирное время нейтрофилы в сосудах помогают очищать кровь. Это полезная работа: нейтрофилы ловят патогены в сети NETs и обезвреживают их. Но когда бактерии защищаются и нейтрофилы теряют контроль над нетозом, запускается воспаление [29].
Против опытных патогенов NETs не срабатывают, потому что они научились сопротивляться нейтрофильным ловушкам:
— тормозят сборку ловушек внутри нейтрофилов с помощью молекул, схожих с сиаловыми кислотами;
— защищаются от NETs с помощью капсул;
— вырабатывают ДНКазы, которые режут нейтрофильные ловушки.
— Еще золотистый стафилококк вырабатывает аденозинсинтетазу. Этот белок превращает звенья ДНК в дезоксиаденозин — молекулу, которая запускает смерть макрофагов [8].
Связанное с нейтрофилами местное воспаление может переходить в сепсис — избыточную воспалительную реакцию всего организма на инфекцию. Из-за нейтрофилов кровь наполняется токсичными гистонами, которые повреждают любые клетки, разгоняя воспаление (рис. 7). Почки перестают очищать кровь и повреждаются. Отходы копятся в организме, а ткани недополучают кислород — развивается септический шок, самый тяжелый вариант сепсиса.
В общем, сепсис — это остановка жизни внутри крепости, куда проникло войско противника. Нетоз — пушка, которая стреляет по своим, пытаясь убить противника. В итоге нейтрофилы только утяжеляют сепсис.
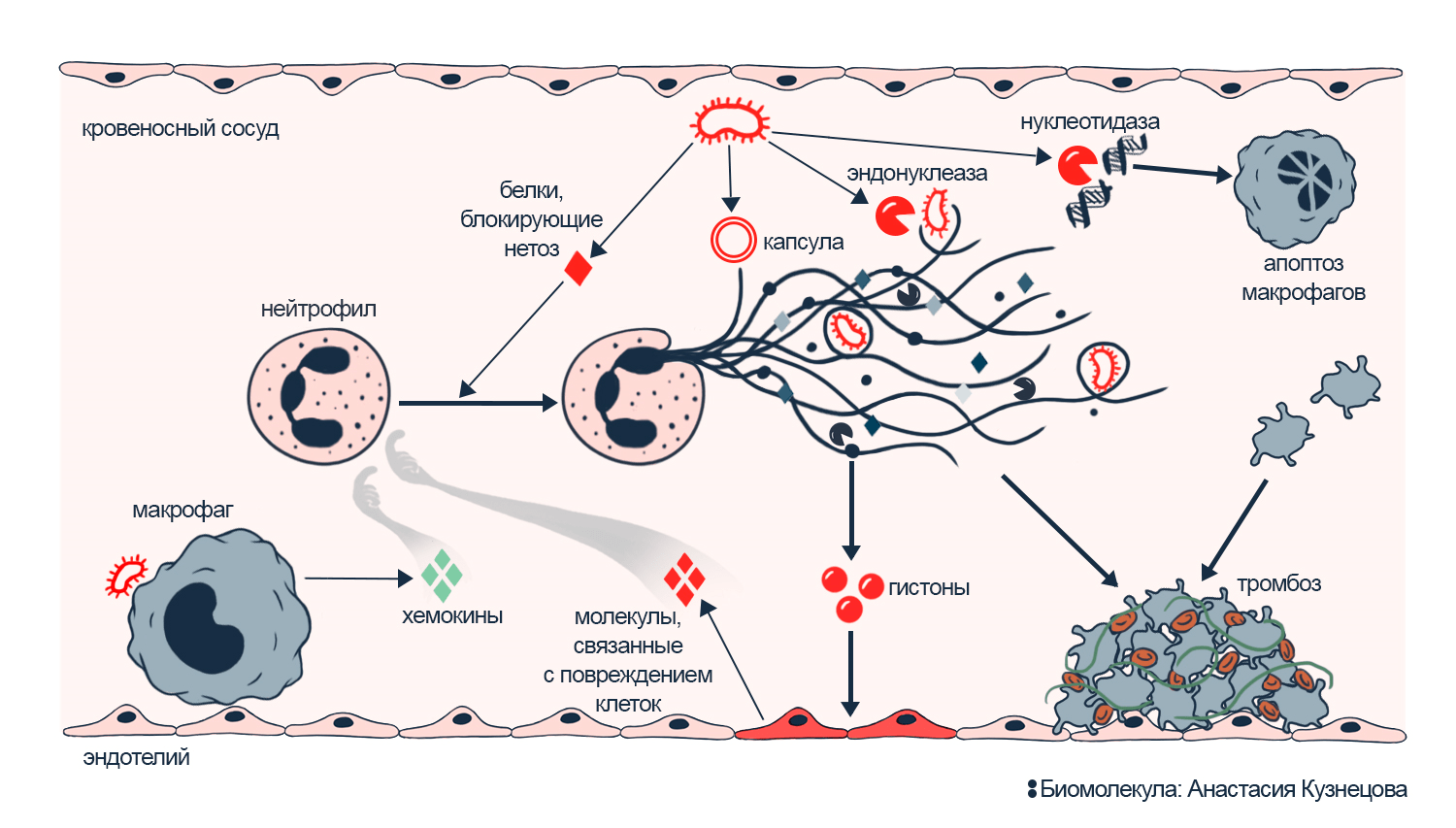
Рисунок 7. Защита бактерий от нейтрофильных ловушек и вклад NETs в сепсис.
Сверху: четыре механизма устойчивости бактерий к действию NETs. Благодаря устойчивости бактерии продолжают размножаться, это стимулирует воспаление и нетоз. В результате нетоз бесполезен и только нарушает работу сосудов: повреждает клетки эндотелия и запускает тромбоз. Усиление нейтрофилами воспаления может превратить его в сепсис.
иллюстрация Анастасии Кузнецовой по [8] и [29]
Человеку с сепсисом стараются вколоть большую дозу антибиотиков, чтобы все патогены погибли и перестали раздражать иммунную систему. Но часто это не помогает: главный урон наносят уже клетки иммунитета. То есть от сепсиса нужно какое-то лекарство, которое остановит его на этапе, универсальном для любых инфекций. Поскольку нетоз отягощает сепсис и из-за него люди с сепсисом чаще погибают, лечение против NETs могло бы помочь.
В попытках победить патогены нейтрофилы могут навредить здоровью. Но не всегда причина — это бактерии или грибы.
Атеросклероз: опасные кристаллы холестерина
В ходе атеросклероза в стенках сосуда копится холестерин и развивается воспаление. Холестерин вместе с продуктами клеточной смерти и волокнами коллагена вырастают в атеросклеротическую бляшку . Бляшка выпячивает стенку сосуда внутрь, и в этом месте возникают тромбы. Кровоток может унести их в другие части тела, где тромбы закупорят сосуды и нарушат снабжение местных органов.
В статье «Лечебный аферез против аферы холестерина и его подельников» мы уже рассказывали про атеросклероз и другие нарушения обмена липидов [30].
Нейтрофилы во многом запускают тромбоз, связанный с бляшкой. Когда они распознают в бляшке кристаллы холестерина, то включают смертельный нетоз. Нейтрофильные ловушки, в свою очередь, запускают свертывание крови, что делает тромбоз более активным и опасным (рис. 8) [31]. Нейтрофилы вообще часто усиливают тромбоз — утяжеляют проблемы с сосудами [32], [33].
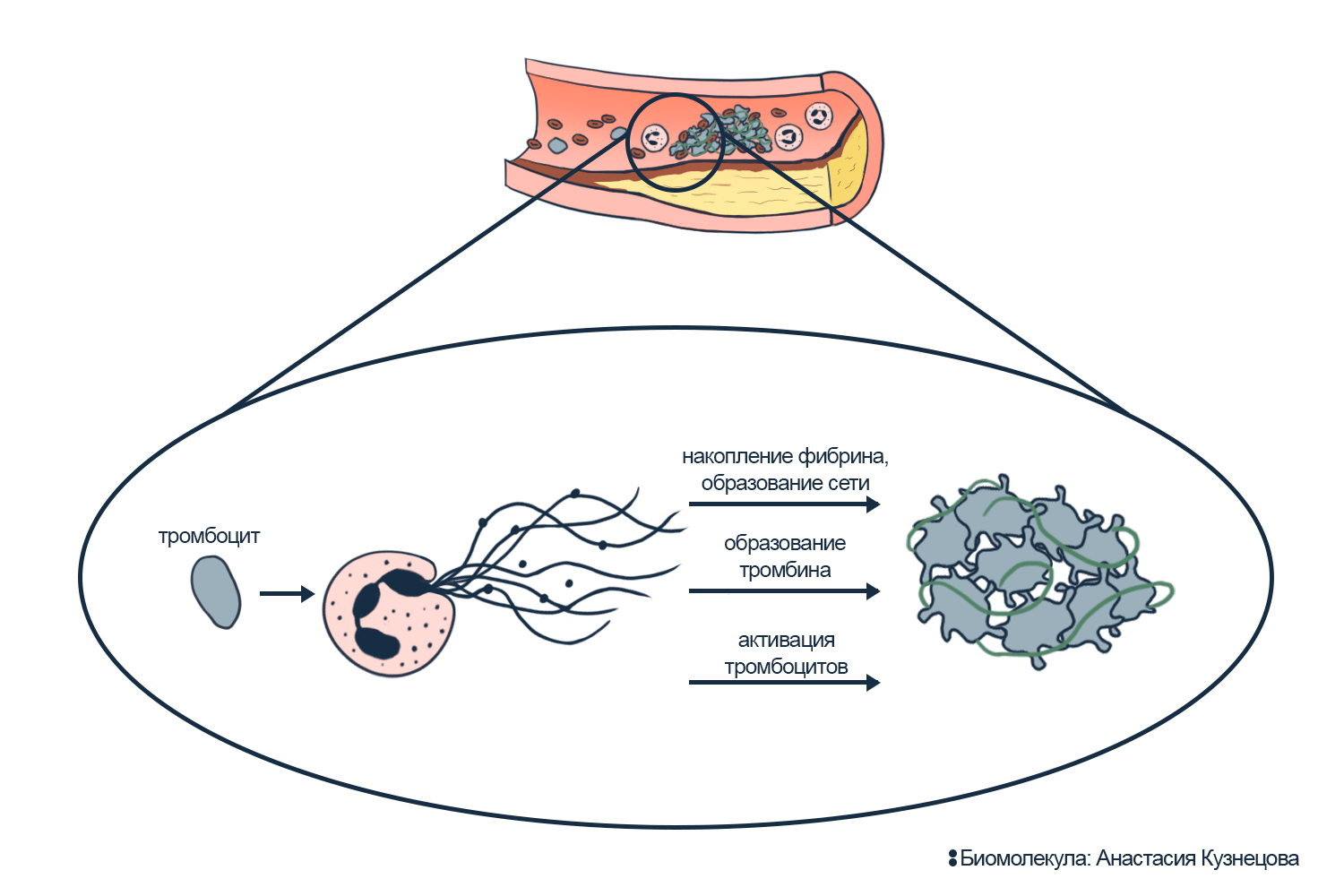
Рисунок 8. Нетоз рядом с атеросклеротической бляшкой. Нейтрофильные ловушки стимулируют свертывание крови, а значит, провоцируют тромбоз рядом с атеросклеротической бляшкой.
иллюстрация Анастасии Кузнецовой по [33]
Рак: рост опухоли и захват новых органов
Раковые клетки очень изменчивы, и лучшие из них используют всё вокруг в свою пользу. Они могут вербовать нейтрофилы, чтобы те им помогали; или извлекать выгоду из нетоза, направленного против опухоли (рис. 9).
- Нейтрофильные ловушки стимулируют раковые клетки размножаться и захватывать новые органы — метастазировать [34–36]. Например, рецептор CCDC25 клеток рака молочной железы в ответ на NETs увеличивает подвижность клеток [37]. Поэтому повышение NETs на ранней стадии рака предупреждает, что опухоль будет метастазировать активно. Чем больше NETs в крови, тем агрессивнее метастазы и тем опаснее раковая опухоль [24].
- Нейтрофильные ловушки скрывают опухоль от Т-киллеров, которые способны убивать раковые клетки. А раковые клетки запускают нетоз в нейтрофилах с помощью ИЛ12 и стимулируя рецепторы CXCR1 и CXCR2 (в норме этот путь используют другие иммунные клетки). В результате NETs вокруг опухоли мешают Т-киллерам приблизиться к раковым клеткам [24], [38].
- Нейтрофильные ловушки пробуждают рецидив рака. После лечения опухоли в организме могут оставаться спящие раковые клетки: они не делятся и не привлекают к себе внимания, их сдерживает противоопухолевое соединение Tsp-1. Когда нейтрофилы начинают нетоз в легких, то выбрасывают в составе ловушек протеазы. Они разрушают Tsp-1 или режут межклеточные волокна — это запускает рецидив рака в легких. Может запускать такой нетоз воспаление в организме из-за инфекции или воспаление в легких, вызванное табакокурением [39], [40].
- Еще на раке мочевого пузыря показали, что нейтрофильные ловушки делают опухоль устойчивее к лучевой терапии. В ходе исследования подтвердили, что если замедлять нетоз до терапии, она помогает лучше [41].
В целом связанное с опухолью воспаление запускает нетоз. Из-за нейтрофильных ловушек рак может сопровождаться сердечно-сосудистыми осложнениями: тромбозом, нарушением работы сосудов и системным воспалением [42], [43].
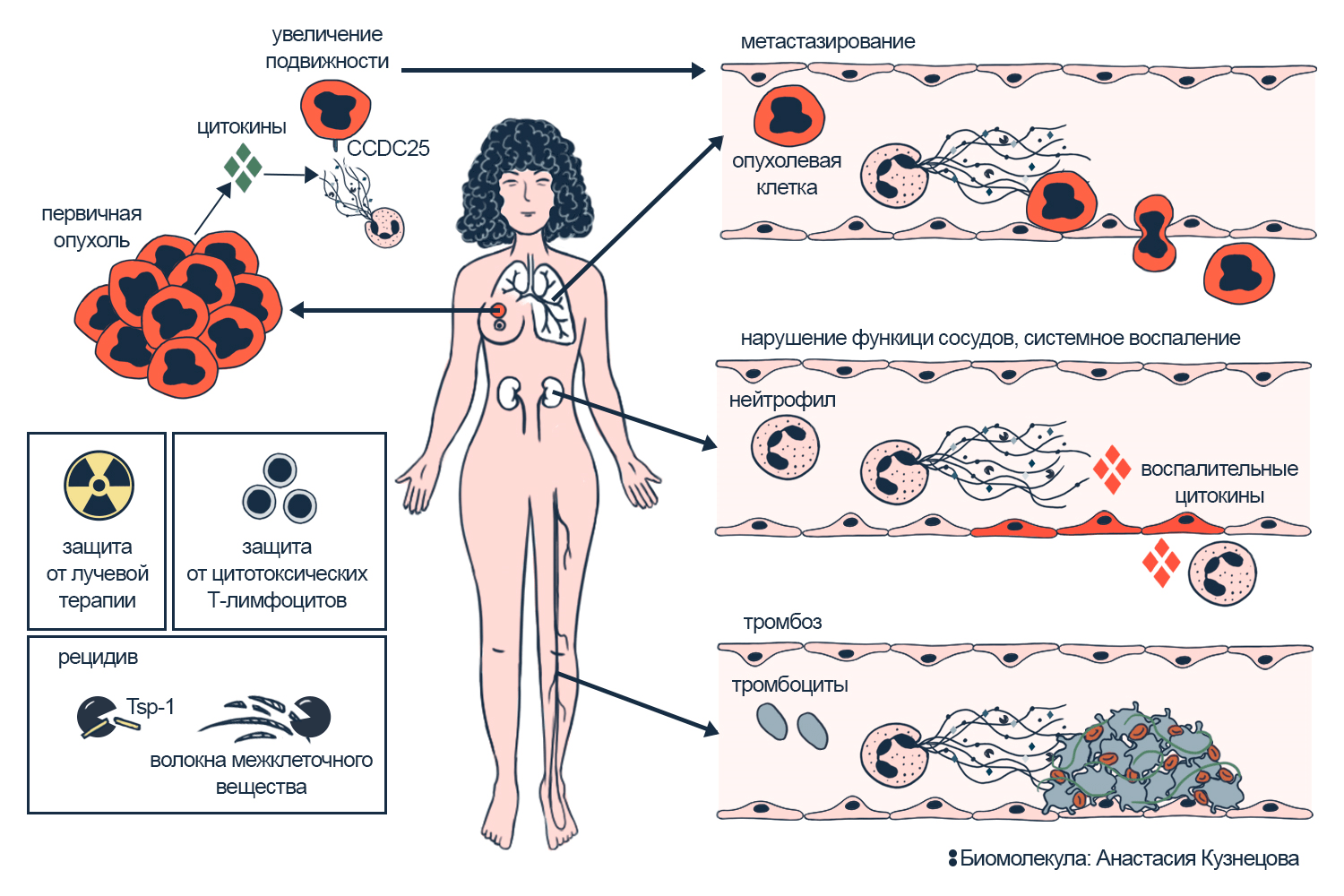
Рисунок 9. Нетоз стимулирует развитие рака и защищает опухоль.
иллюстрация Анастасии Кузнецовой по [37], [39], [43]
Иммунотромбоз: как NETs уничтожают легкие при COVID-19
Коронавирус SARS-CoV-2 провоцирует клетки легких на выработку фактора фон Виллебранда (см. рис. 10). Это соединение привлекает тромбоциты с нейтрофилами и активирует их. Тромбоциты запускают свертывание крови, а сети нейтрофилов подстегивают его. И целом, в ответ на вирусные белки нейтрофилы запускают смертельный нетоз. Это дополнительный вклад в активность свертывания крови. Так иммунитет клеток легких и NETs вместе провоцируют иммунотромбоз в сосудах.
Тромбы легко закупоривают мелкие капилляры легких. А белки нейтрофильных ловушек разрушают клетки. Это уничтожает участки легких, и они перестают снабжать организм кислородом. Когда пораженных участков много, развивается легочная недостаточность.
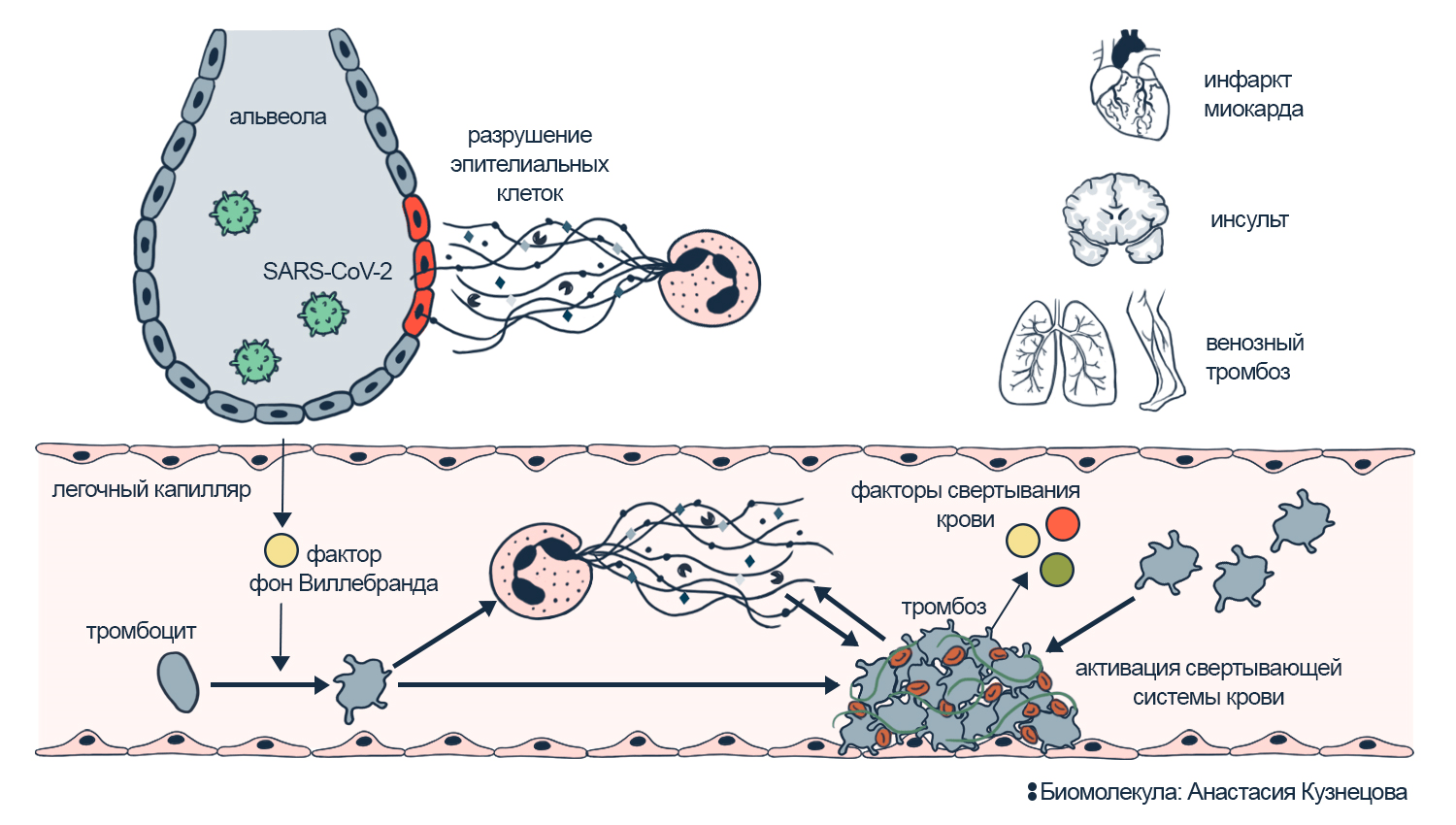
Рисунок 10. Взаимосвязь нетоза, иммунотромбоза и легочной недостаточности при COVID-19. Из-за фактора фон Виллебранда тромбоциты и нейтрофилы активизируют свертывание крови. В результате тромбы могут закупоривать легочные капилляры, вызывать легочную недостаточность и другие осложнения: инсульт или инфаркт миокарда.
иллюстрация Анастасии Кузнецовой по [4]
Что ж, во многих болезнях нетоз действительно опасен. В одних случаях он увеличивает урон от системы свертывания крови. В других — сносит иммунную систему с рельсов. Раз нетоз — это их общее опасное звено, нужно учиться останавливать его.
Как остановить нетоз
Ни у одного потенциального лекарства против опасного нетоза нет разрешения на использование — они еще не закончили проходить лабораторные и клинические тесты [35], [61]. Среди них много ДНКаз, есть блокаторы важных стадий нетоза. Разработка лекарственного лечения займет как минимум несколько лет. Но есть еще один подход.
Как отфильтровать NETs из крови
Можно удалить опасные сети ДНК из плазмы крови экстракорпорально — вне тела пациента. Терапевтический аферез — метод удаления из крови опасных для здоровья компонентов — можно нацелить и на свободную ДНК. Тогда после афереза колонка с сорбентом задержит NETs и не навредит другим молекулам и клеткам.
Сорбент, который должен идеально связывать ДНК — это гистоны. Они работают только с ДНК, а значит, должны забирать из плазмы исключительно ее. Поэтому разработчики афереза NETs сделали сорбент из гистона H1.3 (см. рис. 11).
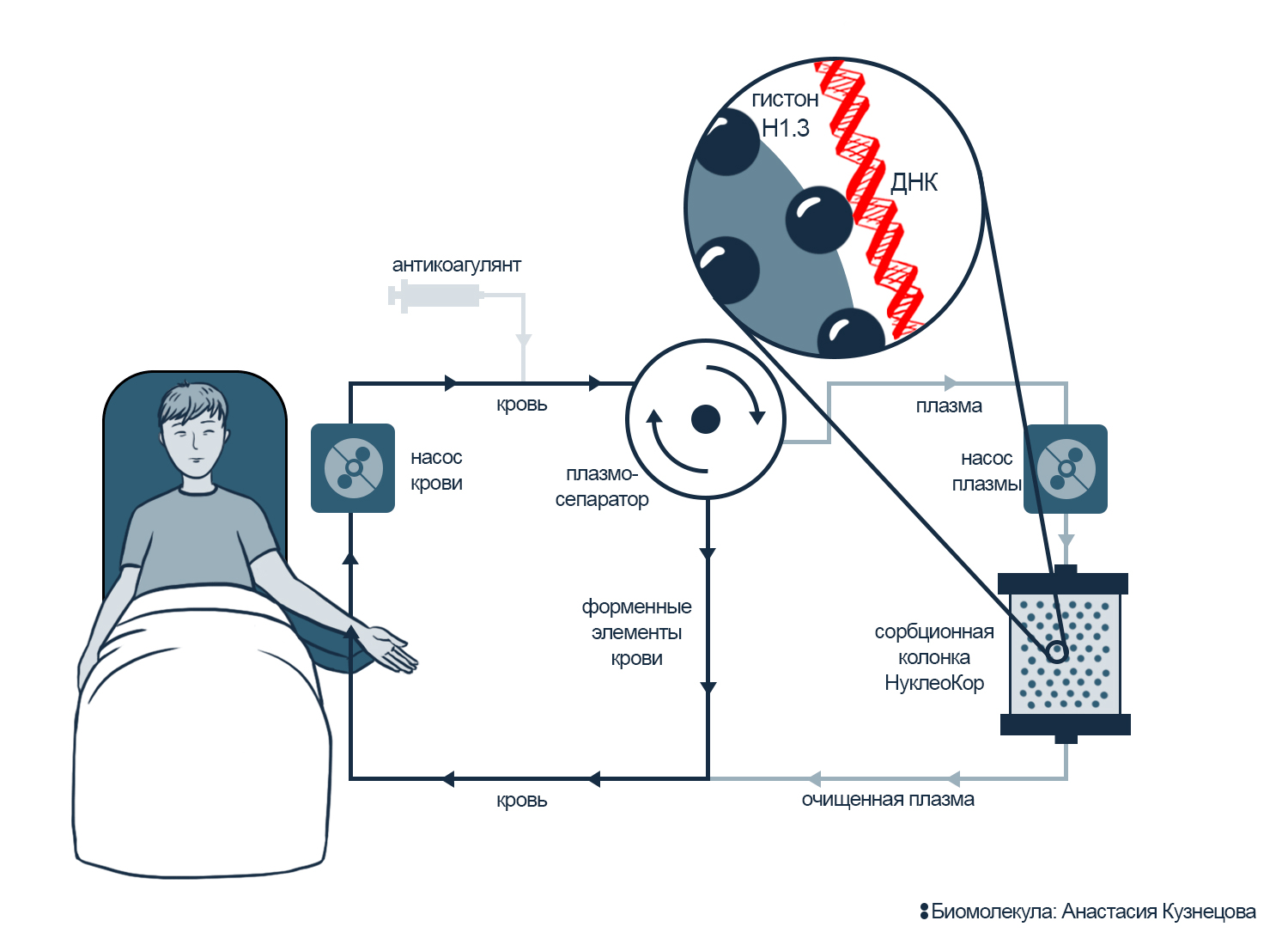
Рисунок 11. Схема афереза NETs. В ходе процедуры кровь пациента разделяется на плазму и форменные элементы, чтобы очистить плазму от NETs. Насос прокачивает плазму через сорбционную колонку с молекулами гистона H1.3 в качестве сорбента. Сорбент задерживает нейтрофильные ловушки, и очищенная плазма вместе с форменными элементами возвращается в кровоток.
иллюстрация Анастасии Кузнецовой
НПФ «Покард» уже проверили безопасность афереза NETs в доклинических испытаниях. В ходе исследований из крови свиней с сепсисом за одну процедуру удалили 98% NETs. Подопытным животным аферез помог: септический шок стал в разы слабее, чем у контрольных животных, которым кровь не очищали. Результатов на людях пока нет, потому что клинические испытания не закончены.
Нетоз где-то защищает здоровье, но чаще ему вредит. Поэтому в опасных случаях нужно очищать кровь от нейтрофильных ловушек. Если аферез NETs окажется полезным и станет доступным, он сможет: сохранить жизни пациентов с сепсисом, улучшить здоровье людей с проблемами внутри сосудов, улучшить восстановление мозга после инсульта и задержать распространение рака по организму.
Литература
- Молекулы и эпигеном ;
- Nora Branzk, Aleksandra Lubojemska, Sarah E Hardison, Qian Wang, Maximiliano G Gutierrez, et. al.. (2014). Neutrophils sense microbe size and selectively release neutrophil extracellular traps in response to large pathogens. Nat Immunol. 15, 1017-1025;
- V. Brinkmann. (2004). Neutrophil Extracellular Traps Kill Bacteria. Science. 303, 1532-1535;
- Konstantin Stark, Steffen Massberg. (2021). Interplay between inflammation and thrombosis in cardiovascular pathology. Nat Rev Cardiol. 18, 666-682;
- Carlos Silvestre-Roig, Quinte Braster, Kanin Wichapong, Ernest Y. Lee, Jean Marie Teulon, et. al.. (2019). Externalized histone H4 orchestrates chronic inflammation by inducing lytic cell death. Nature. 569, 236-240;
- Jun Xu, Xiaomei Zhang, Rosana Pelayo, Marc Monestier, Concetta T Ammollo, et. al.. (2009). Extracellular histones are major mediators of death in sepsis. Nat Med. 15, 1318-1321;
- Что такое внеклеточный матрикс и почему его все изучают;
- Venizelos Papayannopoulos. (2018). Neutrophil extracellular traps in immunity and disease. Nat Rev Immunol. 18, 134-147;
- Ritika Khandpur, Carmelo Carmona-Rivera, Anuradha Vivekanandan-Giri, Alison Gizinski, Srilakshmi Yalavarthi, et. al.. (2013). NETs Are a Source of Citrullinated Autoantigens and Stimulate Inflammatory Responses in Rheumatoid Arthritis. Sci. Transl. Med.. 5;
- Liam J. O’Neil, Ana Barrera-Vargas, Donavon Sandoval-Heglund, Javier Merayo-Chalico, Eduardo Aguirre-Aguilar, et. al.. (2020). Neutrophil-mediated carbamylation promotes articular damage in rheumatoid arthritis. Sci. Adv.. 6;
- Антимикробные пептиды — возможная альтернатива традиционным антибиотикам;
- Maaike R. Scheenstra, Roel M. van Harten, Edwin J. A. Veldhuizen, Henk P. Haagsman, Maarten Coorens. (2020). Cathelicidins Modulate TLR-Activation and Inflammation. Front. Immunol.. 11;
- 12 методов в картинках: микроскопия;
- Christoph Daniel, Moritz Leppkes, Luis E. Muñoz, Gunnar Schley, Georg Schett, Martin Herrmann. (2019). Extracellular DNA traps in inflammation, injury and healing. Nat Rev Nephrol. 15, 559-575;
- Последний путь тромбоцита;
- Позови меня с собой. Как иммунная клетка пошла за тромбоцитом в печень и помогла вырастить рак (и как это предотвратить);
- Shida Yousefi, Dagmar Simon, Darko Stojkov, Antonina Karsonova, Alexander Karaulov, Hans-Uwe Simon. (2020). In vivo evidence for extracellular DNA trap formation. Cell Death Dis. 11;
- Daigo Nakazawa, Jyaysi Desai, Stefanie Steiger, Susanne Müller, Satish Kumar Devarapu, et. al.. (2018). Activated platelets induce MLKL-driven neutrophil necroptosis and release of neutrophil extracellular traps in venous thrombosis. Cell Death Discov.. 4;
- Leo Nicolai, Karin Schiefelbein, Silvia Lipsky, Alexander Leunig, Marie Hoffknecht, et. al.. (2020). Vascular surveillance by haptotactic blood platelets in inflammation and infection. Nat Commun. 11;
- Florian Gaertner, Zerkah Ahmad, Gerhild Rosenberger, Shuxia Fan, Leo Nicolai, et. al.. (2017). Migrating Platelets Are Mechano-scavengers that Collect and Bundle Bacteria. Cell. 171, 1368-1382.e23;
- Selina K Jorch, Paul Kubes. (2017). An emerging role for neutrophil extracellular traps in noninfectious disease. Nat Med. 23, 279-287;
- Ki Lee Milligan, Daphne Mann, Amy Rump, Victoria L. Anderson, Amy P. Hsu, et. al.. (2016). Complete Myeloperoxidase Deficiency: Beware the “False-Positive” Dihydrorhodamine Oxidation. The Journal of Pediatrics. 176, 204-206;
- Matteo Bianchi, Abdul Hakkim, Volker Brinkmann, Ulrich Siler, Reinhard A. Seger, et. al.. (2009). Restoration of NET formation by gene therapy in CGD controls aspergillosis. Blood. 114, 2619-2622;
- Jing Liu, Dandan Yang, Xiqiang Wang, Zhonghai Zhu, Tingzhong Wang, et. al.. (2019). Neutrophil extracellular traps and dsDNA predict outcomes among patients with ST-elevation myocardial infarction. Sci Rep. 9;
- Georg Schett, Christine Schauer, Markus Hoffmann, Martin Herrmann. (2015). Why does the gout attack stop? A roadmap for the immune pathogenesis of gout. RMD Open. 1, e000046;
- Менингит: многоликий убийца;
- Tirthankar Mohanty, Jane Fisher, Anahita Bakochi, Ariane Neumann, José Francisco Pereira Cardoso, et. al.. (2019). Neutrophil extracellular traps in the central nervous system hinder bacterial clearance during pneumococcal meningitis. Nat Commun. 10;
- Miguel Jiménez-Alcázar, Chandini Rangaswamy, Rachita Panda, Josephine Bitterling, Yashin J. Simsek, et. al.. (2017). Host DNases prevent vascular occlusion by neutrophil extracellular traps. Science. 358, 1202-1206;
- Masaki Honda, Paul Kubes. (2018). Neutrophils and neutrophil extracellular traps in the liver and gastrointestinal system. Nat Rev Gastroenterol Hepatol. 15, 206-221;
- Лечебный аферез против аферы холестерина и его подельников;
- Annika Warnatsch, Marianna Ioannou, Qian Wang, Venizelos Papayannopoulos. (2015). Neutrophil extracellular traps license macrophages for cytokine production in atherosclerosis. Science. 349, 316-320;
- Andrew S. Kimball, Andrea T. Obi, Jose A. Diaz, Peter K. Henke. (2016). The Emerging Role of NETs in Venous Thrombosis and Immunothrombosis. Front. Immunol.. 7;
- Carlos Silvestre-Roig, Quinte Braster, Almudena Ortega-Gomez, Oliver Soehnlein. (2020). Neutrophils as regulators of cardiovascular inflammation. Nat Rev Cardiol. 17, 327-340;
- Sheniz Yuzeir, Liana Gercheva. (2022). The Role of Neutrophil Extracellular Traps (NETs) in the Pathogenesis and Complications of Malignant Diseases. Inflammation in the 21st Century;
- Christine Brostjan, Rudolf Oehler. (2020). The role of neutrophil death in chronic inflammation and cancer. Cell Death Discov.. 6;
- Метастазирование опухолей;
- Linbin Yang, Qiang Liu, Xiaoqian Zhang, Xinwei Liu, Boxuan Zhou, et. al.. (2020). DNA of neutrophil extracellular traps promotes cancer metastasis via CCDC25. Nature. 583, 133-138;
- Yu Zhang, Vidhi Chandra, Erick Riquelme Sanchez, Prasanta Dutta, Pompeyo R. Quesada, et. al.. (2020). Interleukin-17–induced neutrophil extracellular traps mediate resistance to checkpoint blockade in pancreatic cancer. Journal of Experimental Medicine. 217;
- Jean Albrengues, Mario A. Shields, David Ng, Chun Gwon Park, Alexandra Ambrico, et. al.. (2018). Neutrophil extracellular traps produced during inflammation awaken dormant cancer cells in mice. Science. 361;
- Tina El Rayes, Raúl Catena, Sharrell Lee, Marcin Stawowczyk, Natasha Joshi, et. al.. (2015). Lung inflammation promotes metastasis through neutrophil protease-mediated degradation of Tsp-1. Proc. Natl. Acad. Sci. U.S.A.. 112, 16000-16005;
- Surashri Shinde-Jadhav, Jose Joao Mansure, Roni F. Rayes, Gautier Marcq, Mina Ayoub, et. al.. (2021). Role of neutrophil extracellular traps in radiation resistance of invasive bladder cancer. Nat Commun. 12;
- Jessica Cedervall, Yanyu Zhang, Anna-Karin Olsson. (2016). Tumor-Induced NETosis as a Risk Factor for Metastasis and Organ Failure. Cancer Res. 76, 4311-4315;
- Catherine C. Hedrick, Ilaria Malanchi. (2022). Neutrophils in cancer: heterogeneous and multifaceted. Nat Rev Immunol. 22, 173-187;
- Diana A. Gorog, Robert F. Storey, Paul A. Gurbel, Udaya S. Tantry, Jeffrey S. Berger, et. al.. (2022). Current and novel biomarkers of thrombotic risk in COVID-19: a Consensus Statement from the International COVID-19 Thrombosis Biomarkers Colloquium. Nat Rev Cardiol;
- Andrew J. Monteith, Jeanette M. Miller, C. Noel Maxwell, Walter J. Chazin, Eric P. Skaar. (2021). Neutrophil extracellular traps enhance macrophage killing of bacterial pathogens. Sci. Adv.. 7;
- Lijing Kang, Huilin Yu, Xing Yang, Yuanbo Zhu, Xiaofei Bai, et. al.. (2020). Neutrophil extracellular traps released by neutrophils impair revascularization and vascular remodeling after stroke. Nat Commun. 11;
- Robin Zenlander, Sebastian Havervall, Maria Magnusson, Jennie Engstrand, Anna Ågren, et. al.. (2021). Neutrophil extracellular traps in patients with liver cirrhosis and hepatocellular carcinoma. Sci Rep. 11;
- Rachel Njeim, William S Azar, Angie H Fares, Sami T Azar, Hala Kfoury Kassouf, Assaad A Eid. (2020). NETosis contributes to the pathogenesis of diabetes and its complications. Journal of Molecular Endocrinology. 65, R65-R76;
- Axel Rosell, Katherina Aguilera, Yohei Hisada, Clare Schmedes, Nigel Mackman, et. al.. (2021). Prognostic value of circulating markers of neutrophil activation, neutrophil extracellular traps, coagulation and fibrinolysis in patients with terminal cancer. Sci Rep. 11;
- Hafsa Munir, James O. Jones, Tobias Janowitz, Markus Hoffmann, Maximilien Euler, et. al.. (2021). Stromal-driven and Amyloid β-dependent induction of neutrophil extracellular traps modulates tumor growth. Nat Commun. 12;
- Xi Chen, Yuanyuan Li, Ling Qin, Ruoxi He, Chengping Hu. (2021). Neutrophil Extracellular Trapping Network Promotes the Pathogenesis of Neutrophil-associated Asthma through Macrophages. Immunological Investigations. 50, 544-561;
- Radermecker C., Sabatel C, Vanwinge C., Ruscitti C., Maréchal P., Perin F., Schyns J., Rocks N., Toussaint M., Cataldo D., Johnston S., Bureau F., Marichal T. (2019). Locally instructed CXCR4hi neutrophils trigger environment-driven allergic asthma through the release of neutrophil extracellular traps. Nature Immunology. 20, 1444–1455;
- Ranjit Sivanandham, Egidio Brocca-Cofano, Noah Krampe, Elizabeth Falwell, Sindhuja Murali Kilapandal Venkatraman, et. al.. (2018). Neutrophil extracellular trap production contributes to pathogenesis in SIV-infected nonhuman primates. Journal of Clinical Investigation. 128, 5178-5183;
- Falko Apel, Arturo Zychlinsky, Elaine F. Kenny. (2018). The role of neutrophil extracellular traps in rheumatic diseases. Nat Rev Rheumatol. 14, 467-475;
- Meng Jiang, Nan Shen, Haibo Zhou, You Wang, Sihan Lin, et. al.. (2021). The enrichment of neutrophil extracellular traps impair the placentas of systemic lupus erythematosus through accumulating decidual NK cells. Sci Rep. 11;
- Michael Boettcher, Melina Esser, Julian Trah, Stefan Klohs, Nariman Mokhaberi, et. al.. (2020). Markers of neutrophil activation and extracellular traps formation are predictive of appendicitis in mice and humans: a pilot study. Sci Rep. 10;
- Pierre-André Jarrot, Edwige Tellier, Lea Plantureux, Lydie Crescence, Stéphane Robert, et. al.. (2019). Neutrophil extracellular traps are associated with the pathogenesis of diffuse alveolar hemorrhage in murine lupus. Journal of Autoimmunity. 100, 120-130;
- Shuainan Zhu, Ying Yu, Yun Ren, Liying Xu, Huilin Wang, et. al.. (2021). The emerging roles of neutrophil extracellular traps in wound healing. Cell Death Dis. 12;
- Sivasami Pulavendran, Maram Prasanthi, Akhilesh Ramachandran, Rezabek Grant, Timothy A. Snider, et. al.. (2020). Production of Neutrophil Extracellular Traps Contributes to the Pathogenesis of Francisella tularemia. Front. Immunol.. 11;
- Deirdre Vincent, Michaela Klinke, Georg Eschenburg, Magdalena Trochimiuk, Birgit Appl, et. al.. (2018). NEC is likely a NETs dependent process and markers of NETosis are predictive of NEC in mice and humans. Sci Rep. 8;
- Lihui Wang, Raashid Luqmani, Irina A. Udalova. (2022). The role of neutrophils in rheumatic disease-associated vascular inflammation. Nat Rev Rheumatol. 18, 158-170;
- Терапевтический аферез. Как и для чего очищают кровь вне тела пациента;
- Внеклеточная ДНК приподнимает завесу тайны беременности.