От живого к неживому и обратно
24 июля 2015
От живого к неживому и обратно
- 2378
- 0
- 0
Эти цветы смолёвки узколистой (Silene stenophylla) появились на свет в лаборатории ученых Пущинского научного центра из плодов растения, которые пролежали в вечномерзлотной почве в безжизненном состоянии примерно 30 000 лет!
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Мир живого полон чудес. И всё же есть явление, где природа, кажется, перешагнула пределы своих возможностей: при определенных условиях жизнь может обратимо прекращаться на молекулярном уровне...
Конкурс «Био/Мол/Текст»-2015
Эта работа опубликована в номинации «Лучшая обзорная статья» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Сова приложила ухо к груди Буратино.
— Пациент скорее мертв, чем жив, — прошептала она и отвернула голову назад на сто восемьдесят градусов.
Жаба долго мяла влажной лапой Буратино. Раздумывая, глядела выпученными глазами сразу в разные стороны. Прошлепала большим ртом:
— Пациент скорее жив, чем мертв...
Народный лекарь Богомол сухими, как травинки, руками начал дотрагиваться до Буратино.
— Одно из двух, — прошелестел он, — или пациент жив, или он умер. Если он жив — он останется жив или он не останется жив. Если он мертв — его можно оживить или нельзя оживить.
— Шшшарлатанство, — сказала Сова, взмахнула мягкими крыльями и улетела на темный чердак.
У Жабы от злости вздулись все бородавки.
— Какакокое отвррратительное невежество! — квакнула она и, шлепая животом, запрыгала в сырой подвал.
Лекарь Богомол на всякий случай притворился высохшим сучком и вывалился за окошко.
А.Н. Толстой
«Золотой ключик, или Приключения Буратино»
Чудо невидимого мира
В 1702 году в Лондонское королевское общество содействия развитию знаний о природе (The Royal Society of London for the Improvement of Natural Knowledge) поступило письмо от одного из зарубежных его членов, озаглавленное «О некоторых Animalcules (лат. „микроскопических животных“. — Е.П.), найденных в осадках сточных желобов крыш домов». В нем были представлены следующие наблюдения: «Я часто доставал этих описанных мною ранее Animalcules из воды... чтобы посмотреть, лопнут ли они после того, как вода вокруг них испарится, и они окажутся на воздухе, как мне приходилось видеть в случае других Animalcules. Так вот теперь я обнаружил, что, когда почти вся вода испарилась, и каждое существо уже не было покрыто водой, оно не двигалось как обычно, а сжималось, принимая овальную форму, но я не мог понять, испарилась ли влага из его тельца... Чтобы полнее удовлетворить свое любопытство в этом отношении, 3 сентября, около семи часов утра, я взял немного сухого осадка, который собрал из свинцового сточного желоба и который простоял у меня в комнате почти два дня, положил его помаленьку в две стеклянные пробирки, куда потом налил охлажденной кипяченой дождевой воды... Сразу после того, как налил воду, я всё это перемешал, чтобы осадок скорее смешался с водой, так как из-за волосков в нём он казался слипшимся, как твердое тело, и, когда он осел на дно пробирок, я исследовал его и заметил несколько этих Animalcules, лежащих плотно прижавшимися друг к другу. Вскоре после этого они начали удлинять свои тельца, а через полчаса по меньшей мере сотня из них уже плавала... Эти эксперименты я повторял многократно с тем же успехом, в частности, с сухим осадком, который пролежал у меня в комнате около пяти месяцев... А если эти Animalcules после пребывания в сухом состоянии столь длительное время способны в воде вновь расправляться и двигаться обычным образом, то можно заключить, что во многих местах, где летом вода застаивается, и затем они высыхают, может быть много видов Animalcules, которые исходно там не обитали, а были занесены туда (из других мест) на лапах и перьях водоплавающих птиц» [1].
Так впервые было описано одно из чудес биологического мира — обратимый переход живых организмов в состояние, при котором они не проявляют признаков жизни. Автором этого открытия был голландский торговец мануфактурой и член Лондонского королевского общества Антони ван Левенгук, а было ему тогда 70 лет. Свои наблюдения он производил с помощью миниатюрных увеличительных стекол (линз), секрет изготовления которых сохранил в тайне до конца своих дней. Линзы были встроены в специальную конструкцию, позволяющую довольно точно устанавливать объект, размещенный на игле, в фокус и добиваться более чем 200-кратного увеличения (рис. 1). Чтобы рассматривать объект, конструкцию подносили к глазам.

Рисунок 1. Микроскоп Антони ван Левенгука. Это устройство принято называть «микроскопом Левенгука», однако, строго говоря, оно не является микроскопом в современном понимании. В настоящее время принято считать микроскопами устройства, состоящие из двух систем линз — объектива и окуляра. Есть указания на то, что такие микроскопы изобрели до Левенгука [2]. Впрочем, это не умаляет достоинств Левенгука как исследователя и первооткрывателя. Благодаря своему «микроскопу» и еще в большей степени пытливому стремлению к новым знаниям, он первым открыл и описал многих микроскопических существ, от бактерий до мелких беспозвоночных животных.
Дебри семантики
Левенгук больше не исследовал обнаруженный им феномен и не дал ему какого-либо специального названия. Не уделили достаточного внимания его открытию и современники-натуралисты — как минимум по двум причинам. Во-первых, это было единичное наблюдение с использованием оригинального приспособления, не подтвержденное ничьими независимыми наблюдениями. Во-вторых, невидимый невооруженным глазом мир микроскопических существ воспринимался в те времена вообще как другой мир, не связанный с макромиром.
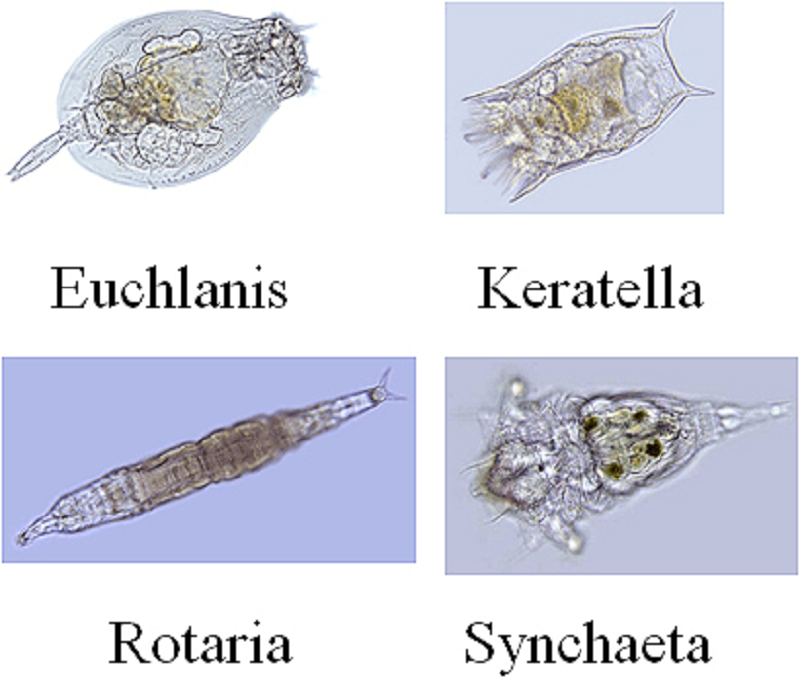
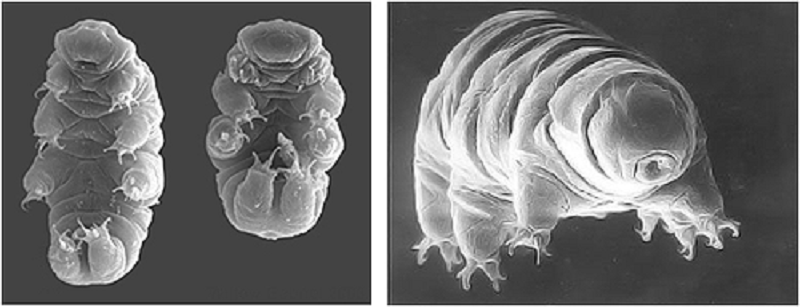
Лишь полвека спустя появились первые сообщения английских натуралистов, членов Королевского общества, Джона Нидхема и Генри Бейкера о похожих наблюдениях. А уже в конце XVIII века итальянский священник и натуралист (тогда эти профессии у многих успешно совмещались) Ладзаро Спалланцани не только подтвердил факты, описанные Левенгуком, но и охарактеризовал тех самых Animalcules. Ими оказались животные, известные в настоящее время как коловратки (тип Rotifera, или Rotatoria) и тихоходки (тип Tardigrada) (рис. 2А, 2Б).
Спалланцани назвал рассматриваемый феномен «воскрешением убитых животных». В 1872 году немецкий физиолог Вильям Прейер предложил более «научный» термин — анабиоз, «возвращение к жизни» (от др.-греч. ανα — «вверх» и βιος — «жизнь»). Общим же у Спалланцани и Прейера, а также ряда других ученых было представление о том, что высушенные микроскопические животные в буквальном смысле перестают быть живыми и при насыщении их тел водой вновь оживают.
Постепенно накапливались сведения о многочисленных случаях оживления не проявляющих признаков жизни представителей разных групп организмов не только в высушенном состоянии, но также при пониженных температурах и в некоторых других условиях. Наряду с феноменологическими наблюдениями разнообразных проявлений живого мира развивались и представления о том, что его отличает от мира неживого. Сформировалось понимание, что в основе жизни лежит метаболизм (обмен веществ) — совокупность биохимических реакций, организованных в пространстве и времени. При этом пространственно-временную упорядоченность метаболизма в значительной мере обеспечивает структурная организация клеток.
Наконец, в 1959 году английский энтомолог и паразитолог Дэвид Кейлин предложил характеризовать все организмы в соответствии с уровнем их метаболизма [1]. По этому показателю он выделил три состояния: нормальный метаболизм, пониженный, или гипометаболизм, и отсутствие метаболизма — аметаболизм. Состоянию аметаболизма Кейлин присвоил специальный термин — криптобиоз, или скрытая жизнь. Он отметил, что именно его наблюдал Левенгук, а Прейер назвал анабиозом. Необходимость же в новом термине ученый объяснил тем, что, по его мнению, жизнь в этом состоянии не прекращается, а приостанавливается, делается скрытой. «В живом активном организме, — писал Кейлин, — состояние множества его компонентов — результат динамического равновесия реакций, участвующих в их постоянном разрушении и регенерации... Стабильность такого организма имеет динамическую природу. При криптобиозе организм не может поставлять энергию для сохранения своей сложной структуры, но которая тем не менее остается интактной... Стабильность такого организма имеет чисто статическую природу...»
Представления Кейлина поддержал советский биолог Александр Михайлович Голдовский [3], занимавшийся проблемой длительного хранения семян растений. Он также трактовал анабиоз как остановку метаболизма при сохранении жизненно важных структур, однако для обозначения состояния аметаболизма предпочел пользоваться термином Прейера «анабиоз», а состояние гипометаболизма предложил называть гипобиозом. А. М. Голдовский несколько расширил классификацию Кейлина — предложил, например, выделить искусственный (полученный в лабораторных условиях) и естественный (природный) анабиоз.
В русскоязычной научной и даже художественной литературе сложилась традиция пользоваться термином «анабиоз» вслед за П. Ю. Шмидтом [4], Л. К. Лозина-Лозинским [5], А. М. Голдовским [3] и др. В англоязычной литературе «прижился» термин «криптобиоз» [6], [7].
Немножко умереть... чтобы выжить
Границу между анабиозом и гипобиозом трудно выявить экспериментально, поскольку практически невозможно «измерить» метаболизм в целом, особенно едва уловимый. В то же время, по-видимому, можно говорить об «истинном» анабиозе, когда метаболизм становится теоретически невозможным — например, при значительной дегидратации организмов (до остаточной влажности 10% и меньше) или глубоком замораживании до температур ниже −80 oC. Расчеты показали, что при содержании воды в клетках 10% и меньше ее недостаточно даже для того, чтобы покрыть все белки хотя бы молекулярным монослоем [6]. А при температурах ниже −80 oC практически вся вода в биологических образцах гарантированно превращается в лед, и поступательное движение молекул прекращается [8], [9]. Не исключено, что какие-либо химические процессы в обоих случаях всё же происходят, однако метаболизм как скоординированное в пространстве и времени течение биохимических процессов прекращается. На основании этих соображений выделяют две формы анабиоза [3]: ксероанабиоз, который в англоязычной литературе называют ангидробиозом [6], [10], [11], и низкотемпературный, или криоанабиоз.
Со времен Левенгука обнаружено множество организмов, которых, как писал Спалланцани, «природа одарила привилегией наслаждаться истинным воскрешением после смерти». Многие организмы в природных условиях погружаются в так называемый вынужденный ксероанабиоз. «Привилегию» переживать дегидратацию имеют многие, если не все виды микроорганизмов, низшие растения (мхи, лишайники) и вегетативные формы некоторых высших так называемых «воскресающих» (англ. resurrection) растений [12], таких, например, как рамонда сербская (Ramonda serbica) и селагинелла чешуелистная (Selaginella lepidophylla) (рис. 3А). Среди животных это, помимо коловраток и тихоходок, микроскопические представители круглых червей (Nematoda), личинки комаров-звонцов Polypedilum vanderplanki, цисты ракообразных Artemia salina (рис. 3Б) [1], [3].
Другой тип ксероанабиоза, «онтогенетический», предопределен характером развития организма, который направлен на подготовку к выживанию в неблагоприятных условиях. Всем известные примеры из мира растений — семена и пыльца [3]. У некоторых видов микроорганизмов (бактерий и микроскопических грибов) эволюционно закреплена способность переходить в состояние споры. На рисунке 4 показаны бактериальные эндоспоры, то есть споры, образующиеся внутри клеток. Переход этот, сложный и многостадийный, совершается, когда в среде снижается концентрация некоторых компонентов питания. Для спор по сравнению с вегетативными клетками характерно более низкое содержание воды (30–50% против 75–80%). Метаболическая активность в них практически отсутствует, и на этом основании их также можно считать анабиотическим состоянием бактерий [13].
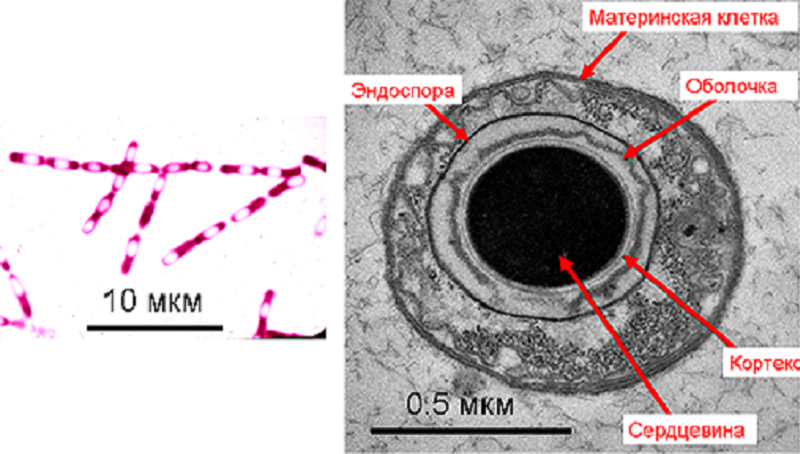
Рисунок 4. Эндоспоры сенной палочки (Bacillus subtilis). В световом микроскопе (слева) видны как бесцветные включения, невосприимчивые к красителю. При электронной микроскопии (справа) выявляется структура споры с многослойной оболочкой и электронно-плотной сердцевиной.
Низкотемпературный анабиоз, или криоанабиоз, известен благодаря лабораторным исследованиям, поскольку в природных условиях сверхнизкие температуры (ниже −80 °С) не встречаются. Так, установлено, что практически все виды микроорганизмов могут переживать замораживание вплоть до температуры кипения жидкого азота (при нормальном атмосферном давлении это −196 oC) [14].
В анабиозе организмы могут находиться подолгу: коловратки и тихоходки — до 120 лет, семена лотоса — 1500 лет, семена финиковой пальмы — около 2000 лет [1], [3]. Недавно группа российских ученых из Пущинского научного центра РАН (руководитель группы — Д. А. Гиличинский) сообщила об успешном проращивании смолёвки узколистой (Silene stenophylla) из плацентарной ткани плодов этого цветкового растения, которые пролежали в вечномерзлотной почве при температурах около −7 oC примерно 30 000 лет [15]. Факт экстраординарный, поскольку при этих температурах полное замораживание растительных тканей и тем самым криоанабиоз могут и не наступать. Любопытно, что хранившиеся там же семена растения оказались нежизнеспособны.
А вот, пожалуй, самые удивительные случаи. В 1995 году журнал Science опубликовал статью [16] микробиологов из Калифорнийского политехнического университета об оживлении спор бактерии Вacillus sphaericus из кишечника пчелы, мумифицированной в янтаре 25–40 миллионов лет назад! Однако в 2000 году сотрудники Уэстчестерского университета в Пенсильвании побили этот рекорд, описав оживление спор неизвестной бациллы, пролежавшей в кристалле соли около 200 миллионов лет [17]. Справедливости ради следует отметить, что скептически настроенная часть научного сообщества, несмотря на всю тщательность, с какой были описаны исследования, не верит в оживление микроорганизмов после столь длительного пребывания в метаболически неактивном состоянии. Основной аргумент скептиков — теоретический: из-за фоновой радиации в ДНК спор за столь длительное время должны были накопиться несовместимые с жизнью повреждения, которые в отсутствие метаболизма не могли быть отремонтированы.
Переход в анабиоз позволяет повысить устойчивость организмов к неблагоприятным воздействиям. Первым это обнаружил всё тот же Спалланцани, любопытству которого, похоже, не было предела. В отличие от своих предшественников он не удовлетворился лишь наблюдением за оживлением высохших микроскопических животных, а исследовал влияние на них различных температур, разреженной атмосферы, электричества и некоторых химических веществ. Он установил, что высохшие коловратки сохраняли жизнеспособность при температурах до 73 oC, тогда как в активном состоянии погибали уже при 45 oC [1]. К настоящему времени на многочисленных объектах показано, что в анабиозе существенно возрастает устойчивость к повышенной температуре, химическим агентам, ионизирующей и ультрафиолетовой радиации. И здесь также есть свои чемпионы. На первое место можно поставить эндоспоры бактерий: они не только существенно превосходят родительские вегетативные клетки по устойчивости к отдельным вредоносным факторам, но оставляют далеко позади практически все живые формы, в том числе находящиеся в состоянии анабиоза, по совокупности экстремальных факторов, которые могут перенести [13]. Впечатляющую устойчивость к экстремальным воздействиям проявляют в состоянии ксероанабиоза тихоходки — значительно более сложные организмы, чем бактерии. В состоянии ксероанабиоза они сохраняют жизнеспособность после прогрева до 100 °С, воздействия ионизирующего излучения в дозах, в 1000 раз превышающих летальные для человека, и даже выдерживают кратковременное пребывание в открытом космосе [18–20].
В природе встречается большое разнообразие проявлений гипобиоза. В большинстве случаев гипобиоз — это ответ организма на похолодание до температур, существенно ниже оптимальных для жизнедеятельности. Такая реакция известна у некоторых теплокровных животных (спячка, или гибернация), насекомых (диапауза), земноводных и рептилий. К гипобиозу можно отнести осенне-зимний покой растений или их частей — корней, клубней [3].
Многие холоднокровные организмы могут пережить в состоянии гипобиоза даже температуры замерзания воды. Обычно это удается видам, которые сами могут оставаться не замороженными. Но есть уникальное исключение — лесная лягушка (Rana sylvatica). Зимой 35–45% воды в ее теле превращаются в лед, и всё животное становится твердым, как кусок льда (рис. 5). Секрет лягушки в том, что замерзает только вода, находящаяся у нее под кожей и между клетками мышц. В основных органах и тканях лед не образуется, иначе животное погибло бы [21], [22]. А так с приходом весны лесные лягушки благополучно «оттаивают» и приступают к брачным церемониям.

Рисунок 5. Лесная лягушка (Rana sylvatica) — чемпион мира по гипобиозу в замороженном состоянии. Слева — лягушка в обычном состоянии, справа — твердая, как кусок льда.
Конечно, не только животным и растениям, но и микроорганизмам приходится зимовать в низкотемпературном гипобиозе. Однако у них еще есть особые состояния, не связанные с низкими температурами, которые также можно отнести к гипобиотическим. Некоторые бактерии (например, Azotobacter vinelandii) и простейшие (Entamoeba histolytica) трансформируются в так называемые цисты при недостатке в среде питательных веществ или в присутствии агрессивных химических соединений. Цисты — это уменьшенные в размерах клетки с утолщенной клеточной стенкой и замедленным метаболизмом [23].
Еще одна разновидность гипобиоза в мире микробов была выявлена сравнительно недавно, благодаря более тщательному изучению одного хорошо известного феномена. При культивировании на плотной питательной среде каждая жизнеспособная клетка должна размножиться и дать видимую невооруженным глазом колонию. Если сопоставить число колоний с числом клеток, подсчитанных под микроскопом, то окажется, что не все клетки способны размножаться. Долгое время считалось, что клетки, не давшие колоний, попросту нежизнеспособны. Но оказалось, что они вполне живые, только впали в некое состояние, при котором отказываются делиться на среде, пригодной для обычных клеток. У них снижена метаболическая активность, изменена морфология, и для начала деления им необходимы другие условия, которые не всегда известны. Эти клетки, состояние которых также можно характеризовать как гипобиотическое, в специальной литературе называют «покоящимися» (англ. dormant [24] или quiescent [25]). Следует особенно отметить, что микроорганизмы в гипобиотическом состоянии обладают повышенной устойчивостью к химическим агентам, в том числе к антибиотикам [26].
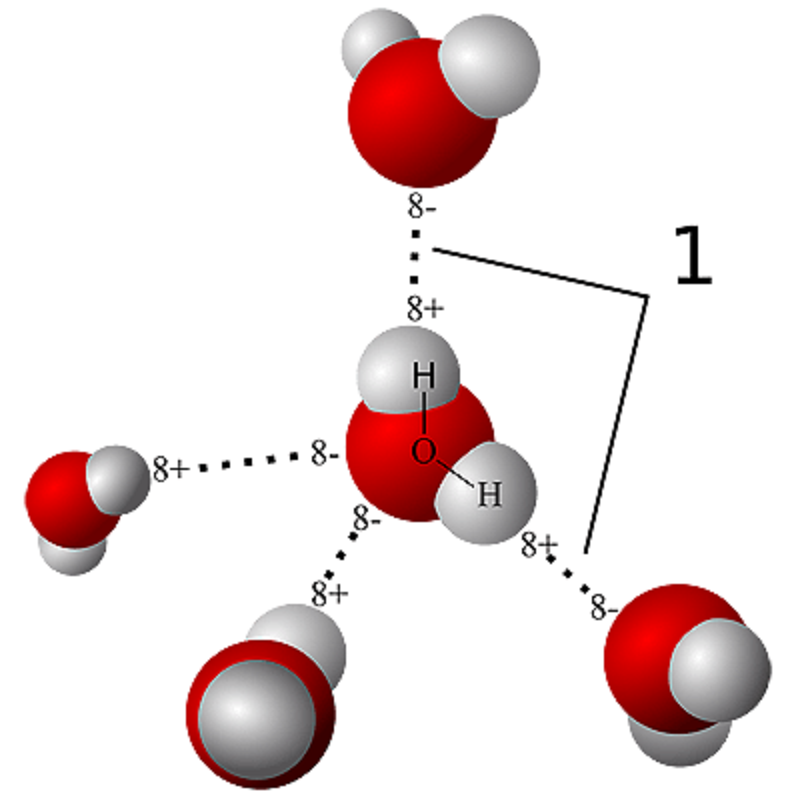
Рисунок 6. Водородная связь образуется между частично электроположительными атомами водорода и электроотрицательными атомами кислорода молекул воды.
Жизнь — это «одушевленная» вода
Во всех известных случаях переход в анабиоз так или иначе связан с водой: при ксероанабиозе в живых организмах снижается ее общее содержание, а при криоанабиозе у воды меняется агрегатное состояние — из жидкой она становится твердой. Чтобы понять, как это сказывается на структурно-функциональном состоянии клеток и их компонентов, остановимся вкратце на той роли, которую вода играет в организации живой материи .
Подробнее со свойствами воды, а также с ее ролью в организации и функционировании биологических систем можно познакомиться на сайте профессора Мартина Чаплина (Martin Chaplin BSc PhD CChem FRSC) [27].
Из всех веществ, существующих в условиях земной атмосферы в виде жидкостей, только в воде биологические молекулы могут собраться вместе и превратиться в то, что мы называем жизнью . Эту уникальную роль вода исполняет в значительной мере благодаря водородным связям между атомами водорода и кислорода соседних молекул (рис. 6).
Но самόй воде превратиться в этакую чудотворную памятливую субстанцию, которую оригиналы от науки величают «живой водой», увы, не суждено. Или просто в присутствии специалистов, знакомых с «нормальными» физикой и химией, она это делать стесняется. Вот и редакторам Nature не посчастливилось: «Здесь покоится тот, чьё имя начертано было на воде» [28]. — Ред.
Молекула H2O способна образовать водородные связи с четырьмя соседними: по одной — каждый протон и две — кислород. Однако при положительных температурах из-за теплового движения в каждый момент времени одна молекула участвует в образовании примерно трех связей (формальный статистический анализ дает значение 3,4). Тем не менее этого достаточно, чтобы молекулы воды компактно упорядочились в кластеры, между которыми встраивается некоторая часть «неспокойных», подвижных молекул. При пониженных температурах движение молекул замедляется, и каждая образует все четыре водородные связи. Так формируются кристаллы льда с меньшей плотностью упаковки молекул, чем в жидкой фазе: именно это делает лед легче воды (рис. 7).
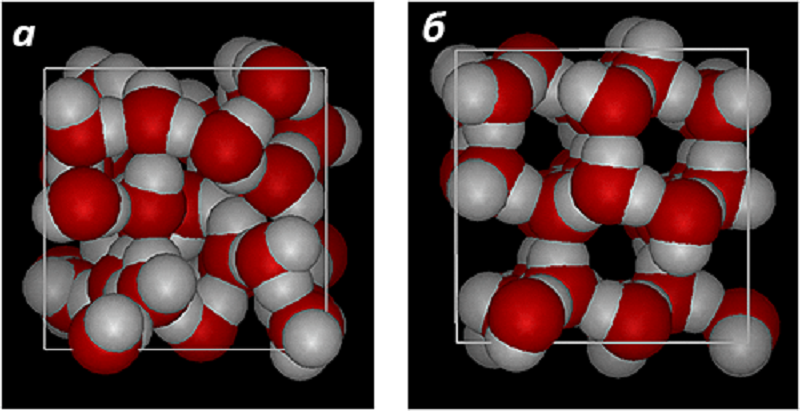
Рисунок 7. Сферические модели жидкого (а) и кристаллического (б) состояния молекул воды.
Энергия водородной связи сравнительно невелика (табл. 1) и примерно в пять раз превышает энергию теплового движения молекул при температуре 25 oC . Тем не менее этого достаточно, чтобы молекулы воды позволяли одному типу молекул растворяться в себе, а другому — нет. Всё дело в том, что растворение — это встраивание чужих молекул между своими. Молекулам воды и самим тесно, ведь водородные связи их сближают, поэтому для растворения эти связи необходимо разрывать. Но этого недостаточно. Для обеспечения термодинамической устойчивости молекулам воды необходимо образовать с «чужаками» новые связи не слабее водородных, например ионные. В противном случае «чужаков» придется вытолкнуть и вновь сомкнуть ряды, восстановив разрушенные связи.
По отношению к молекулярному устройству живых организмов выражение «Сила — в слабости» более чем справедливо. Ведь именно «слабые» связи поддерживают структуру биополимеров — ДНК, белков, полисахаридов — и обеспечивают работоспособность молекулярных машин: «Роль слабых взаимодействий в биополимерах» [29]. — Ред.
| Типы связи | Энергия (ккал/моль) |
|---|---|
| Ковалентные (С—С, О=C=О, N≡N) | 40–230 |
| Ионные в кристаллах (Na+---Cl−) | 50–100 |
| Ионные в растворах | 5–10 |
| Водородные (Н—О—H---O—Н—О-; —N—H---O=C-; —O—H---O=C—) | 3–5 |
| Связи Ван-дер-Ваальса | 1–2 |
| Гидрофобные взаимодействия | 1–5 |
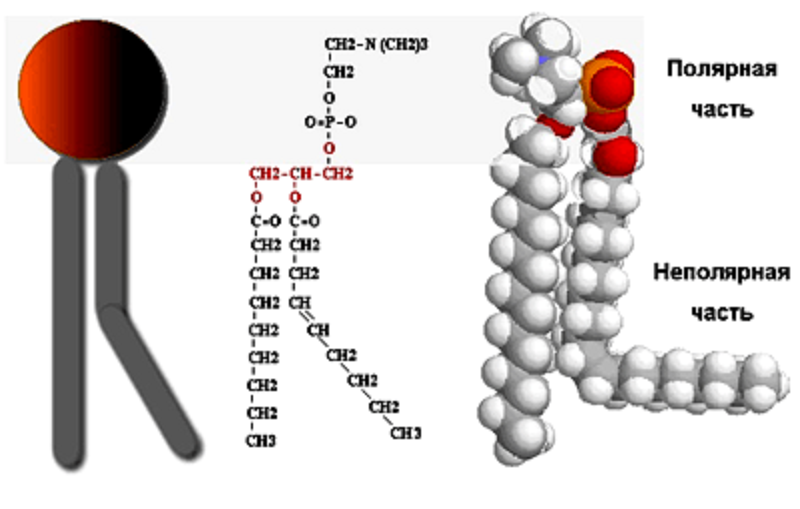
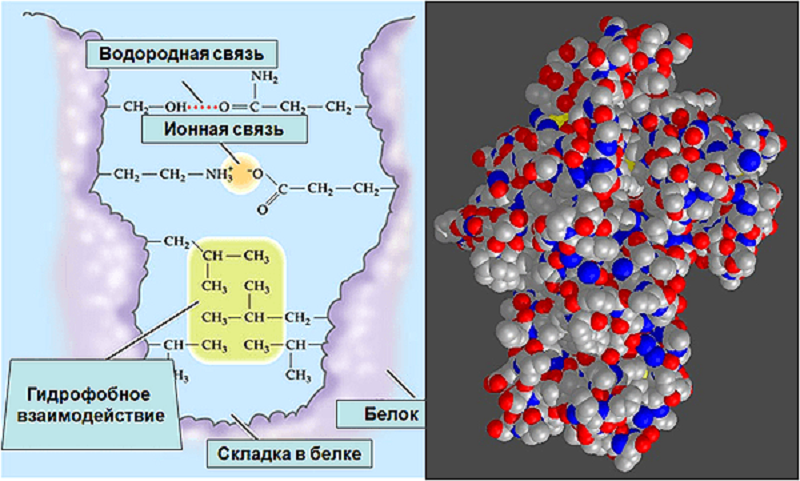
Растворимые в воде (гидрофильные) вещества — это ионы и дипольные молекулы, а нерастворимые (гидрофобные) — молекулы, не несущие зарядов, например углеводороды. Но есть и еще одна категория веществ — амфифильные, одна часть молекулы которых гидрофильна, а другая гидрофобна (рис. 8А). Амфифильные молекулы замечательны своей способностью к самоорганизации в водной среде в надмолекулярные структуры. Эти структуры стабилизированы ионными связями молекул воды с гидрофильными частями, гидрофобным взаимодействием неполярных частей, в которых к тому же при сближении происходит взаимоиндукция зарядов и образуются связи Ван-дер-Ваальса (табл. 1). Так формируется фосфолипидный каркас клеточных мембран, в который встроены белковые молекулы [30] . Те же принципы лежат в основе организации третичной структуры белков (рис. 8Б) и нуклеиновых кислот [31].
Вода, дающая жизнь порождением гидрофобности... Странно? Да, но именно вода ответственна за гидрофобный эффект и дирижирует фолдингом белков, самосборкой амфифильных молекул в бислои (мембраны) и везикулы. О чём-то таком, видимо, догадывался один из отцов-основателей США (и, кстати, первый американский член Российской академии наук) Бенджамин Франклин, поливая пруд оливковым маслом. Позже на философию гидрофобности наслоились термодинамика со статфизикой, и сложилась наконец замечательная общая картина: «Физическая водобоязнь» [32]. — Ред.
Каркас со встроенными белками — образ, конечно, условный, для облегчения восприятия. Мембрана живой клетки — динамичный, пластичный, сложный мир взаимодействий и перестроек. Ее липидный матрикс эволюция довела до практически «разумного» состояния. Динамичная кластеризация липидов и, соответственно, функциональная неоднородность участков мембраны — непременное условие для нормальной работы мембранных белков и поддержания клеточного гомеостаза. И даже выпестовать в себе инфекцию или излечиться от нее же без участия «организованных липидных группировок» не получится: «Липидный фундамент жизни» [33]. — Ред.
Следует подчеркнуть два обстоятельства. Во-первых, свои функции в клетках могут выполнять только правильно структурированные макромолекулы и биомембраны. Во-вторых, структура их поддерживается сравнительно слабыми физическими связями, которые полностью зависят от наличия воды.
Однако вода не только придает структуру макромолекулам и биомембранам; вода — это еще и специфическая среда, в которой протекают биохимические реакции. Особенно важны здесь такие ее свойства, как способность к диссоциации на протон и гидроксил, диффузионные характеристики, формирование гидратных оболочек при взаимодействии с растворенными веществами и надмолекулярными комплексами и многие другие.
Снижение содержания воды внутри и снаружи клеток существенно нарушает функционирование биосистемы, становится стрессом для нее. Почему же клетки одних организмов сохраняют жизнеспособность после высушивания или замораживания, а других — погибают?
Стратегии приспособления к водному стрессу
Реакции клеток на водные стрессы при положительных и отрицательных температурах различаются, но в основе некоторых из них лежат общие принципы. Так, на первых этапах высушивания при положительной температуре или при образовании льда снаружи клеток происходит концентрирование веществ в окружающей среде. Это приводит к так называемому осмотическому стрессу (точнее, гиперосмотическому, ведь бывает еще и гипоосмотический, при котором концентрация растворенных веществ вне клетки опускается ниже оптимума). В норме концентрация веществ в клетках выше, чем снаружи, а активность воды соответственно меньше. (Напомним в скобках, что активность воды в данном контексте — это ее эффективная мольная доля в образце.)
Цитоплазматическая мембрана сравнительно хорошо проницаема для воды и непроницаема для большинства внутри- и внеклеточных веществ. Молекулы воды согласно законам диффузии всегда перемещаются в ту часть пространства, где их активность меньше, поэтому они стремятся в клетки. В результате создается избыточное давление на цитоплазматическую мембрану изнутри, которое называется осмотическим давлением, или тургором. Благодаря тургору мембрана расправлена, как оболочка надутого воздушного шарика, и такое состояние необходимо для ее функционирования.
Дело в том, что цитоплазматическая мембрана — это не просто полупроницаемая пленка, а сложный ансамбль молекулярных структур, обеспечивающих избирательный транспорт веществ, восприятие и передачу внешних сигналов, координированный рост и деление клеток [33]. У многих одноклеточных она также служит для обеспечения движения, а у бактерий участвует в трансформации энергии. Если активность воды снаружи клеток станет меньше, чем внутри, то внутриклеточная вода будет выходить наружу, тургор понизится, мембрана сморщится. Кроме того, в цитоплазме вырастут концентрации всех растворенных веществ, включая ионы К+ и Na+, которые в высоких концентрациях токсичны, так как разрушают внутри- и межмолекулярные ионные связи в белках и надмолекулярных комплексах (биомембранах, рибосомах и т.п.).
Итак, для клеток обезвоживание — стресс. Как ему можно противостоять?
Внутриклеточные механизмы приспособления к осмотическому стрессу наиболее подробно изучены у микроорганизмов [10], [34–37]. Будучи одноклеточными, они напрямую контактируют со средой, подчас неблагоприятной, и каждой клетке приходится надеяться только на себя. Многоклеточные организмы используют стратегию «коллективной безопасности»: бόльшая часть их клеток изолирована от прямого контакта с внешней средой. Кроме того, микроорганизмы — удобный объект для исследований.
Чтобы заставить воду вернуться в клетки после осмотического стресса, необходимо уменьшить ее активность внутри клеток, например, накапливая в них водорастворимые (осмотически активные) вещества — осмолиты. У микроорганизмов в ходе эволюции выработались две стратегии, направленные на решение этой проблемы. Первая основана на накоплении в клетках ионов К+, вторая — органических осмолитов.
Как уже отмечалось, для «обычных» клеток высокие внутриклеточные концентрации К+ токсичны. Поэтому первую стратегию используют лишь некоторые бактерии, и только для кратковременной компенсации резкого снижения тургора. Исключение составляет сравнительно небольшая группа — галофильные («любящие соль») археи и бактерии, обитающие в водоемах и почвах с высокой концентрацией солей (до 30% NaCl). У этих микроорганизмов особые белки и мембраны, которым для обеспечения правильных структур и функций даже необходимы сравнительно высокие внутриклеточные концентрации ионов К+ и Na+. Поэтому в условиях осмотического стресса они могут использовать накопление К+ в качестве компенсаторного механизма.
Бόльшая часть микробного мира — бактерии, дрожжи и водоросли — в ответ на осмотический стресс накапливает из среды или синтезирует так называемые совместимые вещества (англ. compatible solutes), то есть вещества, накопление которых в клетках совместимо с сохранением биологических функций (табл. 2). Это пёстрая в химическом отношении группа веществ: в нее входят аминокислоты, гликозиды, сахара, полиолы, фосфодиэфирные соединения. Некоторые из них выступают в качестве протекторов и при других видах стрессов, в частности при низкотемпературном замораживании и высушивании. Иными словами, именно они могут способствовать переходу клеток в крио- и ксероанабиоз.
Молекулы анабиоза
Низкотемпературное замораживание — в любом случае суровое испытание, но протекать оно может по-разному [38], [39]. При небольших скоростях охлаждения лед прежде всего образуется во внеклеточной среде, активность воды там уменьшается, и вода успевает выйти из клеток, что приводит к их дегидратации. Повреждению мембран при этом способствует и повышение концентрации неорганических солей во внеклеточной среде.
| Микроорганизмы | Совместимые вещества |
|---|---|
| Микроводоросли | Сахароза, глицерин, маннитол, пролин, глицинбетаин (бетаин), диметилсульфониопропионат |
| Дрожжи | Глицерин, арабиол, сорбитол, трегалоза |
| Цианобактерии | Сахароза, трегалоза, глюкозилглицерин, глицинбетаин |
| Фототрофные бактерии | Сахароза, трегалоза, глицинбетаин, эктоин, гидроксиэктоин, N-ацетилглютаминилглютаминамид |
| Сульфатредуцирующие бактерии | Трегалоза, глицинбетаин |
| Гетеротрофные бактерии | Пролин, глютамат, N-ацетилглютаминилглютаминамид, глицинбетаин, эктоин, гидроксиэктоин, трегалоза |
| Актиномицеты | Эктоин, гидроксиэктоин, трегалоза, пролин, глютамат, аланин |
| Археи | Глицинбетаин, β-глютамат |
При быстром охлаждении внутриклеточная активность воды тоже снижается, но уже вследствие ее перехода в твердое состояние (лед) внутри клеток. Добавим, что низкие температуры сами по себе отрицательно влияют на структуру и функции макромолекулярных и надмолекулярных компонентов клеток [40].
Самым благоприятным для живых организмов мог бы быть такой режим охлаждения, при котором вода переходит не в кристаллический лед, а в стекловидное (витрифицированное) состояние, когда все молекулы «мгновенно» застывают. С чистой водой это произойдет при скоростях отвода тепла более 107 oC/сек. Для большинства биообъектов это условие не удастся выполнить из-за физических ограничений по теплопередаче, но для одноклеточных его можно реализовать, например, распыляя образец на металлические поверхности с температурой −196 oC (экспериментально доступная температура кипения жидкого азота при нормальном атмосферном давлении). В присутствии некоторых специально подобранных веществ витрификация может наступить при меньших скоростях охлаждения [41], [42]. Однако широкое внедрение этого подхода в практических целях ограничено трудностью введения в клетки этих веществ.
Важна и скорость отогрева: в общем случае чем она выше, тем лучше. При медленном поступлении тепла возможна рекристаллизация — превращение мелких кристаллов льда в более крупные, что, как оказалось, усугубляет повреждения.
Таким образом, чтобы перейти в криоанабиоз, клеткам необходимы средства защиты — криопротекторы. У многих, если не у всех микроорганизмов в роли криопротекторов могут выступать совместимые вещества, в первую очередь сахара и полиолы. Не раз была продемонстрирована корреляция между внутриклеточным содержанием того или иного совместимого вещества и жизнеспособностью микробных клеток, подвергавшихся замораживанию-оттаиванию в разных режимах. Более того, глицерин, сахароза и трегалоза способны защищать микробные клетки от низкотемпературных повреждений, даже когда их добавляют во внеклеточную среду [43].
Попутно заметим, что глицерин в сравнительно высоких концентрациях встречается в крови полярных рыб [44]: вместе с некоторыми белками он выступает в роли антифриза, снижающего температуру замерзания крови. Ту же роль играют глицерин и трегалоза в гемолимфе некоторых морозостойких насекомых [45], [46].
Механизм защитного действия криопротекторов, многие детали которого еще предстоит выяснить, скорее всего, складывается из двух компонентов [43]. Первый связан с их способностью смягчать осмотический стресс за счет стабилизации тургора, как было описано выше. Представление о втором компоненте защиты было сформировано в исследованиях на изолированных белках, а также искусственных и биологических мембранах. Предполагается, что криопротекторы в высоких концентрациях по мере обезвоживания клетки вытесняют из водного окружения белков и мембран все растворенные вещества, в первую очередь неорганические ионы. Так удается сохранить гидратную оболочку молекул, образованную оставшимися молекулами воды, что и способствует поддержанию их нативной структуры (а во что это выливается, описано в статье «О, этот благодатный дождь из бактерий!» [47] — Ред.).
Переход в ксероанабиоз также сопряжен с водным стрессом, который на первых этапах обезвоживания представлен стрессом осмотическим. Поэтому неудивительно, что у организмов, способных к переходу в ксероанабиоз, было обнаружено повышенное содержание совместимых веществ. Удивительно другое — явное «превосходство» трегалозы в качестве ксеропротектора [6], [10], [11]. Во-первых, в организмах, способных к ксероанабиозу, выявлено высокое содержание этого дисахарида (до 20% сухого веса). Во-вторых, прослежена корреляция между устойчивостью клеток, в частности микроорганизмов, к высушиванию при положительных температурах и содержанием в них трегалозы. В-третьих, установлено, что при высушивании трегалоза значительно лучше других осмолитов предохраняет от разрушения белки, а также изолированные биомембраны и искусственные фосфолипидные мембраны.
Напомним, что при ксероанабиозе активность воды в клетках снижается значительно больше, чем при криоанабиозе, — ее не хватит даже на то, чтобы покрыть все молекулы. Было установлено, что трегалоза может образовывать водородные связи с фосфатными остатками фосфолипидов биологических и искусственных мембран, а также с белками, и эти связи сохраняются после высушивания. Отсюда возникла «гипотеза замещения», согласно которой ксеропротекторы обеспечивают целостность биомембран и белков в высушенном состоянии за счет замещения воды. Однако эта гипотеза не объясняет, почему трегалоза эффективнее других сахаров, которые также способны образовывать водородные связи с белками и мембранами.
Вторая гипотеза получила название «гипотезы стекловидного состояния». Растворы сахаров при высушивании могут превращаться в аморфное стекло. Возможно, движения биомолекул, в первую очередь белков, заключенных в такую стеклянную оболочку, будут ограничены, что приведет к замедлению или прекращению реакций их деградации. Тогда преимущество трегалозы перед другими сахарами объясняется ее относительно высокой температурой стеклования и химической инертностью [10], [11]. Последнее обстоятельство может быть критическим, поскольку другие сахара способны вступать с белками в химическую реакцию Майяра, что приводит к деградации белка [48].
Однако у организмов, способных переживать ксероанабиоз, средства защиты от неблагоприятного действия обезвоживания, скорее всего, не ограничиваются только совместимыми веществами [6], [10], [11], [49]. Важную роль здесь могут играть две категории белков — это так называемые белки теплового шока (англ. heat shock proteins) и белки позднего эмбриогенеза (англ. late embryogenesis abundant proteins). Они были обнаружены в клетках некоторых растений и бактерий, устойчивых к обезвоживанию. Как именно они выполняют свои защитные функции, пока не понятно. Предполагается, что они связываются с ключевыми белками и надмолекулярными комплексами и обеспечивают стабилизацию их структуры в условиях снижения активности воды.
Большие ожидания в изучении ксероанабиоза связывают с применением методов, которые иногда объединяют термином «-омики» — геномики, транскриптомики, протеомики и метаболомики . Полученные с помощью этих методов данные предполагается проанализировать с помощью мультивариантной статистики и представить весь «молекулярный путь» от восприятия снижения внутриклеточной активности воды до устойчивого к дегидратации фенотипа [50].
О всевозможных —омиках рассказано в обзоре «„Омики“ — эпоха большой биологии» [51]; об одной, но такой молодой и очень уж важной для здоровья — пептидомике (с ее теневой стороной!) — в статье «Неизвестные пептиды: „теневая“ система биорегуляции» [52]; а о том, как со всем этим, не марая рук, справляются ученые — в материале «Вычислительное будущее биологии» [53]. — Ред.
В итоге
В мире живого известно много видов адаптационных реакций, но, наделяя некоторые организмы способностью переходить в состояние анабиоза, природа, кажется, перешагнула пределы своих возможностей. Живое существо временно становится неживым; жизнь обратимо прекращается на молекулярном уровне. Впору вновь вернуться к мировоззренческому вопросу «что такое жизнь?», если граница между живым и неживым так неопределенна. Явление анабиоза представляет особый интерес для сторонников гипотезы панспермии [54]. В качестве одного из аргументов они используют данные о радиационной устойчивости бактериальных спор (см. также [55]), ведь в открытом космосе высокий уровень губительной для всего живого ионизирующей радиации .
Защитные ухищрения вирусов, которые вынуждены выживать в экстремально неуютной среде, облюбованной их хозяевами-археями, рассмотрены в статье «ДНК-фитнес для экстремала: правильные белки — идеальная форма» [56]. И эти механизмы могут быть универсальными. — Ред.
Представления о природе анабиоза и гипобиоза важны и с практической точки зрения. Устойчивость к противомикробным агентам спор таких опасных болезнетворных микроорганизмов, как клостридии ботулизма (Clostridium botulinum) и бациллы сибирской язвы (Bacillus anthracis), — серьезная проблема для медиков. Другая, уже упоминавшаяся проблема — покоящиеся (гипобиотические) состояния патогенных микроорганизмов, «невидимые» для лабораторных тестов, основанных на регистрации размножения клеток.
Фантасты любят отправлять своих героев в длительные космические одиссеи в состоянии анабиоза (хотя, судя по описаниям некоторых из них, имеется в виду низкотемпературный гипобиоз). Однако и на Земле есть много важных задач, для решения которых требуется перевод живых организмов в анабиоз. До людей очередь пока не дошла, но длительное хранение некоторых биологических материалов в крио- и ксероанабиозе — уже реальность. В коллекциях культур хранятся жизнеспособные микроорганизмы разных таксономических групп, клеточные линии животных и растений [14]. В криобанках — семена растений, сперматозоиды, яйцеклетки, эмбрионы и стволовые клетки [57]. Все эти биообъекты замораживают в определенных режимах с использованием криопротекторных сред . Клетки бактерий, дрожжей, споры некоторых мицелиальных грибов можно законсервировать в состоянии ксероанабиоза с помощью технологии высушивания из замороженного состояния (лиофилизации) [14], [43]. С другими клетками такое пока не удается. Единственное исключение — тромбоциты, которые после лиофилизации с использованием «анабиотика» трегалозы сохраняют способность активироваться и участвовать в свертывании крови [58], [59].
Без криоконсервации процедура экстракорпорального оплодотворения (ЭКО) часто просто невозможна. Разработаны методики, позволяющие минимизировать риски, связанные с ростом кристаллов при замораживании и размораживании как отдельных клеток — соматических и гамет, — так и целых эмбрионов (но пока не органов и тем более не «взрослых» тел!). Высокие показатели сохранности клеток достигаются именно благодаря упомянутой выше витрификации — стеклоподобному состоянию жидкости в объектах при скоростном глубоком замораживании: «Витрификация — контролируемая пауза развития в стеклоподобном состоянии» [60]. — Ред.
На этом завершается наш рассказ об анабиозе и гипобиозе, но не заканчиваются исследования этих удивительных явлений. Более глубокое понимание природы анабиоза и гипобиоза позволит не только расширить наше понимание сущности живого, но и создавать новые технологии для сельского хозяйства и медицины [50], [59], [61], [62].
Первоначально статья была опубликована в журнале «Химия и Жизнь» [63].
Литература
- Kеilin D. (1959). The Leeuwenhoek lecture. The problem of anabiosis or latent life: history and current concept. Proc. R. Soc. B. 150, 149–191;
- Zuidervaart H.J. The ‘true inventor’ of the telescope. A survey of 400 years of debate. In: The Origins of the telescope / Eds. Van Helden A., Dupré S., Van Gent R., Zuidervaart H. KNAW Press Koninklijke Nederlandse Akademie van Wetenschappen Amsterdam, 2010. pр. 32–36;
- Голдовский А.М. Анабиоз / Отв. ред. Е.М. Крепс. Л.: Наука, 1981. — 136 с.;
- Шмидт П.Ю. Анабиоз. М.: АН СССР, 1948. — 381 с.;
- Лозина-Лозинский Л.К. (1952). Жизнеспособность и анабиоз при низких температурах у животных (обзор). Известия естественнонаучного института им. П.Ф. Лесгафта. 25, 3–32;
- James S. Clegg. (2001). Cryptobiosis — a peculiar state of biological organization. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology. 128, 613-624;
- Yair Neuman. (2006). Cryptobiosis: A new theoretical perspective. Progress in Biophysics and Molecular Biology. 92, 258-267;
- Alexander I. Zhmakin Fundamentals of Cryobiology — Springer Berlin Heidelberg, 2009;
- Muldrew K. and McGann L.E. (1997). Cryobiology — a short course. University of Calgary, Alberta, Canada;
- Armando Hernández García. (2011). Anhydrobiosis in bacteria: From physiology to applications. J Biosci. 36, 939-950;
- Crowe J.H. and Crowe L.M. (2000). Anhydrobiosis: A unique biological state. Amer. Zool. 40, 986;
- Tsanko S. Gechev, Challabathula Dinakar, Maria Benina, Valentina Toneva, Dorothea Bartels. (2012). Molecular mechanisms of desiccation tolerance in resurrection plants. Cell. Mol. Life Sci.. 69, 3175-3186;
- P. Setlow. (2006). Spores of Bacillus subtilis: their resistance to and killing by radiation, heat and chemicals. J Appl Microbiol. 101, 514-525;
- Maintenance of microorganisms and cultured cells: A Manual of laboratory methods / Eds. B.E. Kirsop, A. Doyle. London, UK: Academic Press, 1991. — 308 p.;
- S. Yashina, S. Gubin, S. Maksimovich, A. Yashina, E. Gakhova, D. Gilichinsky. (2012). Regeneration of whole fertile plants from 30,000-y-old fruit tissue buried in Siberian permafrost. Proceedings of the National Academy of Sciences. 109, 4008-4013;
- Геномика этики и эстетики;
- Russell H. Vreeland, William D. Rosenzweig, Dennis W. Powers. (2000). Isolation of a 250 million-year-old halotolerant bacterium from a primary salt crystal. Nature. 407, 897-900;
- K. Ingemar Jönsson, Elke Rabbow, Ralph O. Schill, Mats Harms-Ringdahl, Petra Rettberg. (2008). Tardigrades survive exposure to space in low Earth orbit. Current Biology. 18, R729-R731;
- Roberto Guidetti, Angela Maria Rizzo, Tiziana Altiero, Lorena Rebecchi. (2012). What can we learn from the toughest animals of the Earth? Water bears (tardigrades) as multicellular model organisms in order to perform scientific preparations for lunar exploration. Planetary and Space Science. 74, 97-102;
- Weronika Wełnicz, Markus A. Grohme, Łukasz Kaczmarek, Ralph O. Schill, Marcus Frohme. (2011). Anhydrobiosis in tardigrades—The last decade. Journal of Insect Physiology. 57, 577-583;
- Kenneth B. Storey, Janet M. Storey. (1984). Biochemical adaption for freezing tolerance in the wood frog,Rana sylvatica. J Comp Physiol B. 155, 29-36;
- Jon P. Costanzo, Richard E. Lee, Peter H. Lortz. (1993). Glucose Concentration Regulates Freeze Tolerance In the Wood Frog Rana Sylvatica. Journal of Experimental Biology. 181, 245-255;
- Пиневич А.В. (2006). Микробиология. Биология прокариотов // Учебник. СПб: Изд-во СПбГУ — Т. 3, с. 251–271;
- Barrer M.R. Physiological and molecular aspects of growth, non-growth, culturability and viability in bacteria. In: Dormancy and low-growth state in microbial disease / Ed. A.R.M. Coats. Cambridge University Press, 2003. pp.1–37;
- J. V. Gray, G. A. Petsko, G. C. Johnston, D. Ringe, R. A. Singer, M. Werner-Washburne. (2004). "Sleeping Beauty": Quiescence in Saccharomyces cerevisiae. Microbiology and Molecular Biology Reviews. 68, 187-206;
- Kim Lewis. (2007). Persister cells, dormancy and infectious disease. Nat Rev Microbiol. 5, 48-56;
- Martin Chaplin. Water structure and science. Авторский онлайн-проект;
- Здесь покоится тот, чьё имя начертано было на воде;
- Роль слабых взаимодействий в биополимерах;
- S. J. Singer, G. L. Nicolson. (1972). The Fluid Mosaic Model of the Structure of Cell Membranes. Science. 175, 720-731;
- Lodish H., Berk A., Zipursky S.L., Matsudaira P., Baltimore D., Darnell J. Molecular Cell Biology. 4th edition. New York: W.H. Freeman, 2000;
- Физическая водобоязнь;
- Липидный фундамент жизни;
- Janet M. Wood. (2015). Bacterial responses to osmotic challenges. Journal of General Physiology. 145, 381-388;
- Stefan Hohmann. (2002). Osmotic Stress Signaling and Osmoadaptation in Yeasts. Microbiol Mol Biol Rev. 66, 300-372;
- Janet M. Wood. (2011). Bacterial Osmoregulation: A Paradigm for the Study of Cellular Homeostasis. Annu. Rev. Microbiol.. 65, 215-238;
- Empadinhas N. and da Costa M.S. (2008). Osmoadaptation mechanisms in prokaryotes: distribution of compatible solutes. Int. Microbiol. 11, 151–161;
- J. FARRANT. (1965). Mechanism of Cell Damage During Freezing and Thawing and its Prevention. Nature. 205, 1284-1287;
- Mazur P. Principles of medical cryobiology: The freezing of living cells, tissues, and organs. In: Principles of Medical Biology / Eds. E.E. Bittar and N. Bittar. J.A.I. Press, 1996. — Vol. 4, Cell Chemistry and Physiology. Part IV, pp. 355–384;
- Установлен механизм действия «белков-антифризов»;
- G.M. Fahy, D.R. MacFarlane, C.A. Angell, H.T. Meryman. (1984). Vitrification as an approach to cryopreservation. Cryobiology. 21, 407-426;
- Gregory M Fahy, Brian Wowk, Jun Wu, John Phan, Chris Rasch, et. al.. (2004). Cryopreservation of organs by vitrification: perspectives and recent advances. Cryobiology. 48, 157-178;
- Zdenek Hubálek. (2003). Protectants used in the cryopreservation of microorganisms. Cryobiology. 46, 205-229;
- Возможна ли жизнь без гемоглобина?;
- David A.. (2012). Supercooling and Freezing Tolerant Animals. Supercooling;
- Wharton D.A. Cold tolerance. In: Molecular and physiological basis of nematode survival / Eds. R.N. Perry and D.A. Wharton. CABI Publishing, Wallingford, 2011. pp. 182–204;
- О, этот благодатный дождь из бактерий!;
- Космачевская О.В. (2012). Вездесущая реакция Майара. Химия и Жизнь. 2, 23–27;
- Julio J. Caramelo, Norberto D. Iusem. (2009). When cells lose water: Lessons from biophysics and molecular biology. Progress in Biophysics and Molecular Biology. 99, 1-6;
- John P. Moore, Ngoc Tuan Le, Wolf F. Brandt, Azeddine Driouich, Jill M. Farrant. (2009). Towards a systems-based understanding of plant desiccation tolerance. Trends in Plant Science. 14, 110-117;
- «Омики» — эпоха большой биологии;
- Неизвестные пептиды: «теневая» система биорегуляции;
- Вычислительное будущее биологии;
- Розанов А. Ю. (2000). Бактериально-палеонтологический подход к изучению метеоритов. Вестник Российской академии наук. 70, 214–226;
- Jyoti Madhusoodanan. (2014). Microbial stowaways to Mars identified. Nature;
- ДНК-фитнес для экстремала: правильные белки — идеальная форма;
- Eiseman E. and Haga S.B. Handbook of human tissue sources: A National resource of human tissue samples. Santa Monica, CA: RAND Corporation, 1999;
- John H Crowe, Fern Tablin, Willem F Wolkers, Karine Gousset, Nelly M Tsvetkova, Josette Ricker. (2003). Stabilization of membranes in human platelets freeze-dried with trehalose. Chemistry and Physics of Lipids. 122, 41-52;
- Willem F Wolkers, Fern Tablin, John H Crowe. (2002). From anhydrobiosis to freeze-drying of eukaryotic cells. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology. 131, 535-543;
- Витрификация — контролируемая пауза развития в стеклоподобном состоянии;
- M. Potts. (2005). Desiccation Tolerance of Prokaryotes: Application of Principles to Human Cells. Integrative and Comparative Biology. 45, 800-809;
- Tsanko S. Gechev, Jacques Hille, Herman J. Woerdenbag, Maria Benina, Nikolay Mehterov, et. al.. (2014). Natural products from resurrection plants: Potential for medical applications. Biotechnology Advances. 32, 1091-1101;
- Пучков Е.О. (2015). Немножко умереть. Химия и Жизнь. 1, 20–28..