
Подсластить пилюлю: гликобиология в медицине
14 сентября 2020
Подсластить пилюлю: гликобиология в медицине
- 1948
- 1
- 5
Говорят, что сахар — белая смерть. Но в случае терапевтических препаратов углеводы не только полезны, но и критически необходимы.
иллюстрация автора статьи
-
Автор
-
Редактор
-
Иллюстратор
С развитием методов молекулярной биологии некогда игнорируемые углеводные модификации белков наконец-то получили свое правомерное место в пантеоне биологических макромолекул и заслуженное внимание со стороны исследователей. И спустя 30–40 лет оказалось, что гликобиология имеет огромнейший потенциал не только в фундаментальной биологии, но и, разумеется, в биомедицине. Более того, многие уже широко использующиеся лекарства содержат углеводы в своем составе, а значит впереди не только разработка новых, но и улучшение старых терапевтических агентов. В этой статье спецпроекта о гликобиологии мы постарались суммировать все достижения современной медицины, так или иначе связанные с достижениями гликобиологии или гликохимии. Разумеется, сюда невозможно вместить их все: например, роль углеводных антигенов в трансплантологии, терапию наследственных нарушений гликозилирования и подробный рассказ о роли гликанов в неонкологических заболеваниях пришлось оставить за бортом. Однако то, что поместилось, — неплохой первый нырок во всё многообразие применений углеводов на сегодняшний день и (надеемся!) в скорейшем будущем.
Гликобиология
Сахар — это не только компонент кофе и булочек, топливо для мозга и вечно гонимый диетологами компонент рациона. Углеводы — одни из важнейших биоинформационных макромолекул, наравне с нуклеиновыми кислотами и белками. Именно этим удивительным веществам посвящен наш спецпроект.
Спонсор спецпроекта — «БиоХимМак» — поставщик научного и медицинского оборудования в лаборатории России и стран СНГ.
Biopharmaceuticals — правильно гликозилированные белки как терапевтические агенты
Как можно убедиться из предыдущей статьи [1] спецпроекта, хорошее гликозилирование — залог правильно и долго работающих иммуноглобулинов, а вместе с тем эффективной иммунотерапии. Но не антителами едиными: существует целый ряд (больше сотни наименований!) разнообразных гликопротеинов, используемых в медицине, и для их желаемого эффекта на организм тоже важны правильные углеводные модификации. Из широко известных и повсеместно используемых биотерапевтических гликопротеинов можно вспомнить интерфероны, антитромбин, эритропоэтин. Правильно подобранные гликомодификаторы способны улучшить стабильность белкового препарата в пробирке: снизить вероятность окисления и деамидации аминокислот, денатурации при нагреве/охлаждении, преципитации и агрегации. Стабильность не менее важна и при попадании в организм, так как все белковые препараты подвержены специфической деградации, либо неспецифическому клиренсу с помощью протеаз. То, как и насколько быстро это случится, определит длительность присутствия и работы белка в организме или же токсичность его производных [2]. Например, эритропоэтин — небольшой белок с четырьмя сайтами гликозилирования в составе. Чем больше его антенн-гликанов содержат сиаловые кислоты и чем больше число этих антенн самих по себе, тем медленнее он выводится из организма (и этого эффекта можно добиться путем гликоинженерии в клетках млекопитающих с помощью изменения интенсивности синтеза разных гликозилтрансфераз) [3].
Клиренс — очищение биологических жидкостей или тканей организма от вещества в процессе его биотрансформации, перераспределения в организме, а также выведения из него.
Но более ценно влияние гликозилирования непосредственно на терапевтические эффекты биопрепарата. Так, эритропоэтин без сиаловых кислот проявляет определенные нейропротекторные свойства [4].
Однако основная терапевтическая функция этого белкового гормона — усиление эритропоэза (кроветворения), — осуществляющаяся за счет спасения от гибели и быстрого распространения клеток-предшественников эритроцитов. Эти (и не только) физиологические процессы запускаются в ответ на связывание эритропоэтина с его рецептором EpoR. Как оказалось, оно тоже очень сильно зависит от гликопрофиля гормона. Увеличение количества сиаловых кислот на гликанах эритропоэтина замедляет его связывание с рецептором, в то же время отсутствие гликозирования вовсе приводит к (внезапно!) ускорению связывания [3]. Это исследование было проведено почти 20 лет назад, и с тех пор измерение содержания сиаловых кислот на молекулу вошло в стандартную практику характеристики биотерапевтического препарата (и до сих пор используется для всех биотерапевтических агентов).
Однако 10 лет спустя, ученые стали сомневаться в том, что только сиалирование всему виной. Оказалось, что биологические эффекты (взаимодействие с рецептором) связаны также со степенью ветвления гликанов, их моносахаридным составом и тем, на каком сайте гликозилирования они находятся [5].
Подобные находки стали появляться при изучении многих биотерапевтических белков, тем самым требуя углубить анализ гликопрофиля и сделать препараты более безопасными и эффективными.
Синтез эритропоэтина (как и большинства других гликозилированных биопрепаратов) нередко производится в клетках животных [6]. Проще всего это было бы делать в клетках дрожжей — они быстро и эффективно растут, легко трансформируются и весьма неприхотливы в уходе, — однако механизмом гликозилирования и его регуляцией дрожжи сильно отличаются от млекопитающих. Отличным вариантом решения этой проблемы оказались клетки яичников китайского хомячка. Да, забавно, но это — настоящее название (в английском языке — Chinese Hamster Ovary cells (CHO)), основанное на реальном факте побега американского ученого с клеткой хомячков на последнем самолете в Сан-Франциско от разгорающейся гражданской войны в коммунистическом Китае, — но это уже совсем другая история (кстати, весьма интересная, почитайте тут [7]). За счет легкости и скорости культивирования, высокого выхода белка, уже проработанных методов генетической инженерии и последующей селекции подходящих стабильных клонов, а самое главное, характерных для млекопитающих паттернов посттрансляционных модификаций (в том числе и гликозилирования) СНО стали почти что золотым стандартом производства биотерапевтических белков.
Но как и любая биологическая экспрессионная система, клеточная культура — это живой организм, который подвержен неточностям и вариабельности в биохимических и физиологических процессах. Иными словами, вряд ли удастся получить только заданный гликовариант чистого эритропоэтина (да и любого другого белка) и ничего более. Этой причиной, а также возможностью аналитически достоверно проверять свойства разных гликоформ эритропоэтина руководствовались ученые, разрабатывая варианты химического прикрепления необходимых вариантов гликанов к эритропоэтину с помощью клик-конъюгации (реакций биоконьюгации с применением техник клик-химии [8]) и синтеза этого белкового продукта в неклеточной системе — сложном и многокомпонентном наборе ферментов, организующем последовательность биохимических реакций [9], [10]. Наверное, футуристические «пробирки-клетки» — все-таки ближе, чем нам кажется.
После синтеза и выделения любых гликопротеинов, используемых в медицинских целях, тщательный скрининг их гликозилирования строго необходим, это определено и закреплено органами контроля в специальных сводах требований (известных как ICH guidelines) [11–13]. Это можно делать на уровне отдельных гликанов, гликопептидов или интактного гликопротеина (при умеренной микрогетерогенности и относительно небольшом количестве сайтов гликозилирования этот метод самый быстрый и прямолинейный, но весьма затратный).
Однако вычислительные технологии стремительно развиваются. Пускай механизм гликозилирования еще не расшифрован полностью, биоинформатики преуспевают с прогнозированием результатов гликоинженерии даже на неполных данных. В совсем свежей работе этого года проанализировали зависимости между активностью разных гликозилтрансфераз (ферментов, осуществляющих сборку углеводных структур) и синтезом определенного набора гликанов [2]. Получившуюся вычислительную модель использовали для обратного предсказания — активность каких ферментов надо изменить для получения желаемых углеводных модификаторов, тем самым прокладывая дорогу рациональной гликоинженерии и (в перспективе) облегчая жизнь биофармацевтическим компаниям на этапе синтеза новых продуктов и биосимиляров. Разумеется, это не самая первая модель для планирования нацеленного синтеза гликанов, но, пожалуй, одна из самых сложных и успешных на сегодняшний день (рис. 1).
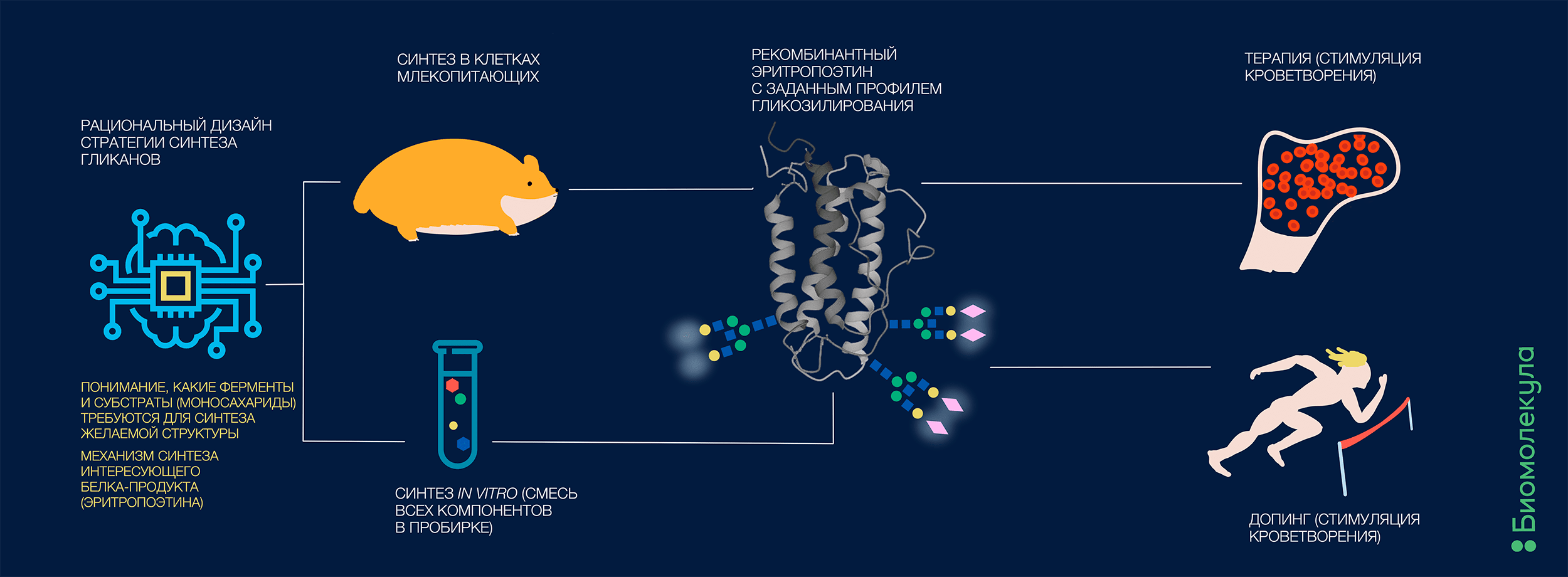
Рисунок 1. Промышленный синтез белковых биофармацевтических препаратов уже не является чем-то новым, однако надежно обуздать их гликозилирование — задача более сложная. Гликаны способны существенно менять поведение белка в организме, и даже выдавать нечестно играющих атлетов.
иллюстрация автора статьи
Помимо синтеза «правильного» для биотерапевтических целей белка, есть еще и чуть менее благородное применение гликоинженерии. Тот же самый эритропоэтин используется не только для лечения анемии и почечной недостаточности, но и как допинг в спорте — чем больше эритроцитов, тем больше кислорода переносится к мышцам. Сразу после запрета приема эритропоэтина спортсменами в 1990 году уличение в неправомерном его применении производили на основе присутствия вторичных маркеров (например, уровней гематокрита, ферритина). Однако эти параметры могли быть связаны с другими функциональными состояниями организма и не могли служить однозначным доказательством допинга. А вот два разных типа гликозилирования эритропоэтина в организме атлета, один из которых подозрительно похож на стандартизованный гликопрофиль рекомбинантного биотерапевтического препарата, весьма точно указывает на прием запрещенного вещества (или на онкологическое заболевание почек, что сильно менее вероятно).
Правда, этот аспект роли углеводов в современной биомедицине уже правильнее рассматривать в свете диагностических применений, о чем и расскажет следующий параграф.
Диагностика — сахарный след заболевания
Гликозилирование — это структурно вариабельная модификация белков, которая происходит уже после синтеза белка, без опоры на записанный в нуклеиновых кислотах «чертеж» клетки. Эта модификация может очень быстро регулироваться множеством внутренних и внешних факторов и менять свойства белка в ответ на потребности самой клетки и организма в целом. Популяция гликозилированных белков (особенно на клеточной поверхности, в свободной циркуляции и в межклеточном матриксе) весьма велика, а функции, ими выполняемые, жизненно важны и невероятно разнообразны. Все эти предпосылки неприкрыто указывают на слона в комнате — очень богатый потенциал гликозилирования в диагностике разнообразных заболеваний и состояний человеческого организма. Причем к диагностике можно подходить с двух позиций: либо изменение в паттерне гликозилирования — результат патологических процессов в организме, либо сдвиг в гликопрофиле сам приводит к нарушениям; хотя, скорее всего, эти факторы взаимосвязаны, цикличны и синергичны. Результат все равно один: знание о том, где и на какие гликаны обращать внимание, может быть очень перспективным методом точной, своевременной и более ранней диагностики самых разных заболеваний и патологий.
Как ожидалось, любимым «ребенком» ученых в этой области оказалась онкология, и уже потом — все остальные заболевания. Количество нацеленных на поиск раковых гликобиомаркеров исследований превышает оное для всех остальных патологий вместе взятых. И неудивительно, ведь онкозаболевание является не только серьезным противником, а идеальной, в данном случае, мишенью. По сути, раковые клетки с их нуждами и поведением — это гибриды зародыша и паразита: плохо дифференцированные клетки с необходимостью быстро делиться, прикрепляться и питаться за счет организма хозяина, путешествовать в другие отделы организма и аккуратно балансировать между эксплуатацией иммунной системы и ее избеганием. Все эти процессы завязаны на межклеточных взаимодействиях и сигналинге; ожидаемо, раковая клетка будет выставлять на поверхности эмбриональные антигены и другие белки, несущие сильно отличающийся от окружения гликопаттерн. Вероятнее всего, клетка также будет их секретировать и заставлять здоровые ткани подстраиваться под нее. Сходные предпосылки обусловливают поиск гликобиомаркеров и для других заболеваний.
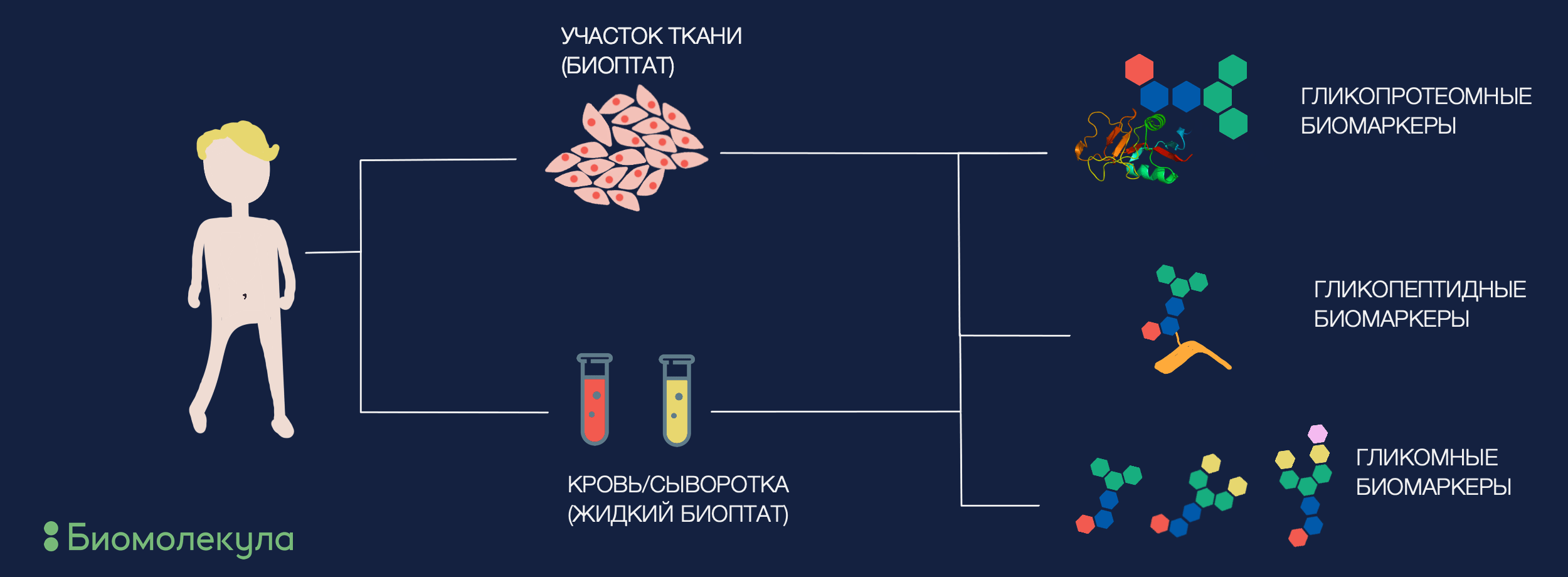
Рисунок 2. Где искать гликобиомаркеры заболеваний? Можно смотреть сразу в корень — на нездоровый участок ткани (например опухолевой), или же оценивать общий пул циркулирующих гликопротеинов (в крови или плазме). В то же время искать в обоих источниках можно разное. Иногда больше подходит охватить весь пул гликанов, в других же случаях можно повысить специфичность, характеризуя отдельные белки или даже их участки — гликопептиды.
иллюстрация автора статьи
Суммируя, гликобиомаркеры можно будет искать как системно (оценивать циркулирующие антигены и общий сдвиг в профиле гликозилирования организма), так и на местах (анализировать гликопрофиль самих трансформированных клеток, например, в биоптате). Первое является более предпочтительным, так как оценка гликопрофиля крови, слюны и других биологических жидкостей малоинвазивна. Самым простым подходом будет просто посмотреть на разницу всего гликопрофиля биологической жидкости больных и здоровых людей и оценить, есть ли различия и имеют ли они системный характер (такой подход называется анализом гликома). Для этого гликаны массово открепляются от белков-носителей, а их количество и структуры определяются разными аналитическими методами, выбор которых зависит от цели исследования (узнать более подробно о методах гликобиологии приглашаю в предыдущую статью цикла [1]). Таким образом были найдены перспективные маркеры в гликопрофилях пациентов с раком предстательной железы [14], яичников [15], гепатоклеточной карциномы [16] и многих других онкологических заболеваний, а также болезни Альцгеймера [17], инфарктов [18], хронических заболеваний печени (получившийся GlycoHepatoTest уже используется в клинике) [19].
Однако специфичность такого диагностического метода вызывает вопросы: скорее всего, изменения в такой большой популяции гликопротеинов продиктованы общим воспалением [20]. Помимо этого, базовый вариант гликозилирования (референсный профиль здорового человека) зависит от пола и возраста [21]. К слову, оба эти факта легли в основу стартапа GlycanAge, концептуально похожего на небезызвестный сервис 23andMe. Имея большой багаж из референсных гликопрофилей и множества более таргетных исследований, они способны определить ваш биологический возраст по гликопрофилю иммуноглобулинов G крови.
Иммуноглобулины — одна из самых больших фракций белков крови, напрямую связанная с иммунитетом. Углеводная часть иммуноглобулинов G влияет как на их стабильность, так и на биологические функции. Несложно предположить, что IgG был первым (и весьма плодовитым!) кандидатом на увеличение специфичности процесса поиска гликобиомаркеров: через вариабельный Fab-фрагмент антитела идет специфическое распознавание патогенного эпитопа, а взаимодействие иммунных клеток с Fc-фрагментом сигнализирует им о дальнейших действиях. Оба эти фрагмента несут углеводные модификации, и это влияет на особенности иммунного ответа. Характерные черты гликоподписи IgG, описанные для различных заболеваний, схематично представлены на рисунке 3.
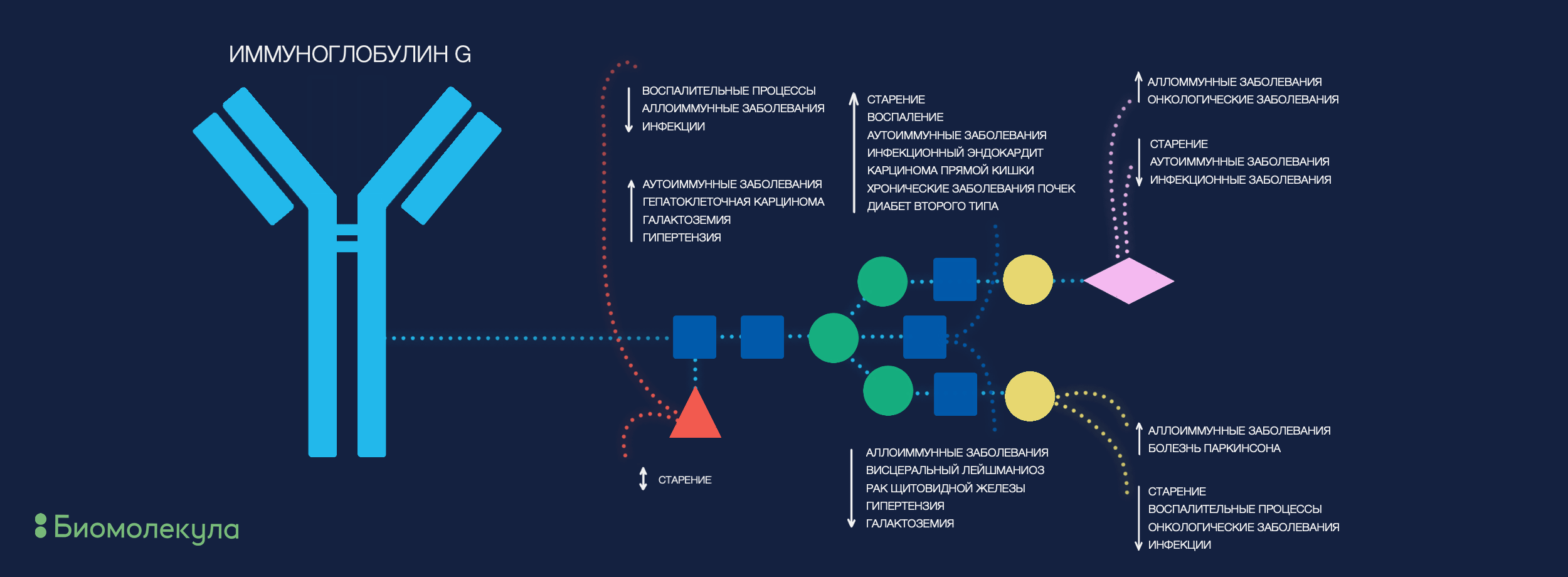
Рисунок 3. Гликозилирование Fc-фрагментов иммуноглобулинов G определенно производит важный эффект на дальнейший иммунный ответ организма. На рисунке отмечены те структурные особенности гликанов IgG, что достоверно меняются в случае определенных патологий.
иллюстрация автора статьи по [58]
Но, вероятно, самым специфичным вариантом анализа гликодиагностических подписей будет поиск белка, который достоверно связан с интересующим заболеванием, и оценка изменений его гликопрофиля. Первейшими кандидатами являются белки, неспосредственно участвующие в разрастании и миграции опухоли (рис. 4), например муцины и модифицирующие внеклеточный матрикс металлопротеазы.
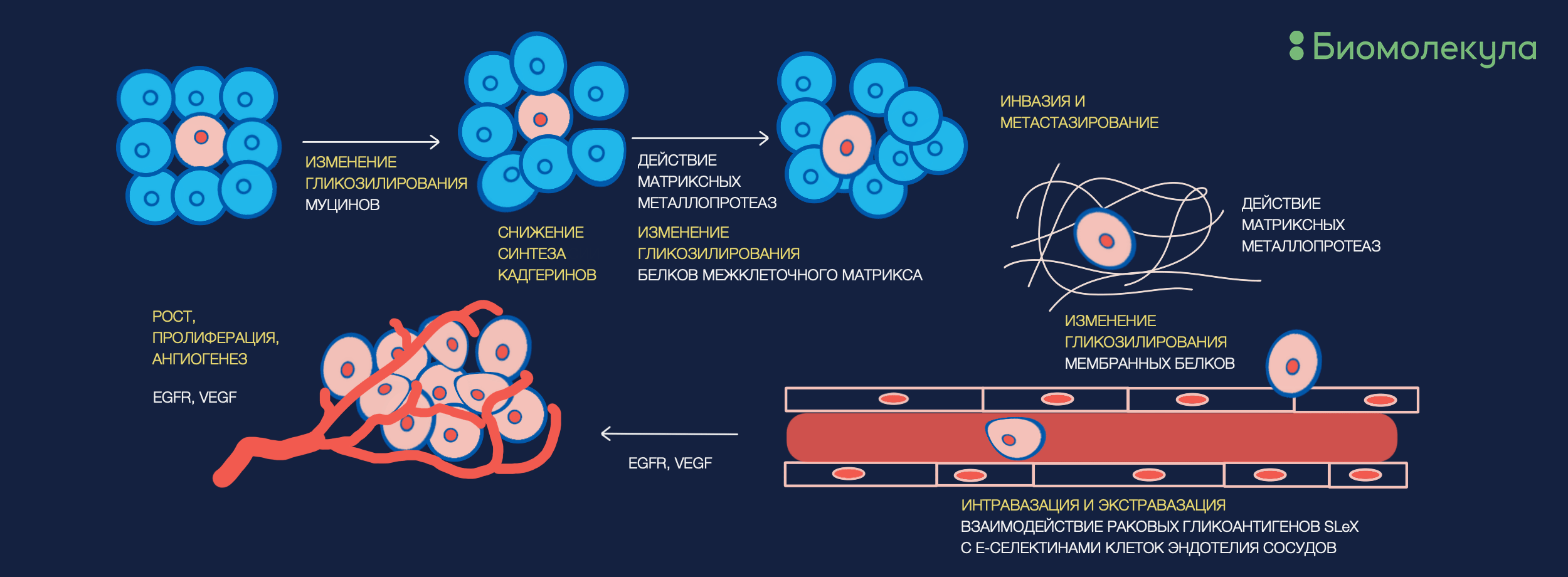
Рисунок 4. События, происходящие в процессе образования метастазов, очень сильно связаны с изменениями гликозилирования белков межклеточного матрикса и поверхностных белков клеток. На этой схеме плотно зависящие от гликомодификаций этапы отображены желтым цветом.
иллюстрация автора статьи по [22]
Эти процессы очень плотно связаны с изменениями в углеводных модификациях, и фактически основаны на углевод-углеводных взаимодействиях [22]. С другой стороны, перспективными могут оказаться гликопротеины, напрямую синтезируемые раковыми клетками: ввиду абнормального метаболизма и процессов роста, скорее всего, гликозилирование их белков будет сильно отличаться от нормального. Так, например, уже используемый в клинике раковый эмбриональный антиген (РЭА, carcinoembryonic antigen) имеет очень специфический гликопрофиль, который значительно меняется в зависимости от стадии колоректального рака [23]. Аналогичные открытия сделаны для гаптоглобина и альфа-фетопротеина в случае злокачественных образований в печени [24], [25].
Когда ученые не знают, на какой именно белок обратить внимание, можно пойти «от противного». Уже накоплено немало информации о том, какие гликоэпитопы часто ассоциированы со злокачественными изменениями. А значит, можно выловить белки, несущие эти эпитопы (рис. 5), и получить целый список новых кандидатов, которые можно исследовать на наличие биомаркерного потенциала [26], [27].
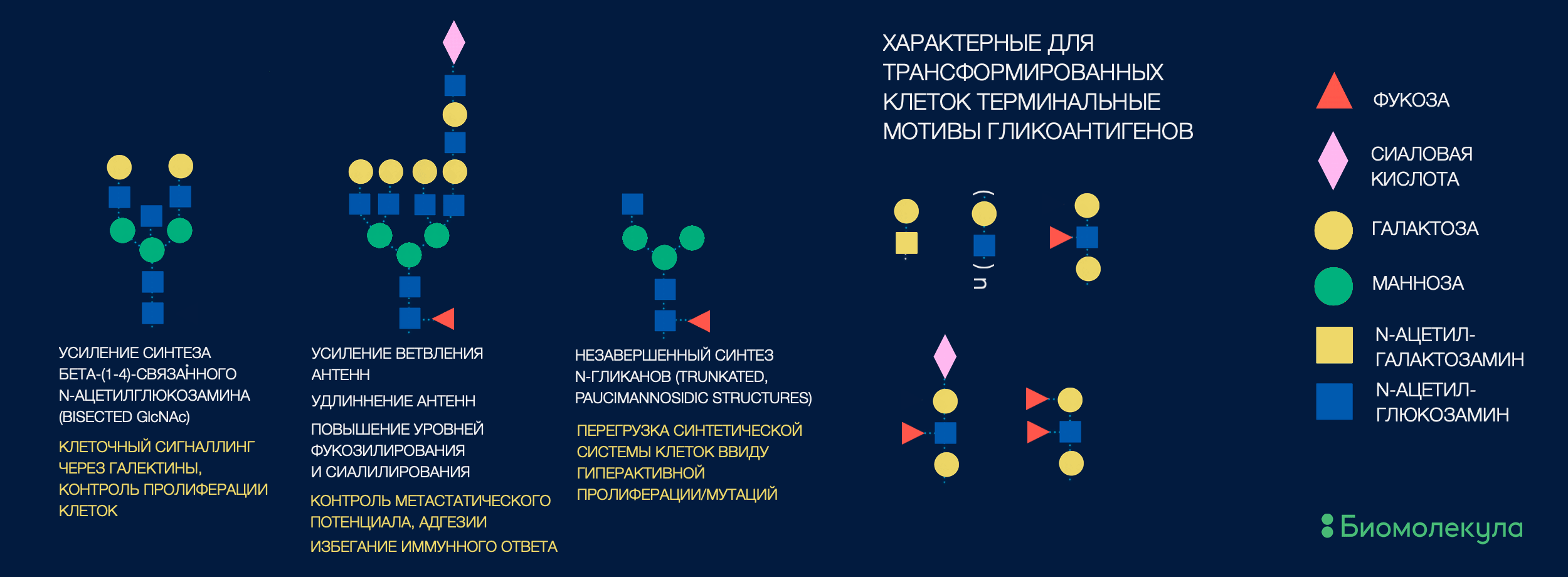
Рисунок 5. Гликобиомаркером может считаться как целая структура N-гликана, так и какие-то ее отдельные фрагменты (гликоэпитопы). Здесь суммированы накопленные на данный момент знания о гликомотивах, ассоциированных с развитием онкозаболеваний.
иллюстрация автора статьи
Упоминавшийся выше поиск гликобиомаркеров непосредственно в ткани опухоли полезен в двух случаях: на начальных стадиях поиска специфических биомаркеров и при исследовании самой опухоли. Это можно сделать с помощью окрашивания лектинами (специфичными к определенным гликанам белками) или с помощью более продвинутых технологий — например масс-спектрометрической визуализации. По итогам можно получить картинку распределения гликанов в кусочке ткани и лучше понять ее границы и свойства (рис. 6).
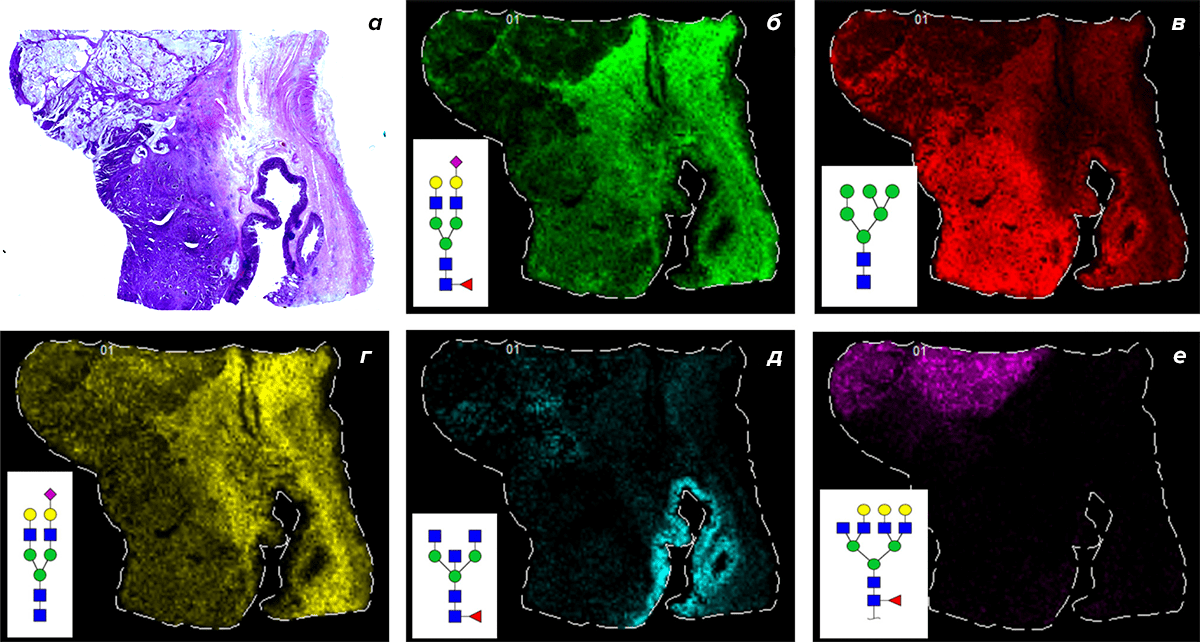
Рисунок 6. Масс-спектрометрическая визуализация с помощью технологии MALDI-FTICR. На рисунке а — фотография гистологического препарата опухоли, окрашенного гематоксилин-эозином. На остальных тот же участок опухоли был обработан ферментом для дегликозилирования, после чего масс-спектрометрический анализ показал распределение гликанов в плоскости ткани.
Но раз абнормальное гликозилирование доказанно может влиять на события в развитии опухолевой клетки, наверное, мы можем убрать эти гликаны и не дать злокачественным процессам произойти вовсе? Так и есть — существует новый, едва зарождающийся концепт углеводной терапии, где блокируется не просто работа определенного белка, а конкретной углеводной детерминанты. Ведь при разработке и применении иммунотерапии необходимо считаться с гликанами. Раковые антигены очень часто являются гликопротеинами, и антитела против них, например, могут быть слабоспецифичны к определенным гликоформам или же не связываться с ними вовсе [28]. Однако появление определенных гликоэпитопов можно предотвратить, помешав работе самих гликозилтрансфераз, — например, введя в клетки модифицированные аналоги моносахаридов (например сиаловых кислот и фукозы), которые связываются с ферментами, но уже не могут быть присоединены к растущему углеводному дереву [29]. Этот вариант — «лечение гликанов гликанами» — концептуально забавен и в то же время очень перспективен. О других же вариантах использования органических молекул с углеводами в составе читайте прямо в следующем параграфе.
Малые молекулы на углеводной основе
Традиционные и укоренившиеся лекарственные протоколы — это «тот корешок», «та жаба» или «тот плесени шмат», то есть натуральные источники влияющих на биохимию нашего тела соединений. И так как углеводы — одна из самых распространенных макромолекул в живой природе, несложно предположить существование множества лекарств природного происхождения с сахарами или их производными в составе.
Антикоагулянт гепарин — по структуре оказывающийся гликозамингликаном, полимером из аминосахаров и уроновых кислот, — впервые открыли еще в начале XX века (как нередко бывает, случайно [30]), и уже во время Второй мировой войны применяли для устранения тромботических осложнений. Пускай у разных фармкомпаний свои подходы к производству очищенного препарата (а так как это смесь полисахаридов — немного различаются состав и действие лекарства), все они пока используют животный источник гепарина (например эндотелий крупного рогатого скота или свиней).
Другой гликозамингликан соединительной ткани — гиалуронат, — тоже получаемый из тканей животных, начинал карьеру как препарат для лечения остеоартрита, фактически функционируя как дополнительная смазка для суставов. Позже он нашел применение в глазной хирургии, но наибольшую популярность в народе получил как продукт для косметологии и пластической хирургии: инъекционный вариант обусловливает задорную приподнятность и пухлость разных частей тела, тогда как топическое (кожное) применение помогает увлажнить кожу и может использоваться как наноноситель для водорастворимых компонентов. Все это обусловлено высокой биотолерантностью и биодоступностью гиалуроната, а также способностью длинных полимеров гликозамингликанов связывать большое количество полярных соединений, в частности воды.
Углеводные препараты также можно получать из бактерий — например акарбозу, применяемую при диабете для регуляции уровня глюкозы в крови путем снижения биодоступности крахмалов из пищи [31].
Самыми же ассоциированными с аптекой лекарствами для современного человека являются относительно низкомолекулярные соединения (малые молекулы) — продукты химического синтеза или очистки натуральных компонентов, считающиеся лекарствами первого поколения [32]. Они сразу приходят на ум при мысли об аптечном арсенале — как например, нимесулид или ацетилсалициловая кислота («Найз» и аспирин соответственно), а также многочисленные антибиотики. Над разработкой и пониманием истинного механизма работы низкомолекулярных лекарственных соединений трудится целая область науки на стыке физики, химии, биологии и программирования (подробнее об этом «Биомолекула» пишет в статье [33]). С развитием вычислительных технологий (особенно машинного обучения) процесс подбора и валидации новых кандидатов становится все быстрее и точнее, а сами соединения — более сложными и разнообразными по своей структуре.
Особенно это заметно и важно для самой интенсивной гонки XXI века — новые антибиотики против бактериальной резистентности. Есть три основные группы углеводных антимикробных соединений с множеством ответвлений, и небезызвестные стрептомицин, туникамицин и азитромицин принадлежат к трем разным классам (аминогликозиды, нуклеозиды и макролиды соответственно). Однако все они нацелены на угнетение синтеза белка бактерией, например, через необратимое связывание с малой или большой субъединицами рибосом, или же на блокировку механизма синтеза гликанов, что мешает не только корректной трансляции, но и синтезу пептидогликанов в составе клеточной стенки бактерий.
Большинство известных нынче углеводсодержащих антибиотиков были выделены из бактерий или грибов и, возможно, модифицированы для лучшей эффективности, увеличенного времени распада в организме и пониженной токсичности, как, скажем, полусинтетический оритаванцин (производное гликопептида ванкомицина) или относительно новый углеводопептидолипидный гибрид рамопланин [34], связывающиеся с аминокислотами клеточной стенки и блокирующие ее дальнейший синтез.
Сейчас многие гликопептидные антибиотики относятся к препаратам «последней надежды», либо к так называемой salvage therapy — резервному лечению, применению неутвержденных протоколов от безысходности, фактически надеясь на чудо. С развитием гликобиологии и гликомики синтезируют всё больше углеводных миметиков и производных, например, аминогликозидов, образующих поры между липосахаридами клеточной стенки бактерий и связывающихся с рибосомами, и исследуют их на наличие антимикробной активности [35], и всё чаще используют вычислительные методы для поиска максимально специфичных соединений с минимальной токсичностью для человека. Больше и подробнее про соревнование бактерий и ученых можно прочитать в статье [36], спецпроекте о вакцинации и многих других материалах «Биомолекулы» о резистентности и биологии микробов; эта же статья скорее стремится намекнуть на законное место углеводосодержащих соединений в пантеоне современных антибиотиков, которое при первом приближении не слишком бросается в глаза.
Мы уже прониклись тем, что моно- и олигосахариды представляют собой чрезвычайно распространенные низкомолекулярные органические соединения, являющиеся неотъемлемой структурной и функциональной составляющей живой клетки, в частности процессов распознавания и проведения сигналов. По своим физико-химическим свойствам углеводы очень удачно вписываются в метаболизм человека: у них хорошая растворимость и почти нулевая токсичность, а также сравнительно быстрая фармакокинетика (то, как соединение проходит через организм и выводится из него). За счет этих факторов они оказываются перспективными вариантами таргетной доставки лекарств: малых молекул, белков и нуклеиновых кислот (рис. 7). Если метод будет основан на лектин-углеводном взаимодействии, доставка может стать довольно специфичной, и сила взаимодействия будет зависеть от аффинности лектина к сахаридному эпитопу. Разумеется, переносчиком лекарственного «груза» может быть как сам лектин, так и олигосахарид [37]. Таким образом, противовоспалительные молекулы можно доставить напрямую к очагу воспаления, используя P-cелектин — белок эндотелия сосудов, узнающий sLex-гликоэпитоп. Нейтрофилы, презентирующие на своей поверхности sLex, направляются к месту иммунного ответа с помощью роллинга , а значит, наночастицы со сходным гликоэпитопом пойдут тем же путем [38]. Развитие гликомики и более глубокое изучение особенностей гликозилирования клеток при патологических процессах (особенно онкологических!) может существенно расширить не только возможности диагностики (см. соответствующий параграф этой статьи), но и варианты таргетной терапии заболевания.
Роллинг — миграция лейкоцитов под влиянием кровотока путем опосредованного белок-углеводными взаимодействиями перекатывания по поверхности фибриновой пленки.
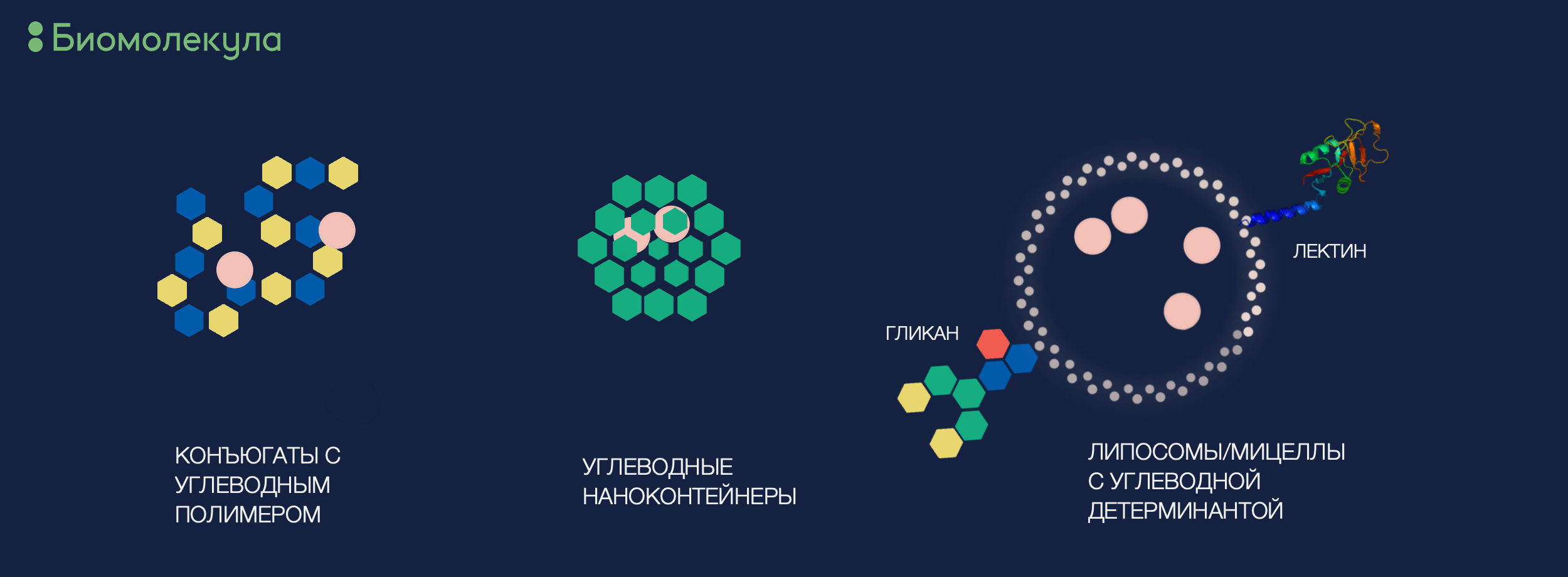
Рисунок 7. Примеры углеводных структур для доставки лекарств
иллюстрация автора статьи
Для менее специфической доставки можно использовать хитозан [39], который обладает мукоадгезивными свойствами, то есть способен липнуть к слизистым оболочкам (например носа, глаз, пищеварительного тракта), причем липнет он как на микро-, так и на макроуровнях. Лекарственные формы — порошки, спреи, небольшие таблетки, пластыри — действительно плотно крепятся к эпителию за счет этих взаимодействий. Пока не совсем понятен механизм этого феномена (о различных теориях расскажет статья [40]), но очевидно, что он завязан на углеводных структурах (ведь, по сути, слизь является протеогликаном) и очень удобен для медленного, продолжительного и надежного поступления лекарства через слизистые дальше в организм. Так как хитозан является аминосахаром и в растворе заряжен положительно, весьма хитрó спарить его с отрицательно заряженной молекулой лекарства и отправить этот комплекс к месту доставки. Помимо малых молекул, несущих отрицательный заряд, генная терапия оказывается самым логичным вариантом применения этого метода — ведь нуклеиновые кислоты фактически состоят из отрицательных зарядов по всей длине. Такой подход, например, использовали для поверхностного лечения хронических заболеваний глаз [41], а также признали многообещающим в случае вакцин на основе ДНК [42]. Про ДНК-вакцины «Биомолекула» уже писала отдельную статью (почитайте [43]), однако важно заметить, что углеводы могут быть не только доставщиками, но и непосредственными антигенами вакцины.
Гликовакцины
В общих чертах вакцина является коктейлем из активного компонента (антигена) и различных поддерживающих субстанций — усилителей иммунного ответа (иначе называемых бустерами, или адъювантами), стабилизаторов, консервантов, эмульсификаторов. По сути своей это обманка для иммунитета: вакцина заставляет организм считать, что он заболел, и вырабатывать адаптивный иммунитет, который будет наготове при появлении реального возбудителя и поможет не заболеть по-настоящему. Сейчас (из-за уже набившего оскомину вируса) вакцины являются горячей темой, и для более ясного понимания всех аспектов вакцинации я советую обратиться к шикарнейшему спецпроекту «Биомолекулы». А в контексте этой статьи нам стоит сфокусироваться на антигенах в составе вакцины, которые и вызывают специфический иммунный ответ.
Коротко говоря, они бывают разными. Самые хорошие «классические» антигены получаются из белков, их частей или целых ансамблей в составе самих инактивированных микроорганизмов. Но как мы помним из предыдущей статьи цикла [1], огромное количество белков, особенно мембранных, гликозилировано. Логично предположить, что специфические для патогена белково-углеводные конъюгаты (так как гликаны по отдельности не всегда хорошо активируют иммунитет) могут быть неплохой мишенью иммунного ответа для предотвращения ряда заболеваний. Вдобавок к стандартному механизму гуморального ответа, обычно активируемого вакцинами, Т-клетки могут специфически распознавать полисахариды на белковой подложке через систему главного комплекса гистосовместимости, тем самым помогая B-клеткам усилить продукцию нужных антител [44].
Особенно замечательно эта идея сочетается с феноменом антибиотикорезистентности бактерий. В составе капсульных полисахаридов бактериальной клеточной стенки находятся уникальные углеводные мотивы. Следуя за успехом препаратов на основе производных этих олигосахаридов, метод расширили до других классов гликанов, например тейхоевых кислот грамположительных бактерий и миколовых кислот микобактерий. Натравливая на них иммунитет заранее, мы можем предотвратить бактериальную экспансию в организме и избежать использования антибиотиков широкого спектра — наша иммунная система будет готова атаковать особо злые клетки микробов. Гликовакцины уже используются против стрептококковых, пневмококковых и менингококковых инфекций, сальмонеллеза, а также рассматриваются как перспективная профилактика туберкулеза [45–47].
Так как капсид вирусов тоже нередко и обильно украшен гликанами, исследователи и их не обошли стороной. На данный момент существуют гликовакцины против некоторых серотипов вируса гриппа, цитомегаловируса, вируса гепатита С и других неприятных патогенов [48]. И разумеется, ведутся разработки гликовакцин для главной знаменитости этого года — ведь капсид нового коронавируса изобилует сахарами [49].
Но не только бактерии и вирусы носят особенные углеводные одежды, и не они одни доставляют нам неудобства. Паразитарные организмы тоже умеют синтезировать довольно уникальные гликопаттерны, которые могут индуцировать специфический иммунный ответ. Зачастую паразиты покрыты защитным гликокаликсом, который помогает оставаться в относительной безопасности и приспособленности в их нелегких странствиях от хозяина к хозяину. Паразитарные гликаны могут непосредственно, механически, укрывать от защитных систем организма, а кроме того, паразиты способны мимикрировать углеводные детерминанты своих гликопротеинов под хозяйские. Однако похожий — не значит идентичный; при усиленной активации иммунитета против этих структур паразиты могут попасть под перекрестный огонь адаптивного и врожденного иммунитетов [50]. Антипаразитарные вакцины уже разрабатываются для активации защиты против шистосом, трипаносом и лейшманий [50], [51]. Притом для последней в качестве антигена рассматриваются не только синтетические белково-углеводные структуры, но и богатый гликанами секреторный гель (Promastigote Secretory Gel, PSG), который паразит использует в процессе заселения в хозяина.
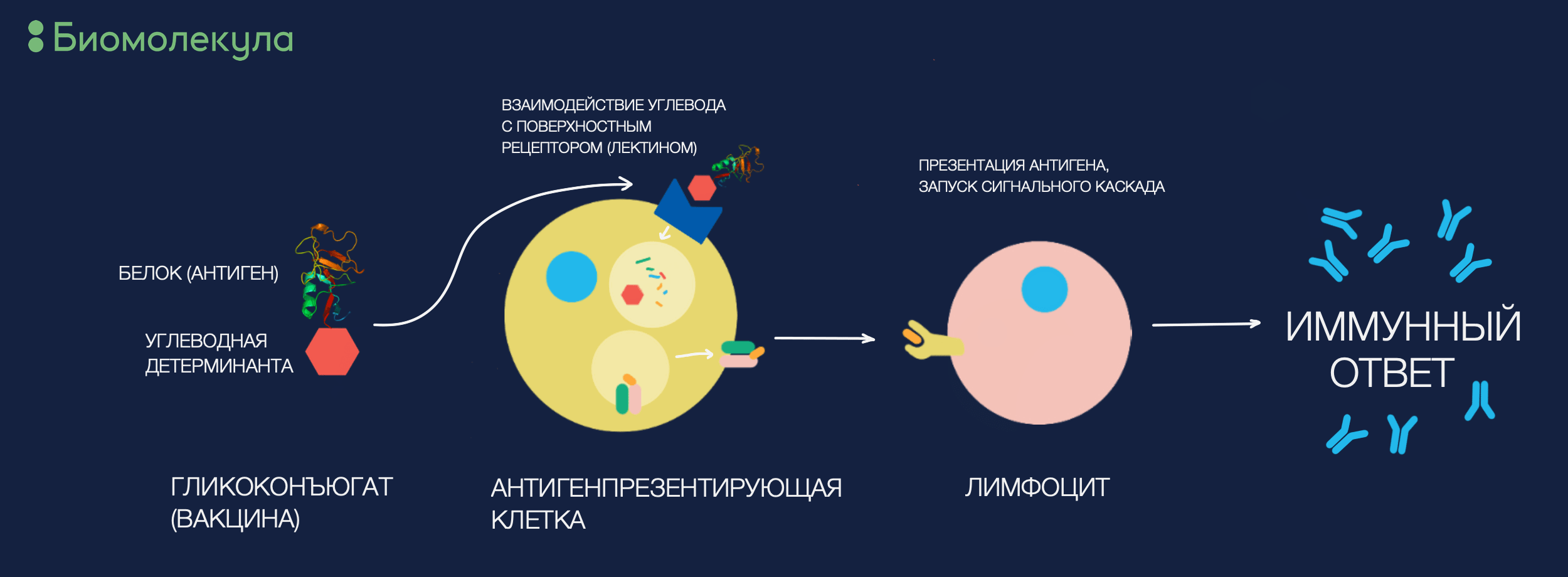
Рисунок 8. Как работает гликовакцина? Примерно так же, как и обычная, но с сильно большей специфичностью. Зная о наличии определенных лектинов в клетках-мишенях, мы можем направлять гликоконъюгат в интересующие антигенпрезентирующие клетки и быть более уверенными, что он будет ими поглощен.
иллюстрация автора статьи
Но самой интересной и горячей историей в разделе гликовакцин, наверное, будут прививки против рака. Как здорово было бы — вакцинироваться и заранее науськать свою иммунную систему на появление абнормальных клеток? Ведь, как мы помним из начала статьи, у гликанов есть вполне неплохой потенциал в диагностике онкологических заболеваний: трансформрированные клетки порой выставляют на поверхность весьма особенные наборы гликанов и углеводно-белковых эпитопов. Такой тип вакцин может использоваться не только для предотвращения онкологического заболевания, но и для его лечения — ведь раковые антигены на поверхностях клеток зачастую недостаточно иммуногенны, и «настройка» иммунитета на их распознавание может ускорить их уничтожение собственными силами организма в обход химиотерапии. Ассоциированные с раковыми изменениями гликоэпитопы могут распознаваться напрямую Т-клетками или толл-подобными рецепторами клеток врожденного иммунитета, которые затем передадут его B-лимфоцитам через систему презентации антигена (например, через поверхности дендритных клеток [52]). Причем доставка противоопухолевых вакцин под кожу считается очень эффективным решением — ведь именно там высока плотность дендритных клеток [53]. Тогда как первое поколение вакцин использует простые гликоконъюгаты, антигены нового поколения состоят из нескольких кластеризованных гликоэпитопов. Этот улучшенный подход применялся, например, в иммунизации пациентов с метастатическим раком молочной железы [54] и имеющих высокий риск рака простаты [55], а также для терапии ряда карцином [56].
Заключение
Понимая, насколько вездесущи и важны углеводы, сегодня невозможно представить будущее фундаментальной науки, биомедицины и биотехнологии без вклада гликобиологов. Они и в дальнейшем не останутся без дела, ведь гликаны имеют отношение к практически любой области биологии. И даже базовое понимание основных принципов гликобиологии поможет ученым из других отраслей лучше и эффективнее решать свои вопросы.
И тем более наивно было бы ожидать, что биомедицинское производство сможет игнорировать вклад сахарного кода при разработке новых лекарств и оптимизации старых. Протекание любого заболевания, провоцирующего гуморальный иммунный ответ, зависит от паттерна гликозилирования антител. Любой патоген имеет хотя бы немного гликанов на своей поверхности. И почти любое взаимодействие с клеткой обусловлено составом и свойствами углеводных детерминант на мембранных белках.
Вопросы, стоящие перед гликобиологами будущего многочисленны и разнообразны. Есть ли скелетная роль гликанов в структурной организации клетки и межклеточного матрикса? Как гликаны регулируют сигналы, идущие от поверхности клетки к ядру? Или же, как так вышло, что природа создала сотни моносахаридов, однако лишь малая часть из них активно задействована в работе биологических систем? И наконец, когда же гликобиология достигнет того уровня развития и понимания, что мы сможем наконец-то встроить ее в холистический подход к изучению организмов — системную биологию?
Из-за сложности углеводных структур и сложности их анализа, медицинская гликобиология долго запрягала, однако быстро поехала; более того, она ускоряется с каждым днем. Ожидается, что к 2026 году суммарный размер рынка гликобиотехнологии достигнет 2,4 миллиардов долларов, с ежегодным приростом в 14,7% — соблазнительный кусок пирога для тех, кто не боится сложностей и новых неизведанных горизонтов [57].
Ведь наука по сути своей и есть поиск ответов там, где никто еще их не искал.
Литература
- Жизнь без сахара — не сахар: третий алфавит в молекулярной биологии;
- Ricardo J. Solá, Kai Griebenow. (2010). Glycosylation of Therapeutic Proteins. BioDrugs. 24, 9-21;
- Bojiao Yin, Yuan Gao, Cheng-yu Chung, Shuang Yang, Emily Blake, et. al.. (2015). Glycoengineering of Chinese hamster ovary cells for enhanced erythropoietin N-glycan branching and sialylation. Biotechnol. Bioeng.. 112, 2343-2351;
- Tomislav Čaval, Weihua Tian, Zhang Yang, Henrik Clausen, Albert J. R. Heck. (2018). Direct quality control of glycoengineered erythropoietin variants. Nat Commun. 9;
- Shigehiro Yanagihara, Yuya Taniguchi, Mareto Hosono, Eiji Yoshioka, Rika Ishikawa, et. al.. (2010). Measurement of Sialic Acid Content Is Insufficient to Assess Bioactivity of Recombinant Human Erythropoietin. Biol. Pharm. Bull.. 33, 1596-1599;
- 12 методов в картинках: клеточные технологии;
- Vital tools. A brief history of cho cell. (2015). LSF Magazine. Winter, 38–54;
- Клик и готово! Укрощение строптивых биомолекул;
- Katharina Streichert, Carina Seitz, Eugenia Hoffmann, Irene Boos, Wolfgang Jelkmann, et. al.. (2019). Synthesis of Erythropoietins Site‐Specifically Conjugated with Complex‐Type N ‐Glycans. ChemBioChem. 20, 1914-1918;
- Anne Zemella, Lena Thoring, Christian Hoffmeister, Mária Šamalíková, Patricia Ehren, et. al.. (2018). Cell-free protein synthesis as a novel tool for directed glycoengineering of active erythropoietin. Sci Rep. 8;
- Lei Zhang, Shen Luo, Baolin Zhang. (2016). Glycan analysis of therapeutic glycoproteins. mAbs. 8, 205-215;
- Контроль качества биотехнологических продуктов;
- Наработка антител для доклинических и клинических испытаний;
- Zuzana Kyselova, Yehia Mechref, Mohammad M. Al Bataineh, Lacey E. Dobrolecki, Robert J. Hickey, et. al.. (2007). Alterations in the Serum Glycome Due to Metastatic Prostate Cancer. J. Proteome Res.. 6, 1822-1832;
- Karina Biskup, Elena I. Braicu, Jalid Sehouli, Christina Fotopoulou, Rudolf Tauber, et. al.. (2013). Serum Glycome Profiling: A Biomarker for Diagnosis of Ovarian Cancer. J. Proteome Res.. 12, 4056-4063;
- Toshiya Kamiyama, Hideki Yokoo, Jun-Ichi Furukawa, Masaki Kurogochi, Tomoaki Togashi, et. al.. (2013). Identification of novel serum biomarkers of hepatocellular carcinoma using glycomic analysis. Hepatology. 57, 2314-2325;
- Cuiying Chitty Chen, Sebastiaan Engelborghs, Sylviane Dewaele, Nathalie Le Bastard, Jean-Jacques Martin, et. al.. (2010). Altered Serum Glycomics in Alzheimer Disease: A Potential Blood Biomarker?. Rejuvenation Research. 13, 439-444;
- Andrea Vilar‐Bergua, Iolanda Riba‐Llena, Valerie Vanhooren, Sylviane Dewaele, Claude Libert, et. al.. (2015). N‐glycome Profile Levels Relate to Silent Brain Infarcts in a Cohort of Hypertensives. JAHA. 4;
- Dieter Vanderschaeghe, Ákos Szekrényes, Christian Wenz, Marcus Gassmann, Natasha Naik, et. al.. (2010). High-Throughput Profiling of the Serum N-Glycome on Capillary Electrophoresis Microfluidics Systems: Toward Clinical Implementation of GlycoHepatoTest. Anal. Chem.. 82, 7408-7415;
- James N. Arnold, Radka Saldova, Umi M. Abd Hamid, Pauline M. Rudd. (2008). Evaluation of the serum N-linked glycome for the diagnosis of cancer and chronic inflammation. Proteomics. 8, 3284-3293;
- Ning Ding, Huan Nie, Xuemei Sun, Wei Sun, Youpeng Qu, et. al.. (2011). Human serum N-glycan profiles are age and sex dependent. Age and Ageing. 40, 568-575;
- Bhairavi N. Vajaria, Prabhudas S. Patel. (2017). Glycosylation: a hallmark of cancer?. Glycoconj J. 34, 147-156;
- Qianqian Zhao, Tiancheng Zhan, Zaian Deng, Qianqian Li, Yaming Liu, et. al.. (2018). Glycan analysis of colorectal cancer samples reveals stage-dependent changes in CEA glycosylation patterns. Clin Proteom. 15;
- Petr Pompach, Zuzana Brnakova, Miloslav Sanda, Jing Wu, Nathan Edwards, Radoslav Goldman. (2013). Site-specific Glycoforms of Haptoglobin in Liver Cirrhosis and Hepatocellular Carcinoma. Mol Cell Proteomics. 12, 1281-1293;
- Ting Zhao, Li Jia, Jun Li, Chen Ma, Jingyu Wu, et. al.. (2020). Heterogeneities of Site-Specific N-Glycosylation in HCC Tumors With Low and High AFP Concentrations. Front. Oncol.. 10;
- Xuemei Zeng, Brian L. Hood, Mai Sun, Thomas P. Conrads, Roger S. Day, et. al.. (2010). Lung Cancer Serum Biomarker Discovery Using Glycoprotein Capture and Liquid Chromatography Mass Spectrometry. J. Proteome Res.. 9, 6440-6449;
- Sun-Hee Heo, Seung-Jin Lee, Hyun-Mo Ryoo, Jae-Yong Park, Je-Yoel Cho. (2007). Identification of putative serum glycoprotein biomarkers for human lung adenocarcinoma by multilectin affinity chromatography and LC-MS/MS. Proteomics. 7, 4292-4302;
- Ana Filipa Costa, Diana Campos, Celso A. Reis, Catarina Gomes. (2020). Targeting Glycosylation: A New Road for Cancer Drug Discovery. Trends in Cancer. 6, 757-766;
- Wan-Ling Ho, Wen-Ming Hsu, Min-Chuan Huang, Kenji Kadomatsu, Akira Nakagawara. (2016). Protein glycosylation in cancers and its potential therapeutic applications in neuroblastoma. J Hematol Oncol. 9;
- Бокарев И.Н. и Попова Л.В. (2008). Опыт применения низкомолекулярных гепаринов при лечении тромбоза глубоких вен. «Трудный пациент». 11, 42–46;
- R. E. Wachters-Hagedoorn, M. G. Priebe, J. A. J. Heimweg, A. M. Heiner, H. Elzinga, et. al.. (2007). Low-dose acarbose does not delay digestion of starch but reduces its bioavailability. Diabetic Med. 24, 600-606;
- Три поколения лекарств;
- Драг-дизайн: как в современном мире создаются новые лекарства;
- Антимикробные пептиды — возможная альтернатива традиционным антибиотикам;
- Lina Guo, Yue Wan, Xin Wang, Peng George Wang, Wei Zhao. (2012). Development of Aminoglycoside Antibiotics by Carbohydrate Chemistry. MRMC. 12, 1533-1541;
- Антибиотики vs Бактерии. «Война Бесконечности» или всему есть предел?;
- Franz Gabor, Elisabeth Bogner, Andrea Weissenboeck, Michael Wirth. (2004). The lectin–cell interaction and its implications to intestinal lectin-mediated drug delivery. Advanced Drug Delivery Reviews. 56, 459-480;
- A.Omolola Eniola, Daniel A. Hammer. (2003). Artificial polymeric cells for targeted drug delivery. Journal of Controlled Release. 87, 15-22;
- Лаборатория инженерии биополимеров: симбиоз длиною в десятилетия;
- RyanF Donnelly, Rahamatullah Shaikh, ThakurRaghu Raj Singh, MartinJames Garland, ADavid Woolfson. (2011). Mucoadhesive drug delivery systems. J Pharm Bioall Sci. 3, 89;
- M de la Fuente, B Seijo, M J Alonso. (2008). Bioadhesive hyaluronan–chitosan nanoparticles can transport genes across the ocular mucosa and transfect ocular tissue. Gene Ther. 15, 668-676;
- Krishnendu Roy, Hai-Quan Mao, Shau -Ku Huang, Kam W. Leong. (1999). Oral gene delivery with chitosan–DNA nanoparticles generates immunologic protection in a murine model of peanut allergy. Nat Med. 5, 387-391;
- Что такое ДНК-вакцины и с чем их едят?;
- Fikri Y Avci, Xiangming Li, Moriya Tsuji, Dennis L Kasper. (2011). A mechanism for glycoconjugate vaccine activation of the adaptive immune system and its implications for vaccine design. Nat Med. 17, 1602-1609;
- Francesco Berti, Roberto Adamo. (2018). Antimicrobial glycoconjugate vaccines: an overview of classic and modern approaches for protein modification. Chem. Soc. Rev.. 47, 9015-9025;
- Caterina Temporini, Teodora Bavaro, Sara Tengattini, Immacolata Serra, Giorgio Marrubini, et. al.. (2014). Liquid chromatography–mass spectrometry structural characterization of neo glycoproteins aiding the rational design and synthesis of a novel glycovaccine for protection against tuberculosis. Journal of Chromatography A. 1367, 57-67;
- Болезнь, не думавшая сдаваться;
- Glycoprotein-based vaccine development. (2019). Creative Biolabs;
- Wang D. (2020). Coronaviruses’ sugar shields as vaccine candidates. Curr. Trends Immunol. 21, 17–23;
- Joao A. Rodrigues, Alvaro Acosta-Serrano, Markus Aebi, Michael A. J. Ferguson, Françoise H. Routier, et. al.. (2015). Parasite Glycobiology: A Bittersweet Symphony. PLoS Pathog. 11, e1005169;
- Matthew E. Rogers, Olga V. Sizova, Michael A. J. Ferguson, Andrei V. Nikolaev, Paul A. Bates. (2006). Synthetic Glycovaccine Protects against the Bite ofLeishmania‐Infected Sand Flies. J INFECT DIS. 194, 512-518;
- Дендритные клетки: профессиональные разведчики в «Опухолевой войне»;
- Sanne Duinkerken, Sophie K. Horrevorts, Hakan Kalay, Martino Ambrosini, Lisa Rutte, et. al.. (2019). Glyco-Dendrimers as Intradermal Anti-Tumor Vaccine Targeting Multiple Skin DC Subsets. Theranostics. 9, 5797-5809;
- T. Gilewski, G. Ragupathi, S. Bhuta, L. J. Williams, C. Musselli, et. al.. (2001). Immunization of metastatic breast cancer patients with a fully synthetic globo H conjugate: A phase I trial. Proceedings of the National Academy of Sciences. 98, 3270-3275;
- Susan F. Slovin, Govind Ragupathi, Celina Fernandez, Meghan Diani, Matthew P. Jefferson, et. al.. (2007). A polyvalent vaccine for high-risk prostate patients: “are more antigens better?”. Cancer Immunol Immunother. 56, 1921-1930;
- P. J. Sabbatini, G. Ragupathi, C. Hood, C. A. Aghajanian, M. Juretzka, et. al.. (2007). Pilot Study of a Heptavalent Vaccine-Keyhole Limpet Hemocyanin Conjugate plus QS21 in Patients with Epithelial Ovarian, Fallopian Tube, or Peritoneal Cancer. Clinical Cancer Research. 13, 4170-4177;
- Glycomics/glycobiology market size worth $2.4 billion by 2026. (2019). Grand View Research;
- Ivan Gudelj, Gordan Lauc, Marija Pezer. (2018). Immunoglobulin G glycosylation in aging and diseases. Cellular Immunology. 333, 65-79;
- R.R. Drake, T.W. Powers, E.E. Jones, E. Bruner, A.S. Mehta, P.M. Angel. (2017). MALDI Mass Spectrometry Imaging of N-Linked Glycans in Cancer Tissues. Advances in Cancer Research. 85-116.








