
Черный ящик изобилия. Нобелевская премия по химии 2018 года
04 октября 2018
Черный ящик изобилия. Нобелевская премия по химии 2018 года
- 2227
- 0
- 2
Слева направо: Фрэнсис Арнольд, Джордж Смит, Грегори Винтер. Иллюстрация Никласа Элмехеда / Nobel Media.
-
Автор
-
Редакторы
Нынешний выбор Нобелевского комитета в очередной раз подтвердил, что наука еще не растеряла свой «бэконовский дух», свою направленность на «приручение» законов природы. В 2018 году лауреатами премии по химии стали авторы методик биоинженерии промышленно и медицински значимых белков с помощью эволюции in vitro. Причем половина премии ушла Фрэнсис Арнольд, разработавшей метод направленной эволюции ферментов, а другая половина — Джорджу Смиту и Грегу Винтеру, авторам метода фагового дисплея, позволившего не только изучать взаимодействия белков, но и получать в пробирке чистые антитела с высокой аффинностью [1].
Эволюция в пробирке
Потому что это работает.
Фрэнсис Арнольд
Помните момент в знаменитом «Властелине колец», когда король-чародей Ангмара уверяет вступившую с ним в схватку Йовин в том, что, по предсказанию, его не сразит ни один муж? «Я не муж!» — отвечает героиня и сражает высшего назгула. Примерно такая же картина вырисовывается в голове, когда мы читаем очерк об исследованиях Фрэнсис Арнольд в далеких 1990-х:
«Некоторые люди смотрели на меня сверху вниз. Некоторые говорили: „Это не наука, приличные джентльмены не занимаются случайными мутациями“. Но я не была ученым. И не была джентльменом... Я легко получала отличный результат, потому что это работает» [2].
Сегодня список многочисленных научных премий Фрэнсис Арнольд пополнился, пожалуй, самой престижной из них — Нобелевской премией по химии. Что сделало ее пятой в истории женщиной-химиком, получившей эту награду. Однако нынешний профессор Калифорнийского технологического института, один из немногих членов сразу трех Американских национальных академий (Национальной академии наук, Института медицины и Национальной академии инженерии) и автор потрясающе эффективного и теперь уже широко используемого метода получения промышленно значимых ферментов начинала довольно скромно. Воистину в духе американской мечты: подрабатывая таксистом и официанткой, чтобы платить за аренду.
На старте своей карьеры она не собиралась быть ученым, а химическим, а затем и биохимическим инженирингом занялась, загоревшись идеей найти возобновляемые источники топлива. Во время работы в Институте солнечной энергетики, после ряда неудач в поиске нужного фермента, Фрэнсис Арнольд рассудила, что эволюция — лучший дизайнер. Так почему же не взять на вооружение ее основные принципы? Это привело ее в Калифорнийский технологический институт, где она сперва изучала биотехнологии, а затем продолжила работать в этом направлении [2], [3].
В 1993 году она получила фермент субтилизин Е — протеазу сенной палочки, — которая оставалась активной даже в присутствии органического растворителя диметилформамида (ДМФ). С помощью метода склонной к ошибкам ПЦР [4] исследователь вносила в ген мутации, а затем клонировала и экспрессировала его с помощью бактерий, отбирая с помощью селекции те клоны, что способны были гидролизовать молочный белок казеин в присутствии ДМФ (рис. 1). Вокруг тех колоний бактерий, чей встроенный фермент гидролизовал казеин, на чашке образовывалось гало. Микроорганизмы с самым большим гало отбирали и подвергали следующему раунду мутагенеза—клонирования—отбора. Таким образом удалось повысить устойчивость к ДМФ в 256 раз [5]!

Рисунок 1. Метод направленной эволюции ферментов. 1. Внесение мутаций в ген, подлежащий модификации. 2. Встраивание генов в бактериальные векторы и их экспрессия в клетках бактерий. 3. Тестирование измененных ферментов по необходимым критериям. 4. Новый раунд внесения случайных мутаций. Цикл повторяется.
И это было только начало! Арнольд смело манипулировала свойствами ферментов, добиваясь сногсшибательных практических результатов. Ее метод был подхвачен и получил необычайно широкое распространение в биоинженерии, химии, биологии. За последние двадцать лет направленная эволюция стала мощным инструментом для управления функциями ферментов. Она позволяет создавать подходящие ферменты с улучшенной специфичностью, активностью, стабильностью и растворимостью, а также устойчивостью к различным условиям производственного процесса [2].
Сама идея кажется донельзя простой. Люди и раньше активно полагались на случайные изменения, с которыми впоследствии работали путем селекции. Фрэнсис Арнольд лишь повторила этот путь, хотя и с принципиальными новшествами, работая с геном напрямую и внедряя его после склонной к ошибкам ПЦР в бактериальные векторы.
Этот путь оказался куда более эффективным в контексте поиска ферментов с необходимыми свойствами. Ведь природа всегда выбраковывает всё то новое, что не способствует выживанию. Однако в пробирке, вооружившись бактериальным вектором, можно получить молекулу с любыми необходимыми свойствами. И при этом действовать куда быстрее и эффективнее самóй биологической эволюции.
Дисплей. Но не компьютерный, а... фаговый!
Почти все научные прорывы основаны на достижениях прошлого.
И моя работа в том числе.
Джордж Смит
«За фаговый дисплей пептидов и антител» — именно так звучит формулировка достижений Джорджа Смита и Грега Винтера в изложении Нобелевского комитета [1] (рис. 2). Смит в настоящее время уже завершил свою карьеру в Университете Миссури в Колумбии, а Винтер по прежнему занимается биохимическими исследованиями в Кэмбриджском университете и является основателем нескольких компаний, включая ту самую, что вывела на рынок противовоспалительный препарат «Хумира» (адалимумаб), продажи которого в настоящий момент составили 18,4 миллиарда долларов [3].

Рисунок 2. Нобелевская премия по химии. Фотограф: Джонас Экстромер / EPA.
Метод фагового дисплея впервые разработал Джордж Смит в 1985 году. Он основан на способности филаментных фагов представлять на своей поверхности белки, встроенные в ген капсида (гены pIII или pVIII в случае фага М13). В результате зараженная таким фагом бактериальная клетка синтезирует соответствующий гибридный белок, а фаг строит из него свой капсид. При этом тот самый белок, чью ДНК мы внедрили, оказывается на его поверхности. А мы, в свою очередь, можем его «пощупать» и проверить на сродство к тем или иным антигенам, изучить его взаимодействие с другими белками, последовательностями ДНК и малыми молекулами [6].
В 1990 году команда Грега Винтера применила метод представления антител на поверхности капсида [7], а в 1991 была создана первая библиотека вариабельных фрагментов антител.
Грэг Винтер, будучи сооснователем биотехнологической компании, то есть человеком, более ориентированным на практику, пошел немного дальше, превратив метод фагового дисплея из метода изучения в метод получения необходимых белков.
Ведь можно не ограничиваться одним лишь только представлением белков на поверхности фаговых капсидов, а отобрать из них те, что лучше или хуже всего взаимодействуют с теми или иными антигенами. Поместим в планшет необходимый компонент. Добавим наших фагов. Отмоем тех, что не связались. Извлечем тех, что связались. Снова инфицируем бактерий. Снова отберем. В результате удастся добиться чрезвычайно высокой эффективности связывания антител с антигеном [6], [8–10].
По своей сути, этот механизм во многом подражает эволюции антител в наших собственных организмах. Лимфатические B-клетки, экспонирующие случайно сконструированные антитела одного-единственного типа, сталкиваются с антигеном. Если происходит связывание антигена с антителом, то B-клетка при помощи помощников превращается в плазматическую клетку, начинает интенсивно размножаться и продуцировать антитела. В результате чего количество антител возрастает на 8 (у человека) — 12 (у мышей) порядков, и организм успешно борется с болезнью. Что же касается метода фагового дисплея, здесь мы вручную отбираем фага с нужным фрагментом белка, чтобы размножить его в пробирке при помощи бактерий [11].
Таким образом в 1993 году научная группа Винтера успешно изолировала фрагменты человеческих антител, которые специфически связывались с антигенами. Эти гены можно было экспрессировать в бактериях, что являлось многообещающей альтернативой методам, основанных на получении антител с помощью животных. И не только экспрессировать, но добиваться чрезвычайной чистоты моноклональных антител, а также улучшать их специфичность с помощью мутагенеза!
Для этого необходимо несколько раундов мутагенеза—амплификации—отбора, когда ДНК отобранных фагов сперва подвергается случайным мутациям, затем снова амплифицируется в бактериях, после чего мы получаем новое поколение немного измененных фагов, из которых опять можно отбирать нужные нам клоны (рис. 3) [11]. Подобный подход чрезвычайно роднит оба нобеленосных метода.
В 2002 году в Европе и США в качестве лекарства для артрита был одобрен адалимумаб (HUMIRA), самый успешный препарат, основанный на моноклональных антителах к TNF. Адалимумаб — если верить словам Грега Винтера, предмет его особой гордости [12], — содержал моноклональные антитела к TNF, полученные в помощью метода фагового дисплея, и стал первым полностью человеческим антителом, получившим фантастический коммерческий успех. О торжественном шествии «Хумиры» мы рассказывали в статье «Краткая история открытия и применения антител» [13].
С тех пор аналогичным путем получили препараты против аутоиммунных заболеваний, всевозможных форм рака и опасных бактерий, таких, как Bacillus anthracis, — возбудителя сибирской язвы.
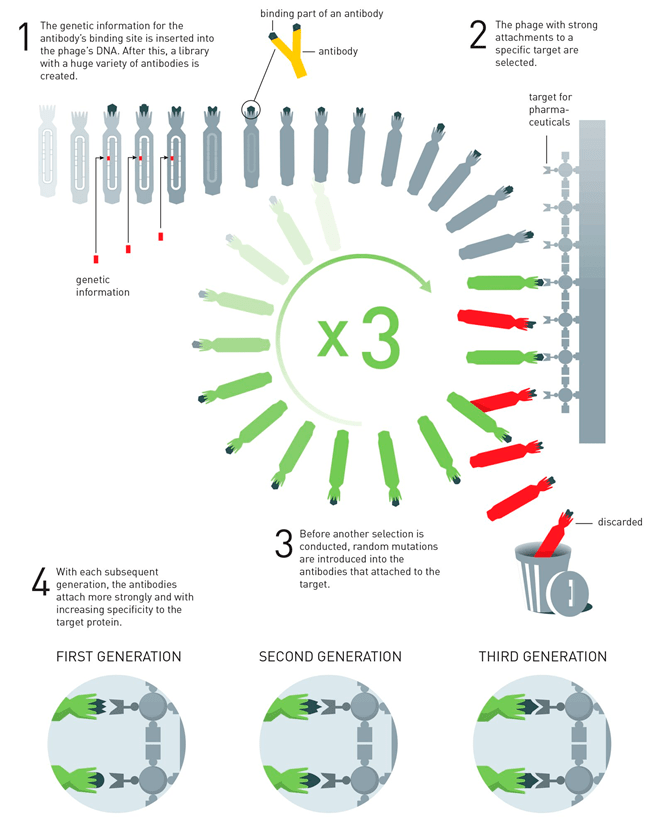
Рисунок 3. Метод фагового дисплея в технологии получении моноклональных антител. 1. ДНК, кодирующая антигенсвязывающие сайты антител, встраивается в гены капсида филаментных фагов. 2. Отбираются фаги с сильным связыванием с антигеном. 3. Внесятся случайные мутации перед новым раундом отбора. 4. С каждым последующим поколением антитела связываются с антигенами все сильнее, со все более высокой специфичностью.
Значение достижений нынешних нобелевских лауреатов по химии трудно переоценить. Недаром «Вашингтон пост» именует их «учеными, которые оседлали силу эволюции» [14].
От случайного блуждания к направленному дизайну
Хотя нельзя не отметить, что методы, основанные на случайном мутагенезе с последующим отбором, в существенной степени представляет собой работу вслепую. В этом процессе мы выигрываем ровным счетом за счет количества. Количества мутаций в генах, встраиваемых в бактериальные векторы или геномы фагов. Количества бактерий, которые быстро и успешно размножаются. Количества поколений микроорганизмов, которые сменяются одно за другим, и на это не приходится тратить миллионы лет. Направленная эволюция подобна черному ящику, который дает прекрасный результат, но от этого не перестает быть менее черным.
Этим направленная эволюция отличается от принципиально другого, рационального пути биоинженерии белков посредством их конструирования из доменов с известными свойствами [15]. С активным задействованием данных о структуре белков и последовательностях, кодирующих их ДНК. Это целое невероятно перспективное направление [16–20], которое, возможно, тоже получит всемирное признание в ближайшие годы, порадовав нас и вас, наших дорогих читателей «Биомолекулы».
Литература
- Официальный пресс-релиз Шведской Королевской Академии наук. (2018);
- Ouellette J. (2013). The director of evolution. Slate;
- Laursen L. (2018). ‘I’m not a scientist, and I’m not a gentleman.’ Frances Arnold is the fifth woman to win the Nobel Prize in chemistry. Fortune;
- 12 методов в картинках: полимеразная цепная реакция;
- K. Chen, F. H. Arnold. (1993). Tuning the activity of an enzyme for unusual environments: sequential random mutagenesis of subtilisin E for catalysis in dimethylformamide.. Proceedings of the National Academy of Sciences. 90, 5618-5622;
- Christoph M. Hammers, John R. Stanley. (2014). Antibody Phage Display: Technique and Applications. Journal of Investigative Dermatology. 134, 1-5;
- John McCafferty, Andrew D. Griffiths, Greg Winter, David J. Chiswell. (1990). Phage antibodies: filamentous phage displaying antibody variable domains. Nature. 348, 552-554;
- Биотехнология антител;
- 12 методов в картинках: иммунологические технологии;
- Враг моего врага — мой друг. Как бактерии и вирусы помогают создавать антитела для лечения человека;
- Greg Winter, Andrew D. Griffiths, Robert E. Hawkins, Hennie R. Hoogenboom. (1994). Making Antibodies by Phage Display Technology. Annu. Rev. Immunol.. 12, 433-455;
- Nobel Prize in chemistry awarded for pioneering work on proteins — live. (2018). The Guardian;
- Краткая история открытия и применения антител;
- Guarino B. (2018). Nobel Prize in chemistry goes to three scientists who harnessed ‘the power of evolution’. The Washington Post;
- Tyler W. Johannes, Huimin Zhao. (2006). Directed evolution of enzymes and biosynthetic pathways. Current Opinion in Microbiology. 9, 261-267;
- Дизайнерские ферменты на службе общества;
- «Дизайнерские» ферменты защищают от нервно-паралитических ядов;
- Лаборатория биокатализа ИБХ: дизайнерские ферменты и клоны-мятежники;
- Ферменты haut couture;
- 12 методов в картинках: генная инженерия. Часть II: инструменты и техники.






